生物污损是水生生物黏附于水下工程结构表面并进行不断生长和繁殖,从而造成水生生态系统群落改变和工程结构表面损伤的现象。海洋生态系统是生物污损发生的主要场所之一,据统计,可造成生物污损的海洋生物数量高达4 000种以上,主要包括软体动物、被囊动物、腔肠动物、节肢动物、藻类和一些微生物等。这些海洋污损生物不但严重影响海洋生态系统的健康和稳定,而且也对海运业、水产养殖业和海洋工程设施等造成了巨大的经济损失。据报道,生物污损严重的船体在航行中的动力消耗会增加86%,每年给全球航运业额外增加至少600亿美元的燃料费用[1];在水产养殖行业,由于污损生物会与养殖经济物种间产生空间和营养物质等的激烈竞争,造成养殖产量下降比例高达50%以上[2];此外,由于污损生物具有高密度聚集等特点,一旦大量死亡会造成所在水体的水质恶化,引发环境污染问题[3]。污损生物的潜在生态威胁在海洋生态系统中已广泛存在,其经济影响也十分显著。目前,如何科学高效地治理海洋生物污损(又称抗污损,antifouling)已经成为国际生态学、环境科学和材料科学等多学科领域关注的重点和热点。
海鞘是最典型的海洋污损生物之一,海鞘污损对海洋生态系统和国民经济重要行业存在巨大的威胁,但其黏附的结构特征和机制至今尚未完全阐明。为此,本研究中综述了污损性海鞘幼体和成体两个阶段生物黏附主要组织/器官的结构特征和黏附机制,以及目前采取的污损防控措施与仿生应用方面的研究进展,同时总结了相关研究领域面临的关键科学问题,并提出了未来发展的主要方向,以期为更加深入地开展海洋生物黏附机制研究、抗污损与仿生材料研发工作提供科学参考。
1 海鞘
海鞘隶属于脊索动物门尾索动物亚门,在发育过程中存在逆行变态现象,生长周期主要包括游动幼虫与固着成体两个阶段。海鞘是典型的雌雄同体生物,除有性生殖外,群体(compound/colonial)海鞘还可进行无性出芽生殖[4]。除此之外,海鞘种类众多,目前已发现的物种数超过3 000种,在全球各大海域广泛分布,常附着于海洋中的各种基底表面营固着生活,除岩石、藻体、浅海泥沙等自然基底外,海鞘还会黏附在船底、码头等人工设施上,因此,海鞘是典型的污损生物。
常见的污损性海鞘包括玻璃海鞘属Ciona、柄海鞘属Styela、菊海鞘属Botryloides和拟菊海鞘属Botrylus等。海鞘中的大部分物种均可黏附于船底、螺旋桨等船体表面,在加速船体腐蚀、减慢航行速度的同时也会产生严重的安全隐患[5]。尽管当前船舶表面都涂敷有防污涂层,但是仍不能有效阻止海鞘的污损[6-7]。此外,海鞘也是一些重要水产经济养殖种类的主要威胁,可以与养殖物种竞争氧气、营养物质等,造成养殖产量下降[2],给水产养殖业带来严重负面影响。近年来,海鞘已经成为贝类养殖的头号敌害生物[8-9],高密度的海鞘附着在网箱、绳索上难以去除(图1),每年投入到海鞘防治上的费用能够占到养殖总成本的14.7%[10]。更严重的是,海鞘具有易迁移的特点,往往随着船舶运输进入新的生境而成为入侵物种[11-12]。污损性海鞘大多已经成为威胁海洋生态系统的入侵生物,尤其是玻璃海鞘属的玻璃海鞘 Ciona robusta[13]、柄海鞘属的柄海鞘 Styela clava[14]、菊海鞘属的史氏菊海鞘 Botryllus schlosseri、拟菊海鞘属的紫拟菊海鞘 Botrylloides violaceus[15]等。污损性海鞘的生物入侵会造成更广泛的损失,对入侵地区的经济与生态环境会造成较大危害[12,16]。

图1 水产养殖设施表面的海鞘生物污损
Fig.1 Biofouling ascidians on aquaculture facilities
2 黏附机制
2.1 污损生物黏附特征
海洋生物的污损过程主要经历3个阶段,即修整膜时期、生物膜时期和生物污损层时期。首先,浸入到海水中的物体,其表面在数十分钟甚至几分钟内就会吸纳一层有机物,形成修整膜(conditioning film);而后,细菌和单细胞藻类等生物开始在修整膜上附着并分泌胞外代谢产物,形成生物膜(microbial biofilm);最后,其他海洋原核生物、真菌、藻类及大型海洋污损生物会在生物膜上黏附并发育生长,形成复杂的大型污损生物层(macrofoulers)[17]。一些大型海洋生物依靠其特有的组织或器官分泌黏性物质,永久或暂时性地黏附于各种水下基质表面(如礁石、船体、水下人工设施及其他生物表面等),从而造成严重的生物污损问题。可见,黏附是海洋生物污损事件发生的重要生物学基础。
从海洋生物的发育阶段来看,幼体和成体阶段均有黏附行为发生,而成体黏附阶段往往是污损行为最为严重的时期。目前,有关海洋生物黏附研究主要集中在几个代表性污损物种的成体阶段,包括软体动物贻贝、甲壳动物藤壶、棘皮动物海星、扁形动物扁虫等,研究人员对其黏附结构特征、过程和机制等进行了探究,明确了生物大分子特别是蛋白质在黏附过程中发挥的重要功能(表1),发现不同海洋污损生物演化出的黏附组织或器官截然不同,这些生物大多依赖于蛋白质组分实现生物黏附,但实现黏附的机理、方式和生物学过程却截然不同。目前,虽然对海鞘黏附机制的研究未深入到分子层面,但与其他海洋污损物种相似,海鞘发育过程中的幼体和成体阶段都有鲜明的发育阶段性黏附特征。海鞘幼体依靠其躯干前端的乳突结构分泌的蛋白质组分实现快速附着,而污损性最强的成体阶段,则由壶腹表皮通过形变分化出特异的匍匐枝结构实现与基底的强力黏附。
表1 典型海洋污损生物黏附蛋白质特征
Tab.1 Characteristics of representative adhesive proteins of marine fouling organisms
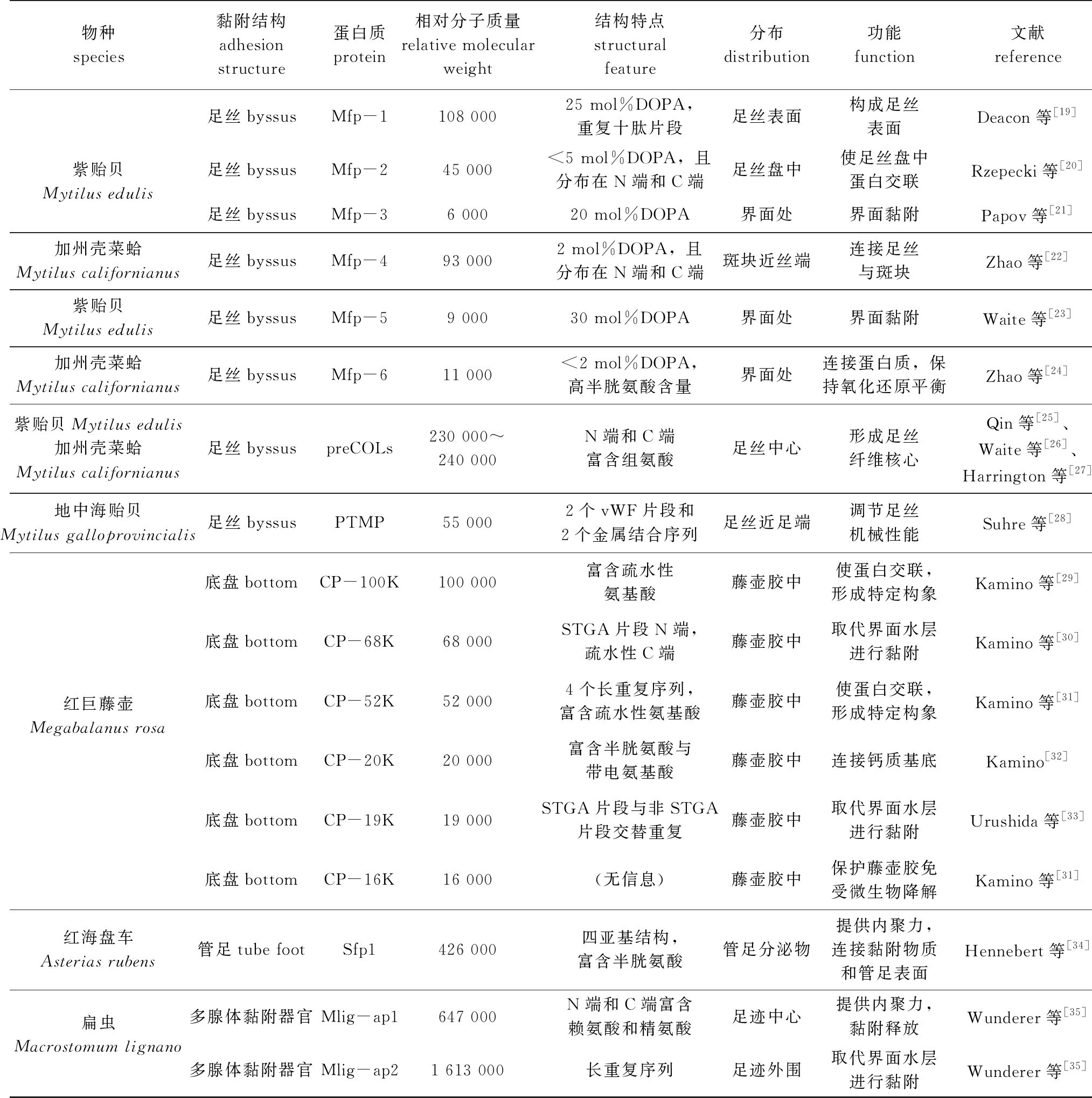
物种species黏附结构adhesion structure蛋白质protein相对分子质量relative molecular weight结构特点structural feature分布distribution功能function文献reference紫贻贝Mytilus edulis足丝byssusMfp-1108 00025 mol%DOPA,重复十肽片段足丝表面构成足丝表面Deacon等[19]足丝byssusMfp-245 000<5 mol%DOPA,且分布在N端和C端足丝盘中使足丝盘中蛋白交联Rzepecki等[20]足丝byssusMfp-36 00020 mol%DOPA界面处界面黏附Papov等[21]加州壳菜蛤Mytilus californianus足丝byssusMfp-493 0002 mol%DOPA,且分布在N端和C端斑块近丝端连接足丝与斑块Zhao等[22]紫贻贝Mytilus edulis足丝byssusMfp-59 00030 mol%DOPA界面处界面黏附Waite等[23]加州壳菜蛤Mytilus californianus足丝byssusMfp-611 000<2 mol%DOPA,高半胱氨酸含量界面处连接蛋白质,保持氧化还原平衡Zhao等[24]紫贻贝Mytilus edulis加州壳菜蛤Mytilus californianus足丝byssuspreCOLs230 000~240 000N端和C端富含组氨酸足丝中心形成足丝纤维核心Qin等[25]、Waite等[26]、Harrington等[27]地中海贻贝Mytilus galloprovincialis足丝byssusPTMP55 0002个vWF片段和2个金属结合序列足丝近足端调节足丝机械性能Suhre等[28]红巨藤壶Megabalanus rosa底盘bottomCP-100K100 000富含疏水性氨基酸藤壶胶中使蛋白交联,形成特定构象Kamino等[29]底盘bottomCP-68K68 000STGA片段N端,疏水性C端藤壶胶中取代界面水层进行黏附Kamino等[30]底盘bottomCP-52K52 0004个长重复序列,富含疏水性氨基酸藤壶胶中使蛋白交联,形成特定构象Kamino等[31]底盘bottomCP-20K20 000富含半胱氨酸与带电氨基酸藤壶胶中连接钙质基底Kamino[32]底盘bottomCP-19K19 000STGA片段与非STGA片段交替重复藤壶胶中取代界面水层进行黏附Urushida等[33]底盘bottomCP-16K16 000(无信息)藤壶胶中保护藤壶胶免受微生物降解Kamino等[31]红海盘车Asterias rubens管足tube footSfp1426 000四亚基结构,富含半胱氨酸管足分泌物提供内聚力,连接黏附物质和管足表面Hennebert等[34]扁虫Macrostomum lignano多腺体黏附器官Mlig-ap1647 000N端和C端富含赖氨酸和精氨酸足迹中心提供内聚力,黏附释放Wunderer等[35]多腺体黏附器官Mlig-ap21 613 000长重复序列足迹外围取代界面水层进行黏附Wunderer等[35]
2.2 海鞘幼体黏附
2.2.1 幼体黏附结构 海鞘幼体为杆状,整体呈蝌蚪形,尾巴长且细,中间有一根脊索,头部近椭圆形,前端较窄,内有眼点。蝌蚪形的海鞘幼体经间歇性自由游动后,其头部与基底接触可实现快速附着。幼体的头部分布有3个杯状的半透明乳头突起(papillae),分别位于躯干前端的腹侧(1个)与背侧(2个),它们以三角形排列在头部并向外延伸(图2(a)),是幼体阶段特有的黏附器官。每一个黏附乳突均由表皮外胚层的内陷所形成。在变态发育开始时,这些乳突通过被膜表皮层的开窗迅速外露,暴露出最前端的透明胶盖(hyaline caps)[18]。透明胶盖中含有幼虫黏附所需的黏附物质,与基底接触后能够快速释放到乳突表面,实现成功黏附。由于乳突结构尺寸较小,其细胞组成与功能一直是该研究领域的难点。最新研究表明,每个乳突通常由至少3种不同的细胞类型构成:4个轴向柱状细胞、4个外侧初级感觉神经元和12个中央胶质细胞(图2(b))。乳突的中间位置分布着中央胶质细胞,这些胶质细胞围绕着轴向柱状细胞,且都延伸到透明质盖中。位于最外围的是外侧初级感觉神经元,其朝向透明质盖的一端延伸有微纤毛,另一端与神经结构相连。这3种类型的细胞规律排列、协同作用,从而发挥不同的生物学功能,对于海鞘幼体乳突结构黏附过程是十分重要的[36]。因此,乳突是海鞘幼体特有的结构,属于感觉和黏附器官,它既可以分泌黏性物质实现附着,又可以借助黏附时产生的神经兴奋传递到躯干开启后继变态过程。
2.2.2 黏附物质的合成与分泌 海鞘幼体依赖于乳突结构中的黏附物质实现快速黏附。显微观察显示,乳突中的中央胶质细胞内含有较多小囊泡和大量的黏附颗粒,推测这类细胞可能承担黏附物质合成与分泌功能。而黏附颗粒又可分为“光滑”和“粗糙”两种类型,利用碳水化合物特异性凝集素进行特异性标记分析,可同时标记乳突顶端、中央胶质细胞的内部颗粒及黏附斑3个区域,证实了上述结论[36]。同时,乳突间的表皮区域也是黏附物质合成与分泌的场所。许多分泌细胞聚集在3个乳突间的三角形区域,特化成腺器官(glandular organ)(图2(b))。此区域细胞的特化始自尾芽期后期,乳突间区的柱状细胞开始参与蛋白质合成与被膜组分的分泌。随着发育的进行,乳突间区的蛋白质合成与分泌能力显著增强,可以观察到大量内质网和高尔基体的活性显著增加,柱状细胞向被膜的顶端分泌增强,顶端囊泡有大量物质排出[37]。
2.2.3 神经系统辅助 由于乳突结构的双重功能,海鞘幼体快速黏附与其神经系统的辅助密切相关。海鞘在幼体阶段尾部长有明显的脊索,幼体乳突神经结构发育始自尾芽期。在尾芽期的初期,乳突神经元细胞开始区别于周围的表皮细胞,轴突朝向躯干一端延伸。到了游泳幼虫期,乳突神经元细胞朝向透明质盖伸出明显的束状末端感受器,同时乳突边缘区域特化出树状表皮神经元。树状表皮神经元细胞的轴突与乳突神经元细胞在朝向躯干一端共同汇聚成束,与体内脊索相连,这两种神经元细胞的末端感受器都深入透明质盖中(图2(b))。乳突神经元是机械感受器,树状表皮神经元是化学感受器,分别介导海鞘幼虫与基底的黏附及后续变态的启动过程[37]。另一项研究也得出相似的结论,即乳突中的轴向柱状细胞包含内吞小泡,具有神经活性,而外侧初级感觉神经元是明显的神经结构[36]。综合来看,乳突是一个集机械感觉、化学感觉和分泌等功能为一体的头部感觉器官,它首先利用其机械感觉功能探寻适合附着的海洋基质表面,一旦寻找成功便启动黏合剂分泌,将黏合剂分泌到基质表面进而成功实现水下黏附过程。

图2 幼体阶段的黏附器官
Fig.2 Adhesive organs in larval stage
2.2.4 黏附物质成分 现有的证据表明,糖残基与3,4-二羟基苯丙氨酸(DOPA)可能是海鞘幼体黏附物质的主要功能单元。海鞘乳突分泌的黏附物质中富含糖残基,这也是大多数海洋黏附生物分泌物的共同特征。含有糖残基的黏附分泌物位于乳突的顶端,可以被花生凝集素(peanut agglutinin,PNA)、菜豆红细胞凝集素(phaseolus vulgaris erythroagglutini,PHA-E)和西非单叶豆同工凝集素Ⅱ[griffonia (bandeiraea) simplicifoliaⅡ,GSLⅡ]等物质标记。PHA-E与GSLⅡ也可以标记基底上的黏附斑,进一步证明糖残基在海鞘乳突黏附中的关键作用[38]。除此之外,DOPA也在乳突和黏附斑中被特异性标记,显示其与乳突黏附间的密切关系。DOPA参与调控黏附物质的黏合力与内聚力[38],这与其他海洋生物的黏附特性是一致的[39-40]。海洋生物幼虫阶段黏附物质的化学组成极为复杂,如藤壶幼体黏合剂中含有几丁质、脂质、磷蛋白等多种功能成分。其中,天然几丁质以糖基化形式结合于蛋白质上,待蛋白质分泌后在黏附斑中以固定位置存在;而率先分泌的脂质可以将黏附表面的水分从界面进行置换,为磷蛋白的引入创造适宜的疏水条件,并保护黏合剂不被微生物降解[41]。海鞘乳突分泌的黏附物质中是否也含有几丁质、脂质等成分,是否也依赖于不同的化学成分协同作用最终实现黏附过程,目前尚不清楚,这也是海鞘黏附研究领域亟待解决的重要问题之一。应用多组学的方法(包括蛋白质组、基因组、转录组等)进行研究是当前海洋生物黏附领域的热点,目前,作为模式生物,多种海鞘基因组测序已经完成[42-44],但仍然缺乏从基因及其调控网络等层面对乳突发育与快速黏附的机制进行分析。
2.3 海鞘成体黏附
海鞘幼虫借助乳突附着在基质上约4 h后,神经系统传递发育信号,开始启动变态发育过程[45]。在变态过程中,海鞘幼体尾部连同脊索逐渐萎缩并被重吸收,神经管及感觉器官退化[46];与此同时,海鞘黏附器官也发生了变化。变态发育开始后,幼体海鞘腹侧表皮处形成血管状壶腹(ampulla)。壶腹发生“形变”,进而与基质表面缓慢接触并发生黏附作用(图3(a))。对于群体(compound/colonial)海鞘,壶腹直接作为成体的最终黏附器官,而单体(solitary)海鞘通过壶腹实现缓慢黏附后,壶腹结构便被吸收缩回到被膜中,剩余被膜突出体外形成突起结构(adhesive projection),发挥黏附作用。黏附突起会随着机体的成熟最终特化为匍匐枝(stolon),发挥长期牢固黏附功能。
2.3.1 黏附突起 黏附突起由海鞘被膜特化而来,分布在被膜腹侧的外周区域,用以扩大海鞘与基底间的黏合面积(图3(b))。与壶腹的“形变黏附”相比,这些突起的黏附活性更高。研究发现,虽然形态上都是突起,但被膜突起的黏附速度与乳突的快速黏附相比却慢得多(约48 h),这说明两种结构的黏附机理或黏附物质的性能可能不同[47]。在被膜上,这些突起的内腔通过被膜血管系统彼此相连。被膜血管中富含血细胞,血细胞中存在大量含钒物质和嗜酸性物质,这些物质与黏附功能间有着密切的联系[48]。此外,富钒的血细胞会在突起的末端积聚,进一步表明其参与了海鞘突起结构的黏附过程。这些血细胞中的嗜酸性物质是海洋黏附蛋白质的共同特征,推测由血管尖端的上皮细胞或者被膜细胞合成分泌,同样在突起末端富集并发挥黏附功能[47]。
2.3.2 匍匐枝结构 对于海鞘来说,被膜突起的黏附时间也是短暂的,长期的牢固黏附依赖于特殊的黏附结构——匍匐枝。匍匐枝被认为是被膜突起的进一步特化,在海鞘发育的成熟阶段起到黏附作用(图3(c))。匍匐枝的表皮由侧壁的立方细胞和末端的柱状细胞组成,立方细胞利用微绒毛固定在被膜上,而柱状细胞内含圆形颗粒,具有一定的分泌功能[49]。对于有些群体海鞘物种如Diplosoma virens,匍匐枝在靠近基底的一端膨胀成壶腹状末端,其顶端便是含有许多圆形颗粒的柱状细胞,柱状细胞内可观察到有分泌功能的囊泡。与被膜突起相似,匍匐枝借助血管结构彼此相连,管腔内有稀疏的血细胞分布,但这些血细胞的功能还未被完全揭示[49]。

图3 成体阶段的黏附器官
Fig.3 Adhesive organs in adult stage
2.3.3 黏附物质成分 由于海鞘被膜分化的匍匐枝比幼体的乳突结构黏附速度慢,研究者推测海鞘成体分泌的黏合剂或许与幼体存在较大差别。Saad等[50]对皱瘤海鞘 Styela plicata 匍匐枝的分泌黏液进行了分析,其中,含量最多的有机物是蛋白质,其次是脂肪和碳水化合物。应用SDS-PAGE技术对这种海鞘生物黏液进行分离,获得的蛋白质相对分子质量为30 000~250 000。进一步用胰蛋白酶进行消化处理,分析得出黏液中含量最高的3种氨基酸分别是缬氨酸、甘氨酸和苯丙氨酸。此外,研究者从单体海鞘Ascidia sydneiensis samea 的被膜突起中分离获得了8种小分子量蛋白质,推测其中几种蛋白质可能参与了海鞘成体黏附过程,但未进行功能验证[47]。由于技术的限制,该研究无法对质荷比大于500的生物大分子进行识别,对黏附相关蛋白质的分析还存在缺陷。在最近的研究中,Li等[51]对污损性较强的玻璃海鞘进行蛋白质组学分析,鉴定出一种含有vWFA结构域的海鞘匍匐枝蛋白ASP-1。NBT染色试验表明,此蛋白质含有DOPA,且酪氨酸酶修饰后的ASP-1黏附性能显著提升。该研究表明,部分海鞘黏附蛋白质功能的实现也像大多数海洋黏附生物一样可能依赖于DOPA组分,但这一结论还需进一步验证,因为ASP-1只是匍匐枝蛋白中的一种,并不是直接参与基质表面界面黏附的蛋白质。基于已报道的结果,至今尚无一种与海鞘成体黏附直接相关的蛋白质组分被分离鉴定,因此,成体海鞘的黏附机制亟待深入解析。
2.3.4 纤维素功能 除蛋白质组分外,纤维素(cellulose)也被认为是海鞘维持稳定黏附能力的关键。成熟的海鞘身体表面覆有一层粗糙坚实的被膜(tunic),被膜由体壁分泌的被囊素形成,从而维持身体形态并起到一定的保护作用。研究发现,被囊素的化学成分是动物纤维素,其与多糖、蛋白质等一起构成被膜的主要成分。过去人们一直以为纤维素成分只是为海鞘被膜提供韧性,起到保护内部机体的作用。但最近的研究发现,海鞘纤维素合成酶(Ces-A)的突变不仅导致幼体变态异常,使幼体不经乳突黏附沉降便开始变态[52];同时还影响其被膜功能,突变体海鞘的被膜脆弱易破,呈胶冻状,易被微生物附着。更为重要的是,突变体无论是在幼体阶段还是成体阶段,黏附能力均显著降低,极易从基质表面脱落[53]。由此可见,海鞘被膜中的纤维素成分对黏附至关重要。通过系统发育分析,推测海鞘的纤维素系列基因(GH-6 cellulase、Ces-A等)均是同时通过基因水平转移的方式从放线菌处获取并得到表达[53]。
基于当前的研究结果,海鞘成体的黏附结构特征和机制仍不清楚。研究人员观察到海鞘的壶腹形成、被膜突起和匍匐枝结构都参与了成体海鞘黏附,它们之间有着功能与发育上的承接关系,即使彼此存在明显的结构差异,黏附机制也可能不同。
3 海鞘生物污损的科学防控
科学高效防止海鞘生物污损是深入开展海鞘黏附特征、过程和机制研究的主要目标之一。针对这一海洋生态环境领域的难题,近些年科研工作者围绕生物与材料间的相互作用关系进行了深入研究与实践[38,54]。这些研究大多是从海鞘生长发育的不同阶段特征出发,利用海鞘对基质选择的倾向性、海鞘黏液物质与基底的黏附机制、海鞘变态发育过程特征等,对海鞘群体进行清除或杀灭,以达到生物污损防治的目的。总体上可以将这些抗污损策略划分为物理法、化学法和生物法,便于清晰理解。
3.1 物理法
物理防海鞘污损方法主要利用海鞘对黏附基质材料的选择性这一特点。决定材料表面防污性能的因素很多,包括表面能、弹性模量、电荷性、极性、疏水性和表面光滑性等。目前,关于抗海鞘黏附材料的设计也是基于这些影响因素,即海鞘对黏附基质选择的倾向性来进行。
当前,该领域中研究最多、前景最广的策略是基于低表面能原理进行抗海鞘黏附涂层设计。此种涂层表面具有低表面能与低弹性模量的特点,使生物难以在其表面产生黏附,即便是成功黏附,洋流或者船舶航行中产生的水动力作用也足以将其洗脱。研究表明,一般当防污涂层的表面能低于25 mJ/m2或与液体的表面接触角大于98°时,防污损效果明显,典型的低表面能涂层包括有机硅涂层和有机氟涂层[55]。当涂层含有一定量的有机硅氧烷时,玻璃海鞘的附着率显著降低。有机硅氧烷除了具有较低的表面能,还可以与水体产生较高的相互作用力,使涂层表面吸水并排斥盐分,形成淡水液膜,进一步减弱海鞘的附着能力[56]。对不同聚合物抗污损试验的结果也显示,聚合物材料表面的污损程度与表面自由能间有一定的相关性。玻璃海鞘的黏附一般发生在浸海后期,且均位于基底已产生污损的地方,其中,聚对苯二甲酸乙二醇酯(PET)、聚氯丁二烯(PCP)、株状聚苯乙烯(PS)等材料能显著抑制玻璃海鞘的黏附[57]。除此之外,纳米材料涂层也属于低表面能涂层[58],纳米表面亦能抑制生物附着[59]。例如,与普通的平板膜相比,通过模仿后生动物(被囊动物、棘皮动物、环节动物)体表的蛾眼阵列(moth-eye structure)设计的基膜MOSMITETM能够显著地抑制海鞘幼体的附着能力[54]。这种仿生基膜属于纳米结构阵列,“高度”一般不大于100 nm,且亲水不亲油。此外,含银纳米复合材料的超支化聚氨酯也表现出优异的抗海鞘污损性能,这种材料还能产生活性氧,对细胞造成损伤[60]。另有研究表明,水凝胶纳米复合涂层也可以有效抑制海鞘生物污损事件的发生[61]。
基质材料的电荷性、极性和疏水性等特征也能明显影响海鞘的黏附,因此,通过涂层改变基底材料的电荷性、疏水性等特性,可以达到抗海鞘污损的效果。研究表明,疏水与否显著影响海鞘幼虫的附着能力,即海鞘幼虫倾向于附着到疏水性较强的材料表面[38]。产生这一差异的机理在于聚乙二醇与两性离子聚合物等材料因为其具有亲水性而抑制蛋白质的吸附与细胞的黏附,但往往疏水性的材料如聚二甲基硅氧烷(PDMS)和含氟聚合物由于具有非极性的特点也可以抑制蛋白质的吸附[59]。
3.2 化学法
与物理法相比,化学法的使用更加关注对污损生物的生理抑制或有效灭杀。典型的例子是化学防污涂料,区别于利用物理性质进行防污的涂层,这些涂料中包含缓慢释放的可抑制或杀死海鞘的防污成分,如有机锡、汞化合物、铜化合物等[58],可通过防污涂料中有毒物质的释放有效阻止海洋生物污损。这些有毒物质是非针对性的,可以应用于包括海鞘在内的所有污损生物。针对玻璃海鞘的试验表明,单磺酸钾盐(potassium monopersulphonate triple salt)可明显降低其在基质表面的黏附量。试验处理组,将已黏附的海鞘置于质量分数3%的单磺酸钾盐试剂中浸泡30 s,可以使其生物量减少89%,且对药物的易感性存在明显的年龄差异。产生这一现象的原因可能与被膜性质有关,幼年海鞘的被膜较薄且比表面积较大,易受到毒物的侵害[62]。也有研究显示,长时间的低盐度条件能抑制冠瘤海鞘 Styela canopus 幼体的附着,低盐度(盐度为10)处理93 h时,试验组的附着率减少近65%[63]。由此可见,利用化学原理进行防污是有效的,但是大多数化学物质由于其毒性会危害整个生态系统的安全,所以化学抗污往往不像物理法那样得到广泛认可与实际应用,即使是曾经在全球范围内广泛使用的有机锡防污涂料也在2008年被全面禁止。因此,目前化学防污的目标是研究低毒或无毒的新型涂料。
3.3 生物法
有些生物的表面及附近不易有其他生物黏附,这种自然的抗污损现象不仅依托于生物表面的特殊物理结构,很大程度还依靠其分泌的生物活性物质。某些生物活性物质对于抗生物黏附具有积极作用,如有机酸、萜类、醇类、胺类、吲哚类等[64]。这一特征被利用到海鞘污损防治,Cahill等[65]测试验证了从生物中提取的根赤壳菌素(radicicol)、蓼二醛(polygodial)和泛醌-10(ubiquinone-10)等物质可以通过抑制海鞘幼虫的变态起到抗海鞘黏附的作用。研究发现,相对于对照组来说,在培养基中添加质量分数2.5%的肝素能使几乎所有的海鞘幼体不附着,且肝素的抑制作用随着浓度的降低逐渐减弱[38]。一定浓度的乙酰胆碱(>10-7 mol/L)对冠瘤海鞘的附着与变态均能表现出抑制作用,与之具有相似效果的生物活性物质还有γ-氨基丁酸(GABA)和印防己毒素(picrotoxin)[66]。同时,有些活性细菌的胞外代谢产物可以抑制玻璃海鞘的沉降,其活性物质可能是相对分子质量低于3 500的蛋白质或肽类物质,且具有一定的热稳定性[67]。越来越多的研究发现,有些酶类也可以对附着生物起到阻止和抑制作用,其靶点可能是黏附物质或者被膜组分,通过分析活性酶的官能团特征,也可设计出新型无毒的海鞘防污剂[68]。
从研究进展来看,目前普遍采用的抗海鞘污损举措并不十分理想,针对海鞘的抗污损研究与技术大多还停留在实验室阶段(表2),究其根本是海鞘生物黏附物质与海底基质材料间黏附的生物学过程和机理未被彻底阐明,无法针对海鞘的黏附机制进行特异性的防污工艺设计。
表2 海鞘污损防控方法
Tab.2 Antifouling methods for ascidians

分类classification防污材料antifouling material防污原理antifouling principle所处应用阶段period应用效果application effect文献来源reference物理法physical method有机硅氧烷等低表面能已应用添加了有机硅氧烷的涂层在浸海60 d后不存在海鞘附着田军等[56]MOSMITETM膜三维立体表面、亲水性实验室阶段MOSMITETM膜上海鞘占37%,普通平面膜上占63%Hirose等[54]水凝胶涂层三维多孔表面、亲水性实验室阶段水凝胶(如长链聚乙二醇水凝胶)可抑制包括海鞘在内的大型污损生物的黏附孙源等[61]化学法chemical method铜化合物等毒性致死已应用氧化亚铜等与辅料共同作用,对海鞘具有高毒性,无海鞘黏附赵金榜[69]单磺酸钾盐毒性致死实验室阶段质量分数3%的单磺酸钾盐处理30 s,4周后生物量减少89%Paetzold等[62]生物法biological method根赤壳菌素等抑制变态实验室阶段IC99为0.8 μg/mL,0.1、1 μg/mL组抑制变态且致死Cahill等[65]肝素抑制黏附物质实验室阶段与对照组(81%)相比,质量分数2.5%肝素组附着率为0Zeng等[38]乙酰胆碱等抑制变态实验室阶段乙酰胆碱浓度大于10-7 mol/L时显著抑制变态黄英[66]
4 海鞘黏附的仿生应用
虽然从生态系统角度看,海洋污损生物产生了显著的生态危害,但从仿生材料角度,这些污损生物的黏附特征也是高性能水下黏合剂的重要仿生对象。海鞘所分泌的黏附物质具有强黏附、生物相容、可降解和自修复等优越的生物学性能,可以应用于医学和材料科学等多个领域。在生物医学、工业涂料、包装作业等领域,传统材料的应用往往受到效率低、难降解、具有毒性和不防水等各方面因素的限制。因此,研发环境友好的高性能水下黏合材料就成为相关应用领域的当务之急。随着合成化学和生物工程技术的发展,从仿生层面研发制备的一些黏合材料在各方面都具有优良的性能,特别是在生物医学与材料领域具有巨大的应用价值[70]。
根据海鞘黏附物质的作用机制可以设计自愈合水凝胶。自愈合水凝胶是一种在受到损伤后自动恢复其完整性和自身功能的一类新型水凝胶。目前,使用的大部分水凝胶具有独特的基于化学键或物理作用的亲水性交联三维体系[71],在受到外部机械刺激或生理侵蚀时,若完整性遭到破坏,功能便会丧失;因此,具有自我修复功能的水凝胶受到了研究人员的广泛关注。海鞘黏附物质具有较强的水下附着力与快速再生性,这一特性与海鞘黏附机制可能密切相关。与贻贝胶相似,海鞘黏液中也被证明存在DOPA组分,海鞘血细胞中还含有特异性TOPA结构。TOPA中的邻苯三酚(PG)可与透明质酸(HA)结合,而PG基团被认为是海鞘具有再生能力的关键成分,可以通过氧化过程实现自我再生。同时利用氧化剂诱导和pH控制的方法可以实现HA-PG体系的快速交联,形成具有生物相容性的水凝胶[72]。HA-PG水凝胶还具有细胞毒性低、无生物免疫反应等特点,在生物医学领域具有广泛的应用前景,在定向运载药物、组织细胞移植、创口缝合等方面都有应用价值[72]。这种水凝胶体系是对海鞘黏附机制的成功仿生,显示了海鞘黏附在仿生领域的潜力。
基于海鞘黏附特性也可以设计新型仿生功能材料。海鞘具有特有的黏附机制,一些独特的黏附蛋白质与结构域也在海鞘黏液中被发现[51]。根据海鞘的黏附机制,可以据此设计新型功能材料与低生物黏附性的表面材料。纤维素是海鞘被膜中的结构组分,不仅起到保护机体的作用,还参与海鞘的生物黏附过程。海鞘纤维素是区别于植物和细菌的Iβ晶型[73],其具有潜在的研究价值。如今有许多研究模仿海鞘纤维素制备纳米晶体(TCNCs)并将其用于功能材料制备。有研究发现,添加少许的TCNCs便可使海鞘纤维素仿生复合材料的储能模量提高千倍以上[74]。此外,TCNCs还可用于生物医学领域,利用TCNCs、环氧乙烷和环氧氯丙烷合成的仿生材料具有可逆的化学反应能力,可设计为微电极,应用到帕金森综合征、中风等神经疾病的治疗中[75]。
目前,针对海鞘黏附机制的仿生研究已经有了重要研究进展,可以预见其仿生潜力。但有关海鞘生物黏附物质与黏附器官的仿生研究却较少。根据海鞘独特的黏附机制与蛋白质特性进行新型水凝胶的研制,模仿乳突、匍匐枝等结构进行特定功能元件的设计,这些思路都有潜在的开发价值。随着海鞘黏附机制的进一步明晰,相信其在仿生应用领域也将会有较大拓展,特别是基于海鞘分子特性的仿生应用将成为可能。
5 存在问题及展望
5.1 海鞘黏附机制与仿生研究中存在的问题
海鞘作为典型的海洋污损生物,在水产养殖、船舶运输等重要行业能够造成巨大的经济损失,但它也是高性能水下黏合剂研发的重要仿生对象,具有较好的开发前景,深入开展海鞘黏附机制研究是解决高性能水下黏合剂不可或缺的重要环节。在过去十年中,海鞘黏附机制研究已经取得一定的进展,但还存在以下几方面的问题。
1) 海鞘不同黏附组织器官间的发育关系不清晰。目前,虽然已经存在部分针对乳突、壶腹、黏附突起、匍匐枝等的研究,但这些研究多集中于对黏附器官的结构与细胞类型进行表征,却忽视了不同黏附器官间的发育关系。特别是针对海鞘成体黏附阶段,不同发育阶段的黏附器官间无明确界限,相互间的功能承接方式还未被阐明。
2) 海鞘黏附分子层面的机制未被揭示。相对于其他典型海洋黏附生物如贻贝、藤壶等,海鞘的黏附机制尚不清楚,其中一个重要原因是缺乏分子层面的深入研究。当前海洋生物黏附机制研究最透彻的物种是贻贝,究其原因是因为贻贝关键的黏附蛋白质得到了有效分离与鉴定,而目前针对海鞘黏附蛋白质的研究则十分有限。尽管已从海鞘的体内分离鉴定出了几种与黏附相关的蛋白质,但是大多数的黏附成分仍然不明晰。
3) 缺乏高效的抗海鞘污损基质材料。对于海鞘来讲,虽然当前采用的普适性抗污损涂层材料被证明是部分有效的,但仍然不能完全阻止海鞘污损事件的发生。特别是在水产养殖行业,海鞘作为主要的敌害生物,利用水流剪切力去除附着生物的低表面能材料的使用受到了限制,为抗海鞘污损工作增加了难度。
4) 基于海鞘黏附机制的深度生物仿生工作尚不深入。海鞘作为典型的黏附生物,具有与其他海洋生物不同的黏附机制,是进行生物仿生的理想试验对象。然而,目前鲜有针对海鞘黏附机制的仿生研究,已有的研究也不够深入。
5.2 未来重点研究方向
针对所提及的海鞘生物黏附研究领域存在的问题,今后的工作可从以下方面展开。
1) 黏附组织器官的研究拓展。针对黏附器官间的发育关系、黏附器官的种间差异应进行更加清晰地研究与界定,以便更加系统地解析海鞘生物黏附的结构基础和分子机制。
2) 黏附蛋白质的鉴定与分析。明确海鞘黏附相关的关键蛋白质组分,探讨其结构与黏附功能,是未来海鞘黏附研究领域的重点方向。如今多个海鞘物种的基因组测序已经完成,应用基因组学、转录组学或蛋白质组学等多组学方法进行分子层面研究将是十分有效的。
3) 设计特异性抗海鞘黏附材料。海鞘黏附有其自身的特点,根据海鞘的黏附机制设计的特异性抗污损材料或许会更加高效。海鞘特异的变态发育过程也可能是一个切入点,可通过抑制海鞘幼体的变态发育从而有效阻止海鞘黏附过程,实现海鞘生物污损的有效控制。
4) 基于分子层面的海鞘黏附仿生研究。海鞘的特殊黏附机制能够启发更多的新型水下黏合剂与复合材料的研制。通过模仿海鞘黏附蛋白质的功能特征、蛋白质间的交联作用等特点,可以生产自修复的水凝胶等仿生材料,而海鞘独特的黏附器官与黏附模式也为黏性力学元件设计提供了新的思路,具有更加广阔的应用前景。
[1] SALTA M,WHARTON J A,STOODLEY P,et al.Designing biomimetic antifouling surfaces[J].Philosophical Transactions of the Royal Society A:Mathematical,Physical and Engineering Sciences,2010,368(1929):4729-4754.
[2] MURRAY C C,THERRIAULT T W,MARTONE P T.Adapted for invasion?Comparing attachment,drag and dislodgment of native and nonindigenous hull fouling species[J].Biological Invasions,2012,14(8):1651-1663.
[3] NAKANO D,STRAYER D L.Biofouling animals in fresh water:biology,impacts,and ecosystem engineering[J].Frontiers in Ecology and the Environment,2014,12(3):167-175.
[4] MONNIOT C,MONNIOT F,LABOUTE P.Coral reef ascidians of new caledonia[M].Paris:ORSTOM,1991:27-50.
[5] 韩帅帅,曹文浩,陈迪,等.中国沿海污损性海鞘生态特点及研究展望[J].生态科学,2018,37(1):186-191.
[6] ALDRED N,CLARE A S.Mini-review:impact and dynamics of surface fouling by solitary and compound ascidians[J].Biofouling,2014,30(3):259-270.
[7] 马士德,徐利婷,刘会莲,等.青岛港湾污损生物及其量化初探[J].中国涂料,2019,34(2):60-65.
[8] 曹善茂,张丛尧,张国范,等.海洋贝类养殖网笼污损生物类群的研究[J].大连水产学院学报,1998,13(4):15-21.
[9] LAMBERT G.Invasive sea squirts:a growing global problem[J].Journal of Experimental Marine Biology and Ecology,2007,342(1):3-4.
[10] ADAMS C M,SHUMWAY S E,WHITLATCH R B,et al.Biofouling in marine molluscan shellfish aquaculture:a survey assessing the business and economic implications of mitigation[J].Journal of The World Aquaculture Society,2011,42(2):242-252.
[11] 严涛,韩帅帅,王建军,等.污损性海鞘的生态特点研究展望[J].生态学报,2017,37(20):6647-6655.
[12] LINS D M,DE MARCO JR P,ANDRADE A F A,et al.Predicting global ascidian invasions[J].Diversity and Distributions,2018,24(5):692-704.
[13] BLUM J C,CHANG A L,LILJESTHRÖM M,et al.The non-native solitary ascidian Ciona intestinalis (L.) depresses species richness[J].Journal of Experimental Marine Biology and Ecology,2007,342(1):5-14.
[14] INAR M E.The alien ascidian Styela clava now invading the Sea of Marmara (Tunicata:Ascidiacea)[J].ZooKeys,2016,563:1-10.
[15] SIMKANIN C,DAVIDSON I C,DOWER J F,et al.Anthropogenic structures and the infiltration of natural benthos by invasive ascidians[J].Marine Ecology,2012,33(4):499-511.
[16] ZHAN A B,BRISKI E,BOCK D G,et al.Ascidians as models for studying invasion success[J].Marine Biology,2015,162(12):2449-2470.
[17] CHAMBERS L D,STOKES K R,WALSH F C,et al.Modern approaches to marine antifouling coatings[J].Surface and Coatings Technology,2006,201(6):3642-3652.
[18] CLONEY R A.Larval adhesive organs and metamorphosis in ascidians:Ⅰ.fine structure of the everting papillae of Distaplia occidentalis[J].Cell and Tissue Research,1977,183(4):423-444.
[19] DEACON M P,DAVIS S S,WAITE J H,et al.Structure and mucoadhesion of mussel glue protein in dilute solution[J].Biochemistry,1998,37(40):14108-14112.
[20] RZEPECKI L M,HANSEN K M,WAITE J H.Characterization of a cystine-rich polyphenolic protein family from the blue mussel Mytilus edulis L.[J].The Biological Bulletin,1992,183(1):123-137.
[21] PAPOV V V,DIAMOND T V,BIEMANN K,et al.Hydroxyarginine-containing polyphenolic proteins in the adhesive plaques of the marine mussel Mytilus edulis[J].Journal of Biological Chemistry,1995,270(34):20183-20192.
[22] ZHAO H,WAITE J H.Proteins in load-bearing junctions:the histidine-rich metal-binding protein of mussel byssus[J].Biochemistry,2006,45(47):14223-14231.
[23] WAITE J H,QIN X X.Polyphosphoprotein from the adhesive pads of Mytilus edulis[J].Biochemistry,2001,40(9):2887-2893.
[24] ZHAO H,WAITE J H.Linking adhesive and structural proteins in the attachment plaque of Mytilus californianus[J].Journal of Biological Chemistry,2006,281(36):26150-26158.
[25] QIN X X,COYNE K J,WAITE J H.Tough tendons:mussel byssus has collagen with silk-like domains[J].Journal of Biological Chemistry,1997,272(51):32623-32627.
[26] WAITE J H,QIN X X,COYNE K J.The peculiar collagens of mussel byssus[J].Matrix Biology,1998,17(2):93-106.
[27] HARRINGTON M J,WAITE J H.Holdfast heroics:comparing the molecular and mechanical properties of Mytilus californianus byssal threads[J].Journal of Experimental Biology,2007,210(24):4307-4318.
[28] SUHRE M H,GERTZ M,STEEGBORN C,et al.Structural and functional features of a collagen-binding matrix protein from the mussel byssus[J].Nature Communications,2014,5(1):3392.
[29] KAMINO K,INOUE K,MARUYAMA T,et al.Barnacle cement proteins:importance of disulfide bonds in their insolubility[J].Journal of Biological Chemistry,2000,275(35):27360-27365.
[30] KAMINO K,ODO S,MARUYAMA T.Cement proteins of the acorn-barnacle,Megabalanus rosa [J].The Biological Bulletin,1996,190(3):403-409.
[31] KAMINO K,NAKANO M,KANAI S.Significance of the conformation of building blocks in curing of barnacle underwater adhesive[J].The FEBS Journal,2012,279(10):1750-1760.
[32] KAMINO K.Novel barnacle underwater adhesive protein is a charged amino acid-rich protein constituted by a Cys-rich repetitive sequence[J].Biochemical Journal,2001,356(2):503-507.
[33] URUSHIDA Y,NAKANO M,MATSUDA S,et al.Identification and functional characterization of a novel barnacle cement protein[J].The FEBS Journal,2007,274(16):4336-4346.
[34] HENNEBERT E,WATTIEZ R,DEMEULDRE M,et al.Sea star tenacity mediated by a protein that fragments,then aggregates[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(17):6317-6322.
[35] WUNDERER J,LENGERER B,PJETA R,et al.A mechanism for temporary bioadhesion[J].Proceedings of the National Academy of Sciences of the United States of America,2019,116(10):4297-4306.
[36] ZENG F,WUNDERER J,SALVENMOSER W,et al.Papillae revisited and the nature of the adhesive secreting collocytes[J].Developmental Biology,2019,448(2):183-198.
[37] CAICCI F,ZANIOLO G,BURIGHEL P,et al.Differentiation of papillae and rostral sensory neurons in the larva of the ascidian Botryllus schlosseri (Tunicata)[J].The Journal of Comparative Neurology,2010,518(4):547-566.
[38] ZENG F,WUNDERER J,SALVENMOSER W,et al.Identifying adhesive components in a model tunicate[J].Philosophical Transactions of The Royal Society B:Biological Sciences,2019,374(1784):20190197.
[39] JENSEN R A,MORSE D E.The bioadhesive of Phragmatopoma californica tubes:a silk-like cement containing L-DOPA[J].Journal of Comparative Physiology B,1988,158(3):317-324.
[40] LEE B P,MESSERSMITH P B,ISRAELACHVILI J N,et al.Mussel-inspired adhesives and coatings[J].Annual Review of Materials Research,2011,41:99-132.
[41] ALDRED N,CHAN V B S,EMAMI K,et al.Chitin is a functional component of the larval adhesive of barnacles[J].Communications Biology,2020,3(1):31.
[42] DEHAL P,SATOU Y,CAMPBELL R K,et al.The draft genome of Ciona intestinalis:insights into chordate and vertebrate origins[J].Science,2002,298(5601):2157-2167.
[43] VINSON J P,JAFFE D B,O’NEILL K,et al.Assembly of polymorphic genomes:algorithms and application to Ciona savignyi[J].Genome Research,2005,15(8):1127-1135.
[44] WEI J K,ZHANG J,LU Q X,et al.Genomic basis of environmental adaptation in the leathery sea squirt (Styela clava)[J].Molecular Ecology Resources,2020,20(5):1414-1431.
[45] MATSUNOBU S,SASAKURA Y.Time course for tail regression during metamorphosis of the ascidian Ciona intestinalis[J].Developmental Biology,2015,405(1):71-81.
[46] 董波.海洋模式动物海鞘及其脊索发育与调控[J].科学通报,2015,60(13):1167-1179.
[47] UEKI T,KOIKE K,FUKUBA I,et al.Structural and mass spectrometric imaging analyses of adhered tunic and adhesive projections of solitary ascidians[J].Zoological Science,2018,35(6):535-547.
[48] MICHIBATA H.The mechanism of accumulation of vanadium by ascidians:some progress towards an understanding of this unusual phenomenon[J].Zoological Science,1996,13(4):489-502.
[49] HIROSE E,AKAHORI M.Comparative morphology of the stolonic vessel in a didemnid ascidian and some related tissues in colonial ascidians[J].Zoological Science,2004,21(4):445-455.
[50] SAAD G A,ALQURASHI N A,HASHIMI S M.Comparative studies on the biological glue of some opportunistic adult marine macro-fouling after dislodgement and construction of temporary faunal conglomerations[J].Journal of Marine Biology & Oceanography,2017,6(1):1000170.
[51] LI S G,HUANG X N,CHEN Y Y,et al.Identification and characterization of proteins involved in stolon adhesion in the highly invasive fouling ascidian Ciona robusta[J].Biochemical and Biophysical Research Communications,2019,510(1):91-96.
[52] SASAKURA Y,NAKASHIMA K,AWAZU S,et al.Transposon-mediated insertional mutagenesis revealed the functions of animal cellulose synthase in the ascidian Ciona intestinalis[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(42):15134-15139.
[53] SASAKURA Y.Cellulose production and the evolution of the sessile lifestyle in ascidians[J].Sessile Organisms,2018,35(2):21-29.
[54] HIROSE E,SENSUI N.Does a nano-scale nipple array (moth-eye structure) suppress the settlement of ascidian larvae?[J].Journal of the Marine Biological Association of the United Kingdom,2019,99(6):1393-1397.
[55] LINDNER E.A low surface free energy approach in the control of marine biofouling[J].Biofouling,1992,6(2):193-205.
[56] 田军,薛群基.低表面能涂层材料降低海洋生物污损的研究[J].环境科学,1997,18(2):40-42.
[57] 朱万章.海洋附着生物对聚合物材料的污损[J].涂料工业,1995(4):12-15.
[58] 高焕,王玉,李光光,等.海水养殖设施防生物附着方法[J].水产养殖,2018,39(11):33-34,36.
[59] KRISHNAN S,WEINMAN C J,OBER C K.Advances in polymers for anti-biofouling surfaces[J].Journal of Materials Chemistry,2008,18(29):3405-3413.
[60] DEKA H,KARAK N,KALITA R D,et al.Bio-based thermostable,biodegradable and biocompatible hyperbranched polyurethane/Ag nanocomposites with antimicrobial activity[J].Polymer Degradation and Stability,2010,95(9):1509-1517.
[61] 孙源,刘冰.污损脱附型海洋防污材料研究进展[J].电镀与涂饰,2019,38(14):757-761.
[62] PAETZOLD S C,DAVIDSON J.Aquaculture fouling:efficacy of potassium monopersulphonate triple salt based disinfectant (Virkon® Aquatic) against Ciona intestinalis[J].Biofouling,2011,27(6):655-665.
[63] 冯丹青,柯才焕,周时强,等.盐度对冠瘤海鞘幼体附着与变态的影响[J].海洋科学,2003,27(1):42-46.
[64] 宓宇晓,周泽华,王泽华,等.海工构件防生物吸附涂料的研究进展[J].材料导报,2015,29(2):35-39.
[65] CAHILL P,HEASMAN K,JEFFS A,et al.Preventing ascidian fouling in aquaculture:screening selected allelochemicals for anti-metamorphic properties in ascidian larvae[J].Biofouling,2012,28(1):39-49.
[66] 黄英.冠瘤海鞘(Styela canopus)附着和变态机制的研究[D].厦门:厦门大学,2002.
[67] ZAPATA M,SILVA F,LUZA Y,et al.The inhibitory effect of biofilms produced by wild bacterial isolates to the larval settlement of the fouling ascidian Ciona intestinalis and Pyura praeputialis[J].Electronic Journal of Biotechnology,2007,10(1):149-159.
[68] KRISTENSEN J B,MEYER R L,LAURSEN B S,et al.Antifouling enzymes and the biochemistry of marine settlement[J].Biotechnology Advances,2008,26(5):471-481.
[69] 赵金榜.无锡防污涂料的现状和发展(Ⅰ)[J].现代涂料与涂装,2005,8(2):35-38.
[70] KAMINO K.Underwater adhesive of marine organisms as the vital link between biological science and material science[J].Marine Biotechnology,2008,10(2):111-121.
[71] HUANG W J,WANG Y X,CHEN Y,et al.Strong and rapidly self-healing hydrogels:potential hemostatic materials[J].Advanced Healthcare Materials,2016,5(21):2813-2822.
[72] CHO J H,LEE J S,SHIN J,et al.Hydrogels:ascidian-inspired fast-forming hydrogel system for versatile biomedical applications:pyrogallol chemistry for dual modes of crosslinking mechanism (Adv.Funct.Mater.6/2018)[J].Advanced Functional Materials,2018,28(6):1870035.
[73] ZHANG L B,LU Z,VELARDE L,et al.Vibrational spectral signatures of crystalline cellulose using high resolution broadband sum frequency generation vibrational spectroscopy (HR-BB-SFG-VS)[J].Cellulose,2015,22(3):1469-1484.
[74] DUBIEF D,SAMAIN E,DUFRESNE A.Polysaccharide microcrystals reinforced amorphous poly(β-hydroxyoctanoate) nanocomposite materials[J].Macromolecules,1999,32(18):5765-5771.
[75] CAPADONA J R,SHANMUGANATHAN K,TYLER D,et al.Stimuli-responsive polymer nanocomposites inspired by the sea cucumber dermis[J].Science,2008,319(5868):1370-1374.