北方须鳅Barbatula barbatula nuda隶属于鲤形目Cypriniformes鳅科Cobitidae须鳅属Barbatula,是中国北方地区溪流中常见的小型底栖鱼类。在国外,主要分布于俄罗斯、日本、朝鲜等地;在中国,除东北地区外,主要分布于滦河、海河上游、新疆额尔齐斯河、乌伦古河等[1]。北方须鳅肉质细嫩,味道鲜美,深受消费者喜爱。目前,由于酷渔滥捕和环境改变,北方须鳅自然资源日趋枯竭,因此,开展其规模化人工繁殖和养殖研究具有重要意义[2-3]。
鱼类的精子质量受雄亲鱼的健康状况、年龄、体型、性腺发育程度等影响。精子活力是衡量精子质量的重要指标[4-7],激活液中离子浓度、葡萄糖浓度、pH、温度等因子均可影响精子活力[8]。目前,北方须鳅的规模化人工繁殖仍然依赖于人工授精,因此,对其精子活力研究显得尤为重要,但尚未见有关北方须鳅精子活力的研究报道。本研究中,通过观察北方须鳅精子活力与离子浓度、葡萄糖浓度、pH、温度等因子间的关系,初步确定了北方须鳅精子激活与离子、葡萄糖、pH、温度等因子的适宜条件,旨在有效解决现阶段北方须鳅人工繁育中精子活力较低的问题,为其人工繁育提供科学参考。
1 材料与方法
1.1 材料
于2019年4月17日从辽宁省桓仁满族自治县木盂子镇某渔场,挑选健康、性腺成熟度好的雄鱼27尾,体长为10~15 cm,体质量为10~38 g,暂养于水泥池中供试验用。
1.2 方法
1.2.1 催产及精液采集 采用促黄体生成素释放激素类似物(LHRH-A2)复合型药物,对鱼体进行背鳍基部肌肉注射后再放入暂养池,水温渐升至20.0 ℃,24 h后用洁净毛巾包裹住鱼体,用吸水纸擦干泄殖孔周围水分,轻压鱼体下腹部,采得无血、无粪便的精液于载玻片上备用。
1.2.2 精子激活试验设计 参考张涛等[9]关于高体雅罗鱼Leuciscus idus精子活力试验方法并加以改进,设计不同因子及其不同浓度对北方须鳅精子活力的影响试验。
单因子试验:NaCl浓度分别设为17、51、68、85、94、102 mmol/L;KCl浓度分别设为5、10、20、50、80、100 mmol/L;CaCl2浓度分别设为10、30、50、80、100 mmol/L;Tris(C4H11NO3)浓度分别设为2、8、16、20、24、33、198 mmol/L;甘油(C2H5NO2)浓度分别设为13、26、30、41、56 mmol/L;葡萄糖浓度分别设为10、30、60、90、150、180 mmol/L;用去离子水作空白对照组。
复合因子试验:在单因子试验基础上设计复合因子试验,设置混合激活液A(Na+68 mmol/L、K+80 mmol/L 2种离子溶液的体积比为1∶1)和激活液B(Na+ 68 mmol/L、K+ 80 mmol/L、Ca2+ 50 mmol/L、葡萄糖180 mmol/L 4种离子溶液的体积比为1∶1∶1∶1)。
每种离子浓度及混合激活液均设置3个重复试验。除温度为因变量的试验组外,其他因子试验组的温度均为室温20 ℃。
不同pH、温度梯度设计均参考阮国良等[8]进行的泥鳅精子活力试验设计。用离子浓度均为0.1 mol/L的KH2PO4、NaOH和H3BO3 溶液配制出不同pH梯度的缓冲液[10],pH分别设为3.0、4.0、5.0、6.0、7.0、8.0、9.0, 其中,pH 7.0为对照组,每个pH设3个重复试验。
将去离子水、北方须鳅精液及玻片等放入烧杯且密封后置于热水浴锅或冰水浴锅中调节温度,温度分别设为(5.0±1.0)、(10.0±1.0)、(14.0±1.0)、(16.0±1.0)、(20.0±1.0)、(25.0±1.0)、(28.0±1.0)℃等,其中,温度为(20.0±1.0)℃为对照组,每个温度设3个重复试验。
1.2.3 精子活力观察 用解剖针挑取少量精液于载玻片上,滴一滴激活液,并迅速盖上盖玻片,置于显微镜(Olympus CX21)下观察,同时用秒表计时,每个梯度做3个重复试验。
1.2.4 精子活力评价指标
快速运动时间(fast movement time,FT):精子呈现快速运动,快到运动过程看不清路线,只能看到精子呈现“一团旋涡”的持续时间。
寿命时间(life time,LT):从精子开始活动至大约90%精子死亡的时间。
精子激活率:指激活起始时,视野中被激活的精子数量占全部精子数量的百分比。
1.3 数据处理
试验结果以平均值与标准差(mean±S.D.)表示,运用 Excel 2016进行处理。采用SPSS 22.0软件进行单因素方差分析,用LSD法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 Na+对北方须鳅精子活力的影响
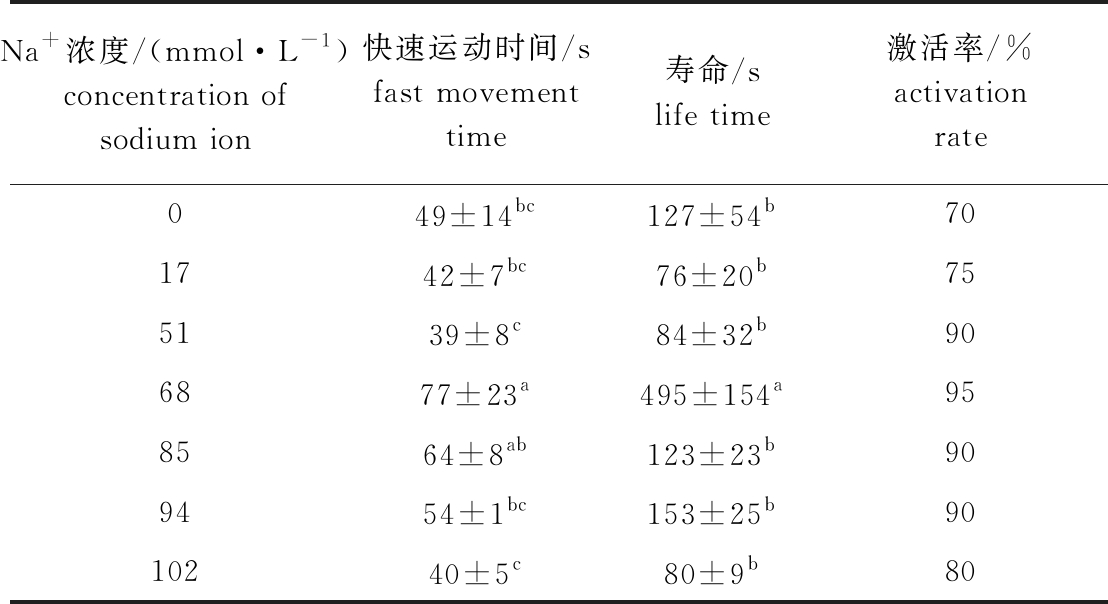
从表1可见:在Na+浓度为17~94 mmol/L 的溶液中,随着Na+浓度的升高北方须鳅精子活力逐渐增强;Na+浓度为68 mmol/L时,精子活力最强,快速运动时间为(77±23)s,寿命为(495±15)s,激活率为95%,该浓度下的精子快速运动时间除与85 mmol/L浓度组无显著性差异(P>0.05)外,显著快于其他组P<0.05),且寿命显著高于其他组(P<0.05);当Na+浓度增加至94 mmol/L时,精子活力骤然下降。
表1 北方须鳅精子在不同浓度Na+溶液中的活力
Tab.1 Sperm viability of loach Barbatula barbatula nuda in different concentrations of Na+solution
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
Na+浓度/(mmol·L-1)concentration of sodium ion快速运动时间/sfast movement time寿命/slife time激活率/%activation rate049±14bc127±54b701742±7bc76±20b755139±8c84±32b906877±23a495±154a958564±8ab123±23b909454±1bc153±25b9010240±5c80±9b80
2.2 K+对北方须鳅精子活力的影响
从表2可见:在K+离子浓度为5~100 mmol/L 的溶液中,北方须鳅精子活力随K+浓度的升高而增强;K+浓度为80 mmol/L时,精子活力最强,其快速运动时间、寿命和激活率分别为(68±10)s、(412±162)s和95%,该浓度下的精子快速运动时间除与100 mmol/L浓度组无显著性差异(P>0.05)外,显著高于其他组(P<0.05),且寿命显著高于其他组(P<0.05);当K+浓度超过80 mmol/L时,精子活力下降。
表2 北方须鳅精子在不同浓度K+溶液中的活力情况
Tab.2 Sperm viability of loach Barbatula barbatula nuda in different concentrations of K+solution
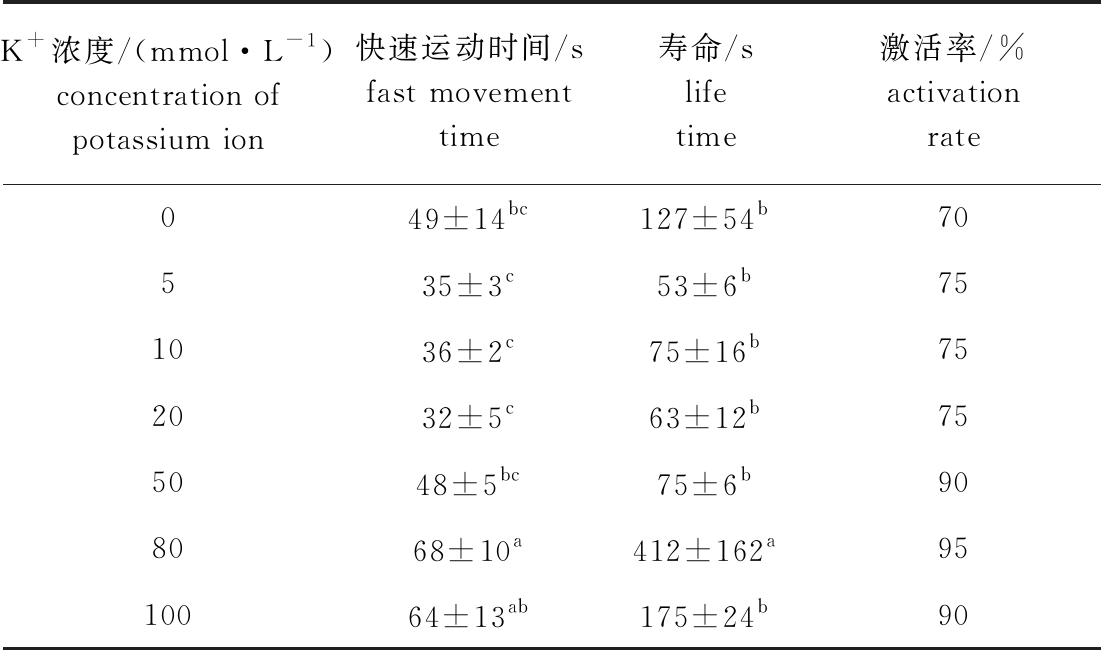
K+浓度/(mmol·L-1)concentration of potassium ion快速运动时间/sfast movement time寿命/slife time激活率/%activation rate049±14bc127±54b70535±3c53±6b751036±2c75±16b752032±5c63±12b755048±5bc75±6b908068±10a412±162a9510064±13ab175±24b90
2.3 Ca2+对北方须鳅精子活力的影响
由表3可见:在Ca2+浓度为10~100 mmol/L的溶液中,北方须鳅精子活力随Ca2+浓度的升高而增强;Ca2+浓度为50 mmol/L时,精子活力达到峰值,其快速运动时间、寿命和激活率分别为(77±13)s、(281±26)s和95%,该浓度下的精子快速运动时间除与80 mmol/L浓度组无显著性差异(P<0.05)外,显著高于其他组(P<0.05),且寿命显著高于其他组(P<0.05);当Ca2+浓度超过50 mmol/L后,精子活力骤然下降。
表3 北方须鳅精子在不同浓度Ca2+溶液中的活力
Tab.3 Sperm viability of loach Barbatula barbatula nuda in different concentrations of Ca2+ solution
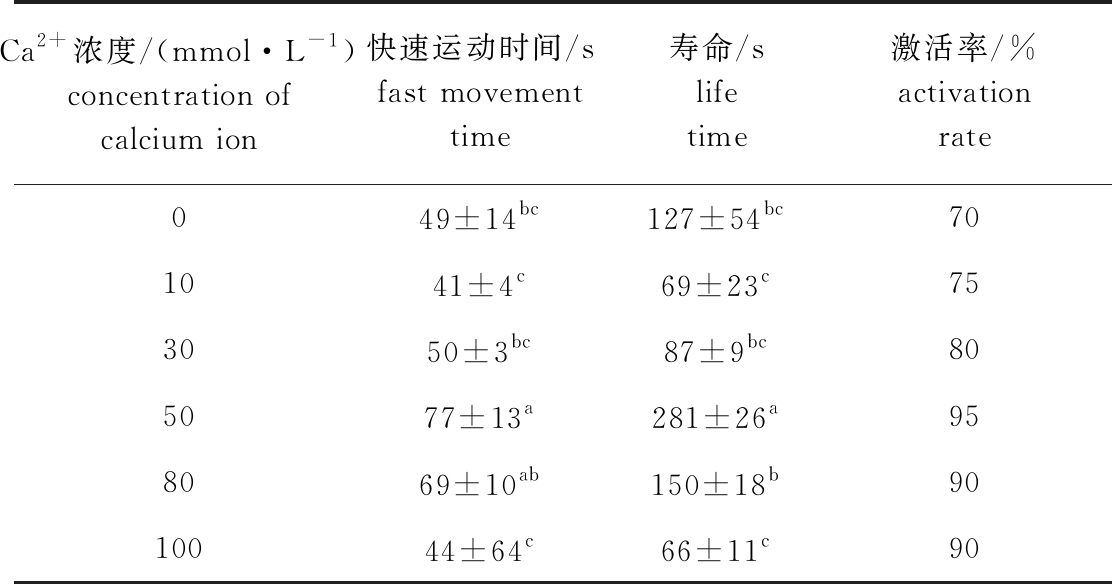
Ca2+浓度/(mmol·L-1)concentration of calcium ion快速运动时间/sfast movement time寿命/slife time激活率/%activation rate049±14bc127±54bc701041±4c69±23c753050±3bc87±9bc805077±13a281±26a958069±10ab150±18b9010044±64c66±11c90
2.4 Tris对北方须鳅精子活力的影响
从表4可见:在Tris浓度为2~198 mmol/L的溶液中,北方须鳅精子活力随着Tris浓度的升高无显著性变化,与对照组相比,加入Tris后精子活力减弱,精子快速运动时间、寿命均降低,精子激活率无明显变化;Tris浓度为0 mmol/L的空白组精子快速运动时间与其他浓度组间有显著性差异(P<0.05),且寿命除与浓度为198 mmol/L组无显著性差异(P>0.05)外,均显著高于其他浓度组(P<0.05)。这表明,加入Tris溶液后精子活力减弱。
表4 北方须鳅精子在不同浓度Tris溶液中的活力
Tab.4 Sperm viability of loach Barbatula barbatula nuda in different concentrations of Tris solution
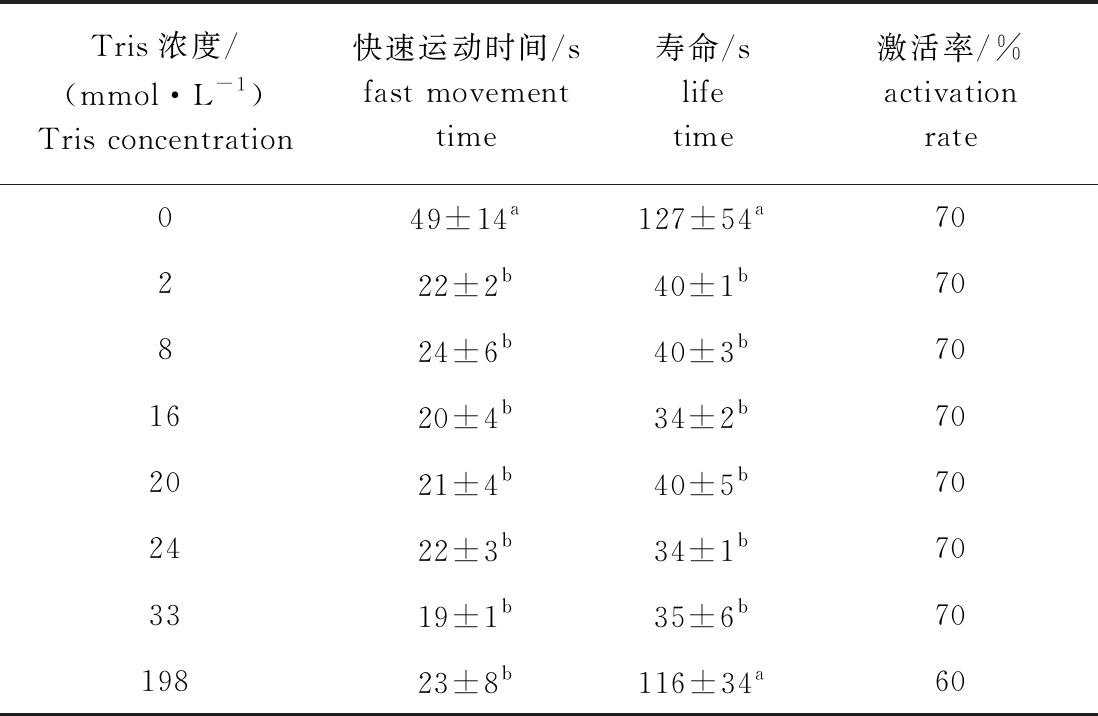
Tris浓度/(mmol·L-1)Tris concentration快速运动时间/sfast movement time寿命/slife time激活率/%activation rate049±14a127±54a70222±2b40±1b70824±6b40±3b701620±4b34±2b702021±4b40±5b702422±3b34±1b703319±1b35±6b7019823±8b116±34a60
2.5 甘油对北方须鳅精子活力的影响
从表5可见:在甘油浓度为13~56 mmol/L的溶液中,北方须鳅精子活力随着浓度的升高而减弱,与对照组相比,加入甘油后精子活力减弱,快速运动时间、寿命、精子激活率均降低;甘油浓度为0 mmol/L的空白组精子快速运动时间与26、56 mmol/L浓度组间有显著性差异(P<0.05),与其他浓度组无显著性差异(P>0.05),且寿命仅与26 mmol/L浓度组间有显著性差异(P<0.05)。这表明,加入甘油溶液后精子活力减弱。
表5 北方须鳅精子在不同浓度甘油溶液中的活力
Tab.5 Sperm viability of loach Barbatula barbatula nuda in different concentrations of glycerol solution
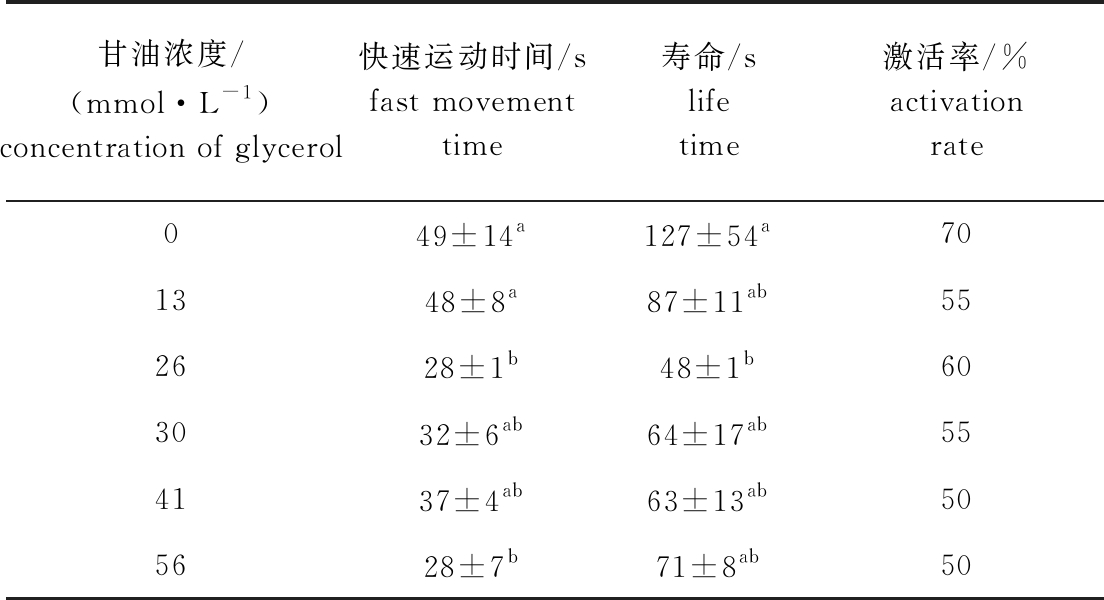
甘油浓度/(mmol·L-1)concentration of glycerol快速运动时间/sfast movement time寿命/slife time激活率/%activation rate049±14a127±54a701348±8a87±11ab552628±1b48±1b603032±6ab64±17ab554137±4ab63±13ab505628±7b71±8ab50
2.6 葡萄糖对北方须鳅精子活力的影响
从表6可见:当葡萄糖浓度为180 mmol/L时,北方须鳅精子活力最强,精子快速运动时间、寿命及激活率分别为(88±11)s、(272±34)s、90%,该浓度下的精子快速运动时间显著高于其他组(P<0.05),且寿命除与150 mmol/L浓度组间无显著性差异(P>0.05)外,均显著高于其他组(P<0.05);当葡萄糖浓度低于180 mmol/L时,随着葡萄糖浓度的增加,精子活力逐渐升高。
表6 北方须鳅精子在不同浓度葡萄糖溶液中的活力
Tab.6 Sperm viability of loach Barbatula barbatula nuda in different concentrations of glucose solution
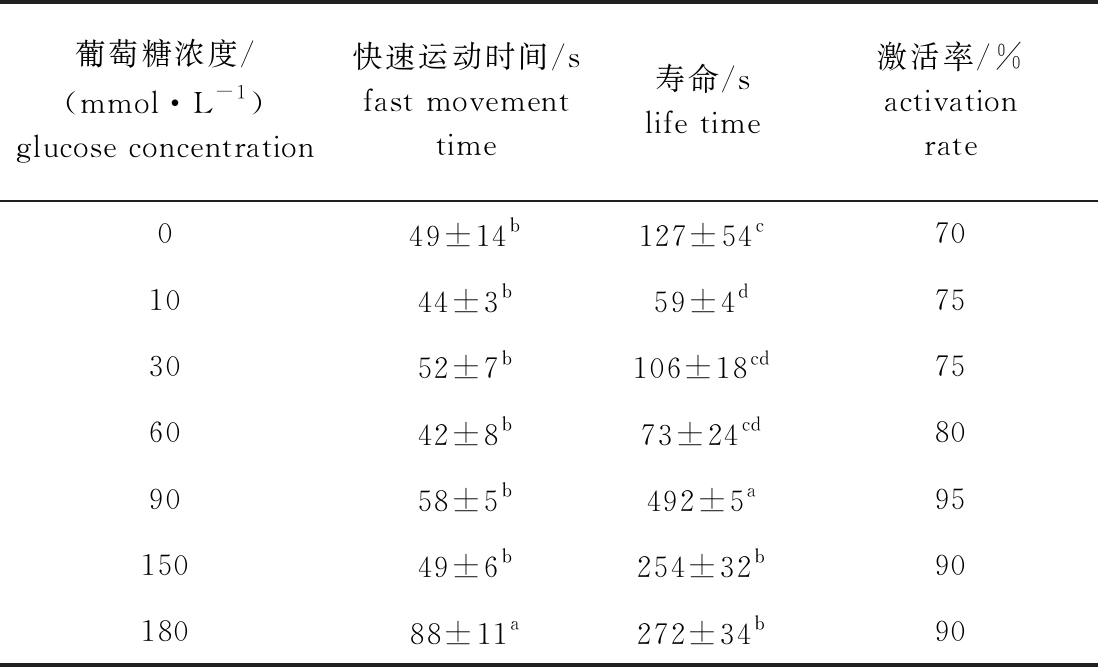
葡萄糖浓度/(mmol·L-1)glucose concentration快速运动时间/sfast movement time寿命/slife time激活率/%activation rate049±14b127±54c701044±3b59±4d753052±7b106±18cd756042±8b73±24cd809058±5b492±5a9515049±6b254±32b9018088±11a272±34b90
2.7 pH对北方须鳅精子活力的影响
从表7可见:当pH为3.0~5.0时,北方须鳅精子完全不运动,精子活力受到抑制;当pH为6.0~7.0时,精子活力随着pH的上升而增强;当pH为7.0时活力最强,精子快速运动时间、寿命及激活率分别为(87±11)s、(128±17)s、90%,该pH条件下的精子快速运动时间除与pH为8.0组无显著性差异(P>0.05)外,显著高于其他组(P<0.05),且寿命与其他各组均无显著性差异(P>0.05);之后,随着pH的增大,精子活力逐渐减弱。这表明,精子在中性或弱碱性环境中活力更强。
表7 北方须鳅精子在不同pH溶液中的活力
Tab.7 Sperm viability of loach Barbatula barbatula nuda in different pH solution
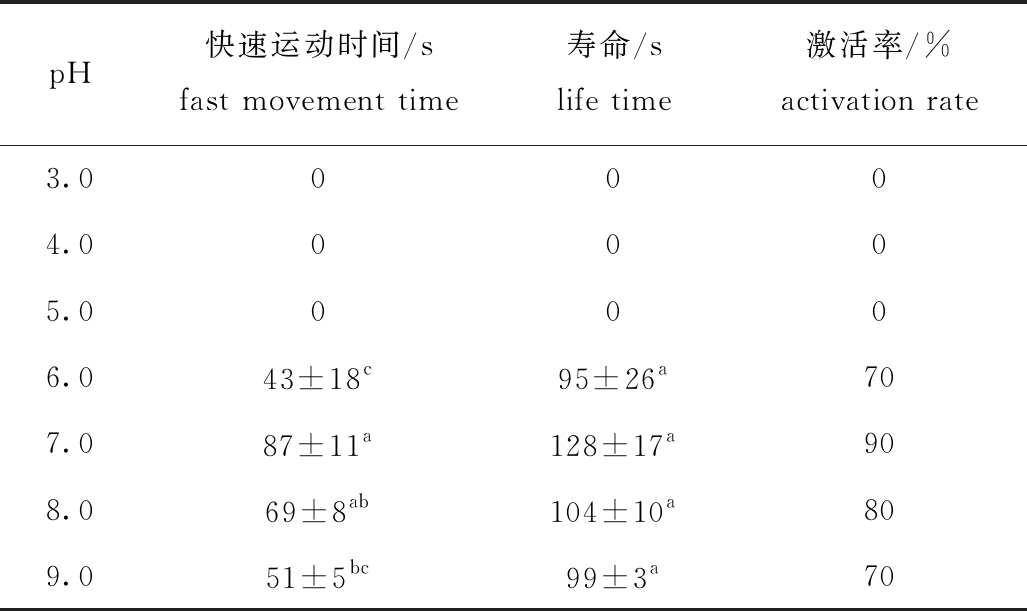
pH快速运动时间/sfast movement time寿命/slife time激活率/%activation rate3.00004.00005.00006.043±18c95±26a707.087±11a128±17a908.069±8ab104±10a809.051±5bc99±3a70
2.8 温度对北方须鳅精子活力的影响
从表8可见:当温度在5~20 ℃时,随着温度的升高,北方须鳅精子活力变化不明显,当温度高于20 ℃时,随着温度的升高精子活力明显减弱;温度为5~28 ℃时,随着温度的升高,精子激活率变化不明显;温度为(5.0±1.0)℃时,精子快速运动时间和寿命均显著高于(25.0±1.0)、(28.0±1.0)℃组(P<0.05)。这表明,北方须鳅精子在温度为5~20 ℃时活力较强。
表8 北方须鳅精子在不同温度溶液中的活力
Tab.8 Sperm viability of loach Barbatula barbatula nuda exposed to different gradient temperature
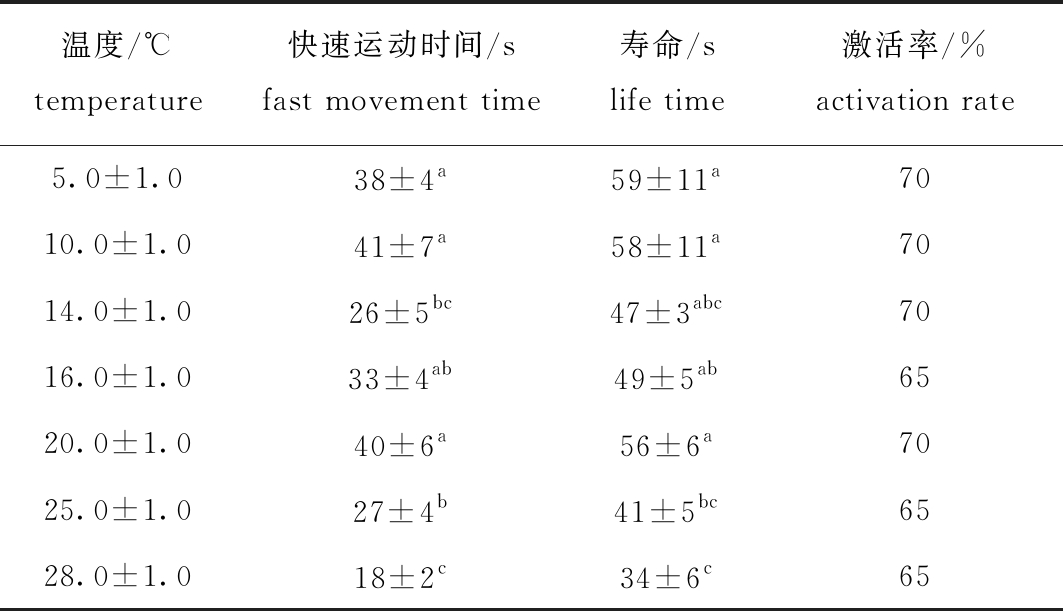
温度/℃temperature快速运动时间/sfast movement time寿命/slife time激活率/%activation rate5.0±1.038±4a59±11a7010.0±1.041±7a58±11a7014.0±1.026±5bc47±3abc7016.0±1.033±4ab49±5ab6520.0±1.040±6a56±6a7025.0±1.027±4b41±5bc6528.0±1.018±2c34±6c65
2.9 两种混合激活液对北方须鳅精子活力影响
从表9可见:在混合激活液A中北方须鳅精子活力强于对照组,其精子快速运动时间、寿命、精子激活率分别为(91±16)s、(552±90)s、95%,精子活力强于其他单一溶质试验组;在混合激活液B中精子活力最强,快速运动时间、寿命、精子激活率分别为(112±17)s、(707±60)s、95%,精子活力强于激活液A及其他单一溶质试验组,激活液B中的精子快速运动时间与激活液A无显著性差异(P>0.05),二者均显著高于空白对照组(P<0.05),激活液B中的精子寿命最长,显著长于其他组(P<0.05)。这表明,加入混合激活液后,精子存活率明显增强。
表9 北方须鳅精子在不同种类混合激活液中的活力
Tab.9 Sperm viability of loach Barbatula barbatula nuda in different kinds of activating solutions

激活液种类type of activating solution快速运动时间/sfast movement time寿命/slife time激活率/%activation rate对照组 control group49±14b127±54c70激活液A activation liquid A91±16a552±90b95激活液B activation liquid B112±17a707±60a95
3 讨论
3.1 离子浓度对精子活力的影响
研究表明,多数鱼类的精子在输精管和精浆中是不运动的,但在不同种类的鱼中,精子在释放前处于静止状态的原因各不相同[12-14]。如在鲤科鱼类[15-17]中,精子是通过较高的精浆渗透压维持静止状态,当精子从精浆到激活液或淡水中时,质膜电位及其电导特性发生变化,精子从静止状态变成了运动状态,这是由于细胞内离子的变化导致一些参数变动,如离子组成发生了改变,从而改变了细胞膜的性质并诱导精子运动,而当精子被激活开始进行剧烈运动时,其自身储存的能量随着时间的推移逐渐被消耗殆尽,最终停止运动。
黄辩非等[18]认为,精子活力与所处环境的渗透压有关。渗透压对精子活力的影响实质是各种离子的浓度对精子的影响。当环境渗透压与精子本身渗透压相等时,精子活力最强,即快速运动时间和寿命达到最大值,渗透压高于或低于精子自身的渗透压时,精子活力均会受到不同程度的抑制。在影响精子活力的各种因素当中,渗透压是影响精子活力的最关键因素[19-20]。一般情况下,低渗透压环境能够激活淡水硬骨鱼类精子,渗透压适宜时精子活力强[21]。本研究表明,当Na+、K+、Ca2+浓度分别为68、80、50 mmol/L时,北方须鳅精子活力较强,以上相关数据可作为北方须鳅人工繁殖中人工授精适宜激活液配制参考。
3.2 葡萄糖、甘油、Tris对精子活力的影响
硬骨鱼类精液中存在葡萄糖、半乳糖、果糖等糖类物质,这些糖类物质在提高精子活力方面具有重要作用[22-24]。有学者研究发现,白斑狗鱼Esox lucius[25]、凹目白鲑Coregonus autumnalis[26]、丁鱥Tinca tinca[27]和高体雅罗鱼[9]等鱼类精子处于合适浓度的葡萄糖溶液中能够有效提高其精子活力。这可能是在适宜浓度的葡萄糖激活液中精子能够直接利用外源性葡萄糖,补充在激活时调节渗透压和运动所消耗的能量[28-29]。有学者认为,甘油对高体部分鱼类的精子活力具有增强效果,其作用甚至不低于葡萄糖[18,23]。此外,Tris常被用作低温环境下精液的保存剂[30]。本研究表明,当激活液中葡萄糖浓度为180 mmol/L时,北方须鳅精子的快速运动时间和寿命均达到最大值,且葡萄糖提升精子活力的效果优于其他物质,这与对泥鳅Misgurnus anguillicaudatus[28]和江鳕Lota lota精子活力的试验结果一致[29]。但本研究中甘油与Tris对北方须鳅精子活力具有抑制作用,其快速运动时间和寿命均不如空白组对照,这两种物质对北方须鳅精子活力的影响机理尚不明确,有待进一步研究。
3.3 pH对精子活力的影响
pH也是影响精子活力的重要因素之一。王芳等[31]研究发现,大多数鱼类精浆的pH为弱碱性,精子处于中性或弱碱性环境中活力更强,在酸性环境中精子因细胞结构受损而失去活力或活力减弱,受精率降低[32]。罗明坤等[33]研究发现,泥鳅、萨罗罗非鱼Sarotherodon melanotheron、翘嘴红鲌Erythroculter ilishaeformis和草鱼Ctenopharyngodon idella等淡水鱼类精子在激活液pH 7.5以上时活力较强。本研究中,北方须鳅精子在pH在5.0以下时不运动,pH在7.0时精子活力最强,pH为7.0~8.0时精子活力较强,精子在中性或弱碱性环境中活力优于弱酸性环境,这与对其他淡水鱼类的研究结果相似(表10)。
表10 北方须鳅及其他几种淡水鱼类精子适宜pH范围
Tab.10 Optimum pH range of sperm of loach Barbatula barbatula nuda and other freshwater fishes

种类 species精子最适pH optimum pH range of sperm文献来源 reference草鱼 Ctenopharyngodon idellus7.5~9.0鲁大椿等[34]萨罗罗非鱼 Sarotherodon melanotheron7.5~8.0罗明坤等[33]翘嘴红鲌 Erythroculter ilishaeformis7.0~8.5王芳等[31]泥鳅 Misgurnus anguillicaudatus7.0~7.6阮国良等[8]北方须鳅 Barbatula barbatula nuda7.0~8.0本试验
3.4 温度对精子活力的影响
温度对精子活力的影响比较复杂,一般认为,温度与精子活力是一个开口向下的二次函数关系[35],温度可能是通过改变精子酶的活性影响其活力。在一定范围内温度升高时酶活性增强,精子的代谢速率加快,其快速运动时间与强度也增加,但精子本身能量迅速消耗殆尽死亡,存活时间变短。当温度降低时,酶活性降低,精子代谢速率减慢,精子快速运动时间和强度也减弱,但精子运动消耗能量也减少,因此,存活时间延长。即在一定温度范围内(不同种鱼类间有差异),随着温度的升高精子活力增强至峰值,达到峰值后,随着温度的升高精子活力逐渐减弱直至完全失活[36-38]。本研究中,温度为5~20 ℃时,随着温度的上升,北方须鳅精子活力较高但变化不显著。这可能是因为此温度范围与其生存和繁殖的适宜温度相符,精子对温度变化的耐受性较强。当温度高于20 ℃时,北方须鳅精子活力随着温度的升高显著减弱。这是否说明北方须鳅精子中酶活性的适宜温度为5~20 ℃,还有待进一步研究。
3.5 复合因子对精子活力的影响
本研究表明,不同离子对精子活力的影响各不相同,单因子试验中发现,Na+、K+、Ca2+及葡萄糖均对北方须鳅精子活力有增强作用。本研究中将不同离子溶液进行组合,以进一步探究其不同离子间的相互作用关系,结果如表11所示,其中Na+、K+离子溶液组成的激活液A相比于单一离子溶液对精子具有更强的激活作用,表明Na+和K+之间具有协同作用,由Na+、K+、Ca2+、葡萄糖组成的激活液B相比于单一离子溶液和激活液A对精子具有更强的激活作用,这表明Na+、K+、Ca2+、葡萄糖间也具有协同作用。由此可见,激活液B对增强北方须鳅精子活力的影响最大。由于涉及影响精子活力的物质较多,不同组合也较多,激活液B是否为最佳激活液还有待进一步试验验证。
表11 不同激活液对北方须鳅精子活力影响的比较
Tab.11 Comparison of effects of different activating solutions on sperm motility of loach Barbatula barbatula nuda

激活液种类type of activating solution快速运动时间/sfast movement time寿命/slife time激活率/%activation rate空白对照control group49±14c127±54d70最适Na+浓度激活液(68 mmol/L)77±23b495±154b95最适K+浓度激活液(80 mmol/L)68±10bc412±162bc95最适Ca2+浓度激活液(50 mmol/L)77±13b281±26c95最适葡萄糖浓度激活液(180 mmol/L)88±11ab272±34c90激活液A (Na+ 68 mmol/L、K+ 80 mmol/L 2种离子溶液的体积比为1∶1)91±16ab552±90ab95激活液B (Na+ 68 mmol/L、K+ 80 mmol/L、Ca2+50 mmol/L、葡萄糖180 mmol/L 4种离子溶液的体积比为1∶1∶1∶1)112±17a707±60a95
4 结论
1)Na+、K+、Ca2+、葡萄糖对北方须鳅精子活力有增强效果,且其组合激活液B(Na+ 68 mmol/L、K+ 80 mmol/L、Ca2+ 50 mmol/L、葡萄糖180 mmol/L 4种离子溶液的体积比为1∶1∶1∶1)效果最佳。
2) 北方须鳅精子的适宜温度为5~20 ℃,适宜pH为7.0~8.0。本研究结果可有效解决现阶段北方须鳅人工繁育中精子活力较低的问题。
[1] 解玉浩,李文宽,解涵.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007:236-237.
[2] 骆小年,段友健,郭童,等.北方须鳅人工繁殖与胚胎发育研究[J].大连海洋大学学报,2021,36(2):187-194.
[3] 徐浩然,骆小年,韩如政,等.北方须鳅室内当年养成食用鱼试验[J].水产学杂志,2018,31(1):7-11.
[4] LINHART O,SLECHTA V,SLAV C T.Fish sperm composition and biochemistry[J].Bulletin of the Institute of Zoology,Academia Sinica Monograph,1991,16:285-311.
C T.Fish sperm composition and biochemistry[J].Bulletin of the Institute of Zoology,Academia Sinica Monograph,1991,16:285-311.
[5] LAHNSTEINER F,BERGER B,WEISMANN T,et al.Determination of semen quality of the rainbow trout,Oncorhynchus mykiss,by sperm motility,seminal plasma parameters,and spermatozoal metabolism[J].Aquaculture,1998,163(1/2):163/181.
[6] COWARD K,BROMAGE N R,HIBBITT O,et al.Gamete physiology,fertilization and egg activation in teleost fish[J].Reviews in Fish Biology and Fisheries,2002,12(1):33-58.
[7] KHARA H,NOVEIRI S B,DADRAS H,et al.Sperm motility and fertilizing ability in Aristichthys nobilis:effect of ions[J].Comparative Clinical Pathology,2013,22(6):1069-1074.
[8] 阮国良,冯家斌,杨代勤.渗透压、pH和温度对泥鳅精子活力及受精率的影响[J].湖北农学院学报,2004,24(1):22-25.
[9] 张涛,李胜忠,牛建功,等.Na+、K+、葡萄糖及甘油对高体雅罗鱼精子活力的影响[J].南方农业学报,2017,48(4):734-738.
[10] 中南矿冶学院分析化学教研室.化学分析手册[M].北京:科学出版社,1982:247-249.
[11] 徐敏.盐碱度对3种鱼精子活力、受精率及孵化率的影响[D].上海:上海海洋大学,2015.
[12] MORISAWA M.Initiation mechanism of sperm motility at spawning in teleosts[J].Zoological Science,1985,2:605-615.
[13] MORISAWA M,SUZUKI K.Osmolality and potassium ion:their roles in initiation of sperm motility in teleosts[J].Science,1980,210(4474):1145-1147.
[14] MORISAWA M,SUZUKI K,SHIMIZU H,et al.Effects of osmolality and potassium on motility of spermatozoa from freshwater cyprinid fishes[J].Journal of Experimental Biology,1983,107:95-103.
[15] BOITANO S,OMOTO C K.Membrane hyperpolarization activates trout sperm without an increase in intracellular pH[J].Journal of Cell Science,1991,98(3):343-349.
[16] CIERESZKO A,GLOGOWSKI J,DABROWSKI K.Biochemical characteristics of seminal plasma and spermatozoa of freshwater fishes[M]//TIERSCH T R,MAZIK P M.Cryopreservation of aquatic species.Baton Rouge:World Aquaculture Society,2000:20-48.
[17] COSSON J,BILLARD R,CIBERT C,et al.Ionic factors regulating the motility of fish sperm[M]//GAGNON C.The male gamete from basic science to clinical applications.Vienna,IL:Cache River Press,1999:161-186.
[18] 黄辩非,罗静波,杨代勤,等.氯化钠溶液对美国大口胭脂鱼精子活力影响的观察[J].湖北农业科学,2000(6):61-62.
[19] 王祖昆,邱麟翔,陈魁侯,等.我国南方主要淡水养殖鱼类精子特性研究[J].淡水渔业,1985(1):18-24,27.
[20] 魏开金,王汉平,林加敬,等.氯化钠浓度对鲥鱼精子活力影响的初步观察[J].淡水渔业,1996,26(4):9-10.
[21] 严安生,王其和,李诗模.渗透压和钾对鲤、团头鲂精子活力的影响[J].淡水渔业,1993,23(3):19-21.
[22] GARDINER D M.Utilization of extracellular glucose by spermatozoa of two viviparous fishes[J].Comparative Biochemistry and Physiology Part A:Physiology,1978,59(2):165-168.
[23] GREGORY R W.Occurrence of fructose in trout seminal plasma[J].Transactions of the American Fisheries Society,1968,97(2):203-204.
[24] DE W KRUGER J C,SMIT G L,VAN VUREN J H J,et al.Some chemical and physical characteristics of the semen of Cyprinus carpio L. and Oreochromis mossambicus (Peters)[J].Journal of Fish Biology,1984,24(3):263-272.
[25] 李胜忠,张健,成沛,等.甘露醇和甘油对白斑狗鱼精子活力的影响[J].水产养殖,2013,34(1):18-20.
[26] 李胜忠,郭焱,蔡林钢,等.Na+、葡萄糖、果糖对凹目白鲑精子活力的影响[J].动物学杂志,2005,40(4):82-85.
[27] 苏德学,严安生,田永胜,等.阳离子、葡萄糖及渗透压对丁鱥精子活力的影响[J].水利渔业,2004,24(1):7-8.
[28] 胡一中.Na+、K+、Ca2+、葡萄糖及渗透压对泥鳅精子活力的影响[J].金华职业技术学院学报,2010,10(3):69-72.
[29] 王位莹,李胜忠,张俊杰,等.江鳕精子在不同激活液中的活力测定[J].贵州农业科学,2015,43(10):144-146,152.
[30] 刘新峰,郝志明,孙忠媛,等.Tris-葡萄糖稀释液中添加重酒石酸去甲肾上腺素、丙酸睾酮对低温保存犬精子活率的影响[J].黑龙江畜牧兽医,2009(3):115-116.
[31] 王芳,岳兴建,谢碧文,等.pH、葡萄糖以及金属离子对翘嘴红鲌精子活力的影响[J].安徽农业科学,2011,39(27):16812-16814,16884.
[32] 顾正选,丁诗华.pH值及不同百分浓度NaCl溶液对齐口裂腹鱼精子活力的影响[J].西南大学学报(自然科学版),2017,39(7):72-76.
[33] 罗明坤,赵岩,JEERAWAT T,等.pH、盐度及K+、Ca2+和葡萄糖对萨罗罗非鱼精子活力的影响[J].南方农业学报,2014,45(11):2076-2080.
[34] 鲁大椿,傅朝君,刘宪亭,等.我国主要淡水养殖鱼类精液的生物学特性[J].淡水渔业,1989(2):34-37.
[35] 潘德博,许淑英,叶星,等.广东鲂精子主要生物学特性的研究[J].中国水产科学,199,6(4):111-113.
[36] 罗芬,黄伟卿,阮少江,等.温度对海捕野生大黄鱼精子活力的影响[J].水产科学,2017,36(6):814-817.
[37] 乔志刚,刘淑琰,沈方方.鲇精子超微结构及pH、温度对其精子活力的影响[J].大连海洋大学学报,2016,31(6):602-606.
[38] 刘鉴毅,黄晓荣,章龙珍,等.盐度、温度和pH对2种篮子鱼精子活性的影响[J].海洋渔业,2014,36(6):523-528.