目前,中国水产养殖业发展受到土地、水及环境问题的限制。为了促进产业持续发展,需要最大限度地利用土地、水和营养物质,从而减少对环境的影响[1]。池塘鱼菜立体种养模式是一种将水栽植物与传统水产养殖技术相结合的绿色养殖模式。池塘鱼菜立体种养模式使鱼—虾—菜间达到生态平衡关系,生产高品质绿色的鱼、虾和蔬菜,实现经济效益和生态效益双赢,被认为是未来水产养殖可持续发展的方向[2-3]。池塘鱼菜立体种养模式以生态系统的自我调节为主导,通过水域中生物(动物、植物、微生物)间和生物与环境间的相互作用形成生态系统的平衡,微生物在其中发挥着重要的作用。但自然界中的细菌可在实验室条件下培养的较少,要反映环境中菌群的结构组成不能仅仅依靠传统的分离培养方法[4]。目前,对环境微生物的研究多采用新一代的高通量测序技术,该技术能够较准确地定性和定量分析微生物的多样性和丰度,有利于深入准确了解鱼菜立体种养模式下的微生物群落结构[5-7]。
目前,针对暗纹东方鲀池塘立体种养模式下系统微生物多样性的研究鲜有报道。本研究中的池塘鱼菜立体种养模式,以暗纹东方鲀Takifugu obscures为主养品种,套养对虾,同时在养殖水面上栽种蕹菜Ipomoea aquatica Forsk。该模式利用水培植物蕹菜吸收养分,提高水体利用率,减少污染物的排放;此外,暗纹东方鲀主要生活在水体的中下层,凡纳滨对虾Litopenaeus vanname主要生活在底层,这使得该系统形成了菜—鲀—虾的上—中—下3层结构,充分利用了水体空间。暗纹东方鲀属凶猛肉食性鱼类,会捕食凡纳滨对虾。凡纳滨对虾面对捕食会采取防御手段,包括潜底、隐蔽或连续弹跳,在这样的生存环境下,体质健壮的对虾个体才能够适应并生存下来,而体弱及患病对虾个体就会被暗纹东方鲀吞食而淘汰,从而达到生态防病的目的。由于暗纹东方鲀对水质要求较高,残饵等容易导致水质变差,而凡纳滨对虾为底栖杂食性甲壳类动物,在减少投喂虾料的条件下可摄食暗纹东方鲀的剩料、有机碎屑及浮游动植物,起到“清道夫”的作用,有效防止饵料腐败变质。本研究中,对池塘鱼菜立体种养模式下的水体、底泥、蕹菜根际与根表、暗纹东方鲀与凡纳滨对虾肠道微生物的16S rRNA V3~V4区进行了高通量测序,分析了系统不同组成的微生物群落结构及差异,以期为池塘鱼菜立体种养系统微生物的研究提供数据参考。
1 材料与方法
1.1 材料
池塘鱼菜立体种养系统(鲀—虾—菜)养殖试验于2019年4月在上海市水产研究所奉贤科研基地池塘进行,试验设置3个池塘,每个池塘养殖面积为0.17 hm2。试验用暗纹东方鲀源自奉贤科研基地,凡纳滨对虾购自海南如意来水产养殖有限公司,蕹菜购自上海玫瑰园商贸城。暗纹东方鲀放养规格约150 g,放养密度为1.194万尾/hm2,合计每个池塘投放2 000尾;凡纳滨对虾放养规格为0.6 ~1.0 cm,放养密度为253.9万尾/hm2,合计每个池塘投放2.85万尾;每个池塘蕹菜栽种量为12 kg,养殖周期为5个月。
1.2 方法
1.2.1 样品采集 于养殖试验末期(8—9月)分批采集试验样品,采集3个鱼菜立体种养池塘的水体(MW1~MW3)、底泥(MS1~MS3)、蕹菜根际(RM1~RM3)、蕹菜根表(MRS1~MRS3)、暗纹东方鲀肠道内容物(MIP1~MIP3)和凡纳滨对虾肠道内容物(MIS1~MIS3),共计18个样品,具体采集方法如下。
水体与底泥:采样时池塘水温为(27±1)℃,pH为 8.14±0.17,水体和底泥样品的采集采用5点采样法。利用采水器采集离水面50 cm处的水样200 mL,混合后用装有0.22 μm微孔滤膜的真空抽滤装置进行抽滤,取出滤膜于灭菌离心管中,于-80 ℃下保存待测,即为水体样品。利用柱状采泥器采集1~5 cm的池塘表层底泥(100 mL),混合后置于灭菌离心管中,于-80 ℃下保存待用,即为底泥样品。
蕹菜根际及根表:将根系表面附着的大块泥去掉后,加入无菌PBS缓冲液,反复洗涤并经3 200×g离心15 min后,得到沉淀,即为根际样品。将反复洗涤后的蕹菜根系浸没于无菌PBS溶液中,以180 r/min孵育20 min,反复进行4次后,汇总洗涤液,用装有0.22 μm微孔滤膜的真空抽滤装置进行抽滤,收集滤膜于灭菌离心管中,-80 ℃下保存待测,即为根表样品。
肠道内容物:随机从每个池塘中采集5尾暗纹东方鲀,鱼体规格为(242.65±42.34)g,将暗纹东方鲀无菌解剖后取出整个肠道,将肠道内容物挤出,使用少量PBS缓冲液冲洗肠道内壁,收集肠道内容物样品于灭菌离心管中,并将5尾鱼肠道内容物混匀成一个样品,即为鲀肠道内容物样品。随机从每个池塘中采集10只凡纳滨对虾,虾体规格为(20.04±3.62)g,将凡纳滨对虾进行无菌解剖后取出整个肠道,将肠道内容物挤出,同一池塘10只虾的肠道内容物混均成一个样品,即为虾肠道内容物样品。
1.2.2 DNA 抽提和PCR扩增 根据DNA提取试剂盒(FastDNA®SPIN Kit) (MP Biomedicals, U.S.)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop 2000进行检测,利用10 g/L琼脂糖凝胶电泳检测DNA提取质量。用338F (5′ACTCCTACGGGAGGCAGCAG 3′)和806R (5′GGACTACHVGGGTWTCTAAT 3′) 引物对细菌16S rRNA 基因V3~V4可变区进行PCR扩增。扩增程序:95 ℃下预变性180 s;95 ℃下循环变性30 s,55 ℃下退火复性30 s,72 ℃下延伸30 s,共进行27个循环;最后在72 ℃下再延伸 10 min。扩增体系(共20 μL):5×FastPfu 缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,引物338F、806R各0.8 μL,FastPfu 聚合酶0.4 μL,DNA模板10 ng,用ddH2O 补足至20 μL。
1.2.3 Illumina MiSeq 测序 采用20 g/L琼脂糖凝胶回收PCR产物,再用AxyPrep DNA 凝胶回收试剂盒(Axygen) 进行纯化。采用QuantiFluorTM-ST (Promega) 进行检测定量。根据Illumina MiSeq 平台标准操作规程将扩增片段构建测序文库后,用Illumina公司的MiSeq PE300平台进行高通量测序(上海美吉生物医药科技有限公司)。
1.3 数据处理
原始测序序列使用Trimmomatic软件质控,并用FLASH软件进行拼接;采用UPARSE(version 7.1 http://drive5.com/uparse/)软件对数据进行处理,根据97%相似度水平对序列进行OTU聚类;采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,比对Silva数据库在不同分类学水平上统计各样本的群落组成;采用Mothur软件计算Alpha多样性指数,包括群落丰富度指数(Chao1指数、ACE指数)和群落多样性指数(香农指数Shannon、辛普森指数Simpson)。
采用T检验法进行样本多样性指数的显著性差异分析(P<0.05);利用R语言工具制作物种组成分析群落柱形图和样本比较分析的主坐标分析(PCoA)图等。
2 结果与分析
2.1 16S rRNA基因测序特点
6组18个样本的平均序列数为66 390条,97%相似度水平下分类操作单元(operational taxonomic units, OTUs)数为9 082。从表1可见:池塘鱼菜立体种养模式下不同样本的OTU数为512~4 013;群落丰富度指数中,Chao1指数为761.71~5 474.29,ACE指数为986.94~5 687.55;群落多样性指数中,Shannon指数为1.69~6.55,Simpson指数为 0.01~0.34;所有样本的物种覆盖率均大于96.05%。这表明,本次测序基本上代表了样本中微生物的真实情况。
样本中细菌的丰富度总体上排序为底泥>蕹菜根际>蕹菜根表≈虾肠道>水体>鲀肠道;样本中细菌的多样性排序为底泥>蕹菜根际>蕹菜根表>水体>虾肠道>鲀肠道;底泥中微生物的Chao1指数、ACE指数和Shannon指数明显大于其他组,而Simpson指数则小于其他组,暗纹东方鲀肠道中微生物的Chao1、ACE指数和Shannon指数最小,而Simpson指数则大于其他组(表1)。
表1 在97%相似度水平上样品中细菌的丰富度和多样性指数
Tab.1 Richness and diversity indices relative to bacteria in samples at 97% similarity level
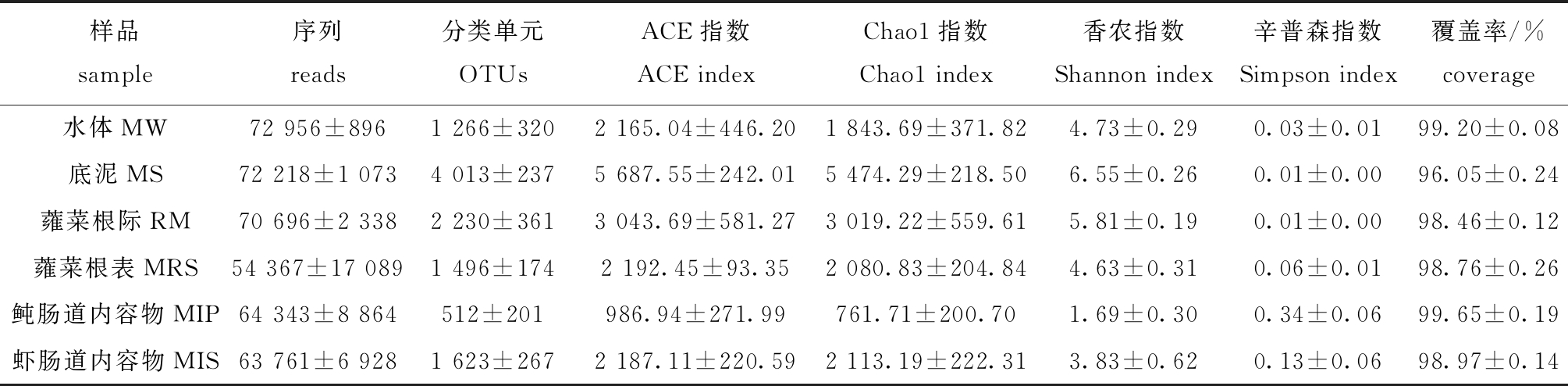
样品sample序列reads分类单元OTUsACE指数ACE indexChao1指数Chao1 index香农指数Shannon index辛普森指数Simpson index覆盖率/%coverage水体MW72 956±8961 266±3202 165.04±446.201 843.69±371.824.73±0.290.03±0.0199.20±0.08底泥MS72 218±1 0734 013±2375 687.55±242.015 474.29±218.506.55±0.260.01±0.0096.05±0.24蕹菜根际RM70 696±2 3382 230±3613 043.69±581.273 019.22±559.615.81±0.190.01±0.0098.46±0.12蕹菜根表MRS54 367±17 0891 496±1742 192.45±93.352 080.83±204.844.63±0.310.06±0.0198.76±0.26鲀肠道内容物MIP64 343±8 864512±201986.94±271.99761.71±200.701.69±0.300.34±0.0699.65±0.19虾肠道内容物MIS63 761±6 9281 623±2672 187.11±220.592 113.19±222.313.83±0.620.13±0.0698.97±0.14
2.2 微生物群落整体结构
池塘鱼菜立体种养系统的6组样品细菌分布于62个门,其中12个门的丰度大于1%,即变形菌门Proteobacteria、放线菌门Actinobacteria、蓝细菌门Cyanobacteria、拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、Epsilonbacteraeota、绿弯菌门Chloroflexi、软壁菌门Tenericutes、螺旋体门Spirochaetes、疣微菌门Verrucomicrobia、酸杆菌门Acidobacteria和浮霉状菌门Planctomycetes的占比分别为27.71%、16.37%、16.05%、10.07%、8.29%、5.30%、2.72%、2.52%、2.25%、2.04%、1.92%和1.25%,其他占3.50%。
池塘鱼菜立体种养系统的6组样品细菌分布于1 503个属,其中19个属的丰度大于1%。在属水平上,不同样品组优势细菌(丰度大于5%的菌属)的组成及丰度存在明显不同,主要优势菌属红球菌属Rhodococcus、葡萄球菌属Staphylococcus、弓形菌属Arcobacter、norank_f_norank_o_Chloroplast、norank_f_Nostocaceae、红杆菌属Rhodobacter、HgcI_clade、短螺旋体菌属Brevinema、盖丝藻属Geitlerinema_PCC-7105、CL500-29_marine_group、Elizabethkingia、norank_f_Steroidobacteracea、Candidatus_Bacilloplasma、拟浮丝藻属Planktothricoides_SR001、浮丝藻属Planktothrix_NIVA-CYA_15、支原体属Mycoplasma、norank_f_Saprospiraceae、Alkalinema_CENA528和unclassified_f_Burkholderiaceae占比分别为6.91%、5.94%、5.20%、3.88%、3.10%、2.51%、2.29%、1.96%、1.91%、1.79%、1.76%、1.40%、1.31%、1.29%、1.16%、1.09%、1.05%、1.03%、1.02%,其他占53.39%。
2.3 细菌群落组成差异
池塘鱼菜立体种养系统下门水平的细菌分布如图1所示,不同样品组的优势菌门(丰度大于10%的菌门)有所不同。水体的优势菌门为放线菌门(36.19%)、变形菌门(26.38%)、蓝细菌门(12.23%)和拟杆菌门(12.06%);底泥的优势菌门为变形菌门(50.73%)和拟杆菌门(12.49%);蕹菜根际的优势菌门为变形菌门(50.15%)、蓝细菌门(17.21%)和拟杆菌门(15.22%);蕹菜根表的优势菌门为蓝细菌门(44.30%)、变形菌门(28.94%)和拟杆菌门(10.74%);暗纹东方鲀肠道的优势菌门为厚壁菌门(32.41%)、Epsilonbacteraeota(25.36%)、蓝细菌门(13.54%)和拟杆菌门(10.01%);凡纳滨对虾肠道的优势菌门为放线菌门(46.66%)和变形菌门(21.92%)。
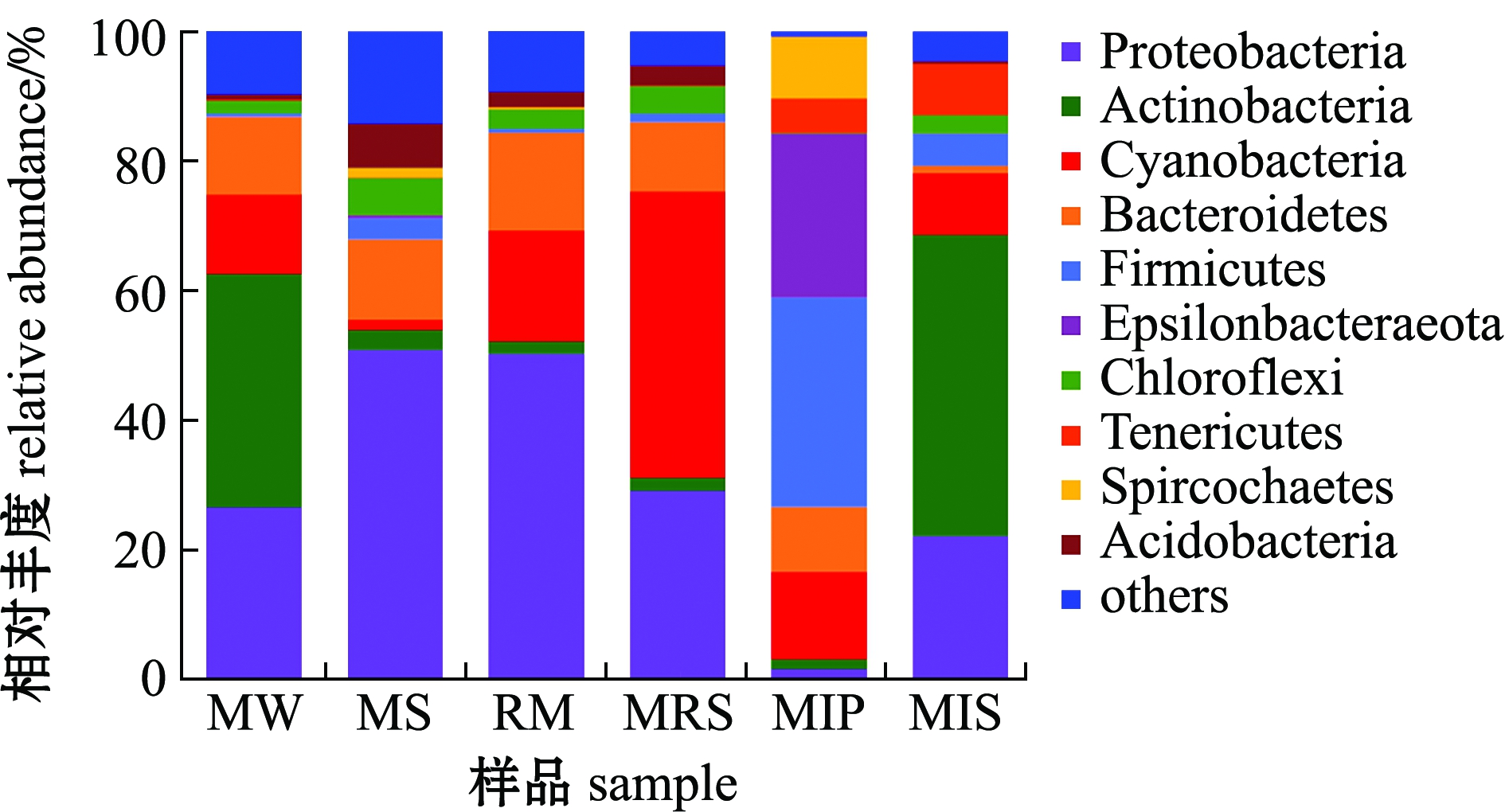
图1 基于门水平的细菌群落组成
Fig.1 Microbiota composition at phylum level
主坐标分析结果如图2所示,其中,PCoA分析获得主成分PC1的方差贡献率为23.85%,主成分PC2的方差贡献率为17.58%。每组3个样品间距离较近,这表明这些样品的微生物群落组成较为相似。水体、底泥、蕹菜根际、蕹菜根表、暗纹东方鲀肠道和凡纳滨对虾肠道微生物群落各自分开,微生物群落分布不同。
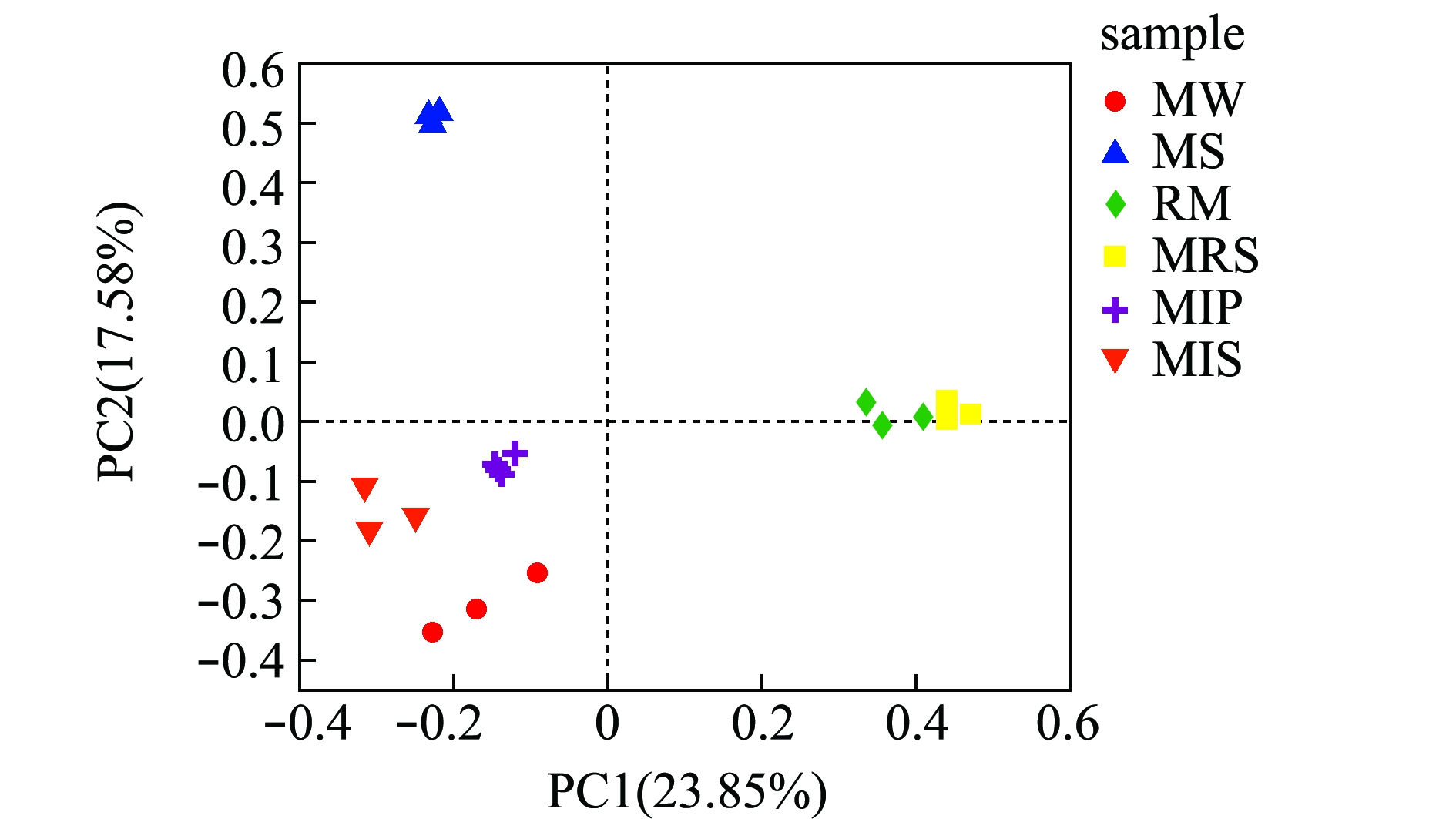
图2 主坐标分析结果
Fig.2 Result of principal co-ordinate analysis (PCoA)
池塘鱼菜立体种养系统下属水平的细菌分布如图3所示,不同样品组的优势菌属有所不同。水体的主要优势菌属为hgcI_clade (12.11%)、CL500-29_marine_group (8.76%)、拟浮丝藻属Planktothricoides_SR001(6.51%)和热红球菌属(5.80%);底泥的主要优势菌属为硫杆菌属Thiobacillus (7.48%)和norank_f_Steroidobacteraceae (7.39%);蕹菜根际的主要优势菌属为红杆菌属(8.89%)、湖丝蓝细菌属Limnothrix(3.72%)、黄杆菌属Flavobacterium(2.14%)和氢噬胞菌属Hydrogenophaga(1.65%);蕹菜根表面的主要优势菌属为norank_f_Nostocaceae(18.63%)、盖丝藻属_PCC-7015 Geitlerinema_PCC-7105(10.15%)、Alkalinema_CENA528 (5.98%)和红杆菌属(4.27%);暗纹东方鲀肠道的主要优势菌属为葡萄球菌属 (28.93%)、弓形菌属 (25.36%)、norank_f_norank_o_Chloroplast (13.31%)、短螺旋体菌属 (9.56%)和Elizabethkingia (8.56%)和支原体属(5.32%);凡纳滨对虾肠道的主要优势菌属为红球菌属 (32.64%)、Candidatus_Bacilloplasma (7.32%)、浮丝藻属Planktothrix_NIVA-CYA_15 (6.15%)、Timonella(5.56%)、LD29 (2.17%)、norank_f_Rhizobiales_Incertae_Sedis(2.13%)和微小杆菌属Exiguobacterium (1.93%)。
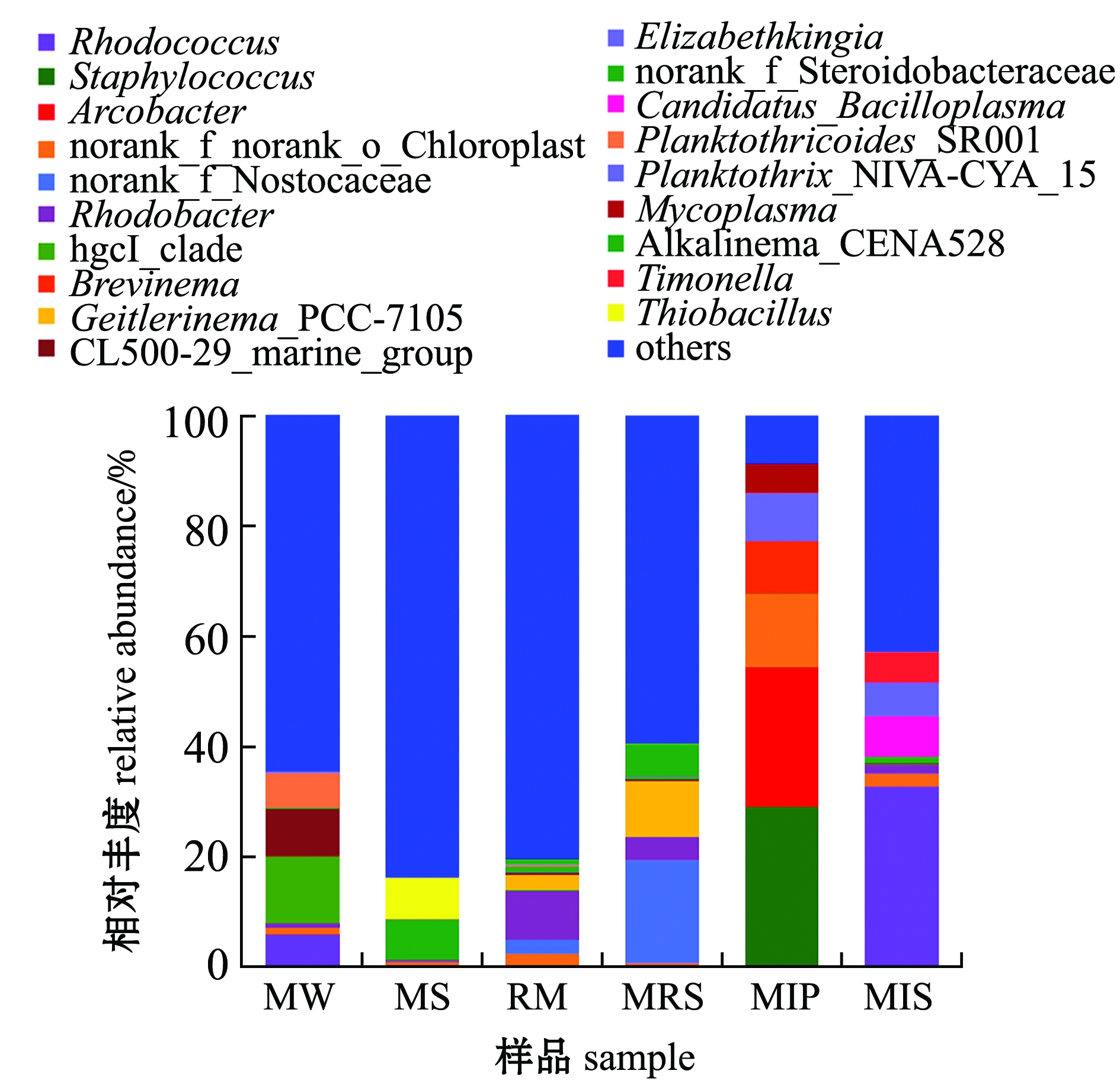
图3 基于属水平的细菌群落组成
Fig.3 Microbiota composition at genus level
2.4 池塘鱼菜立体种养系统中主要功能菌群分布
从表2可见:池塘鱼菜立体种养系统中,参与氮循环的有益菌主要包括硝化细菌、反硝化细菌及固氮菌,其中,硝化细菌总体相对丰度排序为蕹菜根表>蕹菜根际>底泥>凡纳滨对虾肠道≈暗纹东方鲀肠道≈水体,蕹菜根表的硝化细菌丰富度显著高于水体、鲀和虾肠道(P<0.05),其他各组间无显著性差异(P>0.05);反硝化细菌总体相对丰度排序为蕹菜根际>蕹菜根表>凡纳滨对虾肠道>水体>底泥>暗纹东方鲀肠道,蕹菜根际的反硝化细菌显著高于其他各组(P<0.05),其他各组间无显著性差异(P>0.05);固氮菌总体相对丰度排序为水体>蕹菜根际>蕹菜根表>凡纳滨对虾肠道>底泥≈暗纹东方鲀肠道,水体固氮菌相对丰度与蕹菜根际无显著性差异(P>0.05),但均显著高于蕹菜根表、虾肠道、底泥和鲀肠道(P<0.05);底泥中参与硫循环的硫杆菌Thiobacillus相对丰度显著高于其他各组(P<0.05),水体中可有效利用多种碳水化合物的有益菌属hgcI_clade和CL500-29_marine_group显著高于其他各组(P<0.05),凡纳滨对虾肠道中具有生物降解作用的红球菌属Rhodococcus相对丰度显著高于其他各组(P<0.05)。
表2 池塘鱼菜立体种养系统中有益菌属的相对丰度
Tab.2 Relative abundance of beneficial bacterial genera in the pond three-dimensional cultivation system
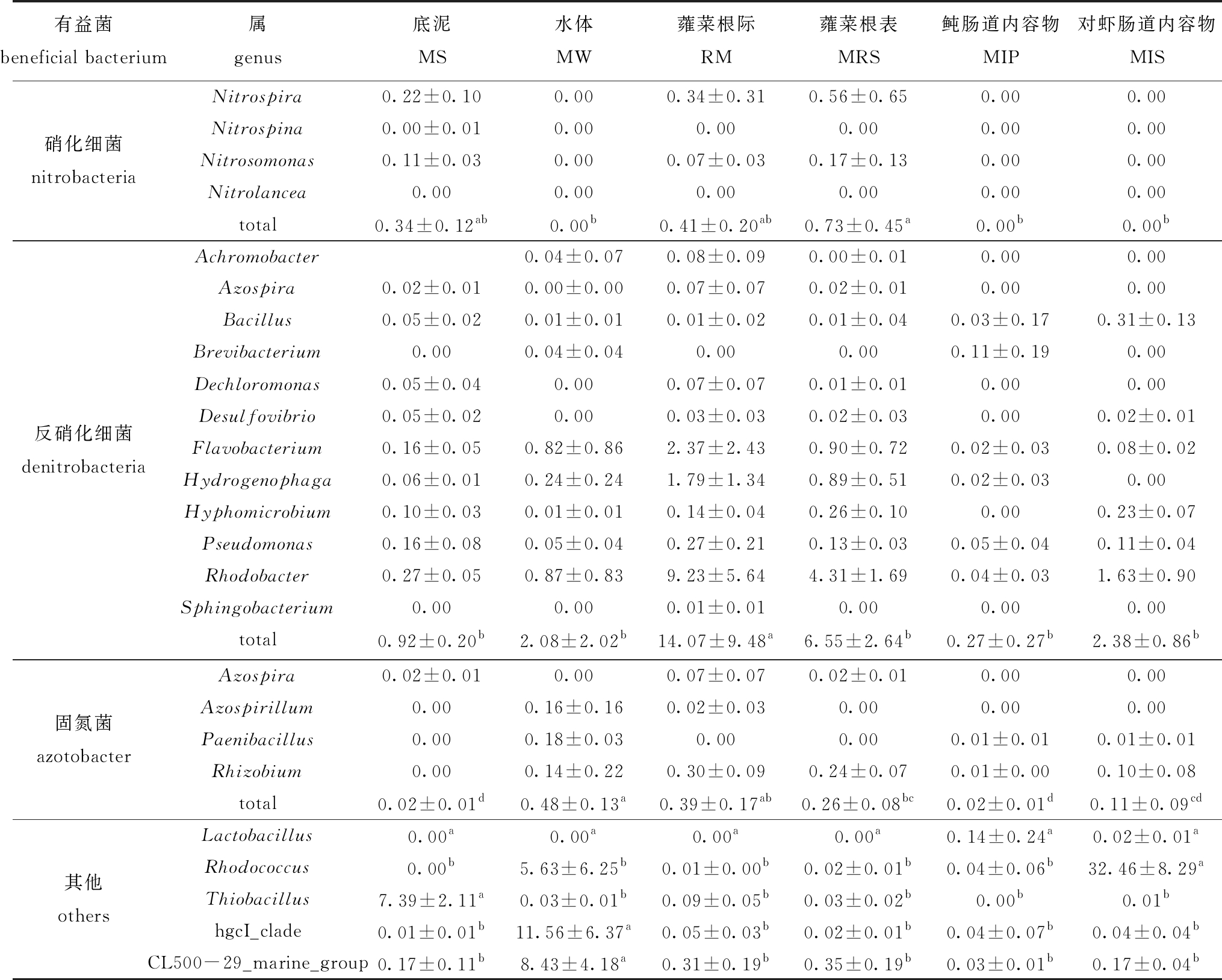
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same line are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same line are not significant differences.
有益菌beneficial bacterium属genus底泥MS水体MW蕹菜根际RM蕹菜根表MRS鲀肠道内容物MIP对虾肠道内容物MIS硝化细菌nitrobacteriaNitrospira0.22±0.100.000.34±0.310.56±0.650.000.00Nitrospina0.00±0.010.000.000.000.000.00Nitrosomonas0.11±0.030.000.07±0.030.17±0.130.000.00Nitrolancea0.000.000.000.000.000.00total0.34±0.12ab0.00b0.41±0.20ab0.73±0.45a0.00b0.00b反硝化细菌denitrobacteriaAchromobacter0.04±0.070.08±0.090.00±0.010.000.00Azospira0.02±0.010.00±0.000.07±0.070.02±0.010.000.00Bacillus0.05±0.020.01±0.010.01±0.020.01±0.040.03±0.170.31±0.13Brevibacterium0.000.04±0.040.000.000.11±0.190.00Dechloromonas0.05±0.040.000.07±0.070.01±0.010.000.00Desulfovibrio0.05±0.020.000.03±0.030.02±0.030.000.02±0.01Flavobacterium0.16±0.050.82±0.862.37±2.430.90±0.720.02±0.030.08±0.02Hydrogenophaga0.06±0.010.24±0.241.79±1.340.89±0.510.02±0.030.00Hyphomicrobium0.10±0.030.01±0.010.14±0.040.26±0.100.000.23±0.07Pseudomonas0.16±0.080.05±0.040.27±0.210.13±0.030.05±0.040.11±0.04Rhodobacter0.27±0.050.87±0.839.23±5.644.31±1.690.04±0.031.63±0.90Sphingobacterium0.000.000.01±0.010.000.000.00total0.92±0.20b2.08±2.02b14.07±9.48a6.55±2.64b0.27±0.27b2.38±0.86b固氮菌azotobacterAzospira0.02±0.010.000.07±0.070.02±0.010.000.00Azospirillum0.000.16±0.160.02±0.030.000.000.00Paenibacillus0.000.18±0.030.000.000.01±0.010.01±0.01Rhizobium0.000.14±0.220.30±0.090.24±0.070.01±0.000.10±0.08total0.02±0.01d0.48±0.13a0.39±0.17ab0.26±0.08bc0.02±0.01d0.11±0.09cd其他othersLactobacillus0.00a0.00a0.00a0.00a0.14±0.24a0.02±0.01aRhodococcus0.00b5.63±6.25b0.01±0.00b0.02±0.01b0.04±0.06b32.46±8.29aThiobacillus7.39±2.11a0.03±0.01b0.09±0.05b0.03±0.02b0.00b0.01bhgcI_clade0.01±0.01b11.56±6.37a0.05±0.03b0.02±0.01b0.04±0.07b0.04±0.04bCL500-29_marine_group0.17±0.11b8.43±4.18a0.31±0.19b0.35±0.19b0.03±0.01b0.17±0.04b
3 讨论
3.1 鱼菜共生系统不同组成的微生物群落结构差异
池塘鱼菜立体种养系统中的水体、底泥、蕹菜根系中的微生物群落在维持该系统的生态平衡中发挥了不同的作用。底泥是水体长期积存的沉积物,是水体的重要组成部分之一,水体底泥中含有的动植物残骸、有机物、金属物质等,以及复杂的好氧厌氧环境,为微生物的生长和活动提供了环境条件,使得水体底泥中蕴藏着大量的细菌和古菌[7]。本研究中发现,底泥中的微生物丰富度和多样性最高,这与底泥自身性质有关。水体是水产动物赖以生存的环境,水环境的稳定性与微生物的多样性密切相关,当水体微生物多样性下降时,就会增加养殖病害暴发的风险[8]。本研究中发现,水体的丰富度和多样性低于底泥和蕹菜根际及根表,这可能与养殖过程中换水有关。植物的健康与土壤微生物多样性有关[9],植物根际是植物与微生物互作的重要生境场所,是一个复杂的微生态系统。根际微生物群落被认为是土壤微生物群落中的一个子系统[10]。方敏等[10]研究发现,马缨杜鹃根系依次从根际、根表、根内,细菌α-多样性显著下降。本研究结果与之类似,蕹菜根际微生物的丰富度和多样性均高于根表。水产动物肠道微生物群落结构主要由宿主自身及外界生长环境因素等决定[11-12]。本研究中虾肠道微生物的丰富度和多样性均高于鲀肠道,这可能与二者的食性差异有关。综上可知,不同的组成(底泥、水体、蕹菜根际与根表、养殖对象肠道)之间微生物群落结构存在较大差异。
3.2 鱼菜共生系统不同组成的优势细菌群落
在淡水水体及底泥中,α-变形菌门和放线菌门分布最为广泛[13],除此之外,Zwart 等[14]发现,蓝细菌门和拟杆菌门也是不同淡水环境(湖泊和河流)常见的优势菌门。变形菌门和放线菌门同样也是植物根际微生物群落的主要优势菌门[10,15]。李建柱等[16]研究发现,鱼菜共生模式下蕹菜根系微生物群落的优势菌门为变形菌门和蓝细菌门,这与本研究结果一致,而养殖水生动物肠道微生物优势菌群有所不同。李建柱等[17]研究发现,鱼菜共生模式下草鱼、鲢、鳙和鲫肠道内容物的优势菌门为梭杆菌门、拟杆菌门、厚壁菌门、放线菌门和变形菌门等。本研究中,暗纹东方鲀肠道的优势菌门为厚壁菌门、Epsilonbacteraeota、蓝细菌门和拟杆菌门,凡纳滨对虾肠道优势菌门为放线菌门和变形菌门,这可能与养殖对象自身及环境的差异有关。
池塘鱼菜立体种养系统水体的主要优势菌属中包含有可能有效利用多种碳水化合物的有益菌属hgcI_clade和 CL500-29_marine_group[18-19],而可能引起水华的Planktothricoides_SR001[20]相对丰度较低。硫杆菌属细菌可用来滤除污水污泥及河流沉积物中重金属[21]。底泥中的硫杆菌属性相对丰度较高,可促进系统硫元素循环,减少重金属的富集,其氧化作用还可为植物提供可利用的硫酸态硫素营养。植物根系微生物在鱼菜共生系统中发挥了重要作用,根际微生物主要生活在外界的土壤环境中,将无机物转化为有机物,为植物生长提供养料。根表微生物主要生活在根系的表面,可形成厚密的套膜,保护内部的根系,抵御病原物入侵。本研究中,蕹菜根际主要优势菌属为红杆菌属、湖丝蓝细菌属、黄杆菌属和氢噬胞菌属,蕹菜根表的主要优势菌属为norank_f_Nostocaceae、盖丝藻属_PCC-7105、Alkalinema_CENA528和红杆菌属。红杆菌属是可高效净化水质,兼具反硝化作用的一类光合细菌[22],其在生物膜形成过程中发挥关键作用[23]。氢噬胞菌属是一类反硝化细菌。黄杆菌在有机污染物的分解代谢中起着重要的作用[24]。表明池塘鱼菜立体种养系统中蕹菜根系有益菌的分布,有利于充分利用水体养分,净化水质。
本研究中,池塘鱼菜立体种养系统中的凡纳滨对虾肠道微生物以红球菌属为主。红球菌还具有较强的生物降解去污能力,多项研究显示,从红球菌属中分离出高效的苯酚降解菌株[25-26],此外,有些红球菌种是人和动物的致病菌[27]。而暗纹东方鲀肠道的主要优势菌属为葡萄球菌属、弓形菌属、norank_f_norank_o_Chloroplast、短螺旋体菌属、Elizabethkingia和支原体属。其中,葡萄球菌属属于反硝化细菌,多数为非致病菌,少数可导致疾病;弓形杆菌是一种人畜共患的食源性和水源性病原菌[28];短螺旋体菌属主要会感染猪肠道导致腹泻[29],而对鱼体的影响尚不清楚;Elizabethkingia属多为致病菌,可威胁人类生命,尤其是免疫缺陷的患者[30]。凡纳滨对虾生活在水体的底部,主要清理残饵及鱼粪,而暗纹东方鲀生活在水体中间区域,会捕食少量病虾。本研究中的养殖对象肠道中既有有益菌也有致病菌属,这可能与不同动物的生活习性有关。
3.3 鱼菜共生系统不同组成的主要功能菌群分布
养殖废水中主要含有磷和氮,在鱼菜共生系统中要将水产养殖过程中剩余的这些无机或有机物废物转化为植物可利用的营养素,则依赖于各种微生物群,其中,硝化细菌发挥着关键作用,营养物质通过微生物硝化和反硝化转化被植物同化[31]。此外,氨氮的转化也离不开亚硝化细菌。亚硝化细菌广泛分布于土壤、淡水和海水中,但实际上它在自然环境的整个细菌种群中仅占很少的一部分。无论是水体底泥中的微生物还是植物根际的微生物,在鱼菜共生系统的物质转化和循环中均发挥了重要作用[32]。本研究中发现,硝化细菌、反硝化细菌及固氮菌等分布在池塘鱼菜立体种养系统的各个部分,但相对丰度有所差异。硝化细菌主要分布于蕹菜的根际与表面、底泥,反硝化细菌主要分别于蕹菜的根际,固氮菌主要分布于水体、蕹菜根际与表面。由此可见,养殖系统中的水生植物在氮循环中发挥了重要作用,在池塘鱼菜立体种养系统中添加微生物制剂对微生物群落结构的影响及养殖作用效果有待进一步研究。
4 结论
1) 池塘鱼菜立体种养系统中不同组成的微生物群落分布有所不同。水体的优势菌门为放线菌门和变形菌门,底泥的优势菌门为变形菌门和拟杆菌门,蕹菜根际及根表的优势菌门为变形菌门和蓝细菌门,而暗纹东方鲀肠道则以厚壁菌门为主,凡纳滨对虾肠道以放线菌门和变形菌门为主。
2) 池塘鱼菜立体种养系统中的功能性细菌分布略有不同。系统中的硝化细菌在蕹菜根表相对丰度显著高于其他各组,蕹菜根际的反硝化细菌相对丰度显著高于其他各组,水体和蕹菜根际固氮菌的相对丰度显著高于虾肠道、底泥和鲀肠道。
3) 养殖对象肠道中既有有益菌也有致病菌属,池塘鱼菜立体种养系统应加强病害防控工作,确保水产动物健康生长。
[1] CAO L,WANG W M,YANG L,et al.Environmental impact of aquaculture and countermeasures to aquaculture pollution in China[J].Environmental Science and Pollution Research - International,2007,14(7):452-462.
[2] 宋红桥,管崇武.鱼菜共生综合生产系统的研究进展[J].安徽农学通报,2018,24(20):63-65.
[3] TYSON R V,TREADWELL D D,SIMONNE E H.Opportunities and challenges to sustainability in aquaponic systems[J].HortTechnology,2011,21(1):6-13.
[4] LOGARES R,HAVERKAMP T H A,KUMAR S,et al.Environmental microbiology through the lens of high-throughput DNA sequencing:synopsis of current platforms and bioinformatics approaches[J].Journal of Microbiological Methods,2012,91(1):106-113.
[5] XU W J,XU Y,HUANG X S,et al.Addition of algicidal bacterium czbc1 and molasses to inhibit cyanobacteria and improve microbial communities,water quality and shrimp performance in culture systems[J].Aquaculture,2019,502:303-311.
[6] FAN L F,WANG Z L,CHEN M S,et al.Microbiota comparison of Pacific white shrimp intestine and sediment at freshwater and marine cultured environment[J].Science of the Total Environment,2019,657:1194-1204.
[7] ORCUTT B N,SYLVAN J B,KNAB N J,et al.Microbial ecology of the dark ocean above,at,and below the seafloor[J].Microbiology and Molecular Biology Reviews,2011,75(2):361-422.
[8] 裘琼芬,张德民,叶仙森,等.象山港网箱养殖对近海沉积物细菌群落的影响[J].生态学报,2013,33(2):483-491.
[9] YANG H W,LI J,XIAO Y H,et al.An integrated insight into the relationship between soil microbial community and tobacco bacterial wilt disease[J].Frontiers in Microbiology,2017,8:2179.
[10] 方敏,徐小蓉,唐明,等.马缨杜鹃根系微生物群落结构及其变化[J].微生物学报,2019,59(8):1522-1534.
[11] BENSON A K,KELLY S A,LEGGE R,et al.Individuality in gut microbiota composition is a complex polygenic trait shaped by multiple environmental and host genetic factors[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(44):18933-18938.
[12] 祭仲石,管卫兵,苏孙国,等.鲢、鳙肠道微生物的研究[J].大连海洋大学学报,2014,29(1):22-26.
[13] EILER A,BERTILSSON S.Composition of freshwater bacterial communities associated with cyanobacterial blooms in four Swedish lakes[J].Environmental Microbiology,2004,6(12):1228-1243.
[14] ZWART G,CRUMP B C,AGTERVELD M P K V,et al.Typical freshwater bacteria:an analysis of available 16S rRNA gene sequences from plankton of lakes and rivers[J].Aquatic Microbial Ecology,2002,28(2):141-155.
[15] NOVELLO G,GAMALERO E,BONA E,et al.The rhizosphere bacterial microbiota of Vitis vinifera cv.pinot noir in an integrated pest management vineyard[J].Frontiers in Microbiology,2017,8:1528.
[16] 李建柱,侯杰,张鹏飞,等.空心菜浮床对鱼塘水质和微生物多样性的影响[J].中国环境科学,2016,36(10):3071-3080.
[17] 李建柱,侯杰,张鹏飞,等.鱼菜共生模式中不同鱼类肠道微生物群落结构的比较[J].南方水产科学,2016,12(6):42-50.
[18] GHYLIN T W,GARCIA S L,MOYA F,et al.Comparative single-cell genomics reveals potential ecological niches for the freshwater acI Actinobacteria lineage[J].The ISME Journal,2014,8(12):2503-2516.
[19] LINDH M V,RIEMANN L,BALTAR F,et al.Consequences of increased temperature and acidification on bacterioplankton community composition during a mesocosm spring bloom in the Baltic Sea[J].Environmental Microbiology Reports,2013,5(2):252-262.
[20] 吴忠兴,余博识,彭欣,等.中国水华蓝藻的新记录属——拟浮丝藻属(Planktothricoides)[J].武汉植物学研究,2008,26(5):461-465.
[21] 高杰.微生物在污泥无害化处理中的应用[J].绿色科技,2018(10):117-118.
[22] 郑耀通,胡开辉,高树芳,等.高效净化水产养殖水域紫色非硫光合细菌的分离和筛选[J].福建农业大学学报,1998,27(3):342-346.
[23] ELIFANTZ H,HORN G,AYON M,et al.Rhodobacteraceae are the key members of the microbial community of the initial biofilm formed in Eastern Mediterranean coastal seawater[J].FEMS microbiology Ecology,2013,85(2):348-357.
[24] 李科德,胡正嘉.芦苇床系统净化污水的机理[J].中国环境科学,1995,15(2):140-144.
[25] 苏琼,江子骏.高效苯酚降解菌的筛选及其降解特性分析[J].湖北大学学报(自然科学版),2019,41(6):567-571.
[26] 沈锡辉,刘志培,王保军,等.苯酚降解菌红球菌PNAN5菌株(Rhodococcus sp.strain PNAN5)的分离鉴定、降解特性及其开环双加氧酶性质研究[J].环境科学学报,2004,24(3):482-486.
[27] 华苟根,郭坚华.红球菌属的分类及应用研究进展[J].微生物学通报,2003,30(4):107-111.
[28] 毕水莲,孟赫诚.致病性弓形杆菌属生物学特性及诊断研究进展[J].现代食品科技,2013,29(1):211-214.
[29] BURROUGH E R,刘河冰.猪痢疾发病机理及诊断技术研究进展[J].中国猪业,2018,13(5):41-43,46.
[30] LIN J N,LAI C H,YANG C H,et al.Elizabethkingia infections in humans:from genomics to clinics[J].Microorganisms,2019,7(9):295.
[31] ZOU Y A,HU Z,ZHANG J,et al.Effects of pH on nitrogen transformations in media-based aquaponics[J].Bioresource Technology,2016,210:81-87.
[32] DUINEVELD B M,KOWALCHUK G A,KEIJZER A,et al.Analysis of bacterial communities in the rhizosphere of Chrysanthemum via denaturing gradient gel electrophoresis of PCR-amplified 16S rRNA as well as DNA fragments coding for 16S rRNA[J].Applied and Environmental Microbiology,2001,67(1):172-178.