睡眠是人体的主动生理过程,可以恢复精神和解除疲劳。失眠是指难以入睡、夜间易醒及睡眠质量差等睡眠障碍问题[1],失眠对日间工作与生活影响较大,失眠会带来身体免疫力下降、神经功能紊乱、记忆力减退等不良影响[2]。目前,治疗失眠多以服用处方药物为主,然而服用药物常伴随过量、依赖性及耐药性等弊端[3],因此,急需开发天然功能活性物质用于改善睡眠。
牡蛎广泛分布于中国广东、广西等海域,属于中国主要经济贝类和四大养殖贝类之一,同时也是第一批纳入药食同源的食物,富含维生素、蛋白质等多种营养物质[4]。酶水解是从蛋白质来源获得生物活性肽的有效方法[5],研究表明,牡蛎的酶解产物具有免疫[6-7]、抗氧化[8]、创伤愈合[9-10]、抗疲劳[11]、改善学习记忆[12]、抗血栓[13]和抑菌[14]等功能活性,然而关于牡蛎改善睡眠的研究鲜有报道。牡蛎含有丰富的谷氨酸[15],有助于促进γ-氨基丁酸的合成,同时,其具有较好的抗氧化能力,可以清除多余的氧自由基,对脑神经具有保护作用[16]。牡蛎还含有丰富的牛磺酸,这是一种γ-氨基丁酸受体激动剂,有助于促进睡眠[17]。此外,牡蛎中有含量丰富的金属元素锌,其可以作为膳食补充剂从而改善睡眠[18],这为开展改善睡眠研究提供了营养及理论基础。本试验中,采用动物蛋白酶对香港牡蛎Crassostrea hongkongensis进行酶解,探究了牡蛎酶解产物(enzymatic products of oysters, EPO)对小鼠睡眠的影响,并初步探讨了牡蛎酶解产物对睡眠的调节机制,以期为后续研究与产品开发提供参考依据。
1 材料与方法
1.1 材料
试验用新鲜香港牡蛎购自广东省湛江市东风市场。
试验动物: SPF 级雄性KM小鼠200只,体质量为18~22 g(济南鹏悦试验动物繁育有限公司),试验动物生产许可证号为SCXK(鲁)2019-0003,试验动物使用许可证编号为SYXK(粤)2019-0204。
试剂: 动物蛋白酶(广西南宁庞博生物工程有限公司)、戊巴比妥钠(Sigma公司)、地西泮(山东信谊制药有限公司)、巴比妥钠(国药集团)、小鼠γ-氨基丁酸(GABA)ELISA 试剂盒、小鼠 5-羟色胺(5-HT)ELISA 试剂盒、小鼠褪黑素(MT)ELISA 试剂盒、小鼠多巴胺(DA)ELISA 试剂盒、小鼠去甲肾上腺素(NE)ELISA 试剂盒(江苏酶免实业有限公司)。
仪器和设备: Lynx 6000 型高速冷冻离心机、Varioskan Flash多功能酶标仪(Thermo Scientific公司)、VAPODEST450全自动凯氏定氮仪(德国Gerhardt公司)、ATY124电子天平(日本岛津株式会社)、PHS-3E型pH酸度计(上海仪电科学仪器股份有限公司)、 N-4000旋转蒸发仪(埃朗科技国际贸易(上海)有限公司)。
1.2 方法
1.2.1 牡蛎酶解产物EPO的制备 参照李婉等[19]的方法略做改进。将牡蛎肉与其3倍体积的蒸馏水进行匀浆,调节pH至7.0,加酶量为1 000 U/g,于53 ℃恒温磁力搅拌水浴锅中酶解5 h,100 ℃沸水浴灭酶10 min,酶解液冷却至室温后,4 ℃下以 8 000 r/min 离心20 min,用纱布过滤去除杂质,取上清液进行浓缩,冷冻干燥。
1.2.2 EPO基本营养成分组成测定 参照GB 5009.3—2016、GB 5009.5—2016、 GB 5009.4—2016、GB 5009.6—2016、GB/T 9695.31—2008分别测定水分、粗蛋白质、灰分、粗脂肪和总糖含量。
1.2.3 EPO氨基酸组成测定 参照GB 5009.124—2016测定氨基酸组成。
1.2.4 动物分组及处理 试验小鼠适应性喂养7 d后,随机分组,每组40只,设阴性对照组 (灌胃等体积蒸馏水)、 阳性对照组 (灌胃地西泮2 mg/kg体质量)及EPO低、中、高剂量组(分别灌胃250、500、1 000 mg/kg体质量,分别记为EPO-L、EPO-M、EPO-H)。各试验组每天灌胃一次,灌胃量为0.1 mL/10 g体质量,连续灌胃30 d。
1.2.5 直接睡眠试验 阴性对照组、EPO各剂量组末次灌胃(第30天)后,观察30 min内各组10只小鼠是否进入睡眠状态。小鼠翻正反射消失(翻正反射消失是指小鼠处于仰卧位超过10 s不能恢复背卧位)超过1 min判定小鼠进入睡眠,小鼠恢复翻正反射判定为小鼠觉醒。统计阴性对照组、EPO各剂量组小鼠入睡数量 [20]。
1.2.6 延长戊巴比妥钠睡眠时间试验 各组小鼠末次灌胃1 h后,各取10只小鼠腹腔注射戊巴比妥钠(60 mg/kg 体质量),注射量为0.1 mL/10 g体质量。翻正反射消失到恢复的时间定义为小鼠睡眠时间,比较阴性对照组、阳性对照组、EPO各剂量组小鼠睡眠的时间[20]。
1.2.7 戊巴比妥钠阈下剂量催眠试验 各组小鼠末次灌胃1 h后,各取10只小鼠腹腔注射戊巴比妥钠(30 mg/kg体质量),注射量为0.1 mL/10 g体质量。观察30 min,统计各组小鼠入睡数量并计算睡眠发生率[20],即
睡眠发生率=入睡动物数/每组动物数×100%。
1.2.8 巴比妥钠潜伏期试验 各组小鼠末次灌胃1 h后,各取10只小鼠腹腔注射巴比妥钠(300 mg/kg 体质量),注射量为 0.1 mL/10 g体质量。注射巴比妥钠到翻正反射消失的时间定义为睡眠潜伏期,比较阴性对照组、阳性对照组、EPO各剂量组小鼠睡眠潜伏期[20]。
1.2.9 神经递质水平测定
1)脑组织匀浆液制备。各组小鼠末次灌胃1 h后,各取5只小鼠解剖,于冰上快速取其下丘脑、大脑皮层,称重后分别与匀浆液PBS按照体积比为1∶9进行匀浆,4 ℃下以3 000 r/min 离心20 min,取上清液,测定5-羟色胺(5-HT)、γ-氨基丁酸(GABA)、褪黑素(MT),以及多巴胺(DA)和去甲肾上腺素(NE)的含量。
2)指标的测定。根据小鼠5-HT试剂盒说明绘制5-HT含量标准曲线,标准曲线回归方程为
y=0.006 3x+0.088 1(R2=0.992 6)。
根据小鼠GABA试剂盒说明绘制GABA含量标准曲线,标准曲线回归方程为
y=0.249 3x+0.106 7(R2=0.985 2)。
根据小鼠MT试剂盒说明绘制MT含量标准曲线,标准曲线回归方程为
y=0.02x+0.041 8(R2=0.999 2)。
根据小鼠DA试剂盒说明绘制DA含量标准曲线,标准曲线回归方程为
y=0.011 9x+0.036 4(R2=0.995 6)。
根据小鼠NE试剂盒说明绘制NE含量标准曲线,标准曲线回归方程为
y=0.175 6x+0.039 5(R2=0.998 7)。
根据各标准曲线,计算所测样品的5-HT、GABA、MT、DA和NE含量。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,试验数据采用SPSS 20.0 软件进行分析,两组数据采用独立T检验法进行分析,多组数据采用单因素法(ANOVA)进行方差分析,睡眠发生率采用卡方检验法分析,显著性水平设为0.05。
2 结果与分析
2.1 EPO的基本营养成分
经测定,EPO基本营养成分中粗蛋白质含量最高,为(55.81±0.53)%,其次为总糖含量,为(30.83±0.35)%,粗脂肪含量为(8.72±0.20)%,灰分含量为(4.65±0.43)%,水分含量为(4.17±0.12)%。
2.2 EPO的氨基酸组成
从表1可见:EPO氨基酸组成种类齐全,必需氨基酸与氨基酸总和的比值为40.44%,符合FAO/WHO推荐标准中理想蛋白质模式,其中苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸的占比分别为8.06%、6.39%、3.24%、6.44%、9.97%、5.67%、0.67%;EPO疏水性氨基酸与氨基酸总和的比值为60.37%,其中脯氨酸、甘氨酸、丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸的占比分别为12.45%、7.20%、9.01%、6.39%、3.24%、6.44%、9.97%、5.67%。
表1 EPO氨基酸组成
Tab.1 Amino acid composition of enzymolysis products of oyster(EPO)
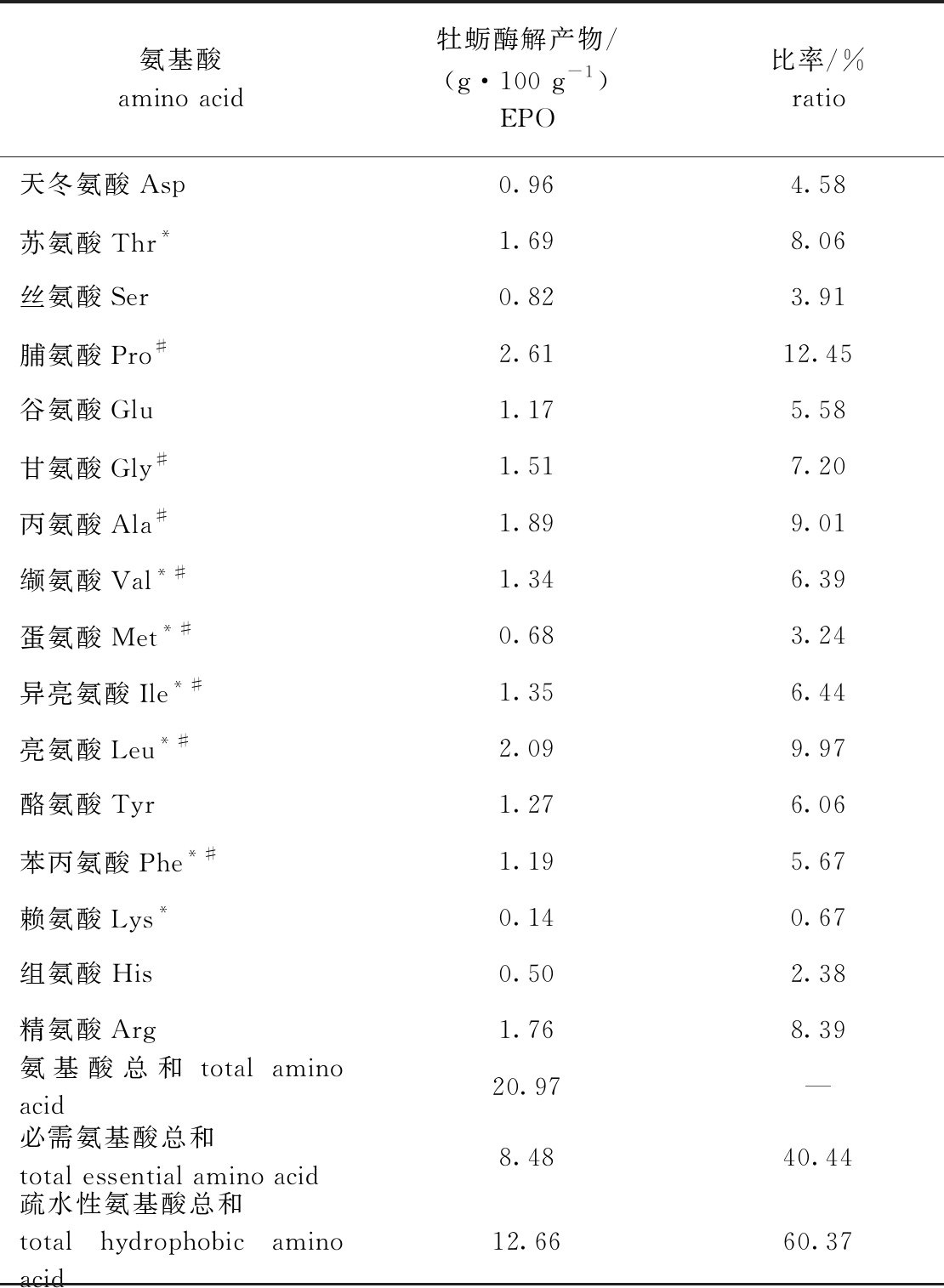
注:*为必需氨基酸;#为疏水性氨基酸。由于酸的水解和分解,该方法无法测定色氨酸。
Note: *,essential amino acid; # ,hydrophobic amino acid. Tryptophan cannot be determined by this method due to acid hydrolysis and decomposition.
氨基酸amino acid牡蛎酶解产物/(g·100 g-1)EPO比率/%ratio天冬氨酸Asp0.964.58苏氨酸Thr*1.698.06丝氨酸Ser0.823.91脯氨酸Pro#2.6112.45谷氨酸Glu1.175.58甘氨酸Gly#1.517.20丙氨酸Ala#1.899.01缬氨酸Val*#1.346.39蛋氨酸Met*#0.683.24异亮氨酸Ile*#1.356.44亮氨酸Leu*#2.099.97酪氨酸Tyr1.276.06苯丙氨酸Phe*#1.195.67赖氨酸Lys*0.140.67组氨酸His0.502.38精氨酸Arg1.768.39氨基酸总和total amino acid20.97—必需氨基酸总和total essential amino acid8.4840.44疏水性氨基酸总和total hydrophobic amino acid12.6660.37
2.3 EPO对小鼠直接睡眠的影响
从表2可见,末次灌胃30 min后,阴性对照组和EPO各剂量组小鼠均无直接睡眠现象,即EPO无直接睡眠作用。
表2 EPO对小鼠直接睡眠的影响
Tab.2 Effects of EPO on direct sleep in mice
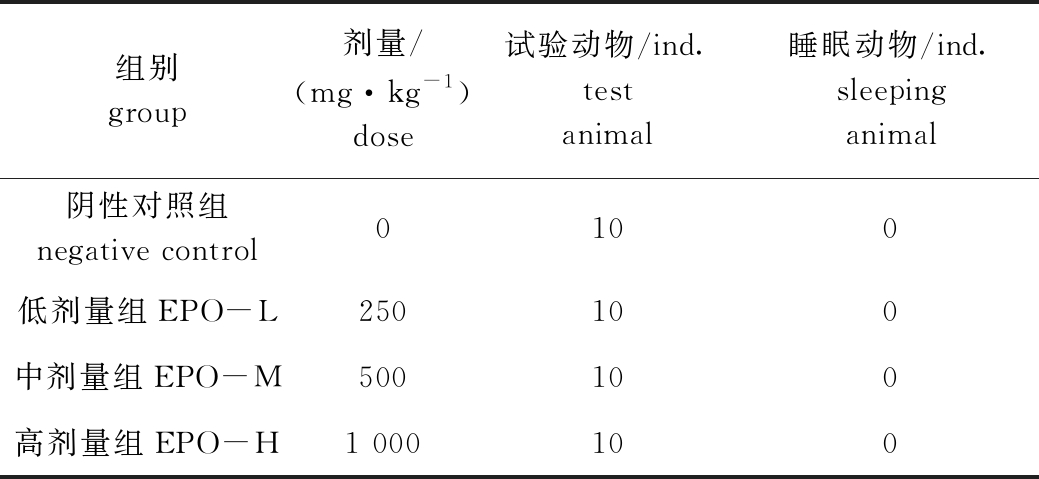
组别group剂量/(mg·kg-1)dose试验动物/ind.test animal睡眠动物/ind.sleeping animal阴性对照组negative control0100低剂量组EPO-L250100中剂量组EPO-M500100高剂量组EPO-H1 000100
2.4 EPO对戊巴比妥钠诱导睡眠时间的影响
从表3可见:阳性对照组、EPO各剂量组较阴性对照组均显著延长了戊巴比妥钠诱导小鼠的睡眠时间(P<0.05);与阴性对照组相比,阳性对照组对戊巴比妥钠诱导的小鼠睡眠时间延长了89.82%,低、中、高剂量的EPO对戊巴比妥钠诱导小鼠睡眠时间分别延长了44.78%、74.52%、45.96%,其中EPO中剂量组相较于其他剂量组,可以较好地延长小鼠睡眠时间。这说明,在一定剂量范围内,EPO与戊巴比妥钠具有协同作用,可以延长小鼠睡眠时间。
表3 EPO对戊巴比妥钠诱导小鼠睡眠时间的影响
Tab.3 Effects of EPO on sleep time of mice induced by pentobarbital sodium
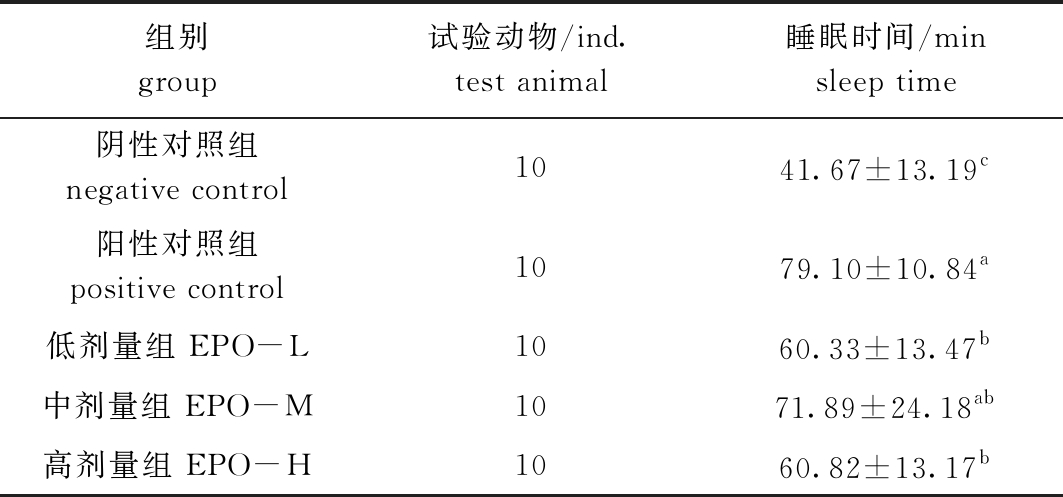
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
组别group试验动物/ind.test animal睡眠时间/minsleep time阴性对照组negative control 1041.67±13.19c阳性对照组positive control1079.10±10.84a低剂量组 EPO-L1060.33±13.47b中剂量组 EPO-M1071.89±24.18ab高剂量组 EPO-H1060.82±13.17b
2.5 EPO对戊巴比妥钠阈下剂量睡眠发生率的
影响
从表4可见,与阴性对照组相比,阳性对照组、EPO各剂量组的睡眠发生率均有升高,分别为80%、40%、70%、50%,其中仅阳性对照组、EPO中剂量组与阴性对照组有显著性差异(P<0.05)。
表4 EPO对戊巴比妥钠阈下剂量睡眠发生率的影响
Tab.4 Effects of EPO on the incidence of sleeping induced by subthreshold dose of pentobarbital sodium

组别 group试验动物 test animal/ind.睡眠动物 sleeping animal/ind.睡眠发生率 incidence of sleep/%阴性对照组 negative control10220a阳性对照组 positive control10880b低剂量组EPO-L10440a中剂量组EPO-M10770b高剂量组EPO-H10550a
2.6 EPO对巴比妥钠诱导睡眠潜伏期的影响
从表5可见,与阴性对照组相比,阳性对照组、EPO各剂量组均显著缩短了小鼠睡眠潜伏期(P<0.05),其中,EPO中剂量组可将睡眠潜伏期缩至最短。这说明,EPO与巴比妥钠通过协同作用,可以显著缩短小鼠睡眠潜伏期。
表5 EPO对巴比妥钠诱导小鼠睡眠潜伏期的影响
Tab.5 Effects of EPO on sleep latency in mice induced by barbital sodium
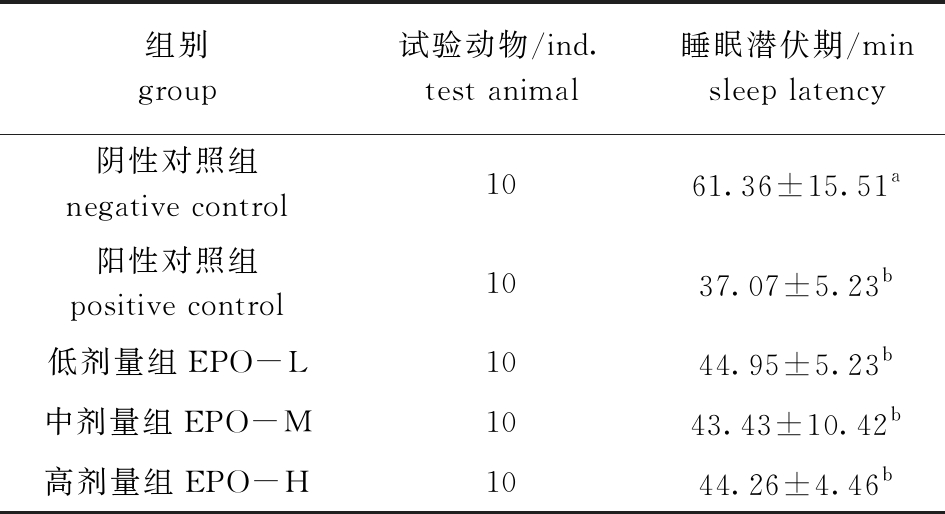
组别group试验动物/ind. test animal睡眠潜伏期/minsleep latency阴性对照组 negative control1061.36±15.51a阳性对照组 positive control1037.07±5.23b低剂量组EPO-L1044.95±5.23b中剂量组EPO-M1043.43±10.42b高剂量组EPO-H1044.26±4.46b
2.7 小鼠下丘脑、大脑皮层的神经递质水平含量
小鼠下丘脑神经递质水平含量如表6所示,其中5-HT、GABA与MT为抑制性神经递质,与阴性对照组相比,阳性对照组及EPO低、中剂量组下丘脑的5-HT和GABA含量均显著升高(P<0.05),EPO高剂量组5-HT和GABA含量略有升高,但无显著性差异(P>0.05),阳性对照组、EPO低、中剂量组MT含量有升高(P>0.05);DA与NE为兴奋性神经递质,与阴性对照组相比,阳性对照组、EPO各剂量组DA含量均有显著降低(P<0.05),EPO低、中剂量组NE含量显著降低(P<0.05),阳性对照组、EPO高剂量组NE含量也有所降低,但无显著性差异(P>0.05)。
表6 EPO对小鼠下丘脑神经递质水平的影响( n=5)
Tab.6 Effects of EPO on the level of hypothalamic neurotransmitter in mice(n=5)

组别 group5-HT/(ngmL-1)GABA/(μmolmL-1)MT/(ngmL-1)DA/(pgmL-1)NE/(ngmL-1)阴性对照组 negative control115.93±19.32c3.23±0.35c73.45±6.87ab126.55±3.02a5.20±0.65a阳性对照组 positive control168.81±30.45a4.21±0.18ab79.20±7.98a108.91±5.19b4.71±0.36ab低剂量组 EPO-L161.56±18.55ab4.52±0.39a74.55±3.11ab114.54±9.89b4.50±0.36b中剂量组 EPO-M167.51±31.29a4.08±0.64ab77.65±4.76a111.26±6.81b4.37±0.21b高剂量组 EPO-H135.90±15.33bc3.69±0.21bc67.50±5.43b113.03±12.95b4.77±0.26ab
小鼠大脑皮层神经递质水平含量由表7所示,与阴性对照组相比,阳性对照组大脑皮层5-HT含量显著升高(P<0.05),EPO低、中剂量组5-HT含量略有升高,但无显著性差异(P>0.05);阳性对照组及EPO低、中剂量组GABA含量均显著升高(P<0.05),EPO高剂量组GABA含量略有升高(P>0.05);阳性对照组、EPO各剂量组MT含量均高于阴性对照组,其中阳性对照组及EPO中、高剂量组MT含量有显著性提高(P<0.05);阳性对照组及EPO中、高剂量组DA含量均显著降低(P<0.05),EPO低剂量组DA含量略有降低(P>0.05);EPO高剂量组NE含量显著降低(P<0.05),阳性对照组及EPO低、中剂量组NE含量略有降低(P>0.05)。
表7 EPO对小鼠大脑皮层神经递质水平的影响( n=5)
Tab.7 Effects of EPO on the level of neurotransmitters in the cerebral cortex of mice(n=5)
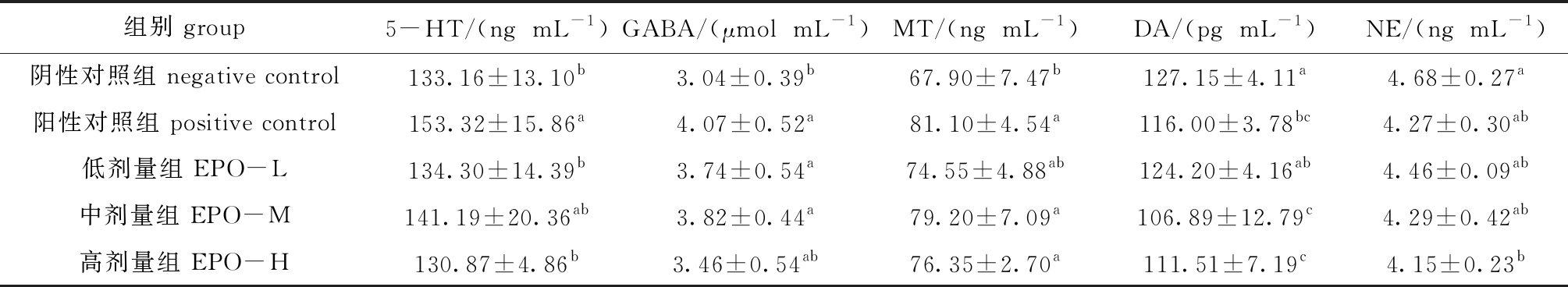
组别 group5-HT/(ngmL-1)GABA/(μmolmL-1)MT/(ngmL-1)DA/(pgmL-1)NE/(ngmL-1)阴性对照组 negative control133.16±13.10b3.04±0.39b67.90±7.47b127.15±4.11a4.68±0.27a阳性对照组 positive control153.32±15.86a4.07±0.52a81.10±4.54a116.00±3.78bc4.27±0.30ab低剂量组 EPO-L134.30±14.39b3.74±0.54a74.55±4.88ab124.20±4.16ab4.46±0.09ab中剂量组 EPO-M141.19±20.36ab3.82±0.44a79.20±7.09a106.89±12.79c4.29±0.42ab高剂量组 EPO-H130.87±4.86b3.46±0.54ab76.35±2.70a111.51±7.19c4.15±0.23b
3 讨论
3.1 EPO营养成分对改善睡眠作用影响
本研究结果显示,EPO蛋白质含量丰富,脂肪含量低,其中谷氨酸含量为1.17 g/100 g,占氨基酸总和的5.58%,甘氨酸含量为1.51 g/100 g,占氨基酸总和的7.20%。同时,基于课题组前期研究,相同制备方法下得到的牡蛎酶解产物微量元素中锌含量最高,为440.67 mg/kg,牛磺酸含量为34.21 mg/g[16]。研究表明,甘氨酸可以通过血脑屏障进入大脑,通过作用于视交叉上核(SCN)中的NMDA受体,从而调节睡眠[21];谷氨酸与牛磺酸可以促进抑制性神经递质GABA的产生,锌作为膳食补充剂可以起到改善睡眠质量的作用[18]。因此,EPO营养成分中相关氨基酸与微量元素能为改善睡眠提供营养支持。
3.2 EPO对小鼠行为学的影响
本研究中参照《保健食品检验与评价技术规范》[20]进行了EPO对小鼠睡眠影响试验研究。直接睡眠试验是为了探究EPO是否有直接睡眠效果;戊巴比妥钠是一种作用于大脑中枢神经的药物,通过肝酶代谢,腹腔注射戊巴比妥钠后,若试验组睡眠时间延长并与阴性对照有显著性差异,即试验结果为阳性,说明EPO与戊巴比妥钠协同改善睡眠;为排除EPO对肝酶有抑制效果,造成假阳性的结果,进行戊巴比妥钠阈下剂量催眠试验,若试验组睡眠发生率与阴性对照有显著性差异,即试验结果为阳性;巴比妥钠也是对中枢系统有抑制作用的药物,腹腔注射巴比妥钠后,若试验组睡眠潜伏期有显著缩短,说明EPO与巴比妥钠也有协同作用,试验结果为阳性。本研究中,延长戊巴比妥钠睡眠时间试验、戊巴比妥钠阈下剂量催眠试验和巴比妥钠睡眠潜伏期试验显示,2项试验结果均为阳性,说明EPO具有改善睡眠的作用。该结果与Saito等[22]的研究结果一致。
3.3 EPO对小鼠下丘脑、大脑皮层神经递质水平的影响
睡眠是一种昼夜活动,发生于大脑中,下丘脑、大脑皮层和海马等神经组织结构与睡眠有着密切的联系[23]。下丘脑位于丘脑下方,是高级神经中枢,下丘脑中包含大量神经元,主要为GABA能神经元、下丘脑腹外侧视前核(VLPO)神经元和黑色素浓缩激素(MCH)神经元,这些神经元在促进睡眠中发挥着重要的作用[24]。大脑皮层中存在着大量的神经元细胞参与睡眠/觉醒调节,此外,大脑皮层神经细胞的波动可以产生慢波睡眠,有助于提高睡眠质量[25]。神经递质分为兴奋性神经递质和抑制性神经递质[26]。5-羟色胺(5-HT),又名血清素,是一种抑制性神经递质,研究表明,5-HT含量下降会导致不同程度的失眠[27]。γ-氨基丁酸(GABA)是神经中枢的主要抑制性神经递质,由谷氨酸经过脱羧合成而来,GABA含量升高有利于睡眠时间的延长,催眠药物都是基于GABAA受体进行调控睡眠[28]。褪黑素(MT)是一种由色氨酸合成的抑制性神经递质,褪黑素可以缩短入睡潜伏期、延长睡眠持续时间及提高睡眠质量[29]。多巴胺(MT)是去甲肾上腺素的前体,是与睡眠有关的兴奋性神经递质,多巴胺可以调节情绪,并促进觉醒[30]。去甲肾上腺素(NE)也是促进觉醒的兴奋性神经递质,失眠状态下,NE含量升高[31]。本研究中,与阴性对照组相比,EPO各剂量组中5-HT、GABA和MT含量的升高,可能与牡蛎中含有的谷氨酸、牛磺酸有关[16-17],而EPO各剂量组中DA和NE含量的降低,可能与牡蛎中锌含量丰富有关[18]。
4 结论
1)EPO可以提供改善睡眠相关的甘氨酸、谷氨酸等氨基酸及微量元素,并与戊巴比妥钠协同延长小鼠睡眠时间,提高睡眠发生率,与巴比妥钠协同缩短小鼠睡眠潜伏期,具有改善睡眠的作用。
2)EPO通过提高脑内5-HT、GABA、MT抑制性神经递质含量,降低DA、NE兴奋性神经递质含量,起到改善睡眠的作用。
3)EPO 3个剂量均有改善睡眠的作用,其中用EPO 500 mg/kg体质量灌胃小鼠,改善睡眠效果最佳。
[1] YU C Q,SHI Z M,LV J,et al.Dietary patterns and insomnia symptoms in Chinese adults:the China kadoorie biobank[J].Nutrients,2017,9(3):232.
[2] TAYLOR D J,LICHSTEIN K L,DURRENCE H H.Insomnia as a health risk factor[J].Behavioral Sleep Medicine,2003,1(4):227-247.
[3] ZISAPEL N.Drugs for insomnia[J].Expert Opinion on Emerging Drugs,2012,17(3):299-317.
[4] 林海生,秦小明,章超桦,等.中国沿海主要牡蛎养殖品种的营养品质和风味特征比较分析[J].南方水产科学,2019,15(2):110-120.
[5] 赵谋明,任娇艳.食源性生物活性肽结构特征与生理活性的研究现状与趋势[J].中国食品学报,2011,11(9):69-81.
[6] LI W,XU C,ZHANG C H,et al.The purification and identification of immunoregulatory peptides from oyster (Crassostrea hongkongensis) enzymatic hydrolysate[J].RSC Advances,2019,9(56):32854-32863.
[7] HWANG D,KANG M J,JO M J,et al.Anti-inflammatory activity of β-thymosin peptide derived from Pacific oyster (Crassostrea gigas) on NO and PGE2 production by down-regulating NF-κB in LPS-induced RAW264.7 macrophage cells[J].Marine Drugs,2019,17(2):129.
[8] 郝更新,曹文红,郝记明,等.超滤法浓缩富集牡蛎蛋白抗氧化活性肽[J].食品工业科技,2013,34(11):77-80.
[9] 杨发明,林海生,秦小明,等.牡蛎酶解产物促进小鼠皮肤创伤愈合效果研究[J].大连海洋大学学报,2019,34(5):649-655.
[10] 杨发明,林海生,秦小明,等.牡蛎酶解产物促进皮肤软组织创伤愈合的作用[J].上海海洋大学学报,2020,29(4):632-640.
[11] MIAO J Y,LIAO W W,KANG M,et al.Anti-fatigue and anti-oxidant activities of oyster (Ostrea rivularis) hydrolysate prepared by compound protease[J].Food & Function,2018,9(12):6577-6585.
[12] 林海生.牡蛎蛋白肽的酶法制备及其改善小鼠学习记忆功能的研究[D].湛江:广东海洋大学,2013.
[13] CHEN H,CHENG S Z,FAN F J,et al.Identification and molecular mechanism of antithrombotic peptides from oyster proteins released in simulated gastro-intestinal digestion [J].Food & Function,2019,10(9): 5426-5435.
[14] SEO J K,LEE M J,NAM B H,et al.CgMolluscidin,a novel dibasic residue repeat rich antimicrobial peptide, purified from the gill of the Pacific oyster,Crassostrea gigas[J].Fish & Shellfish Immunology,2013, 35(2):480-488.
[15] 黄艳球,杨发明,秦小明,等.不同养殖区香港牡蛎的化学组成及特征气味成分分析[J].食品科学,2019,40(14):236-242.
[16] 林海生,曹文红,卢虹玉,等.牡蛎蛋白酶解物改善小鼠学习记忆能力及其体内抗氧化活性的研究[J].食品科技,2013,38(4):37-41.
[17] LIN F J,PIERCE M M,SEHGAL A,et al.Effect of taurine and caffeine on sleep-wake activity in Drosophila melanogaster[J].Nature and Science of Sleep,2010,2:221-232.
[18] CHERASSE Y,URADE Y.Dietary zinc acts as a sleep modulator[J].International Journal of Molecular Sciences,2017,18(11):2334.
[19] 李婉,曹文红,章超桦,等.牡蛎酶解产物的组成特点及其体外免疫活性[J].食品工业科技,2017,38(16):35-42.
[20] 中华人民共和国卫生部.保健食品检验与评价技术规范[M].北京:人民卫生出版社,2003.
[21] KAWAI N,SAKAI N,OKURO M,et al.The sleep-promoting and hypothermic effects of glycine are mediated by NMDA receptors in the suprachiasmatic nucleus[J].Neuropsychopharmacology,2014,40(6):1405.
[22] SAITO H,CHERASSE Y,SUZUKI R,et al.Zinc-rich oysters as well as zinc-yeast- and astaxanthin-enriched food improved sleep efficiency and sleep onset in a randomized controlled trial of healthy individuals[J].Molecular Nutrition & Food Research,2017,61(5):1600882.
[23] SAPER C B,FULLER P M,PEDERSEN N P,et al.Sleep state switching[J].Neuron,2010,68(6):1023-1042.
[24] NISHINO S.Neurotransmitters and neuropharmacology of sleep/wake regulations[M]//KUSHIDA C A. Encyclopedia of sleep.Amsterdam:Elsevier,2013:395-406.
[25] SANCHEZ-VIVES M V,MATTIA M.Slow wave activity as the default mode of the cerebral cortex[J].Archives Italiennes De Biologie, 2014,152(2/3):147-155.
[26] LAJTHA A,VIZI E S.Handbook of neurochemistry and molecular neurobiology:neurotransmitter systems[M].Boston:Springer,2008.
[27] CESPUGLIO R.Serotonin:its place today in sleep preparation,triggering or maintenance[J].Sleep Medicine,2018,49:31-39.
[28] GOTTESMANN C.GABA mechanisms and sleep[J].Neuroscience,2002,111(2):231-239.
[29] LI T,JIANG S,HAN M Z,et al.Exogenous melatonin as a treatment for secondary sleep disorders:a systematic review andmeta-analysis [J].Frontiers in Neuroendocrinology,2019,52:22-28.
[30] RADWAN B,LIU H,CHAUDHURY D.The role of dopamine in mood disorders and the associated changes in circadian rhythms and sleep-wake cycle[J].Brain Research,2019,1713:42-51.
[31] MITCHELL H A,WEINSHENKER D.Good night and good luck:norepinephrine in sleep pharmacology[J].Biochemical Pharmacology,2010,79(6):801-809.