重金属因其潜在毒性、难降解及富集等危害,已成为重要的环境污染源。研究表明,通过重金属的瞬时超标或者长期微量积累常常对鱼类产生胁迫,影响早期生长发育,如增加胚胎发育时间、降低胚胎孵化率、增加畸形率等[1-4],并引起鱼体组织细胞(如肝细胞、鳃和性腺等)超微结构的损伤[5-7]。重金属污染物对鱼类胁迫造成的危害因重金属离子种类、胁迫浓度、胁迫时间和鱼种等因素变化而不同。水体中重金属离子浓度超过一定阈值时,其毒理效应会表现出来,并造成水生动物受伤、死亡[8]。锌是生命活动所必需的微量元素之一,具有催化和调节功能,在营养物质代谢过程中发挥重要作用,也是纠正免疫应答功能的关键元素[9]。当Zn2+缺乏时,会导致中性粒细胞和单核细胞的趋化性降低,细胞免疫反应受损[10]。但是,当Zn2+浓度超过一定浓度时,也会抑制水生生物的生理功能。Zn2+对鱼类的毒害作用与其和鱼类体内生物大分子上的活性位点结合有关,表现为鱼卵的孵化、发育和繁殖过程受阻,甚至死亡[9]。在Zn2+胁迫下,鱼体会产生一种非特异性免疫机制以应对Zn2+引起的免疫和氧化损伤。
多种环境污染物可诱导水生生物产生氧化应激进而产生活性氧(ROS),同时产生脂质过氧化、细胞损伤等一系列生理生化反应,因此,氧化应激和抗氧化酶活性水平常作为评价环境风险的重要指标[11]。核因子NF-E2相关因子(nuclear factor-erythroid 2-related factor 2,Nrf2)属于CNC亮氨酸拉链家族(Cap‘n’Collar basic leucine zipper, CNC-b ZIP)成员,是细胞内缓解氧化损伤和抵抗外来毒性化合物的重要核转录因子,通过调节相关靶基因的表达参与机体内抗氧化和抗炎应激反应、重金属解毒等生理过程[12-13]。Nrf2可通过调控一系列抗氧化蛋白因子的组成型和诱导型表达,减轻活性氧和亲电体引起的细胞损伤,使细胞处于稳定状态,维持机体氧化还原动态平衡[11,14]。但金属暴露会影响Nrf2介导的细胞信号通路,包括Keap1中巯基的还原、MAPK活性的激活、Nrf2的磷酸化等[15]。机体在受到胁迫应激时,Nrf2基因被激活并转运入核,调控包括超氧化物气化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)等下游抗氧化靶基因的转录,保护机体免受氧化损伤[12]。Nrf2 mRNA表达的上调主要是由核易位造成的,核易位由氧化信号诱导,重金属胁迫促使氧化信号增多,导致核易位细胞数量增多[16-17]。研究发现,重金属胁迫会诱导相关抗氧化基因CAT、GPx、Cu/Zn-SOD和Mn-SOD等表达水平显著增加[13-14],以及抗氧化酶SOD和CAT等酶活性显著升高,而这些基因表达水平的上调与Nrf2/Keap1信号通路有关,因为Nrf2与Keap1的解离是Nrf2核易位的主要机制[14]。因此,研究鱼类对重金属胁迫的分子应答机制,有助于筛选出评估水体污染状况[18]的分子标记物,掌握鱼类生存状况,提供水体污染预警,为鱼类保护和资源恢复提供对策。
花斑裸鲤Gymnocypris eckloni俗称大嘴鱼,隶属于裂腹鱼亚科Schizothoracinae裸鲤属Gymnocypris[19],分布于黄河上游段、扎陵湖、鄂陵湖等淡水水域,是黄河上游水域中生物多样性的重要组成部分,具有重要的生态保护价值和开发利用价值。近年来,由于大型水利工程的建设、人为的偷捕乱捞和水环境的局部污染,花斑裸鲤资源量大幅度减少[20]。目前,国家通过实施花斑裸鲤等土著鱼类“三场”(即产卵场、索饵场、越冬场)的生态修复工程,建立了花斑裸鲤人工增殖放流站,严格执行渔政执法,使得人为因素对土著鱼类造成的危害得到有效缓解,而水域环境污染物尤其是重金属污染对土著鱼类的影响日益受到关注。近年来,虽然黄河上游青海段水质符合国家渔业二类水质标准,但局部水域因采矿、雨水冲蚀、生活污水和地表径流等污染会引起瞬时的重金属离子浓度超标或某些重金属离子的长期微量污染风险依然存在,尤其是繁殖季节产卵场的重金属污染直接威胁着花斑裸鲤等土著鱼类的生存。野生花斑裸鲤的孵化、发育和繁殖是其资源保护和恢复的关键,因此,本研究中选择对野生花斑裸鲤繁育活动影响最直接的Zn2+作为重金属胁迫源,通过分析Zn2+胁迫下花斑裸鲤特定组织抗氧化关键基因和关键酶的应答模式,筛选产生胁迫应答的生物标记物,从而更加直接地反映所在水体的Zn2+污染状况,以期为花斑裸鲤的资源保护与恢复,以及作为水质监测预警指标提供科学参考。
1 材料与方法
1.1 材料
试验用花斑裸鲤由青海省渔业环境监测站提供,取体格健康的花斑裸鲤,体长为(15±3)cm,体质量为(10±3)g,于青海大学生态环境学院水生实验室水族箱内暂养适应两周,期间每天10:00投喂一次。试验用水为曝气一周的自来水,溶解氧为6.8~7.8 mg/L,pH为6.8~7.5,温度为(18±2)℃。试验前用高锰酸钾(1~200 mg/L)对试验水族箱进行消毒处理。
1.2 方法
1.2.1 急生毒性试验 ZnSO4 ·7H2O购自Sigma-Aldrich公司(St Louis, MO, USA)。采用静态水质接触法[6]进行金属胁迫试验。Zn2+胁迫浓度以中国渔业水质标准(Zn2+质量浓度为0.1 mg/L)为基准,分别将质量浓度扩大10、20、50、100、200倍,即1、2、5、10、20 mg/L,每个质量浓度设置一个平行组,每组投放15尾健康的花斑裸鲤。试验期间观察并记录Zn2+胁迫24、48、72、96 h时鱼的死亡数,并观察鱼体的活动状况,以鱼静卧鱼缸底部,不见鳃盖有呼吸运动,多次触碰无反应来判断鱼死亡现象。及时捞出死亡个体,记录死亡数量。采用改进寇氏法公式[21]计算出各胁迫时间下的半致死浓度(LD50,mg/L),安全浓度为96 h LD50×0.1。
1.2.2 LD50浓度的计算 根据所记录的鱼死亡数,计算出死亡率(P)。改进寇氏法计算公式为
LD50=lg-1[xmax-i(∑P-0.5)]。
其中:xmax为lg(最大剂量);i为lgd2-lgd1,d2、d1为相邻两组剂量;P为各胁迫组花斑裸鲤的死亡率(用小数表示);∑P为各组P的总和。
lg LD50 的标准误(s50)计算公式为
s50=i×[(∑P- ∑P2)/(n-1)]1/2,
LD50的95%可信限=lg-1(x50 ±1.96 s50),
LD50的平均可信限=LD50±(LD50高限-LD50低限)/2。
其中:n为每组中鱼的数量; x50=lg LD50。
1.2.3 样品的采集 根据本试验中获得的Zn2+胁迫不同时间段的半致死浓度,并以中国地表水质量标准第Ⅲ类(GB/T 14848—93)为标准,将Zn2+质量浓度为1.0 mg/L作为本试验胁迫浓度。在1.0 mg/L Zn2+胁迫12、24、48、72、96 h时,采集不同胁迫时间下的鳃、肾脏和肝脏组织,用液氮速冻后保存在-80 ℃超低温冰箱中,用于后续试验。
1.2.4 总RNA提取 用RNA提取试剂盒(TaKaRa, Japan)提取总RNA,并通过琼脂糖凝胶电泳和核酸检测仪检测RNA的完整性和质量。
1.2.5 荧光定量PCR 设计实时荧光定量PCR引物(表1),以β-actin为内参基因,用荧光定量PCR仪(Light Cycler 96 SW1.1,罗氏)测定Nrf2、Cu/Zn-SOD、Mn-SOD、CAT和GPx的mRNA表达量变化。PCR扩增总体系(共25 μL):iQTM SYBR Green Supermix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板2 μL,ddH2O 8.5 μL。反应条件为:94 ℃下预变性3 min;94 ℃下循环变性30 s,60 ℃下退火复性30 s,72 ℃下延伸40 s,共进行40个循环。每个样本设置3个平行。运用2-ΔΔCt法计算基因的相对表达量。
表1 qPCR检测的基因及引物序列
Tab.1 Genes and primer sequences used for qPCR

基因gene引物序列primer sequence(5'-3')产物长度/bpproduct lengthNrf2F:AGATAAAGGCAAAGAACCCAAAR:TTCTCCTTCTTCAATCGCTCC325CATF:GGTCAACGCTCAGGGACAGTR:TTCCGCCTGCTCAAAGGTCA145GPxF:CGGATACGGATCGCACACCTR:AGTAATCCGGGTCCGTGGATG150Cu/Zn-SODF:GTCCGCACTTCAACCCTCAR:ACCCAGGTCATCGTCTTTCTCA240Mn-SODF:TTCACCACAGCAAGCACCATR:AGCCGACATCTTCTCCTTCA260β-actinF:CCATGTACGTTGCCATCCAGR:CGCAAGACTCCATACCCAA426
1.2.6 基因的应答层次分析 试验材料与方法同“1.2.3”节和“1.2.5”节。基因的应答层次以热图方式呈现。将各基因在鳃、肾脏和肝脏组织中的mRNA表达量进行log2均一化处理,然后将所得试验数据应用HemI 1.0.3.7软件进行分析作图。基因表达的强弱采用不同颜色表示,可直观地分析出同一基因mRNA表达量的变化趋势和不同基因mRNA表达的先后层次。
1.2.7 抗氧化酶活性分析 用电动匀浆器分别对已得到的花斑裸鲤鳃、肾脏和肝脏组织进行匀浆。按照南京建成生物工程公司试剂盒说明书进行操作,并用吸光度法测定SOD、CAT和GPx酶活性。
1.3 数据处理
基因的mRNA表达量及抗氧化酶活力数据采用平均值±标准差(mean±S.D.)表示,采用 SPSS Statistics 22软件进行单因素方差分析,采用SNK法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 Zn2+对花斑裸鲤的急性毒性影响
从表2可见:不同Zn2+浓度胁迫24、48、72、96 h时,花斑裸鲤表现出不同的死亡率,其中,1 mg/L Zn2+胁迫96 h内,花斑裸鲤未出现死亡现象;2 mg/L Zn2+胁迫48 h内,花斑裸鲤未出现死亡,胁迫72 h时出现7%的死亡率;5 mg/L Zn2+胁迫24 h时,出现26.7%的死亡率,胁迫48 h死亡率为46.6%,胁迫96 h时累积死亡率达到93.3%;10、20 mg/L Zn2+胁迫24 h时,花斑裸鲤全部死亡。
表2 不同Zn2+质量浓度下花斑裸鲤的死亡率
Tab.2 Mortality rate of eckloni naked carp Gymnocypris eckloni under different concentrations of Zn2+
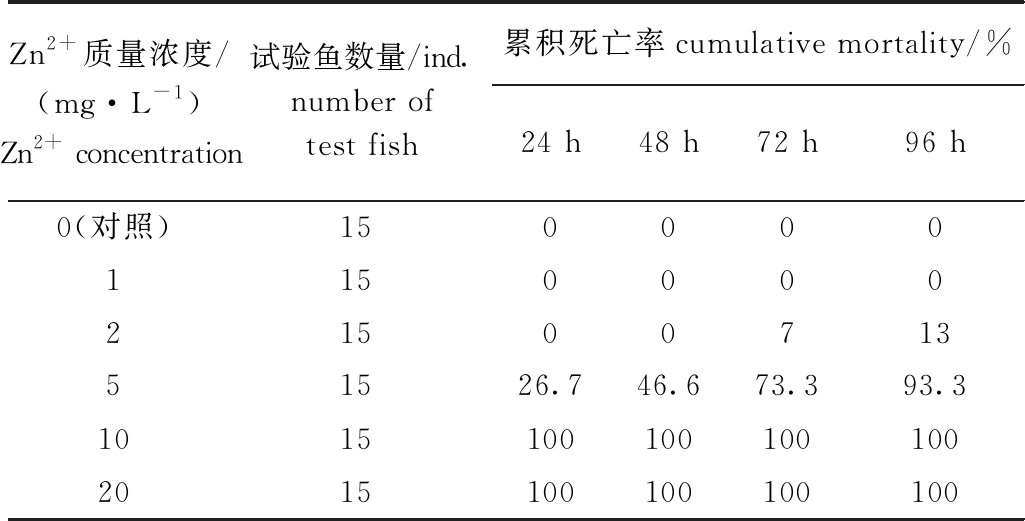
Zn2+质量浓度/(mg·L-1)Zn2+ concentration试验鱼数量/ind.number of test fish累积死亡率cumulative mortality/%24 h48 h72 h96 h0(对照)15000011500002150071351526.746.673.393.310151001001001002015100100100100
Zn2+对花斑裸鲤胁迫24、48、72、96 h时的LD50、LD50的95%可信限、LD50的平均可信限和安全浓度见表3,其中,LD50随胁迫时间延长呈逐渐降低趋势,24 h LD50最高,为5.0 mg/L,96 h LD50最低,为2.0 mg/L,其安全浓度为0.2 mg/L。
表3 Zn2+对花斑裸鲤24、48、72、96 h的LD50及安全浓度
Tab.3 The LD50 and safe concentration of Zn2+ for eckloni naked carp Gymnocypris eckloni in 24,48,72 and 96 h
mg/L
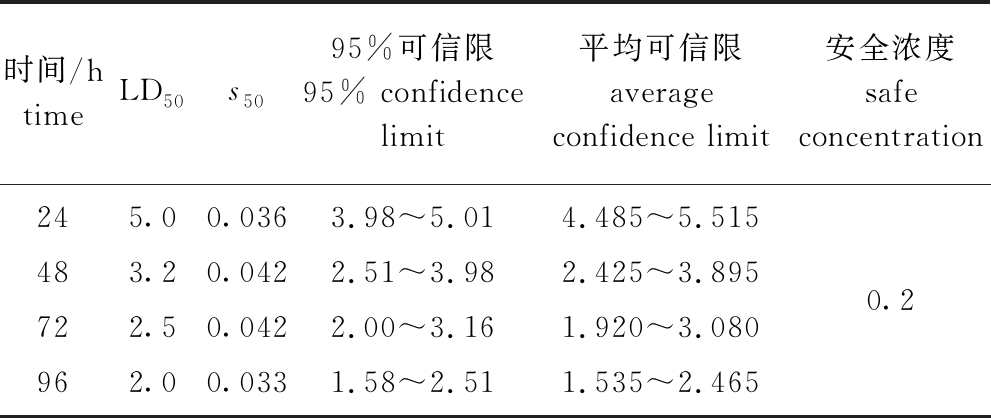
时间/htimeLD50s5095%可信限95% confidence limit 平均可信限average confidence limit 安全浓度safe concentration244872 965.0 3.2 2.5 2.00.0360.0420.0420.0333.98~5.01 2.51~3.98 2.00~3.16 1.58~2.51 4.485~5.515 2.425~3.895 1.920~3.0801.535~2.465 0.2
2.2 Zn2+胁迫下抗氧化关键基因的表达量变化
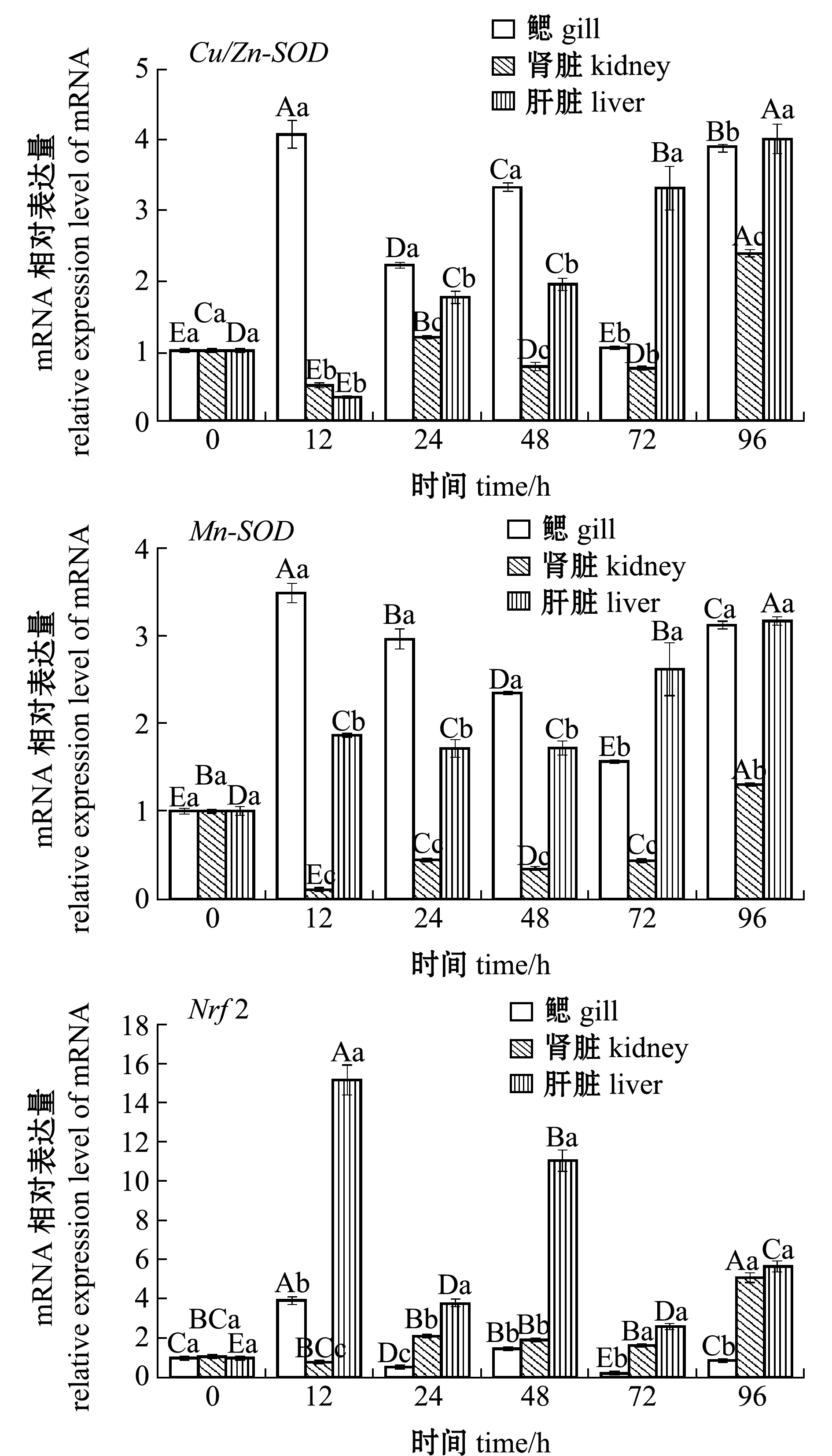
从图1、图2可见:在1.0 mg/L Zn2+胁迫下,随着胁迫时间的延长,花斑裸鲤鳃、肾脏和肝脏组织中抗氧化系统关键基因Nrf2、SOD、CAT和GPx的mRNA表达量均有增加,但关键基因表达量上调的幅度各异,表达量的变化趋势也不完全相同;Zn2+胁迫12 h时,Cu/Zn-SOD和Mn-SOD表达量在鳃中上调幅度最大,分别为对照组的4.05倍和3.46倍,而它们在肾脏中的上调幅度不大;Zn2+胁迫12 h时,Nrf2表达量在肝脏中上调幅度最大,为对照组的15.11倍,而在鳃和肾脏中的上调幅度不大;Zn2+胁迫48 h时,GeCAT和GeGPx表达量在鳃中上调幅度最大,分别为对照组的7.96倍和6.56倍,而它们在肾脏和肝脏中的上调幅度不大。
标有不同大写字母者表示同一组织不同时期间有显著性差异(P<0.05),标有不同小写字母者表示同一时期不同组织间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同。
The means with different capital letters between different periods in the same tissue are significantly different among the groups at the 0.05 probability level,means with different letters between different tissue over the same period are significantly different at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 Zn2+胁迫对花斑裸鲤Cu/Zn-SOD、Mn-SOD和Nrf2基因表达的影响
Fig.1 Effects of Zn2+ stress on Cu/Zn-SOD,Mn-SOD and Nrf2 gene expression in eckloni naked carp Gymnocypris eckloni
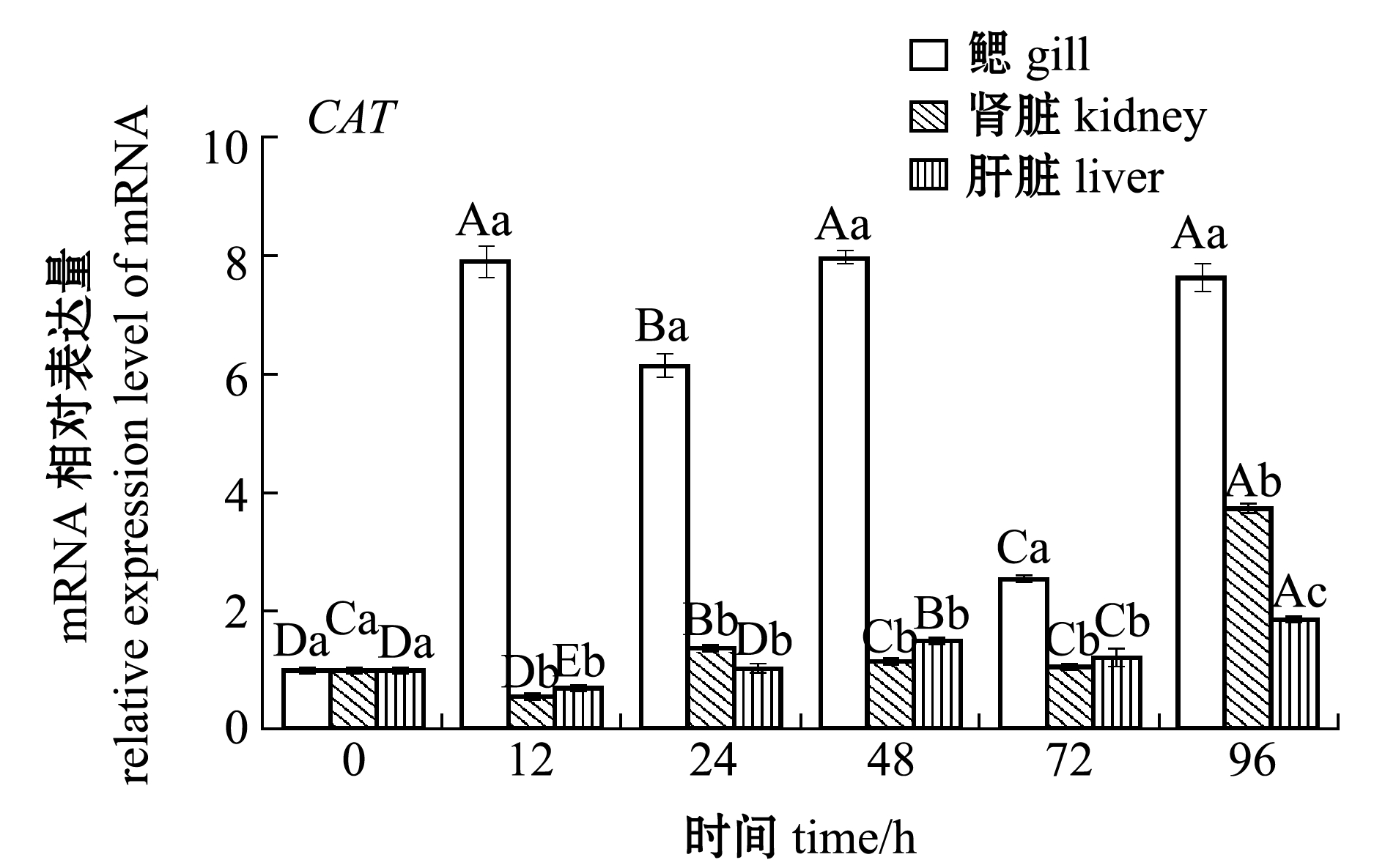
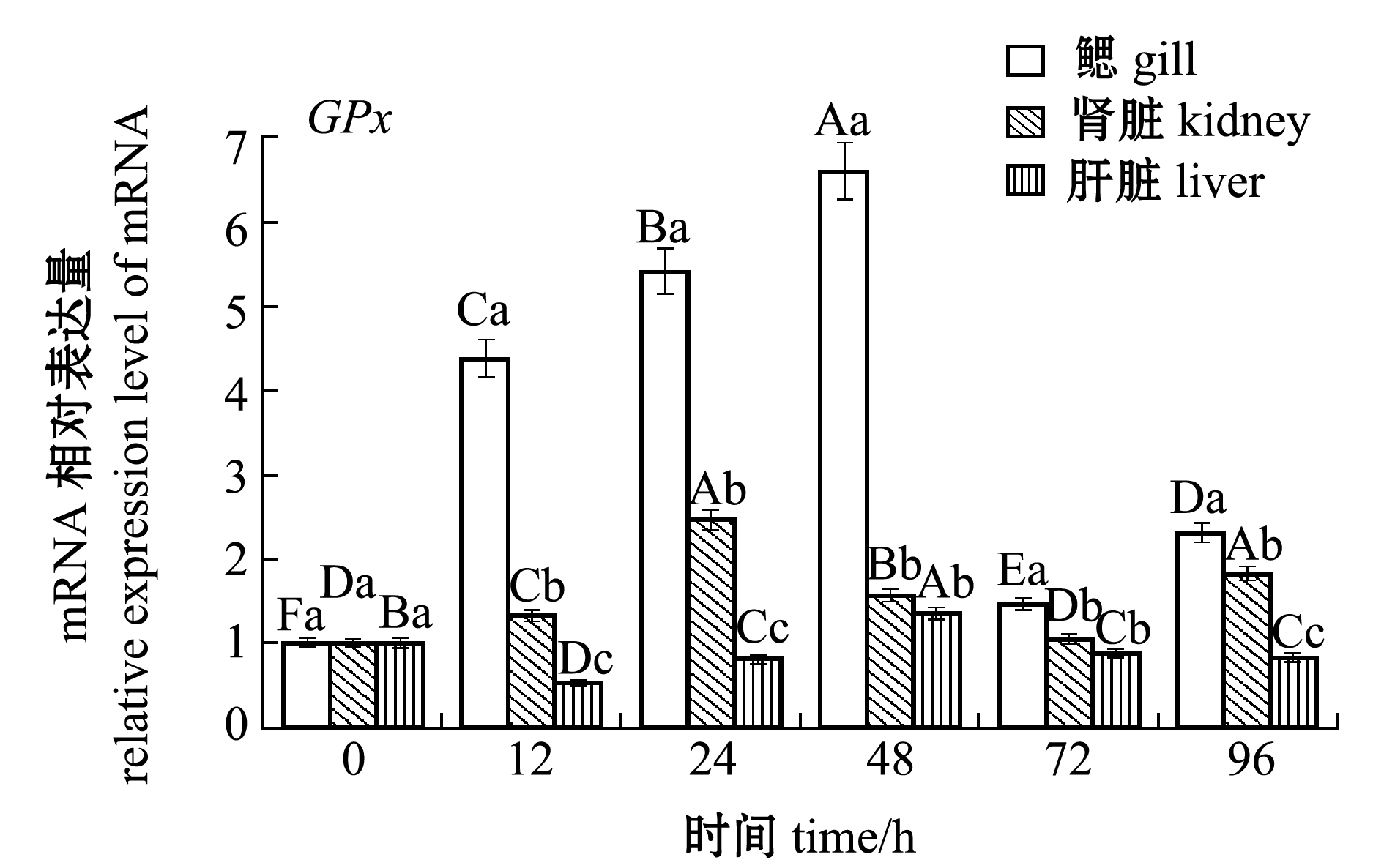
图2 Zn2+胁迫对花斑裸鲤CAT和GPx基因表达的影响
Fig.2 Effects of Zn2+ stress on the expression of CAT and GPx genes in eckloni naked carp Gymnocypris eckloni
在鳃中,Nrf2、Cu/Zn-SOD、Mn-SOD和CAT的表达量在胁迫12 h时即达到最高值,而GPx在胁迫48 h时才达到最高值;在肾脏中,Nrf2、Cu/Zn-SOD、Mn-SOD和CAT表达量在胁迫96 h时达到最高值,而GPx在胁迫24 h时即达到最高值;在肝脏中,Cu/Zn-SOD、Mn-SOD和CAT表达量在胁迫96 h时达到最高值,而Nrf2、GPx表达量分别在12、48 h即达到最高值(图1、图2)。
2.3 Zn2+胁迫下各基因的应答层次分析
从图3可见,在1.0 mg/L Zn2+胁迫下,随着胁迫时间的延长,花斑裸鲤鳃、肾脏和肝脏组织中各基因表现出不同的应答水平,并表现出组织特异性,即5种基因在3种组织中的表达量达到最高值所需要的时间各异,在3种组织中的表达量明显上调的关键基因的种类各异。
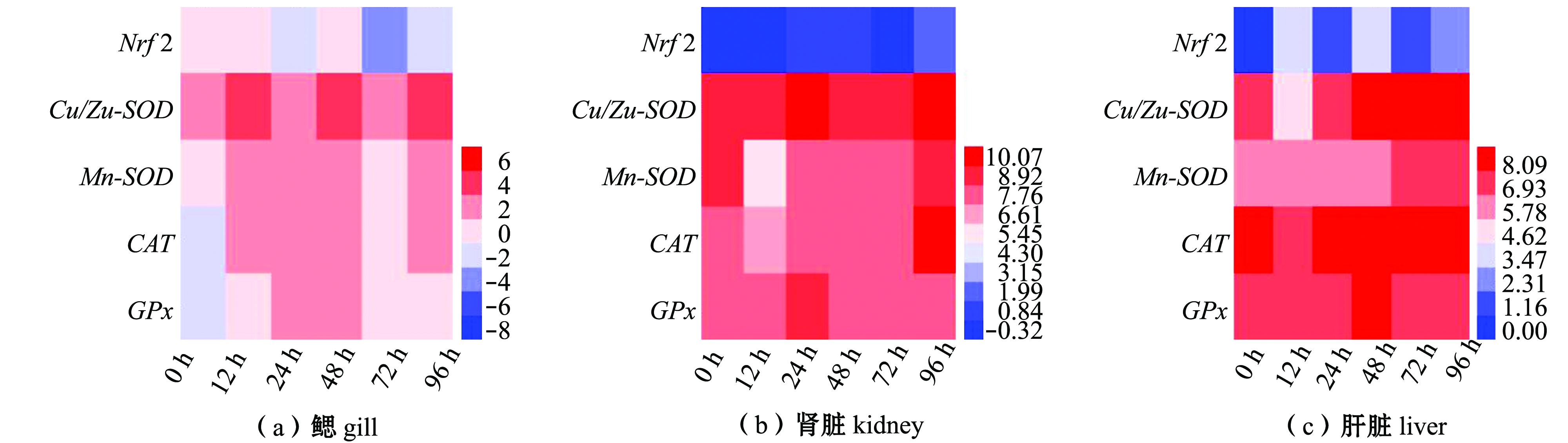
图3 Zn2+胁迫下花斑裸鲤鳃、肾脏和肝脏中Nrf2、Cu/Zn-SOD、Mn-SOD、CAT和GPx的mRNA表达量热图
Fig.3 Heatmap of mRNA expression levels of Nrf2,Cu/Zn-SOD,Mn-SOD,CAT and GPx in gill,kidney and liver of eckloni naked carp Gymnocypris eckloni exposed to Zn2+
从热图(图3)分析可知:在Zn2+胁迫96 h内,花斑裸鲤鳃组织中除了Nrf2基因总体表达水平上调不明显外,其他4个基因均有明显上调;在肾脏中,Nrf2总体表达水平低于其他4个基因,但是5个基因的变化幅度均不大;在肝脏中,Nrf2的总体表达量低于其他4个基因,但Nrf2和Cu/Zn-SOD、Mn-SOD基因的上调幅度最大。
这表明,与3种组织中Nrf2的4个下游基因表达量相比,Nrf2表达量相对较低,尤其在肾脏和肝脏组织中表现更为明显,但在鳃组织中,随着胁迫时间的延长,Nrf2表达量不仅未上调反而出现下调。Cu/Zn-SOD的表达量在3种组织中上调幅度最为明显,CAT和GPx的表达量在肝脏中上调的幅度最为明显。
2.4 Zn2+胁迫对花斑裸鲤组织抗氧化酶活性的影响
从图4可见,未经Zn2+胁迫的花斑裸鲤,SOD、CAT和GPx酶活性分别在鳃、肝脏和肾脏中最高,经Zn2+胁迫后3种酶在相应组织的最大值分别为对照组的1.19倍、1.90倍和1.27倍。
在Zn2+胁迫96 h之内,随着Zn2+胁迫时间的延长,花斑裸鲤鳃、肾脏和肝脏组织中SOD、CAT和GPx的酶活性均有升高,但升高幅度各异,酶活性变化趋势也不完全相同;Zn2+胁迫后,SOD酶活性上调的幅度在肾脏中胁迫72 h最大,为对照组的2.2倍,而在鳃和肝脏中SOD酶活性达最大值的时间分别为12、24 h,分别为对照组的1.19倍和1.6倍;CAT酶活性上调幅度在鳃中胁迫96 h时最大,为对照组的2.76倍,而在肝脏和肾脏中CAT酶活性达最大值的时间分别为24、48 h,分别为对照组的2.46倍和1.99倍;GPx酶活性上调幅度在鳃中胁迫48 h时最大,为对照组的20.93倍,而在肾脏和肝脏中GPx酶活性达最大值的时间分别为24、12 h,分别为对照组的2.08倍和1.26倍(图4)。
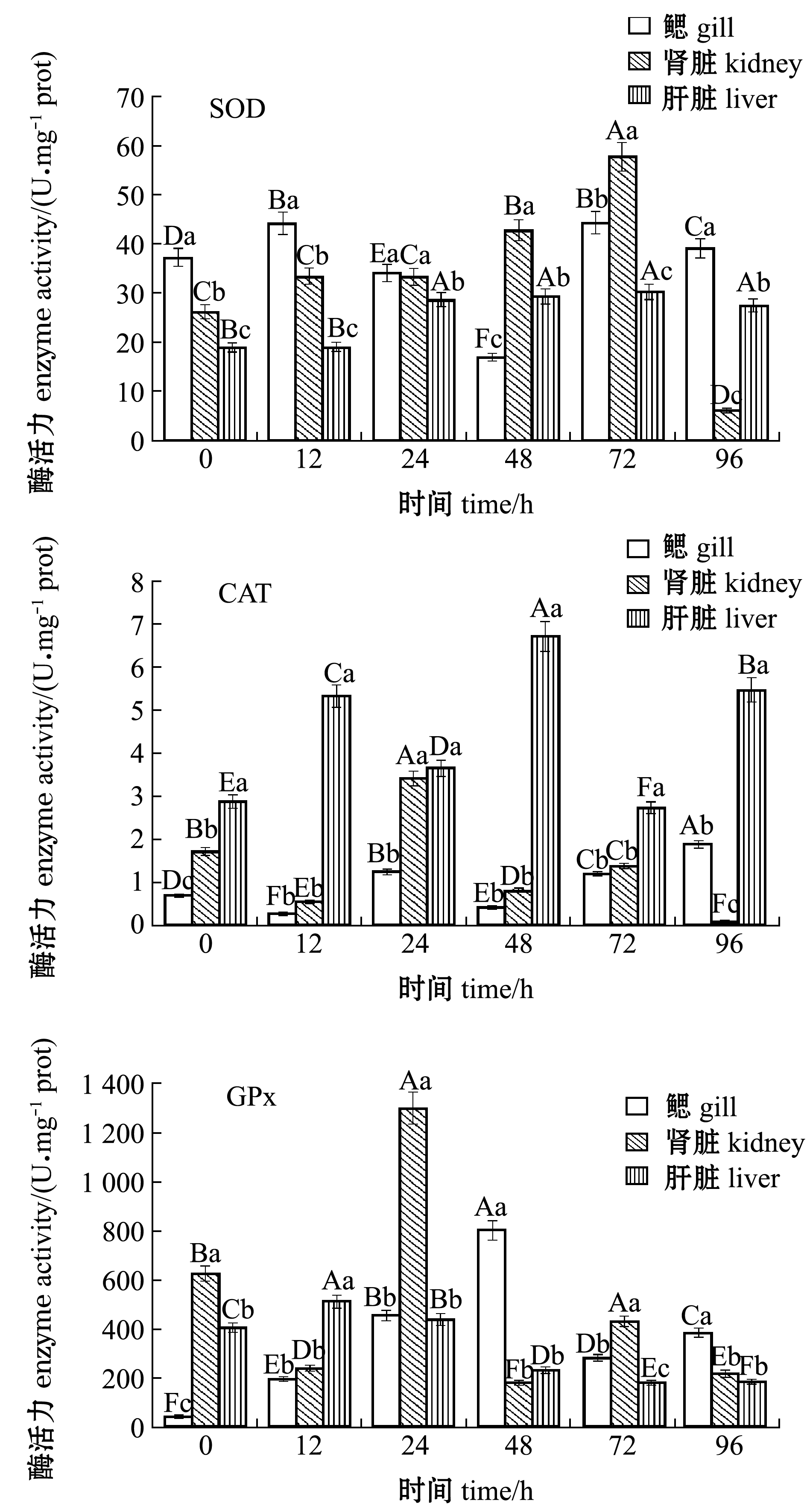
图4 Zn2+胁迫对花斑裸鲤组织中抗氧化酶活性的影响
Fig.4 Effects of Zn2+ stress on the antioxidant enzyme activities in the tissues of eckloni naked carp Gymnocypris eckloni
3 讨论
3.1 Zn2+对花斑裸鲤的急性毒性特征
研究表明,Zn2+对体质量为(5.97±0.84)g的黄姑鱼幼鱼Nibea albiflora胁迫24、48、72、96 h的半致死浓度分别为0.752 3、0.661 6、0.561 8、0.495 9 mg/L[22];Zn2+对七带石斑鱼Inepheluss eptemfasciatus初孵仔鱼胁迫24、48、72 h的半致死浓度分别为2.493、1.814、1.561 8、1.12 mg/L[23]; Zn2+对体质量为(13.10±0.30)g的锦鲤Cryprinus carpiod胁迫24、48、72、96 h的半致死浓度分别为140、118、104、93 mg/L[24]。本试验条件下,随着水体中Zn2+浓度的增加,花斑裸鲤的死亡率不断增加,Zn2+对体质量为(10±3)g的花斑裸鲤幼鱼胁迫24、48、72、96 h的半致死浓度分别为5.0、3.2、2.5、2.0 mg/L,由此可见,本试验中得到的各时段下的Zn2+半致死浓度与其他鱼种存在差异,可能与鱼类的种类、个体大小及对水环境中Zn2+的胁迫抵抗能力有关。本试验结果表明,花斑裸鲤对Zn2+胁迫表现出一定的耐受性,但是其耐受能力与锦鲤相差较大。
3.2 Zn2+胁迫后抗氧化关键基因表达水平的变化及应答层次
肝脏、鳃和肾脏是重金属污染鱼类的主要目标器官[25]。细胞内金属离子水平的调控机制主要包括金属的吸收(鳃)、储存和解毒(肝脏和肾脏)[26]。本研究中,花斑裸鲤被Zn2+胁迫96 h内,在鳃、肾和肝脏组织中抗氧化系统关键基因Nrf2、SOD、CAT和GPx的mRNA表达量均有增加,但关键基因表达量上调的幅度各异,这与Kim等[26]对暗纹东方鲀Takifugu obscurus和Cho等[27]对条石鲷Oplegnathus fasciatus受到重金属Cd胁迫,Moniruzzaman等[28]对卷须鲮Cirrhinus cirrhosus受到重金属Zn和Pb胁迫,以及斑马鱼Danio rerio[13]等鱼种暴露在重金属中的研究结果是一致的。本研究显示,Zn2+胁迫后Nrf2表达量在肝脏中的上调幅度最大是对照组的15.11倍,而Cu/Zn-SOD、Mn-SOD、CAT和GPx上调幅度均在鳃中最大,这表明,各基因表达对Zn2+胁迫具有组织特异性,不同组织通过不同基因的表达产生不同的抗氧化应激应答,从而发挥不同的解毒功能。
本研究显示,Zn2+胁迫下花斑裸鲤5种基因在3种组织中的表达量达到最高值所需要时间各异,在鳃和肝脏组织中Zn2+胁迫后,除了GPx外,Nrf2、Cu/Zn-SOD、Mn-SOD和CAT表达量均在胁迫12 h时达到最高值,而在肾脏中除了GPx外,Nrf2、Cu/Zn-SOD、Mn-SOD和CAT在胁迫后达到最高值的时间均为96 h。这表明,核转录因子Nrf2及其下游靶基因在鳃和肝脏中最先应答,而在肾脏中最晚应答,这表明鳃和肝脏是最重要的抗重金属离子胁迫的器官,这与Kim等[26]对暗纹东方鲀受到重金属Cd影响的结果一致,表明肝脏具有非常强的抗氧化防御系统,对鱼类起着关键的重金属解毒作用。
整体而言,花斑裸鲤Cu/Zn-SOD的mRNA应答水平最快且最强,CAT和GPx的mRNA水平上调比较缓慢,体现出SOD的歧化作用产生了过量的H2O2,从而促进CAT和GPx的mRNA水平显著升高,这与Giuliani等[29]对南极银鱼Pleuragramma antarctica中的研究结果相似。
花斑裸鲤在Zn2+胁迫96 h之内,一方面3个组织中Nrf2的表达量低于4个下游基因的表达量(图3),另一方面在受到Zn2+胁迫后,花斑裸鲤Nrf2的转录水平显著增加的趋势与其他抗氧化因子CAT、GPx和两个SOD的转录水平增加的趋势基本一致。这一结果与对草鱼Ctenopharyngodon idellus[17]受到饥饿胁迫时的研究结果相似,证实了该转录因子作为抗氧化剂激活因子在鱼类应对应激时的重要作用,此外,还体现出Nrf2在调节鱼类抗氧化防御系统激活中的作用来自转录和蛋白翻译间的功能应答[29]。在金属离子胁迫下核转录因子Nrf2的微量上调,通过细胞信号通路的级联放大作用而使得下游靶基因明显上调,同时通过不同基因在不同组织中的不同程度的信号放大,实现对金属离子胁迫的整体应答。
本研究条件下,Zn2+胁迫后,花斑裸鲤的鳃、肾脏和肝脏组织中抗氧化系统关键基因表达量均有增加,但在各组织中表达量上调的幅度、上调达到最大量所需的时间,以及在3种组织中表现出明显上调的基因种类都不尽相同,展示了关键基因应答的时间相关性和组织特异性。这表明,重金属会诱导刺激花斑裸鲤抗氧化防御系统的激活,使得相关抗氧化基因的转录水平显著升高,从而在分子层面揭示了鱼类对重金属的解毒机制。
研究者通常通过在不同水域设置监测断面,以检测出的水体重金属离子浓度来反映水质质量。但部分水域由于各种原因引起的某些重金属离子浓度的瞬时升高,以及重金属离子在水体的富集,对鱼类的健康尤其是繁殖方面的影响常常被忽略。而通过检测鱼体对重金属离子胁迫产生应答的关键基因的表达量,可更加直接地反映水体质量。
3.3 Zn2+胁迫对抗氧化关键酶活性的影响
重金属诱导下相关酶活性水平的变化,可进一步反映重金属胁迫下机体不同组织的应答能力。研究显示,斑马鱼在重金属Zn、Cd、Pb暴露下,SOD酶活性水平显著增加[30]。在对鲤Cyprinus carpio[11]进行Zn、Cd、Pb胁迫处理96 h后,在肝脏和肾脏中的抗氧化酶SOD、CAT和GPx活性水平显著升高。本研究中,花斑裸鲤受到Zn2+胁迫时,SOD、CAT、GPx 3种酶的活性在3种不同组织中均有不同程度的升高,酶活性达到的最高值、达到最高值的时间、酶的种类均各不相同。由此可见,在Zn2+胁迫下花斑裸鲤不同组织首先引起核转录因子Nrf2的上调导致相应的下游靶基因表达量升高,酶活性也相应升高,即通过从基因mRNA水平上调到酶活性提升,从而实现整体应答。以上研究表明,鱼类面对重金属危害会激活抗氧化防御系统,导致抗氧化基因表达量和酶活性的升高,从而保护机体免受氧化应激带来的损伤。
4 结论
1)不同浓度、不同时间的Zn2+胁迫对花斑裸鲤幼鱼的毒性作用是明显的。以1、2、5、10、20 mg/L为Zn2+胁迫浓度, 得到Zn2+对体质量为(10±3)g 花斑裸鲤幼鱼胁迫24、48、72、96 h的半致死浓度分别为5.0、3.2、2.5、2.0 mg/L,安全浓度为0.2 mg/L。
2)重金属会诱导刺激花斑裸鲤抗氧化防御系统的激活,使得相关抗氧化基因的转录水平显著升高,从而在分子层面揭示了鱼类对重金属的解毒机制。Zn2+胁迫下花斑裸鲤鳃、肾脏和肝脏组织中抗氧化核转录因子Nrf2及抗氧化酶基因SOD、CAT和GPx的转录水平均显著升高,且Zn2+使得抗氧化酶SOD、CAT和GPx活性升高。
3)抗氧化核转录因子Nrf2及其下游靶基因表达和酶活性的增加,展示了不同的胁迫应答机制,表现为应答层次上的组织特异性。这提示,可以通过检测Zn2+胁迫的抗氧化关键基因及其酶活性来提前预警水体环境质量。
[1] 吴鼎勋,洪万树.四种重金属对鮸状黄姑鱼胚胎和仔鱼的毒性[J].台湾海峡,1999,18(2):186-190.
[2] 杨再福,印惠君.重金属汞和钴对草鱼卵子孵化的影响[J].农业环境保护,2002,21(1):79-80.
[3] 姚纪花,周平凡.铜、锌和甲胺磷对大鳞副泥鳅胚胎发育和仔鱼成活的影响[J].上海水产大学学报,1997,6(1):11-16.
[4] 陈国柱,方展强.铜、锌、镉对唐鱼胚胎及初孵仔鱼的急性毒性及安全浓度评价[J].生物学杂志,2011,28(2):28-31.
[5] 关海红,蔺玉华,刘伟.汞在松浦鲤体内的转化及对鳃组织的损伤[J].大连水产学院学报,2004,19(1):58-61.
[6] 丁爱侠,王春琳.硫酸铜蓄积对日本归去鲟4种组织细胞超微结构的影响观察[J].南方水产,2010,6(2):21-28.
[7] 唐建勋,唐奕扬,程樟顺,等.Pb2+、Cu2+在黄颡鱼性腺中的富集及其对性腺发育的胁迫[J].水资源保护,2012,28(4):61-63,77.
[8] 李宏,潘晓洁,万成炎,等.重金属对鱼类的生态毒理学研究进展[J].水生态学杂志,2019,40(5):104-111.
[9] SONG Z X,JIANG W D,LIU Y,et al.Dietary zinc deficiency reduced growth performance,intestinal immune and physical barrier functions related to NF-κB,TOR,Nrf2,JNK and MLCK signaling pathway of young grass carp (Ctenopharyngodon idella)[J].Fish and Shellfish Immunology,2017,66(1):497-523.
[10] JAROSZ M,OLBERT M,WYSZOGRODZKA G,et al.Antioxidant and anti-inflammatory effects of zinc. Zinc-dependent NF-κB signaling[J].Inflammopharmacology,2017,25(1):11-24.
[11] BHANU A P.Studies on the influence of heavy metals on antioxidant system in the tissues of freshwater fish Cyprinus carpio[J].International Journal of Research in Engineering and Applied Sciences,2016,6(5):11-14.
[12] SIMMONS S O,FAN C Y,YEOMAN K,et al.NRF2 oxidative stress induced by heavy metals is cell type dependent[J].Current Chemical Genomics,2011,5:1-12.
[13] HAN W,MING M,ZHAO R,et al.Nrf1 CNC-bZIP protein promotes cell survival and nucleotide excision repair through maintaining glutathione homeostasis[J].Journal of Biological Chemistry,2012,287(22):18788-18795.
[14] YIN J,WANG A P,LI W F,et al.Time-response characteristic and potential biomarker identification of heavy metal induced toxicity in zebrafish[J].Fish & Shellfish Immunology,2018,72:309-317.
[15] 聂慧芳,李冰.核转录因子Nrf2信号通路在环境毒物暴露中的作用研究进展[J].环境与健康杂志,2015,32(2):179-182.
[16] LUSHCHAK V I,SEMCHYSHYN H M,LUSHCHAK O V.The classic methods to measure oxidative damage:lipid peroxides,thiobarbituric-acid reactive substances,and protein carbonyls[M]//ABELE D,V ZQUEZ-MEDINA J P,ZENTENO-SAV
ZQUEZ-MEDINA J P,ZENTENO-SAV N T.Oxidative stress in aquatic ecosystems.Malden:Blackwell Publishing Ltd,2012:420-431.
N T.Oxidative stress in aquatic ecosystems.Malden:Blackwell Publishing Ltd,2012:420-431.
[17] GAN L,JIANG W D,WU P,et al.Flesh quality loss in response to dietary isoleucine deficiency and excess in fish:a link to impaired Nrf2-dependent antioxidant defense in muscle[J].PLoS One,2014,9(12):e115129.
[18] STANKOVIC S,KALABA P,STANKOVIC A R.Biota as toxic metal indicators[J].Environmental Chemistry Letters,2014,12(1):63-84.
[19] QI D L,CHAO Y,ZHAO L Y,et al.Complete mitochondrial genomes of two relatively closed species from Gymnocypris (Cypriniformes:Cyprinidae):genome characterization and phylogenetic considerations[J].Mitochondrial DNA,2013,24(3):260-262.
[20] 申志新,王国杰,杨成,等.青海省花斑裸鲤现状及保护对策[J].青海农牧业,2011(2):17-19.
[21] 郑行泉.重金属铜对动物的急性毒性试验[J].福建畜牧兽医,2018,40(5):14-16.
[22] 王志铮,刘祖毅,吕敢堂,等.Hg2+、Zn2+、Cr6+对黄姑鱼幼鱼的急性致毒效应[J].中国水产科学,2005,12(6):745-750.
[23] 孔祥迪,陈超,李炎璐,等.Cu2+、Zn2+、Pb2+对七带石斑鱼(Epinephelus septemfasciatus)胚胎和初孵仔鱼的毒性效应[J].渔业科学进展,2014,35(5):115-121.
[24] 贺诗水,王洪凯.锌离子对锦鲤的急性毒性及安全浓度评价[J].广东农业科学,2010,37(7):147-148.
[25] AL-GHANIM K A,ABDELATTY M,ABDELFATTAH L,et al.Differential uptake of heavy metals by gill,muscles and liver of four selected fish species from red sea[J].Pakistan Journal of Zoology,2015,47(4):1031-1036.
[26] KIM J H,RHEE J S,LEE J S,et al.Effect of cadmium exposure on expression of antioxidant gene transcripts in the river pufferfish,Takifugu obscurus (Tetraodontiformes)[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2010,152(4):473-479.
[27] CHO Y S,CHOI B N,KIM K H,et al.Differential expression of Cu/Zn superoxide dismutase mRNA during exposures to heavy metals in rockbream (Oplegnathus fasciatus)[J].Aquaculture,2006,253(1/2/3/4):667-679.
[28] MONIRUZZAMAN M,MIDDAY P,DHARA A,et al.Change in redox state and heat shock protein expression in an Indian major carp Cirrhinus cirrhosus exposed to zinc and lead[J].The Journal of Toxicological Sciences,2017,42(6):731-740.
[29] GIULIANI M E,BENEDETTI M,NIGRO M,et al.Nrf2 and regulation of the antioxidant system in the Antarctic silverfish,Pleuragramma antarctica:adaptation to environmental changes of pro-oxidant pressure[J].Marine Environmental Research,2017,129:1-13.
[30] CEMPEL M,NIKEl G.Nickel:a review of its sources and environmental toxicology[J].Polish Journal of Environmental Studies,2006,15(3):375-382.