弧菌病是海水养殖动物的重要病害之一,给海水鱼、虾和贝类养殖带来了严重危害。目前,针对弧菌病的生物防控,研究人员已发现有多种微生物对弧菌具有拮抗活性[1-3],其中,杀鱼假交替单胞菌 Pseudoalteromonas piscicida 是极具开发潜力的一种菌,该菌不仅抗菌谱广[4],而且还可提高动物的免疫力,将杀鱼假交替单胞菌用于养殖期对虾及贝类也表现出良好的生物安全性[5-6]。然而也有研究显示,有些杀鱼假交替单胞菌分离株可感染克氏双锯鱼Amphiprion clarkii卵,导致其存活率较低[7]。乔毅等[8]报道,一株与杀鱼假交替单胞菌同源性较近的菌株对黑鲷表现出一定的致病性。
细菌毒性来自其含有的内外毒素,内毒素主要为细菌脂多糖[9],外毒素种类较多,按照作用的靶组织,分为细胞毒素、神经毒素和肠毒素[10]。假交替单胞菌多为海洋菌株,其内毒素毒性通常较低[11],但研究发现,有些假交替单胞菌可分泌细胞毒素,诱导白血病细胞凋亡或溶血[12-13],而有些种类能够分泌神经毒性的河豚毒素[14],目前对杀鱼假交替单胞菌的毒性研究尚未见报道。本研究中,针对前期筛选出的一株具有广谱弧菌拮抗特性的杀鱼假交替单胞菌,测试了其对中国明对虾Fenneropenaeus chinensis受精卵及幼体发育的影响,以及对凡纳滨对虾Litopenaeus vannamei、鱼及羊血细胞的溶血活性,为去除其潜在毒性,还探讨了热处理对菌株灭活、溶血活性和抗菌物质活性的影响,以期为该菌的开发应用提供技术及方法支撑。
1 材料与方法
1.1 材料
试验用中国明对虾受精卵、无节幼体和蚤状幼体由中国水产科学研究院下营增殖实验站提供。
杀鱼假交替单胞菌2515(简称菌株2515)、地衣芽孢杆菌 Bacillus licheniformis、对照组假交替单胞菌2905(简称菌株2905)和金黄色葡萄球菌 Staphylococcus aureus 均由农业农村部海水养殖病害防治重点实验室保存。TCBS培养基、羊血平板均购自北京路桥技术股份有限公司。
1.2 方法
1.2.1 培养基及血平板制备 TCBS培养基:配制方法参照说明书。2216E培养基:胰蛋白胨5 g、酵母膏1 g、FePO4·4H2O 0.01 g、琼脂粉16 g(固体培养基)、陈海水1 L,pH 7.8,121 ℃高压灭菌15 min。
鱼血平板制备:用无菌注射器抽取大菱鲆尾静脉血液,置入等体积的阿氏液(Na3C6H5O7·2H2O 1.60 g、C6H8O7 0.11 g、C6H12O6 4.10 g、NaCl 0.84 g、蒸馏水200 mL,pH 6.1,115 ℃灭菌30 min)轻轻摇匀备用。将灭菌后的2216E固体培养基冷却至40~50 ℃时,加入10%的鱼血备用液,摇匀后倒平板。
1.2.2 菌液制备 将菌株2515和地衣芽孢杆菌分别接种于2216E固体平板,于28 ℃下培养活化后再接种到液体培养基中,在28 ℃ 下以150 r/min摇床培养24 h,菌液经过6 000×g离心10 min,将沉淀用海水稀释成1×109 CFU/mL菌悬液,4 ℃下冷藏带到试验场地,根据试验设计浓度稀释后使用。
1.2.3 菌株2515对中国明对虾受精卵孵化及幼体发育成活影响试验
1)幼体成活试验。试验用对虾育苗袋(直径25 cm,高40 cm)132个,分别加入经过消毒杀菌处理的育苗用海水2 L作为试验水体。根据幼体发育阶段设置3个试验,分别测试菌株2515对中国明对虾虾受精卵孵化至无节幼体Ⅲ期(N3)、N3发育至蚤状幼体Ⅰ期(Z1)、蚤状幼体Ⅱ期(Z2)发育至糠虾幼体Ⅰ期(M1)成活率的影响,每个试验均设置地衣芽孢杆菌阳性对照组及空白对照组,菌株2515及地衣芽孢杆菌均设置105、106、107、108 CFU/mL 4个浓度,每个浓度设3组平行。虾受精卵孵化至N3期试验中,每个袋投入中国明对虾受精卵800个;N3至Z1期、Z2至M1期试验中,每个袋中投入相应期别的幼体40个。在受精卵孵化至N3期、 N3发育至Z1期试验中,试验水体中不添加任何饵料;Z2发育至M1期试验中,每袋添加卤虫幼体600个,经充氧气后打包,放在育苗池中水浴。受精卵孵化期、N3发育至Z1期、Z2发育至M1期的温度分别控制在17、20、23 ℃,试验用海水pH 7.8、盐度30。在各期试验结束后,将试验袋内幼体用网目为125 μm的筛绢网过滤到烧杯中逐尾计数,并统计成活率:
成活率=试验结束时存活数量/试验初始投放数量×100%。
2)幼体发育观察。中国明对虾受精卵孵化至N3期时,从各组随机挑出无节幼体5尾,通过光镜观察幼体体表、附肢和活力情况,评价菌株2515对幼体发育的影响。
1.2.4 溶血试验
1)血平板溶血观察。刮取菌株2515、金黄色葡萄球菌及菌株2905的2216E平板菌落,分别用PBS制成浓度为109 CFU/mL的菌悬液,各取5 μL等距点种在羊血琼脂和鱼血琼脂平板上,每种菌株设3个重复。28 ℃恒温培养箱培养48 h,观察溶血情况。
2)虾细胞溶血显微观察。从凡纳滨对虾Litopenaeus vannamei围心腔抽取血液淋巴与等体积的阿氏液混合作为对虾血细胞悬液,取5 μL对虾血细胞悬液与等体积的菌株2515发酵液(浓度108 CFU/mL)混合后,滴加在载玻片上,改好盖玻片,置于湿盒中4 ℃条件下计时存放,显微镜下间隔1 h观察1次虾血细胞的溶血情况,并设置生理盐水及大菱鲆血细胞对照组。
1.2.5 热处理对菌株2515的灭活效果 取发酵24 h的菌株2515发酵液,用PBS稀释成103 CFU/mL,分装到6个无菌的1.5 mL离心管中,每管400 μL,分别置于40、45、50、55、60、65 ℃的水浴锅中加热处理1 h,空白组常温放置1 h,之后从每管取100 μL涂布于2216E平板。每个样品设3个平行,28 ℃下培养,观察有无菌落形成,统计菌落数量。
1.2.6 热处理后菌株2515的溶血活性 取“1.2.5节”中经40 ℃和55 ℃不同时间热处理后的菌株2515处理液,按照“1.2.4”节中血平板溶血观察方法,点种在鱼血与羊血平板上,观察处理液的溶血活性。
1.2.7 热处理对菌株2515抑菌活性的影响 取菌株2515发酵液(浓度3.9×109 CFU/mL)110 mL,以5 000×g离心10 min,弃上清,将沉淀用PBS洗涤2次后,加50 mL PBS重悬,用超声波细胞破碎仪超声破碎10 min(300 W),至菌液澄清。将澄清的菌液经0.22 μm孔径的细菌过滤器过滤,之后置于平皿中-20 ℃下真空干燥12 h。再用20 mL PBS将干燥后的产物洗脱混匀,之后分装到无菌1.5 mL离心管中(每管0.2 mL),分别在40、45、50、55、60、65、75 ℃水浴锅中进行温浴处理,每个温度设置15、30、45、60 min 4个处理时间段,对照组常温放置,每组设3个平行。完成热处理后参照李萍等[15]的方法进行抑菌活性测定,测试用2216E平板含有鳗弧菌Vibrio anguillarum浓度为107 CFU/mL,经28 ℃培养24 h后,用游标卡尺十字交叉法测量抑菌圈直径,根据抑菌圈直径大小计算菌株2515抗菌活性物质的抑菌活性增长率,即
抑菌活性增长率=(De-D0)/D0×100%。
其中,De、D0分别为试验组和对照组抑菌圈直径。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示。采用SPSS 16.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 菌株2515对中国明对虾幼体发育的影响
从图1可见:相同浓度组中,添加菌株2515与添加地衣芽孢杆菌阳性对照组无节幼体的成活率均无显著性差异(P>0.05);在所有试验组中,添加浓度为105 CFU/mL 2515菌株的幼体成活率最高,显著高于添加浓度为106、108 CFU/mL的地衣芽孢杆菌组(P<0.05),也显著高于添加浓度107 、108 CFU/mL的菌株2515组(P<0.05);空白对照组与各浓度组均无显著性差异(P>0.05)。显微观察各组无节幼体的外形特征,可见各试验组无节幼体活力较好,体表干净,附肢发育正常,未出现弯曲现象。这表明,所选择的浓度范围内,菌株2515对中国明对虾受精卵孵化至N3期的成活率无明显影响。
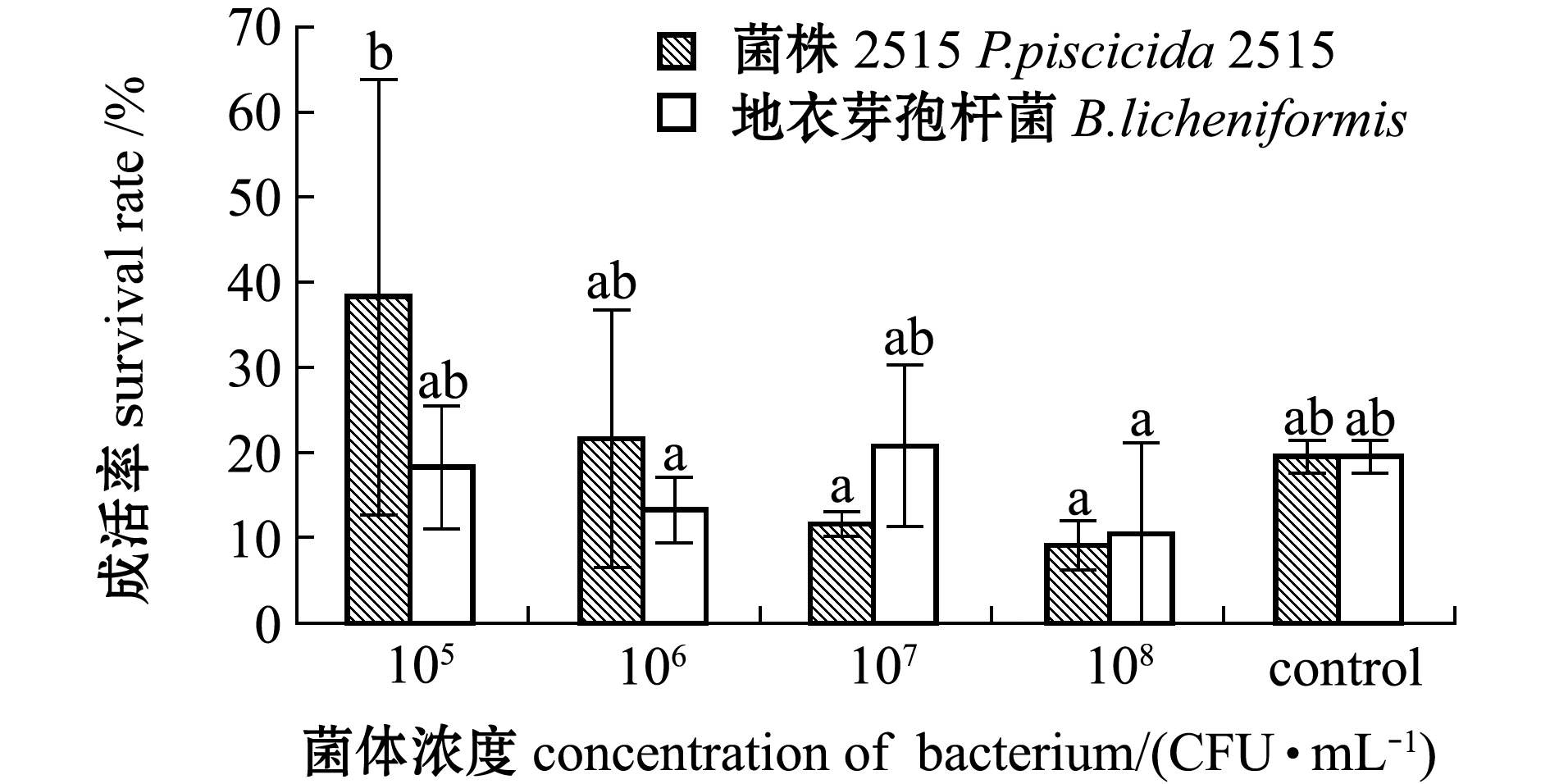
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 卵孵化至N3期的成活率
Fig.1 Survival rate of larvae from egg to nauplius Ⅲ (N3)
从图2可见:各浓度组对虾的成活率差别较大,相同浓度组中,添加菌株2515与添加地衣芽孢杆菌阳性对照组的成活率中仅浓度为105 CFU/mL的组与空白对照组无显著性差异(P>0.05),其他组均显著低于空白对照组(P<0.05),而添加浓度为106、107 CFU/mL的两组中,添加2515菌株的对虾成活率显著低于添加地衣芽孢杆菌组(P<0.05);在所有添加菌株2515的组中,随着添加浓度的升高对虾的存活率呈降低趋势。这表明,在本试验条件下,菌株2515浓度高于105 CFU/mL时对中国明对虾由N3期发育至Z1期有显著性影响,可显著降低无节幼体变态发育至蚤状幼体的成活率。
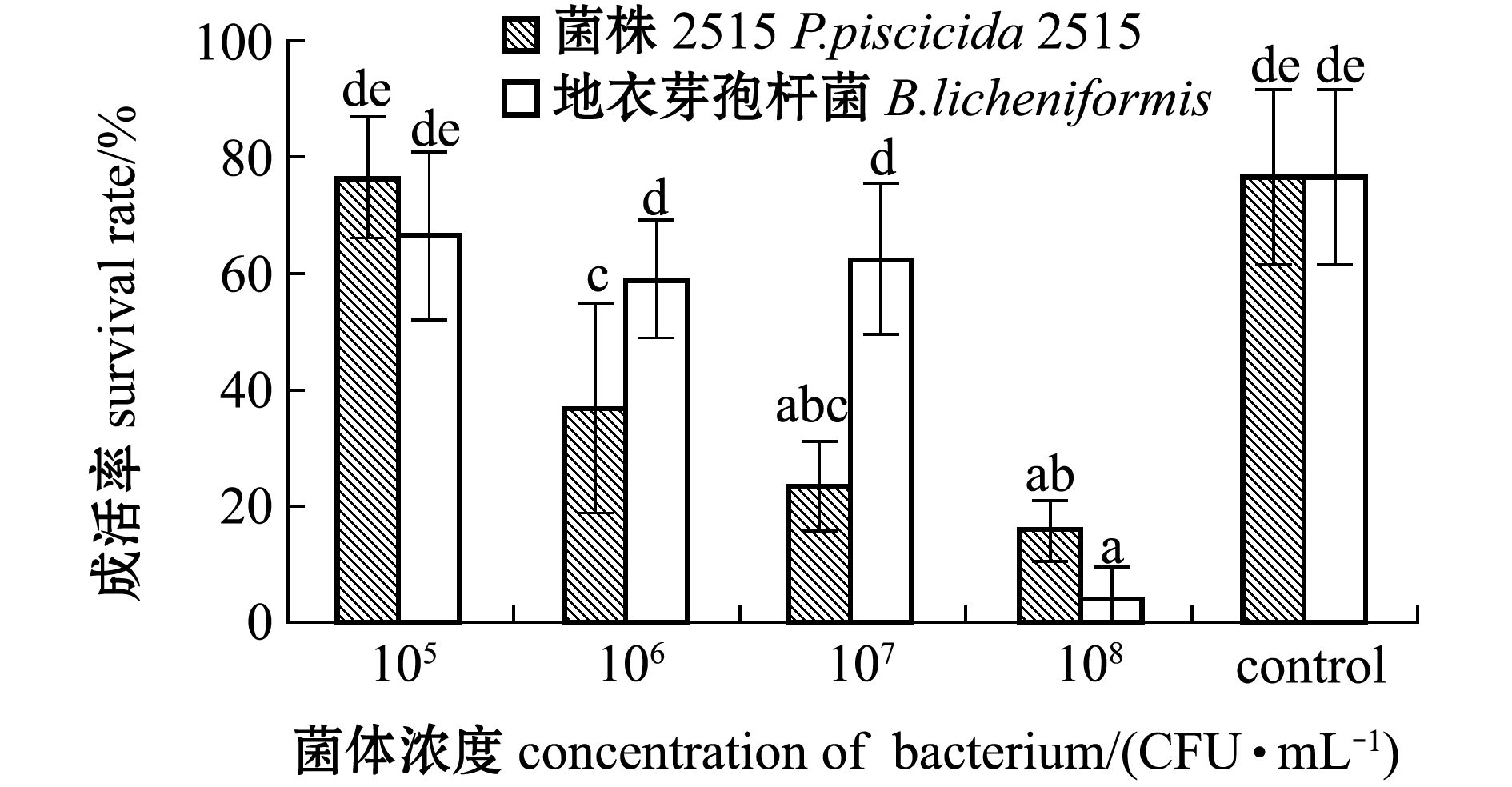
图2 N3到Z1期变态成活率
Fig.2 Metamorphosis survival rate of larvae from N3 to zoeaⅠ (Z1)
从图3可见,各试验组与添加地衣芽孢菌组及空白对照组的对虾成活率均无显著性差异(P>0.05)。

图3 Z2到M1期变态成活率
Fig.3 Metamorphosis survival rate of larvae from Z2 to mysisⅠ (M1)
2.2 菌株2515的溶血性
从图4可见,菌株2515在两种血平板上均具有溶血活性,阳性对照组金黄色葡萄球菌在羊血平板上产生溶血,对照组假交替单胞菌株2905在羊血平板上未产生溶血,而在鱼血平板上产生溶血。
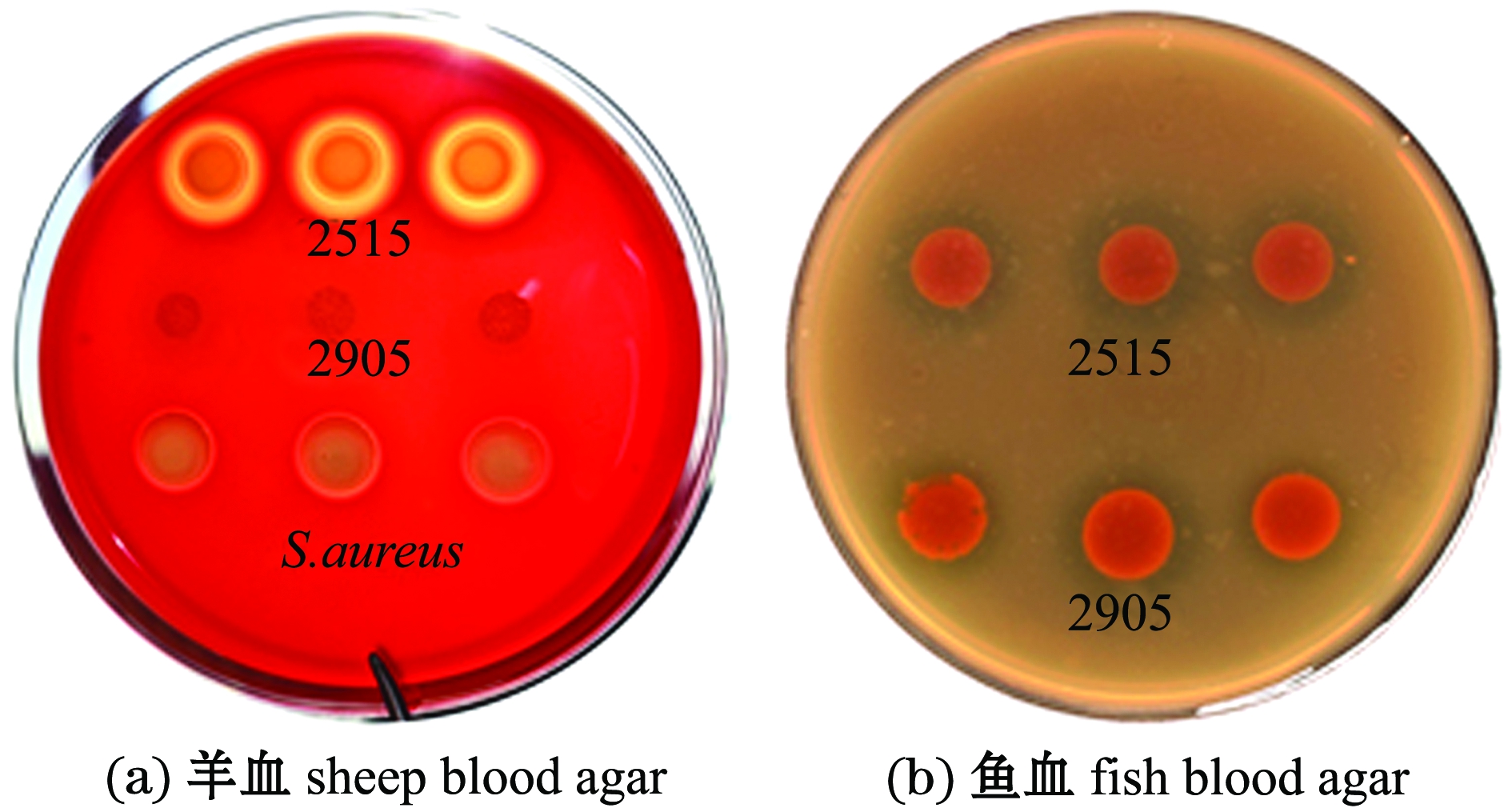
图4 菌株2515对羊血和鱼血的溶血情况
Fig.4 Hemolysis effect of strain 2515 on sheep and fish blood
大菱鲆血细胞试验组,在加入菌株2515 3 h后,红细胞出现细胞膜溶解(图5C),胞内物质固缩变形,有些趋于解体,白细胞则不发生溶血,而大菱鲆生理盐水对照组放置18 h后(图5B),白细胞及红细胞的形态仍然完整;对虾血细胞试验组(图5G)与对虾生理盐水对照组(图5F)中,在加入菌株2515及生理盐水18 h时,两组对虾血细胞形态相似,细胞的形态均趋于收缩变圆,但外形完整,未出现溶血现象。
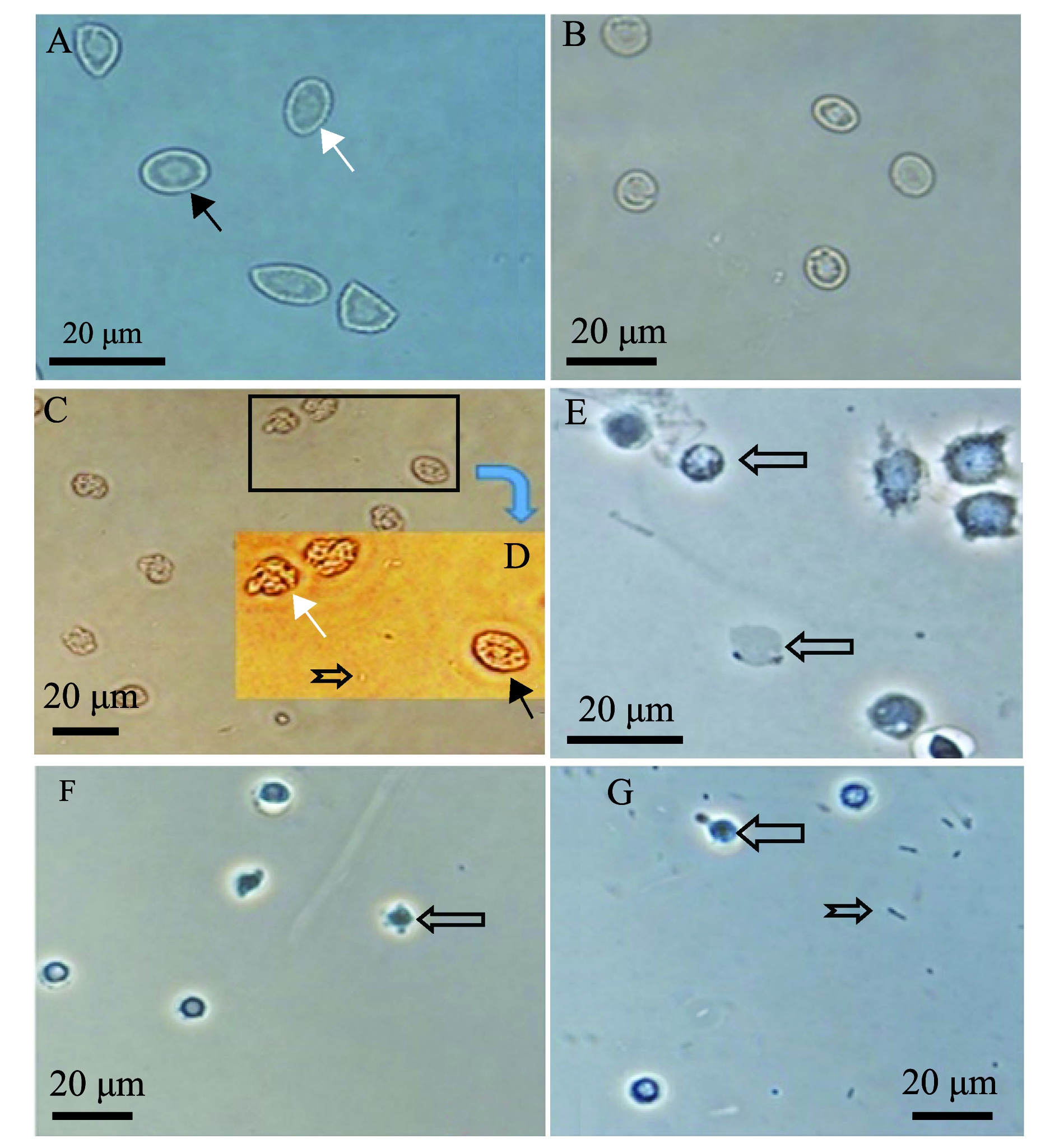
A—试验开始前大菱鲆血细胞;B—在生理盐水中18 h的大菱鲆血细胞;C—在菌液中3 h的大菱鲆血细胞;D—图C中方框区域的放大图片;E—溶血开始前虾血细胞;F—在生理盐水中18 h的虾血细胞;G—在菌液中18 h的虾血细胞。图中白色箭头为大菱鲆红细胞;黑色箭头为大菱鲆白细胞;左向空心箭头为不同类型虾血细胞;鱼尾箭头为菌体。
A—blood cells of turbot before hemolysis test;B—blood cells of turbot in normal saline in 18 h;C—blood cells of turbot in strain 2515 solution in 3 h;D—enlarged picture of the insert in figure C;E—blood cells of shrimp before hemolysis;F—blood cells of shrimp in normal saline in 18 h;G—blood cells of shrimp in strain 2515 solution in 18 h.White arrow shows red blood cells of turbot; black arrow shows white blood cells of turbot; left hollow arrow shows blood cells of different types of shrimp;tail arrow shows bacteria.
图5 菌株2515对中国明对虾血细胞溶血的显微照片
Fig.5 Micrograph of hemolysis of strain 2515 on Chinese shrimp blood cells
2.3 热处理对菌株2515的灭活效果
菌株2515经不同温度灭活1 h后,涂布于2216E平板培养,发现40 ℃处理组中,平板上菌株2515菌落数与未处理组数量相近,分别为(88±12)CFU/平板与(90±8)CFU/平板,在45 ℃处理组中2515菌落数为(77±5)CFU/平板,而在50、55、60、65 ℃处理组平板上,无细菌生长,表明50 ℃热处理1 h即可将该菌灭活。
2.4 热处理后菌株2515的溶血活性
破碎液经40、55 ℃处理15~60 min后,各组破碎液失去对鱼红细胞溶血作用(图6A、B),而对羊红细胞的溶血效果依然保持较高的活性(图6C、D)。
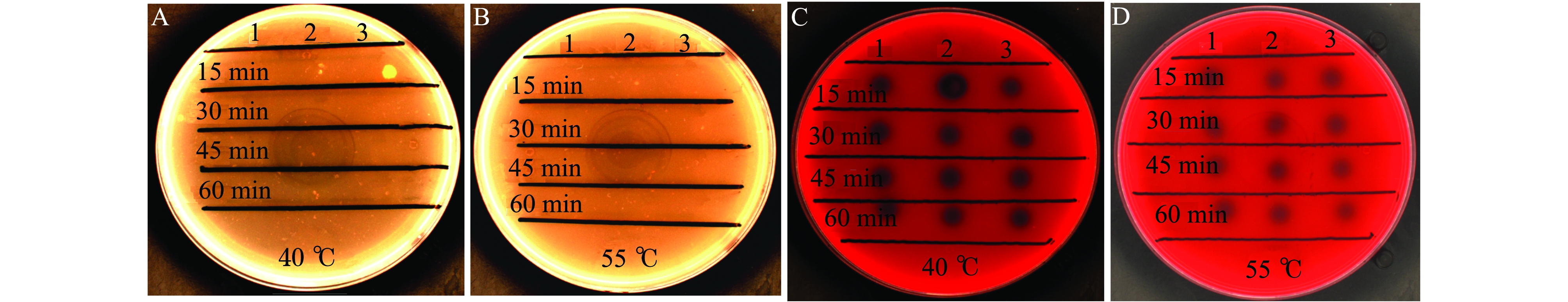
A、B—40、55 ℃处理组大菱鲆血平板;C、D—40、55 ℃处理组羊血平板。
A and B—turbot blood agar plate at 40 ℃ and 55 ℃; C and D—sheep blood agar plate at 40 ℃ and 55 ℃.
图6 热处理后菌株2515对鱼血和羊血的溶血活性
Fig.6 Hemolytic activity of sheep and fish blood by strain 2515 exposed to heat treatment
2.5 热处理对菌株2515抑菌活性的影响
从图7、图8可见:当处理温度为40~65 ℃时,各处理时间组的抑菌活性均比对照组高,但抑菌活性存在差别;当温度为55 ℃时,抑菌活性增长最高,随着处理时间从15 min增加到60 min,抑菌活性增长率由46.1%提高到55.8%;当温度为65 ℃时,处理15 min活性增加最高,达到33.3%,之后随时间延长而降低;当温度为75 ℃时,处理15 min即可降低抑菌活性,处理45 min时即可使抑菌活性完全失活,增长率达到-100%。

图7 菌株2515在不同温度下灭活不同时间对鳗弧菌的抑菌效果
Fig.7 Antibacterial effect of strain 2515 inactivated at different temperatures for different time on Vibrio anguillarum
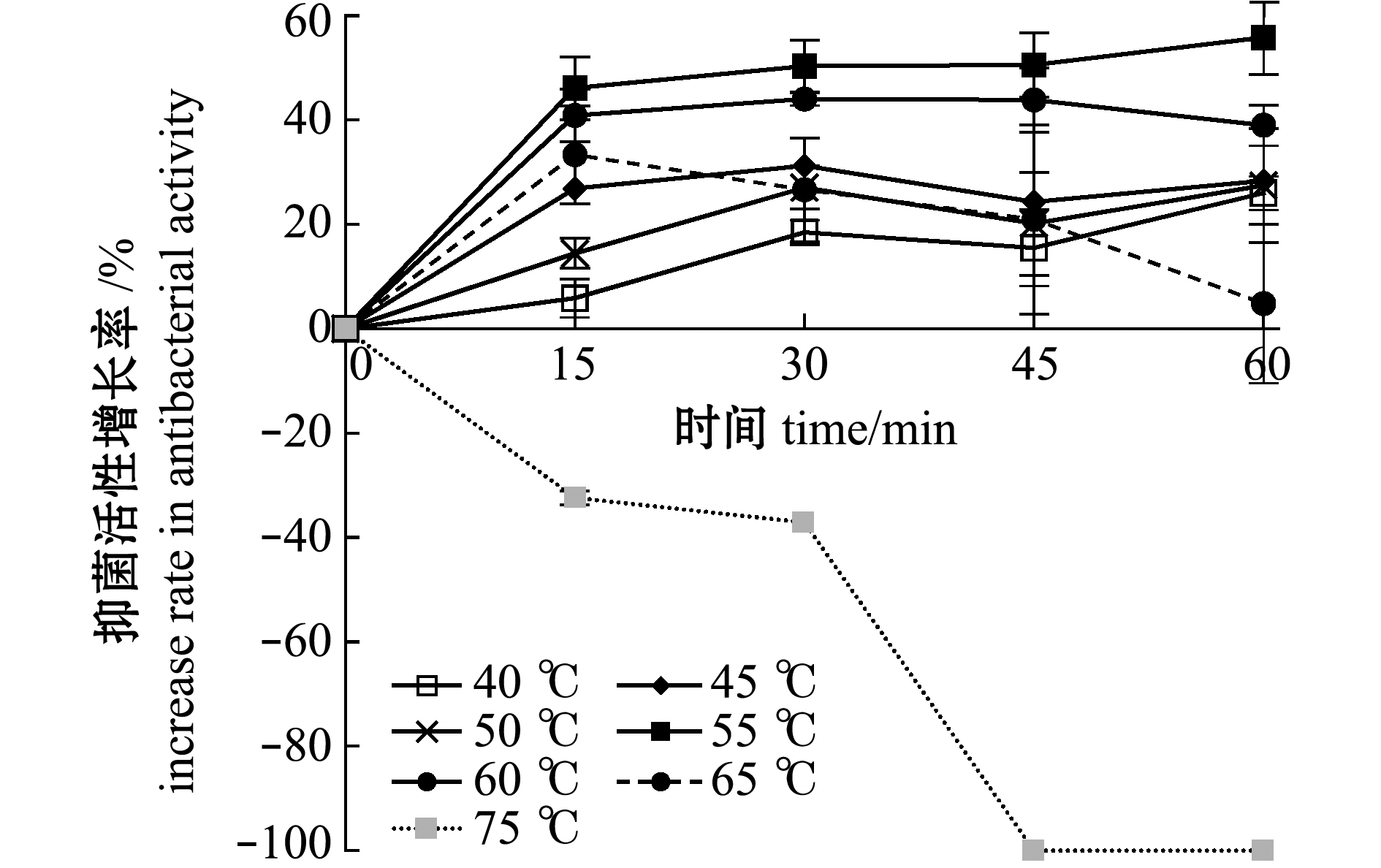
图8 热处理菌株破碎液后抑菌物质活性的增长率
Fig.8 Increase rate of antibacterial activity of strains 2515 crushing solution treated with different temperatures
3 讨论
3.1 杀鱼假交替单胞菌生物学功能
目前,已发现假交替单胞菌属细菌中有20余种能够产生活性物质,其功效包括降解琼胶、抗细菌、抗真菌、杀菌、促进水生动物幼体附着等[16]。杀鱼假交替单胞菌作为其中的一个种,不仅能分泌广谱抗菌活性物质[17],还可产生蛋白酶、脂肪酶、淀粉酶和甘露糖酶,用该菌作益生菌并通过卤虫作为载体投喂对虾幼体,能够提高对虾生长率、存活率和肠道总菌数[18]。菌株2515是从对虾养殖池分离出的一株杀鱼假交替单胞菌[4],该菌株具有广谱抗弧菌特性,而对其生物安全性尚未有系统研究。本研究中,初步确定了该菌对鱼类的溶血毒性及对中国明对虾幼体的潜在毒性,获得了对已知毒素的热减毒方法,而对其潜在的其他毒性物质种类及致病力尚需后续开展研究。
3.2 菌株2515的溶血素及其热稳定性
溶血素为细菌的外毒素,种类较多,其均为单链多肽蛋白,溶血素的溶血活性是衡量细菌毒力的因子之一,根据溶血素结构、其与细胞结合的方式及形成孔道的机制等不同,可将溶血素分为重复子毒素家族和硫醇活性胆固醇结合细胞溶血素家族[19]。溶血素可导致细胞溶解或裂解、细胞膜损伤等病变,进一步导致细胞内钠、钾、钙离子失衡及细胞凋亡[20]。溶血素在同种细菌的不同分离株中,其基因编码、数量和基因表达存在差异[21],弧菌中存在5类有代表性的溶血素家族,其中,包括副溶血弧菌热稳定性溶血素和热不稳定性溶血素[22]。目前,对杀鱼假交替单胞菌溶血素的结构、分类、溶血机制等研究尚为空白,但从本研究结果可知,菌株2515同时含有热稳定性与热不稳定性两种溶血素,分别对羊红细胞及鱼红细胞具有溶血活性,其中,溶解羊血的热稳定性溶血素对鱼红细胞不具有溶血活性。由于菌株2515在水产养殖中具有潜在开发应用价值,对该两种溶血素在水产动物中的致病性强弱尚需进一步研究。本研究结果也提示,在进行水生动物益生菌溶血性评价时,应针对性地选择靶动物的血细胞。
3.3 杀鱼假交替单胞菌对中国明对虾的潜在毒性
Sun等[6]将分离的一株杀鱼假交替单胞菌(P.-SW-1)用于贝类养殖,发现该菌能够减轻溶藻弧菌Vibrio alginolyticus对贝类的致病力,认为该菌株可以用作贝类的益生菌。而乔毅等[8]发现了一株与杀鱼假交替单胞菌分离地位相近的假交替单胞菌属细菌LSHD-1含有丝氨酸蛋白酶基因、溶血素基因、肠毒素基因,对黑鲷Acanthopagrus schlegel具有致病性。本研究中,菌株2515用于对虾幼体培育,仅在N3至Z1期显示出随着添加剂量的增大幼体成活率呈现降低的趋势,而在低浓度组(105 CFU/mL)表现出能提高对虾卵孵化率及N3至Z1期变态率的效果,表明该菌株对中国明对虾幼体具有的潜在危害与使用浓度有关。有关杀鱼假交替单胞菌对中国明对虾的毒性评价及机制研究较少,但相关研究表明,杀鱼假交替单胞菌能够产生降解几丁质的酶[23],若定殖在对虾前肠中,可能会对中国明对虾前肠几丁质具有潜在的破坏作用[24]。而Z1期对虾幼体消化道初步发育完成,为幼体开口期,需要单胞藻类为食物,试验养殖水体中无添加饵料,幼体会滤食菌体导致菌体附着,使得前肠更易受到损伤,但该推测尚需进一步结合组织病理学研究加以证实。
3.4 杀鱼假交替单胞菌热脱毒后的抗菌效果
去除生物毒素有化学、物理及微生物等方法,其中,加热脱毒是降解生物毒素的常用方法,加热脱毒效果与毒素种类有关,过高的温度处理会破坏产品中有价值的成分,因此,适宜的脱毒温度选择尤为重要。存在于粮食中的脱氧雪腐镰刀菌烯醇和T-2毒素为耐高温毒素,需105 ℃以上高温处理方可达到部分去除效果[25]。而为提高牛奶的保质期同时保持其溶菌酶的抗菌活性,采用63 ℃ 30 min处理即可达到效果[26]。菌株2515的抗菌物质成分目前尚未阐明,但为了去除其对鱼类红细胞具有破坏作用的溶血素,灭活该菌,防止其在环境中定殖,同时维持细菌抗菌物质的活性,本研究中采用55 ℃热处理1 h即可达到最佳效果。
4 结论
1)菌株2515直接用于对虾育苗,影响对虾蚤状幼体成活率。该菌存在能够分别溶解鱼与羊红细胞的溶血素,若用于鱼类养殖存在潜在毒性。
2)菌株2515同时含有热稳定性与热不稳定性两种溶血素,热不稳定性溶血素对鱼红细胞产生溶血,而热稳定性溶血素对羊红细胞产生溶血,对鱼红细胞不产生溶血。
3)通过55 ℃ 1 h热处理能够去除菌株热不稳定性溶血素活性,能够灭活该菌,而对其抗菌活性无影响,热处理可以作为该菌脱毒的一种备选方法。
[1] 赵学伟,李明,梁峻,等.1株虾夷扇贝苗种培育用益生菌的筛选及其对幼体存活和生长的影响[J].大连海洋大学学报,2017,32(5):514-519.
[2] WANG H L,WANG C D,TANG Y,et al.Pseudoalteromonas probiotics as potential biocontrol agents improve the survival of Penaeus vannamei challenged with acute hepatopancreatic necrosis disease (AHPND)-causing Vibrio parahaemolyticus[J].Aquaculture,2018,494:30-36.
[3] LIU X F,LI Y,LI J R,et al.Isolation and characterisation of Bacillus spp. antagonistic to Vibrio parahaemolyticus for use as probiotics in aquaculture[J].World J Microbiol Biotechnol,2015,31(5):795-803.
[4] 张欢欢,王秀华,李晨,等.对虾养殖池中一株弧菌拮抗菌的分离鉴定[J].渔业科学进展,2016,37(3):85-92.
[5] WIDANARNI W,SUKENDA,SETIAWATI M.Bakteri probiotik dalam budidaya udang:seleksi,mekanisme aksi,karakterisasi,dan aplikasinya sebagai agen biokontrol[J].Jurnal Ilmu Pertanian Indonesia,2008,13(2):80-89.
[6] SUN X,ZHAO G M,GU C H,et al.Screening for and identification of an anti-clam Vibrio marine bacterium from an aquaculture pond in the Yellow Sea[J].Clean-Soil Air Water,2016,44(3):304-308.
[7] NELSON E J,GHIORSE W C.Isolation and identification of Pseudoalteromonas piscicida strain Cura-d associated with diseased damselfish (Pomacentridae) eggs[J].Journal of Fish Diseases,1999,22(4):253-260.
[8] 乔毅,沈辉,万夕和,等.1株黑鲷致病性假交替单胞菌的鉴定及毒力基因分析[J].江苏农业科学,2015,43(4):229-233.
[9] 沈银忠.细菌内毒素检测方法及其临床应用[J].上海医药,2018,39(21):3-6.
[10] FURSOVA K K,SHCHANNIKOVA M P,LOSKUTOVA I V,et al.Exotoxin diversity of Staphylococcus aureus isolated from milk of cows with subclinical mastitis in Central Russia[J].Journal of Dairy Science,2018,101(5):4325-4331.
[11] KRASIKOVA I N,KAPUSTINA N V,SVETASHEV V I,et al.Chemical characterization of lipid a from some marine proteobacteria[J].Biochemistry (Moscow),2001,66(9):1047-1054.
[12] SCHUETT C,DOEPKE H.Endobiotic bacteria and their pathogenic potential in cnidarian tentacles[J].Helgoland Marine Research,2010,64(3):205-212.
[13] WANG Y,NAKAIJIMA A,HOSOKAWA K,et al.Cytotoxic prodigiosin family pigments from Pseudoalteromonas sp. 1020R isolated from the Pacific coast of Japan[J].Biosci,Biotechnol,Biochem,2012,76(6):1229-1232.
[14] RITCHIE K B,NAGELKERKEN I,JAMES S,et al.A tetrodoto-xin-producing marine pathogen[J].Nature,2000,404(6776):354.
[15] 李萍,张兰,舒展,等.琼脂-孔洞扩散法测定物质抑菌活性中相关影响因素的探讨[J].中国调味品,2017,42(8):47-52.
[16] HOLMSTRÖM C,KJELLEBERG S.Marine Pseudoalteromonas species are associated with higher organisms and produce biologically active extracellular agents[J].FEMS Microbiol Ecol,1999,30(4):285-293.
[17] ZHENG L,CHEN H M,HAN X T,et al.Antimicrobial screening and active compound isolation from marine bacterium NJ6-3-1 associated with the sponge Hymeniacidon perleve[J].World Journal Microbiol Biotechnol,2005,21(2):201-206.
[18] HAMSAH,WIDANARNI W,ALIMUDDIN A,et al.The nutritional value of Artemia sp. enriched with the probiotic Pseudoalteromonas piscicida and the prebiotic mannan-oligosaccharide[J].AACL Bioflux,2017,10(1):8-17.
[19] 陈希,索占伟,许剑琴,等.细菌溶血素的分类及代表性溶血素研究进展[J].畜牧兽医科学,2008,24(8):16-22.
[20] 马碧书,马丽娜,林旭瑷,等.细菌溶血素毒性和致病机制研究进展[J].中国人兽共患病学报,2018,34(2):175-181.
[21] ZHANG X H,AUSTIN B.Pathogenicity of Vibrio harveyi to salmonids[J].Journal of Fish Diseases,2000,23(2):93-102.
[22] ZHANG X H,AUSTIN B.Haemolysins in Vibrio species[J].Journal of Applied Microbiology,2005,98(5):1011-1019.
[23] TSUJIBO H,YOSHIDA Y,IMADA C,et al.Isolation and characterization of a chitin degrading marine bacterium belonging to the genus Alteromonas[J].Nipoon Suisan Gakk,1991,57(11):2127-2131.
[24] MIYAMOTO K,OKUNISHI M,NUKUI E,et al.The regulator CdsS/CdsR two-component system modulates expression of genes involved in chitin degradation of Pseudoalteromonas piscicida strain O-7[J].Arch Microbiol,2007,188(6):619-628.
[25] 邹忠义,黄斐,孙建利,等.热处理对脱氧雪腐镰刀菌烯醇和T-2毒素的去除作用[J].食品研究与开发,2017,38(13):6-10.
[26] COSENTINO C,LABELLA C,ELSHAFIE H S,et al.Effects of different heat treatments on lysozyme quantity and antimicrobial activity of jenny milk[J].Journal of Dairy Science,2016,99(7):5173-5179.