鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2,CyHV-2)是引起鲫造血器官坏死症的病原,具有较强的致病性[1]。流行病学表明,CyHV-2感染后会引发鲫出现体表、鳃出血,内脏肿大出血[2],鳔、下颌多处充血,眼球突出,眼球基部充血等症状[3],对1龄幼鱼具有强烈的致病性,严重威胁中国鲫养殖业的健康发展。然而,迄今尚缺少有效控制该病暴发的措施,对其发病机制也缺乏了解。
为逃避宿主的免疫攻击,病毒在长期进化过程中,发展出多种免疫逃逸策略阻断宿主免疫应答。其中,疱疹病毒等大分子DNA病毒,能通过编码一些宿主细胞免疫调节蛋白类似物(如干扰素受体类似物、白介素类似物、肿瘤坏死因子受体类似物等)干扰宿主的免疫应答,从而逃逸宿主的免疫清除[4],这一类病毒编码蛋白也被称为病毒编码受体(viroceptor),其作用主要是阻断和抑制细胞因子与其受体结合,从而抑制宿主细胞的免疫反应[5]。研究发现,一些DNA病毒可编码TNFR类似物(vTNFR)进而参与病毒的复制过程,目前,兔纤维瘤病毒(Shope fibroma virus, SFV)[6]、新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus, SGIV)[7-8]和鲤疱疹病毒Ⅲ型(Cyprinid herpesvirus 3, CyHV-3)等[9-10]均有相关报道。
CyHV-2病毒隶属于疱疹病毒目Herpesvirales鱼疱疹病毒科Alloherpesviridae鲤疱疹病毒属Cyprinivirus[11]。该病毒最早于1992年在患病金鱼上发现,由于其是从鲤科鱼类分离的第二种疱疹病毒,故被命名为鲤疱疹病毒Ⅱ型。在结构方面,CyHV-2病毒具有鱼类疱疹病毒的一般特征,病毒是一种较大的线性、双链DNA 病毒,具有二十面体立体对称的衣壳结构,衣壳外为皮质层和囊膜[12]。目前,CyHV-2的全基因组测序与注释研究已经完成,病毒基因组全长为290 304 bp,共编码约154个潜在开放阅读框[13]。
在CyHV-2基因组中,开放阅读框4(open reading frame 4,ORF4)位于CyHV-2的反义链上,位置在ORF150~ORF151,其编码一种具有TNFR结构域的非结构蛋白。有研究报道,此类蛋白可能在CyHV-2 的免疫逃避中发挥作用[14],但其具体功能尚未见报道。本研究中,利用杆状病毒表达系统表达纯化CyHV-2 ORF4重组蛋白,并通过小鼠免疫试验分析其免疫原性,以期为进一步研究 CyHV-2 ORF4蛋白的功能提供参考。
1 材料与方法
1.1 材料
BALB/c小鼠(生产许可证号:(辽)2013-0003)购自大连医科大学SPF动物实验中心。
pFastBac HTA质粒、大肠杆菌DH10 Bac感受态细胞、Sf9细胞(草地贪夜蛾细胞)、CyHV-2病毒由盐城工学院水生动物免疫与疾病研究所保存。ExTaq酶、T4 DNA 连接酶、限制性内切酶等购自宝生物工程(大连)有限公司;大肠杆菌DH5α感受态细胞购自生工生物工程(上海)股份有限公司;胶回收试剂盒、质粒小提试剂盒购自天根生化科技(北京)有限公司;鼠抗6×His tag单抗购自武汉博士德生物工程有限公司;AP标记的羊抗鼠IgG、FITC标记的羊抗鼠IgG购自碧云天生物技术公司;镍离子琼脂糖凝胶6FF预装柱购自赛尔瑞成(北京)生命科学技术有限公司;CellfectinTM Ⅱ转染试剂购自Invitrogen公司。
1.2 方法
1.2.1 CyHV-2 ORF4基因的扩增 参考GenBank数据库中CyHV-2 ORF4基因序列(Gene ID: 14011391),设计引物扩增CyHV-2 ORF4的编码序列。其上游引物ORF4-F:5′GGAATTCGCCACCATGACACCTCCACCAACAACAC 3′;下游引物ORF4-R:5′CGGGTCGACAAGCTCTTCTGATGGA- GTGGGTGC 3′(下划线处分别为酶切位点EcoR Ⅰ和Sal Ⅰ)。引物由生工生物工程(上海)股份有限公司合成。以CyHV-2感染异育银鲫的脾脏DNA为模板,用PCR法扩增CyHV-2 ORF4基因片段。PCR反应条件为: 95 ℃下预变性5 min;95 ℃下循环变性1 min,60 ℃下退火复性1 min,72 ℃下延伸1 min,共进行32个循环;最后在72 ℃下再延伸10 min。将扩增产物用10 g/L琼脂糖凝胶电泳进行分析。
1.2.2 重组穿梭载体的构建 将ORF4扩增产物克隆至pMD19-T载体上,挑取阳性克隆菌株送至生工生物工程(上海)股份有限公司使用通用引物(RV-M:5′GAGCGGATAACAATTTCACACAGG 3′;M13-47:5′CGCCAGGGTTTTCCCAGTCACGAC 3′)进行测序。选取测序正确的阳性菌株,大量培养后进行质粒小提,用限制性内切酶EcoR Ⅰ和Sal Ⅰ分别将pMD19-T-ORF4和pFastBac HTA载体进行双酶切,用T4 DNA Ligase进行连接后转化到大肠杆菌DH5α感受态细胞中,采用菌液PCR和测序鉴定后,获得重组穿梭载体pFastBac HTA-ORF4。将重组转移质粒转化至大肠杆菌DH10 Bac感受态细胞,涂布于含有四环素(10 mg/L)、硫酸卡那霉素(50 mg/L)、庆大霉素(7 mg/L)、IPTG/X-gal的蓝白斑筛选平板上,37 ℃下倒置培养48 h。挑取白色菌落加入SOC培养基中,振荡培养约3 h,按照通用引物(M13-F:5′CCCAGTCACGACGTTGTAAAACG 3′;M13-R:5′AGCGGATAACAATTTCACACAGG 3′)进行菌液PCR鉴定,将阳性菌株进行重组杆粒DNA的提取,并命名为Bacmid-ORF4,4 ℃下保存备用。
1.2.3 重组杆状病毒的获得与鉴定 按照1×106个/孔的细胞数,将生长旺盛的Sf9细胞加入6孔细胞培养板中进行培养。将上述阳性重组杆粒Bacmid-ORF4,采用CellfectinTM Ⅱ转染试剂转染对数生长期的Sf9细胞,28 ℃下恒温培养,观察细胞病变,3~5 d 后细胞出现病变,收集细胞培养上清液,为第一代重组杆状病毒;用得到的P1代病毒继续感染Sf9细胞,28 ℃下恒温培养,获得P2代病毒;用P2代病毒继续感染Sf9细胞,28 ℃下恒温培养,获得P3代病毒。
将P3代重组杆状病毒接种Sf9细胞72 h后(同时设置空白细胞对照),采用间接免疫荧光法(IFA)对重组杆状病毒进行鉴定。具体方法为:待转染的Sf9细胞出现病变后,吸弃上清液并加入适量体积分数4%的多聚甲醛。用含3% (质量分数)牛血清蛋白(BSA)的PBS于37 ℃下封闭1 h,加入鼠抗6×His tag单抗(1∶500稀释)为一抗,37 ℃下孵育1 h,用PBS洗涤;以FITC标记的羊抗鼠IgG抗体(1∶800稀释)为二抗,37 ℃下孵育1 h,用PBS洗涤。用含抗荧光衰减淬灭剂的封片剂进行封片,在倒置荧光显微镜(江南XD-202)下观察分析。
1.2.4 重组CyHV-2 ORF4蛋白的纯化 取P3代重组杆状病毒感染72 h后的Sf9细胞,用预冷PBS 洗涤,加裂解缓冲液(50 mmol/L Tris、500 mmol/L NaCl、5%甘油、10 mmol/L咪唑,pH 7.5)重悬,用超声波破碎细胞(超声10 s,停10 s,共进行10个循环),4 ℃下以12 000 r/min 离心30 min,取细胞裂解上清液进行SDS-PAGE电泳,设置未转染杆状病毒感染Sf9细胞为阴性对照。收集病毒感染的Sf9细胞裂解上清液,使用琼脂糖凝胶6FF预装柱,依照说明书进行蛋白纯化。采用BCA 法测定蛋白浓度,-80 ℃下保存备用。
1.2.5 Western blot分析 将纯化产物转移到PVDF膜上,用含3%BSA的PBS于4 ℃下封闭过夜,用鼠抗6×His tag单抗(1∶2 000稀释)作为一抗,37 ℃下孵育1 h,用PBST洗涤3次,每次5 min;使用AP标记的羊抗鼠IgG(1∶3 000稀释)作为二抗,37 ℃下孵育1 h,用PBST洗涤3次,每次5 min。最后使用BCIP/NBT显色试剂盒于暗处显色20 min,观察有无棕色条带出现。
1.2.6 重组CyHV-2 ORF4蛋白的免疫原性分析将6只BALB/c小鼠分为两组,每组3只。对照组和试验组均在第0、7、14、21和28天时通过尾尖采血制备血清,于-80 ℃下保存备用。在对小鼠取血清结束后,试验组随即对每只小鼠注射重组ORF4蛋白进行免疫,对照组随即对每只小鼠注射PBS缓冲液。免疫过程具体为:将纯化的重组CyHV-2 ORF4蛋白溶液与弗氏佐剂混合(体积比为1∶1)后乳化,分别在第0、7、14、21天时以腹腔注射的方式免疫3只BALB/c小鼠,每只注射100 μg的ORF4蛋白(体积100 μL),对照组每只小鼠注射100 μL PBS缓冲液。
以每孔1 μg重组ORF4蛋白包被酶标板,使用间接ELISA方法检测免疫小鼠诱导产生特异性抗体的效价。以制备的免疫血清作为一抗(100 μL/孔,1∶100稀释于PBS缓冲液中),以AP标记的羊抗鼠IgG(1∶3 000稀释于PBS缓冲液中)作为二抗,加入pNpp-Na发色液后,用酶标仪测定405 nm波长下的吸光值。
2 结果与分析
2.1 CyHV-2 ORF4基因的扩增
采用PCR法对CyHV-2 ORF4基因进行扩增,琼脂糖凝胶电泳显示,扩增产物在约1 000 bp处出现了一条特异性条带(图1A),进一步将其克隆入pMD19-T载体上,经EcoRⅠ和Sal Ⅰ双酶切后,得到了大小约1 000 bp左右的条带(图1B),这与ORF4基因的片段(Gene ID:140111391)大小相符。测序结果也表明,扩增片段与CyHV-2 ORF4基因序列的一致性为100%。
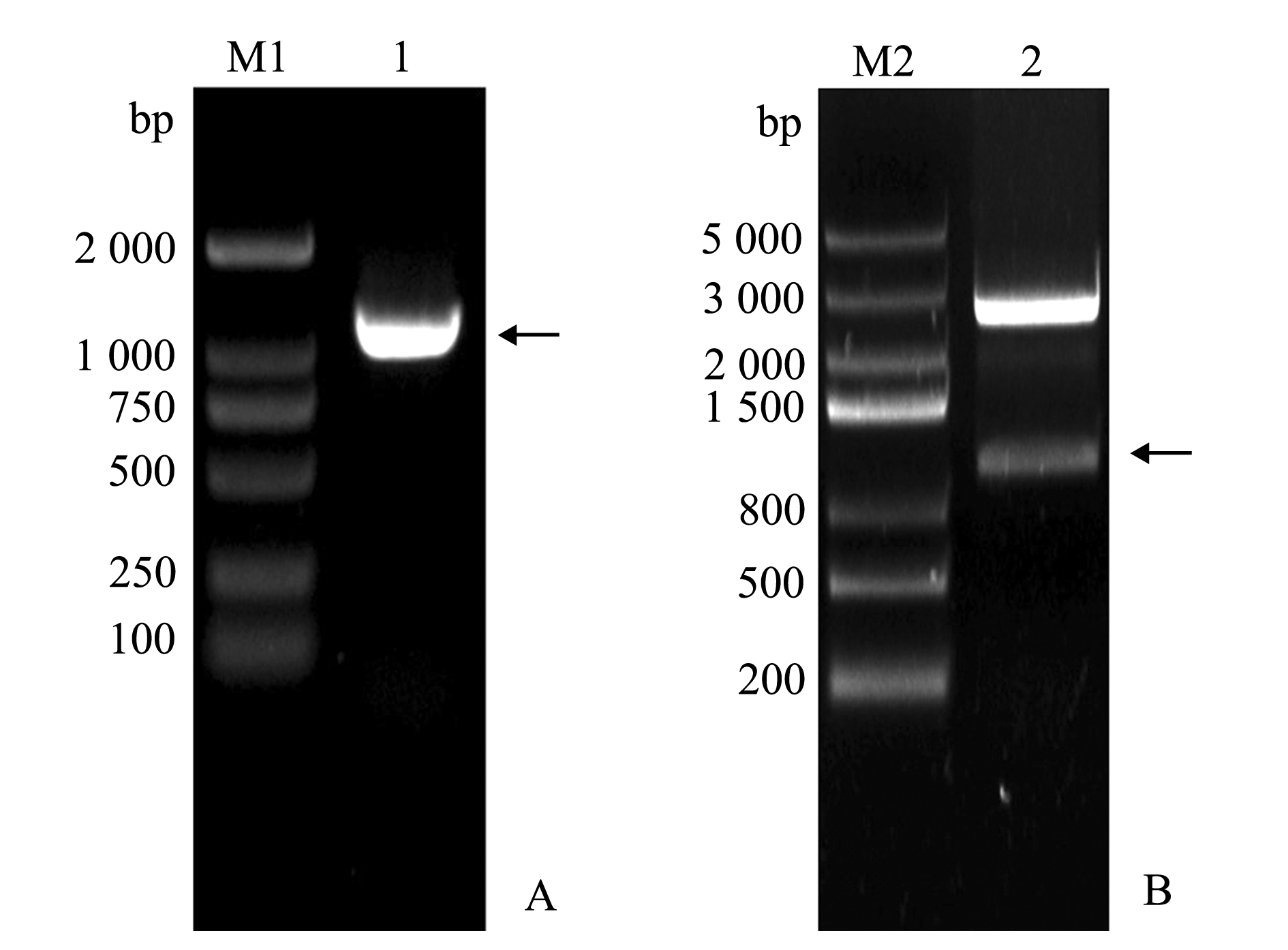
M1—DL2000 DNA Marker;M2—DL5000 DNA Marker;1—PCR扩增产物;2—重组克隆质粒pMD19-T-ORF4的双酶切鉴定。
M1—DL2000 DNA Marker;M2—DL5000 DNA Marker;1—product of PCR amplification;2—double enzyme digestion of recombinant cloning plasmid pMD19-T-ORF4.
图1 CyHV-2 ORF4基因的扩增及pMD19-T-ORF4的双酶切鉴定
Fig.1 Amplification of CyHV-2 ORF4 and double enzyme digestion of pMD19-T-ORF4
2.2 重组穿梭载体的构建与鉴定
分别用M13F、M13R引物对重组杆粒Bacmid-ORF4进行PCR 鉴定。从图2可见,PCR 产物用琼脂糖凝胶电泳后,在约3 500 bp处可见特异性条带, 与预期片段大小相符,表明OFR4基因转座成功。
M—DL10000 DNA Marker;1—重组杆粒DNA。
M—DL10000 DNA Marker;1—recombiant Bacmid DNA.
图2 重组杆粒DNA的鉴定
Fig.2 Identification of recombinant Bacmid DNA
2.3 重组杆状病毒的获得
将重组杆粒Bacmid-ORF4转染到处于对数生长期的Sf9细胞中。从图3可见,转染72 h后细胞逐渐出现形态变圆、细胞核增大、边缘变亮、部分细胞破裂等变化,而未转染细胞状态良好,表明重组杆粒已成功转染Sf9细胞并生产出重组杆状病毒。
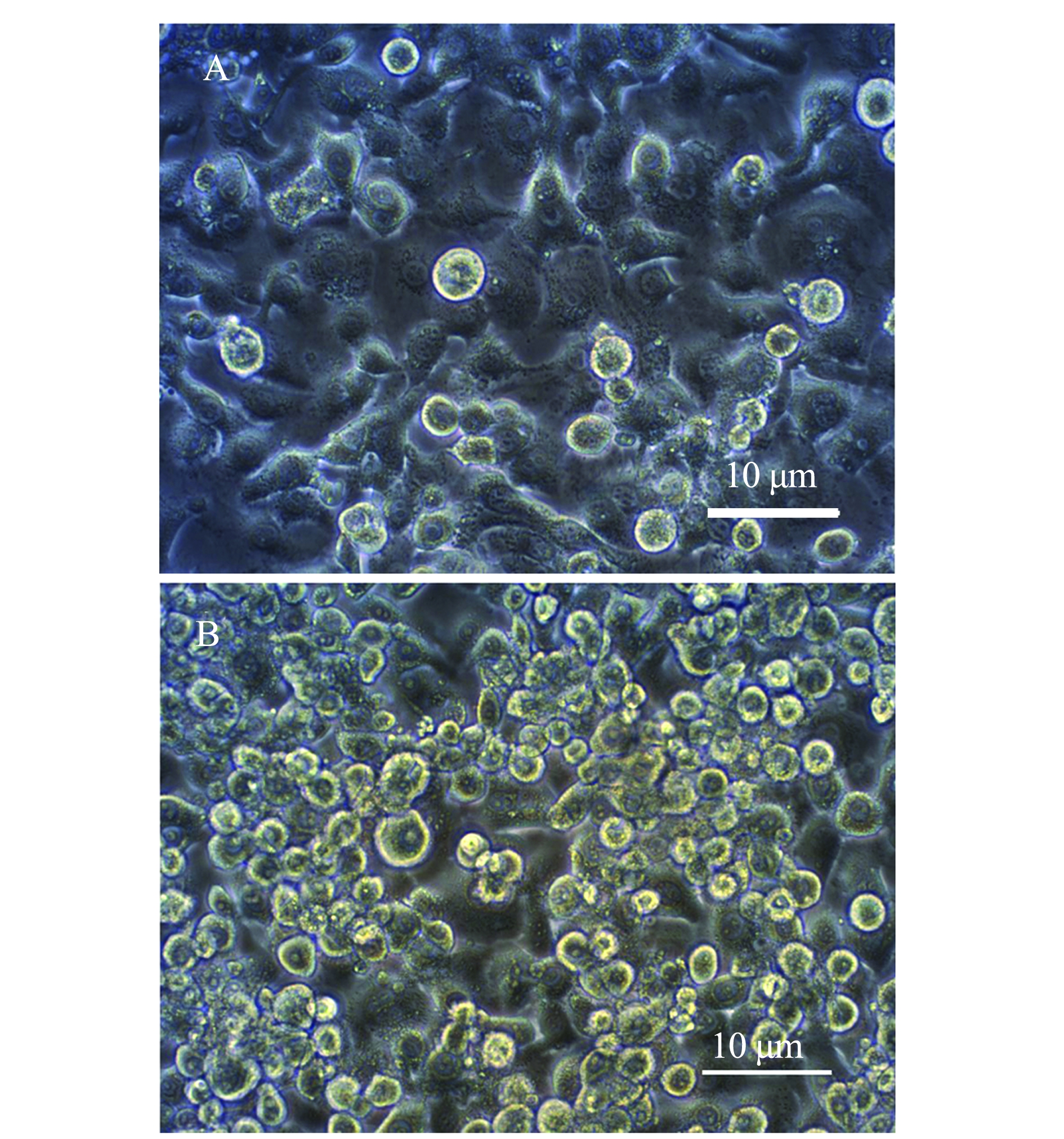
A—正常Sf9细胞;B—转染72 h后的Sf9细胞。
A—normal Sf9 cells;B—Sf9 cells 72 h post transfection.
图3 重组杆状Bacmid-ORF4转染Sf9后的细胞病变
Fig.3 Cytopathic effect of Sf9 cells transfected with recombinant Bacmid-ORF4
2.4 重组杆状病毒的IFA鉴定
将P3代重组杆状病毒接种到Sf9细胞72 h后,对重组杆状病毒进行IFA鉴定。从图4可见,感染重组杆状病毒的Sf9细胞出现特异性绿色荧光,而空白对照组未出现荧光,这表明外源ORF4蛋白在杆状病毒中成功表达。
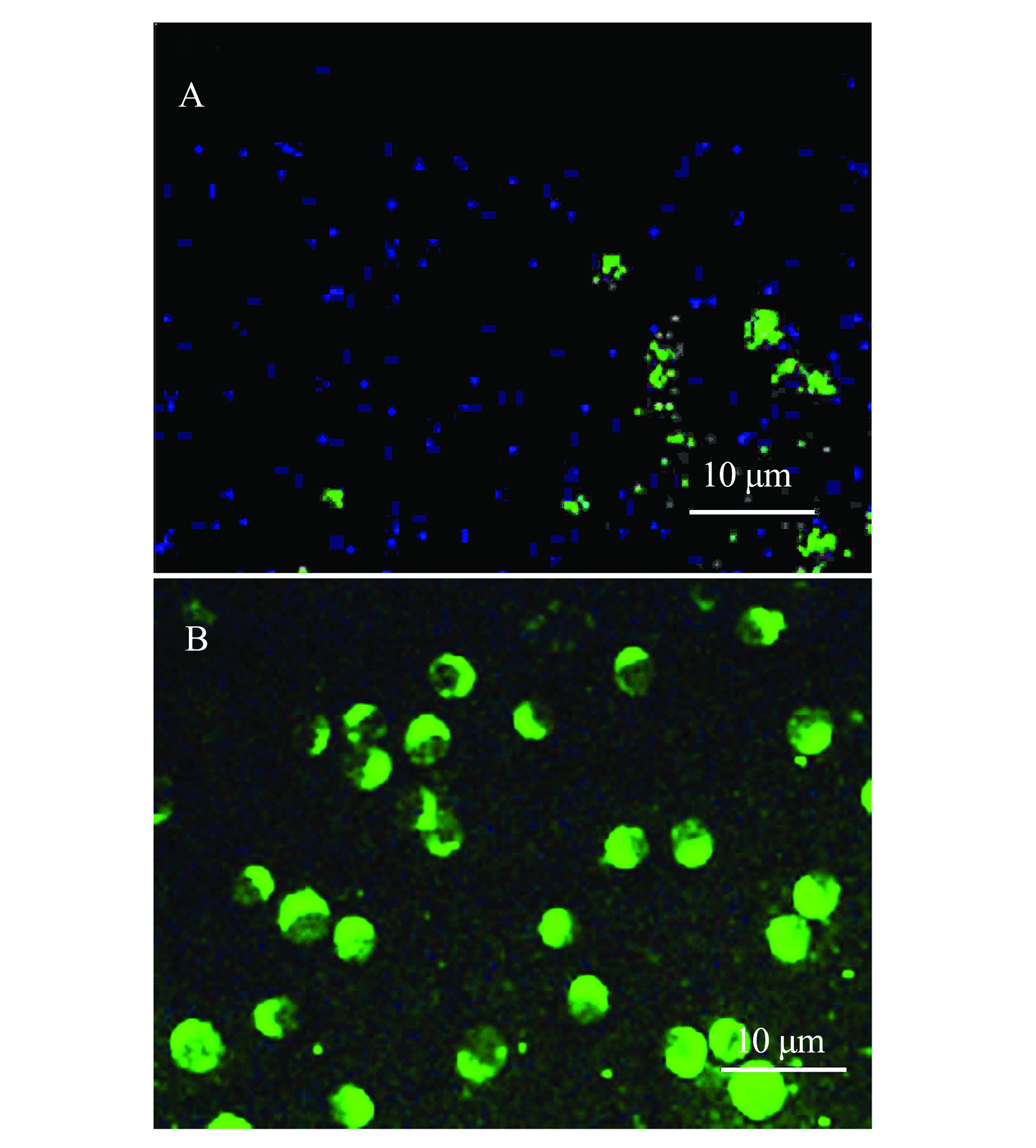
A—正常Sf9细胞;B—转染72 h后的Sf9细胞。
A—normal Sf9 cells;B—Sf9 cells 72 h post transfection.
图4 ORF4蛋白表达的间接免疫荧光鉴定
Fig.4 Identification of ORF4 protein expression by IFA
2.5 重组ORF4蛋白的Western blot鉴定
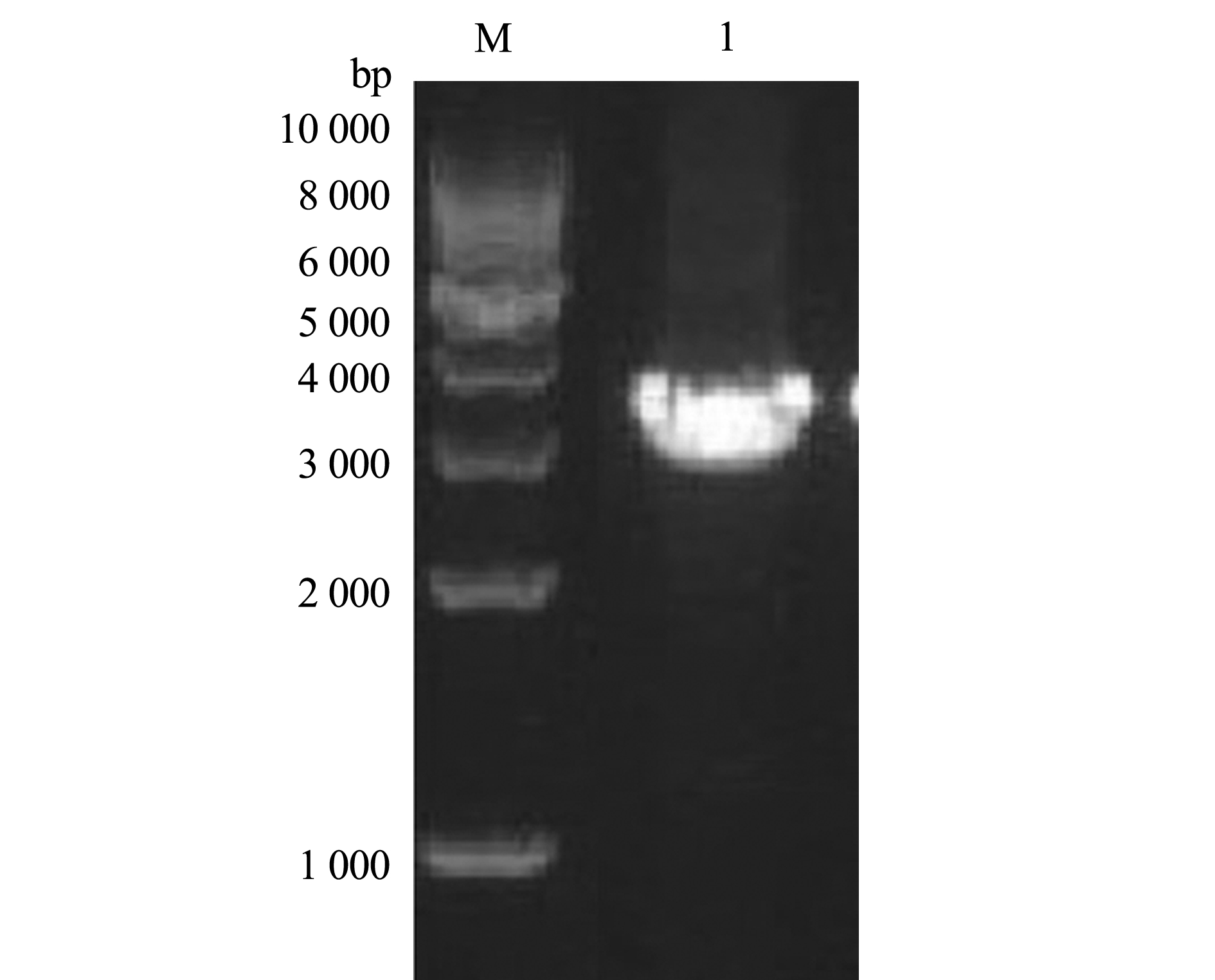
将P3代重组杆状病毒接种到Sf9细胞72 h后,收集感染细胞裂解上清液进行SDS-PAGE电泳,并设置未感染细胞裂解上清液为对照。电泳图谱显示:在相对分子质量约40 000 处出现了一条特异的染色条带,表明重组杆状病毒感染后的Sf9细胞成功表达ORF4蛋白;进一步将细胞上清液进行亲和层析纯化,Western blot结果显示,纯化产物能与抗His单抗发生特异性反应(图5)。
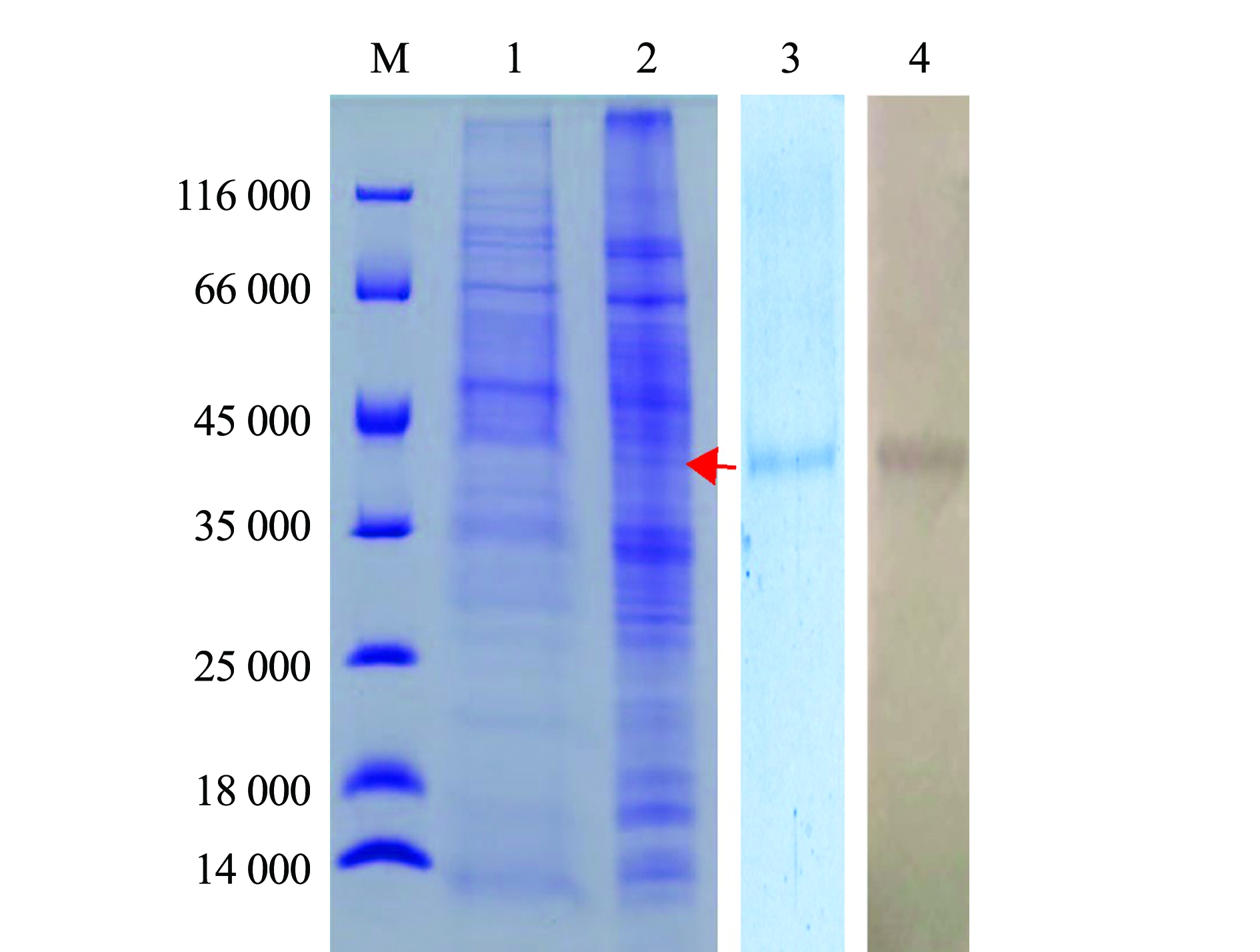
M—蛋白Marker IV;1—空白细胞对照;2—病毒感染Sf9细胞的裂解上清液;3—纯化的ORF4蛋白;4—Western blot。
M—protein Marker IV;1—uninfected cell lysis supernatant;2—supernatant of infected sf9 cell lysis;3—purified ORF4 protein;4—Western blot.
图5 CyHV-2 ORF4蛋白表达及其Western blot鉴定
Fig.5 Expression and Western blot identification of CyHV-2 ORF4 protein
2.6 重组ORF4蛋白免疫原性分析
采用间接ELISA测定重组ORF4蛋白免疫小鼠第0、7、14、21、28天时血清中的特异性抗体效价。从图6可见,与对照组相比,重组ORF4蛋白免疫小鼠诱导产生了特异性抗体,且免疫组小鼠血清的效价随时间的延长而升高,在免疫后第28天时,OD405 nm值达到1.5左右,而对照组的OD405 nm在0.1以下。
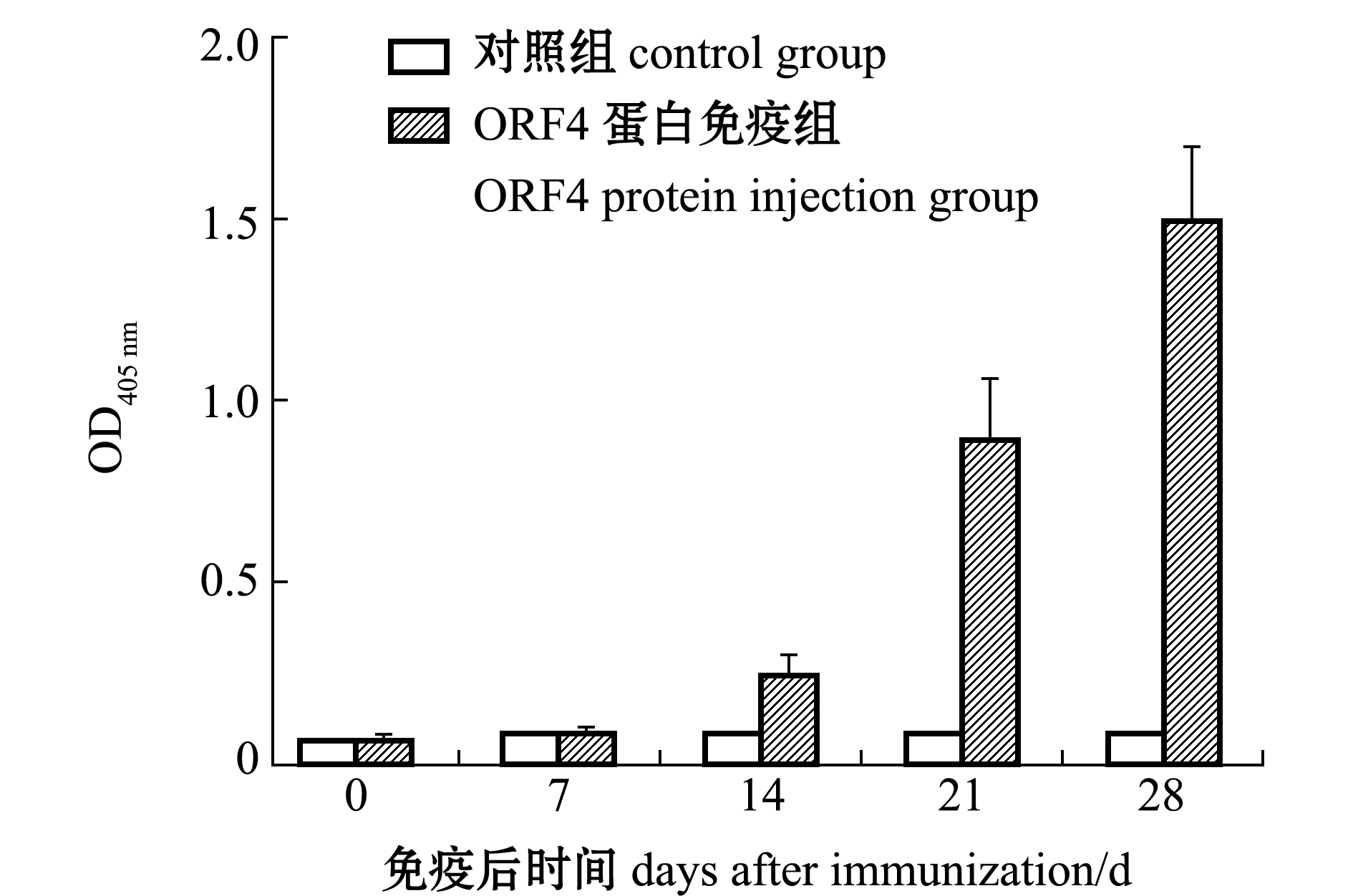
图6 ORF4蛋白的免疫原性分析
Fig.6 Immunogenicity analysis of ORF4 protein
3 讨论
3.1 CyHV-2 ORF4蛋白在杆状病毒表达系统中的表达
在与宿主长期共存的过程中,病毒进化出多种逃逸宿主免疫反应的机制,从而逃避宿主对自身的识别和清除。迄今,已发现多种病毒免疫逃逸方式,包括干扰抗原呈递途径[15-16]、干扰抗病毒细胞因子的调节[17]、干扰受感染细胞的凋亡[18]及干扰免疫相关细胞的功能[19]等诸多方面。正是由于这些免疫逃避机制的存在,最终导致宿主无法控制病毒增殖而死亡。在CyHV-2病毒中,ORF4蛋白具有TNFR结构域,其有介导病毒免疫逃逸的潜在作用。通过对CyHV-2 ORF4蛋白进行深入研究,可为CyHV-2的致病机制和防控策略开发等方面提供理论依据。
杆状病毒表达系统是一种新型的真核表达系统,其表达产物的生物学活性、结构与功能特点、抗原性和免疫原性等与天然外源基因产物极其相似,且杆状病毒具有高度的种属特异性,对脊椎动物无感染性,其表达的产物具有较高的生物安全性[20]。本试验中将ORF4扩增产物连接入pFastBac HTA质粒(该质粒携带His标签,可方便后期蛋白的表达鉴定及纯化),结果显示,重组杆粒Bacmid-ORF4转染Sf9细胞后,出现了细胞变圆、细胞核明显增大、部分细胞破裂等现象,这表明成功获得了重组杆状病毒(图3);IFA结果表明,外源蛋白在重组杆状病毒感染的细胞中成功获得了表达(图4);将感染细胞的裂解上清液进行SDS-PAGE电泳,结果显示,在相对分子质量约40 000处有较弱的特异性条带,这与ORF4蛋白的理论相对分子质量相符;进一步采用亲和层析法进行纯化,成功获得了较纯的目的蛋白,Western blot结果显示,该蛋白能与抗His单抗发生特异性反应,结合蛋白相对分子质量分析,表明已成功利用杆状病毒表达系统在细胞中表达CyHV-2 ORF4重组蛋白。虽然ORF4蛋白在细胞上清液中的表达量不高,但纯化后蛋白纯度和浓度可满足进一步试验的要求。
3.2 CyHV-2 ORF4蛋白免疫原性分析
为检测杆状病毒表达的重组ORF4蛋白的免疫原性,将其免疫小鼠后在不同的时间点采血分离血清,并使用纯化的重组ORF4蛋白包被酶标板进行ELISA检测,结果显示,免疫重组ORF4蛋白组小鼠血清效价随时间延长而不断升高,血清效价变化规律与李天增[21]、魏思琪[22]等的试验结果相符。这表明,重组ORF4蛋白能够诱导小鼠产生特异性抗体,且免疫后第28天的血清效价达到较高水平,重组ORF4蛋白具有良好的免疫原性。
4 结论
1)本试验中以杆状病毒表达系统为工具,构建了Bacmid-ORF4重组杆粒并成功获得P3代重组杆状病毒。在P3代病毒感染的Sf9细胞超声裂解取上清中成功获得了高纯度的重组CyHV-2 ORF4蛋白。
2)获得的重组CyHV-2 ORF4蛋白表现出了较好的免疫原性,适合以其作为工具进行CyHV-2 ORF4 蛋白的功能性研究。
[1] 洪徐鹏.鲤、鲫疱疹病毒病的诊断与防治措施[J].河北渔业,2013(1):39-40.
[2] 熊关庆,段靖,冯杨,等.鲫CyHV-2病毒病的诊断及组织病理损伤研究[J].四川农业大学学报,2019,37(3):397-403.
[3] 操艮萍,陆宏达,李振伟,等.引起混养塘中异育银鲫和鲢发病死亡的病原及组织病理[J].水产学报,2016,40(3):428-444.
[4] KE F,ZHANG Q Y.Aquatic animal viruses mediated immune evasion in their host[J].Fish & Shellfish Immunology,2019,86:1096-1105.
[5] KONTSEK P,KONTSEKOVA E.Virokines and viroceptors— viral immunomodulators with clinical and therapeutic implications[J].Bratislavske Lekarske Listy,2000,101(7):371-382.
[6] EL MAADIDI S,FALETTI L,BERG B,et al.A novel mitochondrial MAVS/Caspase-8 platform links RNA virus-induced innate antiviral signaling to Bax/Bak-independent apoptosis[J].The Journal of Immunology,2014,192(3):1171-1183.
[7] HUANG X H,HUANG Y H,CAI J,et al.Identification and characterization of a tumor necrosis factor receptor like protein encoded by Singapore grouper iridovirus[J].Virus Research,2013,178(2):340-348.
[8] YU Y P,HUANG Y H,WEI S N,et al.A tumour necrosis factor receptor-like protein encoded by Singapore grouper iridovirus modulates cell proliferation,apoptosis and viral replication[J].Journal of General Virology,2016,97(3):756-766.
[9] YI Y,QI H M,YUAN J M,et al.Functional characterization of viral tumor necrosis factor receptors encoded by cyprinid herpesvirus 3 (CyHV3) genome[J].Fish & Shellfish Immunology,2015,45(2):757-770.
[10] RAKUS K,RONSMANS M,FORLENZA M,et al.Conserved fever pathways across vertebrates:a herpesvirus expressed decoy TNF-α receptor delays behavioral fever in fish[J].Cell Host & Microbe,2017,21(2):244-253.
[11] SU H,SU J G.Cyprinid viral diseases and vaccine development[J].Fish & Shellfish Immunology,2018,83:84-95.
[12] 高娃,温虹,王浩,等.鲤疱疹病毒Ⅱ型主要免疫原性蛋白的鉴定[J].水产学报,2020,44(9):1441-1447.
[13] LIU B,ZHOU Y,LI K,et al.The complete genome of Cyprinid herpesvirus 2,a new strain isolated from allogynogenetic crucian carp[J].Virus Research,2018,256:6-10.
[14] 周勇,范玉顶,徐进,等.鲤疱疹病毒Ⅱ型ORF4基因的克隆、表达与免疫学检测方法[J].淡水渔业,2017,47(1):61-65.
[15] YAN Y,CUI H C,GUO C Y,et al.Singapore grouper iridovirus-encoded semaphorin homologue (SGIV-sema) contributes to viral replication,cytoskeleton reorganization and inhibition of cellular immune responses[J].Journal of General Virology,2014,95(5):1144-1155.
[16] KE F,GUI J F,CHEN Z Y,et al.Divergent transcriptomic responses underlying the ranaviruses-amphibian interaction processes on interspecies infection of Chinese giant salamander[J].BMC Genomics,2018,19:211.
[17] WENDEL E S,YAPARLA A,KOUBOURLI D V,et al.Amphibian (Xenopus laevis) tadpoles and adult frogs mount distinct interferon responses to the Frog Virus 3 ranavirus[J].Virology,2017,503:12-20.
[18] HONG J R,GONG H Y,WU J L.IPNV VP5,a novel anti-apoptosis gene of the Bcl-2 family,regulates Mcl-1 and viral protein expression[J].Virology,2002,295(2):217-229.
[19] WILSON A B.MHC and adaptive immunity in teleost fishes[J].Immunogenetics,2017,69(8/9):521-528.
[20] ZHANG L J,CHEN J,WANG D M,et al.Ligation of porcine Fc gamma receptor III inhibits levels of antiviral cytokine in response to PRRSV infection in vitro[J].Research in Veterinary Science,2016,105:47-52.
[21] 李天增,潘晓梅,张伟,等.重组杆状病毒表达猪圆环病毒2型Cap蛋白的优化及蛋白免疫原性研究[J].中国兽药杂志,2019,53(8):30-35.
[22] 魏思琪,张路平,张艳芳,等.寨卡病毒NS1蛋白在杆状病毒系统中的表达及免疫原性分析[J].中国兽医科学,2020,50(3):346-352.