自然界中,常见的鳢科鱼类主要有乌鳢Channa argus和斑鳢Channa maculata[1],在广东将乌鳢、斑鳢和杂交鳢统称为“生鱼”,因其具有肉质细腻、味道鲜美、骨刺少、含肉率高和营养价值高等诸多优点,深受消费者青睐[2-5],在中国淡水鱼养殖中占有较大比重。乌鳢和斑鳢具有各自的优缺点,乌鳢生长快速但不能摄食人工配合饲料,只能投喂冰鲜杂鱼,而过多投喂冰鲜鱼会败坏水质引起病害频发和水源污染等问题[6-10];斑鳢虽然可以摄食配合饲料但生长速度缓慢且个体较小,不受养殖户的喜爱。目前,广东省养殖的鳢科鱼类主要以杂交鳢为主,且 90% 以上均以广东乌鳢为父本、外省斑鳢为母本进行杂交得到(Channa maculata ♀×Channa argus ♂),杂交鳢具备摄食人工配合饲料、耐低温、耐低溶氧和耐恶劣环境的诸多优点,且生长速度也比之前的主养品种有了大幅提高,适合在中国大部分地区推广养殖,有利于推动整个鳢科鱼类养殖业的发展。
肠道微生物在水生动物生长发育过程中起着非常重要的作用,正常的肠道微生物具有消化吸收营养物质和调节鱼类免疫等诸多功能,与鱼类的健康生长密切相关[11-13],因此,研究鱼类肠道微生物对实际生产具有重大意义。目前,众多学者对杂交鳢的病害、营养、药物残留等方面的研究已有诸多报道[14-16],但不同养殖模式下杂交鳢肠道微生物组成及多样性研究鲜有报道。目前,鳢科鱼类的养殖以土池为主,少部分地区用高位铺膜池进行养殖,两种养殖模式产生的生态效益和经济效益差异较大,本研究中以土池和高位铺膜池养殖的健康杂交鳢的肠道为研究对象,采用高通量测序技术进行两种养殖模式下杂交鳢肠道微生物组成及多样性的差异性研究,以期从微生物角度分析不同养殖模式下杂交鳢肠道微生物组成及多样性差异,旨在为杂交鳢健康高效养殖提供科学依据。
1 材料与方法
1.1 材料
试验样品于2019年4月分别取自佛山市顺德顺爷水产有限公司的高位铺膜池和旁边的土池,样品采集前,使用水质监测仪(DZS-706,上海仪电科学仪器股份有限公司)和可见分光光度计(722 s,上海棱光技术有限公司)等仪器测量2种养殖池中的温度、pH、氨氮、亚硝酸盐氮、硝酸盐氮和总碱度等水质指标。为保证水质测量的科学性,采用 2 L有机玻璃采水器分别在高位铺膜池和土池的水面下 50 cm处采集水样,取水样 2 L,取样地点分别在池塘中央和4个拐角处,将这5个点的水样混合后,先用0.15 mm的尼龙过滤网滤去杂质和大颗粒物,然后进行水质指标的测定。
高位铺膜池面积为 2 000 m2,平均水深约 2.5 m,日换水量约为 30%;土塘面积约为3 333 m2,平均水深约2 m。两种池塘的日换水量约为20%,养殖水源相同,都是河涌水,投喂饲料为同一厂商生产,投喂等其他管理方式相同。
1.2 方法
1.2.1 样品采集及前处理 土池设置 3 个重复组,分别记为abce123、abce124和abce125,高位铺膜池设置 3 个重复组,分别记为abce126、abce127和abce128。取样前停止摄食 24 h,从2种养殖模式池塘中各取 3 尾健康且规格相近的杂交鳢,高位铺膜池杂交鳢体质量为(1 130.00±96.27)g,体长为(35.33±1.70)cm,土池杂交鳢平均体质量为(1 140.67±45.88)g,体长为(35.67±1.70)cm。取样前先将解剖盘灭菌,然后在解剖盘上铺一层碎冰。将样本鱼先用冰水混合物浸泡30 min左右,待鱼失去活力并产生休克后,将鱼置于解剖盘中,用体积分数为75%的乙醇擦拭鱼体进行消毒,再用 0.85%(质量分数)无菌生理盐水洗涤 2~3 次,打开鱼的腹腔,用体积分数为75%的乙醇擦拭肠道外部,用无菌剪刀剪取部分肠道中部组织,样品不混样,2种养殖模式肠道样品均留备用样品,将取好的肠道组织样本迅速放入液氮中速冻后于超低温冰箱(-80 ℃)中保存备用。
1.2.2 DNA提取 使用Soil DNA Kit(OMEGA,US)提取肠道样本的DNA,具体操作按照试剂盒说明书进行,所有样品总DNA均重复提取 2~3 次并混合均匀,以避免出现误差。提取完成后使用Thermo NanoDrop 8000(赛默飞世尔科技,美国)分光光度计测定其浓度和纯度,以确保所提取的DNA 质量能够满足后续扩增要求,将提取成功的DNA样品存放于超低温冰箱(-80 ℃)中保存备用。
1.2.3 细菌16S rDNA序列的v3~v4可变区扩增和Illumina Miseq 测序 以提取成功的各样本细菌总DNA作为模板,扩增16S rDNA序列的v3~v4可变区域,为保证后续数据分析的准确性及可靠性,扩增需要两个条件,首先是尽可能使用低循环数扩增,其次保证每个样品扩增的循环数统一。引物为341F(5′CCTAYGGGRBGCASCAG 3′)和806R(5′GGACTACNNGGGTATCTAAT 3′)。PCR 采用PrimeSTAR HS DNA Polymerase,反应体系(20 μL)包括:5× PrimeSTAR Buffer (Mg2+ Plus)10 μL,dNTP Mixture (2.5 mmol/L each)4 μL,Forward Primer(5 μmol/L)1 μL,Reverse Primer(5 μmol/L)1 μL,PrimeSTAR HS DNA Polymerase 0.5 μL,Template DNA 10 ng,用灭菌双蒸水补足至20 μL。PCR反应条件为:98 ℃下预变性3 min; 98 ℃下循环变性30 s,55 ℃下退火复性30 s,72 ℃下延伸30 s,共进行27个循环;最后在72 ℃下再延伸 5 min(PCR仪,ABI 9700型GeneAmp PCR System 9700),扩增好的DNA 序列经琼脂糖电泳检测呈阳性后交由广州赛哲生物科技股份有限公司用 Illumina Miseq PE300高通量测序技术进行序列测定和分析。
1.3 数据处理
根据Barcode序列和PCR扩增引物序列从以下数据中拆分出各样品数据,截去Barcode序列和引物序列,对样品的reads进行拼接,得到的拼接序列为原始Tags数据(Raw Tags),Raw Tags经过过滤操作,去掉低质量、不符合长度的tag及嵌合体,得到高质量的Tags数据(Clean Tags)。之后,基于Clean Tags进行OTUs(Operational Taxonomic Units,操作分类单元)聚类,以 97%相似性为标准划分操作分类单元OTU作为分类和计算的依据。根据OTU聚类结果,对每个OTU的代表序列做物种注释,得到对应的物种注释信息和基于物种的丰度分布情况。同时,对OTU丰度(统计,可视化)、Alpha多样性进行分析等,以得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTU信息。本研究中,定义1个OTU为碱基差异小于3%的序列群,且在结果分析中1个OTU被视为代表一种细菌。
2 结果与分析
2.1 池塘水质指标
高位铺膜池:水温为30.3 ℃,pH为7.88,总氨氮为0.38 mg/L,亚硝酸盐氮为0.44 mg/L,硝酸盐氮为10.87 mg/L,总碱度为17.17 mg/L。
土池:水温为30.8 ℃,pH 为7.88,总氨氮为5.78 mg/L,亚硝酸盐氮为3.29 mg/L,硝酸盐氮为35.10 mg/L,总碱度为50.61 mg/L。
高位铺膜池的水温和pH与土池无明显差异,但高位铺膜池的氨氮、亚硝酸盐氮、硝酸盐氮和总碱度含量均明显低于土池。
2.2 OTU稀释曲线分析
从图1可见,当样品测序数量一定时,土池样品获得的OTU数量远远大于高位铺膜池,土池样品的OTU稀释曲线在样品测序数量低于10 000时就逐渐趋于平缓,而高位铺膜池的OTU稀释曲线在样品测序数量超过10 000时才逐渐开始趋于平缓,这说明样品测序数量比较合理,再增加样品测序数量,获得的新的OTU数量也很少,从另一个角度也说明随着样品测序数量增加,没有新的微生物种类被发现,细菌多样性也无明显变化。总的来说,测序深度比较合理,能够覆盖样品绝大多数的微生物,表明此次菌群分析结果合理。
2.3 基于16S rDNA测序的细菌多样性分析
2.3.1 测序样品中OTU数量及基于16S rDNA基因序列的细菌多样性指数 对高位铺膜池和土池样本中高通量测序的数据进行统计分析,结果显示,高位铺膜池的 3 个样本abce126、abce127和abce128分别获得136、85和79 个 OTU,土池的 3 个样本abce123、abce124和abce125分别获得1 034、489和 414 个OTU;土池 3 个样本的OTU数量和Alpha多样性指数(ACE、Chao1、 Shannon、 Simpson)均明显高于高位铺膜池(表1)。这表明,土池杂交鳢肠道细菌多样性高于高位铺膜池。
表1 测序样品中OTU数量及基于16S rDNA基因序列的细菌多样性指数
Tab.1 Number of OTU and bacterial diversity index in sequencing samples based on 16S rDNA gene sequence
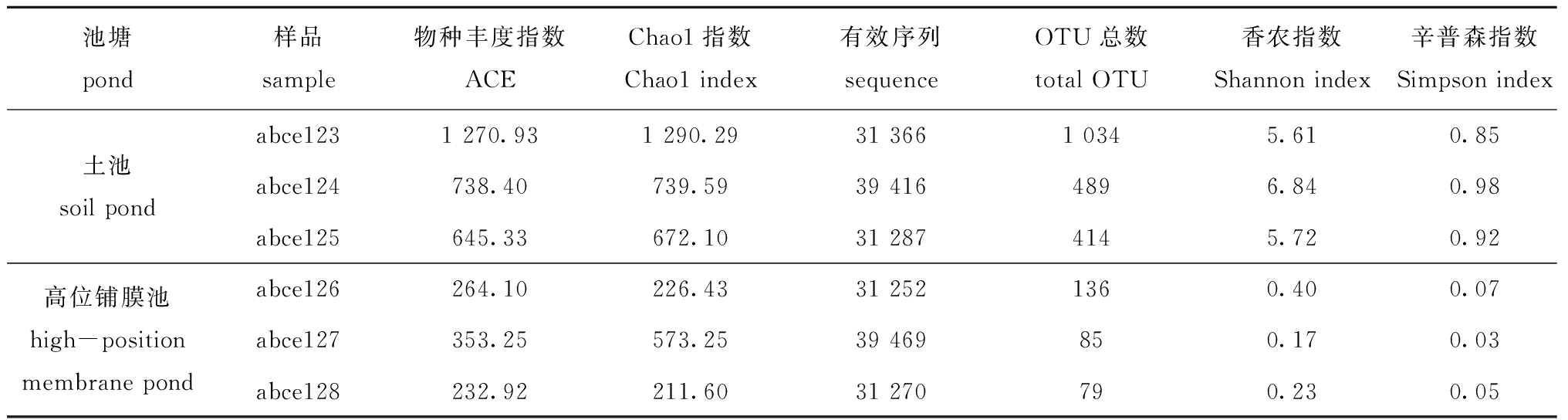
池塘pond样品sample物种丰度指数ACEChao1指数Chao1 index有效序列sequenceOTU总数total OTU香农指数Shannon index辛普森指数Simpson indexabce1231 270.931 290.2931 3661 0345.610.85土池soil pondabce124738.40739.5939 4164896.840.98abce125645.33672.1031 2874145.720.92abce126264.10226.4331 2521360.400.07高位铺膜池high-position membrane pondabce127353.25573.2539 469850.170.03abce128232.92211.6031 270790.230.05
2.3.2 细菌多样性的等级分布曲线分析 细菌多样性的等级分布曲线可直观反映样品中包含的分类丰富度和均匀度,即在水平方向,分类丰度由曲线宽度反映,分类丰富度越高,曲线在横轴上的跨度越大;在垂直方向曲线的平滑程度,反映了样品中分类的均匀程度,曲线越平缓,物种分布越均匀。从图2可见:土池样本曲线在横轴上的宽度均显著高于高位铺膜池样品曲线宽度最高的样本(abce126),表明土池杂交鳢肠道微生物分类丰度高于高位铺膜池;土池样品曲线在纵轴上的平滑程度均显著高于高位铺膜池,表明土池杂交鳢肠道微生物分布均匀度高于高位铺膜池。这表明,土池杂交鳢肠道细菌多样性高于高位铺膜池。
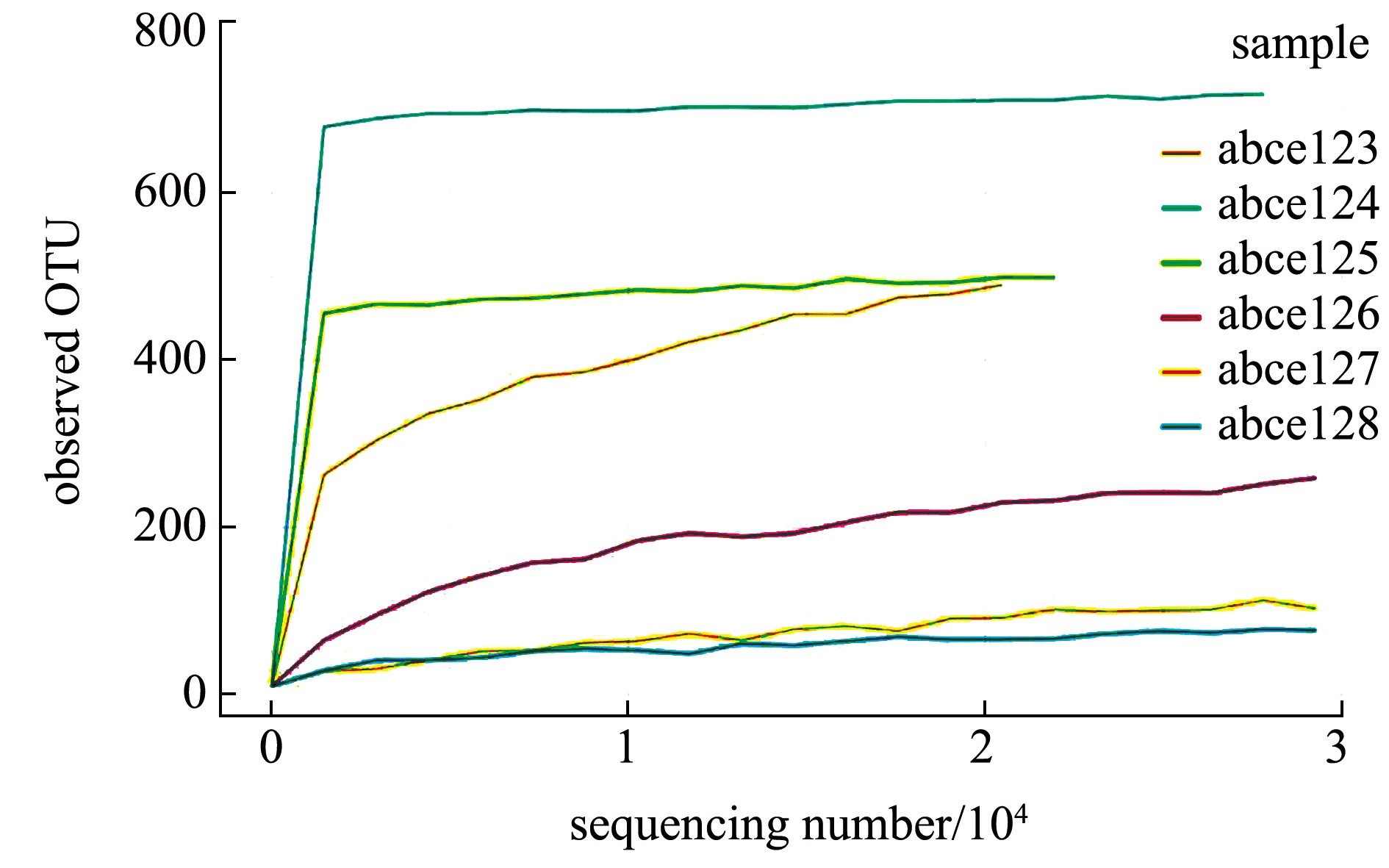
图1 测序样品中OTU稀释曲线
Fig.1 OTU dilution curve of sequencing samples

图2 测序样品中细菌多样性的等级分布曲线
Fig.2 Hierarchical distribution curve of bacterial diversity in sequenced samples
2.3.3 OTU丰度的PCA分析 利用OTU数据绘制PCA图,进一步分析观察各样品间的关系,样品间距离越远表示样品的物种组成差异越大。从图3可见:PC1轴对样品的贡献率为92.7%,PC2轴对样品的贡献率为6.62%,高位铺膜池和土池肠道样品的距离较远,这说明肠道样品的物种组成差

图3 OTU丰度的PCA分析结果
Fig.3 PCA results of OTU abundance
异较大;土池中的abce123肠道样品与另外2个肠道样品距离较远,高位铺膜池中的abce127肠道样品与另外2个肠道样品距离较远。这表明,土地与高位铺膜池杂交鳢肠道细菌组成差异较大。
2.4 不同养殖模式杂交鳢肠道菌群结构组成
2.4.1 门水平菌群组成 从图4可见:土池杂交鳢肠道样品中优势细菌门类包括酸杆菌门Acidobacteria、放线菌门Actinobacteria、拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、梭杆菌门Fusobacteria、变形菌门Proteobacteria 和软壁菌门Tenericutes,而高位铺膜池杂交鳢肠道样品中优势细菌门类包括厚壁菌门Firmicutes和梭杆菌门Fusobacteria;土池样品abce123中变形菌门所占比例明显高于其他门类,样品abce124和样品abce125中分别以变形菌门和拟杆菌门所占比例最高,而高位铺膜池 3 个样品中均以梭杆菌门所占比例最高。这表明,土池杂交鳢样品肠道物种丰富度明显高于高位铺膜池。
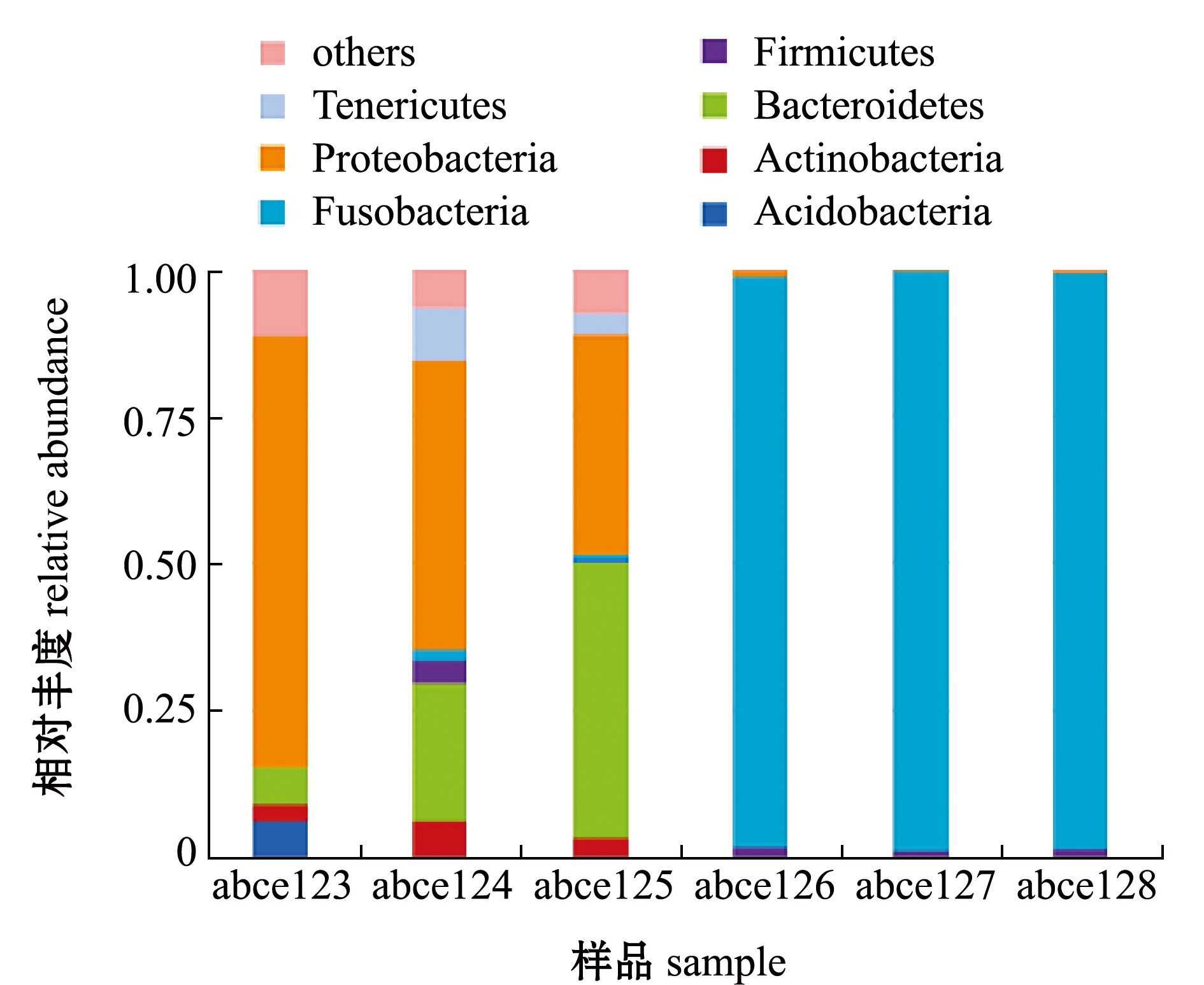
图4 各样品中门水平上的物种相对丰度
Fig.4 Relative species abundance in each sample at phylum level
2.4.2 属水平菌群组成 进一步对高位铺膜池和土池杂交鳢肠道样品中细菌进行属类别统计。从图5可见:土池杂交鳢肠道样品中优势菌目类包括食酸菌属Acidovorax、不动杆菌属Acinetobacter、鲸杆菌属Cetobacterium、金黄杆菌属Chryseobacterium和支原体属Mycoplasma,而高位铺膜池杂交鳢肠道样品中优势细菌属类为鲸杆菌属Cetobacterium;土
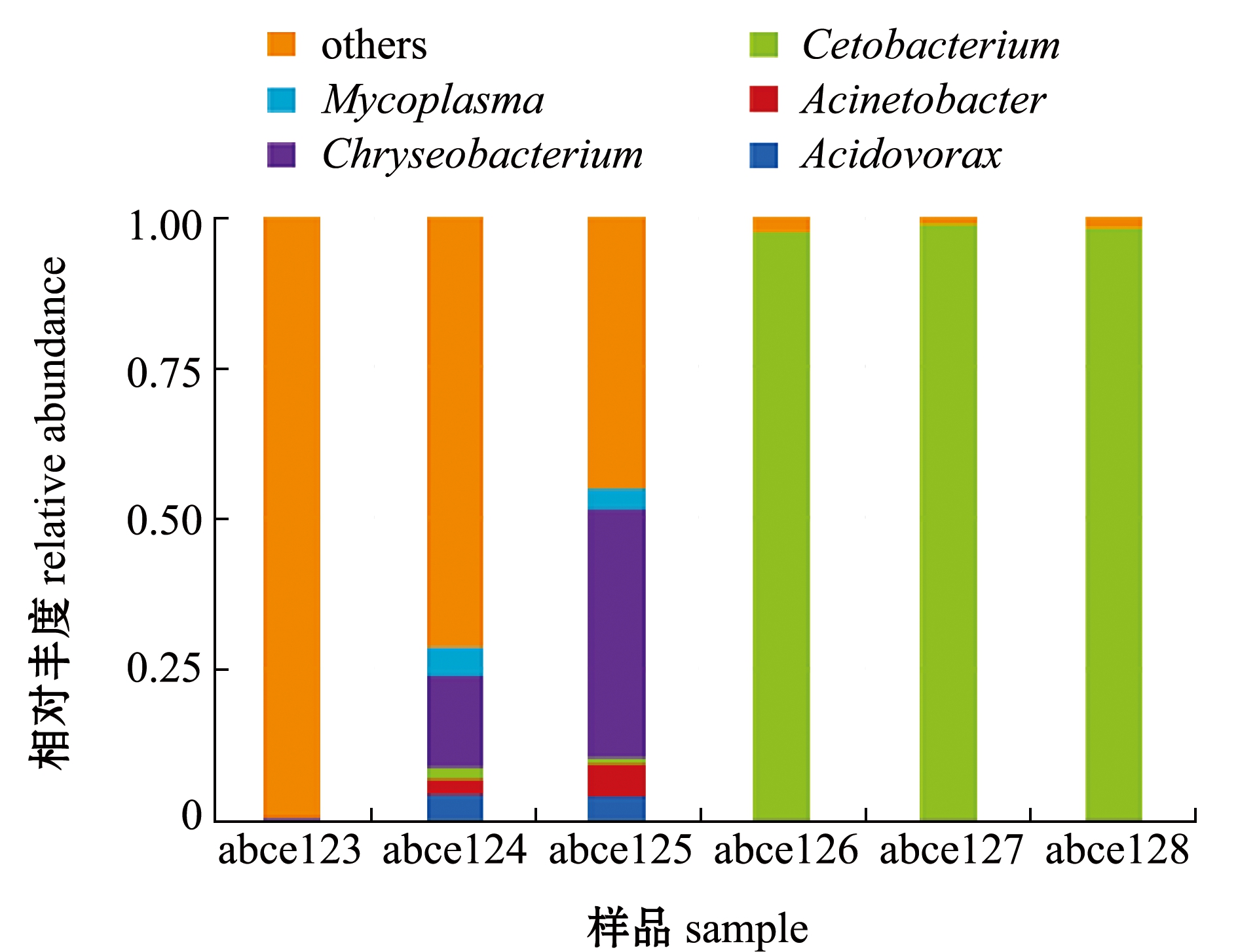
图5 各样品中属水平上的物种相对丰度
Fig.5 Relative species abundance in each sample at genus level
池abce123肠道样品中优势细菌属类均为未知细菌属类,abce124肠道样品中优势细菌属类按丰度依次为金黄杆菌属、支原体属、食酸菌属、不动杆菌属和鲸杆菌属,abce125肠道样品中优势细菌属类按丰度依次为金黄杆菌属、不动杆菌属、食酸菌属、支原体属和鲸杆菌属,而高位铺膜池 3 个样品中均以鲸杆菌属为主。
3 讨论
3.1 养殖杂交鳢的土池和高位铺膜池水质分析
高位铺膜池的水温、pH与土池无显著性差异,但总氨氮、亚硝酸盐氮、硝酸盐氮和总碱度均明显低于土池,这可能是高位铺膜池换水频率高且换水量大造成的。相关研究表明,水产动物在幼体阶段的肠道微生物组成最初来源于水环境,而水体中温度、pH、氨氮等理化因子的变化会影响水体中微生物组成,从而影响水产动物肠道微生物的组成[17-18]。
3.2 土池和高位铺膜池养殖的杂交鳢肠道微生物多样性和丰度比较
研究肠道微生物的传统方法主要有传统培养、变性梯度凝胶电泳(DGGE)和末端限制性长度(T-RFLP)等技术[18-19],但均存在诸多缺陷,不能全面揭示肠道微生物结构多样性的特点。近年来,随着科学技术的发展,高通量测序技术凭借高准确性、测序速度快、成本低和测序范围广等优点开始在肠道微生物研究中广泛应用[20]。本试验中,利用高通量测序技术分析杂交鳢在不同养殖模式下肠道细菌群落组成差异,发现不同养殖模式下杂交鳢肠道微生物菌落结构有显著性差异。高位铺膜池的 3 个样本abce126、abce127和abce128分别获得136、85和 79 个OTU;土池的 3 个样本abce123、abce124和abce125分别获得1 034、489和 414 个OTU,这与徐晟云等[21]在不同环境下取样杂交鳢肠道内容物测出OTU的数量差异较大的结果一致,可能与杂交鳢所处的水环境及投喂饵料种类不同有关[22]。本研究中,通过样品测序序列和OTU丰度计算Alpha多样性指数(ACE、 Chao1、 Shannon、 Simpson),综合分析表明,土池杂交鳢肠道菌群多样性高于高位铺膜池,这与李存玉[23]关于池塘养殖牙鲆肠道菌群多样性高于工厂化养殖结果一致,这可能是杂交鳢喜欢钻泥的习性导致的,池塘养殖的杂交鳢在自然环境中以池塘底泥为食物来源,这样其肠道内的微生物含量就较高,菌群结构较为复杂。陆振等[24]研究也发现,池塘养殖刺参肠道菌群结构比海上吊笼养殖更丰富。至于本研究中高位铺膜池样本abce126和土池样本abce123的OTU数量分别明显高于另外 2 个样本的原因还有待进一步研究。
3.3 土池和高位铺膜池养殖的杂交鳢肠道细菌群落组成比较
在门水平上,本研究中土池的3 个样品中细菌门类丰富,以变形菌门和拟杆菌门为优势菌门,有研究表明,变形菌门、厚壁菌门、拟杆菌门等是鱼类肠道中的优势菌门[25],而高位铺膜池 3 个样品中均以梭杆菌门所占比例最高,占 90%以上,微生物群落结构单一,与土池样品细菌门类构成差异较大,这可能与杂交鳢不同发育阶段和营养状态(饥饿、饱食)等因素有关。Verner-Jeffreys等[26]发现,大西洋比目鱼Hippoglossus hippoglossus L.肠道菌群在仔鱼卵黄囊阶段以假单胞菌Pseudoalteromonas为主,而在开口仔鱼阶段则以弧菌Vibrio anguillarum为主。Xia等[27]也发现,饥饿可以改变亚洲鲈肠道细菌群落的组成。
在属水平上,本研究中土池abce123肠道样品中优势细菌属类均为未知细菌属类,abce124肠道样品中优势细菌属类按丰度依次为金黄杆菌属、支原体属、食酸菌属、不动杆菌属和鲸杆菌属,abce125肠道样品中优势细菌属类按丰度依次为金黄杆菌属、不动杆菌属、食酸菌属、支原体属和鲸杆菌属,其中,金黄杆菌属属于拟杆菌门,支原体属属于厚壁菌门;高位铺膜池 3 个样品中均以鲸杆菌属为主,淡水鱼类肠道内好氧、兼性厌氧细菌一般以气单胞菌属、不动杆菌属、假单胞菌属、黄杆菌属和肠杆菌科等为主[28],鲸杆菌属可以发酵多肽碳水化合物并在其过程中产生维生素B12[29],这说明鲸杆菌属在鱼类消化和营养方面有着重要作用。土池杂交鳢肠道样品中,微生物群落多样性明显高于高位铺膜池,但鳢肠道中鲸杆菌属的比例明显低于高位铺膜池。
微生物群落的生物多样性可反映一定区域内微生物资源的丰富程度,可以评价微生物群落的结构特征、稳定度等[30]。Yachi等[31]曾经提出过保险假说,当外界环境不断发生变化时,较高的生物多样性一定程度上可以缓冲环境变化带来的压力,使生态系统维持相对稳定。维持微生物群落多样性在一定程度上可以降低养殖生物发病的风险[32],在实际生产中,相同条件下土池养殖杂交鳢换水一次可以维持池塘生态系统稳定的时间大约是高位铺膜池的2倍。
4 结论
1)养殖杂交鳢的土池和高位铺膜池,温度和pH无显著性差异,土池的氨氮、亚硝酸盐氮、硝酸盐氮和总碱度明显高于高位铺膜池。
2)土池养殖杂交鳢肠道样品OTU丰度和Alpha多样性指数(ACE、Chao1、Shannon、Simpson)明显高于高位铺膜池。
3)在门和属水平上,土池养殖杂交鳢肠道样品微生物多样性均大于高位铺膜池。
[1] 张龙岗,刘羽清,朱树人,等.乌鳢和杂交鳢4种同工酶的比较研究[J].长江大学学报(自然科学版),2017,14(18):33-36.
[2] 张延华,马国红,宋理平.工厂化养殖饲喂冰鲜鱼和配合饲料对乌鳢肌肉品质的影响[J].长江大学学报(自然科学版),2019(5):72-77.
[3] LIU J S,CUI Y B,LIU J K.Resting metabolism and heat increment of feeding in mandarin fish (Siniperca chuatsi) and Chinese snakehead (Channa argus)[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2000,127(2): 131-138.
[4] 杨四秀,蒋艾青.斑鳢含肉率及肌肉营养成分的测定[J].水产科学,2008,27(12):662-664.
[5] 秦伟夫,蒋俊和.乌鳢复元汤促进术后大鼠切口愈合的实验研究[J].中国中医药现代远程教育,2010,8(10):189-190.
[6] 张新铖,陈昆慈,朱新平.乌鳢、斑鳢及杂交种养殖研究现状[J].广东农业科学,2011,38(22):132-134.
[7] 赵超,张洪海,陈磊,等.乌鳢养殖对浮游动物群落结构的影响[J].动物学杂志,2014,49(1):63-70.
[8] 胡蕾,刘礼辉,杨圆圆,等.杂交鳢舒伯特气单胞菌弱毒疫苗候选株筛选及其免疫效果评价[J].淡水渔业,2019,49(5):74-79.
[9] ZHU S R,MA K Y,XING Z J,et al.The complete mitochondrial genome of Channa argus,Channa maculata and hybrid snakehead fish [Channa maculata (♀) ×Channa argus (♂)] [J].Mitochondrial DNA,2013,24(3):217-218.
[10] 孙东雨,沈理,金珊,等.鰤鱼诺卡氏菌对乌鳢血液指标的影响[J].基因组学与应用生物学,2012,31(3):289-294.
[11] NAYAK S K.Role of gastrointestinal microbiota in fish[J].Aquaculture Research,2010,41(11):1553-1573.
[12] LEY R E,LOZUPONE C A,HAMADY M,et al.Worlds within worlds:evolution of the vertebrate gut microbiota[J].Nature Reviews Microbiology,2008,6(10):776-788.
[13] DE SCHRYVER P,VADSTEIN O.Ecological theory as a foundation to control pathogenic invasion in aquaculture[J].The ISME Journal,2014,8(12):2360-2368.
[14] 伍元植,简纪常,蔡双虎.乌鳢出血病的病原及组织病理学研究[J].广东海洋大学学报,2017,37(4):41-45.
[15] 苗淑彦,朱锦裕,赵臣泽,等.豆粕替代鱼粉对乌鳢肠道内产蛋白酶好氧菌组成及产蛋白酶能力的影响[J].动物营养学报,2017,29(11):4076-4084.
[16] 刘书贵,吴仕辉,郑光明,等.呋喃西林代谢物在杂交鳢(斑鳢♀×乌鳢♂)体内的残留消除规律研究[C]//2012年中国水产学会学术年会论文集.深圳:中国水产学会,2012.
[17] 张家松,段亚飞,张真真,等.对虾肠道微生物菌群的研究进展[J].南方水产科学,2015,11(6):114-119.
[18] 张盛静,赵小金,宋晓玲,等.人工养殖对虾肠道内可培养细菌数量及组成分析[J].上海海洋大学学报,2015,24(2):211-218.
[19] 李志勇,何丽明,吴杰,等.基于PCR-DGGE基因指纹的对虾体内优势细菌组成分析[J].微生物学通报,2005,32(3):82-86.
[20] 王兴春,杨致荣,王敏,等.高通量测序技术及其应用[J].中国生物工程杂志,2012,32(1):109-114.
[21] 徐晟云,陈昆慈,罗青,等.基于16S rRNA高通量测序的鳢肠道微生物群落结构研究[J].大连海洋大学学报,2020,35(5):693-700.
[22] NAVARRETE P,MAGNE F,ARANEDA C,et al.PCR-TTGE analysis of 16S rRNA from rainbow trout (Oncorhynchus mykiss) gut microbiota reveals host-specific communities of active bacteria[J].PLoS One,2012,7(2):e31335.
[23] 李存玉.池塘养殖牙鲆肠道菌群结构及其与益生菌调控的关系[D].上海:上海海洋大学,2015.
[24] 陆振,杨求华,黄瑞芳,等.池塘养殖和海上吊笼养殖仿刺参肠道菌群结构对比分析[J].应用海洋学学报,2017,36(2):187-194.
[25] 翟万营,郭安宁.鱼类肠道微生物研究进展[J].河南水产,2016(4):18-21,40.
[26] VERNER-JEFFREYS D W,SHIELDS R J,BRICKNELL I R,et al.Changes in the gut-associated microflora during the development of Atlantic halibut (Hippoglossus hippoglossus L.) larvae in three British hatcheries[J].Aquaculture, 2003,219(1/2/3/4):21-42.
[27] XIA J,LIN G,FU G,et al.The intestinal microbiome of fish under starvation[J].BMC Genomics,2014,15(1):266.
[28] G MEZ G D,BALC
MEZ G D,BALC ZAR J L.A review on the interactions between gut microbiota and innate immunity of fish[J].FEMS Immunology & Medical Microbiology,2008,52(2):145-154.
ZAR J L.A review on the interactions between gut microbiota and innate immunity of fish[J].FEMS Immunology & Medical Microbiology,2008,52(2):145-154.
[29] PANIGRAHI A,KIRON V,KOBAYASHI T,et al.Immune responses in rainbow trout Oncorhynchus mykiss induced by a potential probiotic bacteria Lactobacillus rhamnosus JCM 1136[J].Veterinary Immunology and Immunopathology,2004,102(4):379-388.
[30] 吴湘香,李云峰,沈子伟,等.赤水河浮游植物群落结构特征及其与水环境因子的关系[J].中国水产科学,2014,21(2):361-368.
[31] YACHI S,LOREAU M.Biodiversity and ecosystem productivity in a fluctuating environment:the insurance hypothesis[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(4):1463-1468.
[32] LOREAU M,NAEEM S,INCHAUSTI P,et al.Biodiversity and ecosystem functioning:current knowledge and future challenges[J].Science,2001,294(5543):804-808.