鲟鱼起源于泥盆纪(距今4.5~3.5亿年),是最早的脊椎动物类群之一,也是软骨硬鳞亚纲Chondrostei中现仅存的唯一的目[1],具有“活化石”之称,在分类学上属于硬骨鱼总纲Osterichthyes辐鳍鱼纲Actinopterygii软骨硬鳞亚纲Chondrostei鲟形目Acipenseriformes。鲟鱼骨骼除头颅骨外,绝大多数为软骨,是介于软骨鱼类与硬骨鱼类之间的过渡类型,在鱼类进化史上具有重要地位,对研究脊椎动物的起源与进化具有重要的理论意义[1],而对仔稚幼鱼骨骼系统的研究将使鱼类系统演化的讨论更加深入,且能探讨各类群间的系统发育关系[2]。目前,国内有关鲟形目鱼类骨骼系统形态特征方面的研究报道较少,其中对白鲟Psephurus gladius骨骼系统[3-5]的研究最多且较为详细,还有学者对短吻鲟Acipenser brevirostrum Lesueur[6]、黄鲟Acipenser dabryanus[7]、达氏鳇Huso dauricu[8]、中华鲟Acipenser sinensis Gray[9]和西伯利亚鲟Acipenser.gueldenstaedtii[10]等其他种类的鲟形目鱼类骨骼系统形态特征进行了相关研究,但未发现对鲟鱼骨骼骨化过程的研究。
施氏鲟是中国现存鲟鱼中最具有经济价值的优质珍稀鱼类,其个体大、寿命长、生长速度快,是中国最主要的鲟鱼养殖种类,主要分布在黑龙江水系。早在1964年就有学者对施氏鲟Acipenser schrencki Brandt(原文献中称北鲟) [11]的骨骼系统进行了解剖研究,但在其发育过程中,骨骼骨化的时间是未知的。本研究中,选取不同发育阶段施氏鲟的仔稚幼鱼,采用阿尔新蓝-茜素红染色技术对骨骼系统进行硬骨-软骨双染色,拍照、分析相应骨骼的基本特征,并概述了骨骼骨化的时间,以期为进一步开展不同发育阶段鲟鱼骨骼系统发育的研究奠定基础,并为其环境适应及脊椎动物的起源与进化等相关研究提供基础资料。
1 材料与方法
1.1 材料
试验用施氏鲟亲鱼来自北京市水产科学研究所房山十渡鲟鱼繁育基地。
1.2 方法
1.2.1 施氏鲟仔稚幼鱼的培育 试验于2020年6月在北京市水产科学研究所房山十渡鲟鱼繁育基地进行,曾于2019年6月在此进行过预试验。对亲鱼进行人工催产并通过人工授精获得受精卵,用滑石粉脱黏后,转移到孵化器中孵化。初孵仔鱼在直径2 m、高0.5 m的圆形玻璃钢水槽中流水培育,每缸放养密度8 000尾鱼苗,水温(17.9±0.5)℃,pH 8.0~8.2,溶解氧量4.5~5.8 mg/L,养殖用水由地下井水经曝气和充氧后使用。鱼苗孵化后7 d开口摄食,用微颗粒饲料(山东圣索饲料科技有限公司)投喂,间隔3 h投喂1次,每天投喂8次,初期投饵量为鱼体质量的1.5%,过量投喂,一周后根据鱼苗的生长情况、摄食情况及时调整投饵量及更换不同粒径的饲料。投喂时水面静止30 min以上,让其充分摄食,并及时清理剩余饵料及死去的鱼苗,保持水体清洁。
1.2.2 样本的采集 在前期预实验初步判定施氏鲟骨骼发育分期的基础上,分别在12个不同的时间点随机采集样本,即孵化后0、5、10、15、20、22、24、26、28、30、40、50 d,每个时期采集的样本不少于5个,避免采集外形畸形的样本。用过量的丁香酚麻醉后,采用电子天平称量体质量,用游标卡尺测量全长,然后用体积分数为10%的福尔马林溶液固定至少24 h,以确保充分固定,之后在室温下保存,用于骨骼染色。
1.2.3 样本的骨骼染色 阿尔新蓝-茜素红S染色法是一种比较成熟的方法,该方法可以对多种生物样本进行软骨和硬骨染色[12-14],但是不同文献中的方法步骤存在很大的差异[15-16] 。本研究中,在梁小毛[17]采用的阿尔新蓝-茜素红染色方法基础上稍做改进,具体染色过程及方法如表1所示。
表1 阿尔新蓝-茜素红S染色法
Tab.1 Alcian blue and alizarin red S staining technique

染色步骤 staining step试验过程 experimental process样本处理sample treatment将样本鱼麻醉,称量样本质量,测量体长和全长,稍大样本固定前需解剖去除内脏,注意不要采集外形畸形的样品固定fixation用体积分数10%的福尔马林溶液浸泡鲟鱼样本,至少24 h或更长时间(根据材料大小而定),浸泡完成后用蒸馏水冲洗样本至少24 h,或用自来水流水冲洗过夜,以彻底清除固定剂。再用梯度酒精溶液(30%酒精→50%酒精→75%酒精→95%酒精,均为体积分数)浸泡脱水,每个体积分数的酒精浸泡时间至少0.5 h酶解zymolysis将样本浸泡在饱和硼砂钠的胰蛋白酶溶液中,置于保温箱内,温度设置为34 ℃左右,根据酶解程度调整消化时间,直至稍见骨骼即可,每20 min检查一次酶解情况。其中,1.5 g/L的胰蛋白酶溶液配制:0.15 g胰蛋白酶和100 mL饱和硼砂钠溶液软骨染色cartilage staining用0.2 g/L的阿利新蓝染色液浸泡鲟鱼样本,至少24 h,期间可以更换染液。注意不要染色过度,否则未被消化的肌肉会变蓝。其中,0.2 g/L阿利新蓝染色液配制:0.2 g阿利新蓝 8GN、700 mL无水乙醇和300 mL 冰醋酸水化hydration用梯度酒精溶液(95%酒精→75%酒精→50%酒精→30%酒精,均为体积分数)浸泡水化,每个体积分数的酒精浸泡时间至少0.5 h,最后将样本转移到蒸馏水中浸泡水化,可换水2~3次或更多次,每次浸泡至少0.5 h调节渗透压osmoregulation用质量分数0.5%的氢氧化钾溶液浸泡鲟鱼样本,至少0.5 h,期间可更换试剂,目的是构建KOH环境帮助茜素红S渗透入骨硬骨染色bone staining用茜素红染色剂浸泡鲟鱼样本,至少24 h,注意不要染色过度,否则未被消化的肌肉会变红。其中,0.05 g/L茜素红S溶液的配制:0.05 g茜素红S和1 000 mL 0.5% KOH 溶液保存preservation用蒸馏水清洗样本,然后放入甘油体积分数逐渐增加的甘油和1%(质量分数)氢氧化钾混合溶液(甘油与1%氢氧化钾比例为1∶3→1∶1→3∶1)中浸泡,最后保存在纯甘油中,每个比例的混合溶液浸泡时间至少为24 h,期间可更换试剂
1.2.4 骨骼染色样本的观察 染色的仔稚幼鱼样品放入加有甘油的培养皿中,用徕卡(Leica)M205FA体视镜观察,用徕卡LAS V4.8拍照系统进行图像采集,并用Adobe Photoshop CS 软件(www.photoshop.com)进行处理。
2 结果与分析
2.1 施氏鲟骨骼系统的组成
本研究中参照孟庆闻等[3]及李怀明等[11]的研究,对施氏鲟骨骼系统进行了概述和标注,其分为主轴骨骼(axial skeleton)和附肢骨骼(appendicular skeleton)两部分,主轴骨骼由头骨(skull)、脊柱(vertebral column)和肋骨(rib)组成,附肢骨骼由带骨(girdle)、支鳍骨骼(pterygiophore)和鳍条(fin-ray)组成。
2.1.1 主轴骨骼 脑颅(neurocranium):施氏鲟幼鱼的脑颅较为宽长,整体呈纺锤形,内层由整块的软骨构成,而外层覆盖硬骨质膜片,且在吻部至鼻孔背面有许多吻部小骨片。主要膜骨骨片有鼻窝上方一对长方形的额骨,两额骨间夹有2小块近椭圆形的中额骨,其后方中央有一对颇长的顶骨,顶骨外侧是一对长方形的翼耳骨;后端枕骨区有正中的上枕骨和两侧的外枕骨,外枕骨后外侧为后颞骨;眼窝上方为眶上骨,其前后及腹面围有小的围眶骨。脑颅腹面正中有发达的副蝶骨,侧面有一系列的鳃盖骨片。
咽颅(splanchnocranium):施氏鲟咽颅骨化程度较少,大部分为软质骨。咽颅分为颌弓(arcus mandibularis)、舌弓(arcus hyoideus)和鳃弓(arcus branchialis) 3个区域。施氏鲟的颌弓分背腹两面,背面为上颌,腹面为下颌,上颌由上颌骨、方轭骨和颚方软骨组成,下颌由齿骨、关节骨和米克尔氏软骨组成。施氏鲟的舌弓由舌颌骨、关节骨、角舌骨、下舌骨和间舌骨等构成。施氏鲟主要有5对鳃弓。
脊柱(columna vertebralis):施氏鲟的脊索呈圆柱形,贯穿全身,终生存在,位于脊髓的腹面,没有真正的椎体,周围被加厚的脊索鞘包围。按形态不同可将脊柱分为躯干部脊柱和尾部脊柱。肋骨位于躯干部脊柱的两侧,每根肋骨一端与脊柱的横突相连,另一端游离。
2.1.2 附肢骨骼 施氏鲟的肩带位于脏颅的后方两侧,支持胸鳍,由膜质的上匙骨、匙骨、乌喙骨、乌喙部软骨和肩胛部软骨组成。背鳍位于尾部的背侧,比臀鳍略前,与身体垂直,呈三角形;臀鳍位于腹面正中央,前缘正对背鳍中部,距肛门较远,鳍与身体背腹面平行;胸鳍小呈圆形[18],位于头后体腹的两侧,与身体垂直相交;腹鳍位于肛门前的腹部两侧,与身体垂直相交,长度仅为胸鳍的一半;尾鳍为歪尾形,尾部椎骨向上弯曲,将尾鳍分为上下两叶,基部分叉,下叶较发达,上叶边缘有一排棘状鳞。
2.2 施氏鲟仔稚幼鱼骨骼系统的染色观察
根据鱼类的形态特征,鱼类早期发育可分为仔鱼期、稚鱼期和稚鱼期。鲟鱼仔鱼期一般指孵化后至开口摄食的阶段,稚鱼期则指开口摄食至鱼体表五列骨板形成的阶段。也有人把仔鱼称为前期仔鱼,稚鱼则称为后期仔鱼。幼鱼则是指体表五列骨板已长至尾柄基部,外观上具备成鱼体型的鲟鱼[19-20]。
2.2.1 仔鱼期 刚孵化(图1)的仔鱼长(11.49±0.10)mm,头部较小,身体纤细透明,卵黄囊呈椭圆形,原始鳍褶将躯干部和尾部分开,口和鳃裂还未形成,嗅觉、味觉等感觉器官也未发育,但可见有色眼睛,此阶段不存在硬骨元件。

图1 施氏鲟孵化后0 d骨骼发育
Fig.1 Skeletal development of Amur sturgeon Acipenser schrenckii 0 day post hatching(DPH)
5日龄(图2)仔鱼全长(17.21±0.20)mm,存在的骨骼元件主要集中在头部,头骨及身体后半部分的色素沉积明显增多。吻部清晰可见,前端有须4根。眼睛呈深色,哑铃形状的鼻孔出现。鳃盖尚未将鳃全部覆盖住,鳃丝露出鳃盖。各鳍均已形成,卵黄囊消耗产生的残留物在螺旋瓣后段可见。脊索呈圆柱形,贯穿全身。

A—侧面观; B—背面观; C—腹面观; pq—腭方软骨; mc—米克尔氏软骨。
A—side view; B—dorsal view; C—ventral view; pq—palatoquadrate; mc—Meckel’s cartilage.
图2 施氏鲟孵化后5 d骨骼发育
Fig.2 Skeletal development of Amur sturgeon Acipenser schrenckii 5 DPH
2.2.2 稚鱼期 10日龄(图3)稚鱼全长(21.97±0.30)mm,鱼体已经开口摄食,身体各部分骨骼发育更加完善。出现了新的形态特征,背骨板及各鳍的幅状软骨形成,卵黄囊明显消失,鳃盖清晰可见,舌弓的角舌骨、鳃弓的角鳃软骨也是本阶段可观察到的结构。视网膜部分呈金色,身体各部分色素明显增多。

A—侧面观;B—背面观; C—腹面观; ds—背骨板; r—幅状软骨; ch—角舌骨; cb—角鳃软骨。
A—side view; B—dorsal view; C—ventral view; ds—dorsal scute; r—radialium; ch—ceratohyale; cb—ceratobranchial.
图3 施氏鲟孵化后10 d骨骼发育
Fig.3 Skeletal development of Amur sturgeon Acipenser schrenckii 10 DPH
15日龄(图4)稚鱼全长(22.45±0.60)mm,咽颅发育良好,牙齿、侧骨板形成。尾部的椎骨末端向背上方弯曲,形成歪型尾。

A—侧面观; B—背面观; C—腹面观; ls—侧骨板; t—牙齿。
A—side view; B—dorsal view; C—ventral view; ls—lateral scute; t—teeth.
图4 施氏鲟孵化后15 d骨骼发育
Fig.4 Skeletal development of Amur sturgeon Acipenser schrenckii 15 DPH
20日龄(图5)稚鱼全长(23.20±2.00)mm,身体各部分骨骼基本形成,形态上无明显变化。骨骼骨化过程在本阶段逐渐开始,上颌骨、齿骨及牙齿最先骨化。

A—侧面观; B—背面观; C—腹面观; m—上颌骨; d—齿骨。
A—side view; B—dorsal view; C—ventral view; m—maxilla; d—dentary.
图5 施氏鲟孵化后20 d骨骼发育
Fig.5 Skeletal development of Amur sturgeon Acipenser schrenckii 20 DPH
22日龄稚鱼全长(23.75±2.00)mm,此阶段未发现头部及躯干部的重大变化。
24日龄(图6)稚鱼全长(26.14±4.00)mm,形态上无明显变化。顶骨、后颞骨、下鳃盖骨、肩胛骨及背骨板外侧部分开始骨化。

A—侧面观; B—背面观; C—腹面观; p—顶骨; pt—后颞骨; so—下鳃盖骨; s—肩胛骨。
A—side view; B—dorsal view; C—ventral view; p—parietal; pt—posttermporal; so—suboperculum; s—scapula.
图6 施氏鲟孵化后24 d骨骼发育
Fig.6 Skeletal development of Amur sturgeon Acipenser schrenckii 24 DPH
26日龄(图7)稚鱼全长(32.36±3.00)mm,形态上无明显变化。翼耳骨、锁骨、匙骨开始骨化。

A—侧面观; B—背面观; C—腹面观; cl—匙骨; clv—锁骨; pte—翼耳骨。
A—side view; B—dorsal view; C—ventral view; cl—cleithrum; clv—clavicle; pte—pterotic bone.
图7 施氏鲟孵化后26 d骨骼发育
Fig.7 Skeletal development of Amur sturgeon Acipenser schrenckii 26 DPH
28日龄(图8)稚鱼全长(36.83±4.00)mm,形态上无明显变化。颊骨、额骨、胸鳍硬棘开始骨化。
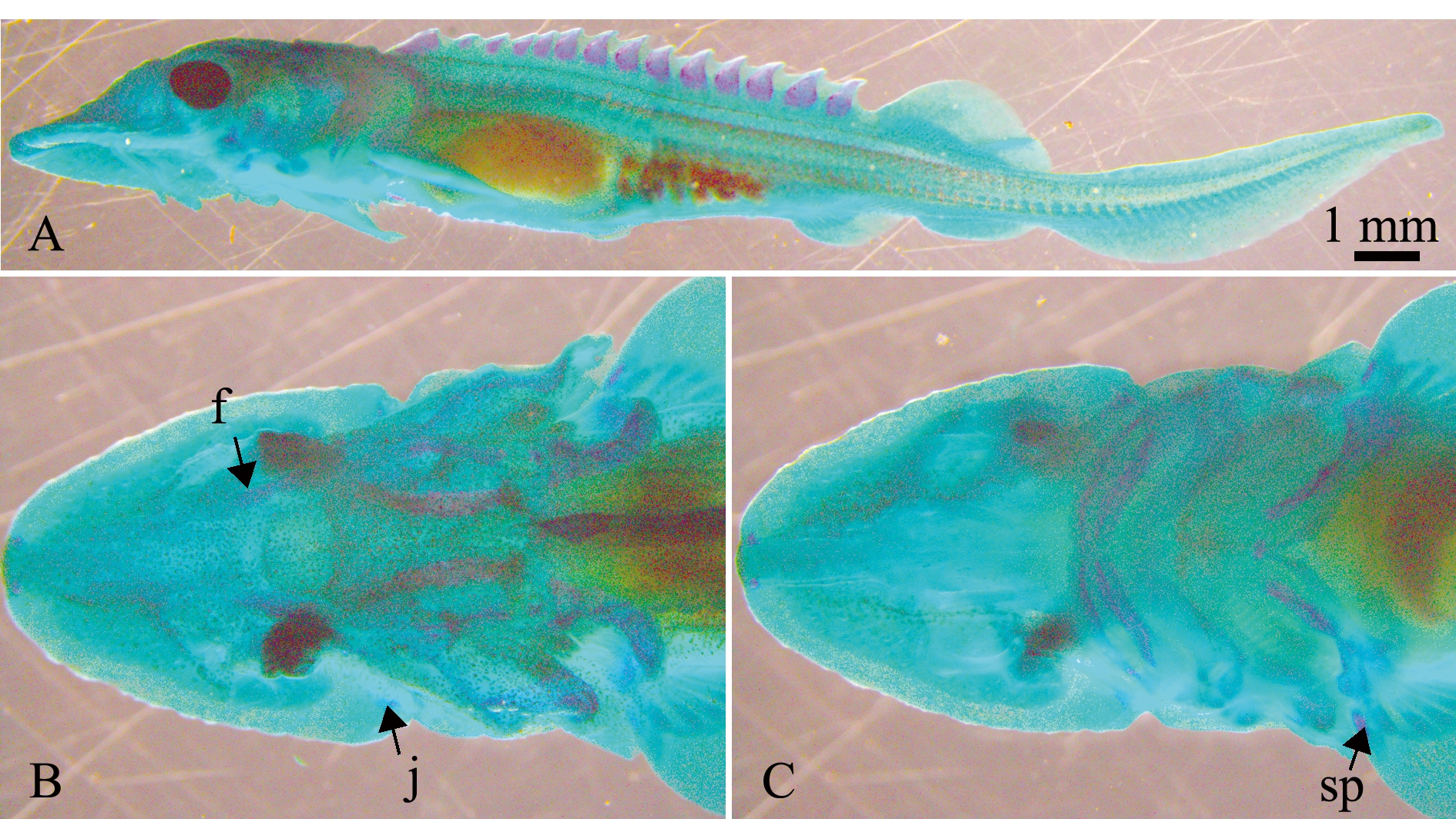
A—侧面观; B—背面观; C—腹面观; f—额骨; j—颊骨; sp—棘。
A—side view; B—dorsal view; C—ventral view; f—frontal; j—jugal; sp—spina.
图8 施氏鲟孵化后28 d骨骼发育
Fig.8 Skeletal development of Amur sturgeon Acipenser schrenckii 28 DPH
30日龄(图9)稚鱼全长(39.75±4.00)mm,器官分化完全,外观与成鱼相似,出现了一些新的幼体特征,如纵向排列的骨板、腹面扁平的身体、细长的触须及歪型尾等。围眶骨、侧骨板开始骨化,背骨板基本完成骨化。
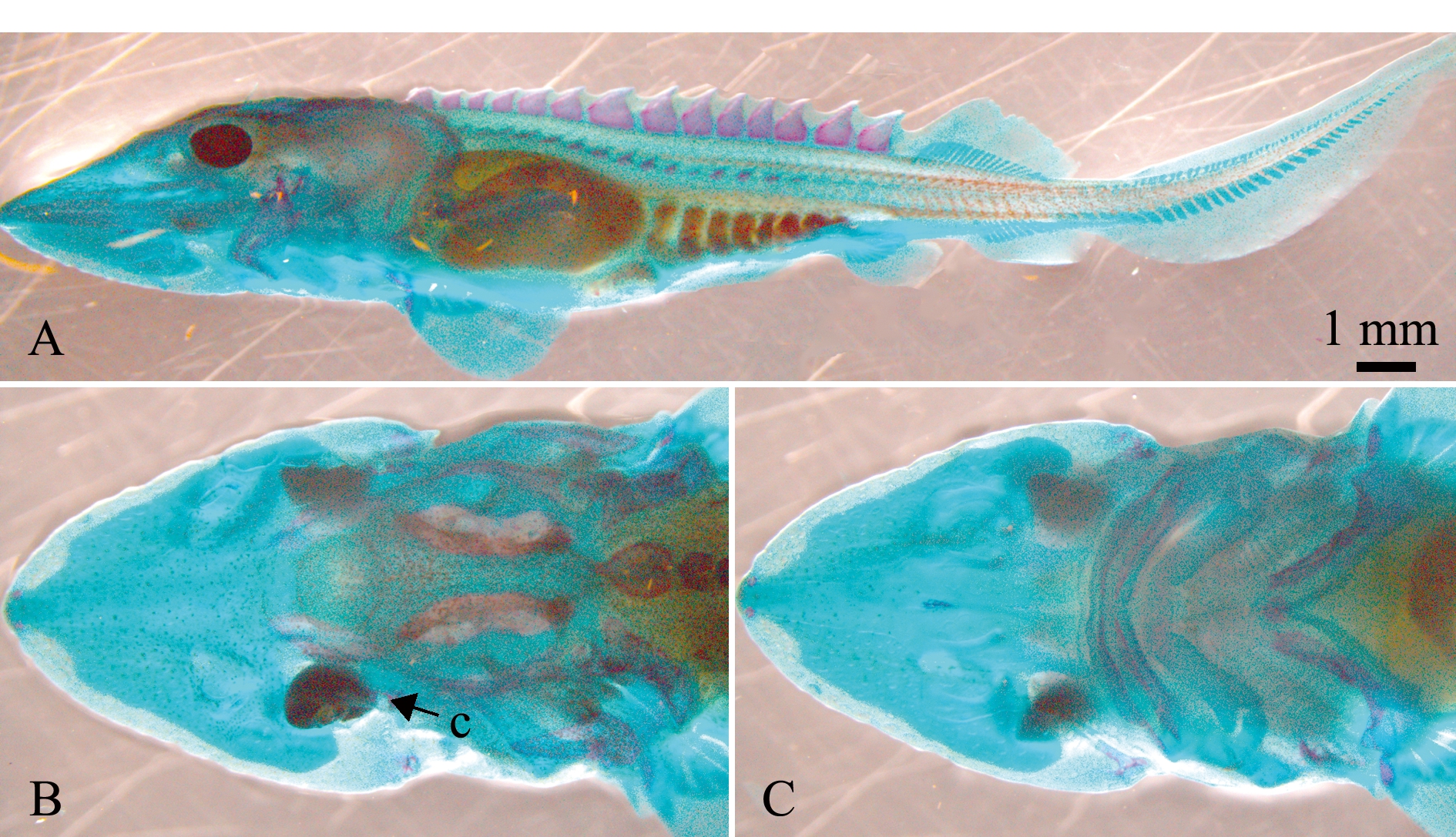
A—侧面观; B—背面观; C—腹面观; c—围眶骨。
A—side view; B—dorsal view; C—ventral view; c—circumorbital.
图9 施氏鲟孵化后30 d骨骼发育
Fig.9 Skeletal development of Amur sturgeon Acipenser schrenckii 30 DPH
2.2.3 幼鱼期 40日龄(图10)幼鱼全长(76.26±4.00)mm,骨骼基础框架基本完成发育,各器官分化完全,外形向成体过渡。尾部椎骨向上弯曲,将尾鳍分为上下两叶,基部分叉,下叶较发达,上叶边缘有一排棘状鳞,其下为背辐状软骨。吻部小骨片、腹骨板,以及腹鳍、臀鳍、背鳍、胸鳍最外侧幅状鳍条均已发生骨化。

A—侧面观; B—背面观; C—尾鳍发育; vs—腹骨板; or—吻部小骨片; fu—棘状鳞:fr—鳍条。
A—side view; B—dorsal view; C—caudal fin development; vs—ventral scute; or—ossiculi rostralia; fu—fulcra;fr—fin ray.
图10 施氏鲟孵化后40 d骨骼发育
Fig.10 Skeletal development of Amur sturgeon Acipenser schrenckii 40 DPH
50日龄(图11)幼鱼全长(105.32±5.00)mm,身体各部分进一步发育,未见新骨化骨骼。

图11 施氏鲟孵化后50 d骨骼发育
Fig.11 Skeletal development of Amur sturgeon Acipenser schrenckii 50 DPH
3 讨论
3.1 施氏鲟骨骼系统发育的功能适应性
骨骼发育起始于骨化前软骨的形成,并且与仔稚幼鱼不同时期的功能需求密切相关[21]。饥饿和被捕食是影响仔稚幼鱼存活的主要影响因素[22-25],因此,在长期的进化过程中形成了与生存相关的器官优先发育的发育模式[26]。
本研究中,在施氏鲟仔鱼期,与摄食和呼吸相关的米克尔氏软骨、腭方骨、角舌骨、角鳃软骨已经形成,且在仔鱼期未观察到任何骨化骨骼。伴随着外源性摄食的开始,稚鱼期进入快速生长阶段,脑颅、咽颅及附肢骨骼迅速发育。施氏鲟20日龄时第一次观察到骨化的骨骼,为上颌骨、齿骨及牙齿,大大增强了鱼苗的摄食能力,脑颅其他骨骼的骨化在此阶段刚刚开始并逐步增加。24日龄时,施氏鲟稚鱼顶骨、后颞骨、下鳃盖骨及背骨板外侧部分开始骨化,头骨及背骨板的骨化在早期发育中具有重要的防御作用[27]。附肢是鱼体游泳运动重要的协调器官,施氏鲟稚鱼肩胛骨、胸鳍硬棘、侧骨板分别在26、28、30日龄时开始骨化,此时游泳能力极大提高,躲避敌害、主动寻找食物和攻击捕食者能力均随之提高。进入幼鱼期,鱼体骨骼基础框架基本完成发育,吻部小骨片、腹骨板,以及腹鳍、臀鳍、背鳍、胸鳍最外侧幅状鳍条均已发生骨化,鱼体活动更加灵活多变,能够伏击或跟踪饵料鱼,遇到敌害后也能逃避藏匿[28]。
3.2 施氏鲟骨骼系统发育与其他鲟鱼的比较
头骨骨化较为复杂,本研究中,施氏鲟在20日龄时第一次观察到骨化的骨骼,为上颌骨、齿骨和牙齿,随后头部其他部位的骨骼相继骨化,且骨化的牙齿在26日龄时就已消失,施氏鲟在仔稚鱼时期存在犬齿状牙齿[29-30],成体则没有任何牙齿[31]。施氏鲟与波斯鲟Acipenser persicus[15]、西伯利亚鲟A.baerii[32]的骨化部位及顺序相一致,但波斯鲟骨化时间较早,在12日龄时就已经观察到上述骨骼的骨化。
骨板骨化顺序从背骨板开始,然后是侧骨板,最后是腹侧骨板,且由远端向近端逐渐骨化。本研究中,施氏鲟背骨板在24日龄时开始骨化,侧骨板和腹骨板分别在30、40日龄时观察到骨化。西伯利亚鲟[33]骨板骨化的时间与施氏鲟相近,背骨板、侧骨板和腹骨板分别在25、31及37日龄时骨化。杂交鲟Huso huso×Acipenser ruthenus[34]骨板的骨化晚于上述两种鲟鱼,背骨板在59日龄时开始骨化,侧骨板和腹骨板均在91日龄时观察到骨化。
各鳍骨化方式一致,均由基部向末梢骨化。本研究中,施氏鲟5日龄时各鳍均已形成,40日龄时观察到各鳍鳍条的骨化。而在杂交鲟H.huso×A.ruthenus[34]中,背鳍和臀鳍在4日龄时形成,胸鳍在6日龄时出现,上述各鳍鳍条均在59日龄时骨化,腹鳍、尾鳍在10日龄时形成,鳍条在91日龄时骨化。
由此可见,不同种类的鲟鱼,其骨骼骨化的时间节点有所差异,可能是生长环境[35]、饵料投喂、鱼卵大小与质量[36]及地理隔离所造成的种族差异等原因所导致[37]。
此外,本次繁育的施氏鲟骨骼骨化时间相比2019年作者在前期预试验中繁育的施氏鲟早10 d(图12、图13),2019年繁育的施氏鲟在30日龄时才观察到骨化的骨骼,而本研究中在20日龄时就观察到骨化的骨骼。由此可见,即使同种鲟鱼其骨化时间也会因环境或遗传因素等有所差异,本研究中提供了施氏鲟早期骨骼发育进程的大致时间范围。

A—侧面观; B—背面观; C—腹面观。
A—side view; B—dorsal view; C—ventral viewd.
图12 施氏鲟孵化后25 d骨骼发育(2019年)
Fig.12 Skeletal development of Amur sturgeon Acipenser schrenckii 25 DPH(2019)

A—侧面观; B—背面观; C—腹面观。
A—side view; B—dorsal view; C—ventral viewd.
图13 施氏鲟孵化后30 d骨骼发育(2019年)
Fig.13 Skeletal development of Amur sturgeon Acipenser schrenckii 30 DPH(2019)
本研究中采用软骨-硬骨双染色技术确定施氏鲟骨骼骨化的时间,但在发育早期,骨中钙量不足,可能无法通过茜素红染色[34],且进入稚鱼期后,肌肉并不能完全被清除,因此,作者推测骨化开始的时间可能比染色观察到的时间更早一些,今后还需进一步对不同发育阶段的软骨和硬骨组织进行相关功能基因的定量分析,确定其出现及骨化时间。
4 结论
1) 本研究中首次对施氏鲟仔稚幼鱼进行了不同发育时期骨骼染色观察。施氏鲟骨骼发育起始于孵化后,且在发育过程中,与呼吸(颌弓)、摄食(鳃弓)和游泳能力(鳍)相关的骨骼优先发育,骨骼骨化顺序与发育顺序大概一致。
2) 仔鱼期未观察到任何骨化骨骼。
3) 稚鱼期进入快速生长阶段,20日龄时观察到开始骨化的骨骼,为上颌骨、齿骨及牙齿。骨化主要集中在24~30日龄。进入幼鱼期,鱼体骨骼基础框架基本完成发育,鱼体活动更加灵活多变。
4) 施氏鲟骨骼骨化时间与养殖环境、遗传等因素有关。本研究中观测到不同批次施氏鲟骨骼骨化起始时间相差10 d。
[1] BEMIS W E,KYNARD B.Sturgeon rivers:an introduction to acipenseriform biogeography and life history[J].Environmental Biology of Fishes,1997,48(1/2/3/4):167-183.
[2] 苏锦祥,孟庆闻,唐宇平.团头鲂骨骼系统的发育[J].水生生物学报,1989,13(1):1-14.
[3] 孟庆闻,苏锦祥,李婉端.鱼类比较解剖[M].北京:科学出版社,1987.
[4] 西南师范学院生物系动物教研组.白鲟鱼Psephurus gladius(Maztens)的解剖[J].西南师范学院学报,1960(2):79-85,122-129.
[5] 李云,刁晓明,陈林.白鲟骨骼系统的补充修正[J].西南农业大学学报(自然科学版),1997,19(1):36-46.
[6] HILTON E J,GRANDE L,BEMIS W E.Skeletal anatomy of the Shortnose sturgeon,Acipenser brevirostrum Lesueur,1818,and the systematics of sturgeons(Acipenseriformes,Acipenseridae)[J].Fieldiana Life & Earth Sciences,2014,3(3):1-168.
[7] 西南师范学院生物系动物教研组.黄鲟鱼(Acipenser dabnynus Deumaril)的解剖[J].西南师范学院学报,1960(2):72-78,116-121.
[8] 郭长江,赵文,石振广,等.达氏鳇幼鱼骨骼系统解剖研究[J].大连海洋大学学报,2016,31(3):301-306.
[9] 罗泉笙,何学福.中华鲟的解剖[J].西南师范学院学报(自然科学版),1980(2):7-30.
[10] 刘钊,赵仲孟,杨世勇,等.西伯利亚鲟幼鱼骨骼系统解剖研究[J].水生生物学报,2019,43(1):117-122.
[11] 李怀明,宁惠兰,袁敬坤.北鲟Acipenser schrencki Brandt骨骼系统解剖[J].哈尔滨师范学院学报(自然科学版),1964(00):157-168.
[12] HANKEN J,WASSERSUG R.The visible skeleton[J].Functional Photography,1981,16(4):22-26.
[13] TAYLOR W R,VAN DYKE G C.Revised procedures for staining and clearing small fishes and other vertebrates for bone and cartilage study[J].Cybium,1985,9(2):107-119.
[14] DINGERKUS G,UHLER L D.Enzyme clearing of Alcian blue stained whole small vertebrates for demonstration of cartilage[J].Stain Technology,1977,52(4):229-232.
[15] ESHAGHZADEH H,AKBARZADEH A,YARMOHAMMADI M,et al.Skeletogenesis in the Persian sturgeon Acipenser persicus and its correlation with gene expression of vitamin K-dependent proteins during larval development[J].Journal of Fish Biology,2018,92(2):452-469.
[16] WALKER M,KIMMEL C.A two-color acid-free cartilage and bone stain for zebrafish larvae[J].Biotechnic & Histochemistry,2007,82(1):23-28.
[17] 梁小毛.小体鲟骨骼系统解剖研究[D].北京:北京师范大学,2019.
[18] ARTYUKHIN E N,VECSEI P,PETERSON D L.Morphology and ecology of Pacific sturgeons[J].Environmental Biology of Fishes,2007,79(3/4):369-381.
[19] 谢从新.鱼类学[M].北京:中国农业出版社,2010.
[20] 张彤晴,葛家春,盛建明,等.小体鲟仔、稚幼鱼生物学及苗种培育技术初步研究[J].河海大学学报(自然科学版),2002,30(sup):114-117.
[21] 吕雪娇.大菱鲆(Scophthalmus maximus)和鞍带石斑鱼(Epinephelus lanceolatus)生长特性以及骨骼发育与畸形研究[D].青岛:中国科学院大学(中国科学院海洋研究所),2018.
[22] HOUDE E D.Fish early life dynamics and recruitment variability[J].American Fisheries Society Symposium,1987,2:17-29.
[23] BAILEY K M,HOUDE E D.Predation on eggs and larvae of marine fishes and the recruitment problem[J].Advances in Marine Biology,1989,25:1-83.
[24] FUIMAN L A.Early life history of fish:an energetics approach[J].Reviews in Fish Biologyand Fisheries,1992,2(4):348-349.
[25] IGUCHI K,MIZUNO N.Early starvation limits survival in amphidromous fishes[J].Journal of Fish Biology,1999,54(4):705-712.
[26] GAGNAT M R,WOLD P A,BARDAL T,et al.Allometric growth and development of organs in ballan wrasse (Labrus bergylta Ascanius,1767) larvae in relation to different live prey diets and growth rates[J].Biology Open,2016,5(9):1241-1251.
[27] MABEE P M,CROTWELL P L,BIRD N C,et al.Evolution of median fin modules in the axial skeleton of fishes[J].The Journal of Experimental Zoology,2002,294(2):77-90.
[28] 熊玉宇.鳜摄食行为发育[D].北京:中国科学院大学,2012.
[29] 马境,章龙珍,庄平,等.施氏鲟仔鱼发育及异速生长模型[J].应用生态学报,2007,18(12):2875-2882.
[30] 韩骥,王云山,李文龙,等.史氏鲟的早期发育异速生长模式及生态学意义[J].河北渔业,2016 (11):31-36.
[31] 中国科学院中国动物志编委会.中国动物志[M].北京:科学出版社,1998.
[32] WARTH P,HILTON E J,NAUMANN B,et al.Development of the skull and pectoral girdle in Siberian sturgeon,Acipenser baerii,and Russian sturgeon,Acipenser gueldenstaedtii (Acipenseriformes:Acipenseridae)[J].Journal of Morphology,2017,278(3):418-442.
[33] LEPR VOST A,AZAÏS T,TRICHET M,et al.Vertebral development and ossification in the Siberian sturgeon (Acipenser baerii),with new insights on bone histology and ultrastructure of vertebral elements and scutes[J].The Anatomical Record:Advances in Integrative Anatomy and Evolutionary Biology,2017,300(3):437-449.
VOST A,AZAÏS T,TRICHET M,et al.Vertebral development and ossification in the Siberian sturgeon (Acipenser baerii),with new insights on bone histology and ultrastructure of vertebral elements and scutes[J].The Anatomical Record:Advances in Integrative Anatomy and Evolutionary Biology,2017,300(3):437-449.
[34] ZHANG X,SHIMODA K,URA K,et al.Developmental structure of the vertebral column,fins,scutes and scales in bester sturgeon,a hybrid of beluga Huso huso and sterlet Acipenser ruthenus[J].Journal of Fish Biology,2012,81(6):1985-2004.
[35] 管士成.环境因素对鱼类生长速度的影响[J].养殖技术顾问,2013(10):229.
[36] 殷名称.鱼类早期生活史研究与其进展[J].水产学报,1991,15(4):348-358.
[37] 郑珂,岳昊,郑攀龙,等.海水养殖鱼类仔、稚鱼骨骼发育与畸形发生[J].中国水产科学,2016,23(1):250-261.