近20年来,中国长江中下游地区湖泊水库的水体富营养化问题日趋严重,水体污染已严重影响了水质景观,威胁了供水安全,甚至制约了社会和国民经济的可持续发展[1]。2017年《水资源公报》报道了全国117个湖泊营养状况评价结果[2],其中,中营养湖泊占23.1%,富营养湖泊占76.9%。全国1 038座水库营养状况评价结果显示,贫营养水库占0.3%,中营养水库占72.6%,富营养水库占27.1%。21世纪以来,随着经济社会的快速发展,大量含有氮、磷营养物质的污水排入江河、湖泊、水库,使得水中以蓝藻为主体的藻类大量繁殖,形成肉眼可见的聚积体,其中以群体微囊藻形成的水华最为典型[3-4]。
蓝藻是原核生物,又称蓝绿藻或蓝细菌,是最简单最原始的单细胞生物。蓝藻细胞能够产生荚膜和黏液层,主要由胞外多糖组成,具有黏滞性,从而形成网状胶群体[5]。蓝藻细胞内的气囊是蓝藻细胞浮力调节机制的关键结构,也是原核生物体中唯一充满气体的细胞器[6],其主要特征是由刚性、中空蛋白质圆柱体组成的气囊结构。藻细胞气囊为蓝藻提供浮力[7],使其能够长时间停留于水体表层光照区,从而快速生长繁殖[8],但当压力高于临界压力值(由气囊的直径决定)时会发生不可逆的破裂[6]。研究表明,常压下蓝藻气囊体积占细胞总体积的28%,经0.3~0.5 MPa压力作用后气囊逐步减少,经0.6~0.7 MPa加压后已观察不到明显的气囊[9]。
加压混凝技术是一种典型的物理处理技术,其原理是利用外加压力破坏蓝藻的伪空胞,再投入适当比例混凝剂使蓝藻混凝沉淀。裴毅等[10]通过检测加压处理过的微藻水体,发现其叶绿素含量、浊度等均有降低;Nakano等[11]发现,加压后不破坏原核细胞,所以藻毒素不会外溢,不会对水体造成新的污染。但有研究表明,在合适的光照条件下,加压沉淀后的蓝藻逐步上浮,且光照度越大(500~8 000 lx),气囊恢复越多[9]。而且由于蓝藻细胞具有较强的上浮特性,需要投加大量的混凝剂才能达到一定的混凝效果[12-13],所以仅仅通过加压混凝的处理方式可能会对水体安全产生一定的威胁性。生物技术中,以生物操纵技术应用最为广泛。1975年,Shapiro等[14]首先提出生物操纵理论以用于治理湖泊富营养化,但因浅水湖泊生态系统组成多样,间接控藻面临复杂的反馈机制,导致治理效果并不理想。21世纪初,谢平[15]提出的非经典生物操纵理论,因其能直接有效地控藻而被应用于实践之中,其中,以鲢Hypophthalmichthys molitrix、鳙Aristichthys nobilis控藻最为广泛[16-19]。近年来,鲢、鳙控藻效果一直存在争议,一些学者认为,鲢、鳙能够有效消除或减轻蓝藻水华的发生[19-21],非经典生物操纵理论适用于浅水富营养化湖泊,能够有效控制藻类数量[19-20],武汉东湖的围隔试验也证明,鲢、鳙能够有效预防微囊藻水华[22];也有研究者认为,鲢、鳙等滤食性鱼类受鳃耙间距的限制,放养会导致水体浮游生物小型化[18, 23]和微型藻类激增[18, 24]等生态问题。而且,“鱼类富营养化”(ichthyoeutrophication)现象的出现可能会加速系统中营养物的再生[25]。由此可见,仅仅通过鲢、鳙控藻的效果存在不确定性,不利于生态渔业实践工作的开展。
综上所述,采取特定方法进行蓝藻处理存在各种各样的弊端。经实际采样观察发现,太湖北部湖区鳙肠道内含物中有大量的蓝藻存在,故本试验中结合物理和生物处理技术,并利用加压破碎技术将蓝藻做预处理,基于非经典生物操控理论提出的“下行作用”原理,蓝藻经鳙滤食后加速了水体中氮、磷转化效率,利用电镜观察蓝藻形态的变化,分析了鳙对加压破碎前后蓝藻消化的差异,以期探寻更利于生态保护的综合修复方法,为净水渔业和环境保护提供基础数据支撑。
1 材料与方法
1.1 材料
试验用鳙取自中国水产科学研究院淡水渔业研究中心养殖基地,均为当年鱼种。用于室内试验的鱼种在360 L玻璃水族箱(120 cm×50 cm×60 cm)中暂养一周,每日9:00定量投喂取自太湖梅梁湾水域的蓝藻(取自德林海锦园藻水分离站),17:00吸取多余的粪便。正式试验前两天,选择活力良好、体表洁净的鳙按不同规格分别暂养于盛有180 L曝气自来水的水族箱(60 cm×60 cm×50 cm)中,及时处理粪便,待鱼肠排空后,作为试验用鱼。蓝藻经镜检鉴定,以惠氏微囊藻Microcystis wesenbergii和铜绿微囊藻Microcystis aeruginosa为主,微囊藻属的藻类约占99%以上,由无锡德林海环保科技股份有限公司提供。
1.2 方法
1.2.1 电镜观察试验的设计及样品采集与处理 电镜试验设置。根据饵料的不同,试验分为加压处理组和未加压处理组,均在体积为100 L的水族箱(50 cm×50 cm×40 cm)中进行,养殖用水为曝气过夜的自来水。试验温度为(25.0±0.5)℃,pH为7.7±0.5,溶解氧质量浓度为(8.1±0.3)mg/L,藻液密度为3.1×1010 cells/L。加压处理组,蓝藻经德林海蓝藻压力试验装置在0.7 MPa压力下处理1 min,鳙的体质量为(112.4±8.6)g;未加压处理组,蓝藻为原液,鳙的体质量为(115.6±7.5)g。每组6尾鱼作为平行,试验时,8:30开始配制藻液,9:00放入鳙开始正式试验,摄食4 h后将鳙小心捞出,分别放入曝气过夜的清水中,每缸一尾,观察待其开始排粪便后,收集粪便并解剖试验鱼,取其中肠内含物备用。
蓝藻原液和加压处理的藻液分别收集在滤膜上;解剖鱼体取中肠内含物,经PBS缓冲液冲洗而收集;收集两组鳙所排粪便,将所有样品放入离心管中并加入适量戊二醛溶液进行固定,编号后保存于冰箱(4 ℃)中备用。
电镜样品制备步骤:
1)脱水,分别用体积分数为30%、50%、70%、90%的乙醇梯度脱水各15 min,再用体积分数为100%的乙醇脱水3次,每次20 min;
2)置换,采用叔丁醇置换3次,每次30 min,叔丁醇熔点为25.69 ℃;
3)干燥,采用ES-2030型冷冻干燥仪(Hitachi)冷冻干燥,约5 h;
4)喷金,采用E-1010/E离子溅射仪(Hatachi)喷金,厚度10 nm,采用S-3000N型扫描电镜(Hatachi)观察并拍照。对比加压处理前后蓝藻及其被鱼类摄食后在中肠和粪便中的形态差异。
1.2.2 摄食消化试验的设计及样品采集与处理 试验采用灰分比例法测定消化率,试验前用0.245 mm筛网过滤藻液,去除明显杂质,镜检确定藻类密度,稀释至加压前后的蓝藻密度(约4.0×108 cells/L),设置对比试验;根据鳙的不同规格(81.0 g±2.1 g、103.0 g±3.1 g、130.0 g±3.4 g)将试验设置为3组,每组6尾鱼作为平行。
试验于2017年夏季进行,期间水质维持在溶解氧质量浓度为(7.4±0.4)mg/L,温度为(26.3±0.2)℃,pH为7.7±0.5。试验于9:00开始,期间用黑布遮光,摄食4 h后将试验鱼捞出,分别放入曝气过夜的清水中,每缸一尾鱼,待其排粪后及时收集粪便,并编号待进一步处理。收集的粪便及浓缩的蓝藻藻浆分别放入事先称量好的坩埚中,65 ℃下烘48 h以上至恒重,干燥器中冷却后称其干质量并记录,再在450 ℃下灼烧4 h后称量其灰分质量。消化率(A)计算公式[26]为
A=(F-E)/[(1-E)F]。
其中:F为食物(蓝藻)样品中的有机质量(即干质量减灰分质量)占食物样品干质量的比;E为粪便样品中的有机质量占粪便样品干质量的比。
1.3 数据处理
采用SPSS 20统计软件进行数据分析,对不同规格和不同藻液处理方式下鳙的消化率差异进行双因素方差分析,显著性水平设为0.05。
2 结果与分析
2.1 蓝藻形态的变化
2.1.1 外观形态变化 蓝藻原液和加压藻液静置4 h后,发现蓝藻原液样品瓶中蓝藻多漂浮在水面,呈暗绿色;而经0.7 MPa压力处理后,大部分蓝藻细胞下沉在瓶底,呈亮绿色(图1)。

图1 压力作用前后蓝藻外观形态的变化
Fig.1 Changes in appearance of cyanobacteria before and after pressure
2.1.2 摄食前蓝藻形态结构的变化 电镜观察显示:蓝藻未做加压处理时,蓝藻细胞间胶质连接明显,边缘模糊,细胞圆滑,呈圆形或椭圆形(图2(a));而经过压力处理后,蓝藻细胞间的胶质明显脱离,细胞多趋向于单个个体,细胞有一定程度的变形,气囊破裂,边缘较为清晰(图2(b))。

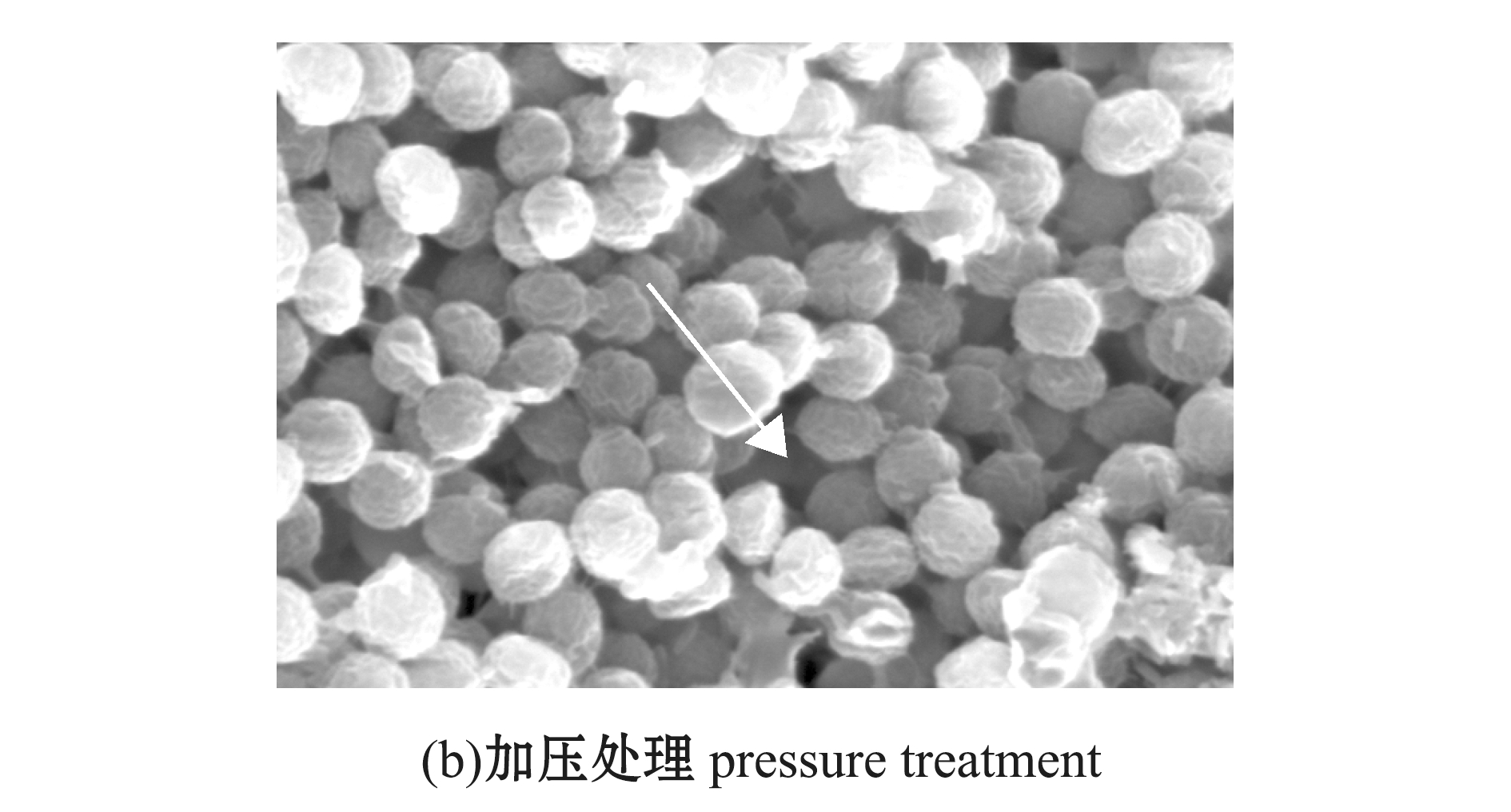
图2 扫描电镜下未加压和加压处理的蓝藻细胞形态
Fig.2 Cells without pressure treatment and with pressure treatment under scanning electron microscopy
2.1.3 摄食后蓝藻形态结构的变化 电镜观察显示:蓝藻被鳙消化吸收后,中肠内未加压处理的蓝藻细胞间胶状物质还未完全消失(图3(a)),而加压处理后的藻细胞已经有部分正被消化,细胞已经变形,由圆形或椭圆形变成了不规则图形(图3(b));粪便内未加压处理的蓝藻细胞间胶状物质基本消失,少量细胞已经被消化(图4(a)),而加压处理的蓝藻细胞表面凹陷明显,细胞壁已经破裂,大部分细胞可能正消化或者即将被消化(图4(b))。

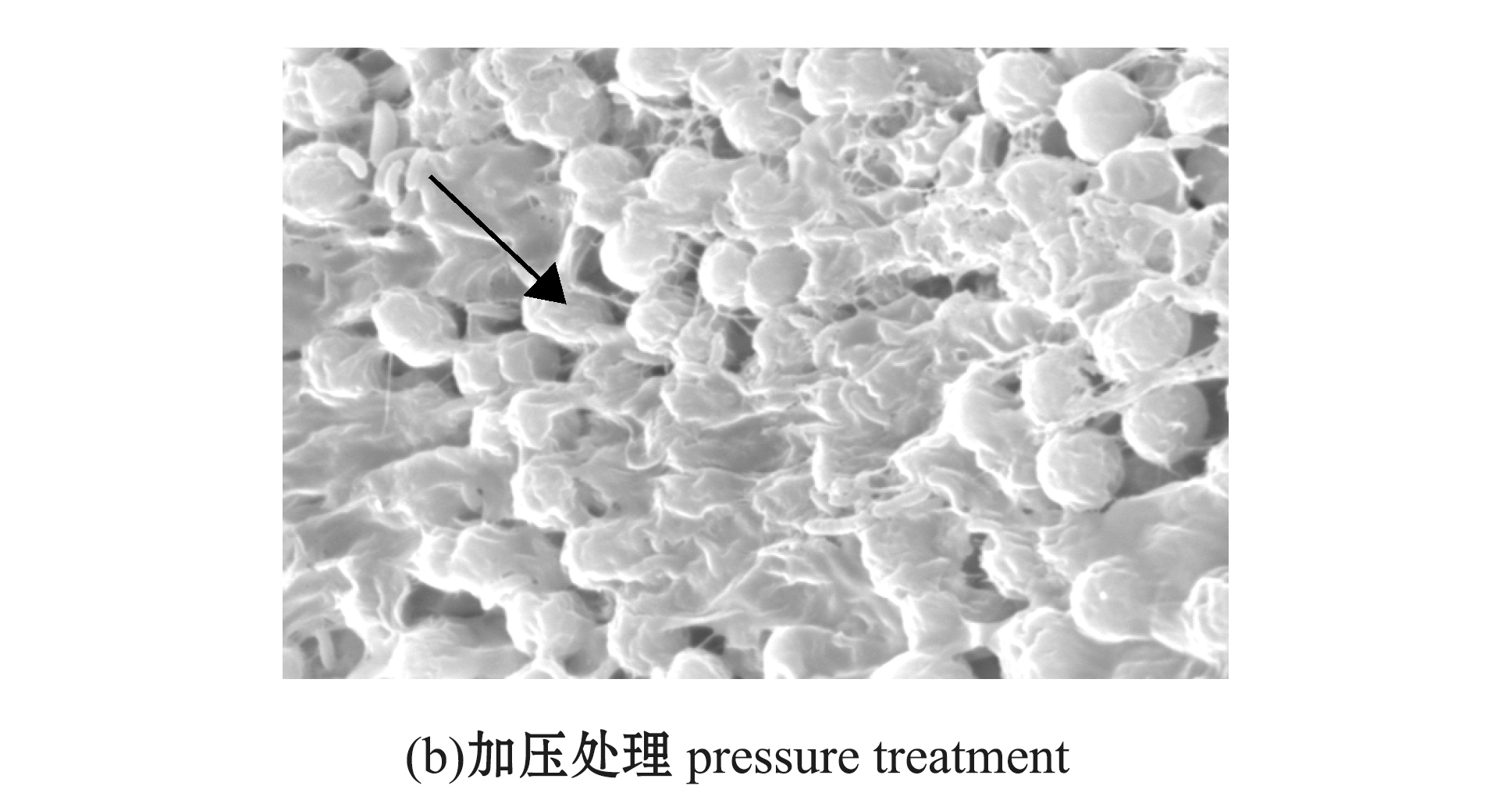
图3 扫描电镜下未加压和加压处理的蓝藻细胞在鳙中肠中的形态
Fig.3 Cells of cyanobacteria without pressure treatment and with pressure treatment in midgut of bighead carp under scanning electron microscopy


图4 扫描电镜下未加压和加压处理的蓝藻细胞在鳙粪便中的形态
Fig.4 Cells of cyanobacteria without pressure treatment and with pressure treatment in bighead carp feces under scanning electron microscopy
2.2 鳙对加压处理前后蓝藻的消化率
在相同的环境条件下进行消化率试验,双因素方差分析表明,不同规格的鳙对加压处理蓝藻的消化率均高于未加压处理蓝藻,其中,103.0 g组显著高于81.0、130.0 g组(P<0.05);81.0 g的鳙对加压处理过的蓝藻消化率(63.9%)高于蓝藻原液(61.1%),103.0 g的鳙对加压处理过的蓝藻消化率高达83.2%,对蓝藻原液的消化率约为65.7%,130.0 g的鳙对加压处理过的蓝藻消化率(50.2%)高于蓝藻原液(46.2%)(图5)。

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.
图5 不同规格的鳙对加压处理前后蓝藻的消化率
Fig.5 Digestibility of cyanobacteria before and after pressure treatment by bighead carp with different body mass
3 讨论
3.1 摄食过程中加压处理前后蓝藻的形态变化
伪空胞的临界压力随水深的变化而发生改变[27],太湖属于浅水湖泊[28],蓝藻的临界破裂压力为0.65~0.72 MPa,有研究表明,铜绿微囊藻的伪空胞具有较高的临界压力值,为0.66 MPa[29]。本试验中采取0.7 MPa的压力,符合其破碎要求,外观形态上,加压处理后的藻液呈亮绿色,未加压的藻液呈暗绿色,这是由于加压后光的投射能力强,散射减弱,散射浊度减小,光的透射能力增强,肉眼能观察到的光强增加后藻细胞呈亮绿色[9]。有研究表明,电镜观察加压后(0.6~0.7 MPa)蓝藻的伪空胞、藻细胞外层结构并未出现明显破损,整体结构形态未造成明显破坏,细胞内的气体外逸,伪空胞基本消失,细胞壁完整,细胞液未外泄[30]。这表明,加压前后太湖水华蓝藻的细胞外形基本未改变,但加压处理后蓝藻沉降性能得到强化,且细胞间胶状物质明显消失。还有研究显示,微囊藻经鲢摄食后只是消化了其表面的黏液胶鞘[31],鲢、鳙对鱼粪的消化率也高于初次消化率[32]。本研究中,电镜观察加压前后的蓝藻细胞被摄食后的形态变化,结果显示,未加压的蓝藻细胞在被鳙摄食后,细胞间的黏液胶鞘基本消失,少量细胞破碎,而加压后的蓝藻细胞被摄食后,细胞表面凹陷明显,大量细胞被破碎。故可以做出预测,压力破碎技术对于解决大量蓝藻聚集水面有一定效果,且加压处理后的蓝藻细胞可能更有利于水生生物的消化吸收。
3.2 鳙对加压处理前后蓝藻的消化吸收
研究表明,鱼类的肠道菌群数量和组成、消化酶活性分布受到饵料、生存环境、健康状态等[33]多种因素的影响。电镜观察试验和消化试验结果均证明,蓝藻能被鳙消化吸收。陈少莲等[34]研究表明,鳙对微囊藻的消化率为26.1%。雷汶龙[35]研究表明,30 ~ 40 g的鲢对铜绿微囊藻的消化率为30%左右。但本试验中鳙对液压蓝藻和蓝藻原液的消化率均较高,其中,103.0 g左右的鳙对加压处理蓝藻的消化率最高(83.2%)。究其原因,一方面,雷汶龙[35]试验对象鲢虽然也是滤食性鱼类,但鲢、鳙对藻类的吸收会产生一定的差异;另一方面,其采用的是实验室培养的铜绿微囊藻,而本试验中所取的是天然水域的水华蓝藻,藻液中所携带的多种细菌在鲢、鳙摄食后可能对鱼体产生了刺激作用,肠道中消化酶种类、浓度、活性及分布均可能发生了变化[36],对于其具体的消化机理,需要进行进一步的研究验证。此外,有学者提出鱼体不同生长发育阶段与其体内的消化酶活性息息相关[37]。本试验中设置了不同规格的鳙进行摄食消化试验,其中,103 g左右的鳙消化率最高,这可能是由于其处在快速生长期,消化酶活性高,因此,所表现出来的消化性能较好。
蓝藻伪空胞破碎后,光吸收面积减少,藻细胞内部散射光照强度减弱,光合作用降低,蓝藻的活性基本不受影响。在适当的光照强度下,伪空胞破裂的铜绿微囊藻会在3~5 d内恢复,加压下沉的蓝藻细胞会产生不同程度的上浮,而低光照强度蓝藻气囊恢复缓慢[6,38]。所以压力作用后,短期内如果能被鱼类消化吸收,就能快速转移蓝藻的能量到更高的营养级中,从而快速转化N、P物质。陈少莲等[34]提出微囊藻经初次消化后排出形成的鱼粪,在水体中离散呈微小颗粒状态,若再次被摄食后更容易被鲢、鳙消化,且有研究表明,由单细胞组成、结构简单的藻类更容易被消化[39]。本研究中,结合消化试验和电镜观察试验结果发现,液压蓝藻细胞在摄食前、中肠和粪便中的状态均比未液压的蓝藻要更利于消化吸收,这表明,0.7 MPa压力作用后的蓝藻有利于滤食性生物对蓝藻的消化利用,符合预想情况。
4 结论
单一的物理技术和生物技术处理蓝藻均存在较大的不确定性,本试验中采取综合处理技术,结合压力破碎技术和非经典生物操纵方法,取得的主要结论如下:
1) 加压处理前蓝藻漂浮在水面,严重影响水体环境和景观;加压处理后蓝藻伪空胞破裂,下沉性可得到加强,水体透明度提高。
2) 与未加压处理的蓝藻细胞相比,加压处理后的蓝藻间胶质消失,多趋向于单个个体,边缘清晰;经鳙摄食后,中肠内和粪便中藻细胞的凹陷程度和破裂程度均更高,说明加压处理后蓝藻细胞更容易被消化,从而加速水体氮、磷等营养元素的转移,生态效益更大。
3) 本试验条件下,103 g左右的鳙对蓝藻的消化率最高,这可能是由于饵料组成和鱼体生长发育期的不同而引起的消化酶活性的差异,但对于其具体的影响机理较为复杂,尚需进一步研究。依据本试验结果,为提高生态效益,建议在增殖放流实践中,可适当增加此类规格鱼类的放流。
感谢水生生物资源室老师及同事对试验提出的指导与帮助;感谢无锡德林海环保科技股份有限公司对试验样品准备所提供的帮助。
[1] 李未,秦伯强,张运林,等.富营养化浅水湖泊藻源性湖泛的短期数值预报方法——以太湖为例[J].湖泊科学,2016,28(4):701-709.
[2] 中华人民共和国水利部.中国水资源公报[M].北京:中国水利水电出版社,2019:7-21.
[3] 马经安,李红清.浅谈国内外江河湖库水体富营养化状况[J].长江流域资源与环境,2002,11(6):575-578.
[4] 许慧萍,杨桂军,周健,等.氮、磷浓度对太湖水华微囊藻(Microcystis flosaquae)群体生长的影响[J].湖泊科学,2014,26(2):213-220.
[5] 苏传东.蓝杆藻113菌株(Cyanothece sp.113)胞外多糖的研究[D].青岛:中国海洋大学,2005.
[6] 代然,储昭升,于秀娟,等.压力下伪空胞破裂对3种水华蓝藻生长及光合作用的影响[J].环境科学研究,2012,25(1):30-35.
[7] 张永生,孔繁翔,于洋,等.蓝藻伪空胞的特性及浮力调节机制[J].生态学报,2010,30(18):5077-5090.
[8] 孔繁翔,高光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J].生态学报,2005,25(3):589-595.
[9] 王巍.压力作用后蓝藻气囊及活性变化规律研究[D].扬州:扬州大学,2015.
[10] 裴毅,黄维,陈飞勇,等.蓝藻处理机的设计及除藻效果试验[J].农业工程学报,2009,25(4):130-134.
[11] NAKANO K,LEE T J,MATSUMURA M.In situ algal bloom control by the integration of ultrasonic radiation and jet circulation to flushing[J].Environmental Science & Technology,2001,35(24):4941-4946.
[12] 刘军,余国忠,李晓梅,等.气浮除藻的工艺设计及运行经验[J].中国给水排水,2003,19(1):70-72.
[13] 蒋福春,华伟,陈玲瑚,等.太湖流域含藻原水的处理技术及运行效果研究[J].供水技术,2008,2(3):24-28.
[14] SHAPIRO J,LAMARRA V,LYNCH M.Biomanipulation:an ecosystem approach to lake restoration[M]//BREZONIK P L,FOX J L.Proceedings of a symposium on water quality management through biological control.Gainesville:University Press of Florida,1975:85-96.
[15] 谢平.鲢、鳙与藻类水华控制[M].北京:科学出版社,2003.
[16] SOSNOVSKY A,QUIR S R.Effects of fish manipulation on the plankton community in small hypertrophic lakes from the Pampa Plain (Argentina)[J].Limnologica,2009,39(3):219-229.
S R.Effects of fish manipulation on the plankton community in small hypertrophic lakes from the Pampa Plain (Argentina)[J].Limnologica,2009,39(3):219-229.
[17] 王丽卿,许莉,陈庆江,等.鲢鳙放养水平对淀山湖浮游植物群落影响的围隔实验[J].环境工程学报,2011,5(8):1790-1794.
[18] 闫玉华,钟成华,邓春光.非经典生物操纵修复富营养化的研究进展[J].安徽农业科学,2007,35(12):3459-3460.
[19] ZHANG X,XIE P,HUANG X P.A review of nontraditional biomanipulation[J].The Scientific World Journal,2008,8:1184-1196.
[20] 王媛,徐东坡,王小林,等.基于碳氮稳定同位素技术探究太湖北部湖区鲢、鳙食性差异[J].大连海洋大学学报,2017,32(5):597-602.
[21] 冯超群,徐东坡,陈永进,等.鲢鳙放流对太湖三国城水域浮游植物的影响[J].大连海洋大学学报,2018,33(5):666-673.
[22] 刘建康,谢平.揭开武汉东湖蓝藻水华消失之谜[J].长江流域资源与环境,1999,8(3):85-92.
[23] KOLAR C S,CHAPMAN D C,COURTENAY W R,et al.Asian carps of the genus Hypophthalmichthys (Pisces,Cyprinidae)-a biological synopsis and environmental risk assessment[R].U.S. Fish and Wildlife Service,2005.
[24] M TY
TY S K,OLDAL I,KORPONAI J,et al.Indirect effect of different fish communities on nutrient chlorophyll relationship in shallow hypertrophic water quality reservoirs[J].Hydrobiologia,2003,504(1/2/3):231-239.
S K,OLDAL I,KORPONAI J,et al.Indirect effect of different fish communities on nutrient chlorophyll relationship in shallow hypertrophic water quality reservoirs[J].Hydrobiologia,2003,504(1/2/3):231-239.
[25] 曾庆飞,谷孝鸿,毛志刚,等.鲢鳙控藻排泄物生态效应研究进展[J].生态学杂志,2010,29(9):1806-1811.
[26] 陆开宏,金春华,王扬才.罗非鱼对蓝藻的摄食消化及对富营养化水体水华的控制[J].水产学报,2005,29(6):811-818.
[27] WALSBY A E,AVERY A,SCHANZ F.The critical pressures of gas vesicles in Planktorhrix rubescens in relation to the depth of winter mixing in Lake Zürich,Switzerland[J].Journal of Plankton Research,1998,20(7):1357-1375.
[28] 郑丙辉,许秋瑾,周保华,等.水体营养物及其响应指标基准制定过程中建立参照状态的方法——以典型浅水湖泊太湖为例[J].湖泊科学,2009,21(1):21-26.
[29] 储昭升,杨波,金相灿,等.6株蓝藻伪空胞的临界破裂压力研究[J].环境科学,2007,28(12):2695-2699.
[30] 丛海兵,高郑娟,孙秀秀.压力作用后太湖蓝藻沉淀性能及其去除研究[J].中国给水排水,2014,30(1):43-47.
[31] GAVEL A,MAR
 LEK B,AD
LEK B,AD MEK Z.Viability of Microcystis colonies is not damaged by silver carp (Hypophthalmichthys molitrix) digestion[J].Algological Studies,2004,113:189-194.
MEK Z.Viability of Microcystis colonies is not damaged by silver carp (Hypophthalmichthys molitrix) digestion[J].Algological Studies,2004,113:189-194.
[32] 陈少莲,刘肖芳.鲢鳙对鱼粪消化利用的研究[J].水生生物学报,1989,13(3):250-258.
[33] 冯雪,吴志新,祝东梅,等.草鱼和银鲫肠道产消化酶细菌的研究[J].淡水渔业,2008,38(3):51-57.
[34] 陈少莲,刘肖芳,胡传林,等.论鲢、鳙对微囊藻的消化利用[J].水生生物学报,1990,14(1):49-59.
[35] 雷汶龙.微囊藻对白鲢摄食、消化的影响及其毒性研究[D].新乡:河南师范大学,2014.
[36] 孙然,皮国华,赵卫红,等.芽孢杆菌和光合细菌对异育银鲫鱼种消化酶的影响[J].北京水产,2008(3):35-37,41.
[37] 曹香林,郭蓓,彭墨,等.不同发育阶段草鱼消化酶活力的变化及其昼夜节律[J].河南农业科学,2009,38(7):120-123.
[38] 储昭升,金相灿,杨波,等.不同群体形态蓝藻的气囊与光的相互作用研究[J].环境科学学报,2006,26(11):1909-1913.
[39] 费志良,吴军,赵钦,等.三角帆蚌对藻类滤食及消化的研究[J].淡水渔业,2006,36(5):24-27.