壳纹船卵溞Scapholeberis kingi Sars是一种淡水枝角类,隶属于节肢动物门Arthropoda甲壳动物亚门Crustacea枝角类Cladocera异足目Anomopoda溞科Daphniidae船卵溞属Scapholeberis,常栖息于水坑、池沼等小型水域及稻田中,因其嗜暖的特性也可生活在水温高达35 ℃的温泉中[1]。枝角类具有繁殖能力强、适应性广、营养价值高、适口性好等特点,对盐度具有一定的适应能力,有发展驯化成为海水养殖动物活饵料的潜力。目前,国内外对枝角类的驯化研究实例较多,主要包括直额裸腹溞Moina rectirostris[2]、蒙古裸腹溞M.mongolica[3-4]、多刺裸腹溞M.macrocopa[5]、近亲裸腹溞M.affinis[6]、大型溞Daphnia magna[7]、蚤状溞D.pulex、老年低额溞Simocephalus vetulus[8]、透明溞Daphnia hyalina[9]和长额象鼻溞Bosmina longirostris[10]等,而对壳纹船卵溞的研究较少,且主要对其形态、繁殖力、生命周期[11]、生态竞争[12]和栖息地[13-15]等有一些报道。为此,本研究中进行了盐度对壳纹船卵溞存活、生长和繁殖的影响试验,旨在为深入研究淡水枝角类实验种群生态学,开发海产经济动物活饵料,以及监测水域富营养化、海水侵蚀和盐碱化等提供科学依据。
1 材料与方法
1.1 材料
于2016—2019年在北京五大水系开展了壳纹船卵溞分布调查,采集该溞带回辽宁省水生生物学重点实验室进行分离后,在生物显微镜(麦克奥迪Motic-BA210)下观察测定。在室温条件下投喂斜生栅藻Scenedesmus obliquus进行驯化培养,待壳纹船卵溞适应实验室条件以后,挑取同步幼溞或同生群进行试验。
试验用海水取自辽宁省大连市黑石礁海域,经过滤、煮沸待其冷却至室温后,利用盐度计确定其盐度,并根据试验设定的盐度加入一定量经煮沸的纯水调至所需盐度。
1.2 方法
1.2.1 试验生物培养条件 壳纹船卵溞在光照强度2 000~3 000 lx、光照周期12 D∶12 L、温度(25±1)℃的光照培养箱(中器PGX-250B)内投喂饵料斜生栅藻培养。
1.2.2 急性盐度耐受性试验 挑选壳纹船卵溞的同步溞(溞龄<24 h,体长为28.5 μm±1.5 μm)进行试验,根据预试验结果,急性盐度耐受性试验中设置0(对照组)、1.0、2.0、3.0、4.0、5.0、6.0共7个盐度组,每个组设3个重复,每个重复中放10只同步溞。将壳纹船卵溞置于20 mL试管中,在连续培养24 h和48 h时观察其存活情况,以壳纹船卵溞不再运动并沉入瓶底为死亡标志,试验期间不投喂和不换水。24、48 h的LC50及其安全盐度通过SPSS 23.0软件用概率单位法求得。
1.2.3 慢性盐度耐受性试验 试验在恒温光照培养箱中进行。将选取出的同步溞(溞龄<24 h)置于20 mL玻璃试管中,每个管中放置1只幼溞,培养液每3 d更换一次。试验盐度根据急性盐度耐受性试验得出的安全盐度即0.31进行设定,分别为0(对照组)、0.5、1.0、1.5、2.0共5个盐度组,每个盐度组设置10个重复。试验期间,观察记录溞每天的存活情况、初次产幼时间和每次产幼数,在第2、4、6、10、14天时各测量一次体长。试验结束的标志为全部试验个体死亡。
1.2.4 指标的计算 安全盐度和体长增长率计算公式为
Sc=(48 h LC50×0.3)/(24 h LC50/48 h LC50)2,
RL=(Lt-L0)/L0×100%。
其中: Sc为安全盐度;LC50为半致死盐度;RL为体长增长率(%);L0、Lt分别为试验开始(即第0天)和试验结束时壳纹船卵溞的体长(μm)。
采用Lotka提出经Birch和林昌善简化的公式计算种群增长参数:
![]()
T=(∑xmxlx)/R0, λ=erm。
其中: rm为内禀增长率(d-1);R0为净增殖量(个);T为世代周期(d);λ为周限增长率(d-1);x为日龄(d);lx为x龄时的存活率(%);mx为x龄时的出生率(%)。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。试验结果采用SPSS 23.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 壳纹船卵溞的形态再描述和分布
壳纹船卵溞雌体长为0.60~1.20 mm,体短近长方形,暗灰或暗褐色;吻短而钝,吻部的末端和壳瓣的前缘颜色更深;壳瓣腹缘平直,其前端有一棱角突起显著,沿缘列生细而密的刚毛;后腹角延伸出一根短而粗的壳刺;头短,约占体长的1/4;复眼很大位于头顶,单眼小呈圆点状,靠近吻的末端;第一触角非常短小,稍微突出于吻部的下方,第二触角刚毛式为0-0-1-3/1-1-3;肠管前部具一对盲囊;后腹部短而宽,有肛刺5~6个;靠近壳瓣后缘有数条与后缘平行的壳纹(图1)。壳纹船卵溞雄性体长为0.80 mm,壳瓣后腹角的壳刺较长,吻不发达,第一触角略大于雌体;第一胸肢具钩及鞭毛,后腹部背缘的中部显著凹陷。该溞广泛存在于中国各地,如北京的妫水河、温榆河、官厅水库、天开水库、玉渊潭、柳荫公园青年湖和汉石桥湿地,以及山东大汶河等水域。

图1 壳纹船卵溞(雌体)
Fig.1 Water fleas Scapholeberis kingi Sars(1903)(female)
2.2 盐度对壳纹船卵溞的急性毒性
从表1可见:由盐度对数(x)和死亡概率单位(y)建立线性回归方程,结果表明,壳纹船卵溞的24 h LC50=3.35,48 h LC50=2.27,安全盐度为0.31。
表1 不同时间下壳纹船卵溞盐度效应曲线方程和半致死盐度
Tab.1 Curve equation and half lethal concentration of salinity in water fleas Scapholeberis kingi in different time

时间/htime盐度效应曲线方程salinity curve equation相关指数(R2)correlation coefficient半致死盐度(LC50)half lethal salinity95%置信区间confidence interval24y=-2.018+3.843x0.9443.35(2.12, 5.18)48y=-1.443+4.053x0.9572.27(1.36, 3.20)
2.3 盐度对壳纹船卵溞的慢性毒性
2.3.1 盐度对壳纹船卵溞存活率和存活时间的影响 盐度对壳纹船卵溞的存活率和存活时间的影响见图2、表2。壳纹船卵溞的存活率随着盐度的升高而显著降低,其中,第19天时,0.5盐度组的存活率超过对照组,总体来看,存活率由大到小依次为0.5盐度组、对照组、1.0、1.5、2.0盐度组(图2);0.5盐度组溞的寿命也最高,与对照组无显著性差异(P>0.05),但二者均显著高于1.5和2.0盐度组(P<0.05)(表2)。
表2 盐度对壳纹船卵溞生长及生殖参数的影响
Tab.2 Effects of salinity on growth and reproductive parameters in water fleas Scapholeberis kingi

盐度salinity寿命/dlife span体长增长率/%growth rate in body length产前发育时间/dprenatal development time总生殖量/(ind.·female-1)life-time fecundity初次产幼数/(ind.·female-1)first-time fecundity021.00±7.59a136.60±24.65a5.90±0.54a28.50±19.75a3.70±1.19ab0.525.40±11.04a130.04±18.37a6.10±0.70a30.40±13.05a4.00±0.77ab1.012.60±6.53ab159.18±14.16b6.00±0.00a38.80±19.90a4.38±0.48a1.59.30±4.56b164.71±9.74b5.75±0.43a10.40±5.90b3.50±1.32ab2.08.20±4.81b137.65±5.65ab6.00±0.00a9.20±10.54b3.00±1.15b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
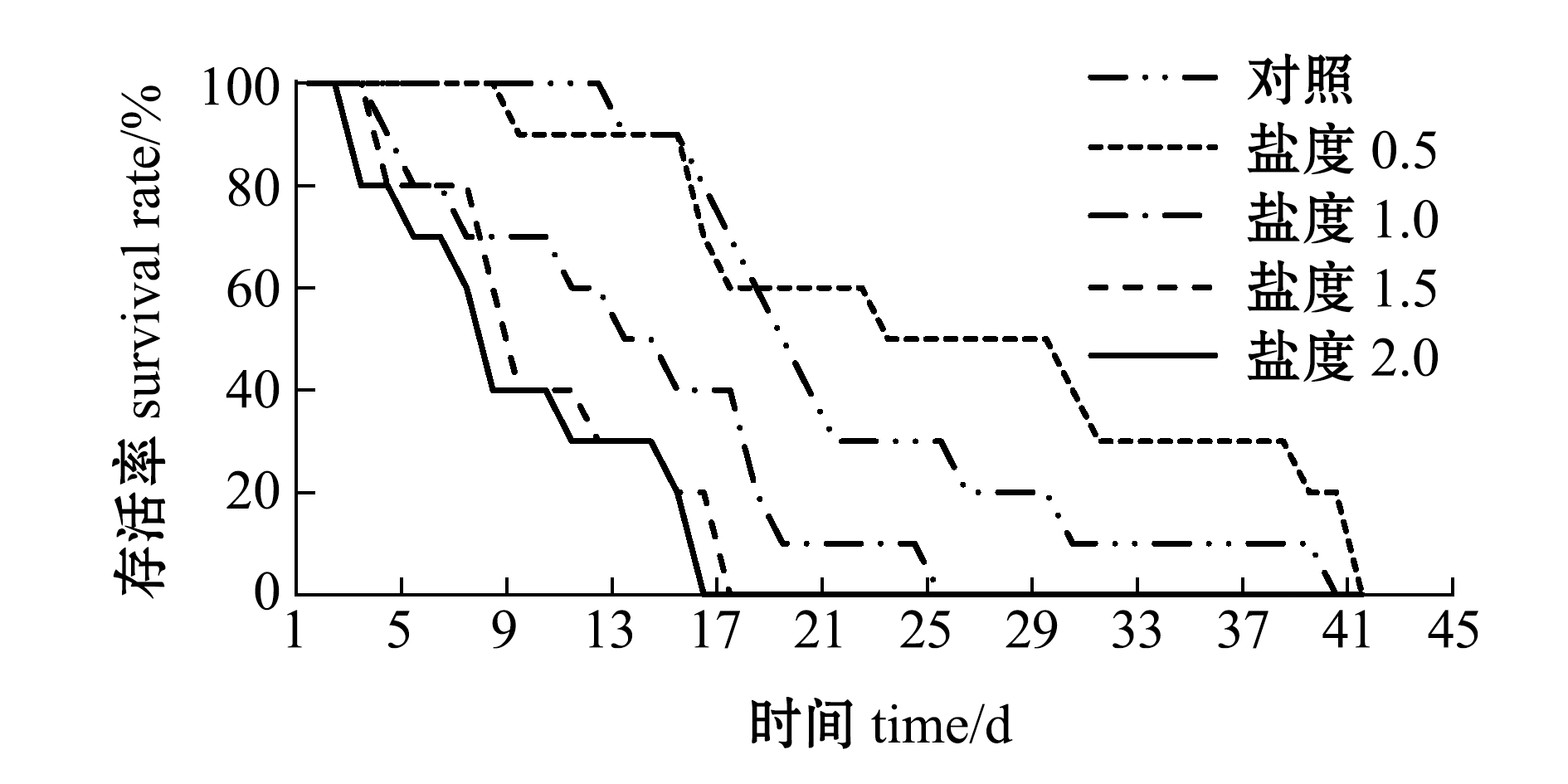
图2 盐度对壳纹船卵溞存活率的影响
Fig.2 Effects of salinity on the survival rate in water fleas Scapholeberis kingi
2.3.2 盐度对壳纹船卵溞生长和繁殖的影响 从表2可见:壳纹船卵溞体长增长率随着盐度的升高呈现出先降低后升高再降低的变化趋势,1.5盐度组体长增长率最大,仅1.0、1.5盐度组显著高于对照组和0.5盐度组(P<0.05);壳纹船卵溞产前发育期在盐度为0.5时最长,盐度1.5时最短,但各盐度组均无显著性差异(P>0.05);壳纹船卵溞初次产幼数随盐度升高呈现先升高后降低的趋势,其中1.0盐度组初次产幼数最多,显著高于2.0盐度组(P<0.05);壳纹船卵溞总生殖量随盐度升高呈现先升高后降低的趋势,其中1.0盐度组溞总生殖量最多,对照组、0.5、1.0盐度组总生殖量显著高于1.5、2.0盐度组(P<0.05)。
2.3.3 盐度对壳纹船卵溞种群增长参数的影响 从表3可见:壳纹船卵溞净增殖量和世代周期随盐度升高均呈现先升高后降低再升高的趋势,内禀增长率、周限增长率随盐度升高呈现先降低后升高再降低的趋势;1.0盐度组净增殖率、内禀增长率和周限增长率最大,0.5盐度组世代周期最大,且均与对照组无显著性差异(P>0.05),而1.5、2.0盐度组各项种群增长参数均较低。
表3 盐度对壳纹船卵溞种群增长参数的影响
Tab.3 Effects of salinity on population growth parameters in water fleas Scapholeberis kingi

盐度salinity净增殖量R0/ind.net productive rate内禀增长率(rm)/d-1intrinsic rate of increase周限增长率(λ)/d-1finite rate of increase世代周期(T)/dmean generation time029.0±20.8ab0.380±0.045a1.463±0.064a10.5±3.5ab0.529.4±14.2ab0.363±0.077ab1.442±0.111ab12.2±3.7a1.038.9±19.9a0.405±0.135a1.500±0.070a9.9±1.9abc1.512.9±4.9c0.357±0.115ab1.429±0.038ab7.3±0.7c2.014.8±8.9bc0.309±0.092b1.368±0.119b8.1±1.5bc
3 讨论
3.1 壳纹船卵溞对盐度的耐受性
水生生物的水盐代谢方式决定其与外界水环境存在渗透关系。在天然淡水水域中存在的枝角类是高渗调节,即外界水环境盐度低于其体内渗透压,所以水分会不断地稀释体内液,但是在长期的进化中,淡水枝角类已经产生了各种排水保盐的系统来维持体液的动态平衡[16]。然而,生物对于渗透压的调节有一定限度,生物体面对超过自身调节限度的外界渗透压即盐度时,就会逐渐失水死亡。淡水枝角类体液渗透压约相当于盐度6~8,即渗透压(-Δ℃)值多在-0.35~-0.45,也就是说,对于大多数淡水枝角类,盐度为6~8时可以正常生存[10],如对直额裸腹溞[2]和大型溞[17]的研究不仅证明了该理论,同时也证明了枝角类在经过短时间盐度驯化后,其盐限可以达到6~8甚至更高。另有学者对一些枝角类的研究表明,有些溞的24 h LC50和48 h LC50低于该理论值,达不到该理论生存盐限。如近亲裸腹溞生存的盐度上限为3.72~5.82[6],长额象鼻溞在25 ℃下的24 h LC50为4.62[10]。而本试验中壳纹船卵溞的盐度上限为2.27~3.35,安全盐度为0.31,也低于理论值。这可能是由于壳纹船卵溞多生栖于水环境盐度变化小的水坑、池沼等小型水域及稻田中[1],从而对盐度的变化较敏感,适应性较差。
根据淡水生物对盐度的适应性,可将其分为3类:喜盐种,生物生长发育会随着盐度的增加而较淡水中快;漠盐种,盐度的变化不会对生物产生影响;嫌盐种,对盐度变化极为敏感[16]。按照这种分类方法,显然壳纹船卵溞对盐度的耐受性较低,应属于嫌盐种。
3.2 盐度对壳纹船卵溞个体生长的影响
在淡水中生活的枝角类,当外界渗透压低于其体内渗透压时,水分会通过体表不断稀释体内液体,所以生物需要排除过多水分并收集盐分以维持体内正常的渗透压。被动的调节渗透压需要耗费生物体的能量,且随着动物体内外渗透压差距的增大消耗增多,生物体用于生长的能量就会相应减少,因此,要减少生物内外液环境间的渗透压就需在生物体耐受范围内提高其生存环境的盐度(一般在盐度4以内),以降低能量消耗,促使动物体生长加速。另一方面,在一定范围内增加淡水盐度,还能够促进动物的食欲和消化能力,从而提高能量的同化效率,增加能量供应。如何志辉等[7]在研究大型溞时指出,一定的低盐度对于淡水生物的生活有积极作用;赵文等[6]的研究证明,近亲裸腹溞的寿命在盐度为1时相对于淡水有所增加,体长日增长率也随着盐度的升高而升高。本试验结果显示,壳纹船卵溞在盐度为1.0和1.5时体长增长率显著高于对照组,其寿命随盐度的升高呈先升高后降低的趋势,且在盐度为0.5时寿命最长(表2),这与上述理论相符合。几种淡水枝角类的盐度耐受性比较见表4,其中大型溞、直额裸腹溞、多刺裸腹溞等的耐盐性较高,而壳纹船卵溞则最低。
表4 几种淡水枝角类的盐度耐受性比较
Tab.4 Comparison of salinity tolerance in some species of freshwater cladocerans

物种species最适盐度optimal salinity24 h LC50文献来源reference直额裸腹溞Moina rectiros-tris16~8何志辉等[2]大型溞Daphnia magna27~8.5何志辉等[7]近亲裸腹溞M.affinis1~25赵文等[6]长额象鼻溞Bosmina longirostris0.1~0.54.62魏杰等[10]多刺裸腹溞M.macrocopa08王丹丽等[5]老年低额溞Simocephalus vetulus25~6王丹丽等[8]蚤状溞D.pulex25~6王丹丽等[8]透明溞D.hyalina0.1~0.54~6杨板等[9]壳纹船卵溞Scapholeberis kingi0~0.53.35本研究
3.3 盐度对壳纹船卵溞种群增长的影响
试验证明,盐度在一定范围内增加时会促进枝角类的繁殖力,但超过该范围后则会对枝角类形成不利的影响。内禀增长率表示特定条件下种群的最高增殖速率, 是反映一个物种繁殖能力最重要的指标之一[18],可以全面而准确地反映影响动物种群的生态环境的优劣,即较高的内禀增长率值是环境良好的标志[19]。当外界环境中的盐度较高,形成的渗透压大于生物体内渗透压时,由于生物要不断吸水排盐以维持体内渗透压的动态平衡,从而不断消耗能量,导致生物的生存和发育受到影响,引起生物生殖量下降;但当外界盐度稍有升高,且不影响其生理平衡时,由于减少了内外液的盐度梯度,从而节约了用于渗透调节的能量,并使标准代谢降低[16],节约的能量可以用来繁殖等。试验证明,在生存盐度范围内,近亲裸腹溞[6]随着盐度的逐渐上升,其内禀增长率、生殖量呈现出先升高后降低的趋势,圆形盘肠溞[20]在盐度为0.5时内禀增长率和周限增长率均高于对照组,王丹丽等[5]在研究多刺裸腹溞内禀增长率的试验时也证明了这一点。而本试验结果也证明,当盐度在0.5~1.0之间时对壳纹船卵溞的生殖有利,可促进种群增长,但当盐度超过1.5时,反而会抑制壳纹船卵溞的生长与增殖,甚至引起溞死亡,这与上述研究结果一致。几种枝角类的内禀增长率比较见表5,其中近亲裸腹溞、直额裸腹溞、多刺裸腹溞内禀增长率较大,长额象鼻溞内禀增长最小。
表5 几种淡水枝角类的内禀增长率(rm)
Tab.5 Comparison of intrinsic rate of increase in some species of freshwater cladocerans

种类 species盐度 salinity水温 temperature/℃内禀增长率(rm) intrinsic rate of increase/d-1文献来源 reference直额裸腹溞Moina rectirostris1~622~260.406~1.204何志辉等[2]近亲裸腹溞Moina affinis1~5250.856~0.959赵文等[6]长额象鼻溞Bosmina longiros-tris0.1250.241魏杰等[10]大型溞Daphnia magna2~5250.239~0.450何志辉等[7]多刺裸腹溞Moina macrocopa0~4250.725~1.070王丹丽等[5]壳纹船卵溞Scapholeberis kingi0~2.0250.309~0.405本研究
3.4 壳纹船卵溞作为饵料开发和水体盐碱变化指示生物的可行性
枝角类相对于桡足类,具有繁殖快、游泳速度较慢、易捕食等特点,且对水质影响较小,便于调控水质,可提高水产动物育苗存活率,降低成本;与轮虫相比较,具有营养价值高、适口性好的优势;与卤虫相比较,具有繁殖能力强、易得性高、适口性好和成本较低的优势[20]。当水产经济动物幼体生长到一定程度以后,个体较小的轮虫不再适宜作为饵料,而个体较大的枝角类较为适合。作为饵料开发的枝角类应具备的基础条件:一是环境适应能力强;二是繁殖快、生产力高。壳纹船卵溞具备较高的繁殖力,但其对海水盐度的适应能力较差,不适宜作为海产动物的开口饵料,但可作为淡水水产经济动物的开口饵料。壳纹船卵溞作为开口饵料应具有的优势:一是个体较小,适口性良好;二是通常生活在水体表面,易得性高。
研究表明,中营养和富营养湖泊枝角类种类较贫营养湖泊多,但是当湖泊富营养化加剧时,其种类数反而下降[21-22],且淡水枝角类种类较多,不同水质条件优势种不同,可以通过对各种不同特定条件下枝角类的筛选,选择出对某种环境变化的指示生物。本试验中,壳纹船卵溞对盐度具有较低的耐受性,即其对盐度具有较高的敏感度,因此,可将其作为受试生物指示和检测淡水水域污染和盐碱化,这对环保、饮用水的生物监测具有重要意义。
4 结论
1)壳纹船卵溞在河流、湖泊等大水体中均有分布。
2)盐度对壳纹船卵溞的生存有显著影响,其24 h和48 h的LC50分别为3.35和2.27,安全盐度为0.31。
3)盐度为0.5时壳纹船卵溞的存活率最高、寿命最长,盐度为1.0、1.5时体长增长率较高,盐度为1.0时初次产幼数和总生殖量最大且其内禀增长率最高。
4)盐度为0.5~1.0时,可促进壳纹船卵溞种群增殖。
5)壳纹船卵溞对盐度变化较敏感,可用作海水侵蚀、水污染和水域盐碱化的受试生物。
[1] 蒋燮治,堵南山.中国动物志[M].北京:科学出版社,1979:145-146.
[2] 何志辉,安树升.直额裸腹溞对海水盐度的适应能力[J].动物学杂志,1986,21(2):25-28.
[3] 王岩,何志辉.温度和盐度对蒙古裸腹溞种群内禀增长能力的影响[J].应用生态学报,2001,12(1):91-94.
[4] 王岩,何志辉,蔡云.温度和盐度对蒙古裸腹溞发育的影响[J].海洋与湖沼,2000,31(1):8-14.
[5] 王丹丽,徐善良,彭仕伟.多刺裸腹溞在不同盐度下的种群增长参数及其驯化[J].水生生物学报,2000,24(1):56-62.
[6] 赵文,余博识,王婷,等.近亲裸腹溞对海水盐度的适应性[J].应用生态学报,2006,17(8):1521-1525.
[7] 何志辉,张建国,姜宏.海水盐度对大型溞的存活和内禀增长率的影响[J].大连水产学院学报,1996,11(3):1-7.
[8] 王丹丽,李明云,杨天勇,等.温度与盐度对老年低额溞和蚤状溞生长及生殖的影响[J].水产学报,1996,20(4):379-383.
[9] 杨板,赵文,魏杰,等.盐度对透明溞存活、生长和繁殖的影响[J].水产科学,2019,38(3):361-367.
[10] 魏杰,赵文,杨为东,等.长额象鼻溞对海水盐度的适应性[J].大连水产学院学报,2009,24(1):40-45.
[11] MURUGAN N,SIVARAMAKRISHNAN K G.Laboratory studies on the longevity,instar duration,growth,reproduction and embryonic development in Scapholeberis kingi Sars (1903) (Cladocera:Daphnidae)[J].Hydrobiologia, 1976,50(1):75-80.
[12] XU L,XU S L,HAN X Y,et al.Spatial heterogeneity and long-term dynamics of cladoceran Ephippia in a monsoonal reservoir,driven by hydrology and eutrophication[J].Journal of Paleolimnology,2017,58(4):571-584.
[13] SHARMA B K,HATIMURIA M K.Zooplankton diversity of three floodplain lakes (Beels) of the Majuli River Island,Brahmaputra River Basin of Assam,Northeast India[J].Journal of Aquaculture & Marine Biology,2017,6(1):00144.
[14] KARUTHAPANDI M,RAO D V,Innocent B X.Zooplankton composition,diversity and physicochemical features of Bandam Kommu Pond,Medak District,Telangana,India[J].Proceedings of the Zoological Society,2016,69(2):189-204.
[15] BOZKURT A,AKTA M.Distribution of cladocera species in different waters of Turkey[J].Journal of Limnology and Freshwater Fisheries Research,2016,2(3):137-143.
M.Distribution of cladocera species in different waters of Turkey[J].Journal of Limnology and Freshwater Fisheries Research,2016,2(3):137-143.
[16] 赵文.养殖水域生态学[M].北京:中国农业出版社,2011:24-28.
[17] SCHUYTEMA G S,NEBEKER A V,STUTZMAN T W.Salinity tolerance of Daphnia magna and potential use for estuarine sediment toxicity tests[J].Archives of Environmental Contamination and Toxicology,1997,33(2):194-198.
[18] MORGAN J D,IWAMA G K.Effects of salinity on growth,metabolism,and ion regulation in juvenile rainbow and steelhead trout (Oncorhynchus mykiss) and fall chinook salmon (Oncorhynchus tshawytscha)[J].Canadian Journal of Fisheries and Aquatic Sciences,1991,48(11):2083-2094.
[19] 赵文,何志辉,殷守仁.盐水枝角类的生物学及海水培养利用[M].北京:科学出版社,2008:26,94-138.
[20] 李双宇,揣洁,崔延超,等.盐度对圆形盘肠溞存活、生长和繁殖的影响[J].大连海洋大学学报,2015,30(1):36-40.
[21] DODSON S.Predicting crustacean zooplankton species richness[J].Limnology and Oceanography,1992,37(4):848-856.
[22] 施海彬,陈光杰,刘园园,等.星云湖枝角类群落变化的长期特征与驱动因素[J].生态学杂志,2015,34(9):2464-2473.