盾纤毛虫隶属于纤毛门Ciliophora寡膜纲Oligohymenophorea盾纤目Scuticociliatida[1]。该类纤毛虫能够自由生活在海水中,但在鱼体受伤、环境恶化等情况下,可引起海水养殖动物感染,主要表现为以宿主细胞或组织为食的组织性寄生虫,导致养殖动物大量死亡[2]。盾纤毛虫现已被公认为是海水养殖动物的一类病原体,在亚洲、大洋洲、欧洲和北美洲等地区均已报道鱼类严重感染盾纤毛虫的病例,如海洋尾丝虫Uronema marinum、水滴伪康纤虫Pseudocohnilembus persalinus和贪食迈阿密虫Miamiensis avidus等,能够引起大菱鲆Scophthalmus maximus[3-4]、欧洲舌齿鲈Dicentrarchus labrax[5]、比目鱼Paralichthys olivaceus[6]、海龙 Phyllopteryx taeniolatus[7]、虹鳟Oncorhynchus mykiss[8]、蓝鳍金枪鱼Thunnus maccoyii[9]等鱼类发病。
本试验中,从辽宁大连地区养殖的患病刺参、红鳍东方鲀、大菱鲆体表分离出3种盾纤毛虫,根据其形态分析,并结合3种盾纤毛虫的18S rDNA基因序列[10],构建了相关类群的系统发育树,从分子序列方面进一步确定了其属级系统分类地位[11],在盾纤毛虫适宜环境生活温度20 ℃下,筛选了3种盾纤毛虫体外培养的最适细胞培养基,初步研究了不同温度、盐度、pH条件对3种盾纤毛虫种群生长的影响,旨在为盾纤毛虫的分离鉴定及基于盾纤毛虫全虫疫苗研制的体外培养条件优化提供参考。
1 材料与方法
1.1 材料
2016年10月—2017年5月分别从辽宁省大连市某红鳍东方鲀、大菱鲆和刺参养殖场收集病料,于农业农村部北方海水增养殖重点实验室对病料进行病原分离。将分离到的虫体接种于海水肉汤培养基中驯化培养,之后挑取单个虫体接种于改良过的L-15培养基内纯化培养,并在实验室传代保种。
1.2 方法
1.2.1 盾纤毛虫的形态观察 活体观察:在干净载玻片上滴加虫液,并缓慢盖上盖玻片,由低倍镜到高倍镜,依次观察并拍照记录。
甲醛固定观察:吸取1 mL虫液加至1.5 mL的离心管中,吸取少量体积分数为10%的甲醛溶液滴入离心管,摇匀灭活之后,从中吸取虫液滴在干净载玻片上,并缓慢盖上盖玻片,由低倍镜到高倍镜依次观察并拍照记录。
甲基绿派洛宁染色观察:吸取1 mL虫液加至1.5 mL的离心管中,吸取经离心处理过的甲基绿派洛宁上清染液0.1 mL滴入离心管,摇匀之后,从中吸取虫液滴在干净载玻片上,并缓慢盖上盖玻片,由低倍镜到高倍镜依次观察并拍照记录。
醋酸洋红染色观察:染色条件及观察步骤均同甲基绿派洛宁染色观察,只将甲基绿洛宁液换为等量醋酸洋红染液(不经离心)。
扫描电镜观察:参照王印庚等[12]的步骤。
1.2.2 3种盾纤毛虫总DNA的提取 对纯化后扩大培养的盾纤毛虫,采用浮游生物计数框计数其种群密度(每次吸取25 μL,计数3次,用平均值±标准差表示),并加入适量体积分数为10%的甲醛溶液杀死盾纤毛虫,以4 000 r/min离心10 min,收集5×105个盾纤毛虫,使用TIANamp Genomic DNA 基因组提取试剂盒(天根生化科技(北京)有限公司)提取盾纤毛虫总DNA。用50 μL灭菌双蒸水溶解DNA沉淀,于-80 ℃下保存备用。
1.2.3 18S rDNA 基因序列的PCR扩增 选用18S rDNA通用引物,上游引物F:5′AACCTGGTTGATCCTGCCAGT 3′,下游引物R:5′TGATCCTTCTGCAGGTTCACCTAC 3′[13],以提取的盾纤毛虫总DNA为模板,进行PCR扩增。PCR反应体系(25 μL)包含:rTaq酶0.25 μL,10×buffer 2.5 μL,dNTP 1 μL,总DNA 1 μL,上、下游引物各1 μL,用ddH2O补足至25 μL。PCR扩增程序:94 ℃ 下预变性 5 min;94 ℃下循环变性1 min, 58 ℃下退火复性2 min,72 ℃下延伸2 min,共进行30个循环;最后在72 ℃下再延伸5 min,4 ℃下结束。取3 μL PCR产物经10 g/L琼脂糖凝胶电泳检测(50×TAE缓冲液,电压120 V),DNA 分子量标准使用DL2000,在凝胶成像系统上观察。
1.2.4 基因克隆与测序 采用琼脂糖凝胶DNA回收试剂盒(天根生化科技(北京)有限公司)纯化回收PCR产物,将纯化后的PCR产物直接连接至pEASY-T1载体,转化到感受态细胞Escherichi coli DH5中,接种于含Amp的LB液体培养基中,震荡培养5 h,经特异PCR验证后,将阳性菌株送至北京华大基因研究中心进行DNA测序验证。
1.2.5 环境因子对3种盾纤毛虫种群生长的影响试验
1)培养基的筛选。 在6孔板中分别加入配制好的L-15、RPMI1640和MEM培养基(调节盐度为30,pH为7.2),每种培养基设置3个平行,每孔3 mL,再分别接种300个盾纤毛虫,温度设置为盾纤毛虫自然环境生长适宜温度20 ℃,每天观察并统计25 μL虫液中的种群数量(计数3次,取其平均值),连续观察统计7d。
2)不同温度条件下3种盾纤毛虫种群密度的计数。接种处于种群生长指数期的虫体于50 mL的锥形瓶中,每个锥形瓶盛入20 mL筛选出的最适细胞培养基L-15培养基,调节盐度为30,pH为7.2,分别在10、15、20、30 ℃下进行培养,每个温度设3个平行组,盾纤毛虫种群初始密度为100 ind./mL,每天观察并统计25 μL虫液中的种群数量(计数3次,取其平均值),连续观察统计7 d。
3)不同盐度条件下3种盾纤毛虫种群密度的计数。接种处于种群生长指数期的虫体于50 mL的锥形瓶中,每个锥形瓶盛入20 mL的L-15培养基,培养温度为20 ℃,pH 为7.2,分别在13、20、30和40盐度下进行培养,每个盐度设3个平行组,盾纤毛虫种群初始密度为100 ind./mL,观察及统计方法同温度试验。
4)不同pH条件下3种盾纤毛虫种群密度的计数。接种处于种群生长指数期的虫体于50 mL的锥形瓶中,每个锥形瓶盛入20 mL的L-15培养基,培养温度为20 ℃,盐度为30,分别在pH为4.2、5.2、7.2、9.2下进行培养,每个pH设3个平行组,盾纤毛虫种群初始密度为100 ind./mL,观察及统计方法同温度试验。
1.2.6 序列比对与系统进化分析 将测序所得到的3种盾纤毛虫的18S rDNA序列在GenBank 数据库中用BLAST进行比对分析,并收集相关的盾纤目纤毛虫18S rDNA 基因序列,采用Clustalx软件进行多序列比对。运用MEGA 4软件采用邻接法(Neighbor-joining method)构建系统发生树,并通过自举分析(bootstrap)进行置信度检测,自举数据集为1 000次。
2 结果与分析
2.1 3种盾纤毛虫的形态学
1)分离自大菱鲆的盾纤毛虫(TUR-2)形态特征:活体外形为饱满的水滴状,呈瓜子形,表膜无缺刻;虫体顶端略尖,向背弯曲,后端浑圆,周身长有纤毛,排列稀疏(图1 A~C),后体部有一条较长的尾纤毛(图1F);体内具有多个圆形食物泡,细胞质无色,显微镜下有时可见位于中央区的不透明大核,呈圆形;一个明显伸缩泡,位于体后端。甲基绿派洛宁及醋酸洋红染色结果显示,可见明显大核,位于体中部,为不规则的椭圆形或圆形(图1D、E)。

A、B—活体观察;C—甲醛固定观察;D—甲基绿派洛宁染色观察;E—醋酸洋红染色观察;F—扫描显微镜观察;FV—食物泡;CV—伸缩泡;CC—尾纤毛;Ma—大核。
A and B—observation of living ciliate; C—observation of ciliates fixed by formaldehyde; D—methyl green-pyronin method; E—aeto carmine method; F—electron scanning microscope method; FV—food vacuole; CV—contractile vacuole; CC—caudal cilium; Ma— macronucleus.
图1 分离自大菱鲆的盾纤毛虫TUR-2形态观察
Fig.1 Morphologic observation of scuticociliates TUR-2 isolated from turbot Scophthalmus maximus
2)分离自红鳍东方鲀的盾纤毛虫(TFG-1)形态特征:虫体呈葵花籽形,前半部稍向内侧弯曲,顶端形成不明显的喙状突起,表膜无缺刻,体内具有多个晶体(图2A、B);虫体周身长有纤毛,虫体后端有一条长尾纤毛(图2E)。甲基绿派洛宁及醋酸洋红染色结果显示,可见明显大核,位于体中部,为不规则的椭圆形或圆形(图2C、D)。

A—甲醛固定观察;B—活体观察;C—甲基绿派洛宁染色观察;D—醋酸洋红染色观察;E—扫描显微镜观察;CC—尾纤毛;Ma—大核。
A—observation of ciliates fixed by formaldehyde; B—observation of living ciliate; C—methyl green-pyronin method; D—aeto carmine method; E—electron scanning microscope method; CC—caudal cilium; Ma—macronucleus.
图2 分离自红鳍东方鲀的盾纤毛虫TFG-1形态观察
Fig.2 Morphologic observation of scuticociliates TFG-1 isolated from tiger putter Takifugu rubripes
3)分离自刺参的盾纤毛虫(STI-3)形态特征:活体外形稳定,呈典型瓜子形,前半部稍向内侧弯曲,顶端裸毛区形成明显的喙状突起,呈尖角状(图3B);表膜无缺刻,体内具有多个不透明晶体(图3A、B),中央区或前端偏上可见大核;虫体顶端尖,周身遍布纤毛,后端有一条略长的尾纤毛(图3E)。甲基绿派洛宁及醋酸洋红染色结果显示,可见中央区或前端明显大核,为不规则的椭圆形或圆形,小核不明显,近球形,紧位于大核侧边(图3C、D)。

A—活体观察;B—甲醛固定观察;C—甲基绿派洛宁染色观察;D—醋酸洋红染色观察;E—扫描显微镜观察;CC—尾纤毛;Ma—大核;Mi—小核。
A—observation of living ciliate; B—observation of ciliates fixed by formaldehyde; C—methyl green-pyronin method; D—aeto carmine method; E—electron scanning microscope method; CC—caudal cilium;Ma—macronucleus;Mi—micronucleus.
图3 分离自刺参的盾纤毛虫STI-3形态观察
Fig.3 Morphologic observation of scuticociliates STI-3 isolated from sea cucumber Apostichopus japonicus
2.2 序列比对与系统进化分析
利用真核生物18S rDNA的通用引物F/R进行PCR扩增,电泳胶图如图4所示。测序结果显示,TFG-1基因片段大小为1 756 bp,TUR-2基因片段大小为1 755 bp,STI-3基因片段大小为1 755 bp。将扩增片段的测序序列在GenBank上进行同源性比对后显示, TFG-1序列与海洋尾丝虫Uronema marinum(GQ259747.1)的一致性高达99%,TUR-2序列与水滴伪康纤虫Pseudocohnilembus persalinus(GQ265955.1)的一致性高达99%,STI-3序列与海洋尾丝虫U.marinum(DQ867074)的一致性高达99%。
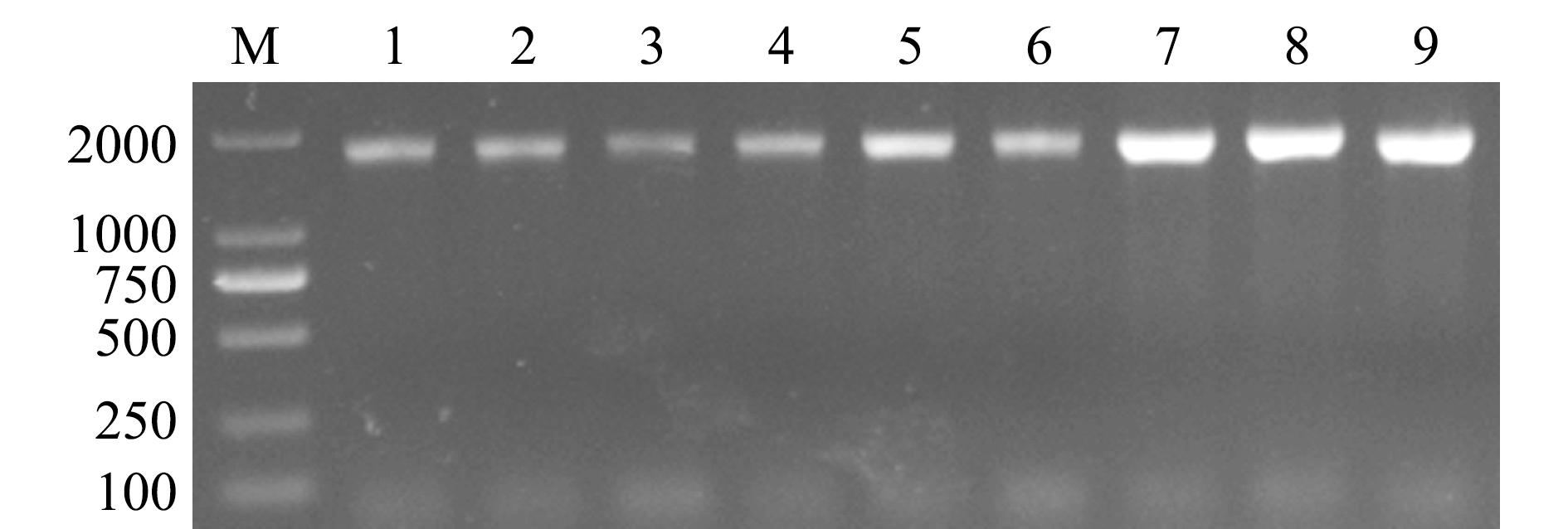
M—DL2000 DNA Marker;1~3—TFG-1的18S rDNA条带;4~6—STI-3的18S rDNA条带;7~9—TUR-2的18S rDNA条带。
M—DL2000 DNA Marker; 1-3—PCR product of 18S rDNA gene of the TFG-1; 4-6—PCR product of 18S rDNA gene of the STI-3; 7-9—PCR product of 18S rDNA gene of the TUR-2.
图4 18S rDNA通用引物PCR扩增结果
Fig.4 Amplification of 18S rDNA gene by PCR
在GenBank 数据库中,选取17 种不同种属的纤毛虫相应序列,采用MEGA 4软件构建系统进化树,结果如图5所示,TFG-1序列与U. marinum(GQ259747.1)以最高置信值(100%)聚为一支;TUR-2 序列与P.persalinus(GQ265955.1)以最高置信值(100%)聚为一支, 再与Mesanophrys carcini(AY103189)以置信度(47%)聚为一支,而与其他种类相距较远;STI-3序列与U.marinum(DQ867074)以最高置信值(100%)聚为一支。
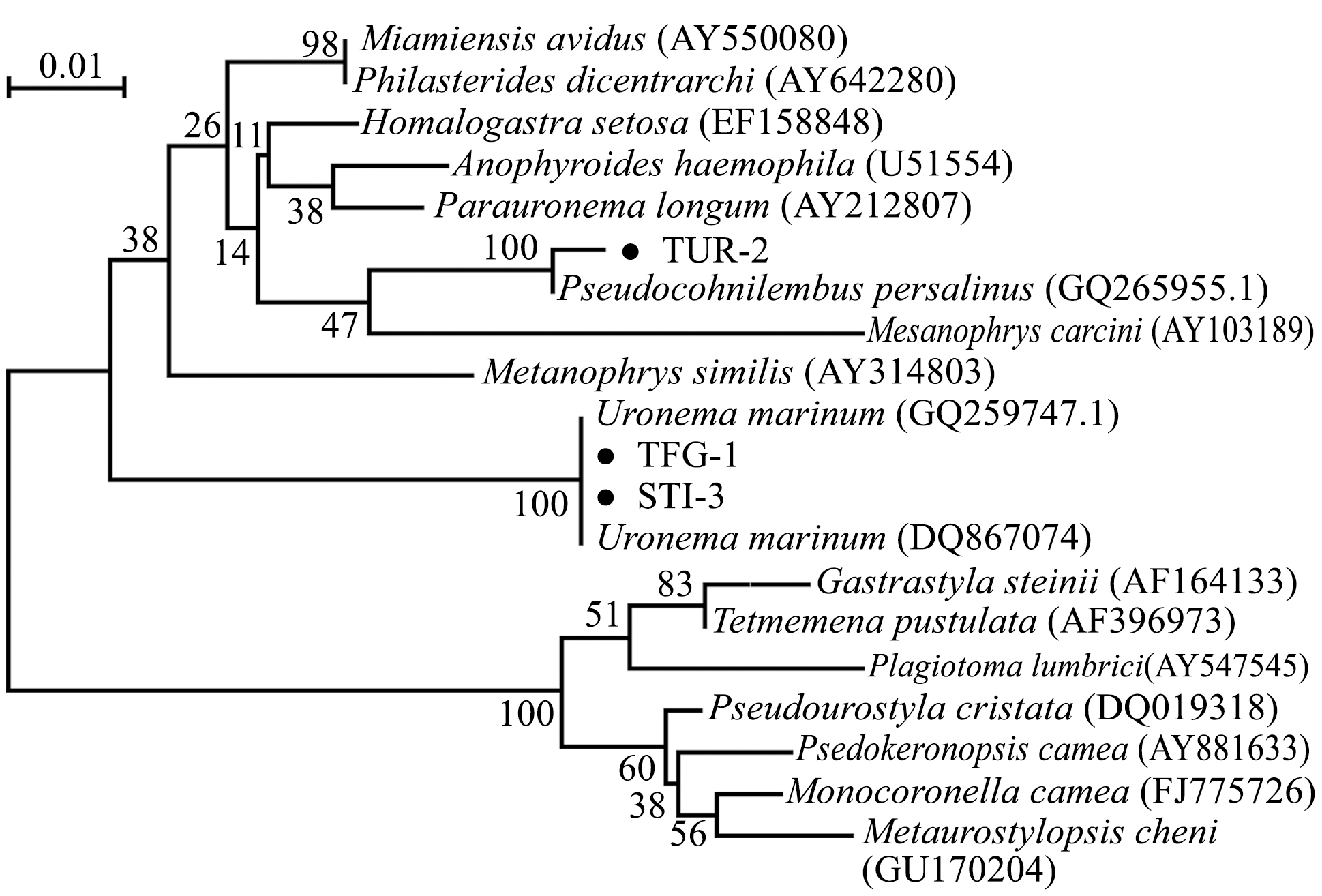
图5 基于18S rDNA基因序列构建的系统发育树
Fig.5 Phylogenetic tree of the related ciliates based on 18S rDNA sequences
2.3 盾纤毛虫体外培养基筛选
在盾纤毛虫适宜环境生活温度20 ℃下,设置盐度30、 pH 7.2,开展了3种盾纤毛虫在不同培养基中的体外培养,结果如图6所示。从图6可见:TFG-1、TUR-2 和STI-3均能在L-15、MEM和RPMI1640培养基中生长,且培养4~5 d时,种群密度达到最大值,之后处于稳定期;在生长期,TFG-1、TUR-2 和STI-3在L-15培养基的繁殖速度比在MEM、RPMI1640培养基中快;3种盾纤毛虫在L-15培养基中生长的最大种群密度也比在MEM、RPMI1640培养基中高,且稳定期较长。

图6 3种盾纤毛虫在3种培养基中的生长情况
Fig.6 Growth of three species of scuticociliates in the three media
这表明,在20 ℃培养温度下,3种盾纤毛虫均能够在3种细胞培养基中生长,但在L-15细胞培养基中的种群密度显著高于MEM和RPMI1640培养基。
2.4 温度对3种盾纤毛虫种群生长的影响
在盐度30、pH 7.2条件下,开展了3种盾纤毛虫在不同培养温度下的体外培养试验,结果如图7所示。10 ℃时,TUR-2能够分裂增殖,种群密度在第6天时达到最大值,TFG-1和STI-3种群密度较低,未出现明显增殖(图7(a));15 ℃时,TUR-2的种群密度在第5天时达到最大值,STI-3的种群密度在第7天时达到最大值,TFG-1种群密度较低,未出现明显增殖,TUR-2的种群密度明显高于STI-3(图7(b));20 ℃时,STI-3的种群密度在第4天时达到最大值,TFG-1种群密度在第4天时达到最大值,TUR-2的种群密度在第6天时达到最大值,STI-3的种群密度明显高于TUR-2和TFG-1(图7(b));30 ℃时,STI-3和TUR-2的种群密度均在第5天时达到最大值,STI-3的增长明显高于TFG-1和TUR-2,TFG-1的种群密度明显高于TUR-2(图7(b))。
3种盾纤毛虫在15、20、30 ℃培养温度中均能够生长,随着温度的升高盾纤毛虫呈现出了种群密度增大的趋势,表明一定范围内温度的提升有助于盾纤毛虫种群密度的增加,但根据本研究中宿主的自然生活温度,均为低温养殖动物,最终确定20 ℃用于3种盾纤毛虫体外培养温度。
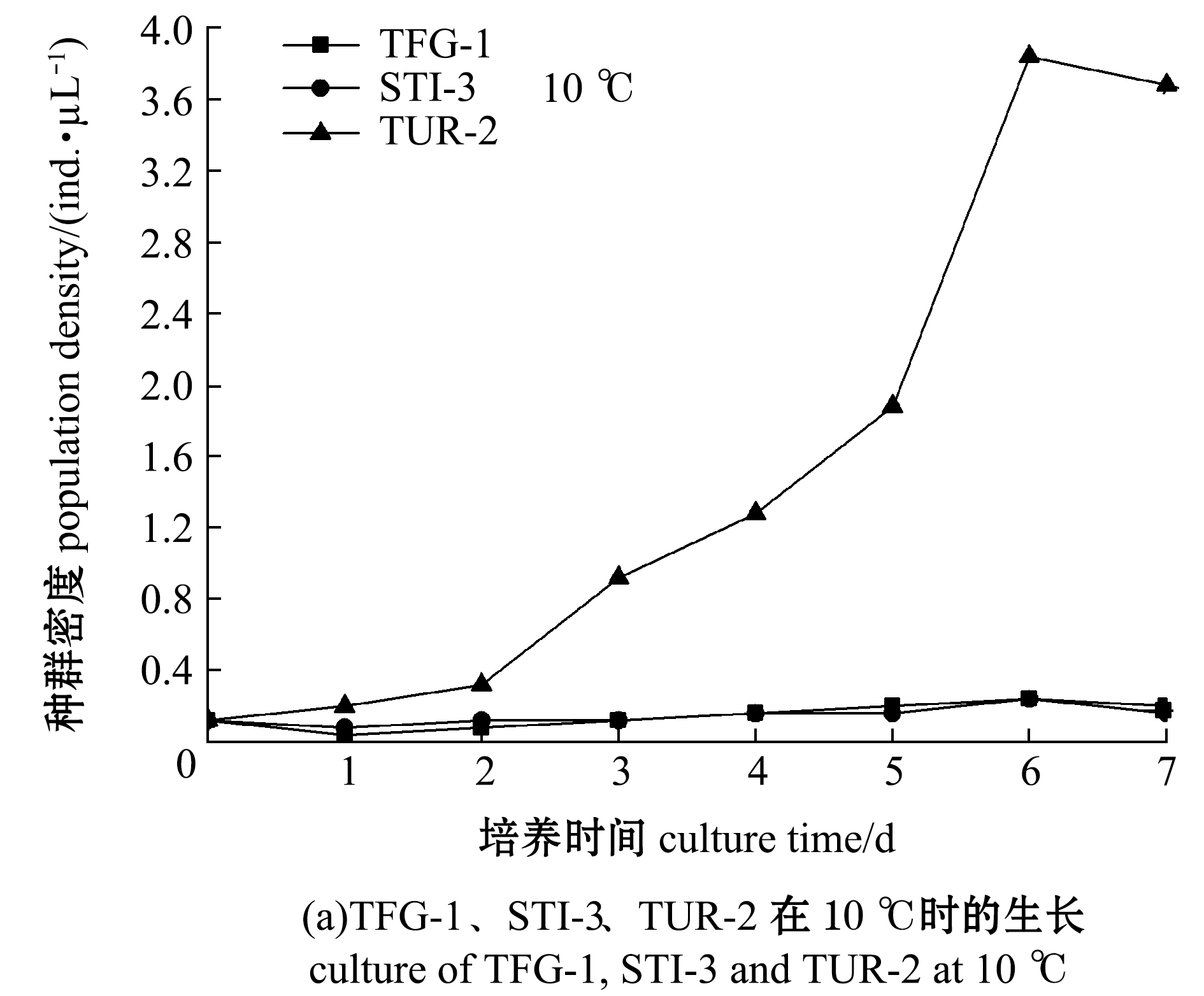

图7 3种盾纤毛虫在10、15、20、30 ℃时的生长情况
Fig.7 Growth of three species of scuticociliates at 10, 15, 20 and 30 ℃
2.5 盐度对3种盾纤毛虫种群生长的影响
在温度为20 ℃、pH 7.2条件下,开展了3种盾纤毛虫在不同盐度下的体外培养试验,结果如图8所示。初始盐度为13时,TUR-2的种群密度在第5天时达到最大值,STI-3的种群密度在第5天时开始增加,TFG-1的种群密度较低,不增殖(图8(a));初始盐度为20时,TUR-2 的种群密度在第5天时达到最大值,TFG-1的种群密度在第7天时达到最大值,STI-3的种群密度在第4天时达到最大值(图8(b));初始盐度为30时,STI-3种群密度在第6天时达到最大值,TUR-2种群密度在第7天时达到最大值,TFG-1的种群密度在第5天时达到最大值,STI-3的种群密度明显高于TUR-2和TFG-1,TUR-2 的种群密度明显高于TFG-1(图8(b));初始盐度为40时,STI-3的种群密度在第4天时达到最大值,TUR-2的种群密度在第6天时达到最大值,TFG-1的种群密度在第5天时达到最大值,STI-3的种群密度明显高于TUR-2、TFG-1(图8(b))。
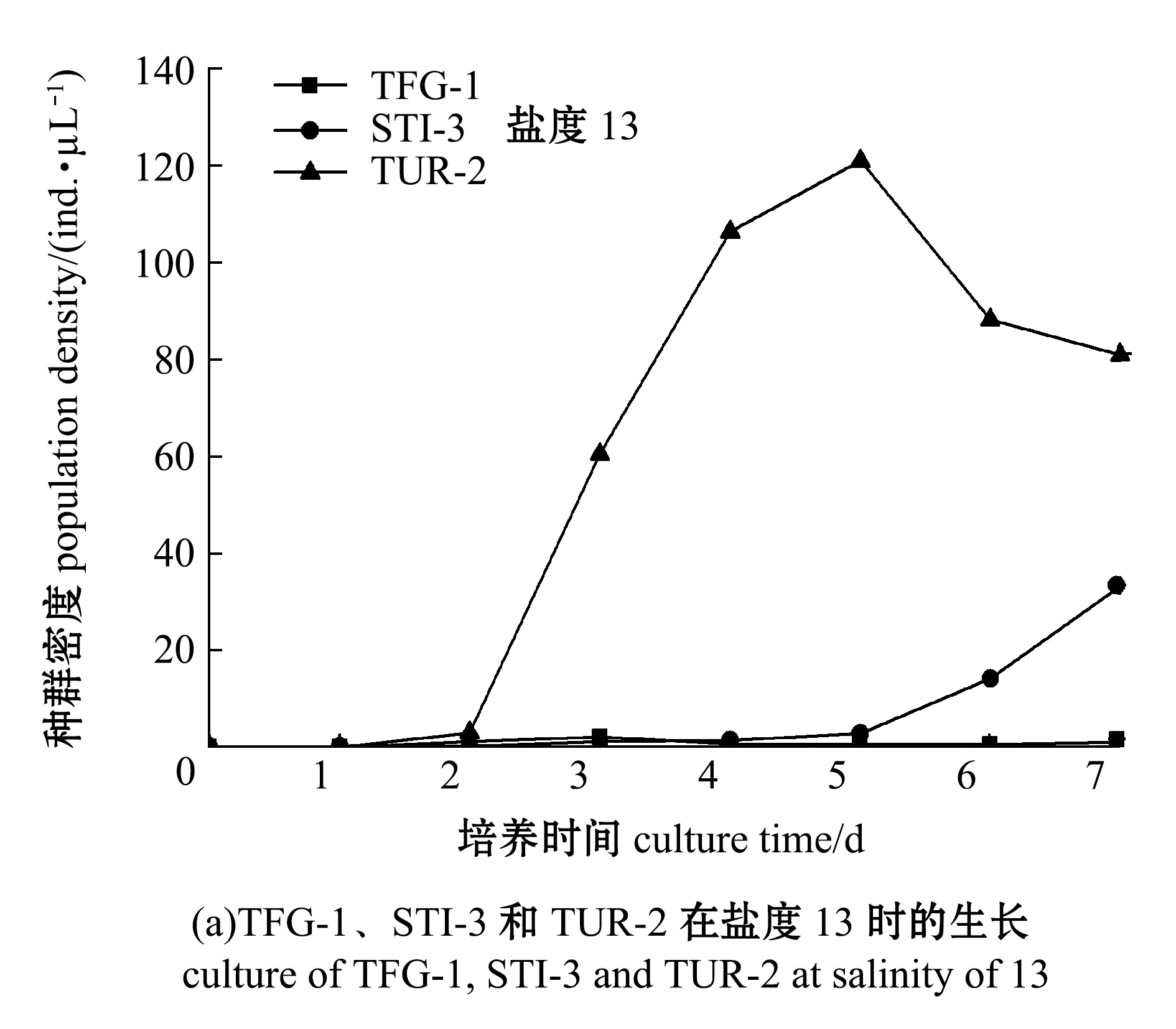
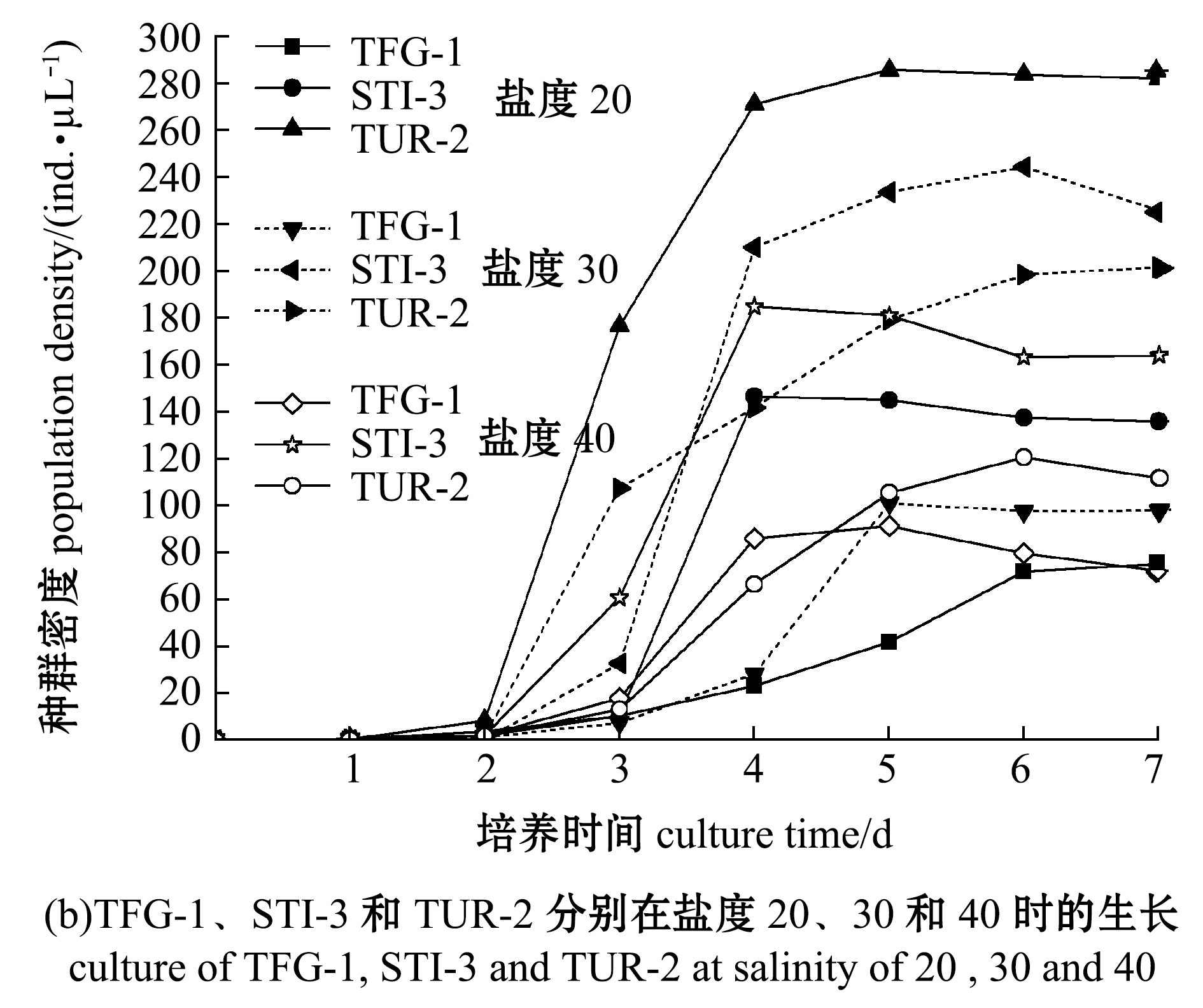
图8 3种盾纤毛虫在盐度为13、20、30和40时的生长情况
Fig.8 Growth of the three species of scuticociliates at salinity of 13, 20, 30 and 40
这表明,在20 ℃培养温度下,3种盾纤毛虫均能够在盐度为20、30、40的L-15细胞培养基中生长,但在盐度为30的L-15细胞培养基中的种群密度明显高于盐度为20和40的细胞培养基。
2.6 pH对3种盾纤毛虫种群生长的影响
在温度为20 ℃、盐度30条件下,开展了3种盾纤毛虫在不同pH下的体外培养试验,结果如图9所示。初始pH为4.2时,STI-3、TFG-1和TUR-2的种群密度均较低,未出现明显增殖(图9(a));初始pH为5.2时, 培养到第4天时, TFG-1种群密度开始增加, 在第7天时达到最大值,培养到第5天时,STI-3种群密度开始增加,STI-3的种群密度在第7天时达到最大值,TUR-2的种群密度较低,未出现明显增殖(图9(b));初始pH为7.2时,STI-3和TFG-1的种群密度在第4天时达到最大值,TUR-2的种群密度均在第5天时达到最大值,STI-3的种群密度明显高于TFG-1、TUR-2(图9(b));初始pH为9.2时,TUR-2和STI-3的种群密度均在第5天时达到最大值,TFG-1的种群密度在第6天时达到最大值(图9(b))。

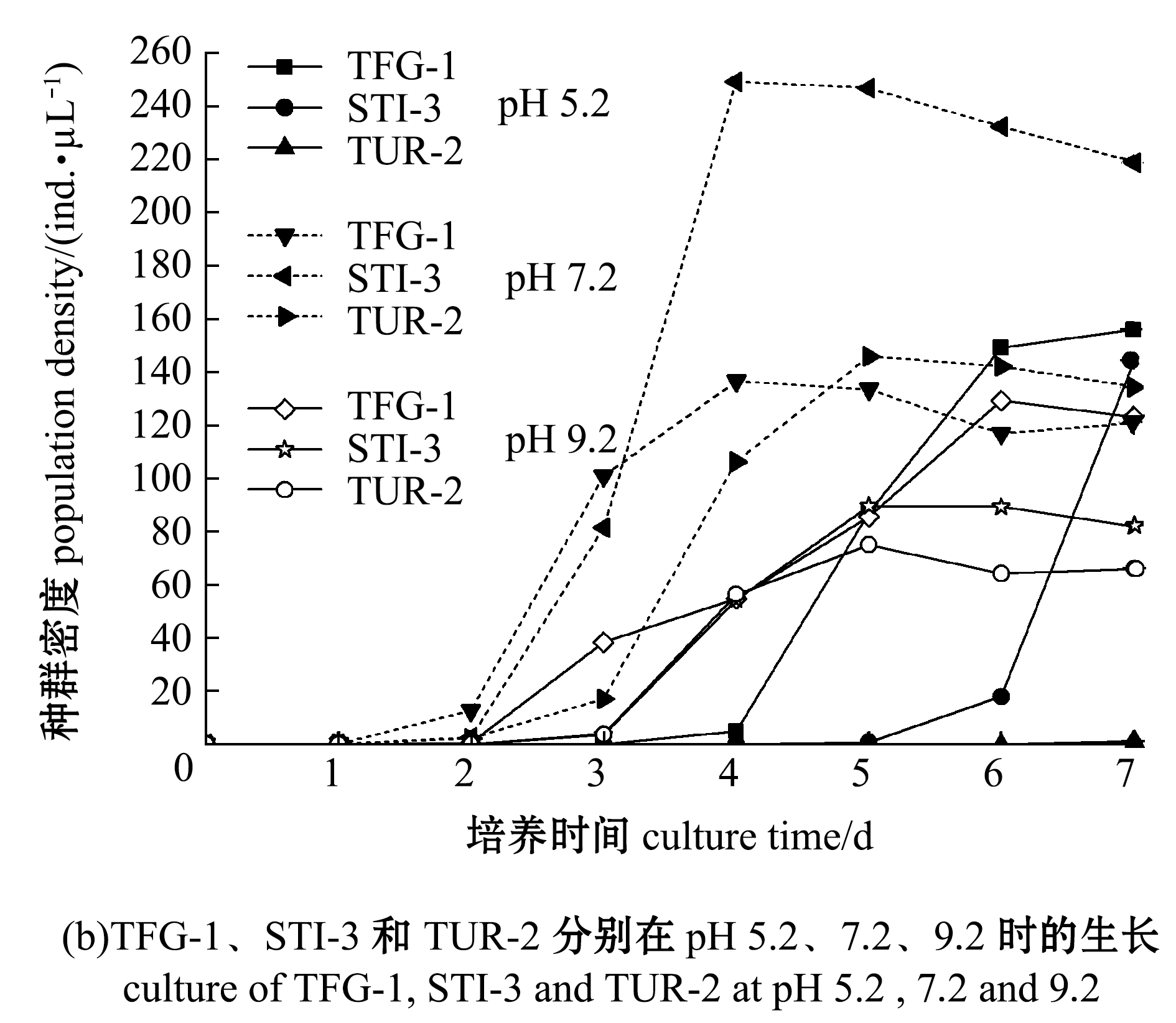
图9 3种盾纤毛虫在pH为4.2、5.2、7.2和9.2时的生长情况
Fig.9 Growth of three species of scuticociliates at pH 4.2, 5.2, 7.2 and 9.2
这表明,在20 ℃培养温度下,3种盾纤毛虫均能够在pH为7.2和9.2的L-15细胞培养基中生长,但在pH为7.2的L-15细胞培养基中的种群密度最高。
3 讨论
3.1 不同宿主源盾纤毛虫的分离与鉴定
目前,国内已有红鳍东方鲀、大菱鲆等海洋动物盾纤毛虫病的报道,且能够从同一种宿主上分离出不同种类的盾纤毛虫,或者同一种类的盾纤毛虫能够从多种宿主上分离出来,这表明盾纤毛虫无明显的宿主选择性。高晓田等[14]、张立坤等[15]分离并鉴定出引起牙鲆体表溃烂的寄生虫为贪食迈阿密虫Miamiensis avidus和水滴伪康纤虫P.persalinus。研究表明,蟹栖拟阿脑虫Paranophrgs carcini不仅能感染中华绒螯蟹[16],而且能感染人工越冬期的中国对虾[17],同时吞食大菱鲆体表组织引起体表溃烂[12]。
本研究中从患病养殖大菱鲆体表溃烂处分离到的病原盾纤毛虫,与张立坤等[15]分离自养殖牙鲆体表溃烂组织中的盾纤毛虫,以及宋微波等[18]从养殖对虾中分离到的盾纤毛虫,均在形态特征上较为相似。结合18S rDNA序列比对结果,本研究中确定此盾纤毛虫是伪康纤虫属的一种,再次证明了盾纤毛虫无明显的宿主选择性。麻丽丹等[19]从患病养殖红鳍东方鲀体表分离到的盾纤毛虫,以及王会芳[20]从红鳍东方鲀分离到的盾纤毛虫,均只根据形态特征鉴定病原体为海洋尾丝虫,而本研究中从形态特征和18S rDNA序列信息两方面进一步证实了本次引起养殖红鳍东方鲀体表溃烂的寄生虫属于尾丝虫属。本研究中同时还从患病养殖刺参溃烂组织中分离到病原,通过形态特征及分子生物学方法确定其也隶属尾丝虫属。
目前,尚未有由尾丝虫属寄生引起养殖刺参盾纤毛虫病的研究报道,本研究在国内属首次报道,病因可能与刺参的生活习性有关,野生刺参是底栖动物,一般生活在潮流畅通、水质清澈的岩礁底或沙底海域[21],几乎不与营腐生盾纤毛虫接触,同时刺参生活的低温环境不利于盾纤毛虫的大量繁殖,但随着人工养殖刺参的环境恶化,加剧了盾纤毛虫病在刺参中传播的风险,具体原因还需进一步研究。本研究中分离自红鳍东方鲀的盾纤毛虫与分离自刺参的盾纤毛虫均属于尾丝虫,但在形态特征上存在较大差异,如吻端大小不同,形体不同等,再结合分子信息,两者18S rDNA序列存在一个碱基的差异, 推测是否因为宿主不同导致的寄生虫相应突变, 还需进一步研究证明。
3.2 体外培养基筛选和最佳培养条件筛选
本研究在盾纤毛虫体外培养基筛选试验中发现,L-15培养基更适合盾纤毛虫的体外培养。L-15培养基富含无机盐、氨基酸和维生素,与MEM、RPMI1640培养基相比,L-15培养基的氨基酸含量更高,高水平的氨基酸对体外培养盾纤毛虫的生存和繁殖很重要。本试验结果与Iglesias 等[22]的研究结果相同。虽然本试验中已在L-15培养基里添加了一定量的青霉素和链霉素,可抑制绝大多数的细菌,但后续试验中发现,培养基里还有少量细菌,通过药敏试验筛选出了最佳的抗生素是诺氟沙星,因此,可以在培养基里添加适当的诺氟沙星,以进一步抑制细菌滋生。
此外,本研究在实验室不同温度、盐度和pH条件下对3种盾纤毛虫种群密度的影响试验中发现,在更接近盾纤毛虫自然环境温度20 ℃条件下,盐度为30、pH为7.2时,3种盾纤毛虫的种群密度相对较高,且维持时间较长,这与张立坤等[23]研究贪食迈阿密虫在实验室的培养结果相吻合。
4 结论
1)本研究中从刺参和红鳍东方鲀体表分离出的盾纤毛虫均属于尾丝虫Uronema sp.,但两者的18S rDNA序列存在一个碱基的差异;从大菱鲆体表分离出的盾纤毛虫属于伪康纤虫Pseudocohnilembus sp.,尚属国内首次报道。
2)3种盾纤毛虫在L-15培养基中培养的种群密度较MEM、RPMI1640高,L-15培养基为3种盾纤毛虫的最佳体外培养基。推荐体外培养条件为温度20 ℃、盐度30、pH 7.2。本研究结果可为海水养殖动物盾纤毛虫的分离鉴定及进一步研究提供科学参考。
3)通过调查发现,病料采集养殖场所用水源靠近人类生活区,养殖水源未经充分沉淀过滤消毒等处理直接使用,养殖污水未经处理直接流入附近海水,以及养殖水池消毒不彻底等,造成水体中有大量盾纤毛虫滋生、繁殖,并有机会寄生在养殖海水鱼类及刺参体上,引发盾纤毛虫病。因此,在养殖过程中,保持良好的养殖环境,彻底消灭水体病原对预防疾病发生具有重要的意义。
[1] 徐奎栋,宋微波.海洋贝类几种危害性纤毛虫的研究[J].中国水产科学,1999,6(2):41-45.
[2] JUNG S J,KITAMURA S I,SONG J Y,et al.Miamiensis avidus (Ciliophora:Scuticociliatida) causes systemic infection of olive flounder Paralichthys olivaceus and is a senior synonym of Philasterides dicentrarchi[J].Diseases of Aquatic Organisms,2007,73(3):227-234.
[3] DYKOV I,FIGUERAS A.Histopathological changes in turbot Scophthalmus maximus due to a histophagous ciliate[J].Diseases of Aquatic Organisms,1994,18:5-9.
I,FIGUERAS A.Histopathological changes in turbot Scophthalmus maximus due to a histophagous ciliate[J].Diseases of Aquatic Organisms,1994,18:5-9.
[4] IGLESIAS R,PARAM A,ALVAREZ M F,et al.Philasterides dicentrarchi (Ciliophora,Scuticociliatida) as the causative agent of scuticociliatosis in farmed turbot Scophthalmus maximus in Galicia (NW Spain)[J].Diseases of Aquatic Organisms,2001,46(1):47-55.
A,ALVAREZ M F,et al.Philasterides dicentrarchi (Ciliophora,Scuticociliatida) as the causative agent of scuticociliatosis in farmed turbot Scophthalmus maximus in Galicia (NW Spain)[J].Diseases of Aquatic Organisms,2001,46(1):47-55.
[5] DRAGESCO A,DRAGESCO J,COSTE F,et al.Philasterides dicentrarchi,n. sp.,(Ciliophora,Scuticociliatida),a histophagous opportunistic parasite of Dicentrarchus labrax(Linnaeus,1758),a reared marine fish[J].European Journal of Protistology,1995,31(3):327-340.
[6] KIM S M,CHO J B,KIM S K,et al.Occurrence of scuticociliatosis in olive flounder Paralichthys olivaceus by Phiasterides dicentrarchi (Ciliophora:Scuticociliatida)[J].Diseases of Aquatic Organisms,2004,62(3):233-238.
[7] UMEHARA A,KOSUGA Y,HIROSE H. Scuticociliata infection in the weedy sea dragon Phyllopteryx taeniolatus[J].Parasitology International,2003,52(2):165-168.
[8] JONES S R M,PROSPERI-PORTA G,LAPATRA S E.First isolation of Pseudocohnilembus persalinus (Ciliophora:Scuticociliatida) from freshwater-reared rainbow trout,Oncorhynchus mykiss[J].Journal of Parasitology,2010,96(5):1014-1016.
[9] MUNDAY B L,O’DONOGHUE P J,WATTS M,et al.Fatal encephalitis due to the scuticociliate Uronema nigricans in sea-caged,southern bluefin tuna Thunnus maccoyii[J].Diseases of Aquatic Organisms,1997,30(1):17-25.
[10] GARZA J B,BOTT N J,HAMMOND M D,et al.Molecular characterisation of Miamiensis avidus (Ciliophora:Scuticociliata) from ranched southern bluefin tuna,Thunnus maccoyii off Port Lincoln,South Australia[J].Aquaculture,2017,469:44-49.
[11] 孙春燕,赵元莙.DNA序列分析在黏孢子虫系统学研究和病原检测中的应用[J].中国水产科学,2006,13(1):159-164.
[12] 王印庚,陈洁君,秦蕾.养殖大菱鲆蟹栖异阿脑虫感染及其危害[J].中国水产科学,2005,12(5):594-601.
[13] CHEUNG P J,NIGRELLI R F,RUGGIERI G D.Studies on the morphology of Uronema marinum Dujardin (Ciliatea:Uronematidae) with a description of the histopathology of the infection in marine fishes[J].Journal of Fish Diseases,1980,3(4):295-303.
[14] 高晓田,王玉梅,张立坤,等.1种牙鲆致病性纤毛虫的鉴定[J].水利渔业,2008,28(4):128-129.
[15] 张立坤,王玉梅,肖国华,等.寄生于养殖牙鲆体表溃烂组织中的水滴伪康纤虫[J].河北渔业,2007(10):42-43.
[16] 卜云江.中华绒螯蟹蟹栖拟阿脑虫病的研究[J].海洋渔业,1997(2):65-66.
[17] 孙修勤,张进兴.对虾越冬期蟹栖拟阿脑虫病的研究[J].黄渤海海洋,1994,12(2):65-68.
[18] 宋微波,赵元莙,徐奎栋,等.海水养殖中的危害性原生动物[M].北京:科学出版社,2003.
[19] 麻丽丹,王殿夫,于晓婕,等.养殖河豚鱼的海洋尾丝虫病病例[J].中国兽医杂志,2012,48(3):69-70.
[20] 王会芳.红鳍东方鲀海洋尾丝虫病研究[J].中国水产,2012,(2):54-56.
[21] 薛素燕.养殖刺参(Apostichopus japonicus)的生态习性及代谢生理的初步研究[D].青岛:中国海洋大学,2007.
[22] IGLESIAS R,PARAMá A, LVAREZ M F,et al.In vitro growth requirements for the fish pathogen Philasterides dicentrarchi (Ciliophora,Scuticociliatida)[J].Veterinary Parasitology,2003,111(1):19-30.
LVAREZ M F,et al.In vitro growth requirements for the fish pathogen Philasterides dicentrarchi (Ciliophora,Scuticociliatida)[J].Veterinary Parasitology,2003,111(1):19-30.
[23] 张立坤,赵振良,王玉梅,等.3种环境因子对致病性纤毛虫——贪食迈阿密虫种群生长的影响[J].海洋水产研究,2008,29(6):122-125.