裙带菜Undaria pinnatifida隶属于褐藻门褐子纲海带目翅藻科裙带菜属,精选的裙带菜其营养可以与螺旋藻媲美,在日本称其为“天然螺旋藻”。裙带菜是微量元素和矿物质的天然宝库,含有十几种人体所需的氨基酸及钙、碘、锌、硒、叶酸,以及维生素A、B、C等矿物质。裙带菜含钙量是“补钙之王”牛奶的10倍,含锌量是“补锌能手”牛肉的3倍。500 g裙带菜含铁量等于10.05 kg菠菜,含维生素C量等于0.75 kg胡萝卜,含蛋白质量等于1.5个海参。其含碘量也比海带多,加上富含氨基酸、粗纤维等微量元素,对儿童的骨骼、智力发育极为有益。裙带菜还可作为刺参饲料原料,助力海参产业[1],其提取物裙带菜凝集素能提高日本对虾非特异性免疫[2],提取物褐藻多糖硫酸酯混合制剂有降血脂作用[3]。
裙带菜在辽宁、山东沿海广为养殖,并发展为当地重要的支柱产业。近年来,随着养殖规模的不断扩大,其病害问题表现得越来越突出,裙带菜溃烂成为裙带菜养殖优质、高产、稳产的重大障碍。大量研究表明,裙带菜溃烂是由多方面因素引起的,致病原因也非常复杂,包括海区环境如温度、光照、盐度、营养盐、pH、潮汐差、栽培密度及微生物因素等,其中,微生物因素是不可忽视的重要原因之一。如马悦欣等[4-5]于1997年首次报道并命名了绿烂病和斑点烂病,并从患病叶状体中分离出火神弧菌和优美德利菌,其后姜静颖等[6]研究了绿烂病病原火神弧菌对宿主感染情况。2018 年 2—3 月,大连市龙王塘和旅顺增养殖海域的裙带菜大面积溃烂,主要表现为叶片顶端出现溃烂,藻体难以展平,边缘皱缩,后期完全腐烂。以患病裙带菜叶状体捣烂组织进行细菌学检验,结果在褐藻酸钠固体选择性培养基上分离到 2 种大量优势生长的细菌(编号为 LQ2 和 LH43)。本研究中,对分离菌株的致病性、生理生化特性、16S rRNA 基因序列的系统发育学及抗生素药敏特性进行了分析,以期为裙带菜病害的研究提供科学参考。
1 材料与方法
1.1 材料
患病裙带菜样品采自大连市龙王塘和旅顺铁山增养殖海域。供感染的健康裙带菜采自金州大李家海域。
培养基及细菌微量生化反应管等均购自杭州天和微生物试剂有限公司。
1.2 方法
1.2.1 细菌分离 取裙带菜患病部位,经生理盐水冲洗后于灭菌后的研钵中匀浆,取0.1 mL匀浆液分别涂布于2216E琼脂培养基、TCBS培养基、褐藻酸钠固体培养基及纤维素钠固体培养基平板上,参考养殖伐区环境温度并于10 ℃下培养。褐藻酸钠固体选择性培养基成分: 0.5%褐藻酸钠+0.5%(NH4) 2SO4+0.2% K2HPO4+0.2% MgSO4·7H2O+2.5% NaCl+0.01% FeSO4·7H2O+1.3% 琼脂(均为质量分数),pH为 7.5。
1.2.2 优势菌与裙带菜溃烂病的相关性试验 选用长度1 m以下的整株藻体,挑选色泽正常、生长健壮的裙带菜叶状体,将假根(固着器)夹入绳内,将藻体吊养在玻璃钢水槽(1.6 m×0.8 m×1.6 m)中,每个水槽中吊挂5株个体,培养温度为(12±1)℃。试验前将藻体用毛笔刷洗干净,在体积分数1%柠檬酸海水溶液中润洗片刻,再用洁净海水冲洗掉叶状体表面的柠檬酸液,暂养3 d。
将分离的两种优势菌株(编号分别为LQ2和LH43)接种于营养肉汤中,10 ℃下过夜培养,逐级扩大培养至体积2 L,密度分别为5.4×109 、4.1×109 CFU/mL。将供试菌均匀加入玻璃钢水槽中,海水中LQ2和LH43菌体的终密度分别为 5.4×106 、4.1×106 CFU/mL,在室温自然光照条件下培养。同时试验设无菌营养肉汤对照组和空白对照组。
1.2.3 优势菌株的形态观察与鉴定 参考闫咏等[7]的方法对分离菌株进行形态及理化特性测定。将供试菌株制备成涂片标本,经革兰氏染色后镜检;采用生化试验法测定菌株的理化特性[8-9]。纯化后的单菌落用体积分数2.5%的戊二醛固定液处理,在透射电镜下观察形态。
按照张晓君等[10]的方法扩增分离菌的16S rRNA基因序列,使用PCR 扩增通用引物对(27F、1492R)[11],将扩增获得的16S rRNA序列与 NCBI数据库中16S rRNA序列进行比对,获得同源关系较近序列。将从GenBank 数据库中获得的序列相似性较高菌株序列进行多序列匹配排列,采用Mega 6.0软件,使用邻接法(Neighbor-joining)构建分子系统发生树,并通过Bootstrap 法(1 000 次重复)进行检验。
1.2.4 优势菌株胞外产物褐藻酸裂解酶活力的测定 采用陈洪基等[12]的方法测定分离纯化酶及其酶活力。褐藻酸裂解酶活定义:在规定试验条件下,每分钟产生1 μg还原性糖所需的酶量为一个酶活力单位(U)。在pH为7.5条件下,以最大酶活力为100%,测定褐藻酸裂解酶在5~30 ℃的相对酶活力,等温度梯度设置6个试验温度,以确定酶反应的最适温度。
1.2.5 药敏特性试验 依据美国NCCLS试验标准方法[13],通过K-B法测定分离菌株对14种抗生素的敏感特性。将菌株接种于营养肉汤中,置于28 ℃培养箱中24 h,调整菌液密度为3.0×107 CFU/mL,采用酶标仪微量法确定菌液密度[14]。将14种药敏纸片轻压于涂布150 μL菌液的培养基表面,28 ℃下恒温培养24 h后,测量抑菌圈直径,参照药敏纸片说明书,判断菌株的药物敏感特性。
2 结果与分析
2.1 细菌分离、形态特征及致病性
在2216E琼脂培养基上及褐藻酸钠固体培养基上均分离得到 2 株优势生长的菌株。 菌落特征为圆形光滑整齐、较隆起、浅黄色半透明;LQ2 菌落特征为不透明、乳白色,在琼脂为唯一碳源的合成培养基上生长较缓慢。两菌株菌落较小,直径多为0.5 mm 左右;TCBS 培养基中均未生长。
革兰氏染色结果均为阴性菌(图1(a)、(b));透射电镜下可见LH43菌体大小略有不同,约为0.60 μm×1.01 μm(图1(c)),细菌细胞壁厚度较大,只能观察到菌体大小轮廓;透射电镜下可见LQ2菌体大小略有不同,约为0.59 μm×1.20 μm(图1(d))。

图1 菌株形态特征
Fig.1 Morphological characteristics of the bacterial strains
用分离菌株感染健康裙带菜叶状体 48 h 后,藻体边缘颜色变淡,叶状体边缘出现黑色斑点,继续养殖,最后藻体边缘逐渐腐烂分解。肉汤对照组和空白对照组叶状体生长正常,发育同自然状态一致,无明显变化。
2.2 生化试验结果
从表1可见:LH43、LQ2菌株氧化酶反应均呈阳性,其中LQ2菌株过氧化氢酶反应呈阳性;LH43菌株能利用葡萄糖、麦芽糖、乙酰胺酶和淀粉酶,能合成胞外DNA酶;LQ2菌株能利用乙酰胺酶、硝酸盐和丙二酸盐;加入质量分数为1%、3%、6% NaCl,两菌株均能生长。
表1 LH43和LQ2菌株的生化试验结果
Tab.1 Biochemical test results of the strain LH43 and the strain LQ2

生化试验biochemical test结果 resultLH43LQ2生化试验biochemical test结果 resultLH43LQ2氧化酶 oxydase++酒石酸盐利用 tartrate utilization--过氧化氢酶 catalase-+苯丙氨酸脱氨酶 phenylalanine deaminase--O-F试验 O-F test--蜜二糖 melibiose--动力 power--纤维二糖 cellobiose--葡萄糖 glucose+-甲基红 methyl red--乳糖 lactose--V-P试验 V-P test--麦芽糖 maltose+-H2S 产生 hydrothion produse--甘露醇 mannitol--乙酰胺酶 acetamide enzyme++甘露糖 mannose--淀粉酶 amylase+-蔗糖 sucrose--DNA酶 DNA enzyme+-阿拉伯糖 arabinose--硝酸盐还原 nitrate reduction-+阿拉伯醇 arabinol--肌醇 inositol--木糖 xylose--水杨苷 salicin--半乳糖 galactose--丙二酸盐利用 malonate utilization-+山梨糖 sorbose--枸橼酸盐利用 citrate utilization--赤鲜醇 erythritol--0%NaCl生长growth at 0% NaCl--鼠李糖 rhamnose--1%NaCl生长growth at 1% NaCl++糊精 dextrin--3%NaCl生长growth at 3% NaCl ++果糖 fructose--6%NaCl生长growth at 6% NaCl++
注:+ —阳性;- —阴性。
Note:+ — positive;- —negative.
2.3 16S rRNA基因序列与系统发育分析
用LH43和LQ2菌株扩增出的16S rRNA基因序列长度分别为1 450 bp和1 453 bp。将两菌株的16S rRNA 基因序列在NCBI数据库中进行Blast同源性比对,LH43菌株与北极假单胞菌属细菌Pseudoalteromonas arctica的一致性为99%,且二者的16S rRNA基因序列自然聚为一支,亲缘关系较近(图2)。LQ2菌株与嗜冷杆菌属细菌Psychrobacter aquimaris的一致性为100%,且二者的16S rRNA 基因序列自然聚为一支,亲缘关系较近(图3)。

图2 LH43菌株的系统发育分析
Fig.2 Analysis of phylogenetic tree of strain LH43

图3 LQ2菌株的系统发育分析
Fig.3 Analysis of phylogenetic tree of strain LQ2
2.4 菌种分类地位
综合菌落形态、生理生化结果在伯杰细菌手册(第八版)中比对结果及 16S rRNA 基因序列分子系统发育分析结果,可确定LH43菌株为北极假交替单胞菌Pseudoalteromonas arctica,LQ2菌株为嗜冷杆菌属细菌 Psychrobacter aquimaris。
2.5 菌株生长与产酶特性分析
将两菌株于不同温度下培养48 h,发现LH43和LQ2菌株最适生长温度为5~10 ℃,胞外产物褐藻酸裂解酶活力最高为15 ℃(图4、图5)。
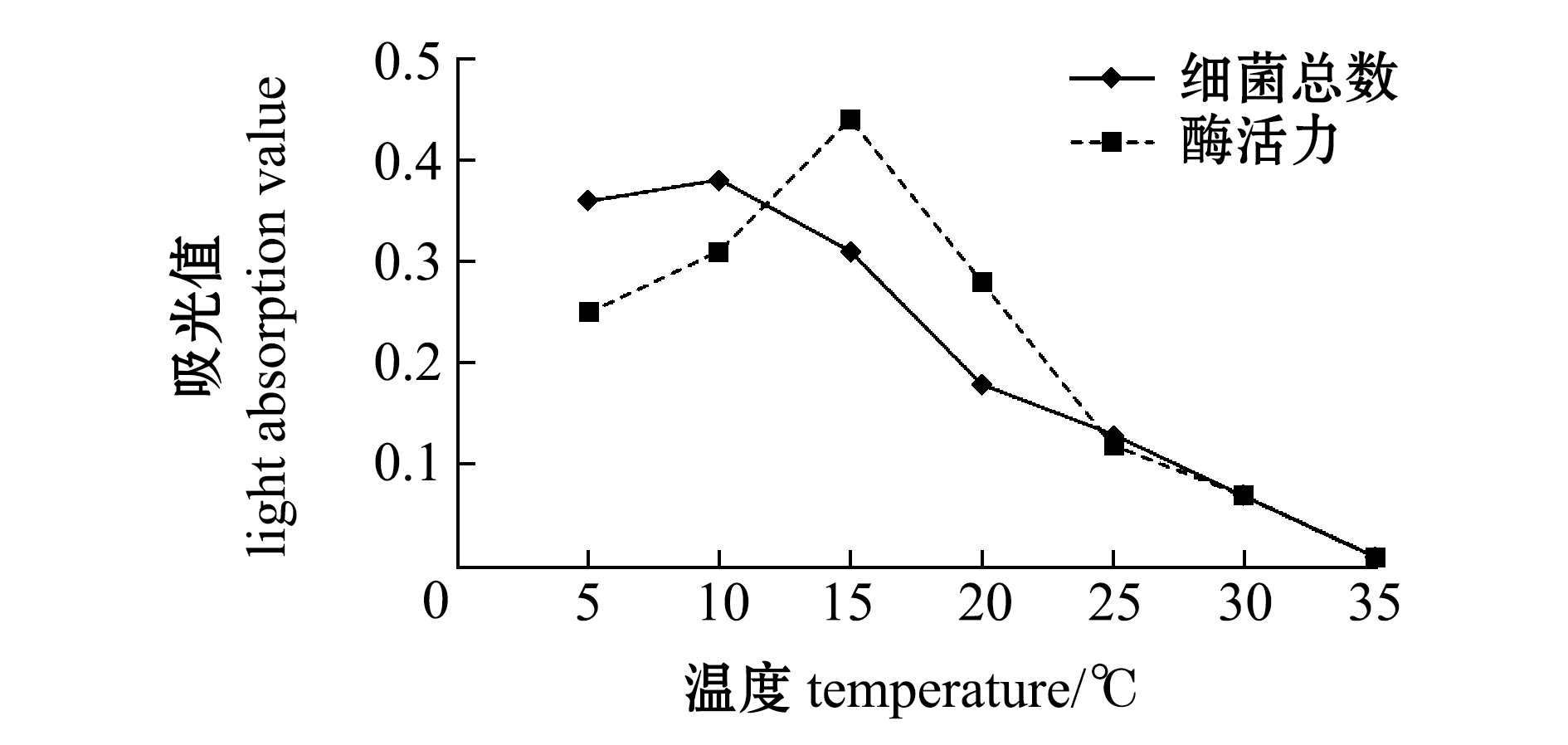
图4 温度对LH43菌株生长及酶活力的影响
Fig.4 Effects of temperature on the growth and enzyme activity of strain LH43

图5 温度对LQ2菌株生长及酶活力的影响
Fig.5 Effects of temperature on the growth and enzyme activity of strain LQ2
2.6 药物敏感特性
从表2可见:LH43菌株对庆大霉素、卡那霉素、氟罗沙星及链霉素高度敏感,对阿奇霉素、克拉霉素、诺氟沙星、多黏菌素B和左氧氟沙星中度敏感,对氨苄西林、青霉素、四环素、头孢唑林和头孢氨苄不敏感;LQ2菌株对庆大霉素、卡那霉素、青霉素、阿奇霉素高度敏感,对克拉霉素、多黏菌素B、诺氟沙星和氟罗沙星中度敏感,对氨苄西林、链霉素、四环素、左氧氟沙星、头孢唑林和头孢氨苄不敏感。
表2 14种抗生素药敏试验结果
Tab.2 Results of 14 antibiotic susceptibility tests

药物drug剂量 /(μg·片-1)dose敏感度sensitivityLH43LQ2氨苄西林 ampicillin10RR青霉素G penicillin G10 URS庆大霉素 gentamycin10SS卡那霉素 kanamycin30SS链霉素 streptomycin10SR四环素 tetracycline30RR阿奇霉素 azithromycin30MS克拉霉素 clarithromycin15MM多黏菌素B polymyxin B300 UMM头孢唑啉 cefazolin30RR诺氟沙星 norfloxacin10MM氟罗沙星 fleroxacin5SM左氧氟沙星 levofloxacin5MR头孢氨苄 cefalexin30RR
注: S—高度敏感; M—中度敏感; R—不敏感。
Note: S—high sensitive; M—medium sensitive; R—resistant.
3 讨论
3.1 菌株的鉴定
本试验中,从大连市龙王塘和铁山增养殖海域发生溃烂病的浮筏养殖裙带菜中分离到在褐藻酸钠固体选择性培养基优势生长的细菌,通过形态观察与生理生化反应及16S rRNA序列在 NCBI比对结果等,确定LH43菌株为北极假交替单胞菌Pseudoalteromonas arctica,LQ2菌株为嗜冷杆菌Psychrobacter aquimaris。
3.2 菌株的致病性
假交替单胞菌为革兰氏阴性杆菌,严格需氧,生长需要Na+,该菌株可见于海水、沉积物、海冰、海藻及海洋无脊椎动物[15]。 近年来,已有假交替单胞菌属某些种可引起水生生物感染发病的报道,闫咏等[7]报道,柠檬假交替单胞菌Pseudoalteromonas citrea可引起条斑紫菜发生绿斑病;陈丽等[16]报道,假交替单胞菌 Pseudoalteromonas sp.也可引起紫菜褐斑病。嗜冷杆菌属为革兰氏阴性杆菌或球菌,能够在5 ℃以下生长,一般在35~37 ℃不能生长[9]。嗜冷杆菌广泛存在于海洋环境中,陈騳等[17]报道,嗜冷杆菌属细菌也可引起紫菜褐斑病。北极假交替单胞菌和嗜冷杆菌广泛存在于海洋环境中,是海洋中极常见和重要的细菌,也是藻体上的主要附生细菌。北极假交替单胞菌和嗜冷杆菌是条件致病菌,在海带、裙带菜、鱼类、贝类等海洋生物体内均有分布,其营养要求低,能产生内毒素、脂酶、蛋白酶等许多与致病性有关的物质[16,18]。正常情况下,由于藻体保持着较高的抗感染能力,在藻—菌间形成一种动态平衡关系,这时并不能引发疾病。但是,当养殖水体恶化、水温过高、养殖密度过大或出现机械损伤时,随着藻体抵抗力下降,菌体易于侵入,在胞外产物褐藻酸裂解酶的作用下导致病害发生[17]。
北极假交替单胞菌和嗜冷杆菌均能够利用褐藻酸钠产生褐藻酸酶,分解裙带菜体内的褐藻酸;人工感染试验结果也初步表明,上述分离的两株菌均能够使健康裙带菜出现溃烂。Yumoto 等[19]认为,褐藻酸降解Alteromonas sp.可引起海带溃烂病;丁美丽[20]用能够降解褐藻酸的菌接种于健康海带表面,发现其侵入海带表面的分生组织,然后进入外皮层、内皮层和髓部,导致细胞游离,部分游离细胞的细胞壁破损,在破损细胞的周围布满了细菌。本研究中分离的两菌株,北极假交替单胞菌和嗜冷杆菌最适生长温度为5~10 ℃,两种菌代谢产生的胞外产物褐藻酸裂解酶在15 ℃时酶活力最高。在发生溃烂病的时候,养殖海域监测水温为13.4 ℃,这与本研究中褐藻酸裂解酶活力最高温度极为接近。初步推测在水温低于10 ℃时,北极假交替单胞菌和嗜冷杆菌大量繁殖,随着海区水温的慢慢升高,细菌代谢产生的褐藻酸裂解酶活力逐渐增强,从而导致裙带菜溃烂发生,这与Lee等[21]的研究结果相似。因此,笔者认为裙带菜溃烂病的发生与北极假交替单胞菌和嗜冷杆菌具有较强相关性,更详细的研究工作需要进一步开展。
3.3 菌株的耐药性
药敏试验结果显示,LH43菌株对庆大霉素、卡那霉素、氟罗沙星及链霉素高度敏感,LQ2菌株对庆大霉素、卡那霉素、青霉素、阿奇霉素高度敏感,虽然在海区养殖过程中用药可行性极低,但该试验结果可以作为北极假交替单胞菌和嗜冷杆菌引起的裙带菜病害和裙带菜幼苗期管理的参考资料。
4 结论
1) 初步确定裙带菜溃烂病的发生与北极假交替单胞菌和嗜冷杆菌具有较强相关性。北极假交替单胞菌和嗜冷杆菌能在褐藻酸钠固体选择性培养基生长,均为革兰氏阴性菌,两菌株最适生长温度为5~10 ℃,两菌株代谢产生的胞外产物褐藻酸裂解酶在15 ℃时酶活力最高。
2) LH43菌株对庆大霉素、卡那霉素、氟罗沙星及链霉素高度敏感,LQ2菌株对庆大霉素、卡那霉素、青霉素、阿奇霉素高度敏感。
[1] 殷旭旺,李文香,白海锋,等.不同海藻饲料对刺参幼参生长的影响[J].大连海洋大学学报,2015,30(3):276-280.
[2] 李丹彤,张静,陈国栋,等.裙带菜凝集素对日本对虾非特异性免疫因子的影响[J].大连水产学院学报,2009,24(3):274-278.
[3] 王亚芳,汪秋宽,何云海,等.褐藻多糖硫酸酯与山楂提取物混合剂的降血脂作用[J].大连海洋大学学报,2015,30(3):309-313.
[4] 马悦欣,张泽宇,刘长发,等.大连地区裙带菜绿烂病病原的研究[J].中国水产科学,1997,4(5):66-69.
[5] 马悦欣,张泽宇,范春江,等.大连地区裙带菜斑点烂病病原菌的研究[J].中国水产科学,1997,4(3):62-65.
[6] 姜静颖,马悦欣,张泽宇,等.大连地区裙带菜“绿烂病”组织病理的研究[J].大连水产学院学报,1997,12(3):7-12.
[7] 闫咏,马家海,许璞,等.1株引起条斑紫菜绿斑病的柠檬假交替单胞菌[J].中国水产科学,2002,9(4):353-358.
[8] HOLT J G,KRIEG N R,SNEATH P H A,et al.Bergey’s manual of determinative bacteriology[M].9th ed.London:Williams and Wilkins,Baltimore,1994:190-191,253.
[9] KRIEG N R,HOLT J G.Bergey’s manual of systematic bacteriology:volume 1[M].London:Williams and Wilkins,Baltimore,1984:467-478.
[10] 张晓君,秦国民,陈翠珍,等.龙胆石斑鱼源美人鱼发光杆菌的生物学特性与系统发育学分析[J].渔业科学进展,2009,30(3):38-43.
[11] POLZ M F,CAVANAUGH C M.Bias in template-to-product ratios in multitemplate PCR[J].Applied and Environmental Microbiology,1998,64(10):3724-3730.
[12] 陈洪基,姜国良,闫广思.一株褐藻酸裂解酶高产菌的筛选及其酶学性质研究[J].中国酿造,2016,35(5):25-30.
[13] WIKLER M A.Performance standards for antimicrobial susceptibility testing[M].Clinical Laboratory Standards Institute,2009.
[14] 杨帆,李淑梅,杨晓,等.分光光度法与酶标仪微量法测量菌液浓度的比较[J].光谱实验室,2011,28(4):1752-1754.
[15] BRENNER D J,KRIEG N R,STALEY J T.Bergey’s Manual of Systematic Bacteriology[M].2nd ed.New York:Springer,2005:467-468.
[16] 陈丽,张晓君,秦蕾,等.条斑紫菜褐斑病原褐藻酸降解菌的筛选与鉴定[J].湖北农业科学,2012,51(13):2728-2731.
[17] 陈騳,林光恒,沈世泽.褐藻酸降解菌的研究Ⅱ.海带夏苗培育中褐藻酸降解菌与烂苗的关系[J].海洋与湖沼,1981,12(2):133-137.
[18] 陈丽,白雪松,张晓君,等.条斑紫菜褐斑病病原嗜冷杆菌的生物学特性[J].江苏农业科学,2012,40(8):234-236.
[19] YUMOTO I,YAMAGUCHI K,YAMADA K,et al.Relationship between bacterial flora and occurrence of the Alteromonas sp.,the causative agent of red-spots on the culture bed of makonbu Laminaria japonica,in the coastal area of Funka Bay[J].Nippon Suisan Gakkaishi,1989,55(11):1907-1914.
[20] 丁美丽.环境因子对褐藻酸降解菌引起海带病烂影响研究[J].海洋学报,1990,12(2):224-230.
[21] LEE Y K,JUNG H J,LEE H K.Marine bacteria associated with the Korean brown alga,Undaria pinnatifida[J].Journal of Microbiology,2006,44(6):694-698.