微小RNA(microRNA,以下简写为miRNA)是内源性的约22个核苷酸的RNA,主要通过结合靶基因的3′非翻译区(3′UTR)来抑制靶基因的翻译或导致mRNA降解,从而抑制靶基因的表达,在动植物mRNA转录水平中发挥着重要的调节作用[1]。近年来,已有不少关于miRNA对血细胞生成调控的研究报道,多种miRNAs是血细胞分化的关键调节因子,在造血中起重要作用。如miR-144和miR-451在红细胞生成中发挥重要作用,受GATA-1转录因子调节并最终影响红细胞的生成,在GATA-1敲除的鼠细胞中,miR-144和miR-451的过表达,均未能恢复GATA-1缺失的影响[2]。miR-221和miR-222抑制正常的血红细胞生成,在成熟过程中导致早期成红细胞表达下降[3]。众多研究表明,造血系统的正常生成在很大程度上依赖转录水平的调节;在血红细胞生成过程中,转录因子经历了一系列的动态变化,影响着细胞的增殖和发育成熟[4-7]。其中ALAS2(delta-aminolevulinate synthase 2)是血红细胞生成过程中最重要的一个转录因子,ALAS2基因的生成是催化红细胞中血红素生物合成的限速步骤[8]。
本实验室前期研究发现,生长于高海拔的青藏高原裂腹鱼与低海拔的裂腹鱼相比,其血红细胞数量、血红蛋白含量均明显下降[9],且高海拔裂腹鱼血液组织中有众多高表达的miRNAs(数据未发表),这些高表达的miRNAs可能抑制着高海拔裂腹鱼血红细胞的生成。在高海拔裂腹鱼血液组织高表达的miRNAs中,miR-30e是呈现显著高表达的一个miRNA(数据未发表),推测miR-30e可能在抑制高原裂腹鱼血红细胞生成中起着重要作用。在此基础上,本试验中以斑马鱼Danio rerio为研究对象,利用显微注射、靶基因验证等试验方法,研究了miR-30e在斑马鱼红细胞生成过程中的作用机制,探索了miR-30e对红细胞生成的调控作用,以期为了解鱼类红细胞的生成机制提供参考。
1 材料与方法
1.1 材料
试验用野生型斑马鱼(AB型)饲养在实验室封闭的水超滤超净化系统中(上海海圣生物实验设备有限公司),培养条件为28 ℃循环水、黑暗10 h、光照14 h,自然产卵后收集所有胚胎。
试验用细胞系293T在含有10%(体积分数)胎牛血清、双抗及Dulbecco改良的Eagle培养基(DMEM)的完全培养液中培养,培养条件为体积分数5%的CO2、温度37 ℃。
1.2 方法
1.2.1 斑马鱼miR-30e靶基因的预测 利用DIANA-dre、TargetScan、miRDB等软件进行miR-30e的靶标预测,根据其结果,ALAS2被预测为miR-30e的潜在靶标。
1.2.2 构建包含ALAS2-3′UTR的质粒 从NCBI数据库获得斑马鱼miR-30e靶基因ALAS2的3′UTR序列。利用反转录获得的cDNA为模板,PCR扩增得到靶基因的3′UTR,并将其连接至PmirGLO(荧光素酶报告基因)和Tol2-EGFP质粒中。PCR反应条件:95 ℃下预变性4 min;95 ℃下变性30 s,56 ℃下退火30 s,72 ℃下延伸1 min,共进行32个循环;最后在72 ℃下再延伸10 min,4 ℃下冷却10 min。PCR所用引物如表1所示。
表1 斑马鱼ALAS2-3′UTR克隆引物序列
Tab.1 Primer sequences used for ALAS2-3′UTR gene cloning in zebrafish

1.2.3 斑马鱼胚胎血红蛋白检测 取性成熟的雌雄斑马鱼交配产生的受精卵,使用显微注射仪将1 nL的miR-30e模拟体(UGUAAACAUCCUUGACUGGAAG)(50 μm)和miRNA模拟体(UU- GUACUACACAAAAGUACUG)(50 μm,NC对照),分别注射到斑马鱼受精卵发育的第一细胞期内,同时以注射1 nL去离子水的胚胎作为空白对照,显微注射48 h后对胚胎进行固蓝染色,观察其血红蛋白含量的变化。首先,用体积分数4%的多聚甲醛来固定注射后的斑马鱼胚胎6 h以上,随后用1×PBS清洗表面杂质,加入适量固蓝染色液,于摇床避光染色20 min,弃去染液并清洗后,于显微镜下观察统计血红蛋白的区域。miR-30e模拟体和miRNA模拟体由苏州吉马公司合成。
1.2.4 斑马鱼胚胎GFP荧光检测 使用显微注射仪将1 nL的miR-30e模拟体(50 μm)和miRNA模拟体(50 μm)(NC对照)分别与100 ng的Tol2-EGFP-ALAS2-3′UTR共注射到斑马鱼受精卵的第一细胞期内,同时以注射1 nL 100 ng的Tol2-EGFP-ALAS2-3′UTR作为空白对照,注射24 h后在荧光显微镜下对胚胎进行观察并检测荧光强度的变化。
1.2.5 双荧光素酶活性检测 用24孔板培养293T细胞,直至细胞密度达到80%,根据Attractene Transfection(QIAGEN)转染试剂提供的说明书,将PmirGLO-ALAS2-3′UTR与miR-30e共转染,同时增设阴性对照(PmirGLO-ALAS2-3′UTR与miRNA共转染)和空白对照(PmirGLO-ALAS2-3′UTR单独转染),每组设3个重复,转染完成并培养24~48 h后,使用Dual-Luciferase试剂盒对细胞进行双荧光素酶活性测定,并计算相对比值。
1.2.6 蛋白质印迹分析 将共注射Tol2-EGFP-ALAS2-3′UTR质粒的3组(空白对照、阴性对照和miR-30e模拟体)斑马鱼胚胎用1×PBS洗涤3次,然后用蛋白酶裂解液在冰上裂解30 min,提取蛋白质。使用10%(质量分数)SDS-聚丙烯酰胺凝胶从每个样品中分离相同量(100 μg)的蛋白质并转移到硝酸纤维素膜上;用1×PBST溶液溶解的5%(质量分数)脱脂牛奶封闭,随后在室温下分别将膜与抗GFP和抗β-肌动蛋白孵育1 h;再用1×PBST洗涤3次,并于室温下与上述二抗一起孵育1 h。使用增强的化学发光蛋白质印迹系统使蛋白质条带可视化,以β-肌动蛋白的蛋白质水平为内源对照。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 17.0软件进行单因素方差分析和t检验,显著性水平设为0.05。
2 结果与分析
2.1 miR-30e靶基因的预测
对miR-30e可能作用的靶基因进行生物学信息预测,结果表明,ALAS2基因的3′UTR区域与miR-30e互补配对,ALAS2基因可能是miR-30e的一个靶基因(图1)。此外,在人类、斑马鱼、黑猩猩、大鼠和三文鱼中,miR-30e相应的种子序列高度保守(黑线标出部分)(表2)。

图1 miR-30e与ALAS2作用原理
Fig.1 Principle of action between miR-30e and ALAS2
表2 miR-30e在物种间的保守性
Tab.2 Conversation of miR-30e among different species

miR-30e序列sequence(5'-3')>dre-miR-30e(斑马鱼Danio rerio)UGUAAACAUCCUUGACUGGAAG>ssa-miR-30e(三文鱼Salmo sal-ar)UGUAAACAUCCUACACUCAGCU>hsa-miR-30e(人类Homo sapiens)UGUAAACAUCCUUGACUGGAAG>ptr-miR-30e(黑猩猩Pan troglo-dytes)UGUAAACAUCCUUGACUGGAAG>rno-miR-30e(大鼠Rattus norveg-icus)UGUAAACAUCCUUGACUGGAAG
2.2 过表达miR-30e对血红蛋白的影响
固蓝染色结果显示,显微注射miR-30e模拟体的斑马鱼胚胎体内血红蛋白含量明显低于注射miRNA模拟体的阴性对照组与注射去离子水的空白对照组(图2,箭头所指的红色区域),说明miR-30e在一定程度上对血红蛋白的表达起到抑制作用。

箭头所指红色区域为固蓝染色后斑马鱼血红蛋白。
The arrow showing the red area indicates the zebrafish hemoglobin stained by O-dianisdine.
图2 血红蛋白表达的固蓝染色检测
Fig.2 Detection of hemoglobin expression by O-dianisdine staining
2.3 miR-30e在体外抑制ALAS2的表达
扩增长度约为500 bp的斑马鱼ALAS2-3′UTR作用位点周边序列(图3),在荧光素酶报告载体PmirGLO中重组了含有ALAS2-3′UTR的质粒。ALAS2-3′UTR位于萤火虫荧光素酶编码区的下游(图1),将重组质粒PmirGLO-ALAS2-3′UTR与miR-30e模拟体共转染293T细胞,与PmirGLO-ALAS2-3′UTR空白对照、miRNA+PmirGLO-ALAS2-3′UTR阴性对照细胞相比,结果发现,用miR-30e模拟体转染的293T细胞中,萤火虫荧光素酶/海肾荧光素酶活性比值显著下调(P<0.05),而阴性对照组与空白对照组无显著性差异(P>0.05)(图4)。
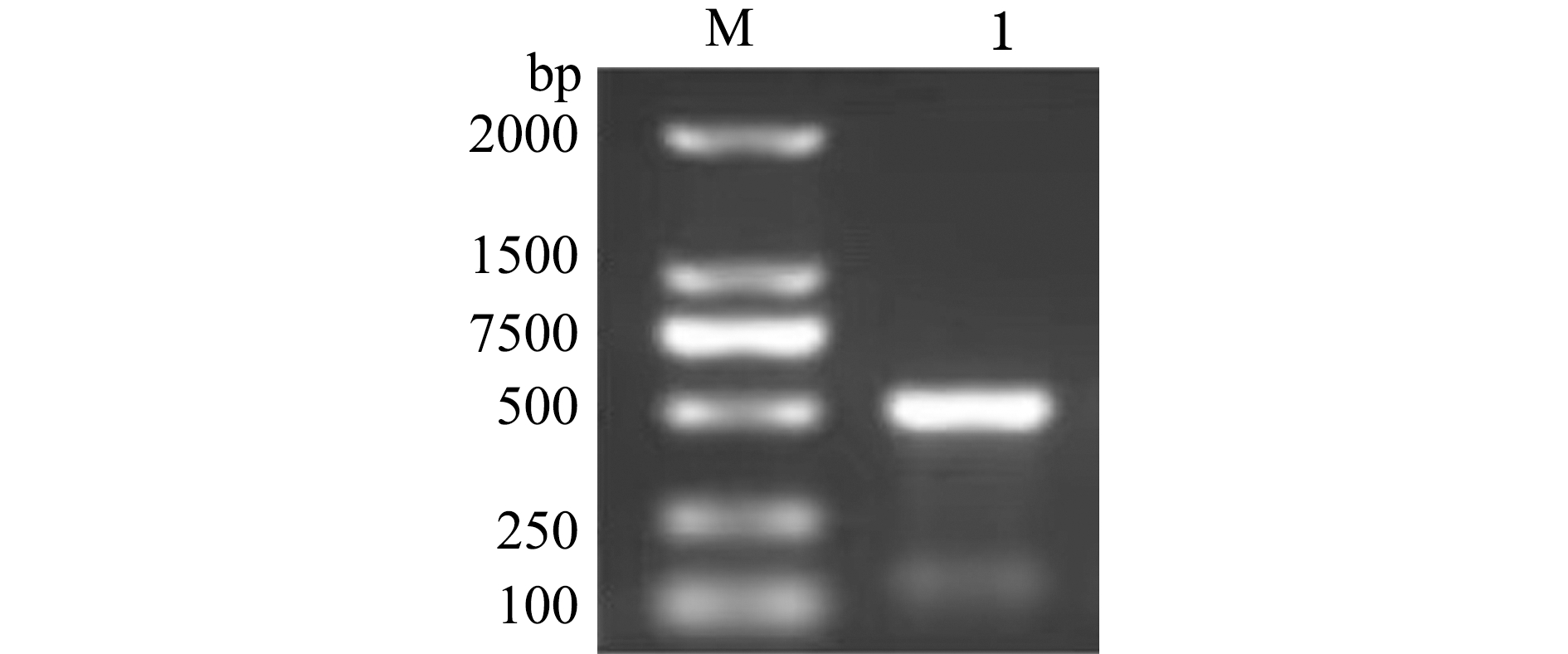
M—DNA2000 Marker;1—miR-30e与ALAS2-3′UTR作用位点的扩增条带。
M—DNA2000 Marker; 1—the amplification of binding site between ALAS2-3′UTR and miR-30e.
图3 斑马鱼ALAS2基因3′UTR扩增
Fig.3 Amplification of the 3′UTR of the ALAS2 gene in zebrafish

*表示对照组与miR-30e试验组存在显著性差异(P<0.05)。
* means significant difference between the control group and the miR-30e experiment group(P<0.05).
图4 双荧光素酶活性的检测
Fig.4 Detection of dual luciferase activity
2.4 miR-30e在体内抑制ALAS2的表达
将重组的Tol2-EGFP质粒与miR-30e模拟体共注射第一细胞期的斑马鱼胚胎,与共注射miRNA模拟体的阴性对照组相比,结果发现,用miR-30e模拟体共注射的胚胎中,GFP荧光强度明显降低(图5),这意味着miR-30e可以靶向作用于ALAS2。同时,提取胚胎总蛋白进行Western blot检测,结果显示,与阴性对照组相比,共注射Tol2-EGFP质粒与miR-30e模拟体的试验组蛋白表达量明显下降(图6)。
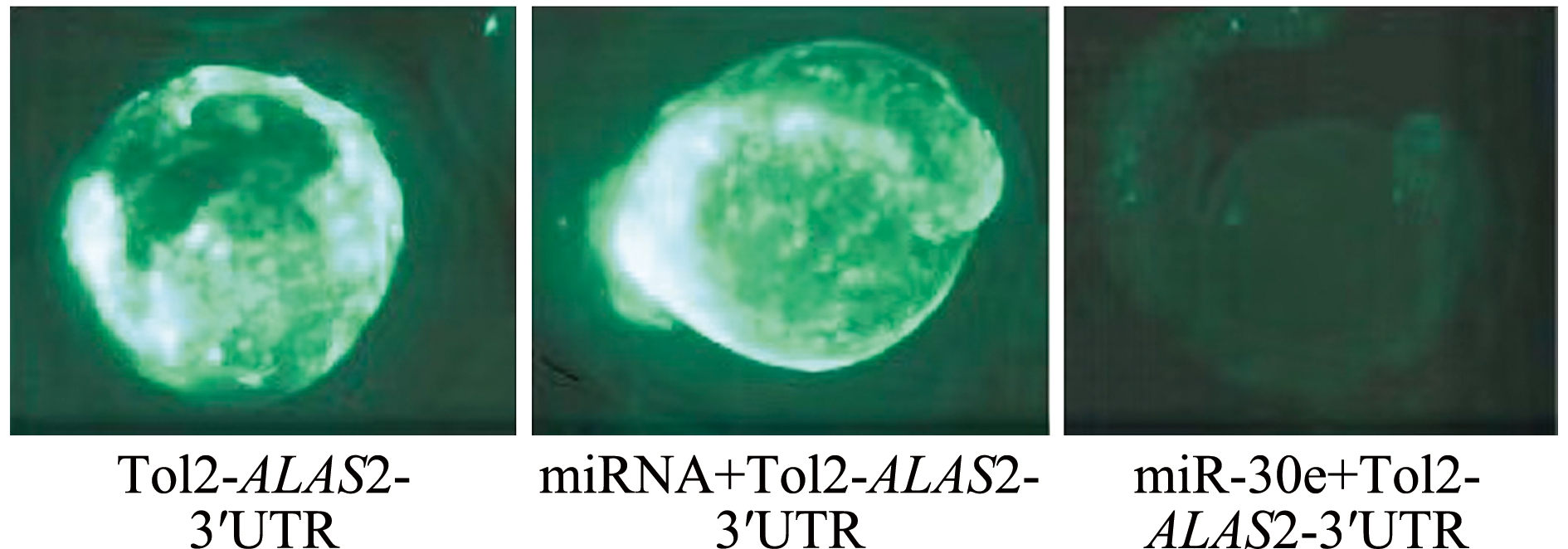
绿色为斑马鱼胚胎注射Tol2质粒后的荧光发光亮度。
the fluorescence intensity of zebrafish embryos injected with Tol2 plasmid is shown in green color.
图5 斑马鱼胚胎的GFP荧光检测
Fig.5 Detection of GFP fluorescence in zebrafish embryos
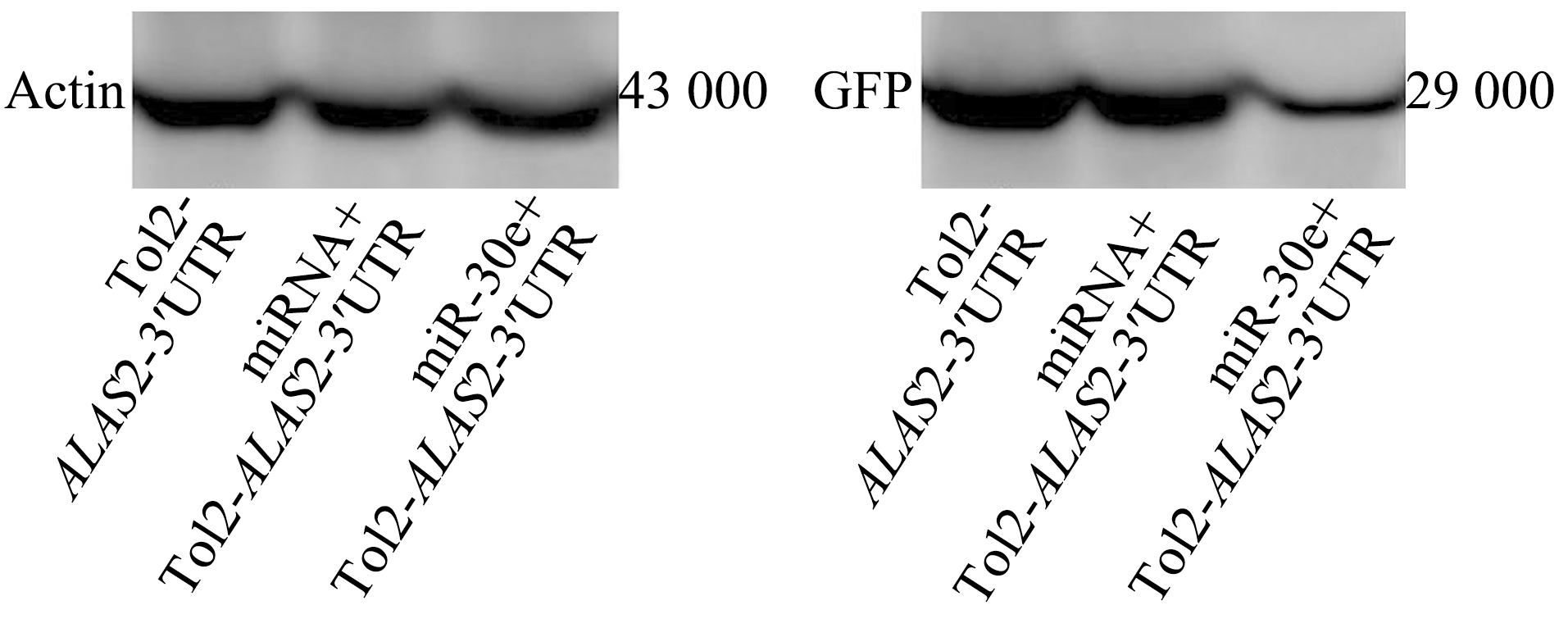
图6 斑马鱼胚胎的GFP蛋白检测
Fig.6 Detection of GFP protein in zebrafish embryos
这些结果表明,miR-30e通过与其在ALAS2-3′UTR处的结合位点相互作用,来抑制ALAS2的表达,同时也表明,miR-30e对ALAS2的表达具有负调控作用。
3 讨论
3.1 miR-30e的作用机制
本实验室前期研究发现,长期处于高海拔低氧环境下的青藏高原裂腹鱼的血红蛋白与血细胞数量比低海拔裂腹鱼明显减少[9],且对不同海拔高度裂腹鱼血液组织中的miRNA比较发现,miR-30e在高海拔裂腹鱼血液组织中呈现显著高表达。本研究中以此为切入点,合成了miRNA-30e模拟体,运用显微注射仪注射到斑马鱼胚胎第一细胞期内,固蓝染色发现,斑马鱼血红蛋白含量明显下降(图2),这说明miRNA-30e抑制了红细胞的生成。
目前,关于miRNA对红细胞生成的影响已有不少研究报道,迄今未见miR-30e影响血红细胞生成的相关研究。关于miR-30e在心血管发育方面的研究也仅有零星报道。有研究已报道了miRNA-30e在动脉粥样硬化中的作用及存在的潜在机制,即miRNA-30e的下调增加了体外氧化应激和活性氧水平,通过转化生长因子介导NADPH氧化酶4氧化应激调节动脉粥样硬化[10]。miRNA-30e通过自噬和神经源性基因座缺口同源蛋白-1/磷酸化蛋白激酶B信号传导途径保护心脏免于缺血/再灌注损伤,miR-30e还可以通过抑制细胞骨架调控蛋白(Twinfilin-1)的表达来调控心肌肥厚增生[11]。还有研究显示,miR-30e在血管发育中也发挥重要的调控作用[12]。
在此之前,尚未有关于miR-30e对红细胞生成作用的研究报道。在后续研究中,作者拟对miR-30e进行体内敲除,更好地研究miR-30e对红细胞生成的作用机制。
3.2 miR-30e的靶基因ALAS2
本研究中,通过分子生物学方法探究了miRNA-30e对红细胞生成的作用,生物信息学分析表明,miR-30e靶向结合ALAS2的3′UTR,使用斑马鱼模型进行体内验证试验,结合体外的细胞共转染等试验,一系列试验结果表明,miRNA-30e的过表达抑制了ALAS2基因的表达,从而导致红细胞的生成受阻,进一步证明了miRNA对红系发育的调控作用。
众所周知,造血是一个涉及复杂遗传程序的发育过程,它产生一种称为红细胞的主要细胞谱系,通常发生在硬骨鱼的肾髓中[13]。研究表明,红细胞的生成受许多转录因子的调节,这些转录因子的调节作用是不同的[14]。其中ALAS2作为特异调节红系发育的限速酶,在红系祖细胞中表达并调节血红素的生物合成[15],其已经被确认为是多个miRNA的靶基因,这些miRNA通过靶向ALAS2基因来调控红系细胞的生成。胡星星等[16]研究发现,miR-7132通过靶向ALAS2参与南极冰鱼红细胞生成过程;Xu等[17]研究发现,缺乏血红细胞的南极冰鱼高表达的miRNA中,靶基因预测显示,共有91种miRNA靶向红细胞的调节因子,其中ALAS2可能受最大数量的miRNAs调控[17]。由此可见,ALAS2在红系中的重要性。
4 结论
1) 本研究中利用生物信息软件预测ALAS2是斑马鱼miR-30e的一个靶基因。
2) 本研究结合细胞转染技术、荧光素酶报告系统、胚胎显微注射等试验方法综合验证了miR-30e通过靶向作用于ALAS2的3′UTR序列,抑制ALAS2表达,从而参与斑马鱼红细胞生成的过程。
[1] DE JONG J L O,ZON L I.Use of the zebrafish system to study primitive and definitive hematopoiesis[J].Annual Review of Genetics,2005,39:481-501.
[2] DORE L C,AMIGO J D,DOS SANTOS C O,et al.A GATA-1-regulated microRNA locus essential for erythropoiesis[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(9):3333-3338.
[3] FELLI N,FONTANA L,PELOSI E,et al.MicroRNAs 221 and 222 inhibit normal erythropoiesis and erythroleukemic cell growth via kit receptor down-modulation[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(50):18081-18086.
[4] CANTOR A B,ORKIN S H.Transcriptional regulation of erythropoiesis:an affair involving multiple partners[J].Oncogene,2002,21(21):3368-3376.
[5] FRIEDMAN A D.Transcriptional regulation of granulocyte and monocyte development[J].Oncogene,2002,21(21):3377-3390.
[6] ZHU J,EMERSON S G.Hematopoietic cytokines,transcription factors and lineage commitment[J].Oncogene,2002,21(21):3295-3313.
[7] YE M,GRAF T.Early decisions in lymphoid development[J].Current Opinion in Immunology,2007,19(2):123-128.
[8] LOSS H,COX T C,BOTTOMLEY S S,et al.X-linked pyridoxine-responsive sideroblastic anemia due to a Thr388-to-Ser substitution in erythroid 5-aminolevulinate synthase[J].N Engl J Med,1994,330(10):709-711.
[9] XU Q H,ZHANG C,ZHANG D S,et al.Analysis of the erythropoietin of a Tibetan Plateau schizothoracine fish (Gymnocypris dobula) reveals enhanced cytoprotection function in hypoxic environments[J].BMC Evolutionary Biology,2016,16:11.
[10] CHENG Y,ZHOU M L,ZHOU W J.MicroRNA-30e regulates TGF-β-mediated NADPH oxidase 4-dependent oxidative stress by Snai1 in atherosclerosis[J].International Journal of Molecular Medicine,2019,43(4):1806-1816.
[11] 李青,胡斌,牛鑫,等.MiR-30e调控心肌肥厚的作用机制研究[J].现代生物医学进展,2013,13(20):3804-3806,3813.
[12] BRIDGE G,MONTEIRO R,HENDERSON S,et al.The microRNA-30 family targets DLL4 to modulate endothelial cell behavior during angiogenesis[J].Blood,2012,120(25):5063-5072.
[13] AL-ADHAMI M A,KUNZ Y W.Ontogenesis of haematopoietic sites in brachy Danio rerio (Hamilton-buchanan) (Teleostei)[J].Development,Growth & Differentiation,1977,19(2):171-179.
[14] SHIVDASANI R A,ORKIN S H.The transcriptional control of hematopoiesis[J].Blood,1996,87(10):4025-4039.
[15] FUJIWARA T,HARIGAE H.Biology of heme in mammalian erythroid cells and related disorders[J].Biomed Research International,2015.doi:10.1155/2015/278536.
[16] 胡星星,王丛丛,产久林,等.南极独角雪冰鱼(Chionodraco hamatus)miR-7132对红细胞发生的作用研究[J].海洋与湖沼,2016,47(3):587-593.
[17] XU Q H,CAI C,HU X X,et al.Evolutionary suppression of erythropoiesis via the modulation of TGF-β signalling in an Antarctic icefish[J].Molecular Ecology,2015,24(18):4664-4678.