北方须鳅Barbatula barbatula nuda,俗称花泥鳅、北方条鳅等,隶属于鲤形目Cypriniformes鳅科Cobitidae条鳅亚科Nemachilinae须鳅属Barbatula,在中国东北主要分布于鸭绿江、辽河、黑龙江上中游、乌苏里江、松花江、嫩江、牡丹江、绥芬河、图们江等水系。北方须鳅为山区溪流性小型鱼类,杂食性,适应性强,因其肉质细嫩鲜美,深受消费者喜爱[1]。在辽宁东部山区,商品鱼可达60~120元/kg,经济价值较高,市场供不应求。然而,近年来,北方须鳅因过度捕捞导致其自然资源量急剧下降,为保护其物种资源和发展山区特色经济,开展北方须鳅的规模化人工繁殖和增殖放流工作迫在眉睫。
目前,北方须鳅生物学特性已有研究[2-7],其苗种生长最适蛋白质需求为40.72%[8],且室内小水体养殖试验获得初步成功[9],然而人工繁殖技术尚未见报道。经作者不断探索,2015年北方须鳅繁殖初试获得成功,2019年其规模化人工繁殖获得成功,这为北方须鳅产业化发展奠定了坚实的基础。本研究中,报道了北方须鳅人工繁殖与胚胎发育研究成果,旨在为其规模化人工增养殖技术提供指导。
1 材料与方法
1.1 材料
试验用北方须鳅亲鱼,一部分购自本溪县小市镇野生鱼交易市场,另一部分于太子河捕捞获得,雌鱼体质量为8.0~25.0 g,雄鱼体质量为4.0~20.0 g。亲鱼运回后于养殖场车间室内暂养池暂养,暂养池规格为4.0 m×4.0 m×1.5 m,水深保持在0.8 m左右,用10 mg/L高锰酸钾药浴约15 min。
于2015年3—4月在辽宁省新宾满族自治县平顶山镇渔场进行人工繁殖初试;于2016年3月—2019年4月在辽宁省桓仁满族自治县木盂子镇渔场进行北方须鳅人工繁殖中试。
1.2 方法
1.2.1 雌雄鉴定及性成熟度鉴别 非生殖季节北方须鳅雌雄鱼不易鉴别。生殖季节,雌鱼个体明显大于雄鱼,腹部膨大柔软,花纹不明显,且生殖孔为水滴状,红肿外凸。卵巢发育成熟时,腹部膨大、饱满,腹部形态类似泥鳅[10-11],部分鱼腹部透明,似有“透明窗”,能清晰观察到卵巢内卵粒,轻微挤压即有卵粒淌出;而雄鱼腹部细长,有条纹状纹路,生殖季节触摸皮肤有粗糙感,生殖孔向内凹陷,呈箭头状,性成熟个体挤压腹部有少量白色精液流出(图1)。
1.2.2 催产药物和适宜雌雄比例 催产药物使用促黄体素释放激素类似物2号(LHRH-A2)等混合催产药物,用1 mL医用注射器于背鳍基部肌肉一次注射,雄鱼剂量为雌鱼的1/2,每尾鱼注射药量为0.1~0.2 mL。为确定其最佳雌雄配比,设置5组梯度试验,每组雌鱼100尾,雄鱼以10尾为基准递增至50尾(即雌鱼与雄鱼的比例为100∶50、100∶40、100∶30、100∶20、100∶10),每组设3个重复。
1.2.3 人工催情自然产卵试验 在水族箱(1.0 m×0.5 m×0.4 m)中进行人工催产,产卵附着物设3类。其中,A组参照鲤Cyprinus carpio催产方式[10],水族箱中悬挂棕榈鱼巢,B组水族箱底部放置小石头,C组水族箱底部放置河道细沙粒。每个水族箱放置已注射催产药物的亲鱼30组,每组两个重复。保持水温为14~18 ℃,气泵充气增氧,溶氧为6 mg/L以上。同时进行繁殖适温试验,水温9~21 ℃,设置7个梯度,每组间隔0.5 ℃,催产30组。出现交配现象时,通过压挤腹部产卵的方式,统计每组雌鱼成熟的数量。
1.2.4 人工授精 采用干法受精,至效应期,轻压腹部检查雌鱼,如雌鱼卵顺利外流,即可进行人工授精。 为了方便操作,使用麻醉药物乙二醇苯醚进行试验效果对比,体积分数为0.1~0.2 mL/L。将雄鱼解剖取出精巢,用0.75 mm的筛绢网布挤压过滤,获得精液,置于4 ℃冰壶内备用。卵粒收集完后,加入精液和少许质量分数为0.7%的生理盐水搅拌,使精卵充分混合。加入与孵化温度相同的清水,继续搅拌约5 min后,倒掉多余的体腔液和精液,再漂洗2~3次,完成授精,进行脱黏或不脱黏孵化。
1.2.5 孵化
1)鱼巢孵化。用棕榈鱼巢或0.83 mm的筛绢网布接卵,悬挂于室外水泥池中,静水充氧,溶解氧始终保持在6 mg/L以上,每2 d换新水一次,每次换水1/3,直至破膜。
2)脱黏孵化。采用黄泥浆脱黏。受精卵置于锥形筛绢(0.245 mm)孵化篓内,孵化篓上端直径为60 cm,高为20 cm,下部高为80 cm,最底部直径为5 cm,底部包裹气石,孵化过程中气量大小以卵粒全部翻滚无死角为宜。每篓放卵25~30万粒,在孵化过程中每隔0.5 h观察一次箱体网眼通透情况,及时换箱或刷箱,保持水质清洁。遇有箱内鱼卵水霉严重时,将卵倒出重新漂洗,直至清理完毕,孵化期间水温保持在8.5~25 ℃。
3)胚胎发育观察。采用奥林巴斯CX21型号显微镜在 4×10倍镜下观察。
4)适时下池(塘)。仔鱼孵出3 d后,部分鱼苗依附在筛绢网上,鱼苗体色由透明逐渐变成灰黑色,当卵黄囊吸收一半以上,鳔充气,消化道贯通,即可下池(塘)。
1.2.6 孵化效率评价
催产率:产卵鱼数占催情鱼总数的百分比。
受精率:原肠中期活卵数占产卵总数的百分比。
孵化率:鱼苗水花数占受精卵总数的百分比。
2 结果与分析
2.1 北方须鳅人工催情自然产卵结果
注射催产药物后,至效应时间,采用人工催产自然产卵试验, A、B、C组水族箱中棕榈鱼巢、石头及沙子上均未见北方须鳅鱼卵,说明该方法不适宜北方须鳅人工繁殖接卵。
2.2 北方须鳅卵及鱼苗的生物学特性
采用催情后人工授精的方法,北方须鳅亲本在17~22 ℃水温下,23~26 h到达效应时间。未受精的成熟卵为圆球形、浅黄色、具有弹性,卵径为(2.15±0.07)mm,卵膜厚且坚韧,不透明;解剖取出精巢,研磨过滤后获得精液,精液入水即散,镜检可见大量快速游动精子。
干法受精后,受精卵遇水产生黏性,卵膜吸水,卵周隙明显扩大,卵径可达(2.35±0.05)mm。北方须鳅产卵最低水温为8.5 ℃,从卵受精到仔鱼孵出需积温66.67 ℃·d,至仔鱼平游需积温126.5 ℃·d。水温为8~24 ℃,经98 h 54 min孵出,初孵仔鱼全长为(4.9±0.8)mm,体质量为(0.6±0.1)mg,全身透明,仔鱼卵黄囊大、侧卧水底、少游动,随着卵黄囊的吸收,身体渐长,活动能力加强,开始间歇在水体中下层活动,受到外界惊扰时,能迅速游开。


图1 北方须鳅雌雄鉴别
Fig.1 Gender discriminaion of loach Barbatula barbatula nuda
2.3 人工授精适宜雌雄比例
从图2可见:不同雌雄比例情况下北方须鳅受精率存在显著性差异(P<0.05);随着雄鱼数量的增加,其受精率逐渐升高,当雄鱼数量低于40尾时,受精率随着雄鱼数量的递增而显著增加(P<0.05),而超过50尾后,其受精率无显著性差异(P>0.05)。这表明,北方须鳅雌雄比例为2∶1时,受精率最高。
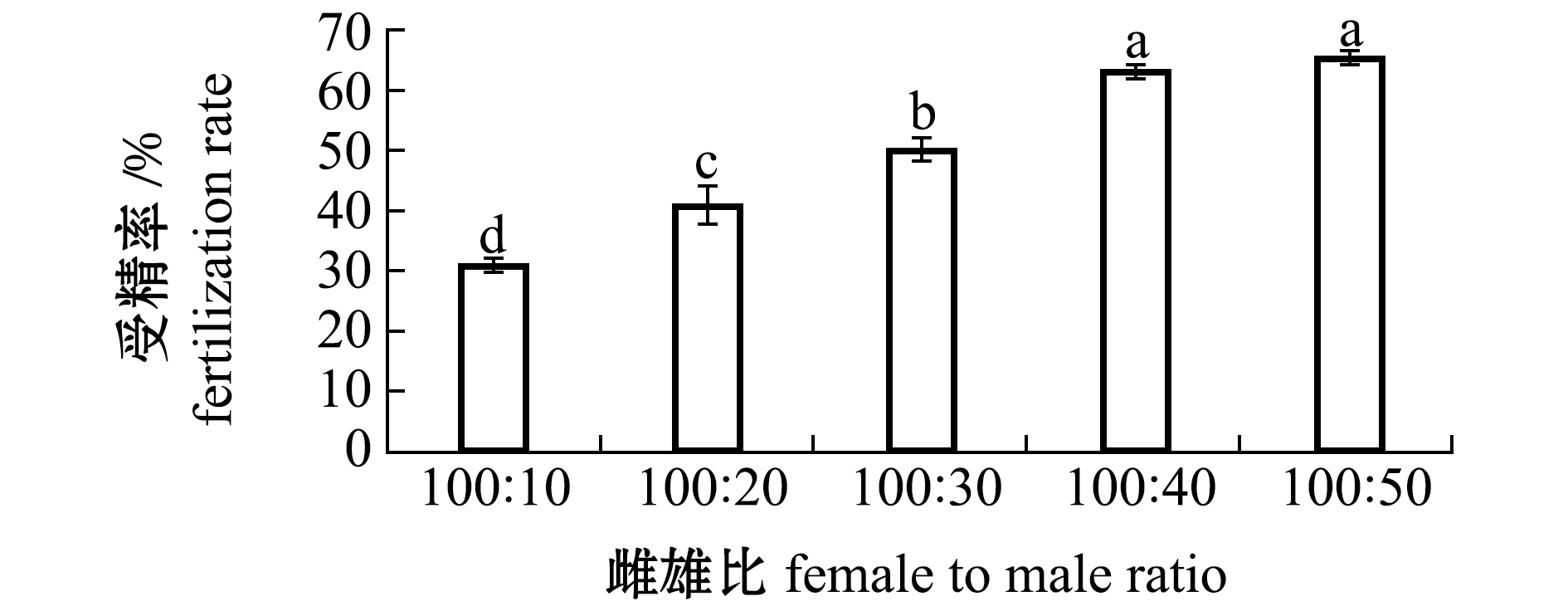
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
图2 雌雄比例对受精率的影响
Fig.2 Effects of female to male ratio on fertilization rate
2.4 水温对雌亲鱼成熟的影响
从图3可见,注射催产药物23 h后,随着水温从9 ℃升至17 ℃,顺利挤出成熟卵粒的雌鱼数量显著增加(P<0.05),水温17 ℃时,亲鱼性腺成熟数量达到峰值,继续升高水温,成熟鱼数量趋于稳定。因此,升温至17 ℃有利于亲鱼集中产卵,此为提高催产效率的有效途径。

图3 注射催产药物后水温对雌鱼性腺成熟的影响
Fig.3 Effects of water temperature on ovary maturity after hormone injection
2.5 北方须鳅人工繁殖试验
2.5.1 北方须鳅人工繁殖初试 于2015年3月28日至4月17日在辽宁新宾平顶山镇进行了3批次北方须鳅人工繁殖试验。从表1可见:共催产雌亲鱼630组,平均催产率为80.8%,平均受精率为84.7%,平均孵化率为51.1%,获卵68.4万粒,获仔鱼35.2万尾;在水温16~20 ℃条件下,一次注射,效应时间为23~26 h,可在室外水泥池内挂巢孵化,但孵化率均不超过40%,且孵化期较长,均达384 h以上,而室内孵化篓孵化,孵化率达88.5%,孵化期可缩短至98 h。
表1 2015年新宾满族自治县平顶山镇渔场北方须鳅繁殖初试
Tab.1 Preliminary test of artificial propagation of loach Barbatula barbatula nuda in Pingdingshan town fish farm in Xinbin Manchu Autonomous County in 2015

方式method指标index催产批次induced spawning batch1雌雄比 female to male ratio 10∶52雌雄比 female to male ratio 370∶1003雌雄比 female to male ratio 250∶150催产日期2015-03-282015-04-092015-04-17催产水温/℃16~1816~1818~20催产药物混合催产药物混合催产药物混合催产药物催产spawn induced by hormone injection注射次数一次注射一次注射一次注射效应时间/h262423产卵方式人工授精人工授精人工授精产卵/万粒2.136.529.8催产率/%85.070.087.5受精率/%867890孵化水温/℃3~154~198~24孵化方式室外水泥池挂巢孵化室外水泥池挂巢孵化室内孵化篓脱黏孵化孵化incubation孵化率/%26.538.588.5孵化期/h48038498出苗数/万尾0.4811.0023.70
2.5.2 北方须鳅繁殖中试 于2016—2019年在辽宁省桓仁满族自治县进行北方须鳅繁殖中试。从表2可见,中试共催产北方须鳅雌亲鱼55 000组,获卵5 960万粒,平均催产率为45.0%,平均受精率为56.0%,平均孵化率42.7%,获水花1 840.3万尾,其中2016年孵化受采用自然水温(8~15 ℃)的影响,孵化率仅为35%,低于2017—2019年孵化率(人工控制水温18~22 ℃)40%~55%,2017—2018年受麻醉药物的影响,人工授精的受精率低于30%,远低于2016、2019年的80%、85%。
表2 2016—2019年桓仁满族自治县木盂子镇渔场北方须鳅繁殖中试
Tab.2 Pilot test of artificial propagation of loach Barbatula barbatula nuda in Muyuzi town fish farm in Huanren Manchu Autonomous County from 2016 to 2019

催产日期data亲鱼组数/组pair of spawner催产水温/℃induced temperature产卵量/万粒fecundity催产率/%successrate受精率/% fertilization rate孵化水温/℃incubationtemperature孵化率/%hatching rate出苗量/万尾fry number备注note2016-04-1010 00017~2198049808~1535274.4自然水温孵化2017-04-0410 00017~2290040288~2041103.3麻醉授精2018-04-0512 00018~221 280453018~2240153.6麻醉授精2019-03-0823 00018~222 800468518~22551 309.0不麻醉
2.6 北方须鳅的胚胎发育情况
北方须鳅的胚胎发育过程可分为受精卵、胚盘形成、卵裂、囊胚、原肠、神经胚、器官分化和孵化出膜8个阶段,根据胚胎形态特征的变化又可划分为17时期。因达到各发育期的时间存在个体差异,将50%个体出现新特征作为发育时期的划分标准,具体见表3和图4。
表3 北方须鳅胚胎发育时序(2019年,水温18~22 ℃)
Tab.3 Embryonic development of loach Barbatula barbatula nuda (2019, water temperature of 18-22 ℃)

序号 No.发育时期 stage主要特征 key feature图序 figure No.1受精卵受精后,卵膜遇水迅速膨胀,卵膜透明图4A2胚盘形成受精2 h左右,外周原生质向动物极移动、集中,形成隆起帽状胚盘图4B32细胞期4 h后,胚盘沿动物极向植物极的轴向分割成左右两个大小相等的分裂球图4C44细胞期5 h后,第二次分裂面与第一次的相垂直,形成4个分裂球图4D58细胞期6 h后,第三次分裂有两个分裂面,将4个分裂球分裂成8个图4E6多细胞期8 h后,卵裂球越分越小,堆积在卵黄上端,呈桑椹状,又称桑椹胚图4F7囊胚期12 h后,早期囊胚的胚层举得较高,尚可看见模糊的细胞界限,未形成囊胚腔,观察不到细胞界限图4G8囊胚晚期24 h后,到达囊胚晚期,此期囊壁的细胞向下生长,逐渐将卵黄部分包围起来,称为“下包”,此时囊胚腔被压缩到极小的程度,同时囊胚层“下包”约达整个胚胎的1/3,外形也变扁平图4H9原肠早期26 h后,囊胚层发育下包到卵黄的1/2处,有部分囊胚层细胞向胚胎内部卷入,为原肠形成的开始图4I10原肠中期28 h后,胚胎继续下包到达卵黄的2/3,称为原肠中期图4J11原肠晚期30 h后,在继续下包达的卵黄的3/4~4/5,细胞集中增厚,形成胚盾,此时称为原肠晚期图4K12神经胚期32 h后,囊胚层从包围卵黄的4/5到逐渐完全包围卵黄,胚胎转入神经胚图4L13眼囊期38 h后,前脑两侧向外突出一对肾形的团块,这便是眼的原基,之后变为椭圆形,更加突出图4M14尾芽期48 h后,胚胎的原肠运动结束,胚胎开始出现体节,尾芽更明显,胚体开始伸长进入体节生成期图4N15肌肉效应期56 h后,胚体逐步分化出嗅囊、听囊、心脏原基,血管贯通,开始血液循环,孵出期肌肉效应图4O16出膜前期72 h后,胚体在卵膜内活动,具有仔鱼的基本形状图4P17出膜期仔鱼破膜而出图4Q

A—受精卵;B—胚盘形成; C—2细胞期;D—4细胞期;E—8细胞期;F—多细胞期;G—囊胚期;H—囊胚晚期;I—原肠早期;J—原肠中期;K—原肠晚期;L—神经胚期;M—眼囊期;N—尾芽期;O—肌肉效应期;P—出膜前期;Q—仔鱼。
A—fertilized egg; B—blastoderm; C—2 cell stage; D—4 cell stage; E—8 cell stage; F—multicellular stage; G—blastula stage; H—late blastula; I—early gastrula; J—middle gastrula; K—late gastrula; L—neurula; M—optic capsula stage; N—tail bud stage; O—muscular effect stage; P—prehatching stage; Q—larva.
图4 北方须鳅胚胎发育
Fig.4 Embryonic development of loach Barbatula barbatula nuda
3 讨论
3.1 北方须鳅产卵行为观察
通过实地调查发现,北方须鳅通常昼伏夜出。繁殖期间北方须鳅将产卵场附近石头、沙子、灰尘清理干净,选择河流较缓、硬底质的河床处产卵。产卵后亲鱼无护卵行为,卵粒较小,颜色灰白色,与河床砂砾相近,不易被敌害发现。人工催产至效应时间时,雌雄鱼成对浮于水上层并排转圈游动,类似于“双人舞蹈”,产毕可见雌鱼翻着白肚皮呈僵尸状沉于底层。据观察,北方须鳅的产卵行为与泥鳅不同,北方须鳅繁殖产卵时无泥鳅Misgurnus anguillicaudatus的缠绕产卵行为[12]。这可能与北方须鳅身体较短有关,不便于缠绕,而泥鳅体型修长,易于缠绕。北方须鳅卵的类型与同一流域的拉氏鱥Phoxinus lagowskii[13]、唇鱼骨Hemibarbus labeo[14]等一样,均是黏性卵,在人为控制条件下,还未能自然产卵,推测可能是产卵条件还未达到其自然产卵的环境。在找到人工条件下北方须鳅自然产卵的限制因子之前,采用人工授精是实现北方须鳅繁殖的高效方法。
3.2 北方须鳅产卵时期的确定及人工产卵和孵化适宜温度
本研究显示,北方须鳅在辽宁新宾和桓仁的人工产卵时间在3月下旬—4月上旬(表1、表2),这与实地观察结果相一致。在新宾满族自治县平顶山镇太子河主河段水温为8.5 ℃时北方须鳅便开始产卵,最早繁殖期为3月28日前后,繁殖末期在4月15日左右。北方须鳅产卵最低水温为8.5 ℃,远低于泥鳅产卵最低产卵水温(16 ℃),这可能与不同种类间的繁殖策略差异有关,属于北方须鳅对低温环境的一种适应性特征。北方须鳅产卵期较早,北方河流冰雪融化后便开始繁殖活动,此时其他鱼类尚未开始繁殖,敌害较少,这种孵育方式推测是北方须鳅这种鱼卵卵径小且仔鱼较小的鱼类对生存环境的一种生态适应。北方须鳅人工繁殖试验表明,适宜北方须鳅孵化水温在17 ℃以上,其原因是:首先,水温高且恒定,则北方须鳅孵化周期短,与室外水泥池(水温8~12 ℃)孵化大约需15 d相比,北方须鳅室内孵化篓孵化3~4 d即能破膜,从而也减少了胚胎死亡的机会;用孵化篓孵化方法能及时剔除死卵,保证孵化水质,其孵化率达50%以上,从而提高孵化效率,但其孵化率并未达80%以上,这可能与本试验中使用自然河流中的野生亲本有关。笔者认为,如果亲本源自人工精心培育的亲鱼,其孵化效率会得到较大提高。
3.3 麻醉药物对受精率的影响
为减轻鱼类人工催产过程中亲鱼的损伤,药物麻醉在鱼类人工授精中得到越来越广泛的应用[15-17]。由于北方须鳅个体小、体表黏液较多,麻醉药物在北方须鳅催产上的应用同样带来较多的好处。经麻醉后的北方须鳅亲鱼在采卵授精时,其挣扎次数和强度明显弱于未麻醉亲鱼,促使亲鱼采卵时间大为缩短,从而大大提高了操作效率,同时减少了亲鱼的损耗。但麻醉对受精率影响较大,未麻醉组受精率达80%以上,麻醉组受精率低于30%(表2)。Billard[18]认为,在授精稀释液中麻醉剂(乙二醇苯醚)的体积分数大于0.05% 时才会影响精子的活力,且麻醉剂对人工授精时产生不利影响的概率较低。Wagner 等[19]研究认为,当MS-222麻醉药物质量浓度在15~100 mg/L,丁香油质量浓度在10~100 mg/L,CO2质量浓度在50~173 mg/L时,活动精子的比例为68%~87%,不受麻醉的影响。然而,随着麻醉药质量浓度的增加,精子持续运动时间则减少,MS-222影响下精子运动的平均持续时间为55~36 s,丁香油影响下的平均持续时间为56~37 s,CO2影响下的精子运动持续时间较短(31~43 s),表明麻醉药在一定程度上影响受精率。本试验中采用干法人工授精,拭干亲鱼体表带有乙二醇苯醚的多余水分,但受精率仍然受到较大影响,推测造成这一因素的原因是北方须鳅属小型无鳞鱼类,药物通过身体较快地吸收进入体液,从而影响了精巢,导致精子活力下降。综上所述,北方须鳅在人工授精时,在未找到不影响精子活力的合适麻醉剂量平衡点之前,不建议使用麻醉药物。
3.4 北方须鳅人工授精技术要点
鳅类人工催情后既可自然产卵也可采取人工授精,而北方须鳅目前仅能采取人工授精。综合近几年北方须鳅人工规模化繁殖试验,可将其人工授精过程总结为“挤、剪、搅、捞、洗、放”6个字。
1)挤。轻轻挤压雌鱼腹部,将成熟的卵流淌至干净的盆中。
2)剪。解剖雄鱼取其精巢,置于0.75~0.96 mm筛绢网中挤压使精液淌出,点滴至盆中卵上,用鹅毛搅动至均匀。
3)搅。盆中倒入清水,搅动受精,30 s后加入黄泥浆,搅动至受精卵的外膜上附一层薄薄的泥浆。
4)捞。在多数受精卵卵膜附有黄泥后,用捞网捞出受精卵放入装有相近水温的清水中进行吸水,吸水过程使受精卵变大,卵体表更具弹性。
5)洗。用清洁的水冲洗受精卵上的黄泥,同时用手不停地搅动,洗净即可。
6)放。将受精卵洗干净后,根据每个孵化篓的大小确定放卵量,用塑料量筒杯进行体积计量或称重计量,后放入孵化篓中进行孵化。
3.5 北方须鳅胚胎发育特点
中国常见鳅科品种胚胎发育过程中(表4),长薄鳅Leptobotia elongata、中华沙鳅Botia superciliaris和花斑副沙鳅Parabotia fasciata为产漂流性卵鱼类,其余均为产黏性卵鱼类,其中,安氏高原鳅Triplophysa angeli和东方高原鳅Trilophysa orientalis鱼卵为微黏性,北方须鳅为产强黏性卵鱼类。泥鳅在水温19~23 ℃条件下,40~60 min进入2细胞期,或在20 ℃条件下,1 h 38 min进入2细胞期;贝氏高原鳅进入2细胞期的时间较长,需4 h 20 min,但其孵化温度较低,为9.0~12.8 ℃;而本试验中的北方须鳅在水温17~22 ℃条件下,进入2细胞期的时间需4 h。综合温度因素的影响,北方须鳅从受精卵进入卵裂所需时间最长,这可能与北方须鳅的胚胎发育特性及其在自然界中生存的环境有关。
表4 中国常见鳅科鱼类的胚胎发育特征
Tab.4 Embryonic developmental features of species in Cobitidae in China
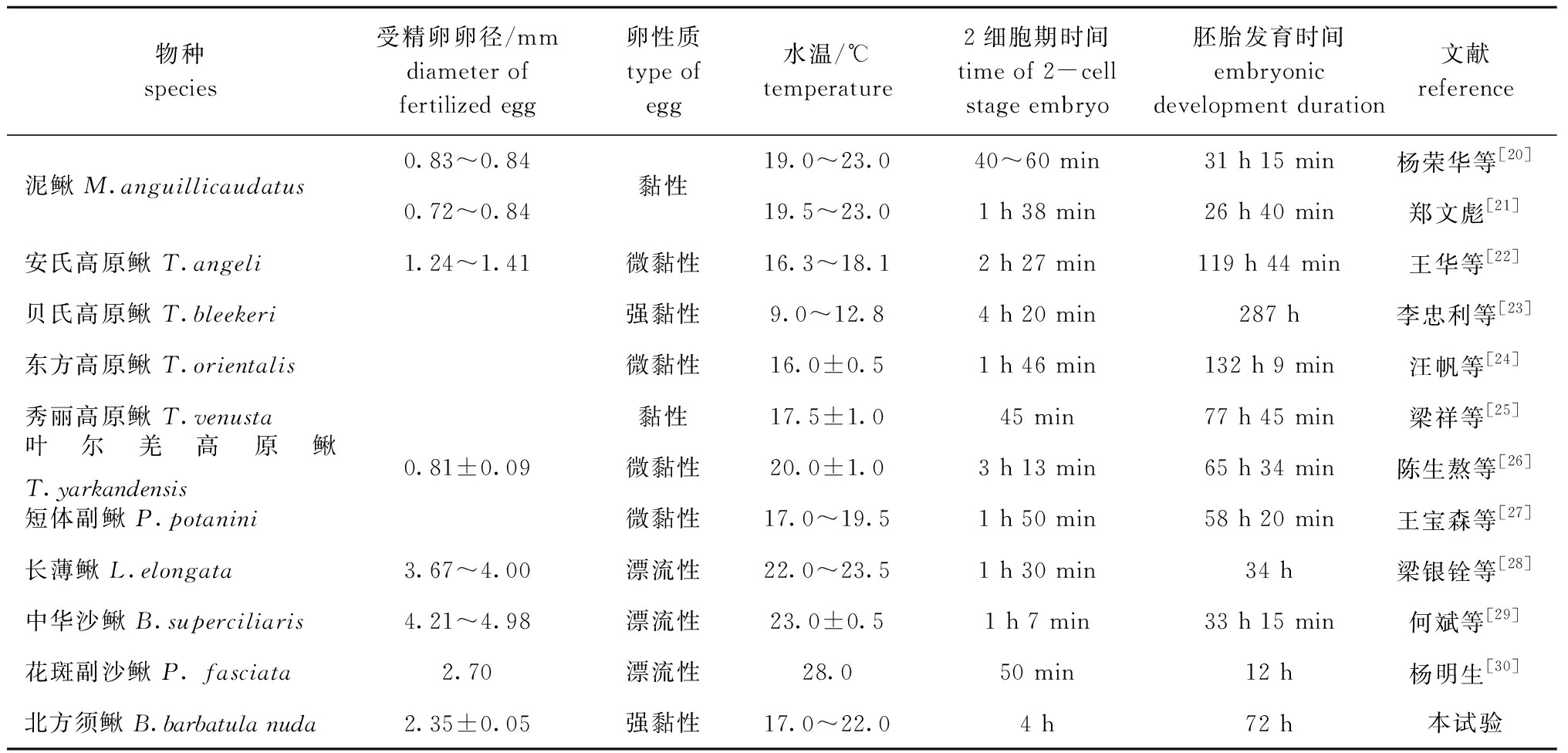
物种species受精卵卵径/mmdiameter of fertilized egg卵性质type of egg水温/℃temperature2细胞期时间time of 2-cell stage embryo胚胎发育时间embryonic development duration文献reference泥鳅 M.anguillicaudatus0.83~0.840.72~0.84黏性19.0~23.040~60 min31 h 15 min杨荣华等[20]19.5~23.01 h 38 min26 h 40 min郑文彪[21]安氏高原鳅 T.angeli 1.24~1.41微黏性16.3~18.1 2 h 27 min119 h 44 min王华等[22]贝氏高原鳅 T.bleekeri强黏性9.0~12.84 h 20 min287 h李忠利等[23]东方高原鳅 T.orientalis微黏性16.0±0.51 h 46 min132 h 9 min汪帆等[24]秀丽高原鳅 T.venusta黏性17.5±1.045 min77 h 45 min梁祥等[25]叶尔羌高原鳅T.yarkandensis0.81±0.09微黏性20.0±1.03 h 13 min65 h 34 min陈生熬等[26]短体副鳅 P.potanini微黏性17.0~19.51 h 50 min58 h 20 min王宝森等[27]长薄鳅 L.elongata3.67~4.00漂流性22.0~23.51 h 30 min34 h梁银铨等[28]中华沙鳅 B.superciliaris4.21~4.98漂流性23.0±0.51 h 7 min33 h 15 min何斌等[29]花斑副沙鳅 P. fasciata 2.70漂流性28.050 min12 h杨明生[30]北方须鳅 B.barbatula nuda2.35±0.05强黏性17.0~22.04 h72 h本试验
3.6 北方须鳅繁殖成功的意义
土著经济鱼类是大自然赐予的宝贵种质资源库,加强资源的保护开发利用研究,了解鱼类资源的分布、洄游、繁衍等生物学特性,掌握高效、合理开发技术,提高科学管理水平,是渔业生产持续发展的重要保障。北方须鳅是辽河土著名优溪流性鱼类,是辽宁省重要土著淡水鱼类,开发前景广阔[31],其人工繁殖的成功,为北方须鳅产业化养殖奠定了坚实基础,同时有助于推动中国水产养殖品种结构改善,对建设美丽乡村具有重要意义。
4 结论
1)通过生态和生理调控措施,可实现野生北方须鳅的规模化人工繁殖。通过注射LHRH-A2等混合催产药物催产北方须鳅雌亲鱼55 000组,获卵5 960万粒,平均催产率45.0%,平均受精率56.0%,平均孵化率42.7%,获水花鱼苗1 840.3万尾。
2)在辽宁东部山区北方须鳅适宜繁殖季节主要集中在3月中旬至4月上旬。
3)北方须鳅产卵最低水温8.5 ℃,适宜水温17~22 ℃,在此温度下,效应时间为23~26 h。
4)北方须鳅人工授精适宜雌雄比为2∶1。
5)将北方须鳅胚胎发育分为8个阶段17个时期,受精卵吸水后卵径为(2.35±0.05)mm,历经胚盘形成期、卵裂期、囊胚期、原肠期、神经胚、器官分化期和出膜期。从受精至仔鱼孵出需积温为66.67 ℃·d,至仔鱼平游需积温为126.5 ℃·d。初孵仔鱼全长为(4.9±0.8)mm,体质量为(0.6±0.1)mg。
[1] 解玉浩,李文宽,解涵,等.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007:235-237.
[2] 王军萍,韩希福.拒马河源北方条鳅的生物学[J].河北渔业,1992(1):5-8.
[3] 邱宝鸿,傅学魁,李雄权,等.长白山北方条鳅生物学特性[J].北华大学学报(自然科学版),2011,12(2):195-198.
[4] 邱宝鸿,傅学魁,李雄权,等.长白山头道白河上游北方条鳅种群结构分析[J].北华大学学报(自然科学版),2012,13(1):94-97.
[5] 孙鹏,马波,赵文阁.北方须鳅4个地理种群的形态差异与判别分析[J].水产学杂志,2014,27(2):14-19.
[6] 魏洪祥,骆小年,徐忠源,等.北方须鳅性腺发育的组织学观察[J].水产学杂志,2016,29(5):7-11.
[7] 王晓光,王兴兵,寇凌霄,等.北方须鳅的耗氧节律、耗氧率和窒息点的研究[J].水产科学,2018,37(3):309-315.
[8] 韩如政,骆小年,韩雨哲,等.北方须鳅幼鱼的饲料蛋白质需求量[J].动物营养学报,2016,28(12):3905-3911.
[9] 徐浩然,骆小年,韩如政,等.北方须鳅室内当年养成食用鱼试验[J].水产学杂志,2018,31(1):7-11.
[10] 赵兴文.鱼类增养殖学实习实践指导[M].北京:中国农业出版社,2018:131.
[11] 朱光来,赵子明.泥鳅的人工繁殖与苗种培育初步研究[J].中国农学通报,2014,30(5):61-67.
[12] 翟旭亮.泥鳅繁殖生物学和人工繁殖技术研究[D].重庆:西南大学,2011:39.
[13] 骆小年,李军,金广海,等.拉氏鱥人工繁殖试验[J].水产科学,2013,32(11):673-675.
[14] 骆小年,李军,夏大明,等.唇鱼骨人工繁殖试验[J].水产学杂志,2011,24(2):9-12.
[15] 金广海,骆小年.北方土著鱼类高效健康养殖技术[M].北京:海洋出版社,2017:104.
[16] 邓龙君,甘维熊,刘小帅,等.MS-222麻醉剂对短须裂腹鱼人工繁殖的麻醉影响[J].江苏农业科学,2018,46(7):167-171.
[17] MARKING L L,MEYER F P.Are better anesthetics needed in fisheries?[J].Fisheries,1985,10(6):2-5.
[18] BILLARD R.Effect of some fish anesthetics on gamete survival during artificial insemination of rainbow trout[J].The Progressive Fish-Culturist,1981,43(2):72-73.
[19] WAGNER E,ARNDT R,HILTON B.Physiological stress responses,egg survival and sperm motility for rainbow trout broodstock anesthetized with clove oil,tricaine methanesulfonate or carbon dioxide[J].Aquaculture,2002,211(1/2/3/4):353-366.
[20] 杨荣华,朱逸仁.泥鳅胚胎与鱼苗发育的研究[J].辽宁师范大学学报(自然科学版),1991,14(1):46-52.
[21] 郑文彪.泥鳅胚胎和幼鱼发育的研究[J].水产学报,1985,9(1):37-47.
[22] 王华,郭延蜀,左林,等.安氏高原鳅胚胎和仔鱼发育的观察[J].水产科学,2009,28(12):721-725.
[23] 李忠利,严太明.贝氏高原鳅胚胎和仔鱼的形态发育[J].水生生物学报,2009,33(4):636-642.
[24] 汪帆,杨瑞斌,樊启学.东方高原鳅的胚胎与胚后发育观察[J].华中农业大学学报,2017,36(6):89-98.
[25] 梁祥,钟文武,冷云,等.秀丽高原鳅胚胎发育观察[J].水产科学,2018,37(1):79-84.
[26] 陈生熬,宋勇,牛玉娟,等.叶尔羌高原鳅胚胎发育与胚后发育观察[J].中国水产科学,2015,22(4):597-607.
[27] 王宝森,姚艳红,王志坚.短体副鳅的胚胎发育观察[J].淡水渔业,2008,38(2):70-73.
[28] 梁银铨,胡小建,黄道明,等.长薄鳅胚胎发育的观察[J].水生生物学报,1999,23(6):631-635.
[29] 何斌,陈先均,温涛,等.中华沙鳅的胚胎发育[J].西南农业学报,2014,27(3):1332-1336.
[30] 杨明生.花斑副沙鳅的胚胎发育观察[J].淡水渔业,2004,34(6):34-36.
[31] 骆小年,赵兴文,段友健.辽宁省淡水土著鱼类开发利用研究进展[J].大连海洋大学学报,2020,35(2):155-160.