围绕南极洲的南大洋是地球上最冷的水域,从3 200万年前的渐新纪开始,南极绕极流(the antarctic circumpolar current, ACC)就阻碍了南极海域与其他海域的热量交流,导致南大洋(the Southern Ocean)的水温逐步下降。在南极大陆架周围的海水温度常年维持在0 ℃以下,并被冰雪覆盖。南极海域虽然寒冷,但也是海洋鱼类分化最快的海域之一[1]。目前,在南极海域占主导地位的是隶属于鲈形目的南极鱼亚目Notothenioidei鱼类,该亚目的鱼类在南大洋变冷过程中快速分化,目前拥有8个科120多个物种,其中3个科(Bovichtidae、Pseudaphritidae和Eleginopidae)的绝大部分物种分布于南极圈外较温暖的海域,而其余5个科(Nototheniidae、Artedidraconidae、Harpagiferidae、Bathy- draconidae和Channichthyidae)的101个物种则占据高纬度的冰冻海域[2]。
一般认为,抗冻蛋白和其他抑制冰晶生长的独特蛋白的出现,以及浮力的变化为这些鱼类向冰冻海域的分化及占据各种深度的水层奠定了基础[2]。除了具有独特的抗冻能力,其中冰鱼科Channichthyidae的16个物种还丢失了血细胞中运送氧气和CO2 的血红蛋白,其血液完全透明。这些鱼类的分子生理及与南极环境密切相关的进化过程,为研究生命演化提供了一个独特的窗口。南极鱼类如何适应长期低温和极端的光周期,是什么力量驱动其快速进化,在全球变暖的环境下它们的命运又将会如何,这一系列问题一直是极地生物学研究的热点。
迄今为止,鳞头犬牙南极鱼Dissostichus mawsoni、智利油南极鱼Eleginops maclovinus、龙嘴雪冰鱼Chionodraco myersi、扁嘴副带腭鱼Parachaenichthys charcoti、革首南极鱼Notothenia coriiceps和鸭嘴裂头冰鱼Chaenocephalus aceratus等南极鱼的基因组已经全面测序和注释[3-7]。最近多个南极亚目物种的全基因组序列如鞍斑杜父鲈 Cottoperca gobio、伯氏肩孔南极鱼Trematomus bernacchii和尖头裸龙鰧Gymnodraco acuticeps也开始公布于公共网站(图1)。研究者们通过与其他已知硬骨鱼类的基因组信息进行比较分析,南极鱼类适应极端环境的分子机制及基因组的进化规律也逐步清晰起来。
Cottoperca gobio、伯氏肩孔南极鱼Trematomus bernacchii和尖头裸龙鰧Gymnodraco acuticeps也开始公布于公共网站(图1)。研究者们通过与其他已知硬骨鱼类的基因组信息进行比较分析,南极鱼类适应极端环境的分子机制及基因组的进化规律也逐步清晰起来。

物种名后的数为该物种基因组的大小,基于二代测序结果的物种未在图中列出。
The number followed by the species name indicates the genome size of the species, and the species sequenced by the second generation sequencing are not listed.
图1 已完成全基因组测序的南极亚目鱼类物种的进化关系及所属的科名
Fig.1 Phylogenetic relationships and family names among Notothenioidei fish species with accomplished whole genome sequencing
1 南极鱼类成体和鱼卵抗冻蛋白的种类、起源和结构变异
由于鱼类血液的冰点是-1 ℃左右,而南极海水的温度常年在-2 ℃,能够降低血液冰点的抗冻蛋白的存在被认为是南极鱼类得以向冰冻海域分化的基本前提[8]。目前在各种鱼类中,已经发现至少5种结构不同却都能抑制冰晶生长从而降低体液冰点的蛋白,即抗冻蛋白[9]。在南极亚目鱼类中发现的这类蛋白称为抗冻糖蛋白(antifreeze glysoproteins, AFGPs),其蛋白链是由一个被糖基化的三肽重复而成,重复次数从3次到60多次不等。该蛋白的命名方式传统上是按照分子量从大到小,分别以AFGP1~AFGP8命名,分子量最小的是AFGP8。这些大小不一的AFGP的基因编码序列一般会成串地聚在一起,分别由一个三肽L(I/N)F编码序列分开,蛋白质翻译后才将中间的三肽间隔子切除,从而形成大小不一但独立编码的抗冻蛋白分子。每个物种中通常含有多个这样的多聚抗冻蛋白基因。一般来讲,在更寒冷区域分布的南极鱼体内拥有更多拷贝数的抗冻蛋白基因,而生活在南极圈外的南极亚目鱼类,只含有残留的片段或者完全缺少抗冻蛋白[10]。另外,Cheng等[11]通过对这些基因序列分析发现,这些基因的5′UTR和 3′ UTR与广泛存在于鱼类及其他动物体内的胰蛋白酶基因的5′UTR和编码序列高度同源。进一步的序列进化分析表明,抗冻蛋白基因起源于一个位于胰蛋白酶第一内含子和第二外显子交界处且具有TAA编码能力的9个核苷酸,经不断扩增后形成了一个AFGP-胰蛋白酶的嵌合体,这一嵌合体正是抗冻糖蛋白的最初雏形[11]。这种原始基因经过进一步的扩增和胰酶编码序列的消除,形成了目前在基因组中可以看到的AFGP基因及基因家族。可见,南极鱼类抗冻糖蛋白是从一段简单的、原来看似无用的短序列,通过不断地扩增而形成的。有趣的是,北极鳕鱼也具有分子结构几乎相同的抗冻糖蛋白,但是这些基因并不起源于胰蛋白酶,而是完全从头起源[7,12]。短序列的扩增和基因的扩增是南北极两种抗冻蛋白形成的共同机制。
在成年南极鱼类体内,抗冻糖蛋白会在胰腺外分泌组织中合成,并通过血液循环运送至全身起到抗冻作用。然而,AFGP基因并不在卵细胞中原位表达。南极鱼类的卵和早期胚胎是如何抗冻的,学者们对此开展了相关研究。Chen等[13]通过对南极圈外和圈内多物种的、基于基因芯片的比较基因组杂交分析发现,南极圈内物种的卵壳蛋白基因家族发生了显著的基因扩增现象。对鳞头犬牙南极鱼的透明带蛋白(zona pellucida protein,ZP)基因转录本进行的测序和分类,并结合比较基因组杂交的结果显示,与温带鱼类相比,有7种透明带蛋白,包括ZPAX1、ZPAX2、ZPC1、ZPC3、ZPC4、ZPC5和ZPB的拷贝数在鳞头犬牙南极鱼中表现出显著的扩增。这些透明带蛋白参与卵壳的形成,具有保护发育中胚胎的作用。研究还发现,南极鱼类的透明带蛋白与冰结合,在中等质量浓度(4 mg/mL)条件下,可以非依数性地降低溶液的冰点和熔点,不同ZP种类降低冰点活性介于0.26~0.65 ℃,其中ZPAX1和ZPC5的活性最高,其降低冰点的活性超过相同浓度的AFGP蛋白[14] (表1)。另外,转入并表达南极鱼科透明带蛋白基因的斑马鱼卵表现出促进冰晶融化的能力,且转基因鱼卵在冰冻环境下较野生对照鱼卵的成活率显著增高。通过对南极鱼类透明带蛋白ZPC5的突变分析发现,透明带蛋白结构域和表面的酸性残基斑块是促进冰融化(ice melting-promoting,IMP)活性的基本结构。因此,南极鱼卵壳蛋白抗冻的机制与AFGP的抗冻机制并不相同,前者可以同时降低液体的熔点和冰点,而AFGP只降低冰点。AFGP只抑制冰晶生长,而南极鱼类的卵壳蛋白能促进冰晶融化[15]。 最近破解的另一个南极亚目物种,鸭嘴裂头冰鱼的基因组表明,透明带蛋白家族在鸭嘴裂头冰鱼基因组中广泛扩增,共鉴定到131个透明带基因,包含20条contig上串联重复的109个基因。其中一个位点就包含19个串联重复的ZPC5基因[6],这个位点与其他南极亚目鱼类并不一致,表明不同的物种具有不同透明带基因的扩增谱系。南极鱼类透明带蛋白扩增和结构特化的过程是一个极地环境推动分子适应性进化的一个新的例证(图2)。
表1 南极亚目鱼类体内发现的抗冻蛋白种类和活性(引自Schrag等[14]和Cao等[15])
Tab.1 Types and activities of antifreeze proteins in Notothenioid fishes(Cited from Schrag et al.[14] and Cao et al.[15])
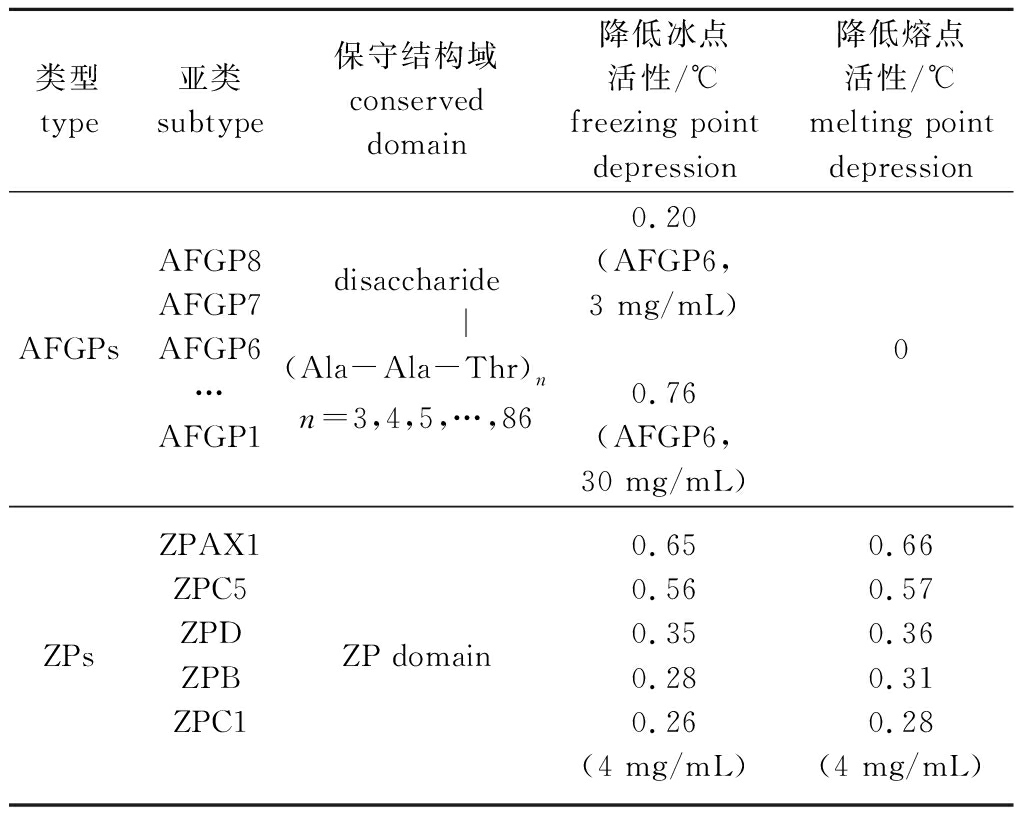
类型 type亚类subtype保守结构域conserved domain降低冰点活性/℃freezing point depression降低熔点活性/℃melting point depressionAFGPsAFGP8AFGP7AFGP6…AFGP1disaccharide |(Ala-Ala-Thr)nn=3,4,5,…,860.20(AFGP6, 3 mg/mL)0.76(AFGP6,30 mg/mL)0ZPsZPAX1ZPC5ZPDZPBZPC1ZP domain 0.650.560.350.280.26(4 mg/mL)0.660.570.360.310.28(4 mg/mL)

南极高寒区鱼类通过透明带蛋白(ZP)基因的扩增和新功能化产生新型的抗冻蛋白,保护鱼卵在冰冻环境下生存。
By gene duplication and neofunctionalization,zona pellucida proteins(ZP) of the Antarctic high cold region fish evolve to become a new-type antifreeze protein,which could protect fish egg survive in frozen environment.
图2 具有抗冻能力的南极鱼透明带蛋白(ZP)
Fig.2 Zona pellucida protein (ZP) with antifreeze activities in Antarctic fish
本实验室对ZPC5结构与抗冻功能的关系进行了详细研究。对体外表达的ZPC5蛋白的变性试验表明,南极鱼ZPC5的抗冻功能依赖于其ZP结构及其非聚合状态[15]。但是,所有ZP蛋白的原始功能都是分泌到卵细胞外周,聚合形成卵壳。因此,ZP蛋白的抗冻功能与其原始结构蛋白的功能存在着结构性的冲突。Chao等[15]在鳞头犬牙南极鱼的基因组中至少鉴定到了3种编码ZPC5变构体的基因,除了原始ZPC5基因(包含10个外显子)外,有2种ZPC5基因分别在第9和第10个外显子中间引入了转录终止位点,形成了C末端截断了的ZPC5。抗冻功能检测表明,C末端截断的ZPC5容易留在细胞内,并且不容易聚合,因此,其在冰冻状态下保护细胞的功能更强[15]。而这种变构体在其他南极鱼类如鸭嘴裂头冰鱼的基因组中也存在,只是截断的位置有所不同。这种通过分子截断而避免功能冲突的基因进化机制,类似于极地绵鳚科鱼类Ⅲ型抗冻蛋白从唾液酸合成酶起源的“避免适应冲突”(escape from adaptive conflict)新基因起源的机制[16]。这也说明,这种分子进化机制存在普遍性。南极鱼类透明带蛋白基因的多样性显然与这些鱼类的进化历史和产卵环境具有关联性。透明带蛋白基因在非南极亚目的其他极地鱼类中扩增的情况、结构的变异及其与环境的关系是一个值得进一步研究的问题。
2 南极鱼类血液发生和抗过氧化信号通路的特殊性和适应性机制
环绕南极大陆的海洋是一个寒冷但温度相对稳定的水体,温度的年变化幅度在-1.9~1 ℃之间。由于海水的氧溶解度与温度成反比,南极海水处于氧饱和状态。因此,生活在这里的南极亚目鱼类表现出许多独特的生理现象。一方面由于南极温度低,南极鱼类具有极低的新陈代谢率,因而对氧气的需求量比较低;另一方面由于海水氧饱和度增加,南极鱼类对运氧能力的需求总体较弱。因此,大部分南极圈内物种单位体积内血红细胞数量比温带鱼类的血红细胞数量明显减少,而冰鱼科的物种则完全失去了血红蛋白,其原始性血红细胞数量仅为具有血红蛋白的相同大小南极鱼的1%左右[17]。最近对南极鱼亚目物种基因组中的高度保守核苷酸片段(conserved nucleotide elements,CNEs)进化模式的分析发现,那些调控血红细胞发生相关基因的CNE在南极圈内物种中存在着快速突变,表明它们在长期的低温环境下具有功能丢失的趋势[18]。这也说明血红细胞的发生(erythropoiesis)在南极亚目的鱼类中受到了放松选择。在血红蛋白丢失的冰鱼科物种中,除了CNE的放松选择之外,其造血组织(头肾)中的TGF-beta信号和p53明显加强。强化的TGF-beta和p53信号通路促进了90余个microRNAs的合成,包含众多靶向调控GATA1、ALAS2等红系发生关键调控因子的miRNAs,如miR-152、miR-1388、miR-16b。这几个miRNAs表达量的提高可以降低斑马鱼胚胎血液的发生[19-20]。现有的研究表明,南极鱼类对血红细胞发生过程的调控是适应低温的一个重要机制。
转录组分析可以为长期低温下鱼类的适应机制探索提供指导。Chen等[13]对鳞头犬牙南极鱼的脑、肝、卵巢和头肾4个组织进行了转录组测序,并与温带/热带硬骨鱼相同组织的转录组图谱进行比较,发现许多与寒冷相关的基因表达上调。这些上调的基因家族在蛋白质生物合成、蛋白质折叠和降解、脂质代谢、抗氧化、抗凋亡、先天免疫、卵壳形成等方面发挥着重要作用。其中,蛋白质生物合成、蛋白质折叠和降解等保持蛋白质稳态通路和诸多抗过氧化通路基因在基因表达上的变化尤其明显。后续在其他物种中基于全基因组测序的比较发现,诸多抗氧化胁迫相关的基因发生了高表达或者扩增,这些均为前期转录组研究提供了良好的例证。
在鸭嘴裂头冰鱼基因组中,与ROS稳态相关的基因家族包括编码超氧化物歧化酶(SOD)和NADPH醌受体氧化还原酶(NQO1)基因在鸭嘴裂头冰鱼基因组中均发生了扩增。研究发现,鸭嘴裂头冰鱼有 5个SOD基因,其他鲈形目硬骨鱼只有3个SOD。更可观的变化是NQO1基因,鸭嘴裂头冰鱼中有33个NQO1基因,远多于大多数鱼类基因组中2~10个NQO1基因的数量。另外,鸭嘴裂头冰鱼也是已完成基因组测序的硬骨鱼中唯一具有两个串联拷贝的8-氧鸟嘌呤DNA糖基化酶(OGGL)的鱼类。OGGL编码的蛋白质用于切除由于活性氧损伤而产生的修饰碱基,而在其他测序的硬骨鱼基因组中只有一个OGGL拷贝[6]。
本实验室在对鳞头犬牙南极鱼和智利油南极鱼两个分别位于南极圈内和圈外不同地理位置的近缘南极鱼物种12个主要组织的转录组比较中,同样也发现了抗过氧化在适应南极冰冻环境上的重要性。在差异基因富集的10多个生物学过程中,硒化合物代谢过程和硒半胱氨酸代谢过程得到了显著富集,这两个生物学过程均为抗活性氧途径。与智利油南极鱼相比,鳞头犬牙南极鱼组织中大部分含硒蛋白基因的转录活性有较大增强。与此相应的,参与含硒半胱氨酸蛋白翻译的基因在鳞头犬牙南极鱼中也显著上调,转运Selcys的Selcys-tRNA基因家族也发生了极大扩张。众所周知,硒蛋白是细胞内应对细胞氧化应激的重要分子,增强的抗活性氧能力是对持续寒冷环境的一种重要适应。谷胱甘肽过氧化物酶4b(gpx4b)是一种唯一能够减少脂质过氧化氢的硒蛋白。该基因在鳞头犬牙南极鱼中表达较低,而与脂肪储存相关的所有脂滴组装蛋白(PLN2、PLN5、Fitm、Seipin)在该鱼所有组织中均上调,这意味着鳞头犬牙南极鱼中存在抑制脂质过氧化并向着脂滴储存方向转变的分子机制[7]。
目前,南极鱼类血红细胞的大幅降低是对低温的适应性进化还是因为高饱和氧环境下的退化所致,迄今还是一个尚未解决的问题。本实验室从血红细胞发生相关CNE的进化研究发现,TGF-beta1及其受体在南极圈内鱼类发生的适应性进化,以及它们对红系发生的抑制功能均暗示,血红细胞的减少可能是一种适应低温的进化过程。另外,低温环境下抗氧化胁迫机制的高度提升,无论在有血红蛋白和无血红蛋白的物种中均是如此。这表明,抗过氧化机制的强化是鱼类适应长期低温的一个重要机制。这个发现对于抗低温和抗高温水产品种的选育具有重要意义。
3 南极鱼类hepcidin基因家族的独特进化
Hepcidin是一种肝脏分泌的抗菌肽,由前体通过翻译后剪切形成20~25个氨基酸残基组成的短肽。在高等脊椎动物中,hepcidin分子一般含有8个高度保守的半胱氨酸残基,相互配对形成了四对二硫键构成稳定的发卡结构。Hepcidin是目前脊椎动物上发现的唯一铁离子代谢调节因子[21],其通过结合FPN1(ferroportin 1)发挥调控铁稳态的作用,而FPN1的作用是将铁从十二指肠上皮细胞、巨噬细胞及其他铁输出细胞输出。Hepcidin在细胞表面与FPN 1结合,激活hepcidin-FPN1复合物的内化,最终导致FPN1泛素化及蛋白复合物降解,从而降低细胞中铁离子的输出[22]。
研究表明,南极鱼类的hepcidin由多个基因编码,有的hepcidin分子发生了结构性的改变。转录组学分析发现,鳞头犬牙南极鱼和革首南极鱼分别具有3种和5种不同的hepcidin cDNA,除了传统的包含8个半胱氨酸(Cystein,Cys)残基的保守的hepcidin外,还有一种只含4个半胱氨酸的hepcidin分子(4cys hepcidin)[23]。这种4Cys hepcidin分子的氨基酸序列几乎与8Cys hepcidin的半胱氨酸没有同源性,表明这类分子在进化过程中发生了极大的改变,且这种4Cys hepcidin 基因只在南极圈内的南极鱼亚目鱼类中检测到。有趣的是,没有血红蛋白的冰鱼科物种,如鸭嘴裂头冰鱼中只有8Cys的hepcidin而缺失4Cys hepcidin,造成这种缺失的原因目前尚不清楚。然而,在鳞头犬牙南极鱼的造血组织头肾和脾脏中高表达但在鸭嘴裂头冰鱼体内缺失的4Cys hepcidin,很可能与鸭嘴裂头冰鱼体内血红蛋白和造血作用缺失有关[23-24]。
这种新型4Cys hepcidin亚型的成熟区只包含4个半胱氨酸,只能形成2个二硫键。可以推测,其结构可能在低温下具有更高的灵活性[23]。南极绵鳚科鱼类Lycodichthys dearborni并不属于南极鱼亚目鱼类,但其同样也生活在南极圈的冰冻水域中。在L.dearborni体内发现了独立进化而来的4Cys hepcidin同源基因,这支持了低温驱动半胱氨酸数目减少的hepcidin产生的假设。
为明确这种结构变异的hepcidin分子是否具有与8Cys的hepcidin一样的功能,近年来,本实验室在体外表达了南极鱼类的3种hepcidin变构体,其中包含2个具有8Cys和1个具有4Cys的hepcidin,并进行了抑菌试验。结果表明,无论哪种hepcidin均能抑制细菌的增殖,其抑菌的活性浓度也相似。同样地,这些hepcidin分子均能与FPN结合(未发表数据)。鉴于铁离子在细胞增殖、死亡、新陈代谢和心血管发育中不可替代的功能,对hepcidin基因家族在各物种中的组成、各种变构体的功能差异及与环境因素的关系的阐明将为理解鱼类的温度适应机制提供新的视角。
4 南极鱼线粒体的适应性进化
革首南极鱼是一种极地特有的硬骨鱼,大量分布于南极近海岸水域。对革首南极鱼基因组中进化最快的10%的基因的GO富集分析发现,大多数的富集项与线粒体相关。在发生正选择的20个编码线粒体蛋白中,有10个基因与氧化磷酸化直接相关,其中6个基因编码ATP合成酶的亚单位,1个基因编码线粒体复合物Ⅲ的亚单位,3个基因编码线粒体复合物Ⅳ。这个结果提示,线粒体蛋白的快速进化可能与寒冷环境的适应相关。相比温带鱼类,南极鱼线粒体在氧消耗率、电子传递与ATP合成的耦合效率等方面对温度更加敏感。它们的快速进化可能影响南极鱼类线粒体功能的热敏感现象,并有助于解释极地鱼类正常代谢的极限温度[25]。
没有血红蛋白的南极冰鱼在线粒体上的改变更加明显。对龙嘴雪冰鱼与3种代表不同温度环境的鱼类(斑马鱼、尼罗罗非鱼、三刺鱼)骨骼肌转录组比较和分析发现,龙嘴雪冰鱼中参与各种线粒体过程的基因存在差异表达[5,26]。核糖体大小亚基的组装是线粒体生成的必要条件,而在龙嘴雪冰鱼中参与线粒体核糖体组装的大部分辅酶基因发生了过表达。3种形成线粒体连接位点和嵴组织系统(MICOS)的蛋白编码转录本(包括MICOS核心组成IMMT)在龙嘴雪冰鱼中显著低表达。另外,线粒体肌酸激酶(mtCK)是连接内部和外部的线粒体膜和促进脂质转移的相关蛋白质,其在龙嘴雪冰鱼骨骼肌中的表达也显著降低。有试验表明,小鼠在敲除线粒体肌酸激酶mtCK 后,肌肉纤维发生超微结构重塑,这导致线粒体的密度增高、体积增大[27]。这些表型与龙嘴雪冰鱼肌肉细胞的表型一致。此外,在嵴重塑中起重要作用的OPA1及调节线粒体分裂的关键基因DNM1L/DRP1在龙嘴雪冰鱼中均发生下调,而促进线粒体融合和连接脂滴的MIGA1基因则在龙嘴雪冰鱼中发生了上调。可以推测,这些变化使得龙嘴雪冰鱼肌肉中含有更多数量的线粒体[28-29]。
事实上,从龙嘴雪冰鱼和非南极物种的比较中得到的结果可以解释为,龙嘴雪冰鱼线粒体过程的基因差异表达在一定程度上可以反映出这是对南大洋冰冻条件的反应,而不是因为缺乏运氧载体——血红蛋白。与其他具有血红蛋白的南极鱼相比,龙嘴雪冰鱼基因组中扩增的基因中,有大量的属于线粒体蛋白组(IMPI)的基因。这种基因扩增与其mRNA水平的高表达显著相关,也与高组织特异性的功能特化显著相关[5]。因此,基因扩增也是南极冰鱼体内线粒体发生机制改变的进化模式。
5 南极鱼类的热休克反应
热休克反应是生物机体在热应激(或其他应激)状态下所表现的以基因表达变化为特征的防御适应反应,具体表现为一种或多种热休克蛋白(heat-shock proteins,HSPs)表达的增强。长期低温且稳定环境下进化的南极鱼类,其热休克反应发生了怎样的变化,学者们对此开展了相关研究。早期报道显示,有的南极鱼类如伯氏肩孔南极鱼已经失去了热休克反应的能力[30]。最近的基因组层面上的分析表明,所有种类的热休克蛋白如HSP70、HSP90及HSP40等蛋白在极地鱼类中均存在,而且有些热休克蛋白如HSP70、HSP90的表达量比正常状态下的温带鱼类还要高[13]。这提示,低温环境下蛋白折叠需要伴侣蛋白的协助。
研究发现,南极鱼类中的热激蛋白是组成性表达的,可能是为了缓解蛋白的冷变性[31-34]。革首南极鱼的基因组草图中,HSR(heat shock response)相关基因保存良好。在脊椎动物中,HSF1(heat shock factor 1)被认为是热应激的主要调节因子,而革首南极鱼的HSF1失去了依赖磷酸化的小泛素相关修饰(phosphorylation-dependent sumoylation motif,PDSM)的基序,该基序是抑制其反式激活能力所必需的。PDSM中丝氨酸残基的磷酸化是将小泛素修饰肽(small ubiquitin-related modifier peptide,SUMO)偶联到HSF1中单个赖氨酸残基的先决条件。当需要最大化HSF1活性时,去泛素化酶从HSF1中去除这种修饰。革首南极鱼和一些冰鱼的HSF1在调节结构域中不包含完整的PDSM,并且其PDSM的丝氨酸残基被天冬酰胺取代。因此,革首南极鱼的HSF1不被类泛素化降解,这意味着HSP1的反式激活不受类泛素化作用的抑制。在革首南极鱼基因组背景下,失去SUMO位点的PDSM会通过简单的模式最大限度地激活对热应激的反应[35-36]。与伯氏肩孔南极鱼不同的是,革首南极鱼中的HSR在全血转录组水平上保留了增加热应激蛋白(HSP70、HSP ssb1、HSP40)的表达能力,以响应急性热应激[3]。因此,极地鱼类的HSR反应具有物种特异性。
6 南极鱼类中性浮力的获得
鱼鳔是大多数硬骨鱼的主要浮力器官,而所有的南极亚目鱼类都没有鱼鳔。与底栖祖先(如智利油南极鱼)显著不同,有些物种在进化上再次获得了中性或接近中性的浮力,使它们能填充海洋中上层水域的生态位,成为南极亚目适应辐射的一个独特标志。鳞头犬牙南极鱼是少数获得了中性浮力的物种之一。研究表明,这个物种通过皮下和肌肉中广泛的脂质(主要是甘油三酯)沉积,以及主要由软骨和少量矿化骨组成的轻质骨骼,降低整体密度,在海水中提供静态升力[37]。转录组分析表明,与智利油南极鱼相比,鳞头犬牙南极鱼肌肉中参与三酰甘油合成的酶转录水平显著上调,包括关键的酰基甘油-3-磷酸O-酰基转移酶亚型和胞苷二磷酸-二酰甘油合成酶。同时,与脂肪储存调控相关的基因除MEST基因外表达量均显著增高。相反地,鳞头犬牙南极鱼肌肉中与脂质β-氧化相关的基因却显著下调。这些数据表明,相对于智利油南极鱼,鳞头犬牙南极鱼肌肉的代谢途径从脂质分解转移到脂质生物合成和脂质储存,有利于脂质的沉积,从而有助于中性浮力的形成。KEGG进一步分析表明,肌肉中脂肪代谢的改变是通过脂肪合成的主要调控因子PPARγ实现 (图3)。 在这条通路上,一些促进PPARγ功能的因子如ID2、METRN1、STK3、CREB1和SNAI2等被大量表达,这些基因的大量表达促进了脂肪细胞的生成[7]。

鳞头犬牙南极鱼肌肉组织中PPARγ和10个促进脂肪细胞生成的基因(红框表示)表达比祖先物种均显著提高,而抑制脂肪合成的因子只发现1个 TGFB1(蓝框)(引自Chen等[7],2019)。
PPARγ and other 10 genes that promote the production of fat cells (red box) show significantly up-regulated expressions in muscle tissues of the Antarctic fish D.mawsoni, compared with its ancestor species.Only one gene TGFB1 (blue box) that inhibits fat synthesis is found(Cited from Chen et al.[7],2019).
图3 鳞头犬牙南极鱼脂肪细胞生成的基因调控
Fig.3 Gene regulations of adipose cell generation of the Antarctic fish Dissostichus mawsoni
在骨化方面,脊椎动物骨骼发育的两个主要调节因子Sox9和Runx2的表达在鳞头犬牙南极鱼、伯氏肩孔南极鱼和博氏南冰鰧Pagothenia borchgrevinki的盆骨带骨转录组中无明显变化。然而,许多BMP通路、Wnt通路基因的表达和许多已知参与这一过程的调节因子的表达在鳞头犬牙南极鱼中发生了特异性改变,这可能改变了软骨形成和成骨之间的发育平衡[7]。在这些高度上调的基因中,结缔组织生长因子CTGF与早期的成骨分化有关,包括成骨前体细胞的增殖和募集;但当CTGF组成性表达时,其会抑制Wnt-3A和BMP-9诱导的成骨细胞分化[25]。另外,前列腺素过氧化物合成酶2(HSPG2)是滑膜间充质细胞向软骨和成脂分化所必需的,其通过调节Sox9和PPARγ促使细胞外基质蛋白1(ECM1)与HSPG2相互作用调节软骨形成。MEF2C是一种调节肌肉和心血管发育的转录因子,通过激活软骨细胞肥大的遗传程序来控制骨的发育[38]。目前已知一些基因的上调可以抑制成骨细胞的形成,如TOB2[39]、CTNNBIP1[40]、分泌型卷曲相关蛋白1(secreted frizzled-related protein 1,SRFP1)[41]和ZBTB16[42];而转化生长因子-β超家族的一些成员(BMPR1A、转化生长因子-β1、Smad1)可促进软骨形成和成骨细胞形成。这些基因在鳞头犬牙南极鱼骨骼中的表达发生显著变化。CYR61和PTN特异性地促进成骨细胞的形成[43-44],但PTN的表达在鳞头犬牙南极鱼骨骼中显著减少,这与减少硬骨的形成是一致的。另外,一些基因通过调节破骨细胞生成来影响骨化,如Sbno2可促进破骨细胞融合[45],成骨细胞上EphA2信号的激活导致骨的重吸收。鳞头犬牙南极鱼骨骼的基因表达模式显示,在骨骼发育过程中,基因表达有利于软骨生成而不是成骨细胞生成,这将降低骨密度,并有助于实现中性浮力 (图4)。因此,南极鱼基因组和转录组的比较研究,为揭示极地鱼类中性浮力形成的分子发育机制指明了新的方向。
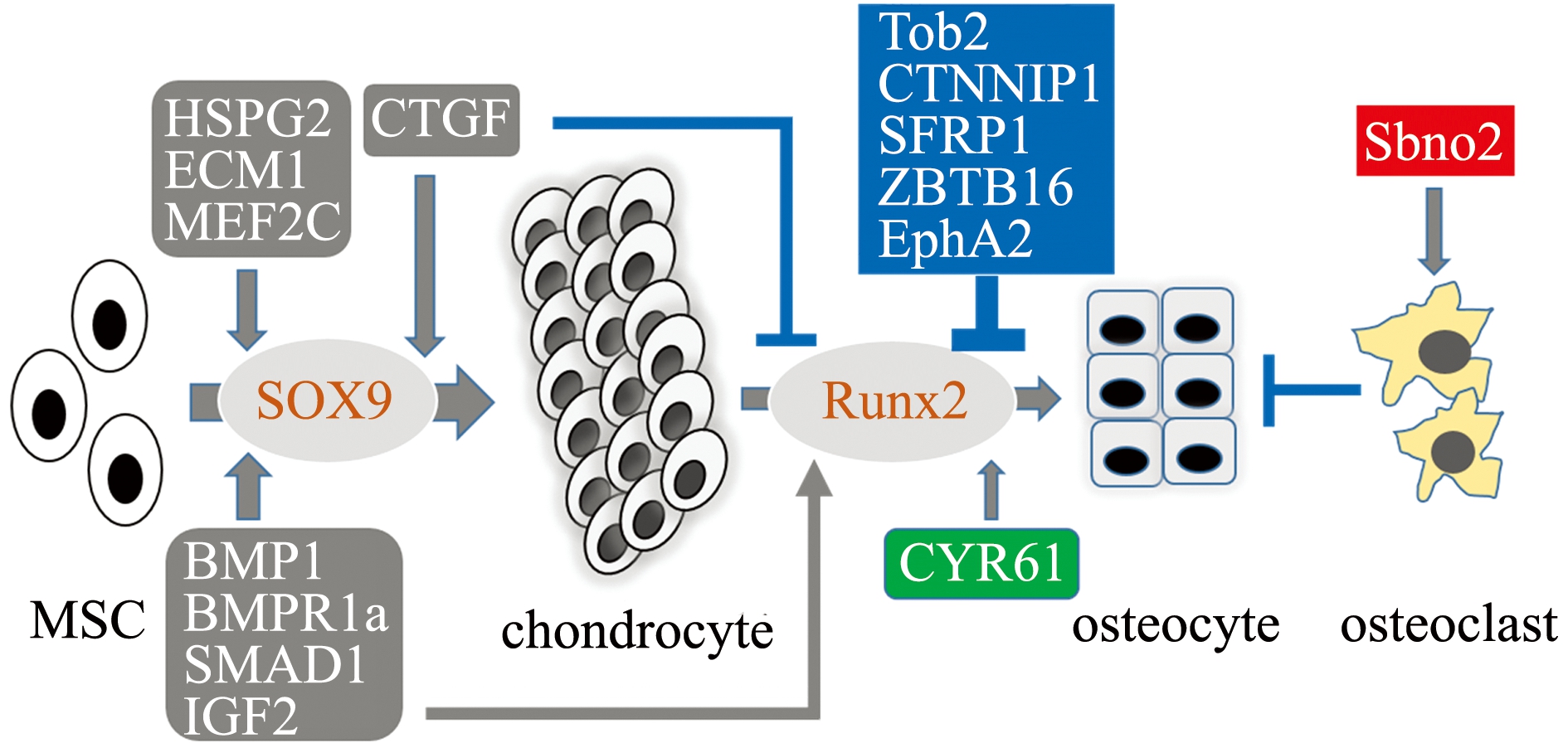
鳞头犬牙南极鱼骨细胞转录组分析表明,与温带祖先物种相比,其促进软骨生成的因子(深灰框)、抑制软骨分化成骨细胞的因子(篮框)和促破骨因子(红框)均显著高表达,而促进成骨细胞生成的因子(绿框)则显著低表达。
The Antarctic fish D.mawsoni osteocyte transcriptome analysis indicates that factors that promote chondrogenesis (dark gray box),and genes that inhibit osteogenesis (blue box),and osteoclastic factors (red box) show significantly up-regulation compared with its ancestor species.
图4 基因表达的变化促使鳞头犬牙南极鱼非钙化软骨的生成[7]
Fig.4 Gene expression changes promote non-calcifiedchondrogenesis in the Antarctic fish Dissostichus mawsoni[7]
7 低温驱动的鱼类基因组进化趋势
极地鱼类为人们了解环境温度与基因组GC含量和蛋白质的氨基酸偏好提供了机会。对基因组总体CG含量的比对发现,南极亚目鱼类的基因组与温带鱼类无明显差异,均在40%左右[7,46],但在氨基酸密码子的使用频率上,冷水鱼和热带鱼表现出密码子替换的不对称性。与热带鱼相比,冷水鱼在同义和非同义密码子替换中均表现出对GC的偏好。温带鱼类也偏爱富含GC密码子的氨基酸,而不倾向于那些富含AT密码子的氨基酸。寒带鱼富含GC密码子的非同义替换倾向于在蛋白质链中增加小分子量的氨基酸比例。对蛋白质组二级结构的预测和比较研究表明,寒带鱼类蛋白质组中随机卷曲的频率明显高于热带鱼类。这种替代的偏向性可以增加蛋白质的灵活性,对降低低温环境下蛋白酶的活化能是有利的[47]。
一系列的研究发现,生活于南大洋不同温度区间的南极亚目鱼类的基因组大小存在明显差异,那些生活于高纬度冰冻海域的南极鱼物种具有更大的基因组。基因组变大的现象在血红蛋白丢失的冰鱼科物种中特别明显,其基因组比低纬度寒温带海域进化上比较原始的物种大30%~50%[48]。南极亚目鱼类未发生过种类特异的全基因组加倍的事件。高纬度冰冻海域物种基因组的增大主要是转座子大量扩增导致的[6-7]。对鳞头犬牙南极鱼基因组与温带南极亚目物种的比较基因组杂交发现,有17个编码逆转录酶和内切酶基因显示出8~300倍南极圈内物种特有的重复[13]。除了转座子的扩增外,很多蛋白的编码基因也发生了扩增。Chen等[7]通过基于芯片的比较基因组杂交发现,118个基因家族在南极鱼物种中表现出明显的扩增,其中包括AFGP基因家族、ZP基因家族、Lectin基因家族、Selcys-tRNA基因及与线粒体相关的基因。对这些扩增基因的功能研究表明,这些扩增基因是对极地冰冻环境适应的重要遗传基础[5,13,15,26]。可以推测,对极地鱼类中扩增基因种类和功能的深入探索是发现抗冻或者抗低温性状决定基因的有效途径。
是什么因素促进了南极亚目鱼类转座子活性的增加,从而导致基因组变大,这是一个尚未解决的问题。一般认为,环境胁迫如极端温度、氧化胁迫、辐射等因素往往导致转座子抑制机制,如DNA甲基化或组蛋白修饰等表观遗传因素的改变,从而使转座子重新回到活跃状态[49-50]。南极鱼类转座子的扩增是否与低温胁迫有关,本实验室对此开展了详细研究。通过对鳞头犬牙南极鱼基因组中长散在重复序列(LINE-1)扩增时间的计算发现,这些序列的大量扩增发生在6百万年前当极地海洋的温度降到最低点的时候(图5)。为进一步研究LINE扩增与低温的关系,将来源于鳞头犬牙南极鱼的一个长散在重复序列(DmL1)进行了克隆并转染人类和鱼类的细胞。结果发现,低温刺激下两种细胞基因组中DmL1的拷贝数均有所增加。而进一步研究揭示,在冷胁迫条件下,正是由于活性氧(reactive oxygen species,ROS)的积累激活了丝裂原活化蛋白激酶(MAPK)/p38信号通路,并进而引起dmL1转座活性的增加[51]。由于MAPK/p38信号通路普遍参与动物的应激反应,这种机制很可能普遍存在于动物中。显然,MAPK通路如何激活LINE-1类的逆转座活性,而南极鱼类高涨的逆转座活性如何得到有效控制从而保持基因组的稳定,是基因组进化领域一个值得研究的问题。
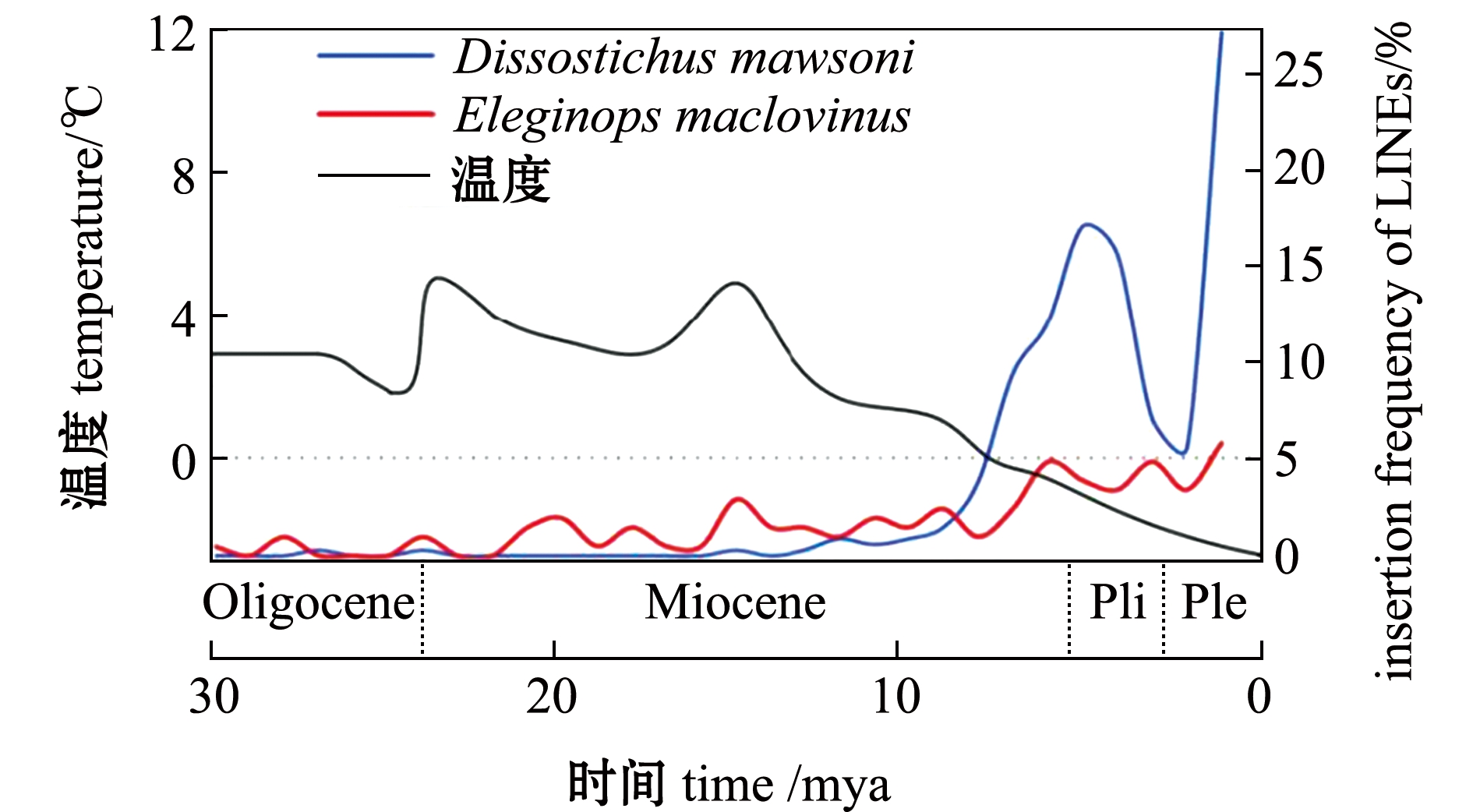
图5 鳞头犬牙南极鱼、智利油南极鱼LINE-1扩增与温度下降的关系[7]
Fig.5 Correlations between LINE1 duplications and the cooling temperature in Antarctic fishes Dissostichus mawsoni and Eleginops maclovinus[7]
8 存在问题及展望
随着各种组学技术的进步,近10多年来,极地鱼类对低温环境生理适应的遗传基础正在得到揭示。人们已经在抗冻和多种组织如血液、骨骼、脂肪等特殊的发育调控有了新的认识。在细胞生理学的水平上,以蛋白质稳态维持和抗过氧化为特征的抗逆信号通路也被揭示是极地鱼类抵抗寒冷环境的重要通路。然而,对鱼类抵抗低温的分子机制的深入了解有赖于扩展到与其他温度区间的鱼类进行更深入的比较研究。目前,在极地鱼类中所揭示的抗冻蛋白及抵抗过氧化等的分子都是处于低温信号传递链的末端分子,是否在鱼类中存在低温感应的关键基因或节点基因还有待进一步研究。
本实验室和其他一些实验室对斑马鱼进行的低温应激下多组织转录组的分析表明,斑马鱼成体各组织中存在复杂的低温响应基因调控网络,其中JUN和BCL6a在低温网络中处于节点的位置[52]。JUN和BCL6a结合位点在各温度区间的鱼类物种基因组上的丰度也呈现出与所处温度范围相对应的现象[52]。JUN的激活受到JNK、P38等MAPK通路激酶的调控,因此,MAPK通路在鱼类低温应激中占据重要位置,这在多种鱼类的低温应激网络中已得到证明[53-54]。进一步来说,细胞内的MAPK通路与其他重要的通路如TGF-beta等也有复杂的联系。可以预见的是,这些重要通路联合起来共同决定鱼类的温度适应范围。然而,目前在这些通路中,由哪些关键节点基因控制鱼类对温度的适应范围还远未明确。另外,鱼类究竟如何感应温度,它们的神经细胞内存在的TRP类离子通道是否与其他动物一样感应温度,它们在低温信号的传导上,对已经确定鱼类的温度适应范围上扮演什么角色,这些问题还有待深入研究。
根据目前对南极鱼类适应低温的分子进化研究情况,作者提出今后在鱼类适应低温和进化机制领域上有待深入开展研究的科学问题及研究方向有:
1)在极地鱼类低温适应的复杂信号网络中,起关键作用的分子是什么,这些关键分子或者调控序列是在南极环境下新产生的,还是在原有的分子基础上加以改进而产生的。
2)极地鱼类分子水平的微进化如何促成物种水平的快速分化使南极亚目鱼类成为快速分化的海洋鱼类的典型代表。
3)在全球变暖的背景下,这些极地鱼类的命运将会如何,什么样的分子或者生物学途径可以预测各物种的最高耐受温度。
4)在深入研究这些科学问题的基础上,利用从南极鱼类中挖掘出来的独特和高效的抗逆基因,为鱼类抗逆育种或器官和细胞的低温保存服务的研究也将是本领域今后的重要研究方向。对极地生命过程的深入研究将使人们更深地了解有关环境适应与生命演化的基本规律,同时也将在农业育种和医学上产生新的应用前景。
致谢:卜梦迪同学和李文豪老师参与了本文的资料搜集与写作工作。
[1] RABOSKY D L,CHANG J,TITLE P O,et al.An inverse latitudinal gradient in speciation rate for marine fishes[J].Nature,2018,559(7714):392-395.
[2] EASTMAN J T.The nature of the diversity of Antarctic fishes[J].Polar Biology,2005,28(2):93-107.
[3] SHIN S C,AHN D H,KIM S J,et al.The genome sequence of the Antarctic bullhead notothen reveals evolutionary adaptations to a cold environment[J].Genome Biology,2014,15(9):468.
[4] AHN D H,SHIN S C,KIM B M,et al.Draft genome of the Antarctic dragonfish,Parachaenichthys charcoti[J].GigaScience,2017,6(8):gix060.
[5] BARGELLONI L,BABBUCCI M,FERRARESSO S,et al.Draft genome assembly and transcriptome data of the icefish Chionodraco myersi reveal the key role of mitochondria for a life without hemoglobin at subzero temperatures[J].Communications Biology,2019,2(1):443.
[6] KIM B M,AMORES A,KANG S,et al.Antarctic blackfin icefish genome reveals adaptations to extreme environments[J].Nature Ecology & Evolution,2019,3(3):469-478.
[7] CHEN L B,LU Y,LI W H,et al.The genomic basis for colonizing the freezing Southern Ocean revealed by Antarctic toothfish and Patagonian robalo genomes[J].GigaScience,2019,8(4):giz016.
[8] NEAR T J,DORNBURG A,KUHN K L,et al.Ancient climate change,antifreeze,and the evolutionary diversification of Antarctic fishes[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(9):3434-3439.
[9] CHENG C H C.Evolution of the diverse antifreeze proteins[J].Current Opinion in Genetics & Development,1998,8(6):715-720.
[10] CHENG C H C,CHEN L B,NEAR T J,et al.Functional antifreeze glycoprotein genes in temperate-water New Zealand nototheniid fish infer an Antarctic evolutionary origin[J].Molecular Biology and Evolution,2003,20(11):1897-1908.
[11] CHENG C H C,CHEN L B.Evolution of an antifreeze glycoprotein[J].Nature,1999,401(6752):443-444.
[12] CHEN L B,DEVRIES A L,CHENG C H C.Evolution of antifreeze glycoprotein gene from a trypsinogen gene in Antarctic notothenioid fish[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(8):3811-3816.
[13] CHEN Z Z,CHRISTINA C C H,ZHANG J F,et al.Transcriptomic and genomic evolution under constant cold in Antarctic notothenioid fish[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(35):12944-12949.
[14] SCHRAG J D,O’GRADY S M,DEVRIES A L.Relationship of amino acid composition and molecular weight of antifreeze glycopeptides to non-colligative freezing point depression[J].Biochimica et Biophysica Acta (BBA)-General Subjects,1982,717(2):322-326.
[15] CAO L X,HUANG Q,WU Z C,et al.Neofunctionalization of zona pellucida proteins enhances freeze-prevention in the eggs of Antarctic notothenioids[J].Nature Communications,2016,7:12987.
[16] DENG C,CHRISTINA C C H,YE H,et al.Evolution of an antifreeze protein by neofunctionalization under escape from adaptive conflict[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(50):21593-21598.
[17] KUNZMANN A.Blood physiology and ecological consequences in Weddell Sea fishes (Antarctica)[J].Ber Polarforsch,1991,91:1-79.
[18] DAANE J M,AUVINET J,STOEBENAU A,et al.Developmental constraint shaped genome evolution and erythrocyte loss in Antarctic fishes following paleoclimate change[J].PLoS Genetics,2020,16(10):e1009173.
[19] XU Q H,CAI C,HU X X,et al.Evolutionary suppression of erythropoiesis via the modulation of TGF-β signalling in an Antarctic icefish[J].Molecular Ecology,2015,24(18):4664-4678.
[20] CHAN J L,HU X X,WANG C C,et al.miRNA-152 targets GATA1 to regulate erythropoiesis in Chionodraco hamatus[J].Biochemical and Biophysical Research Communications,2018,501(3):711-717.
[21] GANZ T,NEMETH E.Hepcidin and iron homeostasis[J].Biochimica et Biophysica Acta (BBA)-Molecular Cell Research,2012,1823(9):1434-1443.
[22] NEMETH E,TUTTLE M S,POWELSON J,et al.Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization[J].Science,2004,306(5704):2090-2093.
[23] XU Q H,CHENG C H C,HU P,et al.Adaptive evolution of hepcidin genes in Antarctic notothenioid fishes[J].Molecular Biology and Evolution,2008,25(6):1099-1112.
[24] LI F X,SU J L,XU Y N,et al.A glucose oxidase-hemoglobin system for efficient oxysulfonylation of alkenes/alkynes in water[J].Molecular Catalysis,2021,500:111336.
[25] LUO Q,QUAN K,SI W K,et al.Connective tissue growth factor (CTGF) is regulated by Wnt and bone morphogenetic proteins signaling in osteoblast differentiation of mesenchymal stem cells[J].Journal of Biological Chemistry,2004,279(53):55958-55968.
[26] COPPE A,AGOSTINI C,MARINO I A M,et al.Genome evolution in the cold:antarctic icefish muscle transcriptome reveals selective duplications increasing mitochondrial function[J].Genome Biology and Evolution,2013,5(1):45-60.
[27] NOVOTOV M,TARABOV
M,TARABOV B,TYLKOV
B,TYLKOV L,et al.Ultrastructural remodelling of slow skeletal muscle fibres in creatine kinase deficient mice:a quantitative study[J].General Physiology and Biophysics,2016,35(4):477-486.
L,et al.Ultrastructural remodelling of slow skeletal muscle fibres in creatine kinase deficient mice:a quantitative study[J].General Physiology and Biophysics,2016,35(4):477-486.
[28] COGLIATI S,FREZZA C,SORIANO M E,et al.Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency[J].Cell,2013,155(1):160-171.
[29] ZHANG Y P,LIU X M,BAI J,et al.Mitoguardin regulates mitochondrial fusion through MitoPLD and is required for neuronal homeostasis[J].Molecular Cell,2016,61(1):111-124.
[30] HOFMANN G E,BUCKLEY B A,AIRAKSINEN S,et al.Heat-shock protein expression is absent in the Antarctic fish Trematomus bernacchii (family Nototheniidae)[J].The Journal of Experimental Biology,2000,203(Pt 15):2331-2339.
[31] FRANKS F.Protein destabilization at low temperatures[J].Advances in Protein Chemistry,1995,46:105-139.
[32] BUCKLEY B A,PLACE S P,HOFMANN G E.Regulation of heat shock genes in isolated hepatocytes from an Antarctic fish,Trematomus bernacchii[J].The Journal of Experimental Biology,2004,207(Pt 21):3649-3656.
[33] PLACE S P,ZIPPAY M L,HOFMANN G E.Constitutive roles for inducible genes:evidence for the alteration in expression of the inducible hsp70 gene in Antarctic notothenioid fishes[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2004,287(2):R429-R436.
[34] TODGHAM A E,HOAGLUND E A,HOFMANN G E.Is cold the new hot?Elevated ubiquitin-conjugated protein levels in tissues of Antarctic fish as evidence for cold-denaturation of proteins in vivo[J].Journal of Comparative Physiology B,2007,177(8):857-866.
[35] HIETAKANGAS V,ANCKAR J,BLOMSTER H A,et al.PDSM,a motif for phosphorylation-dependent SUMO modification[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(1):45-50.
[36] ÅKERFELT M,MORIMOTO R I,SISTONEN L.Heat shock factors:integrators of cell stress,development and lifespan[J].Nature Reviews Molecular Cell Biology,2010,11(8):545-555.
[37] EASTMAN J T,DEVRIES A L.Buoyancy adaptations in a swim-bladderless Antarctic fish[J].Journal of Morphology,1981,167(1):91-102.
[38] ARNOLD M A,KIM Y,CZUBRYT M P,et al.MEF2C transcription factor controls chondrocyte hypertrophy and bone development[J].Developmental Cell,2007,12(3):377-389.
[39] G MEZ B,RODR
MEZ B,RODR GUEZ-CARBALLO E,BARTRONS R,et al.MicroRNA-322 (miR-322) and its target protein Tob2 modulate Osterix (Osx) mRNA stability[J].Journal of Biological Chemistry,2013,288(20):14264-14275.
GUEZ-CARBALLO E,BARTRONS R,et al.MicroRNA-322 (miR-322) and its target protein Tob2 modulate Osterix (Osx) mRNA stability[J].Journal of Biological Chemistry,2013,288(20):14264-14275.
[40] TAGO K,NAKAMURA T,NISHITA M,et al.Inhibition of Wnt signaling by ICAT,a novel Genes & Development β-catenin-interacting protein[J].Genes & Development,2000,14(14):1741-1749.
[41] YAO W,CHENG Z Q,SHAHNAZARI M,et al.Overexpression of secreted frizzled-related protein 1 inhibits bone formation and attenuates parathyroid hormone bone anabolic effects[J].Journal of Bone and Mineral Research,2010,25(2):190-199.
[42] ONIZUKA S,IWATA T,PARK S J,et al.ZBTB16 as a downstream target gene of osterix regulates osteoblastogenesis of human multipotent mesenchymal stromal cells[J].Journal of Cellular Biochemistry,2016,117(10):2423-2434.
[43] TARE R S,OREFFO R O C,CLARKE N M P,et al.Pleiotrophin/osteoblast-stimulating factor 1:dissecting its diverse functions in bone formation[J].Journal of Bone and Mineral Research,2002,17(11):2009-2020.
[44] SU J L,CHIOU J,TANG C H,et al.CYR61 regulates BMP-2-dependent osteoblast differentiation through the αvβ3 integrin/integrin-linked kinase/ERK pathway[J].Journal of Biological Chemistry,2010,285(41):31325-31336.
[45] MARUYAMA K,UEMATSU S,KONDO T,et al.Strawberry notch homologue 2 regulates osteoclast fusion by enhancing the expression of DC-STAMP[J].The Journal of Experimental Medicine,2013,210(10):1947-1960.
[46] ZHANG D S,HU P,LIU T G,et al.GC bias lead to increased small amino acids and random coils of proteins in cold-water fishes[J].BMC Genomics,2018,19(1):315.
[47] ZHANG C,RABIEE M,SAYYARI E.ASTRAL-III:polynomial time species tree reconstruction from partially resolved gene trees[J].BMC Bioinformatics,2018,19(sup 6):153.
[48] DETRICH H W,STUART A,SCHOENBORN M,et al.Genome enablement of the notothenioidei:genome size estimates from 11 species and BAC libraries from 2 representative taxa[J].Journal of Experimental Zoology-Part B:Molecular and Developmental Evolution,2010,314B(5):369-381.
[49] RATNER V A,ZABANOV S A,KOLESNIKOVA O V,et al.Induction of the mobile genetic element Dm-412 transpositions in the drosophila genome by heat shock treatment[J].Proceedings of the National Academy of Sciences of the United States of America,1992,89(12):5650-5654.
[50] STEWARD N,ITO M,YAMAGUCHI Y,et al.Periodic DNA methylation in maize nucleosomes and demethylation by environmental stress[J].Journal of Biological Chemistry,2002,277(40):37741-37746.
[51] CHEN S,YU M C,CHU X,et al.Cold-induced retrotransposition of fish LINEs[J].Journal of Genetics and Genomics,2017,44(8):385-394.
[52] HU P,LIU M L,ZHANG D,et al.Global identification of the genetic networks and cis-regulatory elements of the cold response in zebrafish[J].Nucleic Acids Research,2015,43(19):9198-9213.
[53] HU P,LIU M L,LIU Y M,et al.Transcriptome comparison reveals a genetic network regulating the lower temperature limit in fish[J].Scientific Reports,2016,6:28952.
[54] REN J,LONG Y,LIU R,et al.Characterization of biological pathways regulating acute cold resistance of zebrafish[J].International Journal of Molecular Sciences,2021,22(6):3028.