鱼类的繁殖策略是为了适应其生活的水环境栖息地。鱼卵是鱼类的雌性生殖细胞,其产出后黏性程度因种类的不同有较大差异,Rizzo等[1]通过对鱼卵的宏观评估,将鱼卵按黏性程度分为黏性卵、弱黏性卵和非黏性卵3类。其中,紧密黏附在一起形成黏性卵块的鱼卵为黏性卵,彼此黏附但在轻微搅动下可自由移动的卵为弱黏性卵,而完全自由游离的卵为非黏性卵。产黏性卵的代表鱼类有大泷六线鱼Hexagrammos otakii、松江鲈Trachidermus fasciatus、绒杜父鱼Hemitripterus villosus等,这类鱼卵卵膜表层遇水后表现出极高黏性,呈团块状附着于水草、海藻或岩礁等产卵基质上,一般具有黏性强、孵化时间长等特点;产弱黏性卵的代表种类有西伯利亚鲟Acipenser baerii等;还有一些鱼类所产的卵无黏性,卵粒分离,能自由浮动[2] ,代表性种类有大菱鲆Scophthalmus maximus等。
鱼卵有无黏性与鱼的生活史和繁殖策略有重要关系。在自然条件下,迁徙鱼种的卵通常无黏性,会自由地漂向下游。定居鱼种的卵通常具有黏性,会附着在产卵地附近不同的底层物质上[3]。因此,卵的黏性特征可能有助于理解不同种类硬骨鱼间的系统发育关系[4]。黏性鱼卵遇水后,表面黏性物质即被激活,鱼卵或黏附在基质上或互相黏连成团,不同鱼类卵的黏性成因和黏度各有不同。经长期大量的试验和生产实践,科研人员研发了多种黏性鱼卵人工授精和孵化方法。本研究中,综述了黏性鱼卵表面黏性物质的结构成分及黏连机制,综合对比多种黏性卵人工授精及孵化方法,分析了这些方法的原理及优缺点,并对今后的研究方向进行了思考且提出相应建议,以期为产黏性卵鱼类的人工繁育提供参考。
1 鱼卵黏性的生物学功能
鱼卵的黏性是为适应生活环境而发展出的繁殖策略。许多硬骨鱼类会产下黏性卵,卵子遇水后迅速出现的黏性是防止卵从最佳栖息地漂移到次等栖息地的重要机制[5]。鱼卵的黏性有助于其附着在基质上,或与其他卵相互黏附,以防止鱼卵被水流、海浪冲散或被捕食者捕食。鱼卵沉降附着在固定的领地内有助于亲鱼护卵,提高存活率[6]。在上层和底栖鱼类中,鱼卵的附着方式和黏附程度各不相同,这种繁殖策略的变化反映了不同鱼类对环境条件的适应性。
鲟的鱼卵在与水接触后的几分钟内便会产生黏性,具体时间因种类而异,如俄罗斯鲟Acipenser gueldenstaedti为8~19 min,欧洲鳇Huso huso为4~6 min,闪光鲟Acipenser stellatus为5~12 min[7]。鲟类中有5种产出弱黏性卵,有22种产出黏性卵,其中有3种卵黏性极强。大多数种类的鲟卵是沉黏性卵,产在水底的泥滩、沙地或岩石上的沙砾、鹅卵石这类基质上[8-9]。所有种类的鲟均会产出具有黏性的卵,使得鱼卵可以附着在基质上。Vorob’eva等[10]推测,鲟卵黏性的作用很可能是将卵固着在洁净的基质上以便助其受精,进而提高自然条件下鲟的存活率和孵化率。
鱼卵的黏性也有助于亲鱼护卵。一些鱼类通过亲鱼的护卵行为以提高受精卵存活率,如大泷六线鱼、绒杜父鱼等。大泷六线鱼由雄性选择环境适宜受精卵孵化的水域筑巢,雌性将卵产在鱼巢内,卵粒遇水硬化后,具有极强的黏性,牢固的黏附在基质上,这种繁殖策略有利于雄鱼护卵,降低受精卵被捕食风险,提高其存活率[11]。
在无筑巢护卵习性的鱼类中,卵的黏性有助于在整个胚胎发育过程中将鱼卵固着在最佳孵化位置,对维持孵化率水平具有重要意义[12]。如欧洲白鲑Coregonus lavaretus既不护卵也不筑巢,卵粒和精子均撒播在选定的产卵场上,由于它们在水流湍急的水域产卵,所以几乎不会存在卵沉积,受精卵孵化水环境中含氧量较高,有利于提高受精卵孵化率[13]。如果卵无黏性,受精卵可能会受到水流冲击造成物理伤害,或被冲上岸边因干燥而死亡,或被拖入含氧量较低、沉积物负荷较重的深水区,导致孵化率和存活率降低。有研究表明,欧洲白鲑受精卵死亡的主要原因是鱼卵被水流从产卵场冲到不适合的发育区域[14]。
2 黏性卵的结构特征及其黏性机制
2.1 黏性卵的结构特征
大多数鱼类的卵母细胞和卵被一层厚蛋白质膜所包覆[15],称为卵膜。卵膜可以保护鱼卵免受环境变化(如干燥、机械力)影响造成的器质性损伤[16-18],以及水流[19]、捕食者和病原体(如细菌和真菌)感染[20-21]的影响。卵膜可作为受精卵内部与外部环境污染物间隔离的屏障,在环境急剧变化时(如干燥)起到一定的保护作用,卵膜还有促进发育中胚胎气体交换的功能[22]。
卵膜的结构包括一个较厚内层放射带(zona radiata interna,ZRI)和一个较薄外层放射带(zona radiata externa,ZRE)[23]。大多数鱼类的卵均具有这种通用结构,然而,卵膜的形态可以根据物种和环境表现出修正[24]。非黏性鱼卵通常具有较薄的卵泡上皮细胞层和放射带,而黏性鱼卵则被较厚的卵泡上皮细胞层和相对较复杂的卵膜包覆[25]。
覆盖卵的放射带是一个复杂的、充满孔道的细胞外结构,孔道中填充着卵母细胞微绒毛和卵泡细胞突触。放射带通常分成两层,每层均具有不同的形态特征[26]。内层主要由蛋白质组成,碳水化合物较少,与哺乳动物透明带相似,其在受精和胚胎发育过程中的功能在进化中得到了保留[27];外层由特定的大分子组成,除糖蛋白外,还可能含有羧酸和硫酸多糖及少量唾液酸[28],主要负责卵与水环境的相互作用。鱼类产卵后,放射带经历了广泛的分子修饰,最终形成了卵膜。卵膜结构反映了对不同环境条件的适应性,无黏性卵通常具有较薄的卵膜,外层结构较简单;黏性卵具有较厚和更复杂的卵膜,放射带外层的附属结构遇水会产生物理和化学变化,使其能够黏附在不同的基质上[29]。
Rizzo等[1]对23个脂鲤目Cypriniformes和8个鲇形目Siluriformes鱼卵进行了超微结构分析,并研究了卵的黏性及卵表面结构模式的相互关系,结果表明,脂鲤目鱼类中,无黏性卵的放射带表面呈孔道或纤丝网,弱黏性卵的放射带表面仅为孔道,而高黏性卵的放射带表面则为球状、丝状、绒毛状或蜂窝状的孔道;鲇形目鱼类的卵表面结构均较相似,呈现常见的“胶状层”结构,这一结构的鱼卵是否具有黏性主要取决于膜卵表面的生化成分。
2.2 黏性卵的黏性机制
目前,对黏性鱼卵表面的黏性物质成分及成因研究较少,据推测,卵表面黏性可能与生殖模式和系统发育有关[30],黏性鱼卵的黏性机制研究目前也尚未完全清楚,现有的研究成果仅限具体试验中鱼类黏性机制的探讨。黏性卵黏性机制的研究主要从形态学和生化两方面入手,形态学方面运用电子显微镜对卵表面进行超微结构分析,研究卵表面特征性结构在遇水即呈现出黏性前后的变化;生化方面通常使用凝胶电泳法进行成分分析,探讨卵膜表面大分子成分如糖蛋白等遇水化合后所产生的黏性物质成分及成因等。现有研究成果显示,黏性卵的黏性机制根据鱼的种类不同而有所差异。如香鱼科和胡瓜鱼科,包覆着鱼卵的动物半球的黏性卵膜反转,形成黏性膜[31-32];在雀鲷科Pomacentridae[33]、青鳉属Oryziinae[34]、底鳉属Fundulus[35]及虾虎鱼科Gobiidae[36],鱼卵被卵膜上的长纤丝附着在基质上;另外,在很多种类的鱼卵表面发现的黏性物质也使鱼卵产生黏性,如鲱形目Clupeiformes、鲤形目Cypriniformes、鲇形目Siluriformes[37]、刺鱼目Gasterosteiformes[38]、鲈亚目Percoidei[39]、鲉形目Scorpaeniformes[40]和鲽形目Pleuronectiformes[41]。
鱼卵彼此黏附及鱼卵黏附在基质上的方式随环境条件[42]和鱼卵表面结构的不同而变化。综合分析,黏性的产生机制主要分为以下两类。
2.2.1 形态学与生化双重黏附机制 卵特殊的表面结构(如蜂巢结构、各种形态的突起、黏着丝等)与卵的黏度有重大关联,这种特殊表面结构的鱼卵通常具有形态学与生化双重黏附机制。
研究表明,欧洲白鲑卵与水接触30 s后开始产生黏性,且在与水接触后几分钟内鱼卵即完全黏附在一起[14]。对其卵膜超微结构观察表明,与水接触后,卵膜表面形态发生了显著变化,绒毛状突起附着在卵表面的结缔丝上,通过这些突起的互相锁定产生黏性,也可通过在卵表面与卵落入的基质间产生摩擦来促进黏附。这种绒毛状突起与文鳊Vimba vimba卵的绒毛状突起相类似,不过文鳊卵的黏附结构长度为4 μm,而欧洲白鲑卵上的突起更短且长度不一(1~3 μm)[43]。生化机制方面的分析显示,与水接触后的卵膜上存在一种水解蛋白酶(Chain A,RNase ZF-3e),而未与水接触的卵则未发现该种水解蛋白酶的存在。欧洲白鲑卵的卵膜组织学检测显示,阿尔新蓝和PAS染色反应均呈阳性,印证了糖蛋白及中性和酸性黏多糖的存在,此结果与在其他种类硬骨鱼卵外部放射带中发现的结果一致[19]。由此可见,欧洲白鲑卵的黏性源自卵膜,具有形态学和生物化学双重黏附机制。
2.2.2 生化黏附机制 有些鱼类具有相对平滑的卵表面结构(如放射带孔道和胶状外套层),此类鱼卵是否具有黏性及黏性强弱则与具体鱼的种类有关。此类卵黏性机制主要是通过生化机制实现黏附,即卵表面的化学物质,以及排卵后这些化学物质与水发生化合反应后产生的黏性物质,使鱼卵黏附在基质上或相互黏附。
在有些鱼类中,鱼卵的黏性由外层放射带ZRE的糖蛋白介导[43]。如鲤Cyprinus carpio卵的黏性是蛋白质通过外层放射带ZRE从卵黄周隙扩散而引起的[44]。在许多鱼类中,黏性层来自卵泡上皮细胞,如欧鲇Silurus glanis,在卵黄生成作用中,卵泡上皮细胞转化成结构不规则厚实的由黏性卵泡细胞组成的胶状外套层。该胶状外套层由黏多糖和黏蛋白组成,遇水膨胀成为饱满富有弹性的黏性层,将鱼卵附着在基质或鱼巢中。这些黏性物质可以被蛋白酶分解,这表明这些黏性物质的基本成分是蛋白质[45]。
鲟鱼卵的黏性成因仍然知之甚少。鲟鱼卵受精后吸收水分形成卵黄周隙空间,从而引发卵膜膨胀并导致卵黏附[46-48]。卵泡上皮细胞的分泌物转化形成了黏性层,这一层被认为是另一个卵泡上皮细胞层,但其更接近于放射带。目前,这一黏性外层的存在已在多个鲟类中得到证实[49-53]。黏性层的主要成分是含有唾液酸的相对分子质量为110 000的糖蛋白 ,因此,使用蛋白水解酶可以有效地分解黏性层中的蛋白质。不同种的鲟类形成的黏性层厚度也有所不同[54],高首鲟Acipenser transmontanus的黏性层厚度为0.30~0.64 μm,西伯利亚鲟Acipenser baerii为0.5~0.9 μm[55]。当卵子遇水后,外层在水中非生物因子的影响下产生黏性,如渗透压、pH、温度和离子含量(NaCl、KCl、CaCl2、Mg2SO4)等外部因素均会影响鱼卵黏附的分子机制。
3 产黏性卵鱼类人工授精及孵化技术
鱼类人工繁育成功与否的主要因素是能否获得高质量的受精卵。产黏性卵的鱼类,由于卵的黏性特质导致在人工授精和孵化过程中存在较多困难,例如,卵膜表层结构遇水反应导致黏性卵在短时间内失去受精能力,受精卵黏连结块致使内部气体交换困难,进一步导致孵化率下降等。因此,产黏性卵的经济鱼类人工授精及孵化方法是生产过程中延续至今的研究课题,主要研究思路为两个方向: ① 黏性鱼卵的脱黏授精孵化法,使用简便易操作的物理或化学方法使受精卵失去黏性,如利用黄泥浆水进行机械脱黏和利用水解蛋白酶进行化学脱黏,脱黏后再进行受精卵的孵化;② 人工鱼巢接卵孵化法,此方法模拟自然环境中产黏性卵鱼类的孵化条件,将受精卵接卵并附着在人工鱼巢上进行孵化。常用的有棕榈、水草为代表的传统材料鱼巢,聚乙烯网片为代表的新材料鱼巢等。
3.1 脱黏孵化法
脱黏法是在人工催产的基础上,先授精后脱黏,之后流水孵化的技术,此方法有效解决了黏性鱼卵人工授精及孵化过程中的一些困难,具有受精率高、孵化管理方便、孵化效果好而稳定的优点,可以成批获得规格整齐的鱼苗。脱黏法大致可分为物理脱黏法和化学脱黏法。
3.1.1 物理脱黏法 物理脱黏主要利用脱黏剂对鱼卵进行处理,例如黄泥浆、滑石粉、淀粉或富勒氏土等,使鱼卵脱去黏性。亦可使用机械装置对黏性卵进行冲洗分离鱼卵,通过机械作用除去鱼卵表面的黏液使鱼卵脱去黏性。其中,最具代表性的方法是黄泥浆脱黏法,即采用黄泥浆与受精卵搅拌使之脱黏,然后洗去泥浆进行孵化。罗俊烈[56]采用鲫Carassius auratus、鲮Cirrhinus molitorella人工杂交后利用黄泥浆进行脱黏,然后流水孵化,此方法受精率可达92%,孵化率可达86%。 Monaco等[57]使用黄泥浆人工去除了高首鲟鱼卵黏性,孵化率为54%~57%。Chebanov等[58]认为,富勒氏土是最有效的物质之一,但缺点是处理时间过长,使用黄泥浆和富勒氏土处理需要35~45 min。
陈力等[59]对白斑狗鱼Esox lucius的受精卵进行脱黏试验,并使用6种材质的脱黏剂进行对比,分别为黄泥浆、滑石粉、生粉(淀粉)、牛奶、生豆浆和熟豆浆,对亲鱼人工催产授精后加入脱黏剂,结果表明,滑石粉脱黏效果最好,在显微镜下可观察到卵的表面有大量分布均匀的小颗粒,适于规模化人工授精生产。郭长江等[60]对达氏鳇Huso dauricus受精卵用质量浓度为200 g/L的滑石粉溶液进行脱黏,再用清水清洗后转入尤先科孵化器,取得了良好的效果。
物理脱黏法的原理是利用机械震荡和摩擦去除卵表面的黏性物质,操作不当会对受精卵产生损伤,病原体借此大量滋生而导致孵化率降低。Monaco等[57]指出,真菌感染是湖鲟 Acipenser fulvescens卵孵化率下降的关键。Bouchard等[61]用质量浓度50 mg/L 的缓冲碘液处理鱼卵30 min,然后再分别使用尿素-氯化钠-单宁酸溶液及富勒氏土脱黏,这样先消毒再脱黏的方法,虽然耗时增加,但孵化率高达99.6%和97.7%。
3.1.2 化学脱黏法 化学脱黏法是通过使用对鱼卵卵膜产生化学作用的物质处理来去除鱼卵的黏性,使用的材料包括蛋白水解酶、尿素-氯化钠混合溶液和单宁酸等。
对于欧鲇和丁鱥Tinca tinca,最有效地去除鱼卵黏性的方法是使用蛋白水解酶。硬骨鱼类的卵被一层厚的蛋白质层包覆,可通过蛋白水解酶分解蛋白质层去除黏性。传统的物理脱黏剂(如黄泥浆、滑石粉和牛奶)在孵化期间通常会招致细菌和真菌的大量滋生。使用蛋白水解酶可以降低细菌和真菌感染的风险[62]。消除鱼卵黏性的常用酶为碱性蛋白酶、麦芽糖酶、胰蛋白酶和α-胰凝乳蛋白酶。目前,碱性蛋白酶已成功用于去除鲤、丁鱥和欧鲇鱼卵的黏性,该种酶在欧洲的许多孵化场中作为常规材料使用[63]。以鲤为试验对象的研究中曾经使用过α-胰凝乳蛋白酶,但其效率(孵化率为50%~70%)比碱性蛋白酶(孵化率为80%~87%)低。麦芽糖酶曾被运用在尖齿胡鲇Clarias gariepinus卵脱黏处理中,仅需处理90 s,孵化率即可达71.6%[64]。此外,经6 IU/ mL的胰蛋白酶处理的里海鲟Acipenser persicus卵,孵化率为86.9%[62]。研究表明,大多数酶处理通常需要1~2 min,李志等[65]对异育银鲫Carassius auratus gibelio的研究表明,在23 ℃时用质量分数为0.25%胰蛋白酶(pH为7.1~7.4)消化4 min可获得脱黏受精卵。
尿素和NaCl的混合溶液是水产养殖中去除鱼卵黏性最常用的方法[66]。Kowtal等[67]将高首鲟卵在质量分数为0.4%的尿素和质量分数为0.3%的NaCl溶液中处理35 min后,浸入质量分数为0.1%的单宁酸10 s,获得的孵化率为57.7%,与黄泥浆处理组无明显差异。比较尿素-氯化钠-单宁酸溶液和富勒氏土处理湖鲟卵,结果孵化率分别为84.2%和85.6%[61]。
使用化学方法处理鱼卵时,使用剂量和处理时间对其成功至关重要。不正确的剂量和过长的处理时间会增加死亡率[68]。浸入质量分数为0.15%的单宁酸溶液中60~90 s,丁鱥胚胎死亡率达65%~75%,而仔鱼死亡率则高达85%~95%[69]。
对于其他鱼类,特别是近些年才发展出人工繁殖生物技术的鱼类来说,尚未找到去除鱼卵黏性的最佳方法。![]() 等[70]对梭鲈鱼卵使用较高质量浓度(1.0~1.5 g/L)的单宁酸和较长处理时间(5 min),可观察到较佳的结果(表1)。
等[70]对梭鲈鱼卵使用较高质量浓度(1.0~1.5 g/L)的单宁酸和较长处理时间(5 min),可观察到较佳的结果(表1)。
3.2 人工鱼巢接卵孵化法
采用传统方法制作的黏性鱼卵附着鱼巢材料主要有棕榈皮、水草(聚草、金鱼藻)、杨柳根须等。苏建国等[71]在人工繁育团头鲂的试验中,利用杨树根、棕榈皮制作鱼巢,孵化率为20%左右。杨雪军等[72〗研究了黄颡鱼对不同人工鱼巢的产卵偏好,发现半球形棕榈集卵效果优于半球形塑料和尼龙渔网制作的鱼巢。张胜利[73]研究了用3种材料(芒萁片、棕榈片、聚乙烯纤维)制作鱼巢对锦鲤的集卵效果,发现芒萁制作的鱼巢集卵效果最佳。
由于水草易腐烂,杨柳根须和棕榈皮使用前需经水煮晒干,以除去单宁酸等有毒物质,其应用受到一定限制。刑克智等[74]采用带框聚乙烯网片,网目为0.55~1.65 mm,网片先平铺于布卵池,将受精卵布于网片上,待受精卵在网片上黏结牢固后,放入孵化池进行孵化,总孵化率可达80%。郭文等[75]采用相似的聚乙烯网片作为鱼巢,将未受精的鱼卵整形成单层且紧密排列的卵片后,再进行授精,避免了鱼卵变成团块状,使鱼卵受精时能与精子充分接触,提高了鱼卵受精率。
表1 常见养殖鱼类黏性卵脱黏方法及孵化率
Tab.1 De-adhesion methods of adhesive eggs and corresponding hatching rates in common fishes
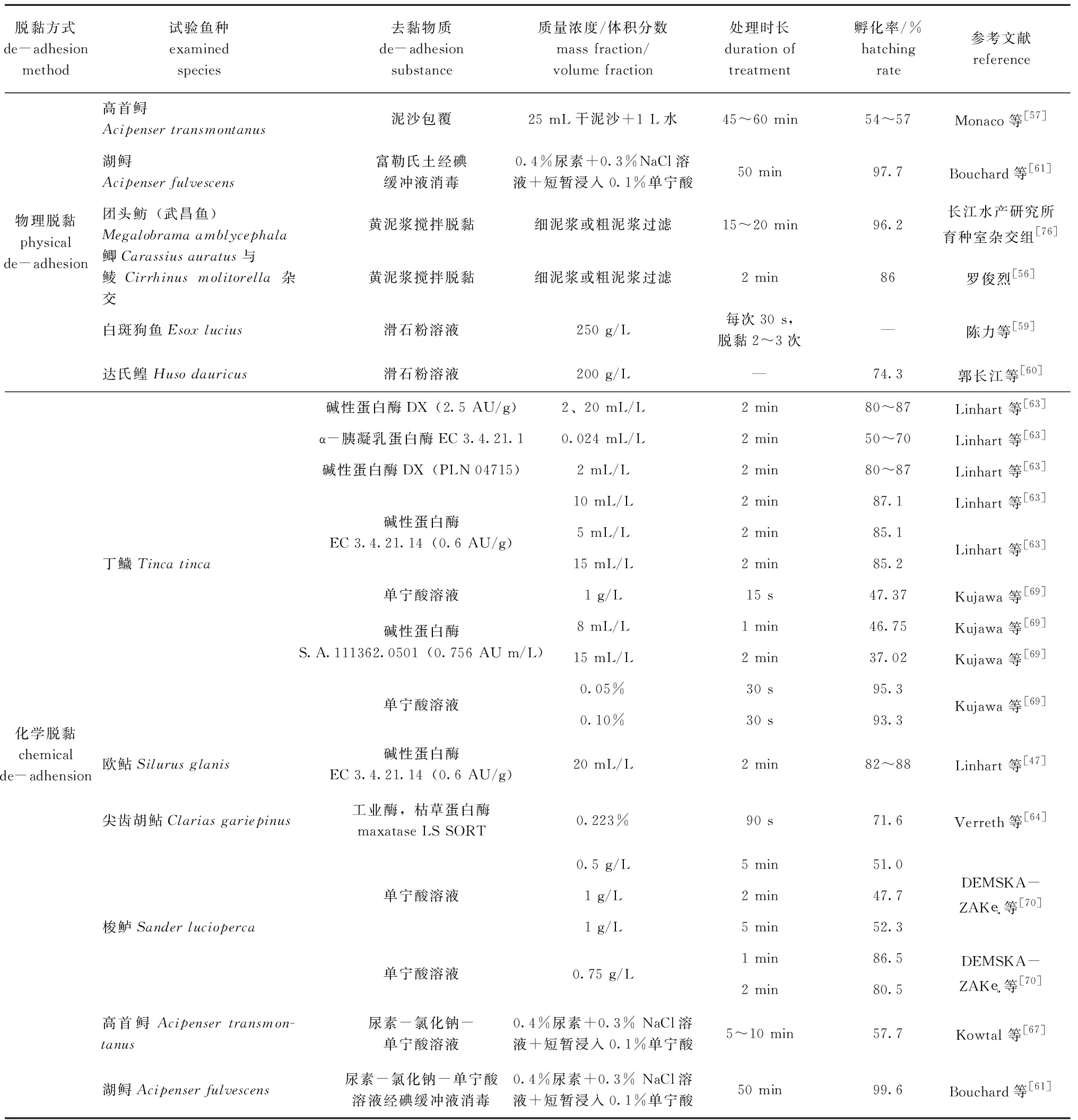
脱黏方式de-adhesion method试验鱼种examined species去黏物质de-adhesion substance质量浓度/体积分数mass fraction/volume fraction处理时长duration of treatment孵化率/%hatching rate参考文献reference物理脱黏physical de-adhesion高首鲟Acipenser transmontanus泥沙包覆25 mL干泥沙+1 L水45~60 min54~57Monaco等[57]湖鲟Acipenser fulvescens富勒氏土经碘缓冲液消毒0.4%尿素+0.3%NaCl溶液+短暂浸入0.1%单宁酸50 min97.7Bouchard等[61]团头鲂(武昌鱼)Megalobrama amblycephala黄泥浆搅拌脱黏细泥浆或粗泥浆过滤15~20 min96.2长江水产研究所育种室杂交组[76]鲫Carassius auratus与鲮Cirrhinus molitorella杂交黄泥浆搅拌脱黏细泥浆或粗泥浆过滤2 min86罗俊烈[56]白斑狗鱼Esox lucius滑石粉溶液250 g/L每次30 s,脱黏2~3次—陈力等[59]达氏鳇Huso dauricus滑石粉溶液200 g/L—74.3郭长江等[60]化学脱黏chemical de-adhension丁鱥Tinca tinca欧鲇Silurus glanis尖齿胡鲇Clarias gariepinus梭鲈Sander lucioperca高首鲟Acipenser transmon-tanus湖鲟Acipenser fulvescens碱性蛋白酶DX(2.5 AU/g)α-胰凝乳蛋白酶EC 3.4.21.1碱性蛋白酶DX(PLN 04715)碱性蛋白酶EC 3.4.21.14(0.6 AU/g)单宁酸溶液碱性蛋白酶S.A.111362.0501(0.756 AU m/L)单宁酸溶液碱性蛋白酶EC 3.4.21.14(0.6 AU/g)工业酶,枯草蛋白酶maxatase LS SORT单宁酸溶液单宁酸溶液尿素-氯化钠-单宁酸溶液尿素-氯化钠-单宁酸溶液经碘缓冲液消毒2、20 mL/L0.024 mL/L2 mL/L10 mL/L5 mL/L15 mL/L1 g/L8 mL/L15 mL/L0.05%0.10%20 mL/L0.223%0.5 g/L1 g/L1 g/L0.75 g/L0.4%尿素+0.3% NaCl溶液+短暂浸入0.1%单宁酸0.4%尿素+0.3% NaCl溶液+短暂浸入0.1%单宁酸2 min80~872 min50~702 min80~872 min87.12 min85.12 min85.215 s47.371 min46.752 min37.0230 s95.330 s93.32 min82~8890 s71.65 min51.02 min47.75 min52.31 min86.52 min80.55~10 min57.750 min99.6Linhart 等[63]Linhart 等[63]Linhart 等[63]Linhart 等[63]Linhart 等[63]Kujawa 等[69]Kujawa 等[69]Kujawa 等[69]Kujawa 等[69]Linhart 等[47]Verreth等[64]DEMSKA-ZAK等[70]DEMSKA-ZAK等[70]Kowtal 等[67]Bouchard等[61]
4 存在问题及展望
抑制鱼卵黏性的活化,或使已经与水化合发生黏附的鱼卵脱黏,是黏性卵人工繁育技术革新最重要的研究方向之一。近年来,在国内外科研人员的不断努力下,被作为研究对象的鱼类愈加广泛,对黏性卵的研究也日渐深入,但仍存在一定局限和不足。本研究中综合国内外学者的最新研究进展,在黏性卵研究内容较为薄弱方面提出了几点尚需加强和拓展的研究内容,以期为今后的研究提供参考。
1) 建立黏性卵黏附程度的统一量化评估标准。目前只能凭借肉眼简单鉴别非黏性卵、弱黏性卵和黏性卵,实际上,不同鱼类黏性卵的黏性程度存在较大差异。卵黏性程度不同,意味着黏性卵的表面超微结构、表面黏性层成分、黏性机制有差异,生产实践中对卵黏性的抑制及针对性脱黏处理方法也不同。因此,建立黏性卵黏附程度的统一量化评估标准是黏性卵研究的基础之一,可以作为今后的一个基础性研究方向。
2) 加强对黏性卵表面结构特别是超微结构的研究。目前,黏性卵表面结构的分类系统尚无学术界较为公认的体系。使用先进的电子显微镜技术对黏性卵做深入的超微结构研究,建立各鱼类鱼卵形态的“数据库”,完善黏性卵表面结构分类体系,这对鱼类的辨识和分类,以及了解鱼类生活的环境因素十分重要。这些工作不仅仅是基础性的学科研究,对提高人工繁育效率和改进工厂化养殖技术也具有重大指导意义。
3) 加强黏性卵表面黏性成分的研究。黏性卵通常具有形态与生化双重黏附机制,目前仅对少数鱼类黏性卵表面黏性成分进行了详尽的描述,且这些黏性蛋白成分的成因,遇水化合反应后对卵表面结构变化的影响等,现有研究成果还有较大的延展空间,可以作为重要的研究方向。特别是对黏性卵表面蛋白质和黏多糖成分的研究,可以指导生产实践,有针对性地使用蛋白酶分解的方法,对鱼卵进行高效且低成本的脱黏处理。
4) 脱黏技术的改进。现有关于黏性卵鱼类的人工繁育孵化技术中,最关键的环节之一是对黏性卵的脱黏。实际生产中还可以考虑使用配方溶液,在黏性卵发生黏附之前抑制黏附,这可能是一种更有效的方法。
[1] RIZZO E,SATO Y,BARRETO B P,et al.Adhesiveness and surface patterns of eggs in neotropical freshwater teleosts[J].Journal of Fish Biology,2002,61(3):615-632.
[2] SATO Y.Reproduction of the Sao Francisco river basin fishes:induction and characterization of patterns[D].Federal University of Sao Carlos,1999.
[3] LAMAS I R.Reproductive characteristics of freshwater Brazilian fishes,with emphasis on the site of spawning[D].Belo Horizonte:Federal University of Minas Gerais,1993.
[4] BRITZ R.Egg surface structure and larval cement glands in nandid and badid fishes with remarks on phylogeny and zoogeography[J].American Museum Novitates,1997,3195:1-17.
[5] RIEHL R,PATZNER R A.Minireview:the modes of egg attachment in teleost fishes[J].Italian Journal of Zoology,1998,65(sup 1):415-420.
[6] MANSOUR N,LAHNSTEINER F,PATZNER R A.Ovarian fluid plays an essential role in attachment of Eurasian perch,Perca fluviatilis eggs[J].Theriogenology,2009,71(4):586-593.
[7] GORBACHEVA L T.On increasing the efficiency of sturgeon hatchery operation of the Don River[M].Trudy VNIRO.V.CXXVII A.Vosproizvodstvo ryb Azovskogo i Kaspiiskogo Moryei,1977:124-131.
[8] BILLARD R,LECOINTRE G.Biology and conservation of sturgeon and paddlefish[J].Reviews in Fish Biology and Fisheries,2000,10(4):355-392.
[9] FROESE R,PAULY D.Fishbase.world wide web electronic publication[EB/OL].(2013-10-20)[2019-12-17]. www.fishbase.org.
[10] VOROB’EVA E I,MARKOV K P.Specific ultra-structural features of eggs of Acipenseridae in relation to reproductive biology and phylogeny[J].Journal of Ichthyology,1999,39:157-169.
[11] KIMURA M R,MUNEHARA H.Spawning substrata are important for breeding habitat selection but do not determine premating reproductive isolation in three sympatric Hexagrammos species[J].Journal of Fish Biology,2011,78(1):112-126.
[12] YOUNGSON A F,PIERTNEY S B,THORLEY J L,et al.Spatial association of nest construction by brown trout Salmo trutta[J].Journal of Fish Biology,2011,78(3):713-725.
[13] SLACK H D,GERVERS F W K,HAMILTON J D.The biology of the powan[M]//SLACK H D.Studies on loch lomond.Glasgow: Univ. Publ.,1957:113-127.
[14] VENTLING-SCHWANK A R,LIVINGSTONE D M.Transport and burial as a cause of whitefish (Coregonus sp.) egg mortality in a Eutrophic Lake[J].Canadian Journal of Fisheries and Aquatic Sciences,1994,51(9):1908-1919.
[15] CHERR G N,CLARK W H.Fine structure of the envelope and micropyles in the eggs of the white sturgeon,Acipenser transmontanus[J].Development,Growth and Differentiation,1982,24(4):341-352.
[16] KUDO S.Enzymatic basis for protection of fish embryos by the fertilization envelope[J].Experientia,1992,48(3):277-281.
[17] YAMAGAMI K,HAMAZAKI T S,YASUMASU S,et al.Molecular and cellular basis of formation,hardening,and breakdown of the egg envelope in fish[J].International Review of Cytology,1992,136:51-92.
[18] BROOKS S,TYLER C R,SUMPTER J P.Egg quality in fish:what makes a good egg?[J]. Reviews in Fish Biology and Fisheries,1997,7(4):387-416.
[19] MANSOUR N,LAHNSTEINER F,PATZNER R A.Physiological and biochemical investigations on egg stickiness in common carp[J].Animal Reproduction Science,2009,114(1/2/3):256-268.
[20] PAXTON C G M,WILLOUGHBY L G.Resistance of perch eggs to attack by aquatic fungi[J].Journal of Fish Biology,2000,57(3):562-570.
![]() M.Formation and structure of egg envelopes in Russian sturgeon Acipenser gueldenstaedtii (Acipenseriformes: Acipenseridae)[J].Journal of Fish Biology,2010,76(3):694-706.
M.Formation and structure of egg envelopes in Russian sturgeon Acipenser gueldenstaedtii (Acipenseriformes: Acipenseridae)[J].Journal of Fish Biology,2010,76(3):694-706.
[22] ESMAEILI H R,JOHAL M S.Ultrastructural features of the egg envelope of silver carp,Hypophthalmichthys molitrix (Osteichthyes,Cyprinidae)[J].Environmental Biology of Fishes,2005,72(4):373-377.
[23] HUYSENTRUYT F,ADRIAENS D.Adhesive structures in the eggs of Corydoras aeneus (Gill,1858;Callichthyidae)[J].Journal of Fish Biology,2005,66(3):871-876.
[24] ARUKWE A,GOKSØYR A.Eggshell and egg yolk proteins in fish:hepatic proteins for the next generation:oogenetic,population,and evolutionary implications of endocrine disruption[J].Comparative Hepatology,2003,2:4.
[25] STEHR C M,HAWKES J W.The comparative ultrastructure of the egg membrane and associated pore structures in the starry flounder,Platichthys stellatus (Pallas),and pink salmon,Oncorhynchus gorbuscha (Walbaum)[J].Cell and Tissue Research,1979,202(3):347-356.
[26] BAZZOLI N,RIZZO E.A comparative cytological and cytochemical study of the oogenesis in ten Brazilian teleost fish species[J].European Archives of Biology,1990,101(4):399-410.
[27] MURATA K,SUGIYAMA H,YASUMASU S,et al.Cloning of cDNA and estrogen-induced hepatic gene expression for choriogenin H,a precursor protein of the fish egg envelope (chorion)[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(5):2050-2055.
[28] BAZZOLI N.Oogenesis in Neotropical freshwater teleosts[D].Brazil:Federal University of Minas Gerais,1992.
[29] LAALE H W.The perivitelline space and egg envelopes of bony fishes:a review[J].Copeia, 1980(2):210-226.
[30] MITO S.Fish egg[J].Gekkan Kaiyo-Kagaku,1979,11:126-130.
[31] KANOH Y.On the eggs of Clupea harengus L.[J].Saishu-to-shiiku,1952,11:162-164.
[32] YAMADA J.The normal developmental stages of the pond smelt,Hypomesus olidus (Pallsa)[J].Bulletin of the Faculty of Fisheries Hokkaido Universitu, 1963,14:121-126.
[33] SHAW E S.The embryology of the sergeant major,Abudufduf saxatalis[J].Copeia,1955(2):85-89.
[34] TSUKAHARA J.Ultrastructural study on the attaching filaments and villi of the oocyte of Oryzias latipes during oogenesis[J].Development,Growth and Differentiation,1971,13(3):173-180.
[35] KUCHNOW K P,SCOOT J R.Ultrastructure of the chorion and its micropyle apparatus in the mature Fundulus heteroclitus (Walbaum) ovum[J].Journal of Fish Biology,1977,10(3):197-201.
[36] DOTSU Y.Eggs,fry and larvae of Gobioidei fish[J].Gekkan Kaiyo-Kagaku,1979,11:111-116.
[37] SHELTON W L.Fate of the follicular epithelium in Dorosoma petenense (Pisces: Clupeidae)[J].Copeia, 1978(2):237-244.
[38] LAALE H W.The perivitelline space and egg envelopes of bony fishes:a review[J].Copeia,1980(2):210-226.
[39] MANSUETI A J.Early development of yellow peach,Perca flavescens[J].Chesapeake Science,1964,5:46-66.
[40] MUNEHARA H,MISHIMA S.Embryonic development,larve and juvenile of elkhorn sculpin,Alcichthys alcicornis[J].Japanese Journal of Ichthyology,1986,33(1):46-50.
[41] OHTA H.Electron microscopic study on adhesive material of Pacific herring (Clupea pallasi) eggs[J].Japanese Journal of Ichthyology,1984,30(4):404-411.
[42] PATZNER R A,GLECHNER R.Attaching structures in eggs of native fishes[J].Limnologica,1996,26(2):179-182.
[43] RIEHL R.Structure of oocytes and egg envelopes in oviparous teleosts-an overview[J].Acta Biologica Benrodis,1991,3:27-65.
[44] CHANG Y S,HUANG F L.Fibroin-like substance is a major component of the outer layer of fertilization envelope via which carp egg adheres to the substratum[J].Molecular Reproduction and Development,2002,62(3):397-406.
[45] SHELTON W L.Fate of the follicular epithelium in Dorosoma petenense(Pisces: Clupeidae)[J].Copeia, 1978(2):237-244.
[46] DETTLAFF T A,GINSBURG A S,SCHMALHAUSEN O I.Sturgeon fishes:developmental biology and aquaculture[M]. Berlin:Springer-Verlag,1993.
[47] LINHART O,KUDO S.Surface ultrastructure of paddlefish eggs before and after fertilization[J].Journal of Fish Biology,1997,51(3):573-582.
[48] PSENICKA M,RODINA M,LINHART O.Ultrastructural study on the fertilisation process in sturgeon (Acipenser),function of acrosome and prevention of polyspermy[J].Animal Reproduction Science,2010,117(1/2):147-154.
[49] GINZBURG A S.Fertilization in fishes and the problem of polyspermy[M].Jerusalem:Israel Program for Scientific Translations Ltd.,1972.
[50] MARKOV K P.Scanning electron microscope study of the microstructure of the egg membrane in the Russian sturgeon (Acipenser gueldenstaedtii)[J].Journal of Ichthyology,1975,15:739-749.
[51] ALTUF’YEV Y V,VLASENKO A D.Analysis of the state of the neurohypophysis and gonads of the common sturgeon Acipenser gueldenstaedti,and the Beluga,Huso huso,below the dam of the Volgograd hydroelectric power station and in the “Mashkina Kosa” over wintering depression[J].Journal of Ichthyology,1980,20:95-103.
[52] DEBUS L,WINKLER M,BILLARD R.Structure of micropyle surface on oocytes and caviar grains in sturgeons[J].International Review of Hydrobiology,2002,87(5/6):585-603.
[53] DEBUS L,WINKLER M,BILLARD R.Ultrastructure of the oocyte envelopes of some Eurasian acipenserids[J].Journal of Applied Ichthyology,2008,24(sup 1):57-64.
[54] VOROB’EVA E I,MARKOV K P.Specific ultra-structural features of eggs of Acipenseridae in relation to reproductive biology and phylogeny[J].Journal of Ichthyology,1999,39:157-169.
[55] LE MENN F,PELISSERO C.Histological and ultrastructural studies of oogenesis of the Siberian sturgeon Acipenser baerii[M]//WILLIOT P.Acipenser.Bordeaux,France:Cemagref Publications,1991:113-127.
[56] 罗俊烈.两种脱粘剂脱粘孵化效果的比较[J].水产与教育,1976(2):16-18.
[57] MONACO G,DOROSHOV S I.Mechanical de-adhesion and incubation of white sturgeon eggs (Acipenser transmontanus Richardson) in jar incubators[J].Aquaculture,1983,35:117-123.
[58] CHEBANOV M S,GALICH E V.Sturgeon hatchery manual[M].Rome:Food and Agriculture Organization of the United Nations,2013.
[59] 陈力,肖国华,高小田.白斑狗鱼受精卵脱粘方法试验研究[J].河北渔业,2009(9):23.
[60] 郭长江,赵文,石振广,等.达氏鳇养殖群体的胚胎发育研究[J].大连海洋大学学报,2016,31(6):589-597.
[61] BOUCHARD Ⅲ H J,ALOISI D B.Investigations in concurrent disinfection and de-adhesion of lake sturgeon eggs[J].North American Journal of Aquaculture,2002,64(3):212-216.
[62] NEITALI B K,AMIRI B M,KALBASSI M R,et al.A comparative study on the effect of trypsin treatment and clay method on jelly coat removal of the Persian sturgeon (Acipenser persicus) ova[J].Journal of Fisheries,2014,67(1):109-122.
[63] LINHART O,RODINA M,GELA D,et al.Improvement of common carp artificial reproduction using enzyme for elimination of egg stickiness[J].Aquatic Living Resources,2003,16(5):450-456.
[64] VERRETH J,MEYLING A G.The use of an industrial enzyme,maxatase,to eliminate the adhesiveness of Clarias gariepinus (Burchell) egg[M]//DE PAUW N.Aquaculture.Bredene,Belgium:European Aquaculture Society,1989.
[65] 李志,周莉,张君,等.黏性卵鱼类受精卵一种快速高效的显微注射方法[J].水生生物学报,2016,40(1):76-82
[66] WOYNAROVICH E.Hatching of carp eggs in Zuger glasses and rearing of carp larvae until an age of 10 days[J].Bamidgeh,1962,14(2):38-46.
[67] KOWTAL G V,CLARK W H,CHERR G N. Elimination of adhesiveness in eggs from the white sturgeon,Acipenser transmontanus:chemical treatment of fertilized eggs[J].Aquaculture,1986,55(2):139-143.
[68] CHEBANOV M S,GALICH E V,CHMYR Y.Sturgeon breeding and rearing handbook[M].Moscow,Russia:FGNU “Rosinformagrotekh”,2004:136.
[69] KUJAWA R,KUCHARCZYK D,MAMCARZ A.The effect of tannin concentration and egg unsticking time on the hatching success of tench Tinca tinca (L.) larvae[J].Reviews in Fish Biology and Fisheries,2010,20(3):339-343.
![]()
![]() Z,ROSZUK J.The use of tannic acid to remove adhesiveness from pikeperch,Sander lucioperca,eggs[J].Aquaculture Research,2005,36(14):1458-1464.
Z,ROSZUK J.The use of tannic acid to remove adhesiveness from pikeperch,Sander lucioperca,eggs[J].Aquaculture Research,2005,36(14):1458-1464.
[71] 苏建国,杨春荣.团头鲂的繁殖技术[J].畜牧兽医杂志,2000(4):46-49.
[72] 杨雪军,王邢艳,冯晓婷,等.基于不同人工鱼巢研究黄颡鱼的产卵偏好性[J].中国水产科学,2020,27(2):213-223.
[73] 张胜利.芒萁鱼巢着卵及卵孵化效果对比试验[J].淡水渔业,2002,32(6):20-21.
[74] 刑克智,蔡中华,陈成勋,等.粘性卵鱼苗孵化方法:200410019940.1[P].2005-03-16.
[75] 郭文,潘雷,胡发文,等.六线鱼人工授精和孵化方法:201010103983.X[P].2010.07.14.
[76] 长江水产研究所育种室杂交组.淡水鱼类粘性卵脱粘孵化的研究[J].淡水渔业科技动态,1973(9):13-17.