茎柔鱼Dosidicus gigas广泛分布于东太平洋,是重要的大洋性经济头足类之一,其既是东太平洋最重要的捕捞对象,同时也在中上层海洋生态系统中扮演着关键角色[1]。作为东太平洋最重要的渔业资源之一,随着其资源不断被开发,国内外学者对其关注度也在不断攀升。20世纪90年代以来,各国学者对茎柔鱼的年龄、生长、种群、繁殖、渔场及资源等方面做了大量研究工作[1-5],但对茎柔鱼摄食生态学研究相对较少。
在生态系统研究中,由于构成消费者组织成分的稳定同位素与其食物相关,故稳定同位素已成为一种有效研究生态系统中物质和能量流动的方法,为研究海洋生物营养状况和迁徙模式提供了重要途径[6-7]。碳稳定同位素比(δ13C)从食物到消费者变化较小,但是在基础的生产者中存在差异,因此,其扮演了碳源的示踪者角色[8]。氮稳定同位素比(δ15N)从食物到消费者的营养富集度为3.0‰~4.0‰,可用来代表消费者的营养级[8-9]。头足类软组织中含有较多的蛋白质和脂类,具有丰富的碳氮元素,是稳定同位素分析常用材料,对这些组织中碳氮稳定同位素的分析是研究海洋生物洄游路径和栖息环境的重要手段,但是脂类的存在会导致稳定同位素测定产生一些偏差,而由此造成的影响在头足类中的研究较少[10]。另外,生物体不同组织间周转率存在差异,即在消费者组织中反映其食物来源稳定同位素值所需的时间不同,因此,研究稳定同位素含量在不同组织中的差异非常重要[11-13]。本研究中,通过比较去脂前后赤道茎柔鱼软组织中碳氮稳定同位素的差异,从而分析了脂类对软组织稳定同位素含量的影响,旨在为进一步开展茎柔鱼的摄食生态研究提供基础资料。
1 材料与方法
1.1 材料
2017年12月—2018年2月从10个站位(图1)共采集茎柔鱼样品500多尾,随机挑取62尾(胴长为195~324 mm,表1)分别提取60个胴部肌肉样品、18个性腺样品和54个消化腺样品(-17 ℃下冷冻保存),用于软组织稳定同位素分析,由于性成熟度较低,故性腺样品收集较少。
表1 样本基础信息
Tab.1 Sample basic information
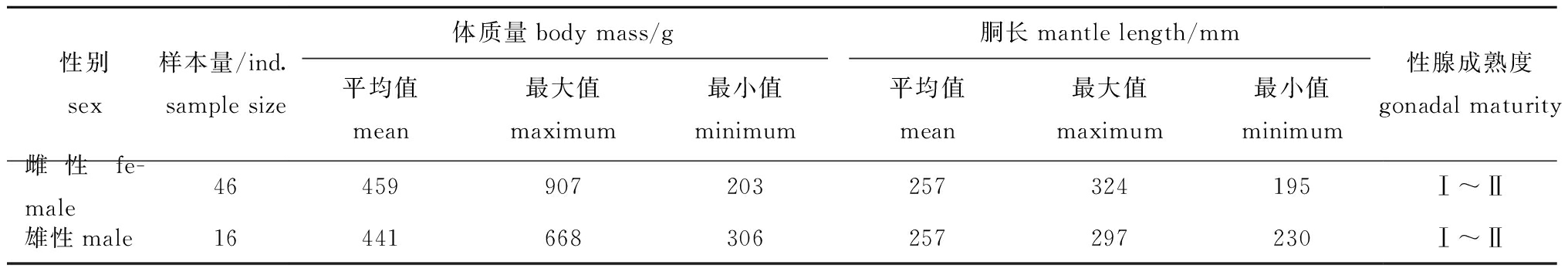
性别sex样本量/ind.sample size体质量body mass/g胴长mantle length/mm平均值mean最大值maximum最小值minimum平均值mean最大值maximum最小值minimum性腺成熟度gonadal maturity雌性fe-male46459907203257324195Ⅰ~Ⅱ雄性male16441668306257297230Ⅰ~Ⅱ
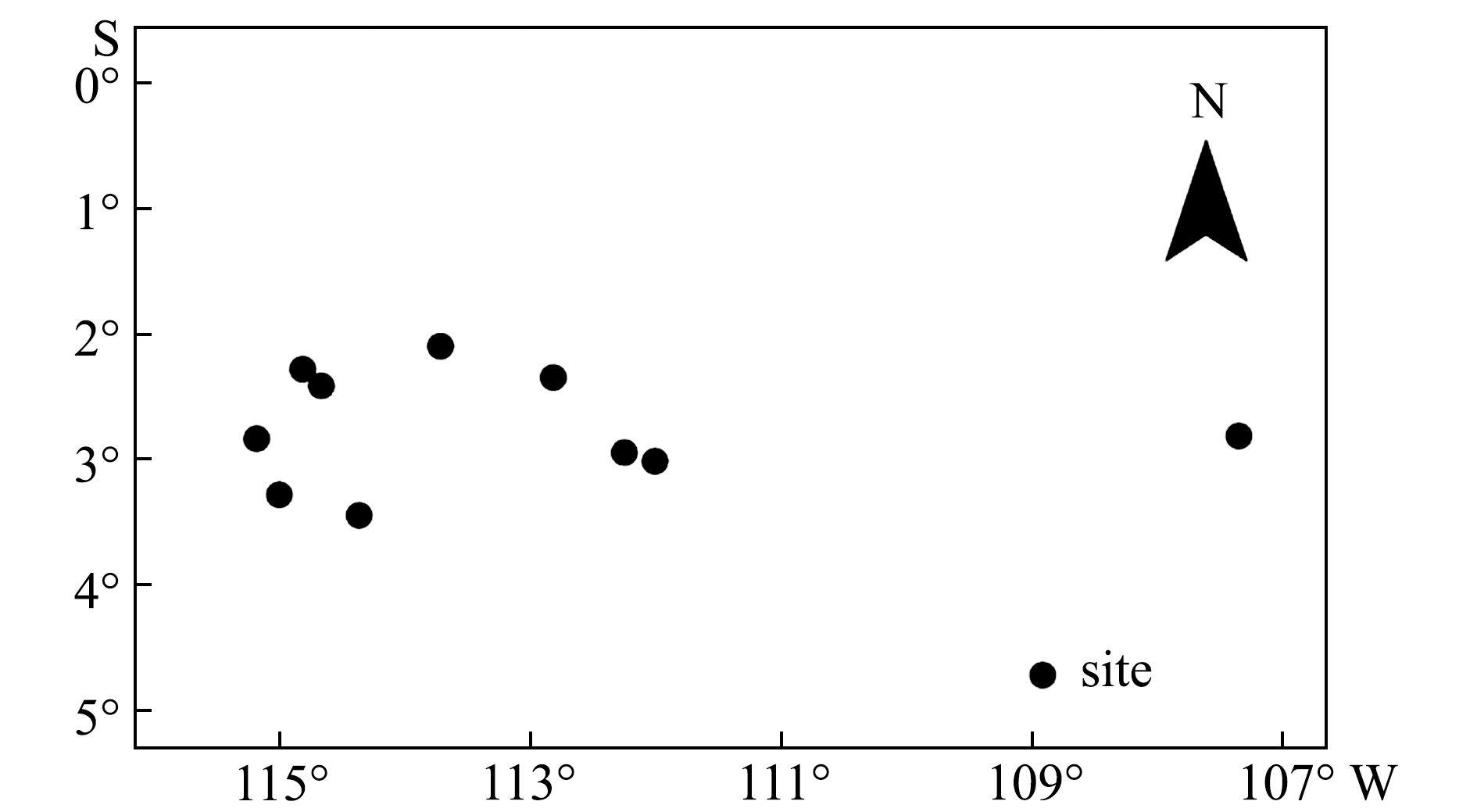
图1 茎柔鱼样品采集站位
Fig.1 Sampling stations of jumbo flying squid Dosidicus gigas
1.2 方法
1.2.1 脂类去除 将软组织样品用超纯水清洗后放入冷冻干燥机内冷冻干燥(-55 ℃,干燥24 h以上),干燥后的样品用MM400混合型球磨仪(RetschGmbH,Haan,Germany)研磨1.5 min至粉末;称取样品粉末200 mg加入12 mL三氯甲烷-甲醇溶液中(体积比为2∶1)浸泡24 h,以4 000 r/min离心3 min,取出上清液;再次加入3 mL三氯甲烷-甲醇溶液中(体积比为2∶1),震荡2 min混匀,以4 000 r/min离心3 min,取出上清液,此过程再重复一次;最后将取出的上清液样品放入烘箱中(65 ℃)烘干3 h,烘干后的样品再次用球磨仪研磨至粉末。
1.2.2 稳定同位素的测定 称取1.0~1.5 mg样品粉末用铝箔包被后送入仪器,使用ISOPRIME 100稳定同位素质谱仪(Isoprime Corporation,Cheadle,UK)和Vario ISOTOPE cube元素分析仪(Elementar Analysensysteme GmbH,Hanau,Germany)测定碳氮稳定同位素。计算公式为
δX=(Rsample/Rstandard-1)×103。
其中:X为13C或15N;R为相应的比例,如13C/12C或15N/ 14N;δ为同位素组成的代名词,如δ13C、δ15N分别为碳和氮稳定同位素相对于各自标准物的比值,可代表碳氮稳定同位素值。
1.3 数据处理
试验数据利用SPSS 20.0软件进行统计检验,采用t检验分析去脂前后各软组织碳氮稳定同位素差异,用单因素方差分析(One-way ANOVA)对软组织间碳氮稳定同位素进行差异性分析和Post-hoc检验,利用Origin 9.1软件进行绘图分析。
2 结果与分析
2.1 脂类对碳氮稳定同位素的影响
配对t检验显示,肌肉、性腺、消化腺3种软组织中,除消化腺中δ15N去脂前后无显著性差异(P>0.05)外,其余软组织去脂前后δ13C、δ15N和C/N均存在显著性差异(P<0.05)(表2,图2)。
肌肉中,δ13Cafter与δ13Cbefore相比升高0.70‰~1.82‰,平均升高1.13‰;δ15Nafter与δ15Nbefore 相比升高0.48‰~1.59‰,平均升高1.02‰;C/Nafter与C/Nbefore 相比降低0.11~0.31,平均降低0.21。线性回归分析表明,δ13Cbefore与δ13Cafter、δ15Nbefore与δ15Nafter、C/Nafter与C/Nbefore 间均存在显著正相关 (P<0.05) (图3)。
性腺中,δ13Cafter与δ13Cbefore 相比升高0.70‰~2.44‰,平均升高1.38‰;δ15Nafter与δ15Nbefore相比升高-0.18‰~2.34‰,平均升高0.41‰;C/Nafter与C/Nbefore 相比降低0.21~0.86,平均降低0.43。线性回归分析表明:δ13Cbefore与 δ13Cafter、C/Nafter与C/Nbefore均无显著相关性(P>0.05),而δ15Nbefore 与δ15Nafter存在显著正相关(P<0.05)(图3)。
消化腺中,δ13Cafter与δ13Cbefore 相比升高0.84‰~2.23‰,平均升高1.27‰;δ15Nafter与δ15Nbefore 相比升高-0.75‰~0.99‰,平均升高0.39‰;C/Nafter与C/Nbefore 相比降低0.20~0.82,平均降低0.37。线性回归分析表明:δ13Cbefore与δ13Cafter、δ15Nbefore 与δ15Nafter均存在显著正相关 (P<0.05) ,而C/Nafter与C/Nbefore无显著相关性(P>0.05)(图3)。
表2 脂类去除前后稳定同位素值
Tab.2 Stable isotope values before and after lipid removal
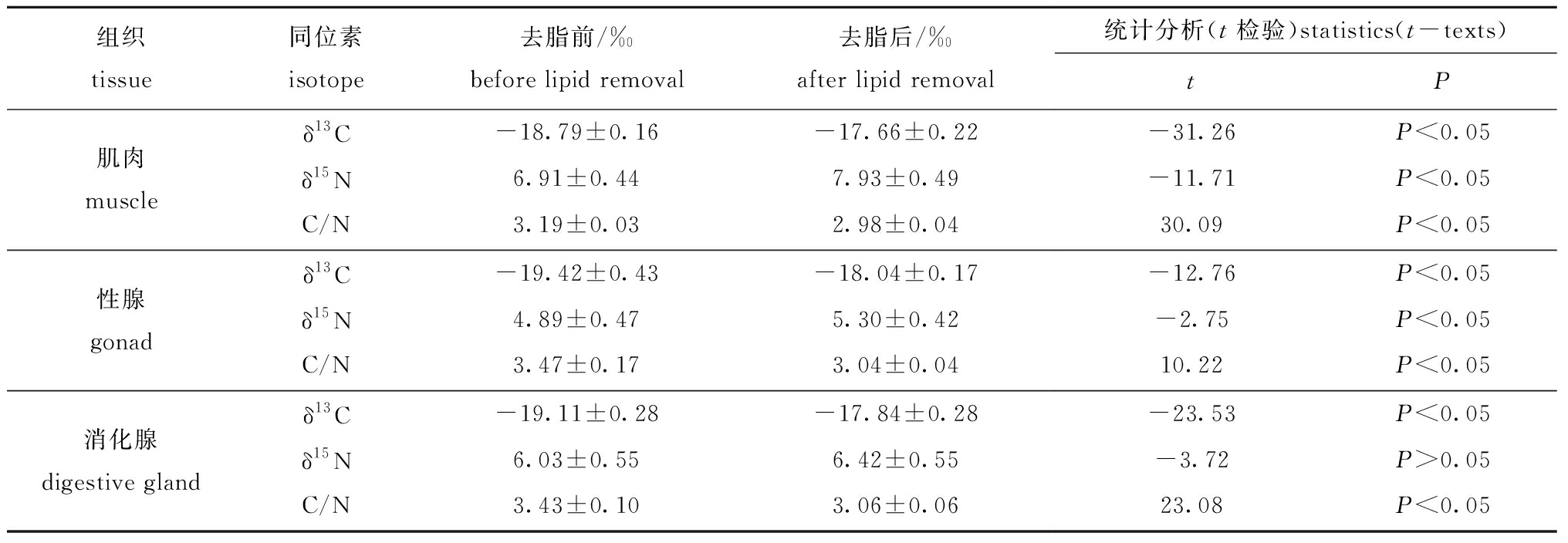
组织tissue同位素isotope去脂前/‰before lipid removal去脂后/‰after lipid removal统计分析(t检验)statistics(t-texts)tP肌肉muscleδ13C-18.79±0.16-17.66±0.22-31.26P<0.05δ15N6.91±0.447.93±0.49-11.71P<0.05C/N3.19±0.032.98±0.0430.09P<0.05性腺gonadδ13C-19.42±0.43-18.04±0.17-12.76P<0.05δ15N4.89±0.475.30±0.42-2.75P<0.05C/N3.47±0.173.04±0.0410.22P<0.05消化腺digestive glandδ13C-19.11±0.28-17.84±0.28-23.53P<0.05δ15N6.03±0.556.42±0.55-3.72P>0.05C/N3.43±0.103.06±0.0623.08P<0.05
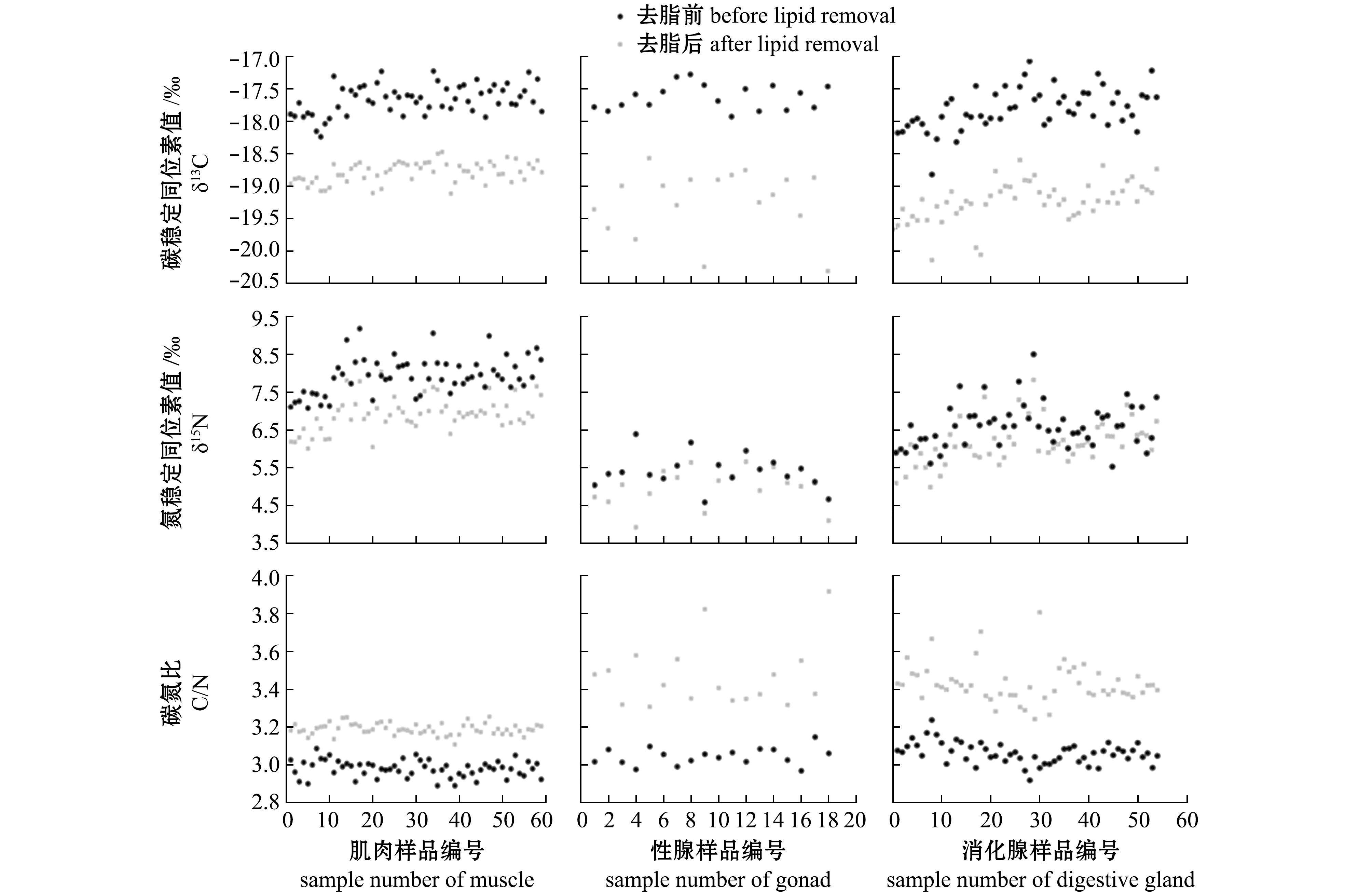
图2 3种组织脂类去除前后稳定同位素值
Fig.2 Stable isotope values in three tissues before and after removal of lipid
2.2 稳定同位素组织间差异
3种不同的软组织间δ13C、δ15N、C/N在脂类去除前或去脂后均具有显著性差异(P<0.05)。不同组织去脂前或去脂后δ13Cbefore依次均为肌肉>消化腺>性腺;去脂前或去脂后δ15Nbefore依次均为肌肉>消化腺>性腺;去脂前C/Nbefore依次为性腺>消化腺>肌肉,去脂后C/Nafter依次为消化腺>性腺>肌肉。去脂后3种组织间碳氮稳定同位素有明显的差异,3种组织的δ13C值范围相较于δ15N变化范围较窄(图4)。Post-hoc检验结果显示,δ13C、δ15N去脂前或去脂后两两组织间均有显著性差异(P<0.05);C/N值除去脂前肌肉与性腺间、去脂后性腺与消化腺间无显著性差异(P>0.05)外,其余两
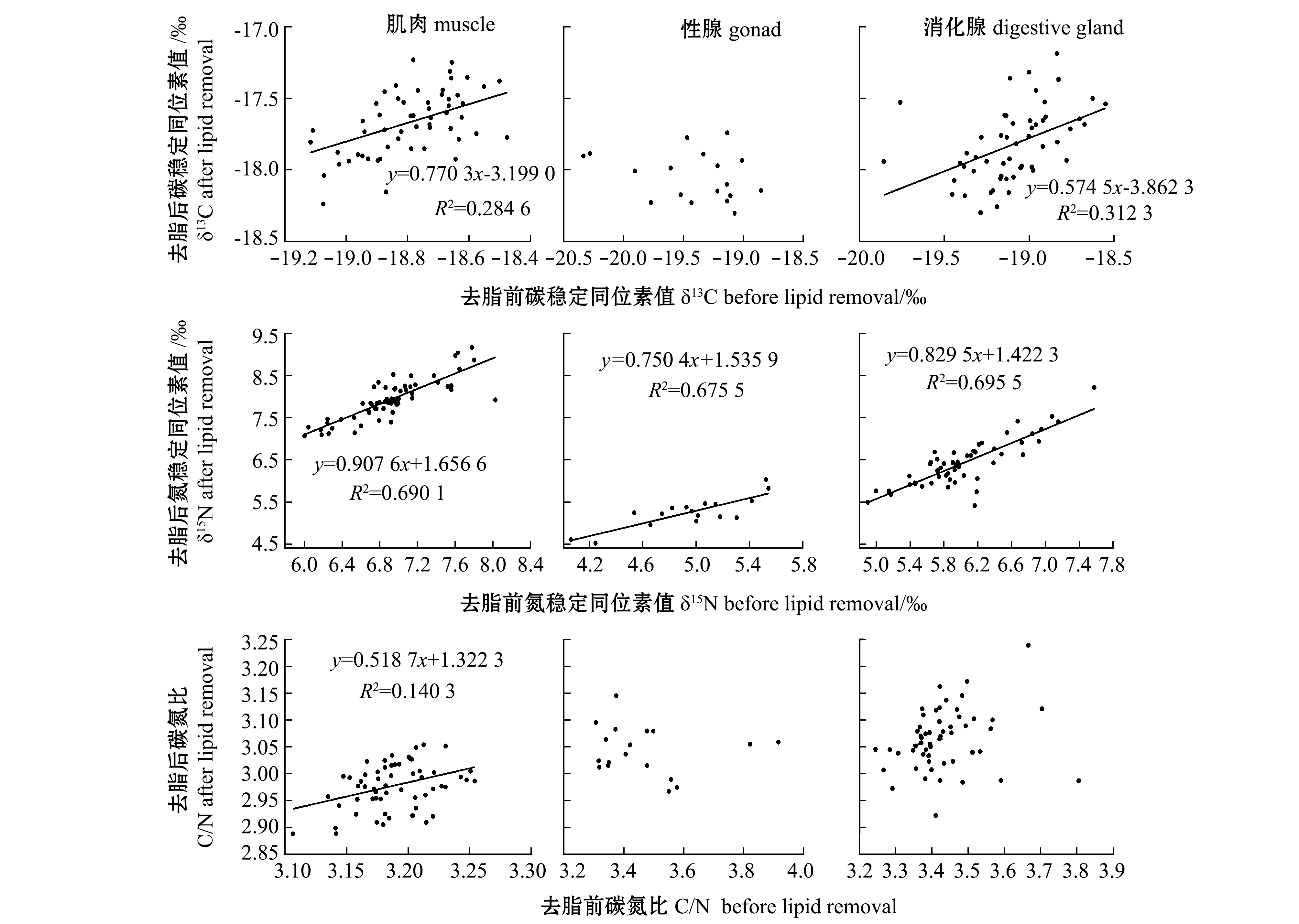
图3 3种组织脂类去除前后稳定同位素相关性分析
Fig.3 Correlation analysis of stable isotopes in three tissues before and after the lipid removal
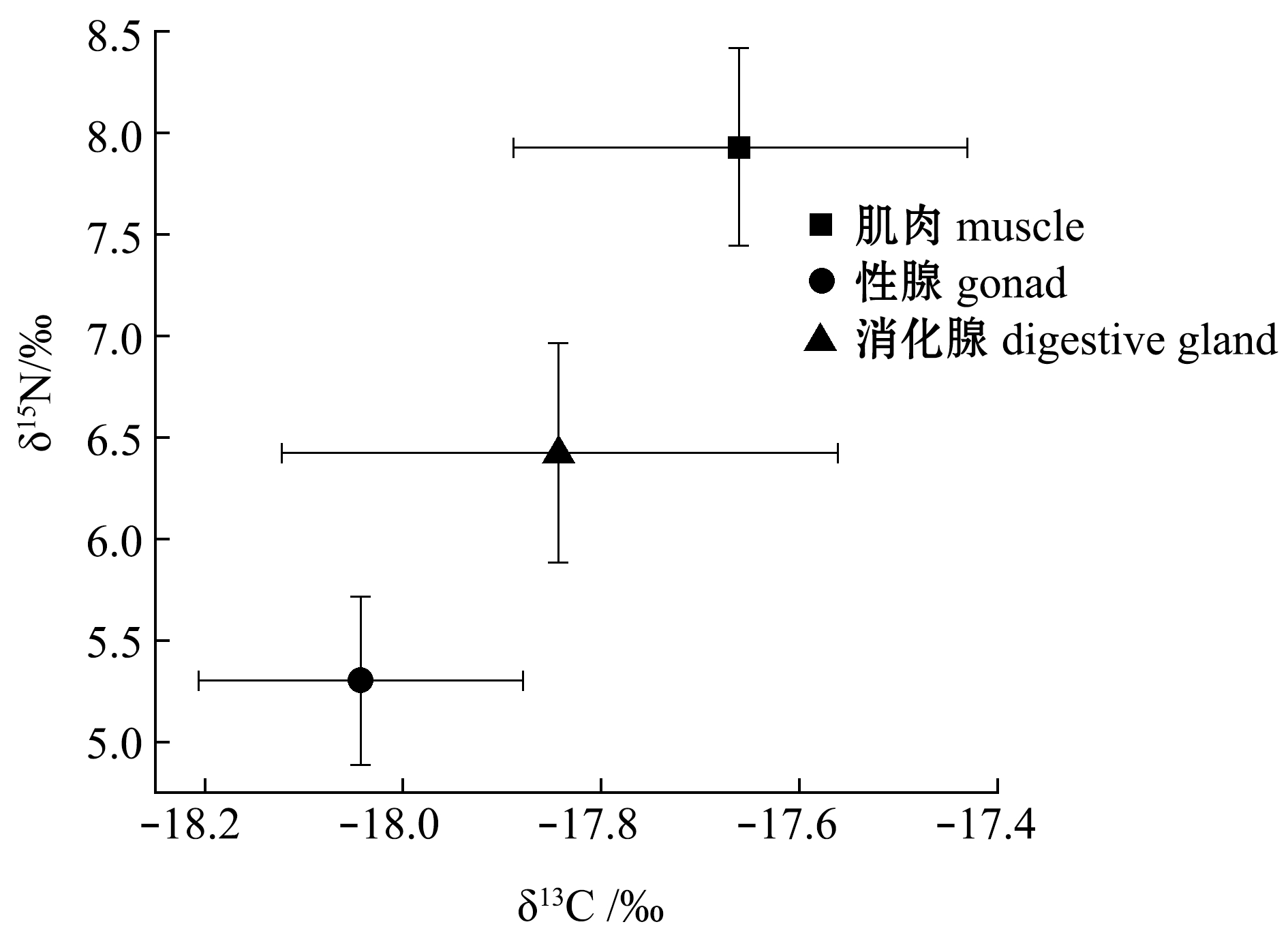
图4 脂类去除后不同组织δ13C、δ15N营养生态位图
Fig.4 Trophic ecology of δ13C and δ15N in different tissues after lipid removal
组织间均有显著性差异(P<0.05)。
3 讨论
3.1 脂类去除对碳稳定同位素的影响
由于脂类中的δ13C含量比蛋白质和碳水化合物中的含量小,所以脂类含量较高的组织中δ13C含量更低,因此,脂类去除之后会导致δ13C值上升[14-15]。本研究中,去脂后的茎柔鱼肌肉、性腺、消化腺中δ13C均明显增加,去脂后δ13C在肌肉组织、性腺、消化腺等3种组织中平均分别提升了1.13‰、1.37‰、1.27‰,由此也可推测,茎柔鱼性腺中脂类含量较高,消化腺次之,肌肉中最小。Ruiz-Cooley等[10]对圆鳍枪乌贼Lollinguncula brevis和普氏枪乌贼Loligo pleii研究发现,去脂后δ13C分别升高了1.6‰和2.7‰,并指出δ13C变化范围与物种、个体大小及组织中的脂类含量有关。本研究中δ13C的变化也体现了组织间稳定同位素的差异,与上述文献结果一致。脂类的存在导致δ13C测定值产生偏差,从而影响了对消费者食物来源的分析,因此,利用稳定同位素技术对头足类软组织进行食性分析时应先进行脂类去除。
3.2 脂类去除对氮稳定同位素的影响
Bodin等[15]、Yurkowski 等[16]研究表明,使用未去脂样品的δ15N值计算茎柔鱼的营养级将会偏低,这是因为脂蛋白化合物具有较低的 δ15N,其被抽提后会引起样品中δ15N 升高,因而要尽量使用去脂后的δ15N进行分析。本研究中发现,脂类去除后茎柔鱼肌肉、性腺中的δ15N 显著升高,而消化腺中δ15N 也有上升但并不显著,δ15N在肌肉、性腺、消化腺等3种组织中平均分别提升了1.02‰、0.41‰、0.39‰,再次证明了不去脂会影响茎柔鱼营养生态位的计算。不同组织器官的营养成分和结构不同,从而导致δ15N 值在不同组织器官间存在差异[17-19],本研究中肌肉、性腺、消化腺δ15N值具有显著性差异也符合这一结论。Post等[20]在研究稳定同位素技术是否需要考虑脂类影响时发现,C/N<3.5 时不需要进行脂类的去除。而后又有研究发现,虽然C/N 值较小(C/N<3.5),但脂类去除后茎柔鱼δ13C升高范围较大(>0.65‰),脂类含量存在较大差异的组织仍然可能有相近的C/N 值,所以C/N 值可能不适合作为衡量茎柔鱼脂类含量的标准[11]。本研究中,肌肉、性腺、消化腺中C/N均小于3.5,但是脂类去除后3种组织中δ13C、δ15N均有显著升高,这与贡艺等[21]对北太平洋柔鱼肌肉分析结果一致,故在C/N均小于3.5的条件下仍需进行去脂处理。
3.3 不同组织间稳定同位素差异
研究表明,生物体不同组织间周转率存在差异[22],头足类肌肉中稳定同位素转化率较慢,一般为几周或者更长,因此,肌肉的稳定同位素比值仅能反映出机体几周或数月前的摄食情况,而消化腺和性腺中的稳定同位素转化率较快,可表征机体几天内的摄食情况[23-24],这也是本研究不同组织间稳定同位素差异的原因之一。因此,可以根据不同组织的δ13C、δ15N周转率的差异,从不同时间尺度来分析头足类的摄食变化。
本研究中对茎柔鱼不同组织器官中稳定同位素的分析,揭示了δ13C、δ15N 值在不同组织器官的分布特征及脂类去除对稳定同位素分析的影响,为稳定同位素技术在头足类生态学中的研究供了重要基础。尽管如此,本研究中也存在不足之处,例如性腺样本较少且大部分样品性成熟度较低,样品覆盖范围较小,不同体质量大小的样本个数分布不均,个体大小不同对其稳定同位素的影响仍需后期继续研究。在今后的研究中需要进一步补充样品量,进而分析软组织中稳定同位素值在性别上的差异等。
4 结论
1) 脂类去除前后δ13C、δ15N、C/N在肌肉、消化腺和性腺等3种软组织间均具有显著性差异,消化腺中δ15N除外。
2) 不同组织稳定同位素含量比较显示,脂类去除前或去脂后,δ13C与δ15N值均依次为肌肉>消化腺>性腺;C/Nbefore依次为性腺>消化腺>肌肉,C/Nafter依次为消化腺>性腺>肌肉。
[1] GILLY W F,MARKAIDA U.Perspectives on Dosidicus gigas in a changing world[M]//OLSON R J,YOUNG J W.The role of squid in open ocean ecosystems.Honolulu,Hawaii:Global Ocean Ecosyst. Dyn.,2006.
[2] NEV REZ-MART
REZ-MART NEZ M O,HERN
NEZ M O,HERN NDEZ-HERRERA A,MORALES-BOJ
NDEZ-HERRERA A,MORALES-BOJ RQUEZ E,et al.Biomass and distribution of the jumbo squid (Dosidicus gigas;d’Orbigny,1835) in the Gulf of California,Mexico[J].Fisheries Research,2000,49(2):129-140.
RQUEZ E,et al.Biomass and distribution of the jumbo squid (Dosidicus gigas;d’Orbigny,1835) in the Gulf of California,Mexico[J].Fisheries Research,2000,49(2):129-140.
[3] KEYL F,ARGÜELLES J,MARI TEGUI L,et al.A hypothesis on range expansion and spatio-temporal shifts in size-at-maturity of jumbo squid (Dosidicus gigas) in the eastern Pacific Ocean[J].California Cooperative Oceanic Fisheries Investigations Reports,2008,49:119-128.
TEGUI L,et al.A hypothesis on range expansion and spatio-temporal shifts in size-at-maturity of jumbo squid (Dosidicus gigas) in the eastern Pacific Ocean[J].California Cooperative Oceanic Fisheries Investigations Reports,2008,49:119-128.
[4] 胡振明,陈新军.秘鲁外海茎柔鱼渔场分布与表温及表温距平值关系的初步探讨[J].海洋湖沼通报,2008(4):56-62.
[5] LIU B L,CHEN X J,CHEN Y,et al.Age,maturation,and population structure of the Humboldt squid Dosidicus gigas off the Peruvian exclusive economic zones[J].Chinese Journal of Oceanology and Limnology,2013,31(1):81-91.
[6] FRY B,SHERR E B.δ13C measurements as indicators of carbon flow in marine and freshwater ecosystems[J].Contribution in Marine Science,1984,27:13-47.
[7] DENIRO M J,EPSTEIN S.Influence of diet on the distribution of carbon isotopes in animals[J].Geochimica et Cosmochimica Acta,1978,42(5):495-506.
[8] ZANDEN M J V,RASMUSSEN J B.Variation in δ15N and δ13C trophic fractionation:implications for aquatic food web studies[J].Limnology and Oceanography,2001,46(8):2061-2066.
[9] MINAGAWA M,WADA E.Stepwise enrichment of δ15N along food chains:further evidence and the relation between δ15N and animal age[J].Geochimica et Cosmochimica Acta,1984,48(5):1135-1140.
[10] RUIZ-COOLEY R I,GARCIA K Y,HETHERINGTON E D.Effects of lipid removal and preservatives on carbon and nitrogen stable isotope ratios of squid tissues:implications for ecological studies[J].Journal of Experimental Marine Biology and Ecology,2011,407(1):101-107.
[11] HESSLEIN R H,HALLARD K A,RAMLAL P.Replacement of sulfur,carbon,and nitrogen in tissue of growing broad whitefish (Coregonus nasus) in response to a change in diet traced by δ34S,δ13C,and δ15N[J].Canadian Journal of Fisheries and Aquatic Sciences,1993,50(10):1267-1272.
[12] MACAVOY S E,MACKO S A,GARMAN G C.Isotopic turnover in aquatic predators:quantifying the exploitation of migratory prey[J].Canadian Journal of Fisheries and Aquatic Sciences,2001,58(5):923-932.
[13] 林静远,刘必林,陈新军.头足类角质颚微化学及其在渔业生态学中的应用研究进展[J].大连海洋大学学报,2019,34(2):280-287.
[14] 徐亮,宁加佳,王雪辉,等.脂类去除对南海鸢乌贼肌肉碳、氮稳定同位素分析的影响[J].南方水产科学,2018,14(4):88-93.
[15] BODIN N,LE LOC’H F,HILY C.Effect of lipid removal on carbon and nitrogen stable isotope ratios in crustacean tissues[J].Journal of Experimental Marine Biology and Ecology,2007,341(2):168-175.
[16] YURKOWSKI D J,HUSSEY N E,SEMENIUK C,et al.Effects of lipid extraction and the utility of lipid normalization models on δ13C and δ15N values in Arctic marine mammal tissues[J].Polar Biology,2015,38(2):131-143.
[17] SOTIROPOULOS M A,TONN W M,WASSENAAR L I.Effects of lipid extraction on stable carbon and nitrogen isotope analyses of fish tissues:potential consequences for food web studies[J].Ecology of Freshwater Fish,2004,13(3):155-160.
[18] SWEETING C J,POLUNIN N V C,JENNINGS S.Tissue and fixative dependent shifts of δ13C and δ15N in preserved ecological material[J].Rapid Communications in Mass Spectrometry,2004,18(21):2587-2592.
[19] 谭鲁玉,王玉堃,唐学玺,等.黄海小黄鱼不同组织中δ15N的分布特征及其生态学意义[J].渔业科学进展,2018,39(3):30-35.
[20] POST D M,LAYMAN C A,ARRINGTON D A,et al.Getting to the fat of the matter:models,methods and assumptions for dealing with lipids in stable isotope analyses[J].Oecologia,2007,152(1):179-189.
[21] 贡艺,陈新军,高春霞,等.脂类抽提对北太平洋柔鱼肌肉碳、氮稳定同位素测定结果的影响[J].应用生态学报,2014,25(11):3349-3356.
[22] ARGÜELLES J,LORRAIN A,CHEREL Y,et al.Tracking habitat and resource use for the jumbo squid Dosidicus gigas:a stable isotope analysis in the Northern Humboldt Current System[J].Marine Biology,2012,159(9):2105-2116.
[23] CHEREL Y,FONTAINE C,JACKSON G D,et al.Tissue,ontogenic and sex-related differences in δ13C and δ15N values of the oceanic squid Todarodes filippovae (Cephalopoda:Ommastrephidae)[J].Marine Biology,2009,156(4):699-708.
[24] STOWASSER G,PIERCE G J,MOFFAT C F,et al.Experimental study on the effect of diet on fatty acid and stable isotope profiles of the squid Lolliguncula brevis[J].Journal of Experimental Marine Biology and Ecology,2006,333(1):97-114.