目前,鱼、虾、蟹混养的生态养殖模式主要为立体生态混养,该模式充分利用了养殖池塘的水体空间及饵料生物资源,选取不同的规格与密度搭配进行放养,从而提高了整体养殖经济效益[1-2],但由于在养殖过程中养殖水体需要进行定期更换,对水资源的消耗不容忽视。而传统循环水养殖模式以鱼类为主要养殖对象,并引入多生态位综合修复技术,在养殖过程中进行多重净化,实现循环水养殖[3-5],但随着养殖模式的不断优化,在保证养殖系统正常运行的情况下,通过在系统内新增区域,将鱼、虾、蟹养殖与循环水模式相结合,在养殖高经济水产品的同时进一步净化水质从而提高养殖的综合效益,这将成为一个值得探索的新途径。为此,本研究团队构建了“流水养殖槽—虾—蟹”串联式循环水养殖系统(IPRS-shrimp-crab),并于2018年7月开始投入生产,本试验于2019年5—8月进行,在传统养殖模式基础上增加虾蟹池作为“养殖+净化”双功能区,定期监测系统内各区域水质变化情况,通过对比各功能区水质参数及浮游生物变化情况,对该养殖模式的有效性及可持续性进行研究,旨在为今后多样化养殖模式的优化发展提供科学依据。
1.1.1 养殖系统设计及各功能区组 本试验在江苏省苏州市阳澄湖大闸蟹配载中心水产站养殖试验基地进行,养殖系统主要由流水养殖槽(IPRS)、集污区、人工湿地净化区、青虾养殖区、河蟹养殖区、净化水循环利用区6个区域组成(图1)。
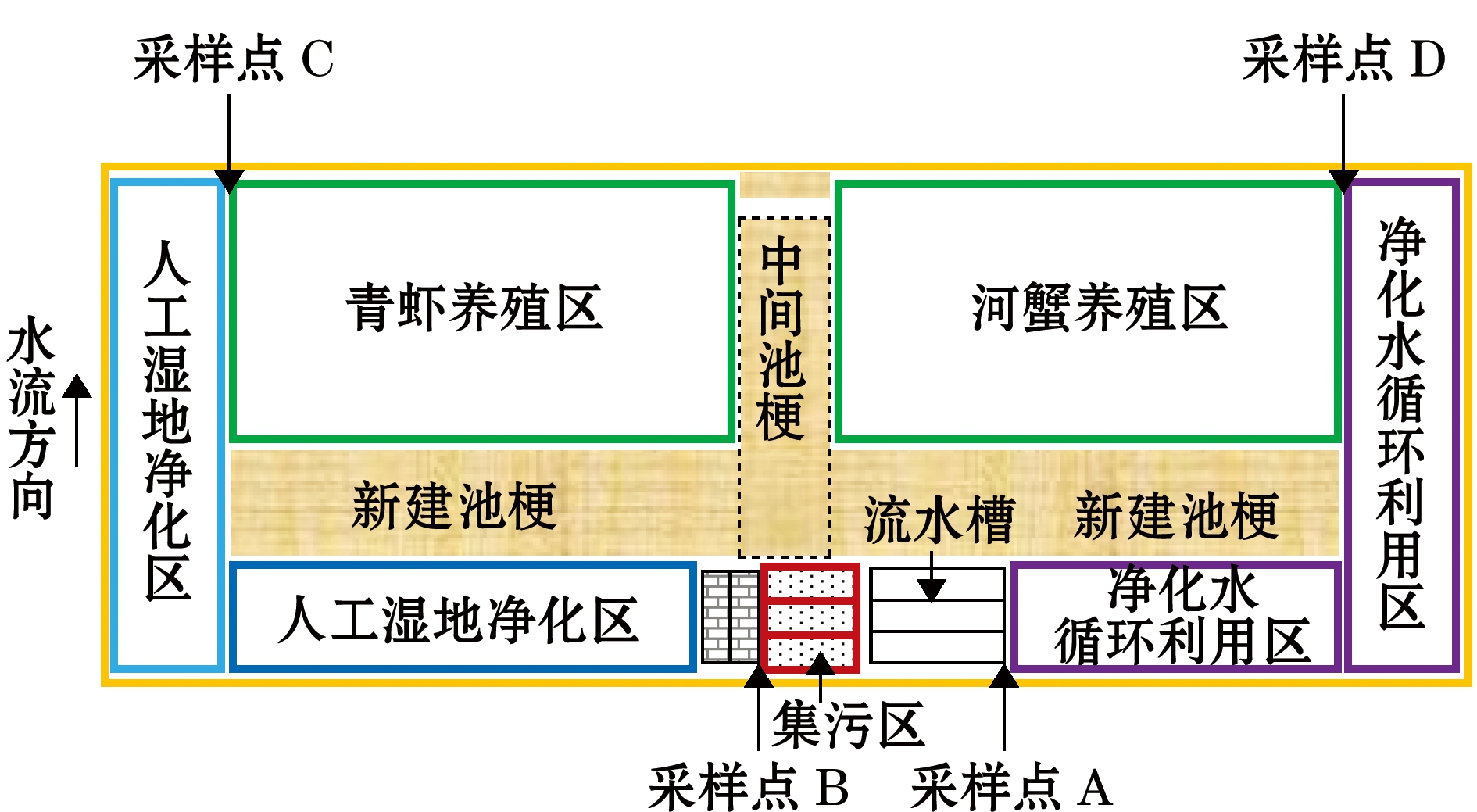
图1 养殖系统平面图
Fig.1 Plan of the aquaculture system
池塘东侧并列排布的3条养殖流水槽,流水槽建设总规格为20 m × 26 m × 2 m,水槽采用网箱设计,每个流水槽内放养大口黑鲈Micropterus salmoides 1万尾。集污区建设总长为21 m,宽26 m,高2 m,在网箱的底部与塘底间建立6 m× 6 m矩形型锥底,共计36个,每个集污锥底的中心与集污漏斗连接,上口对接网箱底部,漏斗之间通过PVC管道连接后再与岸边的排污井(1 m ×1 m ×3 m)相连通,内置带液位开关的排污泵,后期通过压缩装置将收集到的污物压缩成饼,用作肥料(图2)。
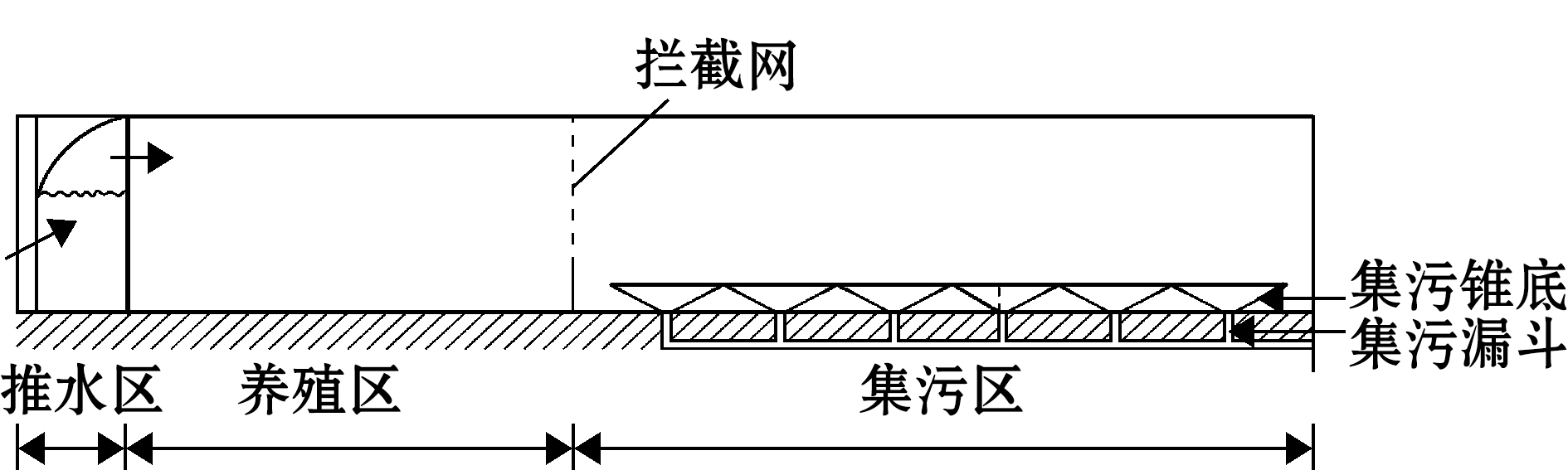
图2 集污功能区构建
Fig.2 Construction of the sewage collecting area
人工湿地净化区总面积为4 133.3 m2,区域内种植芦苇Phragmites australis、轮叶黑藻Hydrilla verticillata、苦草Vallisneria natans、伊乐藻Elodea canadensis 等水生植物。虾蟹养殖池面积均为3 666.7 m2,投放有青虾Macrobrachium nipponense 虾苗48万只,河蟹Eriocheir sinensis 1 034只,养殖池内设有一定量的水生植物及水草。净化水循环利用区总长为80 m,水深为2.2 m,上宽为16 m,与蟹池接通,下宽为6 m,与流水槽接通,区域内投放少量的螺蛳,并在溢流坝两边堆放一些活性炭及麦饭石,水体通过进一步的净化后,再次流入养殖流水槽。
1.1.2 系统运行及日常管理 系统运行期间坚持早晚巡塘,查看生产设施是否有破损,水色是否正常(黄绿色为好),虾蟹塘水草有无腐烂,鱼虾蟹有无死亡等。由于水中溶氧在早上处于最低水平,故早晨巡塘完成后,将3台增氧推水设备全开增氧,开机时长为20~30 min,白天只开启1台推水设备,傍晚投喂结束后关闭,再开启另外2台推水设备至翌日。早晚(6:00、18:00)各投喂一次饲料,每次投喂时间30 min左右(到吃食水花不大、有饲料漂到流水槽中后部为止),早上投喂前将鼓风机和增氧机全开20~30 min,将池底沉降物随水带出流水槽为止,然后再开始投喂,每周三定期用碘制剂进行槽内水体消毒,如有鱼病发生,按照治疗方法给药。
1.2.1 样品的采集与分析 待试验系统运行一段时间后进行样品采集,系统区域内设置4个采样点,每个采样点取3个平行样,且每个平行样品进行3次重复测定,取其平均值。采样点分别位于流水养殖槽前端(A)、集污区(B)、人工湿地(C)和虾蟹池出水口(D)(图1),采集上、中层混合水样,分别于2019年5月14日、6月12日、7月15日、8月16日的9:00—11:00进行采样。
1)水质指标的测定。按照《水和废水监测分析方法》测定总氮(TN)、总磷(TP)、氨氮![]() 亚硝态氮
亚硝态氮![]() 高锰酸盐指数(CODMn)、叶绿素a(Chl-a)等指标,采用便携式溶氧仪现场测定溶氧(DO)、水温(T),使用pH计现场测定pH,采用Secchi盘测定透明度(SD)。
高锰酸盐指数(CODMn)、叶绿素a(Chl-a)等指标,采用便携式溶氧仪现场测定溶氧(DO)、水温(T),使用pH计现场测定pH,采用Secchi盘测定透明度(SD)。
2)浮游动植物生物学指标的采集与测定。浮游植物采集:用25号浮游生物网在水面以下约0.5 m处以适当的速度做“∞”字形缓慢循环拖动1~3 min,收集至1 000 mL采样瓶中,加入15 mL鲁哥试剂固定,在实验室内静置沉淀48 h后浓缩至30 mL。
浮游动物采集:浮游动物定性分析样品的采集使用13号浮游生物网,在水面下0.5 m做“∞”形拖动,1~3 min后捞取,收集于1 000 mL采样瓶中,加入一定量的福尔马林溶液进行固定,带回实验室后浓缩至30 mL,在显微镜下进行分类鉴定。
浮游动植物的计数与鉴定方法参照《淡水浮游生物研究方法》[6]。Shannon-Weaver多样性(H′)、R.Margalef 种类丰富度指数(D)、Pielou均匀度指数(J)计算公式分别为
D=(S-1)/log2N,
J=H′/log2N。
其中:S为总种类数;N为所有种类个体总数(即总密度);Pi为第i种的个体数量在总个体数中所占的比例。污染物去除率公式为
Re=(ρ1-ρ2)/ρ1。
其中:Re为污染物去除率(%);ρ1、ρ2分别为集污区出水口和流水槽前端污染物质量浓度(mg/L)。
1.2.2 富营养化评价 采用综合状态指数法[7]对各区域养殖水体进行富营养化评价,计算公式为
其中:TLI(∑)为综合营养状态指数;m为评价参数个数;Wj 为第j种参数的营养状态指数的相关权重;TLI(j)为第j种参数的营养状态指数。
以Chl-a作为基准参数,结合TN、TP、SD、CODMn 4个参数进行评价,则第j种参数的归一化相关权重(Wj)计算公式为
其中,rij为第j种参数与基准参数Chl-a的相关系数。各参数的营养状态指数计算公式分别为
TLI(TN)=10(5.453+1.694 lnTN),
TLI(TP)=10(9.436+1.624 lnTP),
TLI(SD)=10(5.118-1.94 lnSD),
TLI(CODMn)=10(0.109+2.661 lnCODMn),
TLI(Chl-a)=10(2.5+1.086 lnChl-a)。
其富营养状态评定与污染关系见表1。在同一营养状态下,其综合营养状态指数值越高,营养程度就越重,污染也越大。
使用SPSS 22.0软件进行单因素方差分析和Duncan多重比较,分析不同月份水质指标差异[8]。
2.1.1 流水槽前端 从表2可见:流水槽前端的![]() 值在5、7月之间存在显著性差异
值在5、7月之间存在显著性差异![]() 值在7月出现最大值,SD出现最小值,说明随着温度的升高,各营养盐指数总体呈上升趋势,水体透明度下降;
值在7月出现最大值,SD出现最小值,说明随着温度的升高,各营养盐指数总体呈上升趋势,水体透明度下降;![]() 值在7、8月间无显著性差异(P>0.05),且各指标水平均有所下降,说明流水槽前端8月的水质要优于7月。
值在7、8月间无显著性差异(P>0.05),且各指标水平均有所下降,说明流水槽前端8月的水质要优于7月。
表1 水质营养状态评价表
Tab.1 Evaluation table of water trophic status
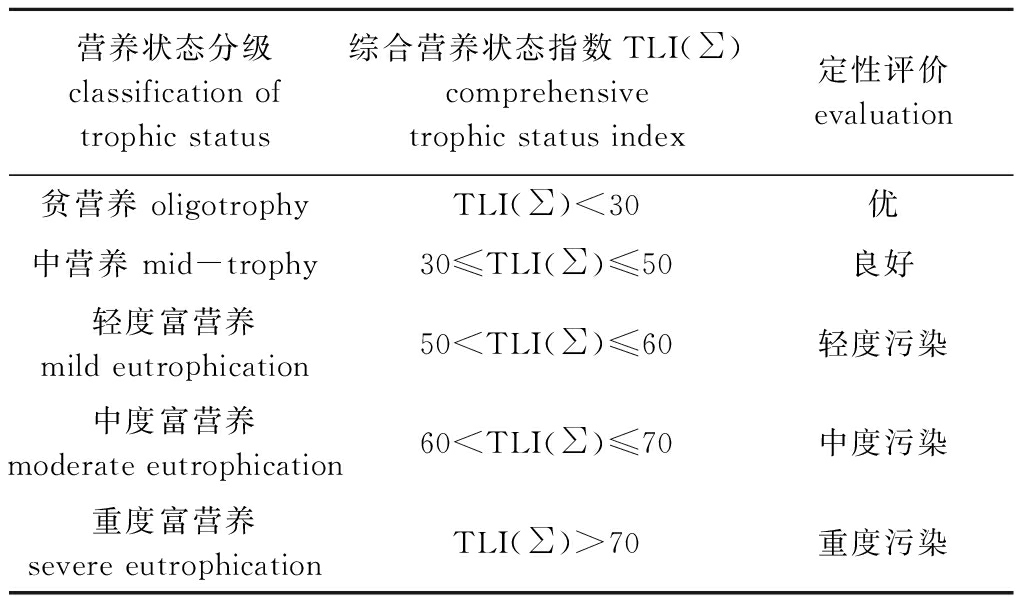
营养状态分级classification of trophic status综合营养状态指数TLI(∑)comprehensive trophic status index定性评价evaluation贫营养 oligotrophyTLI(∑)<30优中营养 mid-trophy30≤TLI(∑)≤50良好轻度富营养 mild eutrophication50
2.1.2 集污区 从表2可见:集污区的![]() 值在7、8月间存在显著性差异(P<0.05),其中
值在7、8月间存在显著性差异(P<0.05),其中![]() 在8月出现最大值;
在8月出现最大值;![]() 值在5、7月之间存在显著性差异(P<0.05),其中
值在5、7月之间存在显著性差异(P<0.05),其中![]() 在7月出现最大值;8月份集污区的
在7月出现最大值;8月份集污区的![]() 水平与流水槽存在明显差异,且数值要高于流水槽前端,是由于集污区水体存在大量残饵、鱼类代谢粪便等,虽然不溶性污染物沉降在集污漏斗内,但在收集期间仍存在有机物分解导致该区域营养盐水平普遍偏高。
水平与流水槽存在明显差异,且数值要高于流水槽前端,是由于集污区水体存在大量残饵、鱼类代谢粪便等,虽然不溶性污染物沉降在集污漏斗内,但在收集期间仍存在有机物分解导致该区域营养盐水平普遍偏高。
2.1.3 人工湿地 从表2可见:人工湿地的![]() 在4个月中均存在显著性差异
在4个月中均存在显著性差异![]() 值在7、8月间无显著性差异
值在7、8月间无显著性差异![]() 值在5、7月间均存在显著性差异(P<0.05),且
值在5、7月间均存在显著性差异(P<0.05),且![]() 值在7月份达到最大值;8月人工湿地的
值在7月份达到最大值;8月人工湿地的![]() 值明显低于集污区,说明集污区的水体通过人工湿地净化后,水质优于集污区。
值明显低于集污区,说明集污区的水体通过人工湿地净化后,水质优于集污区。
2.1.4 虾蟹池出水口 从表2可见:虾蟹池出水口的![]() 值在5、7月间均存在显著性差异(P<0.05),且
值在5、7月间均存在显著性差异(P<0.05),且![]() 在7月达到最大值;
在7月达到最大值;![]() 在7、8月间存在显著性差异(P<0.05);8月份虾蟹池出水口的TP与人工湿地的值差异明显,
在7、8月间存在显著性差异(P<0.05);8月份虾蟹池出水口的TP与人工湿地的值差异明显,![]() 与集污区的值差异明显,TN、CODMn、Chl-a与流水槽前端的值差异明显,说明经虾蟹池二次净化后水体部分营养盐下降,但虾蟹池水草和代谢物等使水体CODMn和Chl-a增加。
与集污区的值差异明显,TN、CODMn、Chl-a与流水槽前端的值差异明显,说明经虾蟹池二次净化后水体部分营养盐下降,但虾蟹池水草和代谢物等使水体CODMn和Chl-a增加。
表2 各区域不同月份水质指标的差异性分析
Tab.2 Divergence analysis of water quality indices in different areas in different months
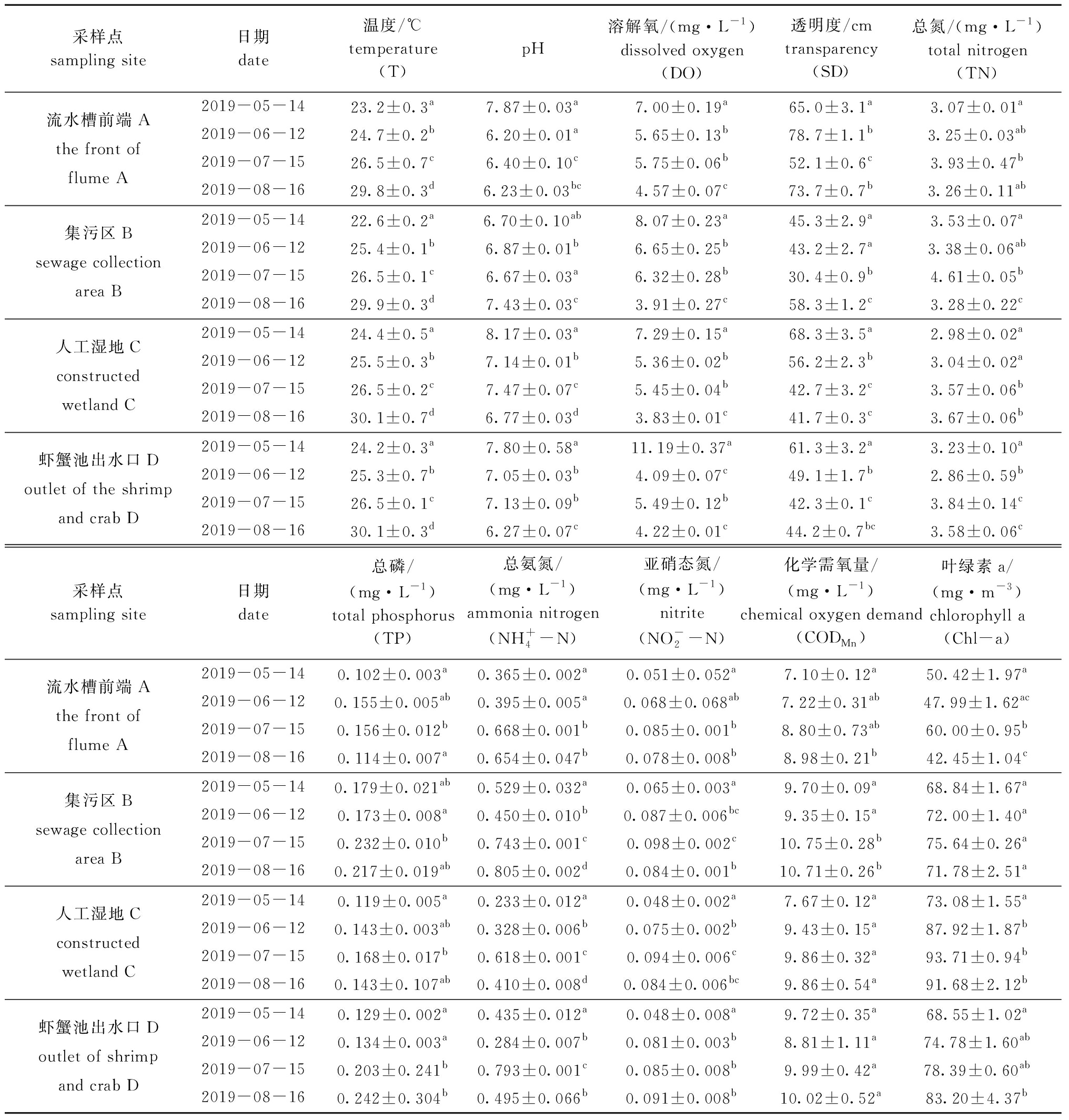
采样点sampling site日期date温度/℃temperature(T)pH溶解氧/(mg·L-1)dissolved oxygen(DO)透明度/cmtransparency(SD)总氮/(mg·L-1)total nitrogen(TN)流水槽前端Athe front of flume A2019-05-1423.2±0.3a7.87±0.03a7.00±0.19a65.0±3.1a3.07±0.01a2019-06-1224.7±0.2b6.20±0.01a5.65±0.13b78.7±1.1b3.25±0.03ab2019-07-1526.5±0.7c6.40±0.10c5.75±0.06b52.1±0.6c3.93±0.47b2019-08-1629.8±0.3d6.23±0.03bc4.57±0.07c73.7±0.7b3.26±0.11ab集污区Bsewage collection area B2019-05-1422.6±0.2a6.70±0.10ab8.07±0.23a45.3±2.9a3.53±0.07a2019-06-1225.4±0.1b6.87±0.01b6.65±0.25b43.2±2.7a3.38±0.06ab2019-07-1526.5±0.1c6.67±0.03a6.32±0.28b30.4±0.9b4.61±0.05b2019-08-1629.9±0.3d7.43±0.03c3.91±0.27c58.3±1.2c3.28±0.22c人工湿地Cconstructed wetland C2019-05-1424.4±0.5a8.17±0.03a7.29±0.15a68.3±3.5a2.98±0.02a2019-06-1225.5±0.3b7.14±0.01b5.36±0.02b56.2±2.3b3.04±0.02a2019-07-1526.5±0.2c7.47±0.07c5.45±0.04b42.7±3.2c3.57±0.06b2019-08-1630.1±0.7d6.77±0.03d3.83±0.01c41.7±0.3c3.67±0.06b虾蟹池出水口Doutlet of the shrimp and crab D2019-05-1424.2±0.3a7.80±0.58a11.19±0.37a61.3±3.2a3.23±0.10a2019-06-1225.3±0.7b7.05±0.03b4.09±0.07c49.1±1.7b2.86±0.59b2019-07-1526.5±0.1c7.13±0.09b5.49±0.12b42.3±0.1c3.84±0.14c2019-08-1630.1±0.3d6.27±0.07c4.22±0.01c44.2±0.7bc3.58±0.06c采样点sampling site日期date总磷/(mg·L-1)total phosphorus(TP)总氨氮/(mg·L-1)ammonia nitrogen(NH+4-N)亚硝态氮/(mg·L-1)nitrite(NO-2-N)化学需氧量/(mg·L-1)chemical oxygen demand(CODMn)叶绿素a/(mg·m-3)chlorophyll a(Chl-a)流水槽前端Athe front of flume A2019-05-140.102±0.003a0.365±0.002a0.051±0.052a7.10±0.12a50.42±1.97a2019-06-120.155±0.005ab0.395±0.005a0.068±0.068ab7.22±0.31ab47.99±1.62ac2019-07-150.156±0.012b0.668±0.001b0.085±0.001b8.80±0.73ab60.00±0.95b2019-08-160.114±0.007a0.654±0.047b0.078±0.008b8.98±0.21b42.45±1.04c集污区Bsewage collection area B2019-05-140.179±0.021ab0.529±0.032a0.065±0.003a9.70±0.09a68.84±1.67a2019-06-120.173±0.008a0.450±0.010b0.087±0.006bc9.35±0.15a72.00±1.40a2019-07-150.232±0.010b0.743±0.001c0.098±0.002c10.75±0.28b75.64±0.26a2019-08-160.217±0.019ab0.805±0.002d0.084±0.001b10.71±0.26b71.78±2.51a人工湿地Cconstructed wetland C2019-05-140.119±0.005a0.233±0.012a0.048±0.002a7.67±0.12a73.08±1.55a2019-06-120.143±0.003ab0.328±0.006b0.075±0.002b9.43±0.15a87.92±1.87b2019-07-150.168±0.017b0.618±0.001c0.094±0.006c9.86±0.32a93.71±0.94b2019-08-160.143±0.107ab0.410±0.008d0.084±0.006bc9.86±0.54a91.68±2.12b虾蟹池出水口Doutlet of shrimp and crab D2019-05-140.129±0.002a0.435±0.012a0.048±0.008a9.72±0.35a68.55±1.02a2019-06-120.134±0.003a0.284±0.007b0.081±0.003b8.81±1.11a74.78±1.60ab2019-07-150.203±0.241b0.793±0.001c0.085±0.008b9.99±0.42a78.39±0.60ab2019-08-160.242±0.304b0.495±0.066b0.091±0.008b10.02±0.52a83.20±4.37b
注:同列中同一功能区中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters in same functional area are significantly different at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.1.5 营养元素去除率 从表3可见:该系统对![]() 的平均去除率分别为8.22%、33.41%、18.44%、15.95%、20.98%、30.41%;随着系统运行时间延长,TN去除率较为不稳定且偏低,TP去除率呈先减后增趋势,在8月份达到最大值,而
的平均去除率分别为8.22%、33.41%、18.44%、15.95%、20.98%、30.41%;随着系统运行时间延长,TN去除率较为不稳定且偏低,TP去除率呈先减后增趋势,在8月份达到最大值,而![]() 去除率均呈下降趋势,可能与系统内微生物与浮游植物的数量及结构有关[9]。
去除率均呈下降趋势,可能与系统内微生物与浮游植物的数量及结构有关[9]。
表3 营养元素去除率的变化
Tab.3 Variations in nutrient removal rate
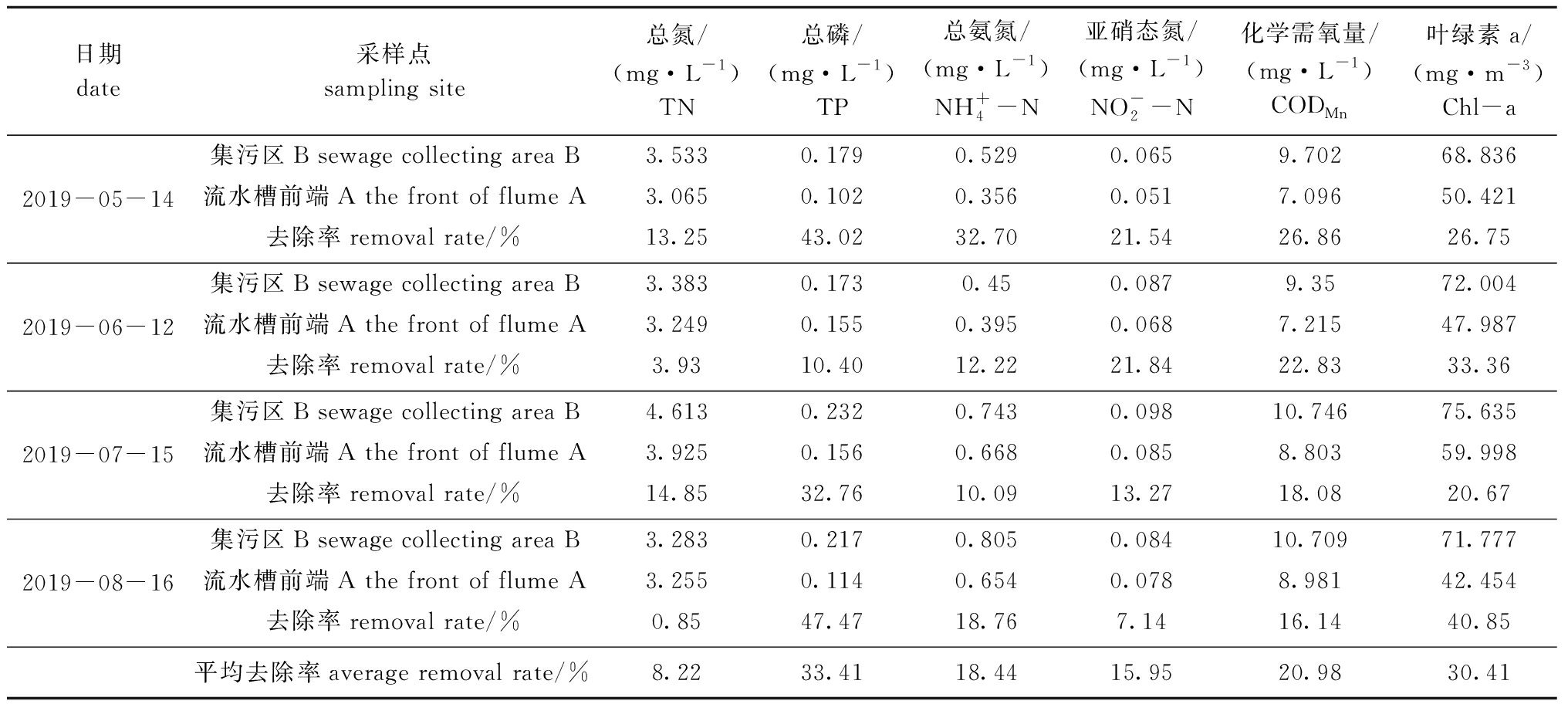
日期date采样点sampling site总氮/(mg·L-1)TN总磷/(mg·L-1) TP总氨氮/(mg·L-1) NH+4-N亚硝态氮/(mg·L-1) NO-2-N化学需氧量/(mg·L-1)CODMn叶绿素a/(mg·m-3) Chl-a2019-05-14集污区B sewage collecting area B3.5330.1790.5290.0659.70268.836流水槽前端A the front of flume A3.0650.1020.3560.0517.09650.421去除率removal rate/%13.2543.0232.7021.5426.8626.752019-06-12集污区B sewage collecting area B3.3830.1730.450.0879.3572.004流水槽前端A the front of flume A3.2490.1550.3950.0687.21547.987去除率removal rate/%3.9310.4012.2221.8422.8333.362019-07-15集污区B sewage collecting area B4.6130.2320.7430.09810.74675.635流水槽前端A the front of flume A3.9250.1560.6680.0858.80359.998去除率removal rate/%14.8532.7610.0913.2718.0820.672019-08-16集污区B sewage collecting area B3.2830.2170.8050.08410.70971.777流水槽前端A the front of flume A3.2550.1140.6540.0788.98142.454去除率removal rate/%0.8547.4718.767.1416.1440.85 平均去除率average removal rate/%8.2233.4118.4415.9520.9830.41
2.2.1 浮游植物密度与生物量 从图3可见:随着温度升高,各区域浮游植物密度与生物量逐渐上升;养殖系统内浮游植物密度最大值为4.33×106 ind./L,出现在7月15日集污区,最小值为1.89×106 ind./L,出现在6月12日人工湿地,系统内平均密度为3.11×106 ind./L;养殖系统内浮游植物生物量最大值为12.24 mg/L,出现在5月14日集污区,最小值为2.99 mg/L,出现在6月12日人工湿地,系统内平均生物量为7.62 mg/L。
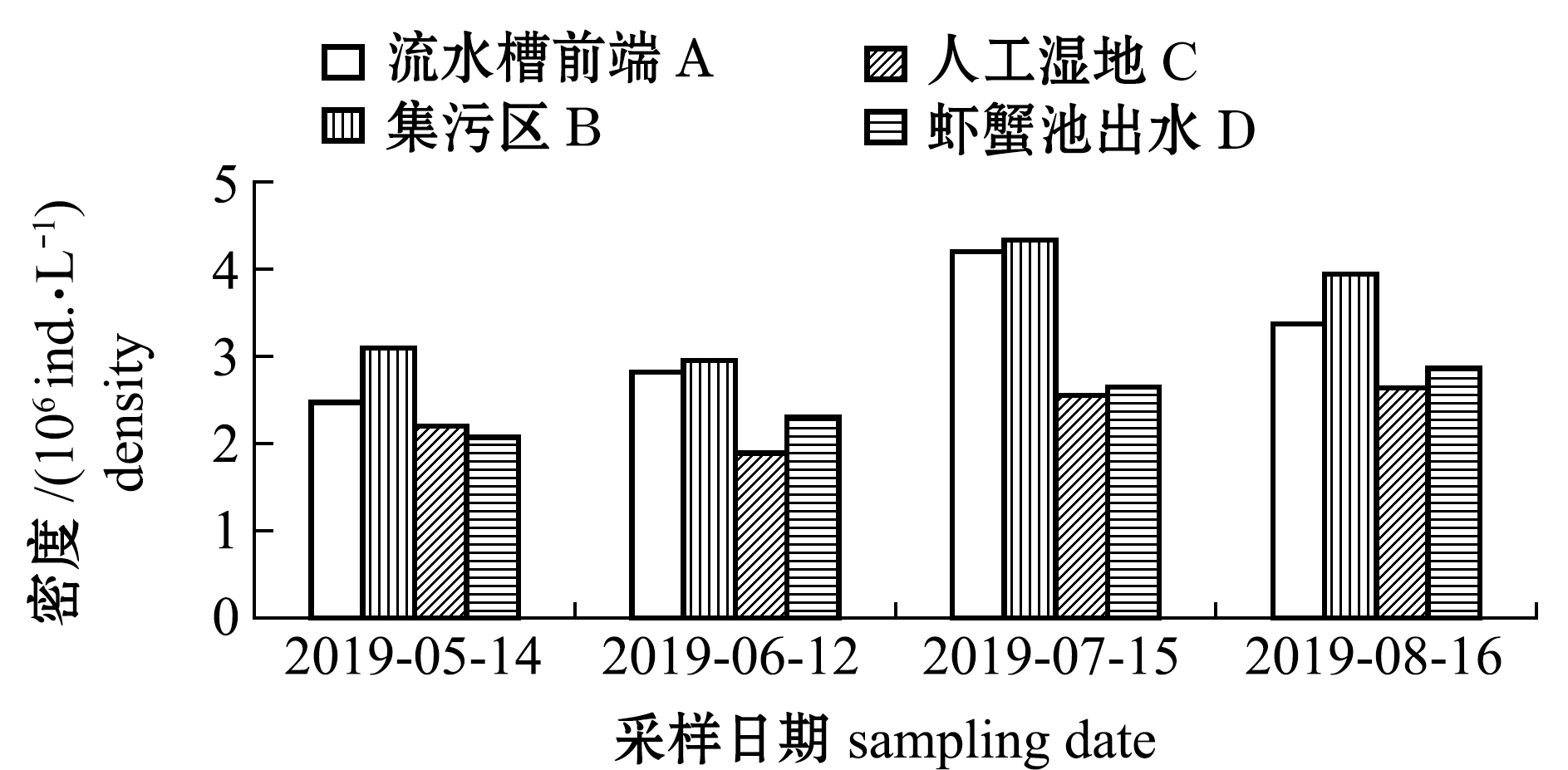
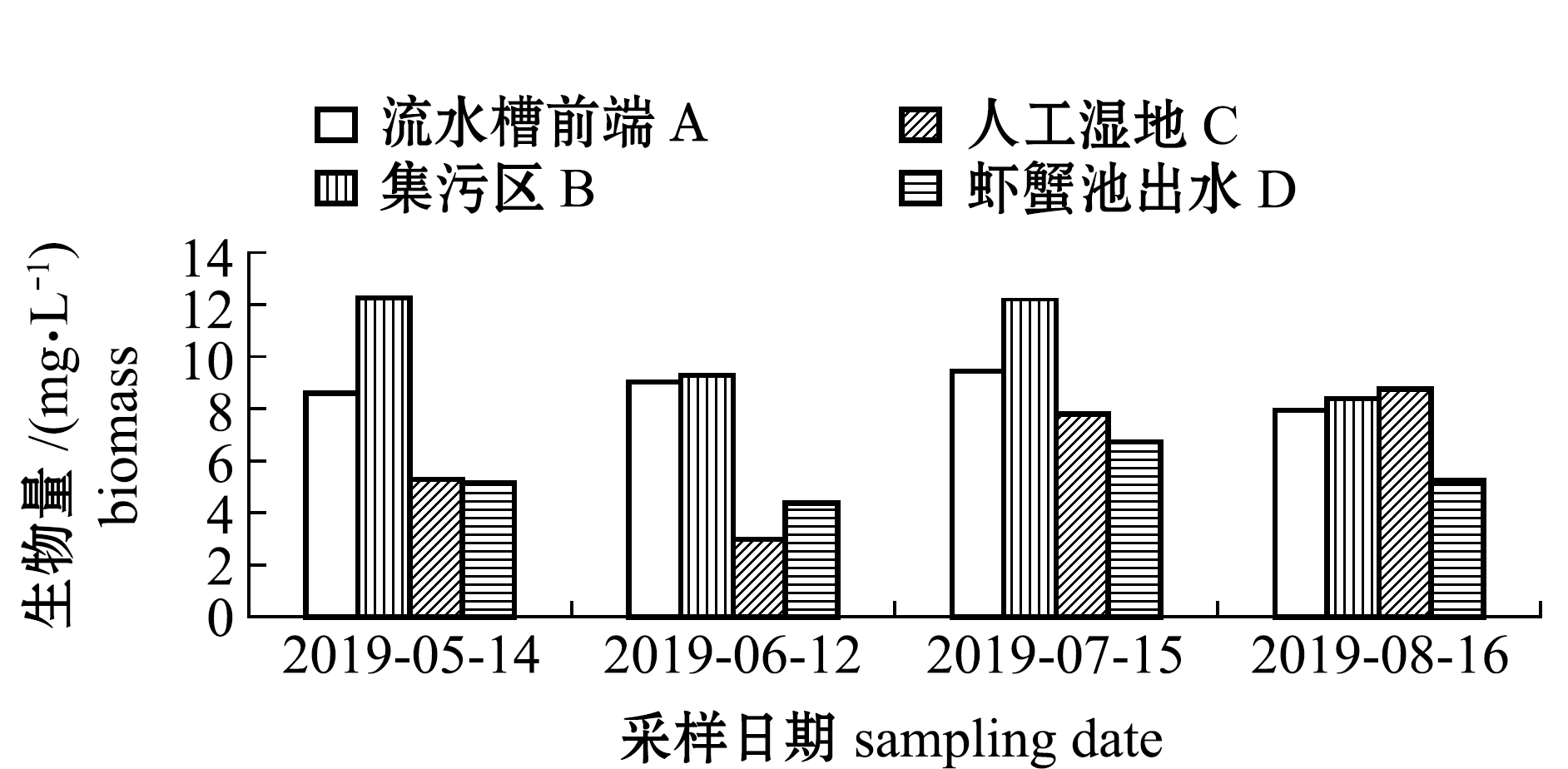
图3 各区域浮游植物密度和生物量变化
Fig.3 Variation in phytoplankton density and biomass in different regions
在试验过程中,各区域浮游植物密度依次为集污区>流水槽前端>虾蟹池出水口>人工湿地;各区域浮游植物生物量依次为集污区>流水槽前端>人工湿地>虾蟹池出水口。其中,5月份人工湿地区浮游植物密度和生物量高于虾蟹池出水口,6月份虾蟹池出水口的浮游植物密度和生物量要高于人工湿地,可能是区域内不同浮游植物结构所导致,说明养殖水体在流经净化区后,营养盐水平的下降限制了浮游植物的生长,导致浮游植物密度与生物量降低[10-11]。
2.2.2 浮游植物多样性指数 浮游植物多样性指数H′的变化范围为4.16~4.81,平均值为4.49,各区域4个月H′指数的平均值依次为集污区(4.603)>流水槽前端(4.475)>虾蟹池出水口(4.425)>人工湿地(4.410),且随着温度升高,H′指数总体呈上升趋势,而集污区水体经过净化后,H′值有一定程度的减少,这与净化后水体中浮游植物的物种数下降有关(表4)。
浮游植物均匀度指数J的变化范围为0.52~0.58,平均值为0.55,各区域4个月J的平均值依次为人工湿地(0.560)>虾蟹池出水口(0.558)>集污区(0.543)>流水槽前端(0.538),而人工湿地和虾蟹池出水口J值从5月到6月有所降低,说明5、6月水质状况良好,净化后浮游植物种类数下降,导致J值减小。随着系统的运行,7月随着温度的升高净化区生物繁殖加快,种类数增加,均匀度指数增加,8月时浮游植物群落趋于完整,净化区内基质上的微生物和兼性厌氧的固着类微小植物等形成生物膜[12],在水体循环作用下流出,从而使净化区浮游生物种类数逐渐下降,均匀度指数再次下降(表4)。
浮游植物丰富度指数D的变化范围为2.29~4.23,平均值为3.26,4个区域的D指数平均值依次为人工湿地>虾蟹池出水口>流水槽前端>集污区,各区域随着时间推移D指数均有所增加,说明随着时间的推移,系统内浮游生物种群有所增加,利于循环养殖系统内水体的稳定(表4)。
表4 各区域浮游植物多样性指数变化
Tab.4 Variation in phytoplankton diversity indices in different regions
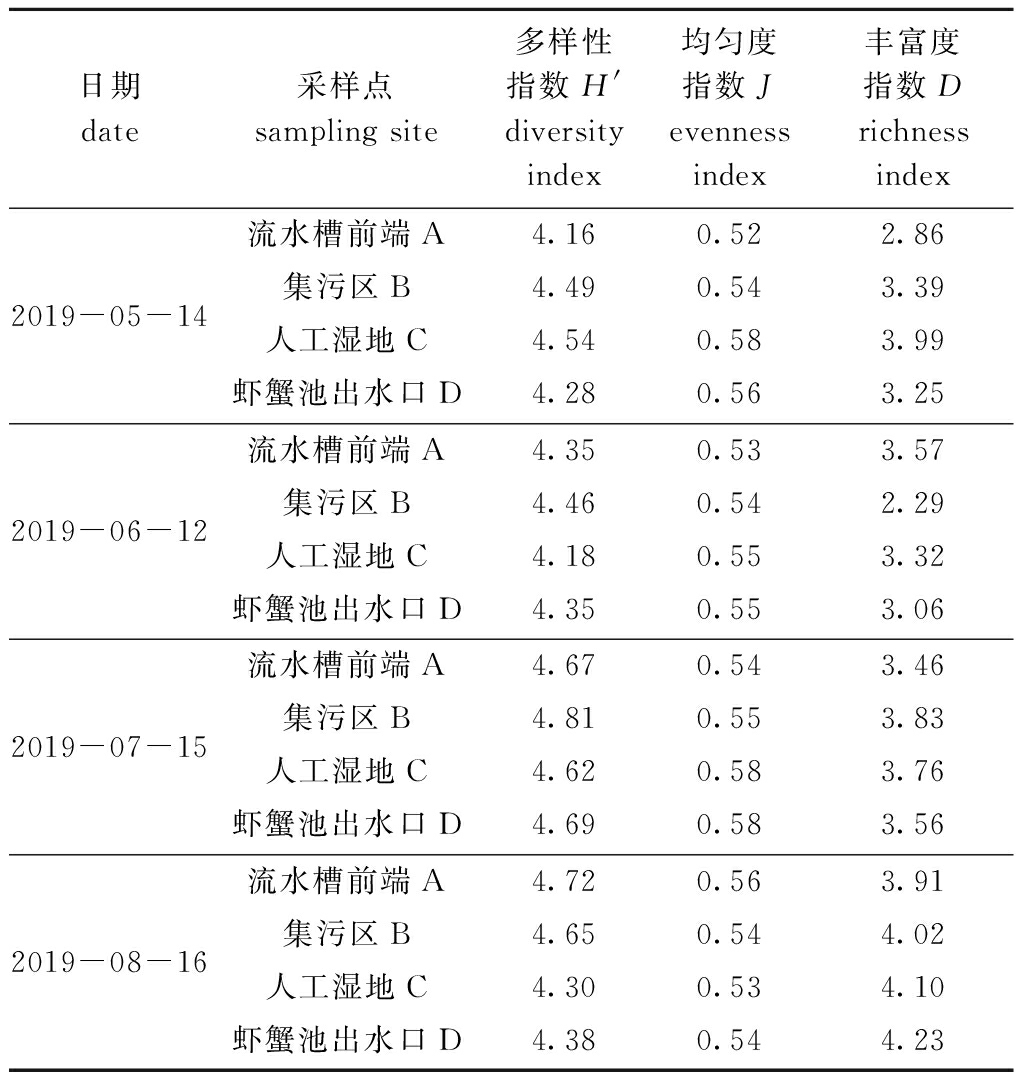
日期 date采样点 sampling site多样性指数H' diversity index均匀度指数Jevenness index丰富度指数D richness index2019-05-14流水槽前端A4.160.522.86集污区B4.490.543.39人工湿地C4.540.583.99虾蟹池出水口D4.280.563.252019-06-12流水槽前端A4.350.533.57集污区B4.460.542.29人工湿地C4.180.553.32虾蟹池出水口D4.350.553.062019-07-15流水槽前端A4.670.543.46集污区B4.810.553.83人工湿地C4.620.583.76虾蟹池出水口D4.690.583.562019-08-16流水槽前端A4.720.563.91集污区B4.650.544.02人工湿地C4.300.534.10虾蟹池出水口D4.380.544.23
2.3.1 浮游动物密度与生物量 从图4可见:随着温度的升高,各区域浮游动物密度与生物量逐渐上升;养殖系统内浮游动物密度最大值为8.46×104 ind./L,出现在7月15日集污区,最小值为4.29×104 ind./L,出现在5月14日人工湿地,系统内平均密度为6.38×104 ind./L;养殖系统内浮游动物生物量最大值为9.71 mg/L,出现在7月15日集污区,最小值为3.81 mg/L,出现在5月14日流水槽前端,系统内平均密度为5.09 mg/L。
在试验过程中,集污区水体经过人工湿地区域净化后,浮游动物密度有一定程度的下降,其中7、8月差异较为明显,而经过虾蟹池后有所回升,分析可能是该区域内虾蟹养殖过程中营养盐成分上升,适宜浮游动物的生长。随着时间的推移,温度上升导致养殖水体营养盐水平的升高,加快了浮游动物的繁殖速率[13],导致7、8月的浮游动物密度要高于5、6月。在该养殖模式运行过程中,各区域随着时间推移,浮游动物生物量与密度的变化趋势一致,除了虾蟹池出水口外,系统内其他各区域的浮游动物生物量总体呈上升趋势,集污区水体经过人工湿地净化后,浮游动物生物量明显减少,说明经过人工湿地后的养殖水体净化效果明显,营养盐水平下降限制了浮游动物的生长繁殖,从而导致总体的生物量有所降低;8月份虾蟹池出水口的生物量低于人工湿地净化区,可能与虾蟹池的日常管理及人工调控有关。
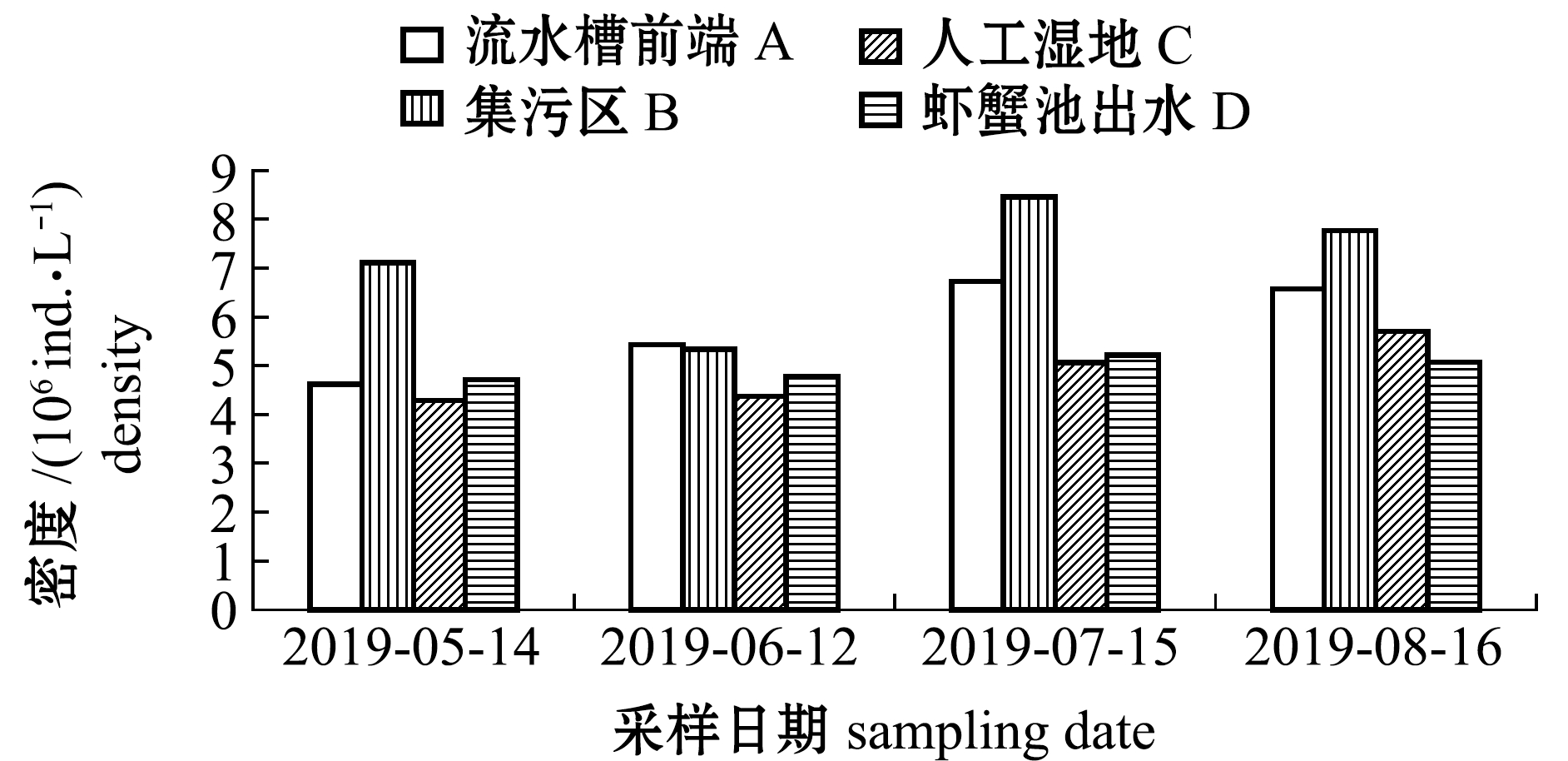
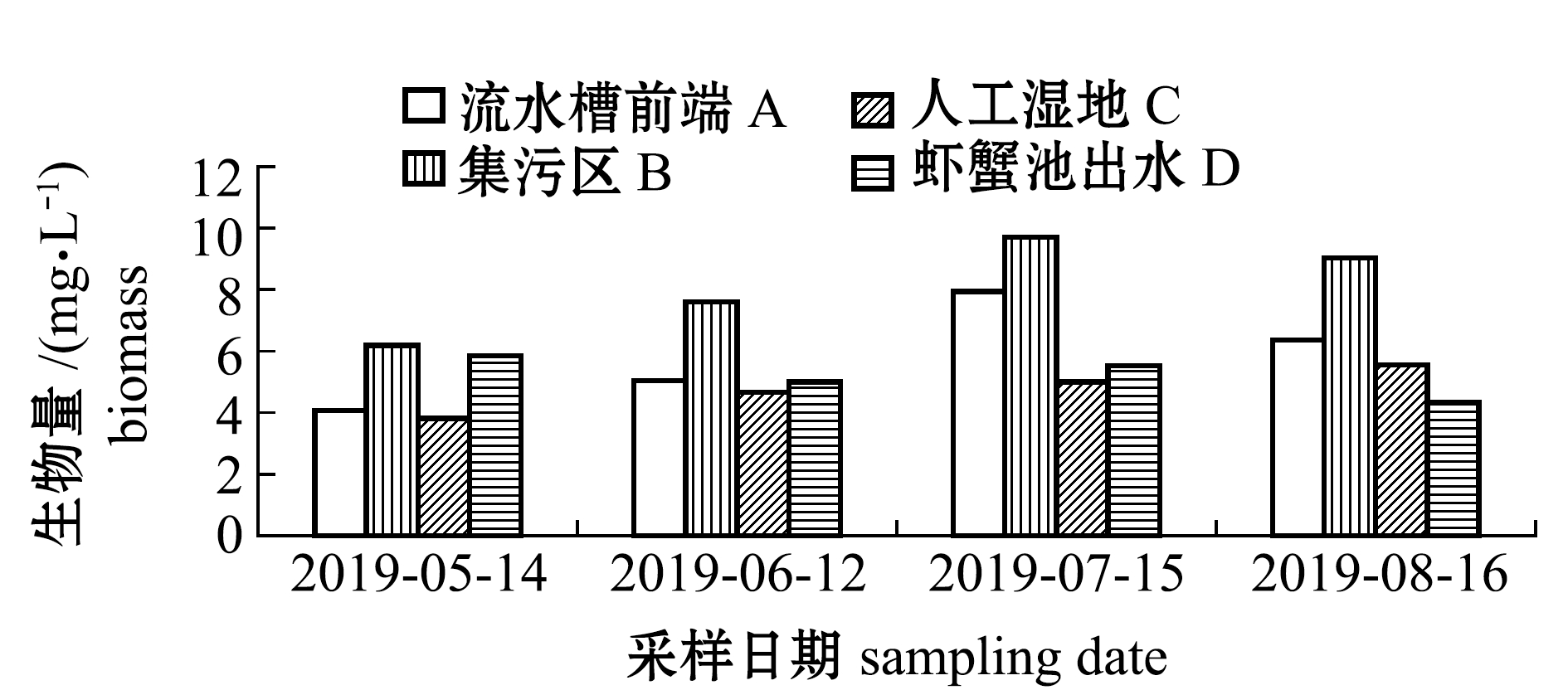
图4 各区域浮游动物密度和生物量变化
Fig.4 Variation in zooplankton density and biomass in different regions
2.3.2 浮游动物多样性指数 各区域浮游动物多样性指数H′的变化范围为3.86~4.78;各区域H′指数平均值依次为流水槽前端>集污区>虾蟹池出水口>人工湿地;随着时间推移,流水槽前端的H′指数总体呈下降趋势,最小值出现6月,最大值出现在7月;集污区的H′指数总体呈上升趋势,最小值出现在5月,最大值出现在8月;人工湿地的H′指数总体呈上升趋势(除6月份外),最小值出现在5月,最大值出现在6月;虾蟹池出水口的H′指数总体呈上升趋势(除6月份外),最小值出现在6月,最大值出现在7月(表5)。
浮游动物均匀度指数J变化范围为0.51~0.61,随着系统的运行,流水槽前端与人工湿地的J指数总体呈下降趋势,集污区J指数总体呈上升趋势,虾蟹池出水口4个月内变化不明显;4个区域J指数平均值依次为虾蟹池出水>流水槽前端>集污区>人工湿地,其中最大值出现在流水槽前端,可能是由于温度升高,未摄食的饵料经微生物分解后导致流水槽前端营养盐含量升高,从而浮游动物繁殖速度加快所导致(表5)。
浮游植物丰富度指数D变化范围为3.34~5.11,流水槽前端D指数最小值出现在6月,最大值出现在7月,可能与该区域水质的管理调控有关;而集污区、虾蟹池出水口D指数总体呈上升趋势,说明随着系统的运行水体中浮游动物种群数上升,有利于养殖水体水质的稳定性;4个区域D指数平均值依次为流水槽前端>集污区>虾蟹池出水口>人工湿地,与H′指数变化规律一致(表5)。
表5 各区域浮游动物多样性指数变化
Tab.5 Variation in zooplankton diversity indices in different regions
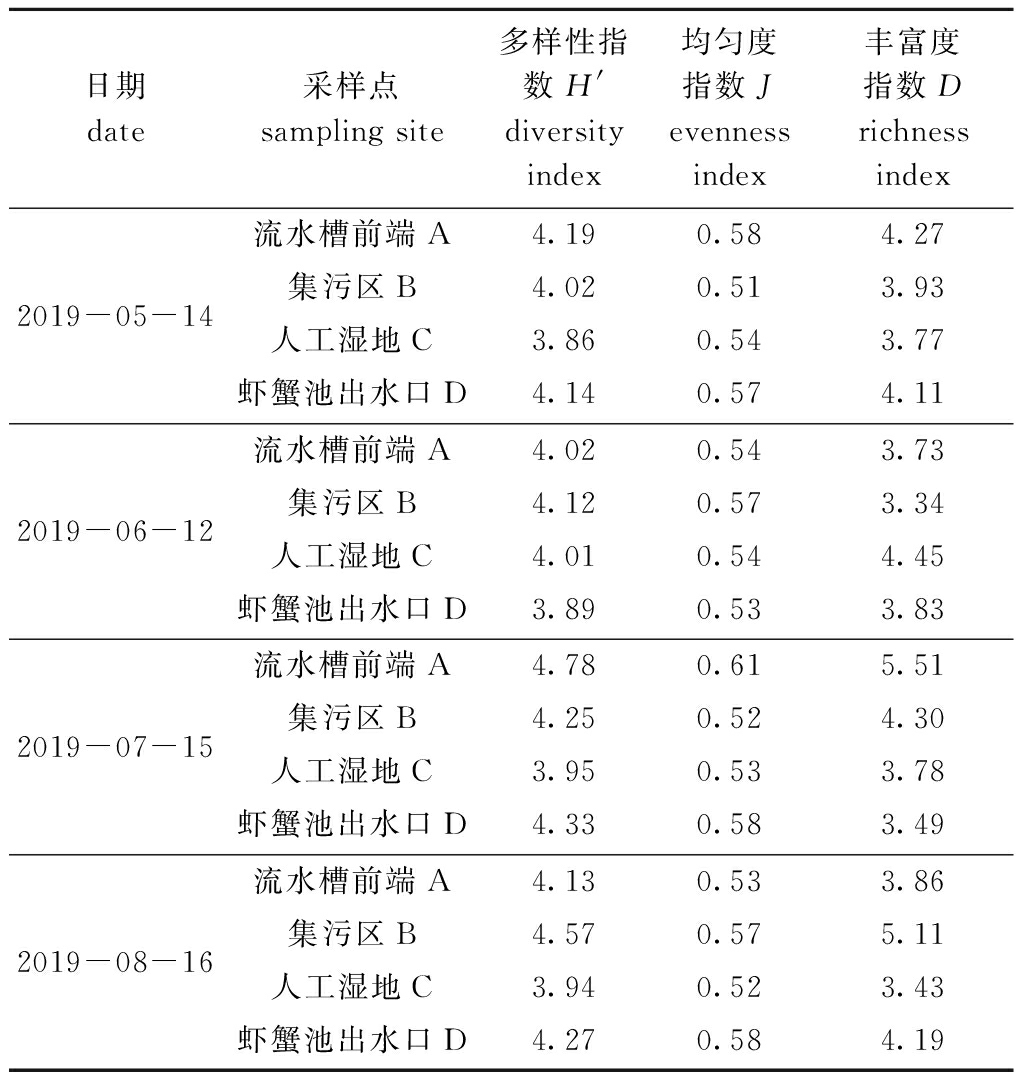
日期 date采样点 sampling site多样性指数H' diversity index均匀度指数Jevenness index丰富度指数D richness index2019-05-14流水槽前端A4.190.584.27集污区B4.020.513.93人工湿地C3.860.543.77虾蟹池出水口D4.140.574.112019-06-12流水槽前端A4.020.543.73集污区B4.120.573.34人工湿地C4.010.544.45虾蟹池出水口D3.890.533.832019-07-15流水槽前端A4.780.615.51集污区B4.250.524.30人工湿地C3.950.533.78虾蟹池出水口D4.330.583.492019-08-16流水槽前端A4.130.533.86集污区B4.570.575.11人工湿地C3.940.523.43虾蟹池出水口D4.270.584.19
从表6可见:流水槽前端7月水体营养状态为轻度富营养化,其他月份为中营养状态,7月富营养化程度最高,5月富营养化程度最低;集污区4个月中均为轻度富营养化,7月富营养化程度最高,5月富营养化程度最低;人工湿地5月水体营养状态为中营养状态,其他月份为轻度富营养化,7月富营养化程度最高,5月富营养化程度最低;虾蟹池出水口5月水体营养状态为中营养状态,其他月份为轻度富营养化,8月富营养化程度最高,5月富营养化程度最低。
本研究中“流水养殖槽—虾—蟹”串联式循环水养殖模式通过构建多个功能区域,流水槽内养殖大口黑鲈Micropterus salmoides,并且底部装有若干微孔增氧板,保证流水槽内溶氧充足,其上游装有气提式增氧推水机,下游设有集污池,在集污池底部设有多个锥形集污漏斗,且在尾端放置有人工浮床,可吸收一定量的营养元素,为其提供养料;集污池下游开设的人工湿地净化区,种植有大量水生植物,可吸收水体中的N、P等营养元素,进行光合作用,增加水体含氧量,可加快有机物的分解,将有机氮转化成为氨氮,促进硝化反应,从而避免氨氮和亚硝态氮的积累[14-15]。后端与虾池连通,蟹池与虾池相邻,池内均种有水草,不仅能够增加虾蟹养殖池的透明度与溶氧量,还可以遮阳降温,为虾蟹栖息、脱壳提供隐蔽场所,而水草的嫩叶和碎屑可供青虾与河蟹食用;蟹池后端设有的净化水循环利用区内投放螺蛳,通过上述多功能区的多生态位综合修复技术,可提高系统自身净化效能,实现水资源循环利用。
表6 各区域水体综合营养状态指数(TLI)
Tab.6 Comprehensive trophic status index(TLI) of water bodies in different regions
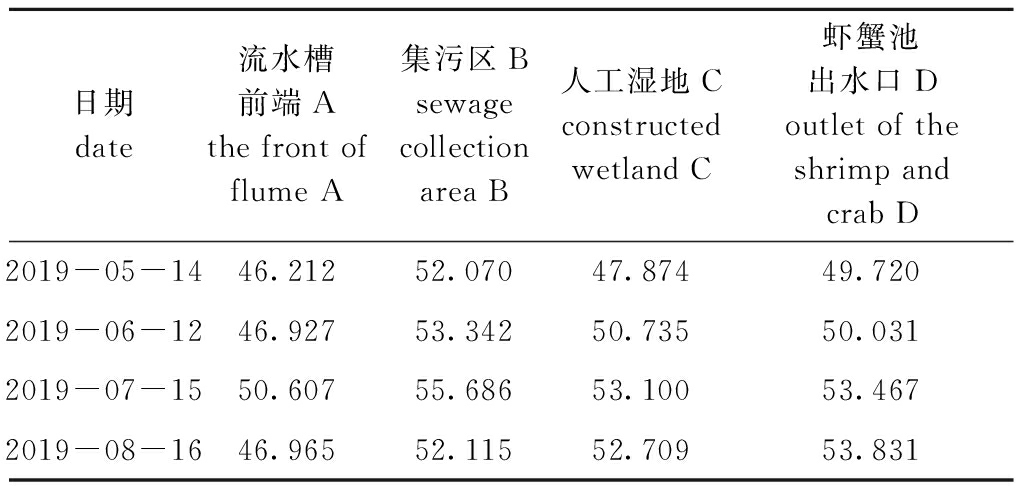
日期date流水槽前端Athe front of flume A集污区Bsewage collection area B人工湿地Cconstructed wetland C虾蟹池出水口Doutlet of the shrimp and crab D2019-05-1446.21252.07047.87449.7202019-06-1246.92753.34250.73550.0312019-07-1550.60755.68653.10053.4672019-08-1646.96552.11552.70953.831
3.2.1 水体理化因素 本研究中,随着系统的运行,营养盐的整体水平呈先上升后下降的趋势,说明该系统各部分生态结构逐渐趋于稳定,净化能力逐渐加强。在该养殖模式下,系统内的![]() 平均去除率分别达到8.22%、33.41%、18.44%、15.95%、20.98%、30.41%,与其他传统的养殖系统相比,该循环系统对
平均去除率分别达到8.22%、33.41%、18.44%、15.95%、20.98%、30.41%,与其他传统的养殖系统相比,该循环系统对![]() 的去除率偏低,可能与不同养殖模式中功能区域分布情况有关,今后需要进一步改善优化。通过对各区域水质指标进行监测及差异性分析可知,8月份在虾蟹池出水口的TP与人工湿地的值差异明显,
的去除率偏低,可能与不同养殖模式中功能区域分布情况有关,今后需要进一步改善优化。通过对各区域水质指标进行监测及差异性分析可知,8月份在虾蟹池出水口的TP与人工湿地的值差异明显,![]() 与集污区的值差异明显,TN、CODMn、Chl-a与流水槽前端的值差异也明显,可知流水槽中养殖水体经过各功能区后水中的污染物得到有效地去除。其中,养殖水体大部分处于轻度富营养化状态,水质良好,且随着系统运行各项数据变化趋于稳定。
与集污区的值差异明显,TN、CODMn、Chl-a与流水槽前端的值差异也明显,可知流水槽中养殖水体经过各功能区后水中的污染物得到有效地去除。其中,养殖水体大部分处于轻度富营养化状态,水质良好,且随着系统运行各项数据变化趋于稳定。
3.2.2 浮游动植物生物学指标 浮游动植物的密度和生物量与水体中营养盐水平息息相关[16]。本研究中,通过循环水养殖模式将传统封闭净水转为循环流水,在循环过程中实行净化,养殖过程中会产生大量饲料残饵及养殖生物排泄物,导致水体营养盐水平升高,集污区的浮游生物密度与生物量要高于其他区,说明该区域内具有丰富的营养物质,为浮游植物的生长提供充分养料,使得浮游植物生长速度加快,密度与生物量增加,而浮游植物生物量增加后为浮游动物及其他捕食者提供饵料,促进其生长繁殖。浮游植物与浮游动物的消长呈交替现象,说明浮游植物的增加会促进浮游动物的生长繁殖,而浮游动物的生长与繁殖反过来又会在一定时间内限制浮游植物的生长。流水槽前端、人工湿地及虾蟹池出水口的浮游生物密度与生物量远低于集污区,说明通过净化区,在水体中的营养盐水平下降的同时,有效限制了浮游生物的生长繁殖,该养殖模式具有一定的净化效果。
浮游生物的多样性指数能够反映生物种群或群落结构的变化,其中浮游植物多样性能够体现群落功能的组织特征,浮游动物多样性与水体中生态系统的稳定有关,随着环境的变化,其种类、数量、群落结构等均会发生改变[17-18]。评价水体时,浮游生物多样性指数越高,水体的自净能力越强[19]。在本试验中,通过生态净化,养殖水体营养元素被吸收,浮游动植物的密度与生物量迅速降低,而系统内浮游生物Shannon-Weaver 多样性指数H′、Pielou均匀度指数J、丰富度指数D随时间的推移呈上升趋势,这说明养殖水体环境越来越稳定,该养殖模式净化的有效性及可持续性得以体现。
对于水产养殖业而言,夏季是鱼类暴发病害、水质恶化的频发期,若不提前预防和及时处理,将会带来巨大的经济损失。有报道认为,池塘养殖投喂的湿饲料中有5%~10%未被鱼类食用,而被鱼类食用消化的饲料中又有 25%~30% 以粪便形式排出[14-15]。本系统的养殖过程中,随着鱼类未摄入的饲料、代谢产生的粪便等有机物不断增加,尤其是到了夏季高温时期,有机物氧化分解致使各区域水中的![]() 含量逐渐上升,在7月达到了最高峰,8月份时,各营养盐含量呈下降趋势(表2),主要是由于在日常管理上,集污区集污漏斗中收集的不溶性污染物被及时抽出,减少了有机物的氧化分解。
含量逐渐上升,在7月达到了最高峰,8月份时,各营养盐含量呈下降趋势(表2),主要是由于在日常管理上,集污区集污漏斗中收集的不溶性污染物被及时抽出,减少了有机物的氧化分解。
氨具有较高的脂溶性,能通过鳃及皮膜进入鱼的体内, 损伤鳃表皮细胞,导致血液中氨浓度的增加, 降低了载氧能力,从而使得鱼体内某些酶失活或异变,具体表现为组织机能损伤或代谢机能无法正常运行。而提高养殖水体含氧量,可加快水中含氮物质的硝化与反硝化作用,将有害的氨态氮、亚硝态氮转化成硝酸态氮,从而被浮游植物吸收利用[20]。
1)鱼虾蟹养殖与循环水养殖相结合的生态养殖系统对养殖废水中的营养盐具有一定程度的净化效果,且随着时间推移系统的净化能力逐渐上升,各项数据趋于稳定,但总体去除效率有待进一步加强,今后可通过加大水生植物种植密度、水草投放量、集污区污物抽出频率等方式进一步改善。
2)较之传统循环水养殖业,一方面,该养殖模式在一定程度上将“封闭净水”转为循环流水,通过“异位修复”的水环境调控实现养殖尾水“零排放”;另一方面,通过新增虾蟹池功能区,在保证系统净化效果的同时,提高了养殖的综合效率,对水产生态集约化养殖的发展具有积极意义。
[1] 陈东兴,蔡春芳,华雪铭,等.鱼、虾、蟹养殖池塘清塘排水水质及污染强度[J].淡水渔业,2015,45(1):30-34.
[2] XIAO R C,WEI Y G,AN D,et al.A review on the research status and development trend of equipment in water treatment processes of recirculating aquaculture systems[J].Reviews in Aquaculture,2019,11(3):863-895.
[3] 何玉明,周凤建,陈文永,等.池塘工业化生态养殖系统排出水槽集污区污物处理方式探讨[J].科学养鱼,2017(8):18-19.
[4] 吴凡,刘晃,宿墨.工厂化循环水养殖的发展现状与趋势[J].科学养鱼,2008(9):72-74.
[5] 张曦文,吴垠,贺茹靖,等.循环水养殖模式下养殖密度对青石斑鱼生长及生理指标的影响[J].大连海洋大学学报,2012,27(6):518-522.
[6] 章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京:科学出版社,1991.
[7] 李娜,黎佳茜,李国文,等.中国典型湖泊富营养化现状与区域性差异分析[J].水生生物学报,2018,42(4):854-864.
[8] 李昆,李兆华,陈红兵,等.丹江口水库上游武当山剑河水质空间差异性分析[J].湖泊科学,2013,25(5):649-654.
[9] 侯伟,黄成,江启明,等.粤北三座典型中型水库富营养化与浮游植物群落特征[J].生态环境学报,2011,20(5):913-919.
[10] 张家路.上海青草沙水库及周边水域浮游植物群落结构的研究[D].上海:上海海洋大学,2017.
[11] 唐毅,郑永华,刘建虎,等.横江中下游春季浮游植物群落结构及多样性分析[J].淡水渔业,2016,46(1):51-58.
[12] CHAI Q Y,JU Y F.Biological evaluation based quality management of water resources in small Xingkai Lake[J].Asian Agricultural Research,2017,9(11):37-40.
[13] 高岩,张映东,胡文革,等.新疆石河子市蘑菇湖水库浮游动物的群落特征及营养状态评价[J].动物学杂志,2018,53(6):890-898.
[14] 贺伟平.养殖水体氨氮、亚硝酸盐超标及防治[J].云南农业,2010(12):49.
[15] 蒙烽,黄龙,韦木莲,等.生态塘对养殖池塘水氨氮和亚硝态氮去除的研究[J].科学养鱼,2019(6):68-69.
[16] 孙濡泳.动物生态学原理[M].3版.北京:北京师范大学出版社,2001.
[17] 叶文虎,栾胜基.环境质量评价学[M].北京:高等教育出版社,1994:150.
[18] 吴恢碧,李谷,陶玲,等.循环流水池塘养殖系统浮游植物群落结构与特征[J].华中农业大学学报,2008,27(5):648-653.
[19] 王玉彬.茅莲湖水产养殖池塘中浮游生物的研究[D].南昌:南昌大学,2007:44.
[20] 赵安芳,刘瑞芳,温琰茂.不同类型水产养殖对水环境影响的差异及清洁生产探讨[J].环境污染与防治,2003,25(6):362-364.