视网膜作为鱼类视觉系统中负责成像的重要结构,与其生活习性与捕食习性息息相关[1-3]。视网膜主要依靠感光细胞层完成光线感知与目标成像,感光细胞按其功能不同分为视杆细胞与视锥细胞,其中,视杆细胞主要负责暗视条件下感受弱光[3],视锥细胞主要负责明视条件下的辨色与成像[1-2]。而根据结构的不同,视锥细胞又分为单锥细胞、双锥细胞和三锥细胞等亚型,其中双锥细胞较为常见[1]。视杆细胞在视网膜中的结构与数量直接决定了鱼类视网膜感光能力的高低,即光敏度[1,4-5];视锥细胞中含有吸光度不同的视蛋白,特定类型视锥细胞只对特定波长光照敏感,各类视锥细胞以不同数量与比例、排布进行组合直接决定了鱼类的辨色与成像能力,即视锐度[1,6-8]。
鳜Siniperca chuatsi 是中国特有的名贵淡水经济鱼类,自然条件下终身以活饵为食,白天隐藏在水底,常在晨昏时捕食鱼类[9-11]。目前,已有学者对鳜捕食行为中视觉系统作用进行了研究,如Liang等[10]利用行为学试验证明鳜捕食以视觉为主要感觉;鳜视网膜结构方面已有不少研究,梁旭方[12]利用组织学方法对鳜视网膜各层结构进行了描述,指出其视网膜中含有大量视锥细胞,适宜感受弱光;魏开建等[13]、田文斐等[14]利用组织学方法对鳜视网膜早期发育特征进行了描述,均发现鳜视网膜在发育阶段视杆细胞、视双锥细胞大量增长,并指出这种视觉结构的变化与其从浮游到底栖的生态迁移及捕食方式的变化相适应;Zhang等[15]对鳜视网膜感光细胞层结构进行了研究,对其感光细胞的超微结构分析发现,鳜视杆细胞与视双锥细胞结构有利于鳜适应暗光下的生活,但发育各阶段视锥细胞排布规律较差可能导致其视锐度的下降;Zhang等[15]、魏开建等[13]均指出,在鳜稚鱼到幼鱼阶段(D21~D56,其中下标数值n代表出膜后的时间(d),记作Dn)的短暂胚后发育时期中,鳜的视觉特点、生活习性均发生了显著变化,由早期具有趋光性的主动摄食转变为趋向于暗光下生活的伏击型捕食,这段特殊的发育时期被称为鳜的视觉转变期。
感光细胞是视觉结构的主要组成,感光细胞的发育特点是分析鱼类不同发育时期视网膜结构及视觉特点的重要内容。目前,针对鳜视网膜感光细胞层的发育与结构变化的研究较少,有很多内容尚待补充。首先,视杆细胞与视锥细胞在视网膜发育各时期的具体数量变化需要阐明,其次,对发育过程中各类感光细胞(视杆细胞、单锥细胞和双锥细胞)在视网膜上的密度变化过程的研究尚未见报道,此外,鳜视网膜发育中大量出现的视杆细胞是否影响视锥细胞排布的规律性尚需进行研究。利用组织学方法对鳜视网膜发育中感光细胞进行准确计数较为困难,主要表现为鳜视杆细胞外节细长且轮廓模糊,难以计数,而视单椎、双椎细胞由于椭球体和外节部分限于观察角度不同,易将二者混淆。本研究中,基于鳜视网膜明暗适应时感光细胞层的结构变化,利用免疫荧光技术实现了对视杆细胞的计数和单双锥细胞的识别,对鳜视觉转变期视杆细胞与视锥细胞的数目增长与分布特点进行了详细的分析,同时对视杆细胞与视锥细胞排布构建的相关性进行了证明,旨在揭示鳜视网膜感光细胞层的发育过程和特点,为进一步研究鳜适应暗光下底栖生活提供重要资料。
1 材料与方法
1.1 材料
鳜Siniperca chuatsi鱼苗取自上海市浦东新区孙农水产养殖场。鳜视杆细胞与视双锥细胞在D12~D14(体长为9.5~12.5 mm)零星出现,而视杆细胞与视双锥细胞数量在D23(体长为20~25 mm)以后明显升高,特别是D28(体长为25~35 mm)以后视杆细胞数量急剧上升,视双锥细胞大量出现[13,15],而至D56(体长为85~100 mm)以后视网膜结构已与成鱼结构相仿[12-15]。为分析各类感光细胞的生长特点,验证视杆细胞数量上剧烈增加对视锥细胞排布构建的影响,本试验中在鳜视觉转变期均匀地选取3个采样时间点 (D28、D42和D63),采样过程中确保所采样本在每个特定发育阶段的鱼苗规格基本一致。视网膜光适应采样方法同Zhang等[15],明适应的鳜在自然光下直接取样,暗适应的鳜在无光条件下暗适应5 h后采样。
1.2 方法
1.2.1 视网膜组织切片 D 28、D42和D63各时期选取规格一致的鳜鱼苗5尾,浸入MS-222溶液中麻醉后选取鳜左眼角膜处正上方扎一小孔定位,将样本头部固定于2%多聚甲醛溶液48 h。用精密解剖剪将眼球取出,用1×PBS溶液漂洗,在体视镜下用手术工具剥离多余组织,分离出完整视网膜组织。用梯度乙醇处理视网膜组织(25%→50%→75%→85%→95%,均为体积分数),在各体积分数的乙醇中均浸泡30 min,最后在体积分数为100%的无水乙醇中浸泡1 min,取出后用二甲苯透明1 min,浸蜡3 h后包埋。利用Leica RM2235切片机以5 μm厚度做视网膜切向切片,用于后续H.E染色、免疫荧光观察。
1.2.2 组织切片H.E染色 将“1.2.1节”中的视网膜组织切片置于二甲苯中脱蜡2次(15 min×2),用梯度乙醇复水(100%→95%→85%→75%→50%,均为体积分数),即在各体积分数的乙醇中浸泡5 min后,将切片置于蒸馏水中5 min,苏木精染液染15 min;水洗10 min,用体积分数为1%的盐酸-乙醇浸泡后,蒸馏水冲洗,用质量分数为 0.5%的伊红液染色1~3 min。再用梯度乙醇脱水,方法与复水时的操作相反,二甲苯处理后,用中性树胶封片。
1.2.3 免疫荧光 紧密连蛋白(Zonula occluden-1,ZO-1)分布于细胞间贴合面,基于这一分布特征常利用转基因或免疫荧光手段对其进行荧光标记,其荧光信号可以描绘细胞轮廓与细胞群体排列[16-17];极性蛋白(Crumbs)在细胞的极性生长与稳定细胞群体排列方面发挥重要作用[18]。本研究中,利用极性蛋白Crb2a (Crumbs家族蛋白成员之一)与紧密黏连蛋白ZO-1在细胞群体中分布的相似性与差异性,对视杆细胞计数及与视锥细胞进行区分。具体操作如下:由“1.2.1节”所得组织切片在室温下用二甲苯脱蜡(15 min×2),梯度乙醇复水(体积分数为100%~50%,每个步骤5 min),磷酸盐缓冲液漂洗(1×PBS,10 min×2),PBTX (体积分数0.1% tritonX-100,1×PBS稀释)抗原修复,然后在室温下用5%(体积分数)羊血清封闭1 h,4 ℃下一抗孵育过夜,使用的一抗和稀释液详见表1。按上述方法漂洗与封闭后,用二抗(体积分数为5%的羊血清稀释鼠抗IgGHRP 1∶1 000)孵育3 h,浸泡于PBTX中(1×PBS稀释的Tween-20),PBS漂洗后,用TSATM加双荧光素标记二级抗体(表1),用TSA-F(1∶100,2 h)标记鼠抗IgGHRP,按上述方法冲洗封闭,加入二级抗体(兔抗IgGHRP 1∶1 000),4 ℃孵育过夜,用TSA-T(1∶100,2 h)标记兔抗IgGHRP,PBS冲洗,梯度乙醇复水、封片。图像采集使用尼康SMZ250荧光显微镜或徕卡SP5扫描共焦显微镜(Wetzlar,Germany)。
1.2.4 视网膜的光适应与视杆细胞计数 在预试验中,有光条件下鳜视网膜中视锥细胞外段椭球体紧密地黏附在一起,并将视杆细胞挤压在狭窄的间隙中,因此,较难对视杆细胞进行区分和计数;相反,在暗适应后,视网膜运动发生,视锥细胞椭球体黏附强度逐渐减弱,视杆细胞分布在视锥细胞扩大的间隙之间,从而在免疫荧光标记的组织切片中可以清楚地识别视杆细胞,同时,也可对单锥与双锥细胞进行很好地识别(图1(a)、(b))。此外,鳜视网膜胚后发育过程中视杆细胞和视锥细胞直径并未出现显著变化[15]。综上,在暗适应后对视网膜组织切片进行免疫荧光处理后,使用Image J软件对视网膜特定区域(100 μm2)的视杆细胞与视锥细胞进行计数。

蓝色箭头示视锥细胞椭球体结构部分; 白色箭头示双锥细胞椭球体横切面;绿色箭头示单锥细胞椭球体横切面。
The blue arrow is the ellipsoid structure of the cone cell;The white arrow is the ellipsoid cross section of double cone cell;The green arrow is the ellipsoid cross section of single cone cell.
图1 明暗适应下鳜视网膜的结构变化与免疫荧光效果
Fig.1 Structural changes and the effect of immunofluorescence in retina of mandarinfish exposed to light and dark adaptation
1.2.5 视网膜分区与数据采集 鳜视网膜不具有中央凹结构,视锥细胞在视网膜中分布虽有区域性,但整体较为均匀[13,15]。故本试验中将视网膜分为4区(D-N,背-鼻区; D-T,背-颞区;V-N,腹-鼻区; V-T,腹-颞区),同时视网膜边缘有一狭窄的生成带,均为感光细胞前体,形态不易区分,本研究中未做讨论(图2)。特定发育阶段选取5片完整视网膜,在每片视网膜各区域随机采样5次,各区域不同时期各获得16个左右的样本数,进行后续杆细胞数和对应Q4值的统计分析。
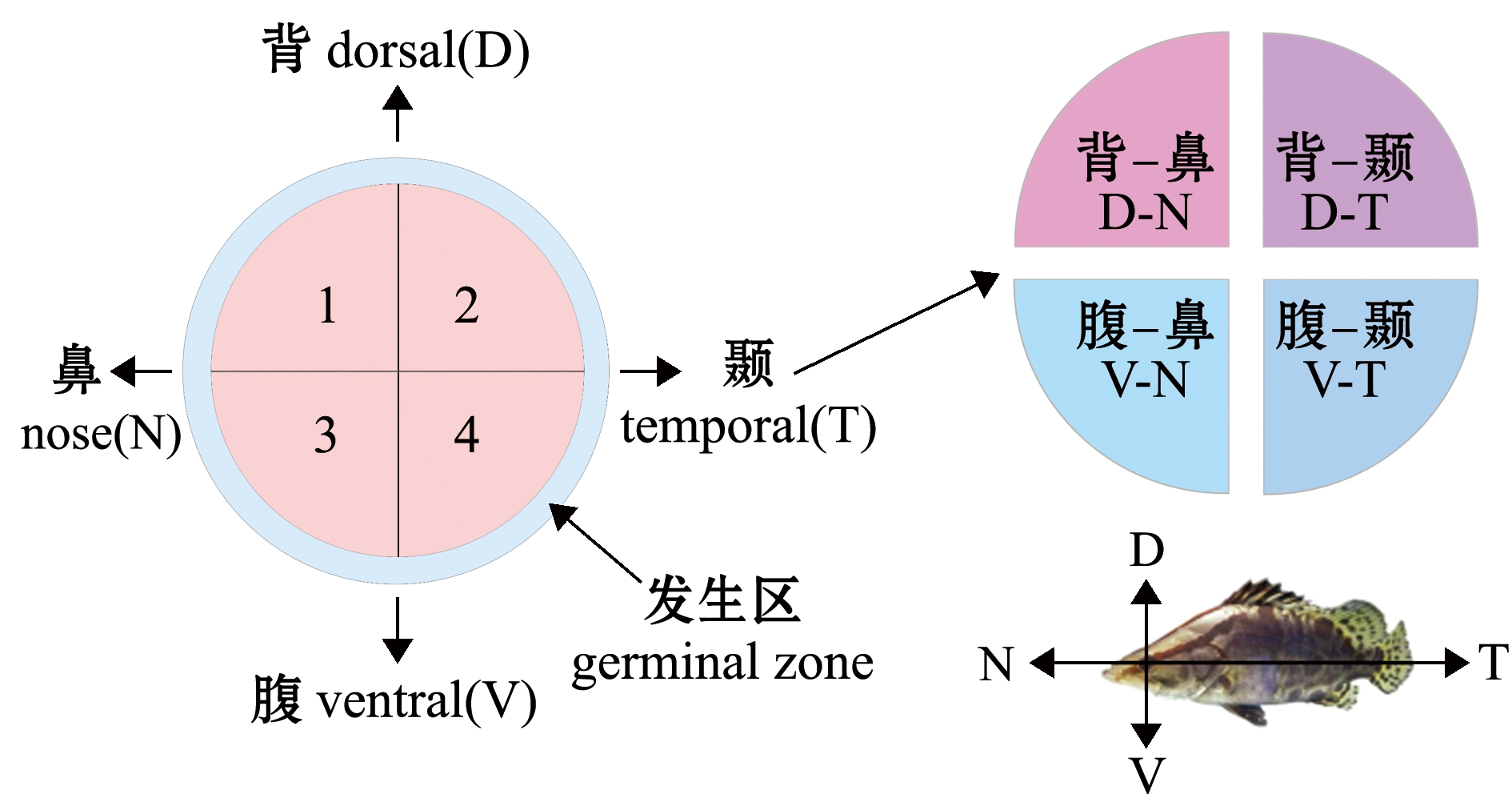
N—鼻侧; D—背侧; T—颞侧; V—腹侧; D-N—背-鼻区; D-T—背-颞区; V-N—腹-鼻区; V-T—腹-颞区; 蓝色窄带示视网膜发生区;左下角示鳜鱼方向与视网膜方向的对应关系。
N—nose side; D—dorsal side; T—temporal side; V—ventral side; D-N—dorsal-nose side; D-T—dorsal-temporal side; V-N—ventral-nose side; V-T—ventral-temporal side; the blue narrow band shows the germinal zone of retina;the lower left corner shows the direction correspondence between mandarinfish and retina.
图2 视网膜分区
Fig.2 Division on retina
1.2.6 视锥细胞排布规则性的定量分析 引入Q4值作为衡量细胞排布规则性的参数,具体算法参照Salbreux等[17]的方法:Q4=0时表示单个细胞相对于其周围细胞排列完全随机,区域细胞群体平均Q4=0时表示细胞总体平面排列完全随机;相反,Q4=1时表示单个细胞相对于外周细胞严格标准化排列,而区域细胞群体平均Q4=1时则表示细胞群呈现出完美的平面排列。基于MATLAB (R2018b)软件(MathWorks,Natick,USA)计算所选图像中视锥细胞群体的Q4值。
1.3 数据处理
试验数据均采用单因素方差分析和最小显著性差异多重比较法进行处理。试验数据以平均值±标准差(mean±S.D.)表示,数据处理使用IBM SPSS 22 软件(Armonk,NY,USA)完成,显著性水平设为0.05。
表1 试验用抗体和荧光显色剂信息
Tab.1 Informations on antibody and fluorescent chromogenic agent in this study
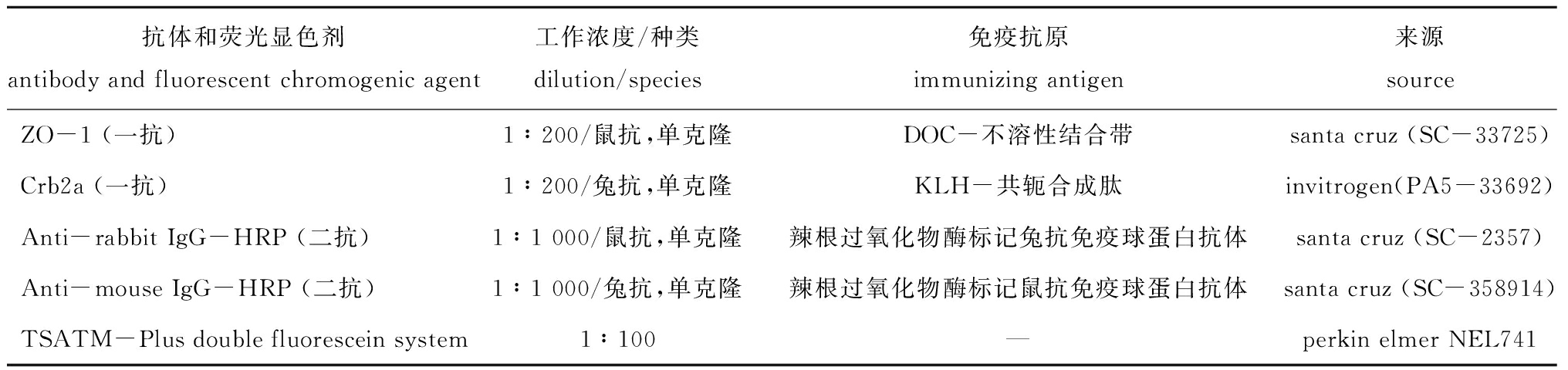
抗体和荧光显色剂antibody and fluorescent chromogenic agent工作浓度/种类dilution/species免疫抗原immunizing antigen来源sourceZO-1 (一抗)1∶200/鼠抗,单克隆DOC-不溶性结合带santa cruz (SC-33725)Crb2a (一抗)1∶200/兔抗,单克隆KLH-共轭合成肽invitrogen(PA5-33692)Anti-rabbit IgG-HRP (二抗)1∶1 000/鼠抗,单克隆辣根过氧化物酶标记兔抗免疫球蛋白抗体santa cruz (SC-2357)Anti-mouse IgG-HRP (二抗)1∶1 000/兔抗,单克隆辣根过氧化物酶标记鼠抗免疫球蛋白抗体santa cruz (SC-358914)TSATM-Plus double fluorescein system1∶100—perkin elmer NEL741
2 结果与分析
2.1 视觉转变期视杆细胞数量的增长特点
从图3(a)、(b)可见:鳜视觉转变期视网膜各区域视杆细胞数均出现显著增长,且各区域D28、D42、D633个时期间均有显著性差异(P<0.05);视网膜腹侧(V侧)视杆细胞数量最多且增长快,如腹-鼻区中100 μm2内视杆细胞数,D28时期为473±178,D42时期为3 101±876,而D63时期已达5 505±1 103;视网膜背侧(D侧)视杆细胞数量在D28、D42、D63时期也出现了显著增长,数量略小于腹侧,但也积累到了较高的数量,如背-颞区中100 μm2内视杆细胞数在D63时期已达5 135±820;发育过程中,视杆细胞在视网膜全区域生长较为均匀,各时期视网膜腹侧与背侧视杆细胞的数量无显著性差异(P>0.05)。
从图3(c)可见:视杆细胞与视锥细胞之比(R/C)在整个视觉转变期发生了剧烈变化,且视网膜各区域D28、D42、D63 3个时期间均有显著性差异(P<0.05);视网膜各区域均表现为视杆细胞逐渐占据感光细胞的主体,如背-颞区中,D28时期R/C平均值为4.3±0.4,而D63时期已上升到42.3±10.6。这种R/C值的显著变化不仅说明同一时期视杆细胞与视锥细胞数量组成情况,也反映出这一时期视杆细胞远高于视锥细胞的增长速度。另外,视网膜各区域D28时期R/C值均未出现显著性差异(P>0.05),但到D42、D63时期,背侧的背-鼻区与背-颞区R/C值均显著高于腹侧的腹-鼻区与腹-颞区 (P<0.05),这也说明视锥细胞在视网膜胚后发育中逐渐出现区域化,腹区视锥细胞数量逐渐高于背区。
2.2 视觉转变期视锥细胞的增长特点
鳜视觉转变期视锥细胞数量的变化较为独特,其中单锥细胞数量在整个发育时期呈现出下降趋势,且视网膜各区域D28、D42、D63 3个时期间单锥细胞数均有显著性差异(P<0.05)(图4(a)),而双锥细胞数量则呈上升趋势,且视网膜各区域D28、D42、D63 3个时期间双锥细胞数均有显著性差异(P<0.05)(图4(b));双锥与单锥细胞数之比(DC/SC)随发育时间的延长明显上升,视网膜各区域D28、D42、D63 3个时期间DC/SC值均有显著性差异(P<0.05)(图4(c))。以背-颞区为例,100 μm2内,随发育时间的延长单锥细胞数量逐渐减少,D28 时期为 31±6,D42 时期为15±9,D63 时期减少至8±3,双锥细胞数量显著提高,D28时期为74±17, D42时期为88±21,D63时期增加至103±17,D28、D42、D63时期DC/SC值分别为2.4±0.3、5.72±0.9、12.8±1.9。
单锥细胞数量在整个视觉转变期平缓下降,而双锥细胞数增长速度在D42~D63时期明显高于D28~D42时期,如D63时期的背-颞区中DC/SC值已达到12.8±1.9,而在DC/SC值较低的腹-鼻区中D63时期数值也达到了6.5±1.1(图4(c))。
在D63阶段,背-鼻区与背-颞区的DC/SC值无显著性差异(P>0.05),腹-鼻区与腹-颞区的DC/SC值也无显著性差异(P>0.05),而背侧(背-鼻区和背-颞区)与腹侧(腹-鼻区和腹-颞区)的DC/SC值存在显著性差异(P<0.05),这说明D63时期腹侧单锥细胞较背侧多,而在D28和D42时期视网膜各区的DC/SC值变化同D63时期,只是没有D63时期DC/SC值变化大(图4(c)),这说明处于视觉转变期的视锥细胞群体中,双锥细胞生成速度明显快于单锥细胞,对各时期一定区域单锥与双锥细胞的统计结果也从侧面证明了这点。
2.3 视杆细胞与视锥细胞排布的相关性
为分析鳜视网膜中视锥细胞间隔处视杆细胞的数量变化是否影响视锥细胞排布,对视网膜不同区域100 μm2内的视杆细胞进行计数。首先对特定时期视网膜各区域感光细胞层进行分析。在D63时期,Crb2a蛋白在视杆细胞和视锥细胞轮廓上有明显的标记,其中在双锥细胞间隔的窄缝中分布较少,大部分分布在细胞间隔处;同时,在锥体细胞间隔处混合了大量的视杆细胞 (图5)。视网膜各时期各区域视杆细胞数与对应视锥细胞排布的平均Q4值如图6所示,如D63时期背侧和腹侧的平均Q4值分别为0.69(n=15)和0.62(n=16),背侧和腹侧的视杆细胞数未随Q4值的变化出现明显浮动(图6E、F),D28、D42时期的视杆细胞数与Q4值的关系也与D63时期相似(图6A~D)。结果表明,在特定发育阶段,视锥细胞间隙的视杆细胞数量与视锥细胞排布规律性无明显相关性。

标有不同小写字母者表示同一区域不同时期间有显著性差异(P<0.05),标有不同大写字母者表示同一时期不同区域间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Means with different small letters are significant difference in different developmental periods in the same region (P<0.05),means with different capital letters are significant differences in different regions with the same developmental period (P<0.05),and means with the same letters are not significant difference between groups (P>0.05), et sequentia.
图3 鳜视觉转变期视杆细胞增长特点
Fig.3 Growth characteristics of rod cell in mandarinfish during visual transition period
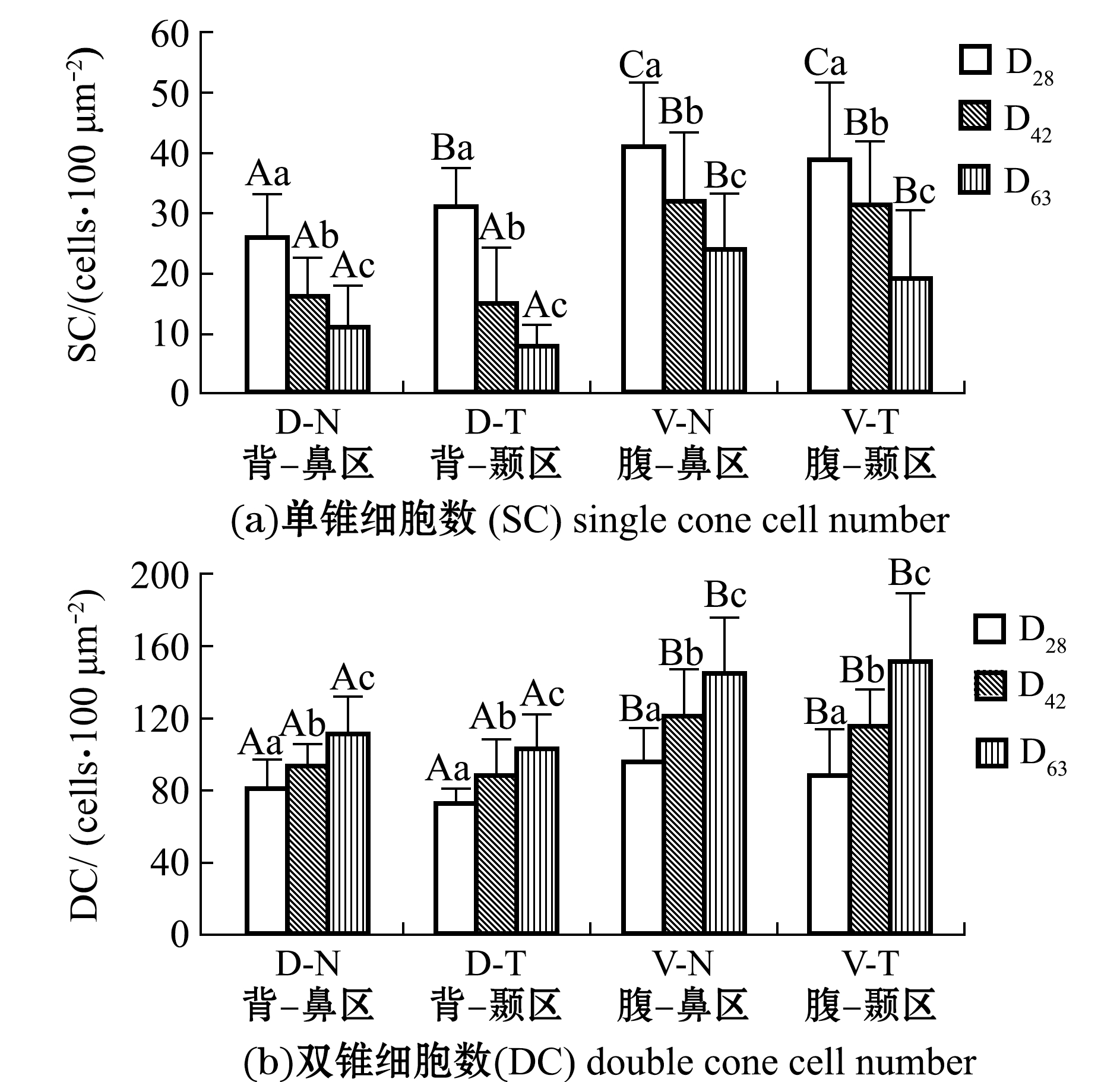
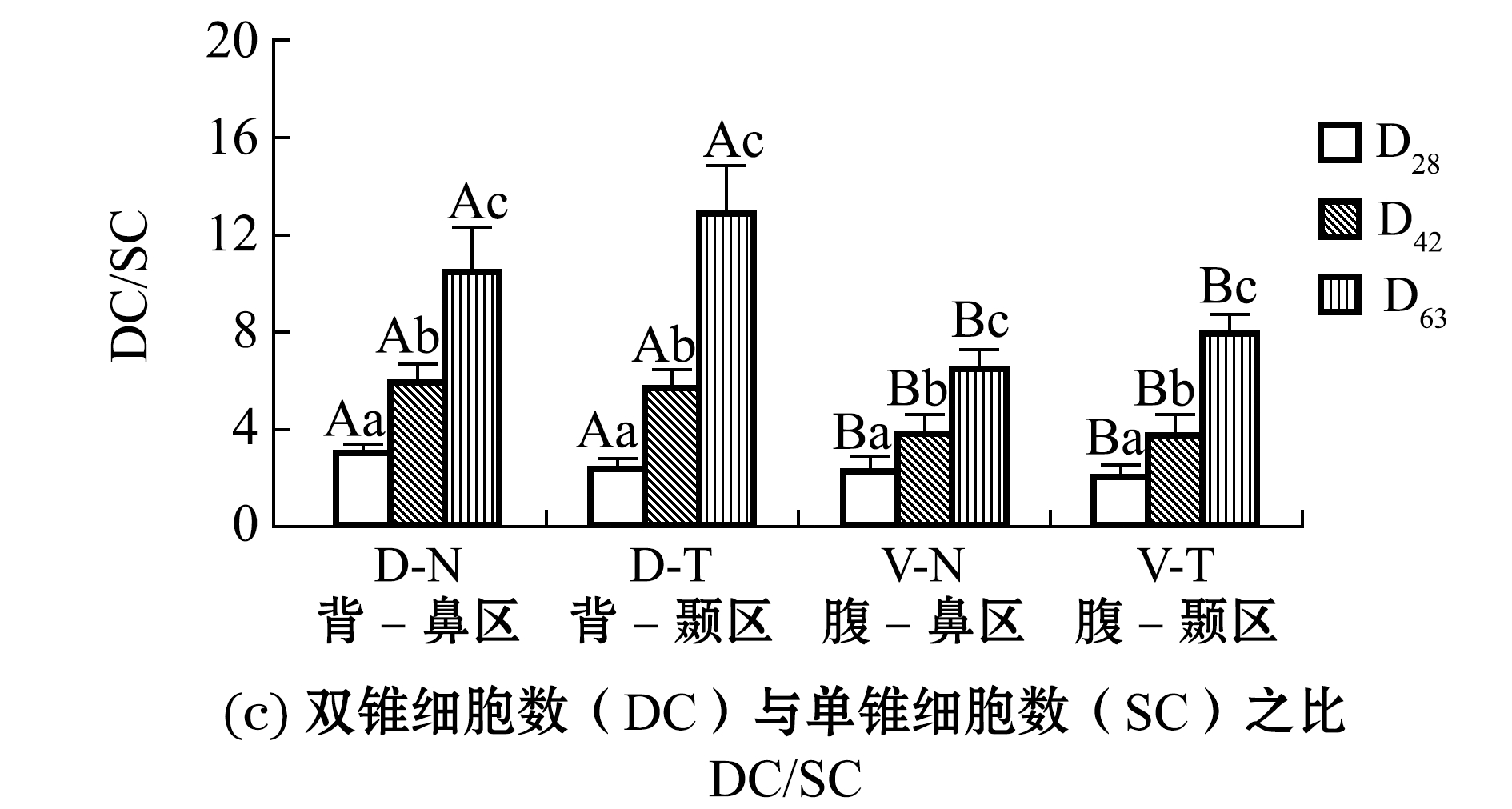
图4 鳜视觉转变期视锥细胞增长特点
Fig.4 Growth characteristics of cone cells of mandarinfish during visual transition period
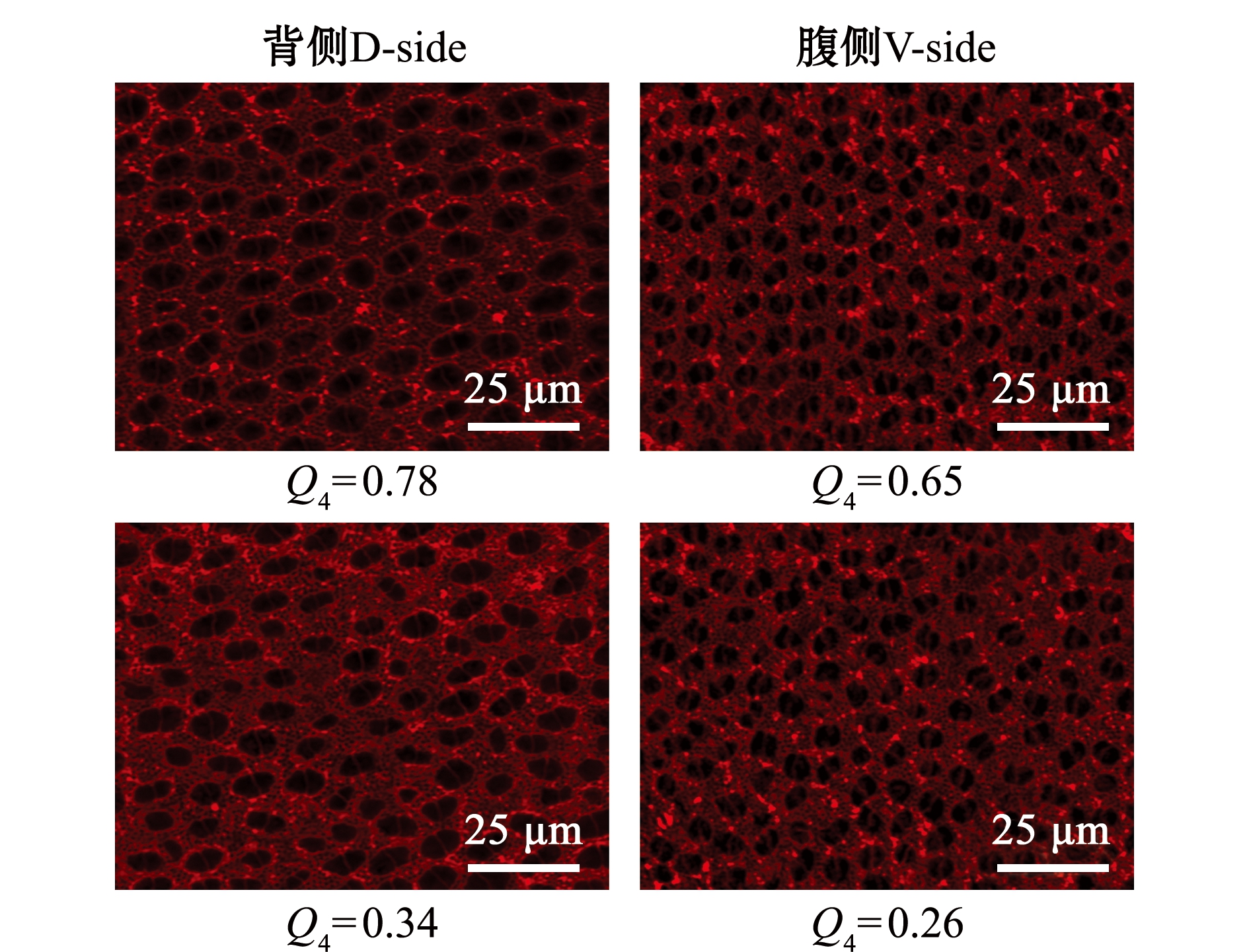
图5 特定时期视网膜视锥细胞排布特点 (以D63为例)
Fig.5 Arrangement characteristics of cone cell mosaic in specific period (i.e.D63)
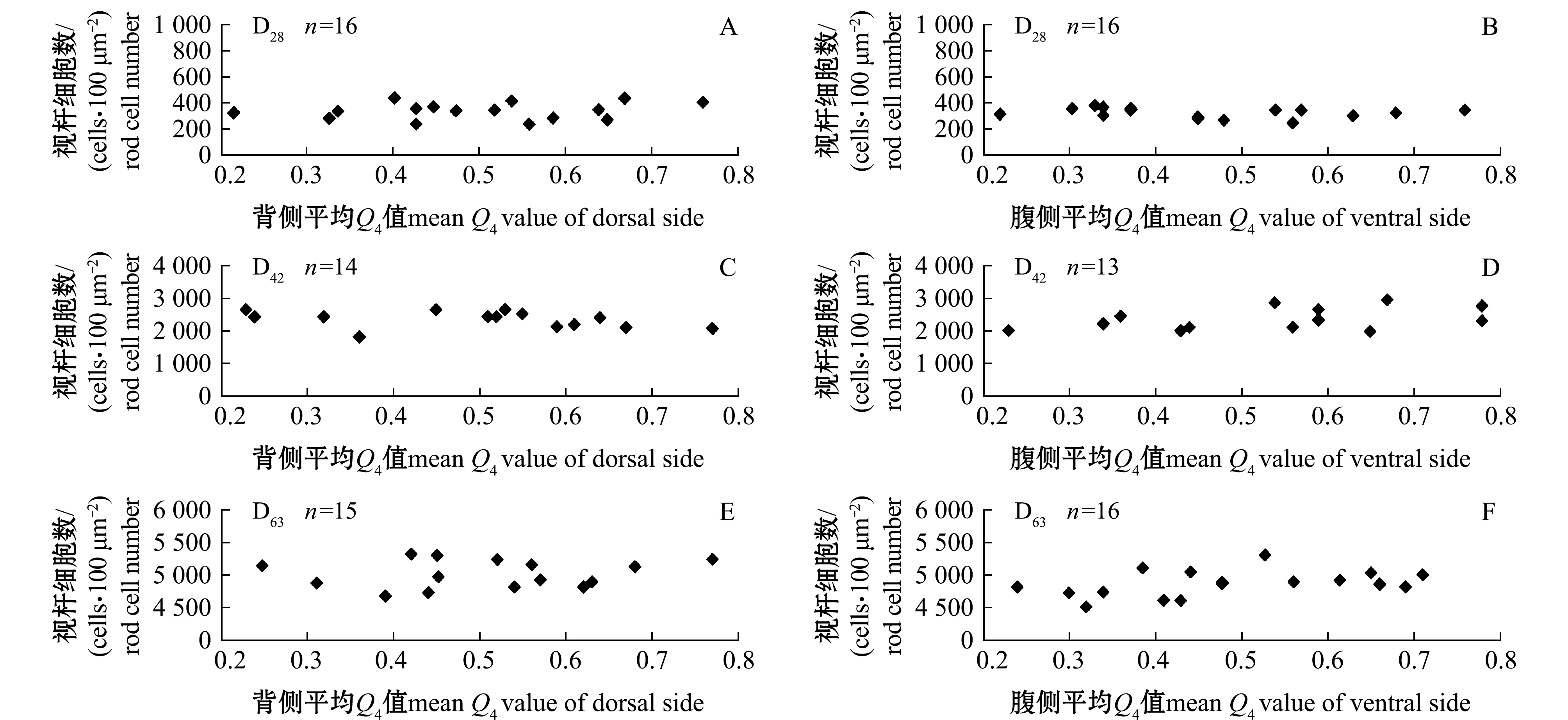
图6 各时期特定区域视杆细胞数与对应视锥细胞排布的平均Q4值的关系
Fig.6 Relationship between the rod cell number and the mean Q4 value of cone cell mosaic in each period
在D28时期,视杆细胞以较低密度分布在视锥细胞狭窄的间隙中,在D28~D63时期,视锥细胞间隙的视杆细胞数量急剧增加(P<0.01)(图3(a),图7(a));各时期视杆细胞的显著增加并不影响视锥细胞排布,主要表现为平均Q4值无明显变化(P>0.05)(图7(b))。这也说明,在不同发育阶段,视杆细胞数量的急剧增加与视锥细胞排布的规律性无直接关系。
3 讨论
3.1 鳜视觉转变期视网膜中视杆细胞的变化
本研究表明,鳜视杆细胞数量在视觉转变期出现剧烈增长,这与昼间活动鱼类的视网膜结构有明显不同,如斑马鱼视杆细胞数量较少,且终身维持在一定范围内[6,17,19]。同时,鳜视网膜神经节细胞在胚后发育过程中增长缓慢[13-15],大量视杆细胞与下游较少神经节细胞所组成的高度汇聚感受野是增强鱼类视网膜感光能力的关键因素之一[1,3]。本试验中,鳜视网膜胚后发育时期视杆细胞的大量出现,由视杆与视锥细胞数量的比值可以看出,视杆细胞在鳜视觉转变期及后续发育阶段将占据感光细胞的绝对主体。推测鳜D63时期,视杆细胞与神经节细胞汇聚程度增高,这种结构极大增强了鳜视网膜对于光线的敏感性。视杆细胞急剧增长也与此阶段鳜生活习性、捕食习性的变化相对应,主要表现为鳜视网膜感光能力增强,鳜苗逐渐畏惧强光,趋于暗光下活动[9,12]。
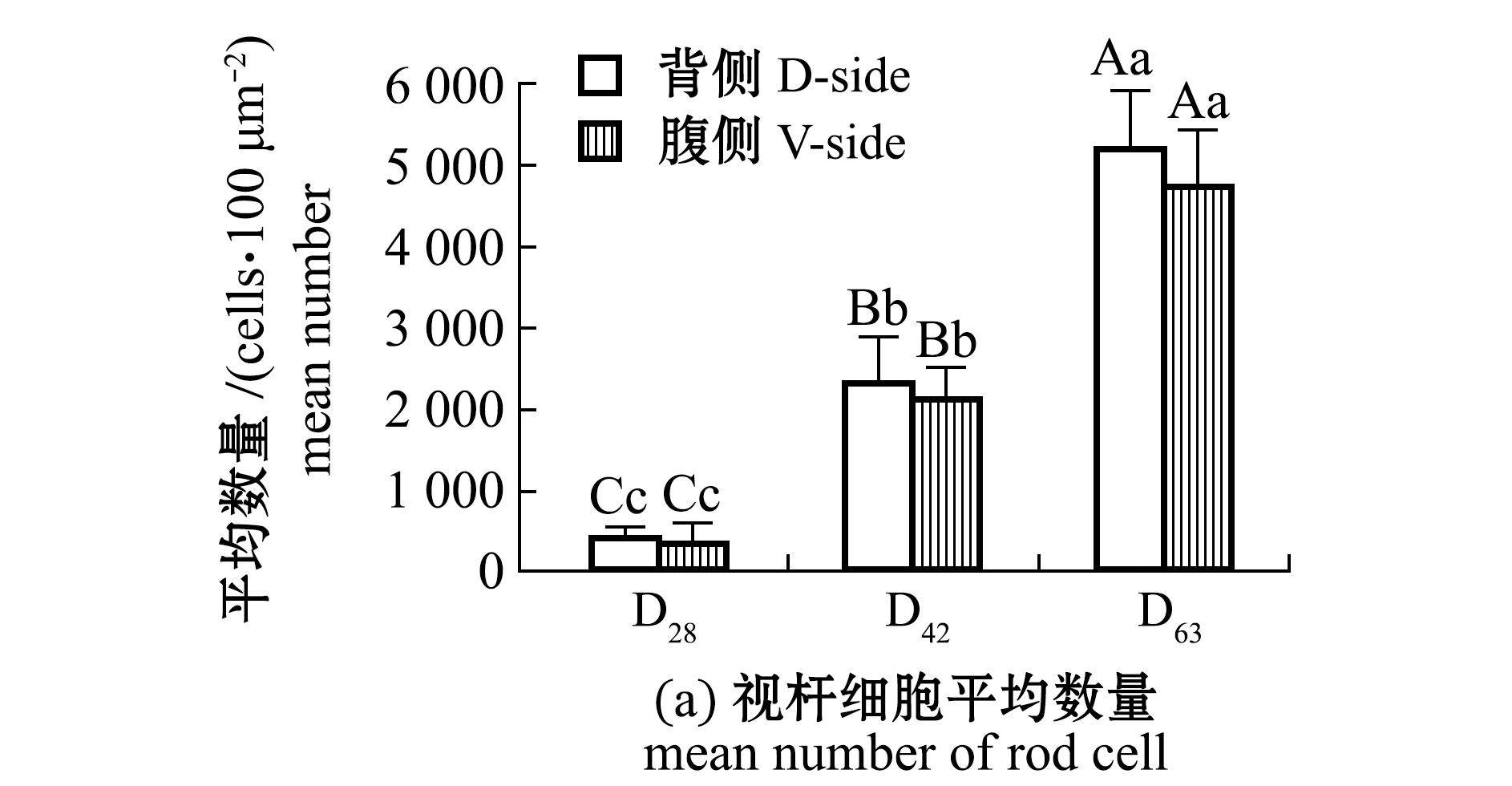
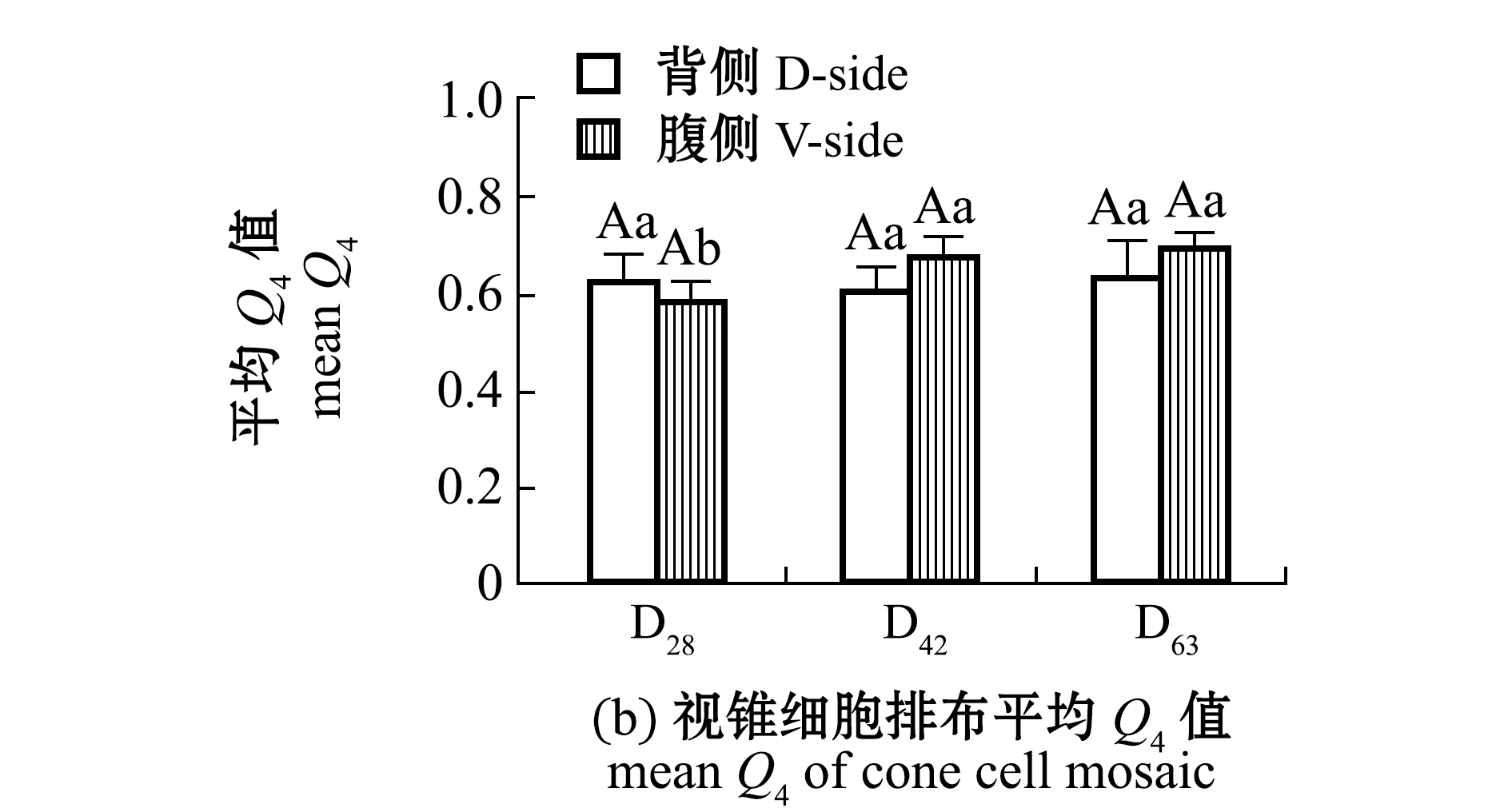
标有不同小写字母者表示组间有显著性差异(P<0.05),标有不同大写字母者表示组间有极显著性差异(P<0.01),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different small letters being significantly different at the 0.05 probability level, the means with different capital letters are significantly different at the 0.05 probability level, and the means with the same letter are not significant differences.
图7 各时期视杆细胞平均数量与视锥细胞排布的平均Q4值
Fig.7 Average rod cell number and the mean Q4 of cone cell mosaic in each period
3.2 鳜视觉转变期视网膜中视锥细胞的变化
本研究中视觉转变期,鳜视网膜中双锥细胞逐渐占据了视锥细胞的主体。而双锥细胞的大量出现被认为是鱼类视网膜增强其感光能力的适应性结构变化,主要表现为视锥细胞与下游神经节细胞而言逐渐失去了一对一的精确对应关系,辨色能力与成像能力下降,而出现视锥细胞与下游神经节细胞多对一的关系,视锥细胞相对下游神经节细胞汇聚程度增加[1,3]。本研究中D28时期以后,双锥细胞的显著增加与单锥细胞的缓慢增长造成视锥细胞种类的单一化,可能造成鳜视网膜胚后发育过程中辨色能力逐步下降。
鱼类视网膜视锥细胞的区域密度与组成直接决定了视网膜在各个方向上的成像能力[20-21]。本研究中,鳜视网膜腹侧单锥细胞数量高于背侧,D42~D63时期腹侧双锥与单锥细胞数量的比值逐步低于背侧,D42时期以后鳜视网膜腹侧单锥细胞含量较多,视锥细胞种类较背侧丰富。这表明鳜视网膜腹侧的成像能力与辨色能力应高于背侧,这也与鳜逐渐营底栖生活捕食水体上层鱼类的捕食习性相对应[12-15]。
3.3 鳜视网膜中视杆细胞发育对视锥细胞排布构建的影响
分化中的视杆细胞与视锥细胞来源于不同的祖细胞[22-23],同时,视杆细胞出现在视锥细胞间隔处的时间比视锥细胞排布形成的时间晚[17,19]。昼间活动的斑马鱼视网膜发育中,视杆细胞对视杆细胞排布的形成并无明显影响[17,19],本研究结果与上述研究结论一致。同时,本研究中提供了新的结论,表明在视网膜发育过程中视杆细胞在视锥细胞排布形成过程中无影响,特别是在一些类似鳜这样栖息于暗光下视网膜中具有丰富视杆细胞的鱼类中,视网膜发育过程中视杆细胞数量的急剧增加并不影响视锥细胞排布的形成。简而言之,鳜视杆细胞数量的增长对视锥细胞排布形成几乎无影响。这也说明在视觉转变期,鳜视网膜趋向于增强感光能力的结构变化过程中,视杆细胞的大量增生并不会影响鳜的视锐度,这使得鳜在视觉转变期中视网膜的结构既适应了暗光感受,又保证了基本的成像能力。
4 结论
1)通过对鳜视觉转变期视网膜中感光细胞发育特征的分析,发现鳜视觉转变期视网膜感光细胞层在结构上发生了剧烈变化,各类感光细胞数量与比例变化明显。
2)视杆细胞在视网膜各区域均匀增长,视锥细胞区域化增长,其中腹侧增长速度明显快于背侧,两个发育过程相互独立,共同为其底栖暗光生活的视觉转变提供结构基础。
[1] EVANS B I,BROWMAN H I.Variation in the development of the fish retina[J].American Fisheries Society Symposium,2004,40:145-166.
[2] CAVES E M,BRANDLEY N C,JOHNSEN S.Visual acuity and the evolution of signals[J].Trends in Ecology & Evolution,2018,33(5):358-372.
[3] DOUGLAS R H,PARTRIDGE J C.VISION I Visual adaptations to the deep sea[J].Encyclopedia of Fish Physiology,2011,1:166-182.
[4] BRAEKEVELT C R.Retinal photoreceptor fine structure in the short-tailed stingray (Dasyatis brevicaudata)[J].Histology and Histopathology,1994,9(3):507-514.
[5] GARZA-GISHOLT E,HART N S,COLLIN S P.Retinal morphology and visual specializations in three species of Chimaeras,the deep-sea R.pacifica and C.lignaria,and the vertical migrator C.milii (Holocephali)[J].Brain,Behavior and Evolution,2018,92(1/2):47-62.
[6] RAYMOND P A,BARTHEL L K.A moving wave patterns the cone photoreceptor mosaic array in the zebrafish retina[J].The International Journal of Developmental Biology,2004,48(8/9):935-945.
[7] COLLIN S P,MARSHALL N J.Sensory processing in aquatic environments[M].2nd ed.New York:Springer,2003.
[8] ALLISON W T,BARTHEL L K,SKEBO K M.Ontogeny of cone photoreceptor mosaics in zebrafish[J].Journal of Comparative Neurology,2010,518(20):4182-4195.
[9] LIANG X F.On the feeding behaviour of mandarin fish (Siniperca chuatsi)[J].Oceanologia et Limnologia Sinica,1995(sup 1):119-125.
[10] LIANG X F,LIU J K,HUANG B Y.The role of sense organs in the feeding behaviour of Chinese perch[J].Journal of Fish Biology,1998,52(5):1058-1067.
[11] LIANG X F,OKU H,OGATA H Y,et al.Weaning Chinese perch Siniperca Chuatsi (basilewsky) onto artificial diets based upon its specific sensory modality in feeding[J].Aquaculture Research,2001,32(sup 1):76-82.
[12] 梁旭方.鳜鱼视觉特性及其对捕食习性适应的研究:II.视网膜结构特性[J].水生生物学报,1994,18(4):376-377.
[13] 魏开建,张海明.鳜鱼视网膜发育的组织学研究[J].华中农业大学学报,1996,15(3):263-269.
[14] 田文斐,钟俊生,钱叶洲,等.鳜仔鱼视网膜及口腔齿的发育对摄食的适应[J].上海海洋大学学报,2012,21(2):190-198.
[15] ZHANG R Q,ZHAO J L,ZHAO Y Y,et al.Retinal development in mandarinfish Siniperca chuatsi and morphological analysis of the photoreceptor layer[J].Journal of Fish Biology,2019,95(3):903-917.
[16] NAGASHIMA M,HADIDJOJO J,BARTHEL L K,et al.Anisotropic Müller glial scaffolding supports a multiplex lattice mosaic of photoreceptors in zebrafish retina[J].Neural Development,2017,12(1):20.
[17] SALBREUX G,BARTHEL L K,RAYMOND P A,et al.Coupling mechanical deformations and planar cell polarity to create regular patterns in the zebrafish retina[J].PLoS Computational Biology,2012,8(8):e1002618.
[18] ZOU J,WANG X L,WEI X Y.Crb apical polarity proteins maintain zebrafish retinal cone mosaics via intercellular binding of their extracellular domains[J].Developmental Cell,2012,22(6):1261-1274.
[19] RAYMOND P A,COLVIN S M,JABEEN Z,et al.Patterning the cone mosaic array in zebrafish retina requires specification of ultraviolet-sensitive cones[J].PLoS One,2014,9(1):e85325.
[20] BROWMAN H I,GORDON W C,EVANS B I,et al.Correlation between histological and behavioral measures of visual acuity in a zooplanktivorous fish,the white crappie (Pomoxis annularis)[J].Brain,Behavior and Evolution,1990,35(2):85-97.
[21] MIYAZAKI T,KOHBARA J,TAKII K,et al.Three cone opsin genes and cone cell arrangement in retina of juvenile Pacific bluefin tuna Thunnus orientalis[J].Fisheries Science,2008,74(2):314-321.
[22] RAYMOND P A.The unique origin of rod photoreceptors in the teleost retina[J].Trends in Neurosciences,1985,8:12-17.
[23] RAYMOND P A,HITCHCOCK P F.How the neural retina regenerates[M]//Fini M E.Vertebrate eye development.Berlin,Heidelberg:Springer,2000.