链球菌是一种条件性人畜共患病病原菌,可感染人类和几乎所有海淡水鱼类,可引起局部组织蜂窝织炎、心内膜炎及化脓性脑膜炎等[1]。目前,发现的水生动物致病性链球菌主要有无乳链球菌Streptococcus agalactiae、海豚链球菌Streptococcus iniae和停乳链球菌Streptococcus dysgalactiae等种类。无乳链球菌又称B群链球菌 (Group B Streptococcus), 是链球菌中重要类型之一[2]。无乳链球菌除可感染人、牛、猪、狗外,还可感染海湾鲱Brevoortia patronus、海鲶Arius felis、罗非鱼Oreochromis niloticus、日本沼虾Macrobrachium nipponense、牛蛙Bullfrog等[3]。如无乳链球菌能够引起新生儿败血症,血液中可分离培养出链球菌,感染后死亡率很高;感染无乳链球菌的罗非鱼在泰国炎热季节的死亡率高达95%,无论是在经济上还是在市场供应方面都造成了重大损失[4];2009、2010年在浙江养殖牛蛙地区发生一种新的无乳链球菌流行病,在蝌蚪和刚变态幼蛙中的发病率已超过了60%,该病死亡率也极高, 通常达60%以上[5]。
水生动物细菌性疾病的防治方法主要有投喂抗生素和化学合成抗菌药物、接种疫苗预防及使用微生态制剂调控等[6]。目前,抗菌药物治疗是中国水生动物细菌性疾病防治的主要手段之一。然而,长期大量使用抗菌药物易导致药物残留、增加病原菌的耐药性,甚至会产生超级耐药菌株。接种疫苗虽具有安全、特异及绿色环保等优点,但仍存在效果不稳定、操作不便等问题,且目前多数水生动物疾病尚无疫苗可用。微生态制剂是在微生物理论指导下,对宿主有益的活性微生物及其代谢产物和促生长物质的制剂,具有维持宿主微生态平衡、提高机体健康水平、拮抗病原及改善养殖水环境等多种作用,已在人类健康及多种水产动物疾病防控中表现出良好功效[7]。本研究中,以重要的水产病原菌——无乳链球菌Streptococcus agalactiae为指示菌,以实验室分离、保存不同来源芽孢杆菌为备选菌株进行病原拮抗菌株筛选及主要拮抗物质分析,以期从微生态制剂防控的角度为水生动物无乳链球菌病防治提供新的思路和参考资料。
1 材料与方法
1.1 材料
备选菌株:本试验所用21株芽孢杆菌分离自盐碱地养殖池塘、海洋牧场或受赠于研究所等地,保存在大连市海珍品疾病防控重点实验室超低温冰箱(-80 ℃)中。
指示菌:无乳链球菌(KCCM11957),由韩国釜庆大学鱼病预防实验室自牙鲆肠道分离鉴定并赠予,保存于大连市海珍品疾病防控重点实验室超低温冰箱(-80 ℃)中。
试剂:分析纯硫酸铵和改良型Bradford蛋白浓度测定试剂盒购于生工生物工程(上海)股份有限公司;相对分子质量为1 000的透析膜和葡聚糖凝胶填料(sephadex-G100)购于索莱宝科技有限公司。
1.2 方法
1.2.1 拮抗菌的筛选与鉴定 拮抗菌的初筛方法参考李云等[8]的报道,采用双层平板法。用接种针或灭菌牙签将备选菌株点种于底层含NaCl质量浓度为30 g/L的NA平板上,28 ℃下倒置培养。待备选菌株形成肉眼可见菌落后,在底层平板上倒入10 mL左右混有109 CFU/mL无乳链球菌的半固体培养基(含30 g/L的NaCl和250 g/L琼脂的NB),于28 ℃培养6~8 h后,观察并测量备选菌株的菌落和抑菌圈直径。将有明显抑菌活性的备选菌株进行复筛。
拮抗菌的复筛方法参照Yang等[9]的报道,采用琼脂扩散法(打孔法)。挑取拮抗菌单菌落于液体培养基中,180 r/min恒温28 ℃振荡培养12 h获得种子液。将种子液按体积分数1%的接种量接种于液体培养基中,28 ℃摇床中培养36 h。取发酵液于4 ℃、4 000 r/min下离心10 min,取上清液,经过0.22 μm滤膜过滤后得到拮抗菌去菌体发酵液(CFS)待用。在半固体培养基灭菌后约45 ℃时加入指示菌菌液,使指示菌终浓度为105~106 CFU/mL后倒板。平板凝固后用直径5 mm的打孔器打孔,加入35 μL的CFS,28 ℃培养12 h后观察结果,并测量抑菌圈直径。选取CFS抑菌效果最好的菌株进行后续试验。
参照《伯杰氏细菌鉴定手册》(第八版)将筛选获得的拮抗菌进行生理生化鉴定。拮抗菌16S rDNA鉴定采用细菌16S rDNA通用引物进行PCR扩增后测序。测序结果在NCBI核酸数据库中进行Blast比对,选择相似度较高序列并使用MEGA软件构建系统发育树。系统进化树分支置信度用1 000次重复自举检验,在计算过程中,系统自动省略不确定和缺失的位点。
1.2.2 抑菌物质的纯化及最小抑菌浓度(MIC)测定 采用硫酸铵沉淀法初步纯化拮抗菌胞外抑菌物质。将CFS于4 ℃时加入硫酸铵,使硫酸铵饱和度分别达到20%、30%、40%、50%、60%、70%、80%,于4 ℃静置过夜,以10 000 r/min离心30 min,收集沉淀。沉淀重悬于0.01 mol/L的PBS缓冲液后,置于相对分子质量为1 000的透析袋透析24 h,测定经不同饱和度硫酸铵沉淀后抑菌物质的抑菌活性。选择最适饱和度硫酸铵纯化物质经Sephadex G-100葡聚糖凝胶柱层析分段分离,用0.01 mol/L的PBS缓冲液洗脱,流速为0.5 mL/min,10 min为一组。经指示菌检测获得抑菌活性最强的组分,取其进行后续检测。
取10个灭菌试管,编号1~10号,并加入NB肉汤1.0 mL。于1号管中加入1.0 mL抑菌活性最强组分溶液并在1~7号管中进行倍比稀释。1~7号管再加入100 μL指示菌。8号管不加抑菌物质,9号管不加指示菌,10号管仅加1.0 mL NB肉汤。于28 ℃培养24 h后观测结果。
1.2.3 抑菌物质的MALDI-TOF-MS和LC-MSMS检测 采用MALDI-TOF-MS(由中国科学院大连化学物理研究所完成)和LC-MSMS(由生工生物工程(上海)股份有限公司完成)法测定菌株抑菌物质成分。
1.2.4 主要抑菌物质的理化特性分析 物理因素对抑菌物质的影响参照Wen等[10]的方法进行。将纯化的活性组分分别置于40、60、80、100、121 ℃温度下孵育20 min,以热处理前样品作为对照,研究温度对活性组分抑菌作用的影响。调节活性组分pH分别为2、4、6、8、10,处理30 min后调节pH至7,以处理前活性组分作为对照,研究pH对活性组分抑菌活性的影响。将活性组分置于20 W紫外灯下分别照射1、3、5 h,照射距离为15 cm,以未用紫外照射的抑菌物质溶液作为对照组,研究紫外照射对活性组分抑菌活性的影响。
化学因素对抑菌物质的影响参照张宝[11]的方法进行。分别加入蛋白酶K、胰蛋白酶、胃蛋白酶,使酶的终质量浓度为1 mg/mL(调节胃蛋白酶处理组pH为2),于37 ℃条件下水浴处理2 h,然后置于100 ℃条件下金属浴5 min,以未添加蛋白酶的抑菌物质作为对照组,研究蛋白酶对活性组分抑菌活性的影响。向活性组分中分别加入等量的甲醇、乙醇和丙酮有机溶剂,置于室温条件下1 h,以不添加有机溶剂的抑菌物质作为对照组,研究有机溶剂对活性组分抑菌活性的影响。将活性组分的pH调节为2,于4 ℃条件下静置12 h。在4 ℃、10 000 r/min条件下离心5 min,收集沉淀。用甲醇抽提沉淀3次,得到拮抗菌的活性组分,利用薄层层析硅胶板进行层析,用质量浓度为5 g/L的茚三酮水溶液显色并观察结果。
2 结果与分析
2.1 无乳链球菌拮抗菌株筛选与鉴定结果
双层平板法筛选结果显示(图1(a)),21株备选菌株中有19株有较明显的抑菌活性(表1),选取上述菌株进行胞外产物的抑菌活性复筛试验(图1(b)),结果表明,共有7株芽孢杆菌的胞外抑菌物质对无乳链球菌产生抑菌活性,其中,菌株BA015的CFS对无乳链球菌的拮抗作用最强,抑菌直径达到(29.2±0.8) mm,故选择BA015进行后续拮抗特性研究。
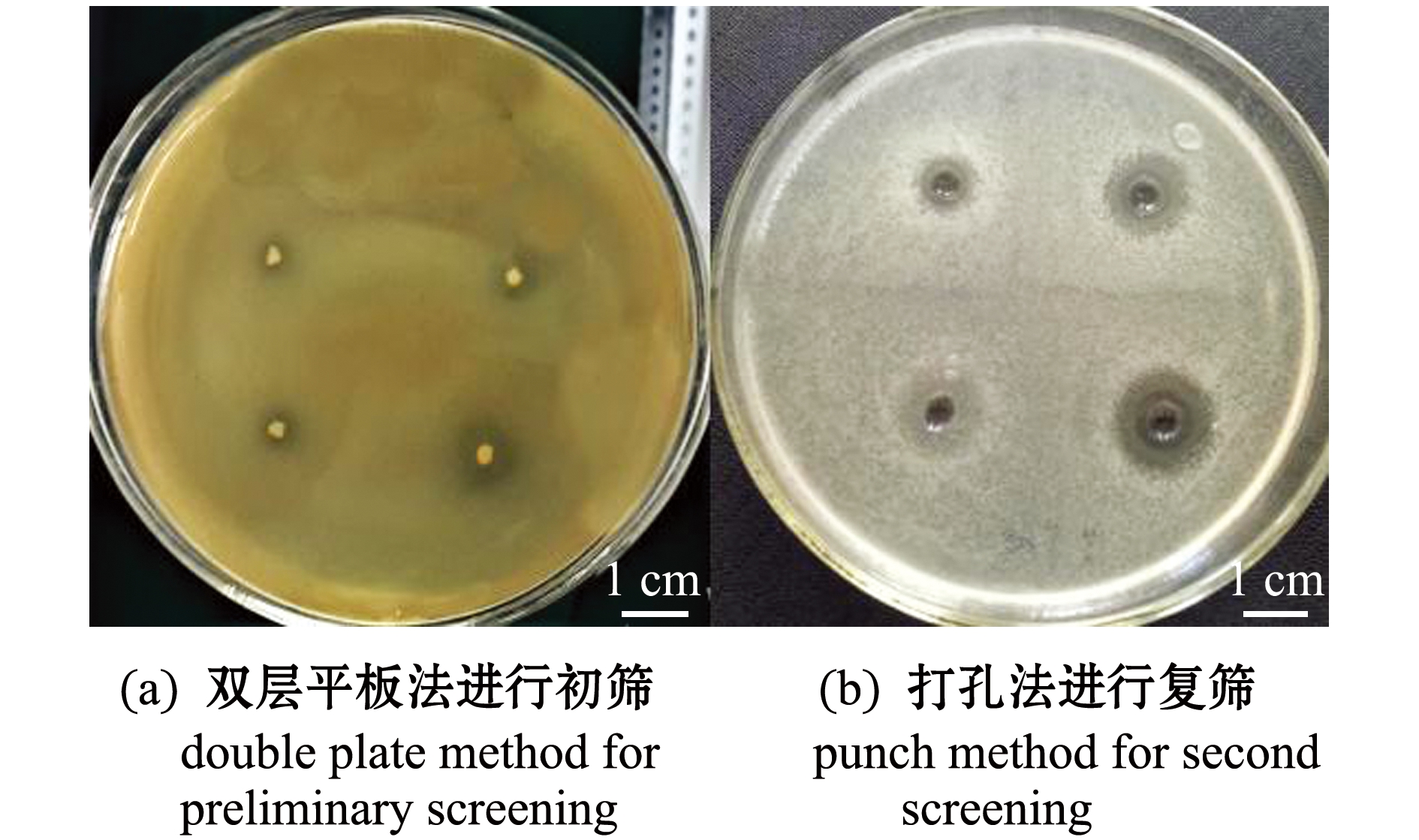
图1 细菌筛选结果
Fig.1 Results of screening of partial bacteria
生理生化试验结果显示,拮抗菌BA015与吲哚、硫化氢不发生反应,与V.P、甘露糖、甘露醇反应为阳性,除肌醇、棉子糖和精氨酸双水解酶外与Bacillus subtilis ATCC 6051基本一致(表2)。16S rDNA序列分析显示,BA015的16S rDNA序列与Bacillus subtilis BEST7613(AP012495.1)的一致性达到99.9%。基于16S rDNA序列构建的系统发育树分析显示,BA015与枯草芽孢杆菌聚为一支(图2)。结合生理生化特性分析,鉴定菌株BA015为枯草芽孢杆菌。
表1 拮抗菌的抑菌活性
Tab.1 Antibacterial activity of antagonistic bacteria
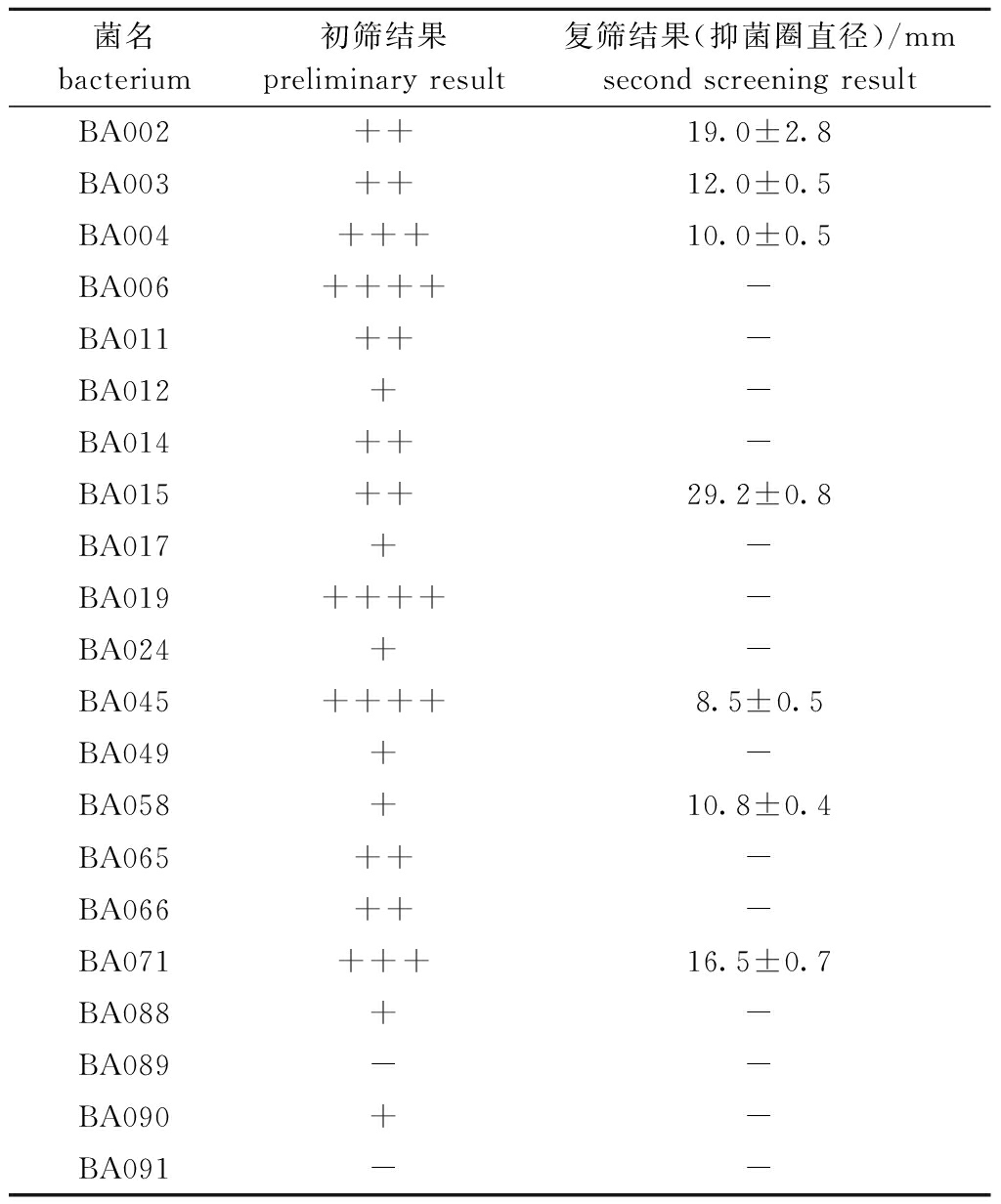
菌名bacterium初筛结果preliminary result复筛结果(抑菌圈直径)/mmsecond screening resultBA002++19.0±2.8BA003++12.0±0.5BA004+++10.0±0.5BA006++++-BA011++-BA012+-BA014++-BA015++29.2±0.8BA017+-BA019++++-BA024+-BA045++++8.5±0.5BA049+-BA058+10.8±0.4BA065++-BA066++-BA071+++16.5±0.7BA088+-BA089--BA090+-BA091--
注:数据为抑菌圈直径与菌落直径的差值(d);+为1 mm≤d<3 mm; ++为3 mm≤d<6 mm; +++为6 mm≤d<9 mm; ++++为d≥9 mm;-为d<1 mm,阴性。
Note:Data are the differences(d) between the diameter of bacteriostasis and the diameter of colony. +, 1 mm≤d<3 mm; ++, 3 mm≤d<6 mm; +++, 6 mm≤d<9 mm; ++++, d≥9 mm;-, d<1 mm,negative.
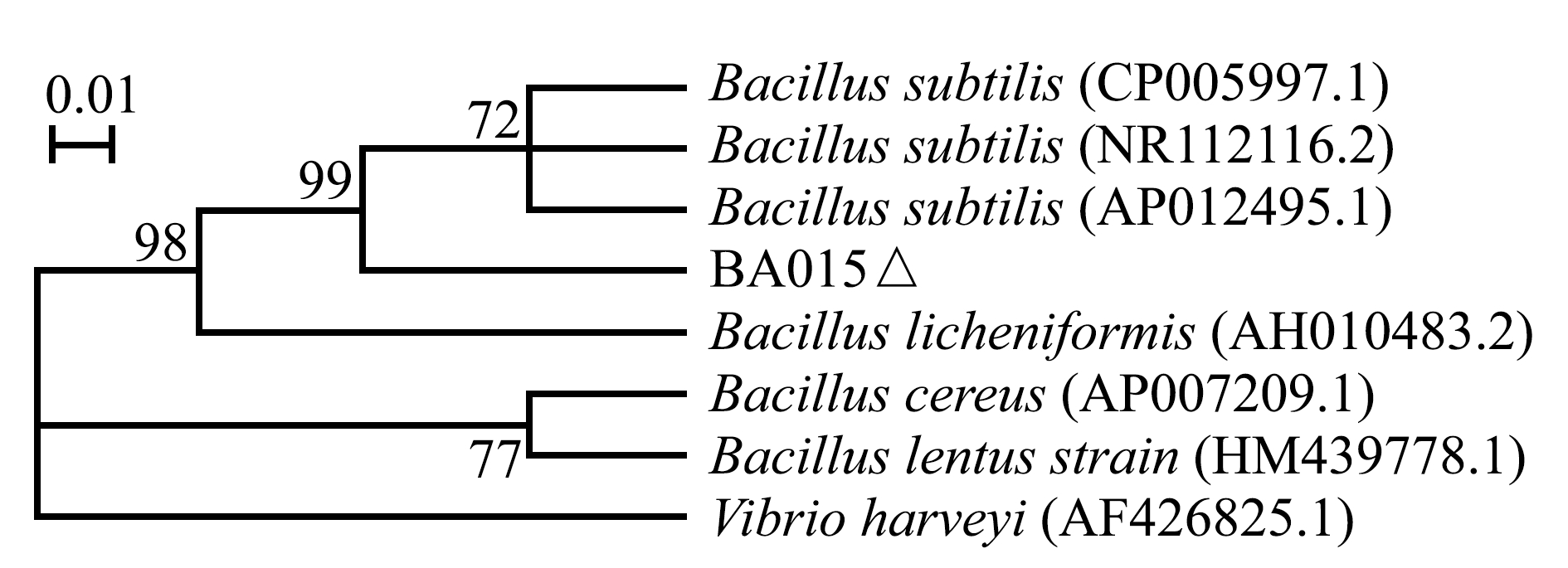
图2 基于菌株BA015 16S rDNA构建的系统发育树
Fig.2 Phylogenetic tree of the strains based on BA015 16S rDNA
2.2 抑菌物质纯化及最小抑菌浓度
拮抗菌BA015的CFS经不同饱和度硫酸铵纯化后的抑菌活性结果显示,采用80%饱和度硫酸铵沉淀提取的抑菌物质对指示菌的抑菌效果最好,抑菌圈直径可达22.8 mm(表3)。80%饱和度硫酸铵盐析后的粗提物经凝胶柱层析后共收集到15组抑菌物质,其中第7、8组抑菌作用最强,抑菌直径分别为22.2、20.8 mm。后经测定发现,活性组分的蛋白质量浓度为103.8 μg/mL,抑菌物质的MIC为3.2 μg/mL,未检测到最小杀菌浓度(MBC)。
表2 拮抗菌BA015的生理生化特征
Tab.2 Physiological and biochemical characteristics of BA015

鉴定项目characteristic itemBA015枯草芽孢杆菌ATCC 6051Bacillus subtilis ATCC 6051革兰氏染色gram stain++吲哚indole--V.P 反应 V.P reaction++硫化氢hydrogen sulfide--硝酸盐还原nitrate reduc-tion++甘露醇 mannitol++甘露糖 mannose++木糖 xylose--阿拉伯糖 arabinose--蔗糖 sucrose++葡萄糖 glucose++果糖 fructose++肌醇 inositol-+柠檬酸盐 citrate++尿素 urea--棉子糖 raffinose-+乳糖 lactose--精氨酸双水解酶 arginine dihydrolase+-七叶灵 esculin++明胶 gelatin++pH 8 生长 growth at pH 8++
注:+为阳性; -为阴性。
Note:+, positive; -, negative.
表3 不同饱和度硫酸铵盐析的抑菌物质的抑菌活性
Tab.3 Antibacterial activity of antibacterial substances salted out by different saturated ammonium sulphate
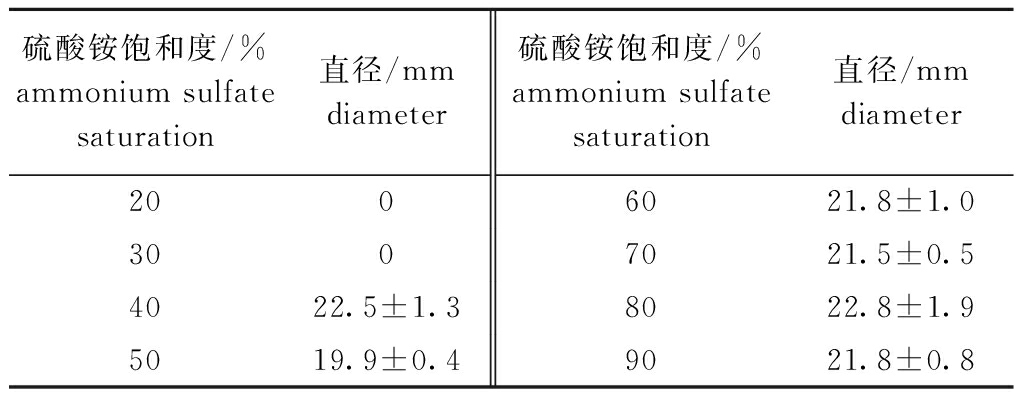
硫酸铵饱和度/%ammonium sulfate saturation直径/mmdiameter硫酸铵饱和度/%ammonium sulfate saturation直径/mmdiameter2006021.8±1.03007021.5±0.54022.5±1.38022.8±1.95019.9±0.49021.8±0.8
2.3 MALDI-TOF-MS及LC-MSMS检测结果
用80%饱和度硫酸铵沉淀的产物经MALDI-TOF-MS质谱分析,结果如图3所示。在荷质比(m/z)为1 054.48、1 068.47处有离子峰出现,这2个离子峰均对应于Iturin B的分子质量;在m/z值为1 031.45、1 045.50、1 053.47、1 067.47、1 055.47、1 069.48处有离子峰出现,这6个离子峰均对应于Bacillomycin D的质量;在m/z值为1 032.49处有离子峰出现,这个离子峰对应于Surfactin B的质量;在m/z值为1 505.69、1 519.65、1 525.68、1 539.65、1 553.65、1 543.64处有离子峰出现,这6个离子峰均对应于Fengycin A的质量(表4)[12-21]。
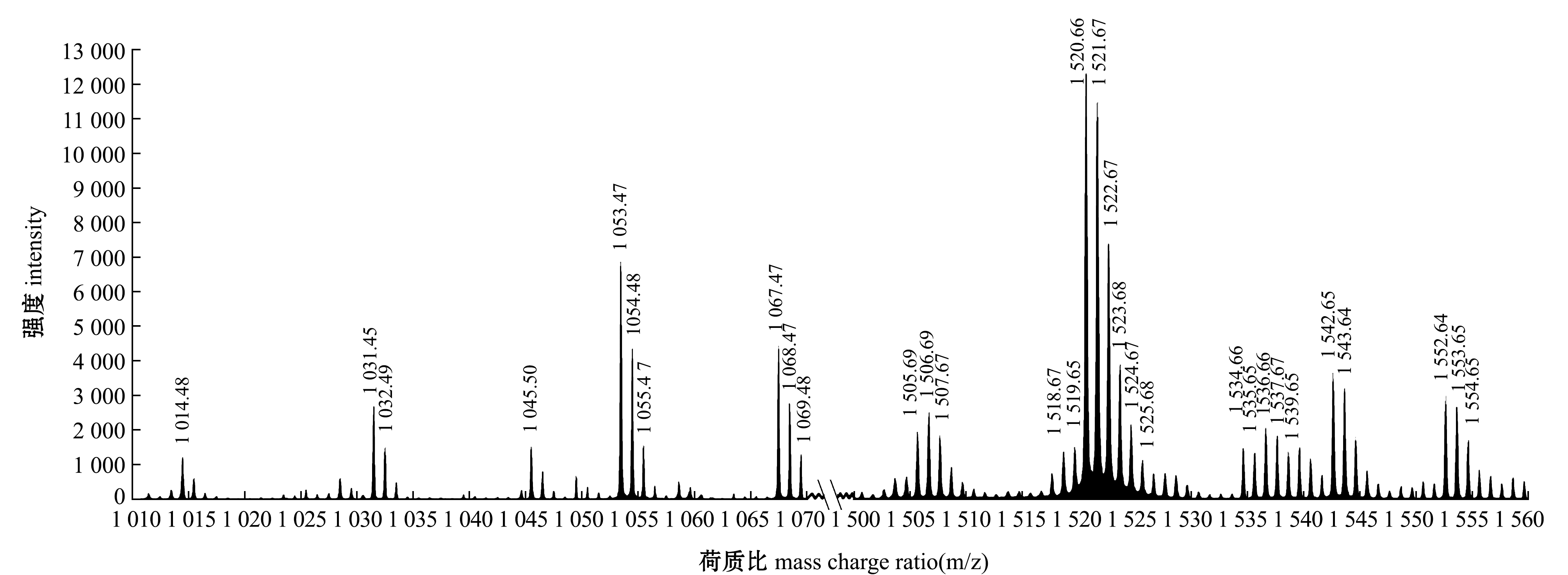
图3 枯草芽孢杆菌BA015脂肽类物质的MALDI-TOF-MS分析
Fig.3 MALDI-TOF-MS analysis of lipopeptide fraction from Bacillus subtilis BA015
LC-MSMS检测质谱数据通过UniProt蛋白质序列数据库进行检索分析,比对酶切肽评分值较低,共检测到21个可信蛋白比对结果,未见有抗菌活性的相关报道。
2.4 拮抗菌活性组分的主要特性
从表5可见:温度处理试验显示,芽孢杆菌活性组分热稳定性良好,不同温度处理后各组的抑菌活性仅略有降低,但组间差异不明显;pH处理试验显示,芽孢杆菌活性组分对pH不敏感,pH适应范围广,不同酸碱条件处理后各处理组的均保持良好;紫外照射处理试验显示,芽孢杆菌活性组分对紫外不敏感,具有较好稳定性,几乎不受紫外照射影响;拮抗菌BA015活性组分可与茚三酮水溶液反应显红色;蛋白酶处理试验显示,芽孢杆菌活性组分抑菌活性对其不敏感,抑菌活性仍保持稳定;有机溶剂处理试验显示,芽孢杆菌活性组分抑菌活性对其不敏感,乙醇处理组与对照组相比,直径大小仅损失约10%。
表4 活性组分的MALDI-TOF-MS质谱分析
Tab.4 Analysis of the active components by MALDI-TOF-MS mass spectrometry
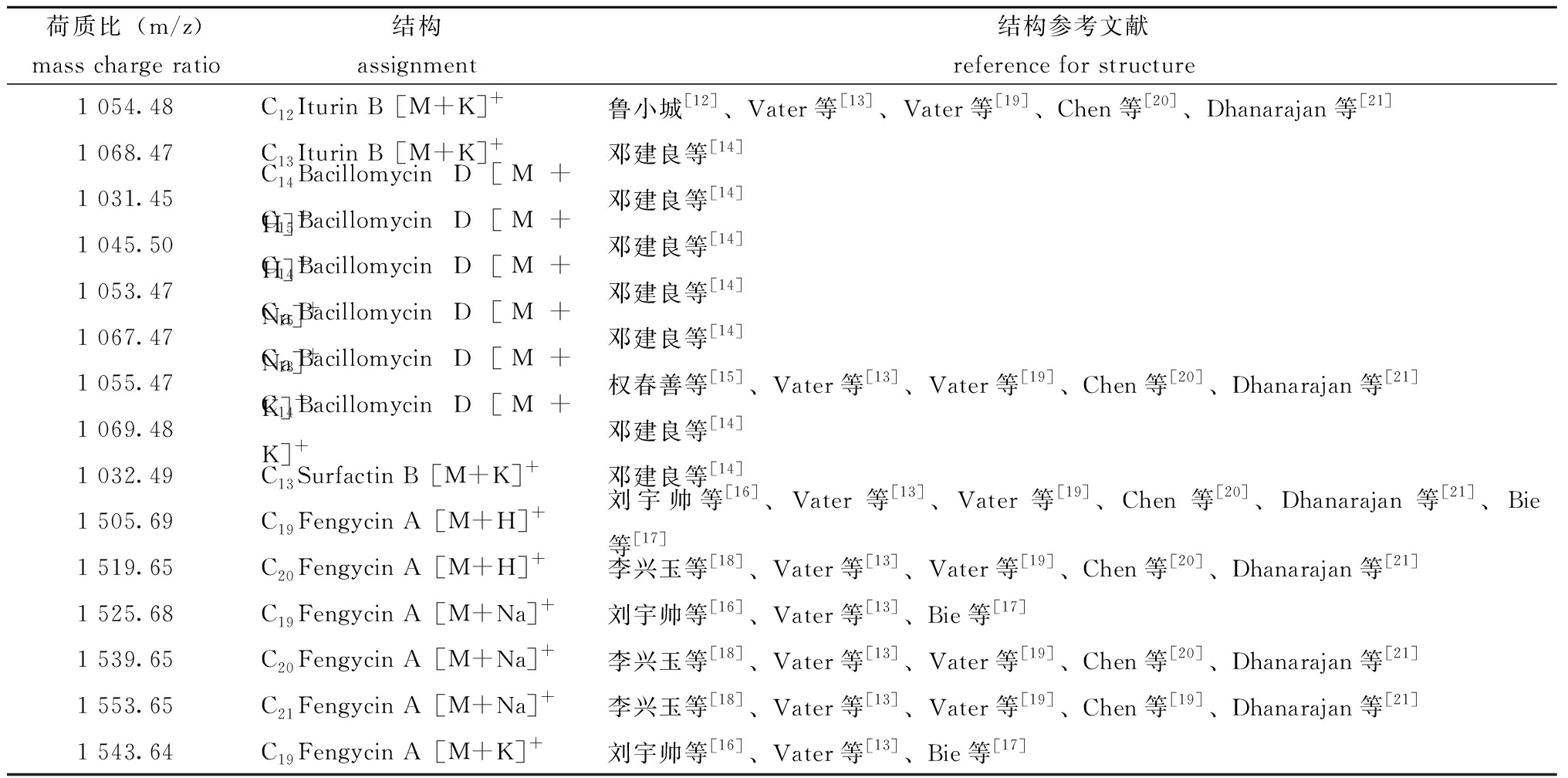
荷质比(m/z)mass charge ratio结构 assignment结构参考文献reference for structure1 054.48C12Iturin B[M+K]+鲁小城[12]、Vater等[13]、Vater等[19]、Chen等[20]、Dhanarajan等[21]1 068.47C13Iturin B[M+K]+邓建良等[14]1 031.45C14Bacillomycin D[M+H]+邓建良等[14]1 045.50C15Bacillomycin D[M+H]+邓建良等[14]1 053.47C14Bacillomycin D[M+Na]+邓建良等[14]1 067.47C15Bacillomycin D[M+Na]+邓建良等[14]1 055.47C13Bacillomycin D[M+K]+权春善等[15]、Vater等[13]、Vater等[19]、Chen等[20]、Dhanarajan等[21]1 069.48C14Bacillomycin D[M+K]+邓建良等[14]1 032.49C13Surfactin B[M+K]+邓建良等[14]1 505.69C19Fengycin A[M+H]+刘宇帅等[16]、Vater等[13]、Vater等[19]、Chen等[20]、Dhanarajan等[21]、Bie等[17]1 519.65C20Fengycin A[M+H]+李兴玉等[18]、Vater等[13]、Vater等[19]、Chen等[20]、Dhanarajan等[21]1 525.68C19Fengycin A[M+Na]+刘宇帅等[16]、Vater等[13]、Bie等[17]1 539.65C20Fengycin A[M+Na]+李兴玉等[18]、Vater等[13]、Vater等[19]、Chen等[20]、Dhanarajan等[21]1 553.65C21Fengycin A[M+Na]+李兴玉等[18]、Vater等[13]、Vater等[19]、Chen等[19]、Dhanarajan等[21]1 543.64C19Fengycin A[M+K]+刘宇帅等[16]、Vater等[13]、Bie等[17]
表5 理化因素对活性组分抑菌活性的影响
Tab.5 Effects of physical and chemical factors on antimicrobial activity of active components
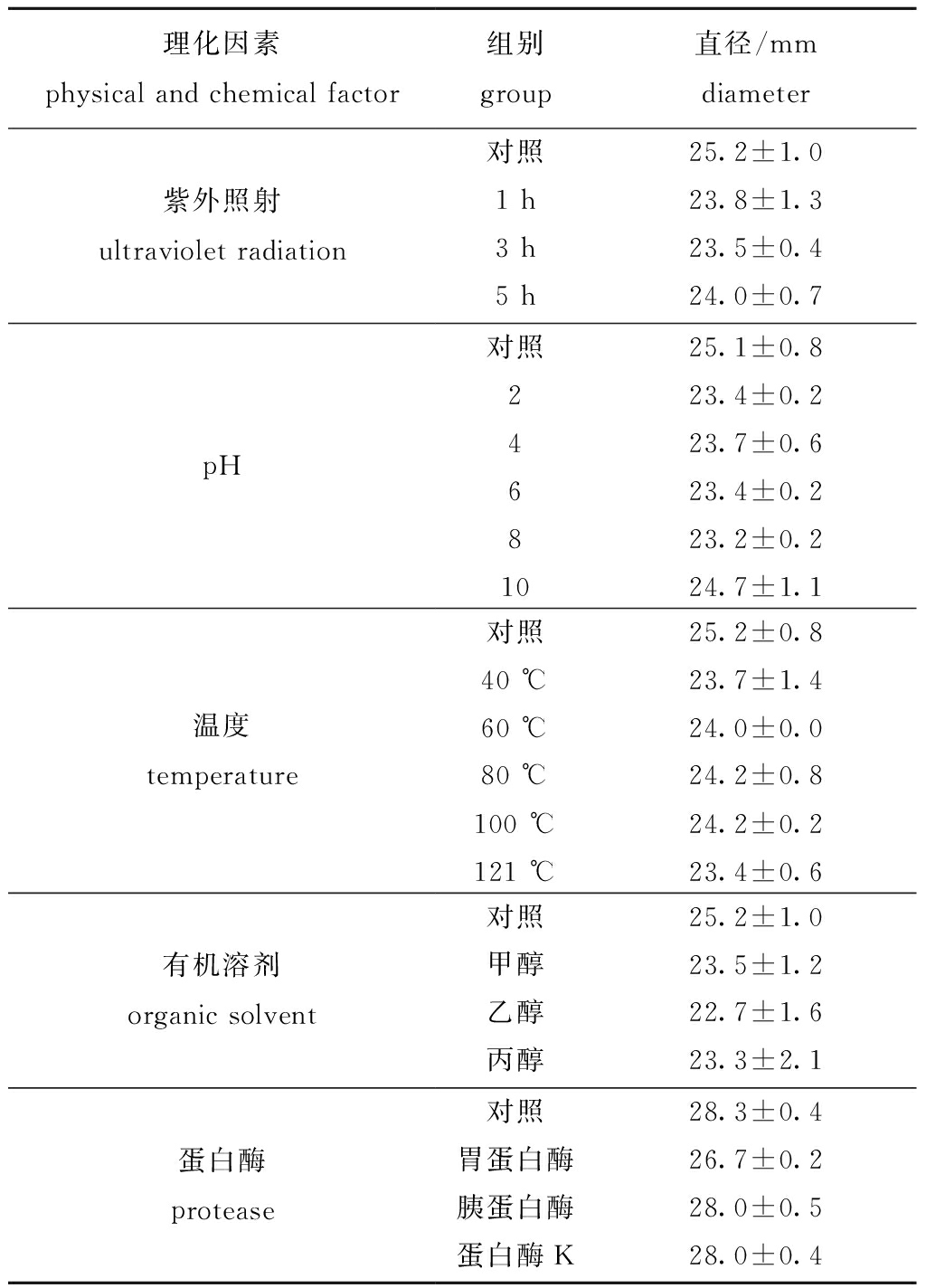
理化因素physical and chemical factor组别group直径/mmdiameter紫外照射 ultraviolet radiation对照25.2±1.01 h23.8±1.33 h23.5±0.45 h24.0±0.7pH对照25.1±0.8223.4±0.2423.7±0.6623.4±0.2823.2±0.21024.7±1.1温度 temperature对照25.2±0.840 ℃23.7±1.460 ℃24.0±0.080 ℃24.2±0.8100 ℃24.2±0.2121 ℃23.4±0.6有机溶剂 organic solvent对照25.2±1.0甲醇23.5±1.2乙醇22.7±1.6丙醇23.3±2.1蛋白酶 protease对照28.3±0.4胃蛋白酶26.7±0.2胰蛋白酶28.0±0.5蛋白酶K28.0±0.4
3 讨论
3.1 无乳链球菌拮抗菌筛选与鉴定
无乳链球菌宿主众多、致病性高,可突破血脑屏障进行繁殖[22],已受到广泛关注。本研究中以21株芽孢杆菌作为备选菌株,以无乳链球菌作为指示菌株,在初筛得到19株具有拮抗无乳链球菌作用的菌株基础上,复筛中发现菌株BA015的去菌体发酵液对无乳链球菌抑制作用最强,经鉴定该菌株为枯草芽孢杆菌。BA015在初筛时抑菌活性与复筛时存在差异,这可能是由于菌株间相互作用机制复杂,胞外产物只是其中一个影响因素,这一现象也进一步证实了微生物拮抗作用的复杂性。
本研究中拮抗菌的初筛与复筛均采用琼脂扩散法,琼脂扩散法是利用待检测菌在琼脂表面对指示菌的生长显示抑制效果的一种定性筛选方法,因具有操作简单、使用方便、经济的特点,是目前较为常用的检测方法,在筛选拮抗菌、测定抗生素效价、抑菌药敏试验等方面都有广泛应用[23-25]。
3.2 抑菌物质分析
BA015的去菌体发酵液采用80%饱和硫酸铵盐析后的粗体物,经葡聚糖凝胶柱层析分离出的第7、8组活性组分抑菌作用最强。对其进行LC-MSMS质谱检测,结果与蛋白质比对后发现并无抑菌相关的蛋白质。经MALDI-TOF-MS质谱检测发现,有Iturin、Bacillomycin、Surfactin和Fengycin类脂肽同系物。后续试验验证显示,理化因素对柱层析后的第7、8组活性组分影响均不明显,这一特点符合脂肽类物质的特征,由此推断,脂肽为BAO15的主要抑菌物质。
本研究中使用的MALDI-TOF-MS和LC-MSMS是目前物质组分鉴定工作中较多使用的方法。MALDI-TOF仪器是最容易操作的MS仪器,对肽的检测也十分精确、灵敏[12]。因此,MALDI-TOF质谱技术常应用于鉴定脂肽、基因分型分析、鉴定病原体、质谱成像等[26-27]。使用LC-MSMS所建立的分析方法通常具有较短的分析时间、较高的监测感度及较高的选择性,适合应用于微量分析物的定性确认与定量分析方法的开发[28]。LC-MSMS常应用于酒中物质残留、中药活性成分测定、菌株产物鉴定等[29-30]。
3.3 脂肽及其在疾病防控中的应用
脂肽一般是革兰氏阳性芽孢杆菌产生的代谢产物[11],作为一种细菌产生的由核糖体合成的抗菌肽,对相似或近缘菌株的生长有一定的抑制作用。芽孢杆菌产生的抗菌脂肽一般具有抗真菌、抗细菌、抗支原体、抗病毒、抗血凝、抗肿瘤、抗昆虫活性及表面活性剂的特性。其抑菌谱广、稳定性高,对热、酶不敏感,能抗紫外照射[31]。因此,近年来对脂肽研究十分活跃,涉及许多领域。脂肽用于抗菌方面,如Sim等[32]将D-enantiomeric和脂肪酸共价添加到抗菌肽杆菌素中以增强其抗菌活性。在人类医疗方面,如Li等[33]用葡萄球菌Staphylococci中得到的脂肽激活β-连环蛋白抑制皮炎。由于抗菌脂肽具有区别于常规抗生素的全新抗菌机制,不仅不易产生耐药性,而且对传统药物已具有耐药性的菌株仍然有良好的抑菌或杀菌功效,因此,本文为寻找抑制动物细菌感染、安全无残留的抑菌物质提供了新思路,使脂肽成为绿色安全、新型高效的水产抗菌药物的研发方向。
4 结论
1) 拮抗菌BA015的去菌体发酵液经80%饱和度硫酸铵沉淀后抑菌直径可达22.8 mm,MIC为3.2 μg/mL,因此,菌株BA015及其去菌体发酵液对无乳链球菌具有较好的抑制效果。
2) MALDI-TOF-MS分析结果确定脂肽含有伊枯菌素(Iturin)、杆菌霉素(Bacillomycin)、表面活性素(Surfactin)、芬荠素(Fengycin)等,因此,BA015的主要抑菌物质为脂肽。
[1] WILKINSON H W,THACKER L G,FACKLAM R R.Nonhemolytic group B Streptococci of human,bovine,and ichthyic origin[J].Infection and Immunity,1973,7(3):496-498.
[2] 柴家前,丁巧玲,王振龙,等.罗非鱼链球菌的分离鉴定[J].中国预防兽医学报,2002,24(1):18-20.
[3] 周冬仁,陈莎莎,杭小英,等.牛蛙源无乳链球菌全菌疫苗免疫效果研究[J].中国农学通报,2012,28(14):135-137.
[4] VAN DOAN H,HOSEINIFAR S H,SRINGARM K,et al.Effects of Assam tea extract on growth,skin mucus,serum immunity and disease resistance of Nile tilapia (Oreochromis niloticus) against Streptococcus agalactiae[J].Fish & Shellfish Immunology,2019,93:428-435.
[5] 杭小英,周冬仁,叶雪平,等.牛蛙无乳链球菌病病原的分离鉴定[J].水生生物学报,2012,36(2):361-364.
[6] MU OZ-ATIENZA E,G
OZ-ATIENZA E,G MEZ-SALA
MEZ-SALA ![]() C,et al.Antimicrobial activity,antibiotic susceptibility and virulence factors of lactic acid bacteria of aquatic origin intended for use as probiotics in aquaculture[J].BMC Microbiology,2013,13:15.
C,et al.Antimicrobial activity,antibiotic susceptibility and virulence factors of lactic acid bacteria of aquatic origin intended for use as probiotics in aquaculture[J].BMC Microbiology,2013,13:15.
[7] 宁健,龚萍,叶胜强,等.不同微生态制剂对樱桃谷鸭生长性能的影响[J].上海畜牧兽医通讯,2019(5):34-36.
[8] 李云,杨胜远,林晓东,等.产细菌素苏云金芽孢杆菌的鉴定及其所产抗菌物质性质[J].食品科学,2010,31(11):147-152.
[9] YANG E,FAN L H,JIANG Y M,et al.Antimicrobial activity of bacteriocin-producing lactic acid bacteria isolated from cheeses and yogurts[J].AMB express,2012,2:48.
[10] WEN L S,PHILIP K,AJAM N.Purification,characterization and mode of action of plantaricin K25 produced by Lactobacillus plantarum[J].Food Control,2016,60:430-439.
[11] 张宝.解淀粉芽孢杆菌抗菌脂肽bacillomycin L的纯化鉴定及抑菌机理研究[D].北京:中国农业大学,2014.
[12] 鲁小城.一株枯草芽孢杆菌抗植物病原真菌活性物质的研究[D].杭州:浙江大学,2006.
[13] VATER J,KABLITZ B,WILDE C,et al.Matrix-assisted laser desorption ionization-time of flight mass spectrometry of lipopeptide biosurfactants in whole cells and culture filtrates of Bacillus subtilis C-1 isolated from petroleum sludge[J].Applied and Environmental Microbiology,2002,68(12):6210-6219.
[14] 邓建良.解淀粉芽孢杆菌YN-1抑制植物病原真菌活性物质研究[D].武汉:华中农业大学,2009.
[15] 权春善,刘静,周伟,等.解淀粉芽孢杆菌Q-426 Bacillomycin D的分离纯化及其抗肿瘤活性[J].生物工程学报,2018,34(2):235-245.
[16] 刘宇帅,张杰,钟瑾,等.解淀粉芽孢杆菌TF28抗菌脂肽芬芥素的分离鉴定及抑菌作用[J].中国生物工程杂志,2018,38(10):20-29.
[17] BIE X,LU Z,LU F.Identification of fengycin homologues from Bacillus subtilis with ESI-MS/CID[J].Journal of Microbiological Methods,2009,79(3):272-278.
[18] 李兴玉,毛自朝,吴毅歆,等.芽孢杆菌环脂肽类次生代谢产物的快速检测[J].植物病理学报,2014,44(6):718-722.
[19] VATER J,GAO X W,HITZEROTH G,et al. “Whole cell” - matrix assisted laser desorption Ionization time-of-flight mass spectrometry,an emerging technique for efficient screening of biocombinatorial libraries of natural compounds present state of research[J]. Combinatorial Chemistry & High Throughput Screening,2003,6(6):557-567.
[20] CHEN H,WANG L,SU C X,et al.Isolation and characterization of lipopeptide antibiotics produced by Bacillus subtilis[J].Letters in Applied Microbiology,2008,47(3):180-186.
[21] DHANARAJAN G,RANGARAJAN V,SEN R.Dual gradient macroporous resin column chromatography for concurrent separation and purification of three families of marine bacterial lipopeptides from cell free broth[J].Separationand Purification Technology,2015,143:72-79.
[22] 苏友禄,刘婵,邓益琴,等.罗非鱼无乳链球菌病的研究进展[J].大连海洋大学学报,2019,34(5):757-766.
[23] OMAR N B,ABRIOUEL H,KELEKE S,et al.Bacteriocin-producing Lactobacillus strains isolated from poto poto,a Congolese fermented maize product,and genetic fingerprinting of their plantaricin operons[J].International Journal of Food Microbiology,2008,127(1/2):18-25.
[24] SAVIANO A M,LOURENÇO F R.Using image analysis to determine gentamicin potency by agar diffusion microbiological assay and its measurement uncertainty[J].Measurement,2019,146:315-321.
[25] H∅IBY N,HENNEBERG K Å,WANG H S,et al.Formation of Pseudomonas aeruginosa inhibition zone during tobramycin disk diffusion is due to transition from planktonic to biofilm mode of growth[J].International Journal of Antimicrobial Agents,2019,53(5):564-573.
[26] 田丹丹,周维,李朝生,等.香蕉枯萎病拮抗菌GKT04产生的脂肽类抗生素的分离和鉴定[J].南方农业学报,2020,51(5):1122-1127.
[27] 李翔,李慧铭,刘正祥,等.MALDI-TOF MS检测产碳青霉烯酶肠杆菌科细菌及其表型的临床应用研究[J].检验医学与临床,2020,17(18):2604-2609.
[28] 韩方.LC/MS/MS检测大麻活性成分THC及其主要代谢产物THCC的方法研究[D].杭州:浙江中医药大学,2014.
[29] 何开蓉,程铁辕,张莹,等.LC/MS/MS法测定白酒中氨基甲酸酯类农残研究[J].食品研究与开发,2019,40(15):156-159.
[30] 李嘉骏,吴孟华,刘韵,等.LC/MS/MS鉴定丹参化学成分在Caco-2细胞中的代谢产物[J].中药材,2018,41(2):353-357.
[31] SORBARA M T,PAMER E G.Interbacterial mechanisms of colonization resistance and the strategies pathogens use to overcome them[J].Mucosal Immunology,2019,12(1):1-9.
[32] SIM J Y,KIM S,LEE J,et al.A significantly enhanced antibacterial spectrum of D-enantiomeric lipopeptide bactenecin[J].Biochemical and Biophysical Research Communications,2019,514(2):497-502.
[33] LI D,WANG W,WU Y,et al.Lipopeptide 78 from Staphylococcus epidermidis activates β-catenin to inhibit skin inflammation[J].The Journal of Immunology,2019,202(4):1219-1228.