夜光藻Noctiluca scintillans在世界沿海广为分布,也是中国最早报道的赤潮藻类[1]。夜光藻赤潮在中国南北沿海频繁发生,南海的大鹏湾、浙江近海、长江口、胶州湾及渤海湾等地常有报道[2-5]。1981—1988年,长江口及邻近海域发生的赤潮中由夜光藻引起的赤潮占总数的80%,在南海所搜集的147次赤潮事件中,有44次为夜光藻赤潮[2],此外,在渤海海域发生的夜光藻赤潮次数占赤潮总数的50%以上[3],虽然这些年来政府加大了对海洋环境的治理,但沿岸地区夜光藻赤潮爆发的范围及频率并没有减弱趋势[4]。因此,研究赤潮爆发的规律,探究赤潮生物的生长繁殖与各种环境因素的相互关系,预测、预报赤潮的发生,一直是赤潮研究的热点问题[5]。
已有的调查显示,不同海域夜光藻赤潮发生的环境条件不同。Zhang等[6]研究表明,在香港水域,夜光藻赤潮最早出现在1月份,水温大约为17 ℃左右;Jang等[7]研究显示,韩国长木湾夜光藻丰度会随水温波动,在水温大于28 ℃时丰度急剧下降;胶州湾夜光藻种群丰度与水温呈负相关,水温最低的2月份种群密度最高[8],但也有报道显示,辽东湾夜光藻赤潮发生在水温较高的7、8月份[9];Qi等[10]也报道了东海长江入海口近岸地区,水温25~30 ℃时出现了夜光藻赤潮。同样,盐度对夜光藻赤潮发生的影响在不同海区也不尽相同,胶州湾、秦皇岛海域夜光藻赤潮发生的水域,盐度值变化不大[8,11];南海北部夜光藻赤潮发生在冬春季节时,盐度范围有所起伏,通常为23~32[12-13] ;而长江口夜光藻赤潮发生时的水体盐度可低至15以下[14] 。
以上调查表明,夜光藻赤潮发生在不同海域的环境条件差异较大,而目前对夜光藻的实验生态研究不多,关于在室内恒定培养条件下,温度和盐度等环境因子对赤潮生物夜光藻的影响尚无报道,为此,本文中对夜光藻的种群密度与海水温盐度之间的关系进行了研究,并结合夜光藻的原位生态研究结果,考虑夜光藻赤潮爆发的突发性和生态环境复杂性等因素,分析其规律,旨在为夜光藻赤潮发生预测和海洋生态环境保护提供科学参考。
1 材料与方法
1.1 材料
试验用夜光藻取自大连黑石礁近海海域,在实验室经分离后将夜光藻置于消毒海水中(盐度31±1),在光照培养箱(GXZ-380B)中进行培养,光照培养箱温度设置为(20±1)℃,光照周期为12 L∶12 D,光照度为4 000 lx。
试验用饵料藻为盐生杜氏藻Dunaliella salina(简称盐藻),取自大连海洋大学水生生物学重点实验室,将藻种扩增培养至试验所需密度的藻液(试验均设为10×104 cells/mL)。
1.2 方法
1.2.1 温度对夜光藻种群密度增长的影响试验 试验设置12、16、20、24、28 ℃ 5个温度组,试验开始前,温度从20 ℃ 开始,以每天平均升高或降低2 ℃至试验所需温度,并在此温度下驯化2 d,以免因温度骤变影响试验结果。正式试验前饥饿培养夜光藻24 h。
每一个温度组设置7个重复组、3个对照组。在250 mL锥形瓶中,内盛200 mL盐藻藻液。取出经温度驯化后的夜光藻,将其放置在消毒干净的培养皿中,用煮沸消毒海水(盐度31±1)清洗3~4遍,重复组中每瓶放入50只夜光藻,对照组中不放夜光藻。用封口膜封口,在光照培养箱(光周期和光照度同上)中培养20 d,观察其生长情况,试验期间每2 d计数一次夜光藻和盐藻的密度。
1.2.2 盐度对夜光藻种群密度增长的影响试验 试验设置18、22、26、30、34、38、42共7个盐度组,用消毒纯水和海水晶配制试验所需盐度,低于30为低盐度组,高于30为高盐度组,从盐度31开始,以每天平均升高或降低2个盐度至试验所需盐度,并在此盐度下驯化2~3 d,以免因盐度突变而影响试验结果。正式试验前饥饿培养夜光藻24 h。每个盐度组设7个重复组、3个对照组。重复组中放入50只夜光藻,对照组中不放夜光藻。培养箱温度为(20±1)℃,其他试验条件及过程同“1.2.1节”。
1.2.3 指标的测定与计算
1) 盐藻和夜光藻密度。
盐藻密度N=Sc/(Sf·n)×(V/Vc)×Pn。
其中:N为盐藻密度(cells/L);Sc为计数框的面积(mm2);Sf为计数视野面积(mm2);n为视野个数;V为定容体积(mL);Vc为计数框体积(mL);Pn为计数所得藻类个数(ind.)。
夜光藻密度:试验第2天取摇匀的夜光藻藻液10 mL于培养皿中计数;试验进行第4~8 天时,取5 mL计数;从第10天起,每次取1 mL藻液计数。每次计数后的藻液直接丢弃不再倒入锥形瓶,以减少污染源。根据抽取体积,计算1 L藻液中夜光藻的密度。
2) 生长速率(v)。
v=(lnN2-lnN1)/(t2-t1)。
其中: N1、N2分别为时刻t1、t2时夜光藻的藻密度(ind./L)。
1.3 数据处理
试验结果以平均值±标准差表示(mean±S.D.),试验数据采用 SPSS 22. 0 软件进行单因素方差分析,采用 Duncan 法进行组间多重比较,显著性水平设为 0.05。
2 结果与分析
2.1 温度对夜光藻种群增长的影响
2.1.1 不同温度条件下夜光藻与饵料藻种群密度的变化 从图1可见:在12 ℃温度条件下,夜光藻的种群增长较为缓慢,但其密度随着培养时间的延长而持续增加,20 d时夜光藻密度达最高值(14.80×103 ind./L);在16、20、24 ℃温度条件下,随温度升高夜光藻种群增长也随之加快,种群密度均呈现出先升高后下降再上升的趋势,最终达到动态平衡,最高密度分别为10.2×103、10.6×103、10.0×103 ind./L,3个温度下的种群密度最大值无显著性差异(P>0.05);在28 ℃温度条件下, 夜光藻种群密度呈现出下降趋势,最终密度趋于零。
饵料藻盐藻在5个温度条件下,密度均呈现出先上升后下降的趋势,但在不同温度下所达到最大值的时间点有所不同,随着温度的升高达到最大值的时间有缩短趋势,12 ℃下第12天达最大值,16、20 ℃下第6天达最大值,24、28 ℃下第4天达最大值(图1)。
2.1.2 不同温度条件下夜光藻的日增长率 从表1可见:28 ℃下夜光藻的日增长率均为负值,与12、16、20、24 ℃组均有显著性差异(P<0.05),
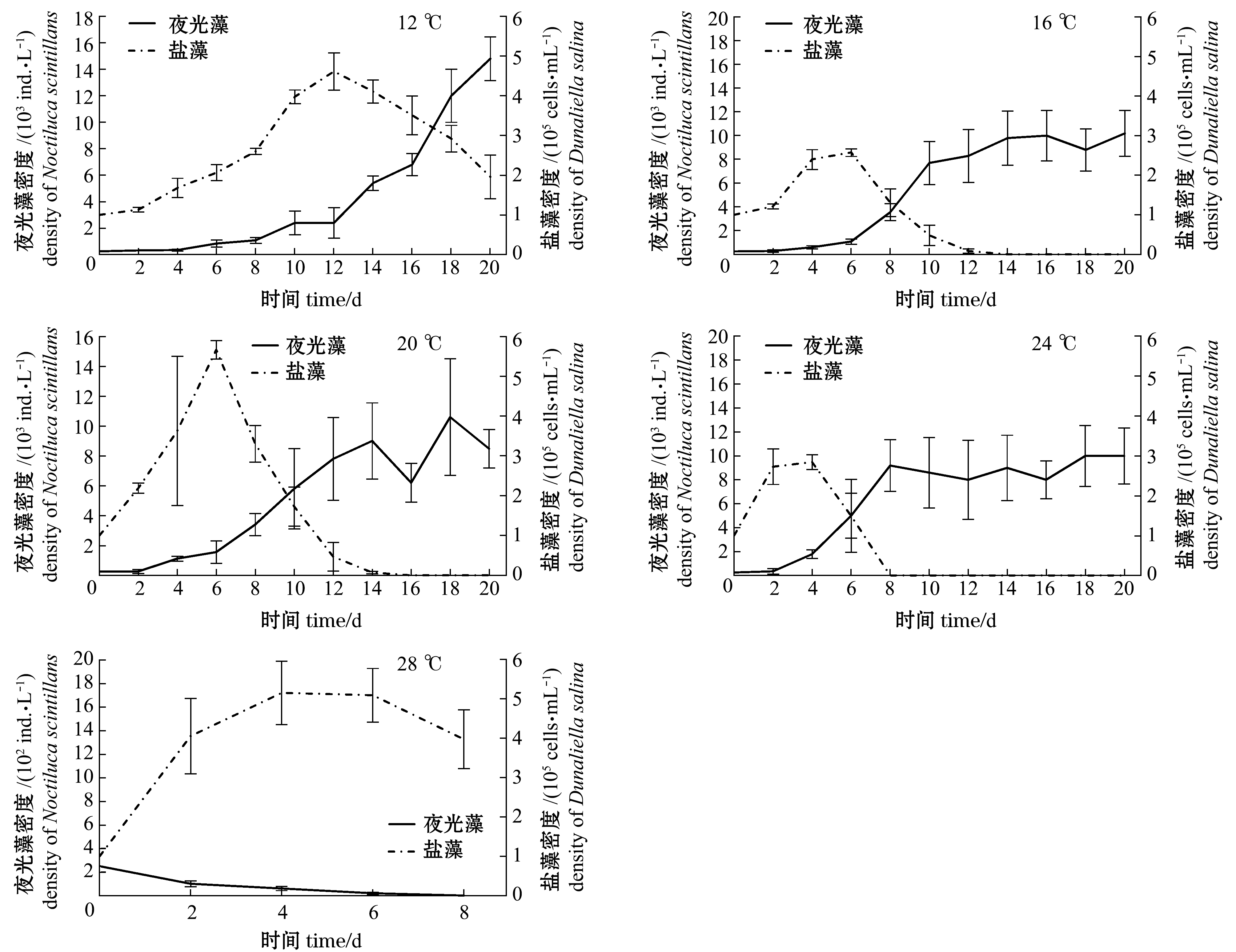
图1 不同温度下夜光藻与饵料藻种群密度的变化
Fig.1 Change in densities of alga Noctiluca scintillans and food alga Dunaliella salina at different temperatures
即28 ℃夜光藻种群密度一直在下降,直至降为0;其他几个温度组中,试验刚开始第2天时,夜光藻日增长率以24 ℃组最高,但各组间无显著性差异(P>0.05),试验第4天时日增长率以20 ℃组最高,除与24 ℃组无显著性差异(P>0.05)外,与其他组均有显著性差异(P<0.05),第6天时以24 ℃下日增长率最高;之后较低温度组的日增加率逐渐增大,第8天时以16 ℃组最高,第10天时以12 ℃组最高,除与24 ℃组有显著性差异(P<0.05)外,其他组间均无显著性差异(P>0.05),之后的第12~20天,以12 ℃组日增长率较大,但12、16、20、24 ℃各组间均无显著性差异(P>0.05);各温度组的平均增长率以12 ℃组最大。
2.1.3 夜光藻密度与温度的关系 根据以上结果,可以求得夜光藻密度与温度的回归方程为
y=-18.424x3+1 055x2-19 822x+132 606
(R2=0.999 4)。
即在12~28 ℃范围内,夜光藻密度最大值出现在12 ℃时,16~24 ℃ 3个温度条件下夜光藻密度相差不大(图2)。
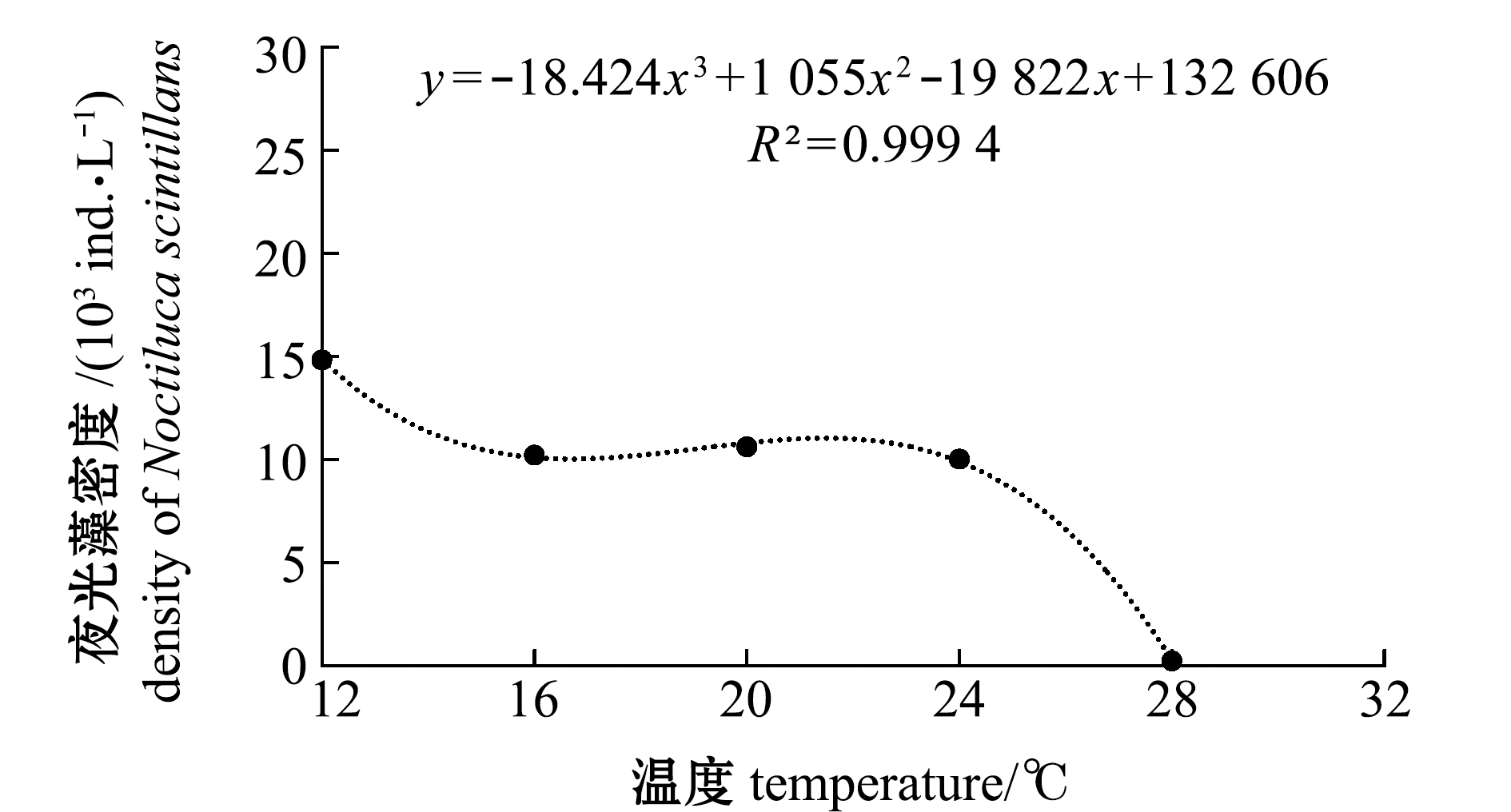
图2 夜光藻密度与温度的关系
Fig.2 Relationship between density of alga Noctiluca scintillans and temperature
2.2 盐度对夜光藻种群增长的影响
2.2.1 不同盐度条件下夜光藻与饵料藻种群密度的变化 从图3可见:盐度为18~42下,夜光藻种群密度均能增长,在7个不同盐度条件下,夜光藻的种群密度呈现出先升高后下降再上升的小幅度波动趋势;不同盐度下夜光藻种群密度的最大值和达到最大值所需时间有所差异。
表1 不同温度下夜光藻的日增长率
Tab.1 Daily growth rate of alga Noctiluca scintillans exposed to different temperatures
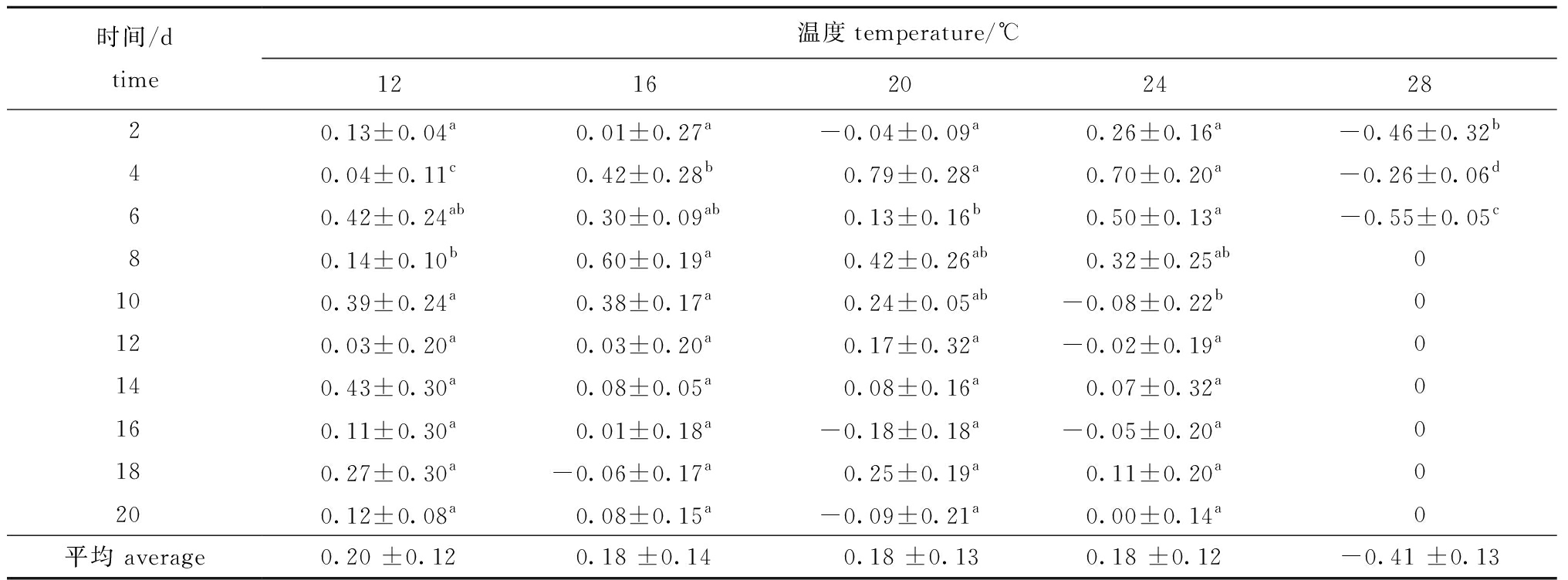
时间/dtime温度temperature/℃121620242820.13±0.04a0.01±0.27a-0.04±0.09a0.26±0.16a-0.46±0.32b40.04±0.11c0.42±0.28b0.79±0.28a0.70±0.20a-0.26±0.06d60.42±0.24ab0.30±0.09ab0.13±0.16b0.50±0.13a-0.55±0.05c80.14±0.10b0.60±0.19a0.42±0.26ab0.32±0.25ab0100.39±0.24a0.38±0.17a0.24±0.05ab-0.08±0.22b0120.03±0.20a0.03±0.20a0.17±0.32a-0.02±0.19a0140.43±0.30a0.08±0.05a0.08±0.16a0.07±0.32a0160.11±0.30a0.01±0.18a-0.18±0.18a-0.05±0.20a0180.27±0.30a-0.06±0.17a0.25±0.19a0.11±0.20a0200.12±0.08a0.08±0.15a-0.09±0.21a0.00±0.14a0平均 average0.20 ±0.120.18 ±0.140.18 ±0.130.18 ±0.12-0.41 ±0.13
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same line are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same line are not significant differences, et sequentia.
盐度为18时,夜光藻在试验前6 d生长缓慢,从第8天起数量增加,在第14天时平均密度达到最大值,为19 400 ind./L;盐度为22、26时夜光藻变化同盐度18时较为相似,第8~10天时夜光藻生长迅速,均在第12天时密度达到最大值,分别为21 600、25 800 ind./L;盐度为30、34时,夜光藻密度最大值分别为9 000、10 600 ind./L;高盐度38时,夜光藻密度增加缓慢,增长幅度较小,最大密度值为3 800 ind./L,仅为盐度26时藻密度的1/6;盐度为42时与盐度为38时变化趋势相似,最大密度值仅为3 000 ind./L;盐度为38、42时夜光藻生长无显著性差异(P>0.05),但均与其他盐度组有显著性差异(P<0.05)(图3)。
不同盐度下,饵料藻盐藻均表现出先升高后下降的变化趋势;当夜光藻种群密度增长速率最快时,饵料藻的密度达到最大值并随之降低(图3)。
2.2.2 不同盐度条件下夜光藻的日增长率 盐度对夜光藻密度的日增长速率有着较为明显的影响,夜光藻密度的日增长率随着盐度的变化而变化。从表2可见:试验第2天时,低盐度18、22组和高盐度34、38、42组夜光藻均出现负增长,只有盐度26和30组日增长率为正值,且二者与其他几组均有显著性差异(P<0.05);试验第4天时,各组日增长率明显增高,但各组间无显著性差异(P>0.05);试验第6天时,30以下的低盐度组日增长率明显高于高盐度组(P<0.05);试验第8天时,盐度26组日增长率达最大值,除与盐度22组无显著性差异(P>0.05)外,与其他组均有显著性差异(P<0.05);第10天之后,各盐度组的日增长率逐渐降低,且组间差异规律性不强。
表2 不同盐度下夜光藻的日增长率
Tab.2 Daily growth rate in alga Noctiluca scintillans exposed to different salinities
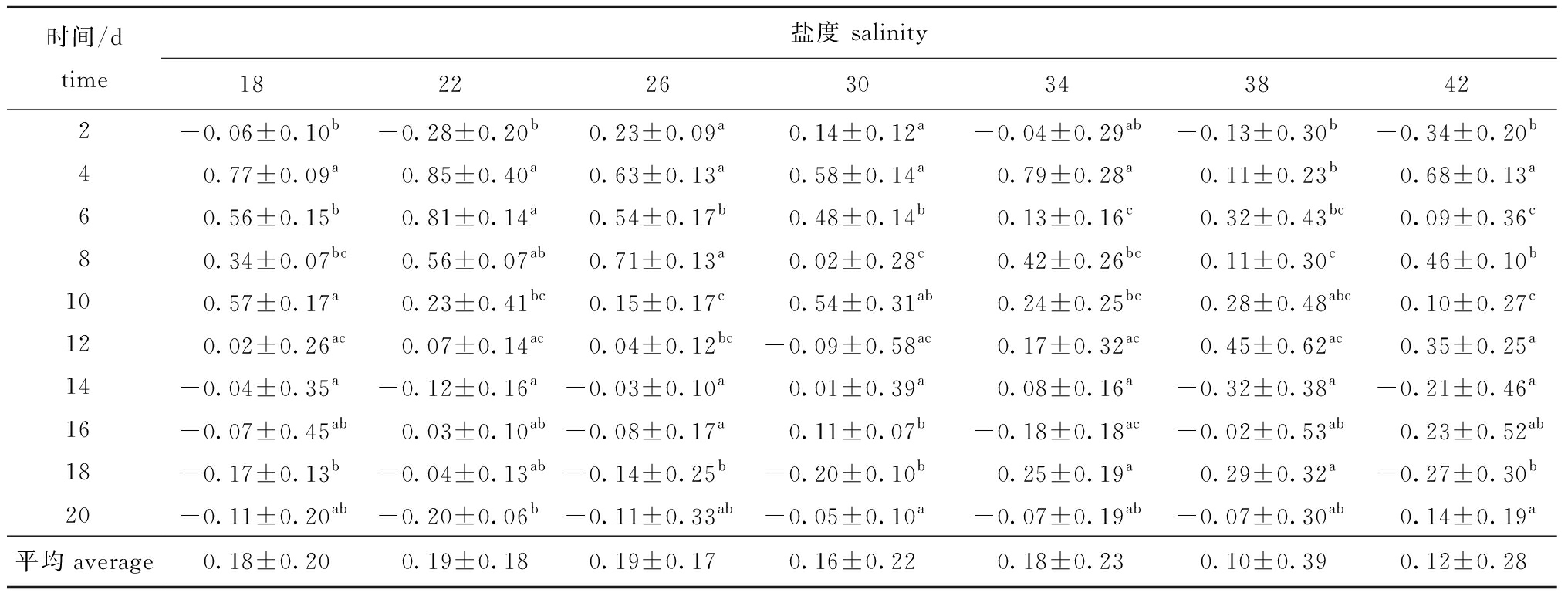
时间/dtime盐度 salinity182226303438422-0.06±0.10b-0.28±0.20b0.23±0.09a0.14±0.12a-0.04±0.29ab-0.13±0.30b-0.34±0.20b40.77±0.09a0.85±0.40a0.63±0.13a0.58±0.14a0.79±0.28a0.11±0.23b0.68±0.13a60.56±0.15b0.81±0.14a0.54±0.17b0.48±0.14b0.13±0.16c0.32±0.43bc0.09±0.36c80.34±0.07bc0.56±0.07ab0.71±0.13a0.02±0.28c0.42±0.26bc0.11±0.30c0.46±0.10b100.57±0.17a0.23±0.41bc0.15±0.17c0.54±0.31ab0.24±0.25bc0.28±0.48abc0.10±0.27c120.02±0.26ac0.07±0.14ac0.04±0.12bc-0.09±0.58ac0.17±0.32ac0.45±0.62ac0.35±0.25a14-0.04±0.35a-0.12±0.16a-0.03±0.10a0.01±0.39a0.08±0.16a-0.32±0.38a-0.21±0.46a16-0.07±0.45ab0.03±0.10ab-0.08±0.17a0.11±0.07b-0.18±0.18ac-0.02±0.53ab0.23±0.52ab18-0.17±0.13b-0.04±0.13ab-0.14±0.25b-0.20±0.10b0.25±0.19a0.29±0.32a-0.27±0.30b20-0.11±0.20ab-0.20±0.06b-0.11±0.33ab-0.05±0.10a-0.07±0.19ab-0.07±0.30ab0.14±0.19a平均average0.18±0.200.19±0.180.19±0.170.16±0.220.18±0.230.10±0.390.12±0.28

图3 不同盐度下夜光藻与饵料藻种群密度的变化
Fig.3 Changes in densities of alga Noctiluca scintillans and food alga Dunaliella salina under different salinities
2.2.3 夜光藻密度与盐度的关系 从图4可见:夜光藻密度随着盐度增加而降低,低盐度组夜光藻密度明显高于高盐度组,且盐度18、22、26这3个低盐度组夜光藻密度呈逐渐递增的趋势。根据以上结果,可以求出夜光藻密度与盐度的回归方程为
y=-0.086 3x5+12.641x4-717.19x3+19 600x2-257 671x+105(R2=0.875 6)。
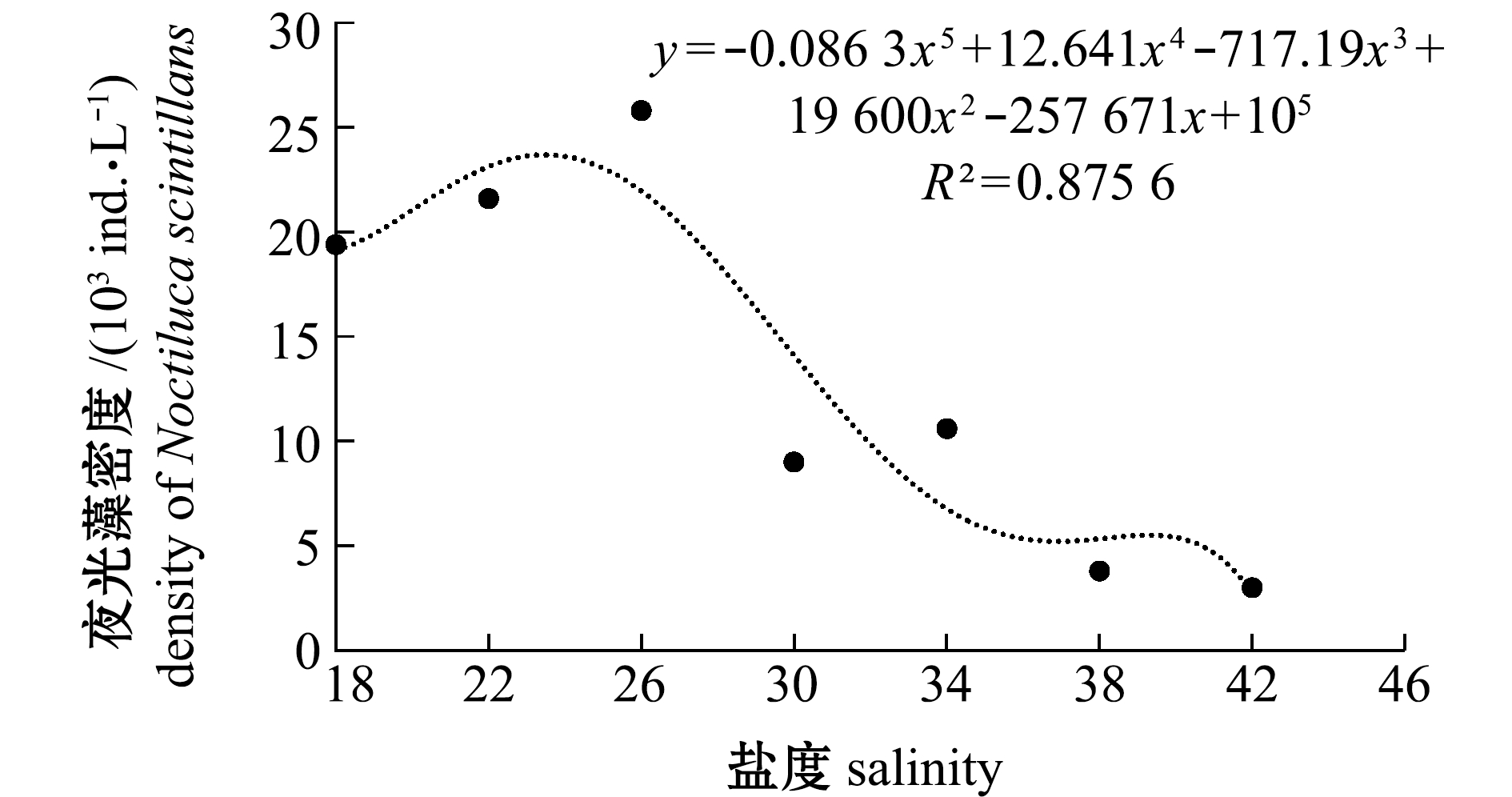
图4 夜光藻密度与盐度的关系
Fig.4 Relationship between density of alga Noctiluca scintillans and salinity
根据回归方程计算得出,盐度为23.4时夜光藻的密度可达到最大值。
3 讨论
夜光藻是国内最早报道的赤潮藻类,在中国北起辽东湾南至海南岛,几乎覆盖了所有的近海水域[2-5],其种群增长受环境、其他生物及自身种群结构等多种因素的影响。
3.1 温度对夜光藻种群密度的影响
以往研究认为,夜光藻属偏冷水性种类 [15],水温5、6 ℃时就能繁殖,种群的最适温度一般在16~24 ℃,其种群分布在水温较低的季节。20世纪90年代,黄长江等[16]对南海大鹏湾夜光藻种群研究表明,夜光藻种群在1月份出现,3月初随着水温回升而急剧增加,数量高峰维持到5月初,然后急剧减少,至6月初种群从调查海区完全消失;黄长江等[17]认为,当水温超过25~26 ℃夜光藻的生存上限时,近岸表层水体中的夜光藻自然死亡,而只有同时生活在较深冷水团中的个体可存活下来,待水温降至其适温范围时,再急速繁殖并随海流或潮流漂过来予以补充;Zhang等[6]也研究表明,在香港水域夜光藻也最早出现在1月份,水温大约17 ℃左右;黄伟建等[18]通过建立大鹏湾夜光藻种群增长动态与时间序列模型,得出夜光藻生长的适宜温度为17~22 ℃;谢健等[19]的研究也显示,在长江口海域,夜光藻的最适生长温度为15~20 ℃;Wang等[20]研究表明,黄海夜光藻在10 ℃左右达到每年的高峰值;Uhlig等[21]的研究表明,夜光藻生长的温度范围为15~24 ℃;在韩国长木湾也有相似的结果,夜光藻丰度会随水温波动,水温大于28 ℃时丰度急剧下降[7]。本试验结果表明,在恒定的高温28 ℃下,夜光藻的日增长率均为负值,与12、16、20、24 ℃温度组均有显著性差异,28 ℃时夜光藻种群密度迅速下降,直至种群全部消失,与以上的调查结果较为一致。
而实际上,不同研究者发现夜光藻在海区的分布更为广泛。周遵春等[9]报道,辽东湾1995年和1999年的夜光藻赤潮发生在7、8月份,当时的水温为23~26 ℃;2016年4月珠江口广海湾和镇海湾爆发的夜光藻,调查中各站位的水温变化范围为 23.2~26.1 ℃[5];王雨等[12]对南海2006—2008年大尺度海域调查中发现,虽然南海夜光藻仍在春、冬季丰度最高,但在夏季温度26.7 ℃以上时,海南岛南部及东南部亦检出较高丰度的夜光藻,并能分布到远岸水域;邹景忠等[22]对渤海湾赤潮的研究也显示,渤海夜光藻的适宜温度为16~28 ℃;而2006年8月渤海湾天津近岸海域发生的夜光藻赤潮,有3个站位表层水温平均值高达28.4 ℃[23];Qi等[10]报道了在长江入海口近岸地区,水温在25~30 ℃时出现夜光藻赤潮,远远超出之前报道10~25 ℃的温度范围。
最近,田达玮等[8]对胶州湾夜光藻种群全年动态研究得出,夜光藻丰度与水温存在显著的负相关性,夜光藻丰度较高时(>104 ind./m3)水温均在3~5 ℃,种群密度最高出现在全年水温最低的2月份,并发现同一月份水温较低的站位相比,夜光藻丰度更高。由此得出,胶州湾夜光藻赤潮发生时的水温,低于历史资料中其他海区夜光藻赤潮爆发时的水温。本试验的5个温度中,16~24 ℃ 3个温度条件下夜光藻密度相差不大,在温度12 ℃条件时,夜光藻的种群开始增长较为缓慢,但随着培养时间的延长密度持续增加,20 d后夜光藻密度达最高值(14.80×103 ind./L),反映出夜光藻对低温有较好的适应能力。
不同海区夜光藻赤潮爆发时的温度差异较大,这可能是夜光藻种群对不同海区环境的适应,也有可能是不同海区夜光藻种群存在区系之间的差异。田达玮等[8]研究中同时发现,胶州湾夜光藻对温度的适应性极强,全年均有分布,在8月全年水温最高值的B2站位(水温高达28 ℃以上),也有100 ind./m3以上密度的夜光藻。另外,已有研究表明,根据营养方式,夜光藻分为全异养的红色夜光藻和混合营养的绿色夜光藻,通常红色夜光藻的适温范围为10~25 ℃,且在中国各海区均有分布,而绿色夜光藻的适温范围为25~30 ℃,常在南亚泰国湾、孟加拉湾等热带海域分布[24]。中国海区是否也存在这种绿色夜光藻,南亚热带海域向亚热带过渡的暖温带海域之间分布的夜光藻是否为同一种群,以及夜光藻不同地理种群区系间是否存在差异等问题,在今后的研究中应予以加强。
3.2 盐度对夜光藻种群密度的影响
在自然海域中,盐度的变化主要是由江河径流、降雨或者海流、水团的流动所引起。已有研究表明,盐度对夜光藻的影响不如温度明显,有些水体的盐度也相对比较稳定,如田达玮等[8]研究表明,胶州湾虽有淡水输入,盐度变化却不大,湾内盐度平均值(30.76)略低于湾口(30.89)和湾外(30.96),胶州湾全年的盐度变化较小,月平均盐度变化范围为30.03~31.71,均在夜光藻最适的盐度范围内。王雨等[12]表明,南海北部春季出现夜光藻的表层盐度范围为27.88~34.37,冬季表层盐度为32.03~33.33,均为夜光藻的适宜盐度范围,是夜光藻丰度较高的一个因素。2006年8月渤海湾天津近岸海域发生的夜光藻赤潮,监测的3个站位表层盐度的平均值为30.08,赤潮爆发前后盐度值基本无变化[23]。付仲等[11]对2011年秦皇岛海域11个站位3航次的调查表明,夜光藻种群高密度时的盐度为30.8~31.8,平均为31.3,变化亦不大。
通常认为,夜光藻是广盐性的浮游生物,既能在高盐度的海域生存也能在低盐度区域繁殖生长。陆斗定等[25]研究表明,夜光藻在14.7~32.9盐度范围内均能存活,25~30是夜光藻的最适盐度范围。杨鸿山等[26]对长江口杭州湾海区两次赤潮研究发现,夜光藻的最适盐度范围为15~27。 本研究结果显示,大连黑石礁海域的夜光藻在盐度18~42范围内均能存活和繁殖,且盐度对夜光藻的生长有较大影响。相比高盐度,夜光藻更适宜在22~26低盐度区域的环境中生长,盐度38以上时,夜光藻生长明显缓慢。海南夏季的盐度在34以上,较高的盐度也可能是影响夜光藻繁殖的因素之一[12]。自然海水中,盐度降低似乎更有利于夜光藻的增殖,周遵春等[9]报道辽东湾在1995年和1999年的夜光藻赤潮均发生在降雨后,降雨使沿岸局部水域盐度略有降低,可能与夜光藻的瞬时爆发有关。研究表明,长江口夜光藻赤潮时的水体盐度可低至15以下[14],但过低的盐度不利于夜光藻赤潮的爆发。徐兆礼[27]报道,长江春季夜光藻极高丰度是位于长江冲淡水主轴南北两侧的区域,即冲淡水与外海交汇偏外海水的一侧,而长江外冲淡水主轴经过的水域,夜光藻丰度显著低于南北两侧。
3.3 夜光藻种群密度的其他影响因素
本研究中还发现,夜光藻在温度和盐度适宜环境下,种群增长较快,对盐藻的捕食效应也增大,当饵料藻消失后,夜光藻的密度不再增加,而是在峰值上下波动,或有轻微下降趋势,可能是因为环境中的饵料藻消失,夜光藻的主要食物来源不足所致。虽然夜光藻的主要食物来源消失,但夜光藻仍能继续生存,其种群密度没有大幅度下降,这是因为夜光藻可以通过摄食环境中的其他有机碎屑和细菌得以生存[28]。夜光藻赤潮的发生是一个非常复杂的过程,外界环境的温度、盐度、溶氧、水文及气象条件等均可影响其种群增值,而食物的种类和数量无疑也是一个重要的影响因素。
4 结论
1) 室内12、16、20、24、28 ℃ 5个温度下培养夜光藻20 d,以12 ℃时生长最好,种群密度最高,16、20、24 ℃时次之, 28 ℃时种群日增长率均为负值,密度一直降低,至第8天时种群消失为零,即室内28 ℃下培养夜光藻不能存活。
2) 夜光藻在盐度18~42下均能存活和繁殖,以盐度26时种群密度增长最好,高盐度38和42组种群增长极为缓慢,并与其他盐度组有显著性差异。
3) 夜光藻食性较杂,在饵料藻盐藻消失后,仍能以水中有机碎屑、细菌微生物等为食物而存活和繁殖。
[1] 华泽爱.赤潮灾害[M].北京:海洋出版社,1994.
[2] 吴瑞贞,林端,马毅.南海夜光藻赤潮概况及其对水文气象的适应条件[J].台湾海峡,2007,26(4):590-595.
[3] 张洪亮,张爱军,窦月明,等.渤海海区赤潮发生特点的研究[C]//第一届中国赤潮研究与防治学术研讨会论文摘要汇编.广州:中国海洋学会,2004:1107-1111.
[4] 窦勇,高金伟,时晓婷,等.2000-2013年中国南部近海赤潮发生规律及影响因素研究[J].水生态学杂志,2015,36(3):31-37.
[5] 綦世斌,覃超梅,黄少建,等.夜光藻斑块分布与水环境因子的相关关系[J].热带生物学报,2018,9(1):1-11.
[6] ZHANG S W,HARRISON P J,SONG S Q,et al.Population dynamics of Noctiluca scintillans during a bloom in a semi-enclosed bay in Hong Kong[J].Marine Pollution Bulletin,2017,121(1/2):238-248.
[7] JANG M C,SHIN K S,JANG P G,et al.Relationship between environmental factors and short-term variations of mesozooplankton during summer in Jangmok Bay,South coast of Korea[J].Ocean and Polar Research,2010,32(1):41-52.
[8] 田达玮,宋书群,陈田田,等.胶州湾夜光藻种群动态及其大量繁殖的生态机制[J].海洋与湖沼,2017,48(2):276-284.
[9] 周遵春,马志强,薛克,等.对辽东湾夜光藻赤潮和叉状角藻赤潮成因的初步研究[J].水产科学,2002,21(2):9-12.
[10] QI L,TSAI S F,CHEN Y L,et al.In search of red Noctiluca scintillans blooms in the East China Sea[J].Geophysical Research Letter,2019,46(11):5997-6004.
[11] 付仲,侯雁彬,郗艳娟,等.秦皇岛海域夜光藻种群密度与环境因子的关系[J].河北渔业,2015(10):31-35,82.
[12] 王雨,叶又茵,林茂,等.南海北部夜光藻种群的时空分布及其环境适应性[J].生物多样性,2012,20(6):685-692.
[13] 钱宏林,梁松,齐雨藻,等.南海北部沿海夜光藻赤潮的生态模式研究[J].生态科学,1994(1):39-46.
[14] 蒋晓山,洪君超,王桂兰,等.长江口赤潮多发区夜光藻(Noctiluca scintillans)赤潮发生过程分析[J].暨南大学学报(自然科学),1992,13(3):134-139.
[15] FUNG Y C,TROTT L B.The occurrence of a Noctiluca scintillans (Macartney) induced red tide in Hong Kong[J].Limnology and Oceanography,1973,18(3):472-476.
[16] 黄长江,杞桑,齐雨藻,等.南海大鹏湾夜光藻种群在其生态群落中的地位和功能[J].海洋与湖沼,1997,28(4):348-355.
[17] 黄长江,齐雨藻,杞桑,等.大鹏湾夜光藻种群的季节变化和分布特征[J].海洋与湖沼,1996,27(5):493-498.
[18] 黄伟建,齐雨藻.大鹏湾海水理化因子对夜光藻生长影响的因子分析[J].海洋通报,1993,12(2):17-22.
[19] 谢健,李锦蓉,吕颂辉,等.夜光藻赤潮与环境因子的关系[J].海洋通报,1993,12(2):1-6.
[20] WANG W C,SUN S,SUN X X,et al.Seasonal phenology of the heterotrophic dinoflagellate Noctiluca scintillans (Macartney) in Jiaozhou Bay and adjacent coastal Yellow Sea,China[J].Journal of Oceanology and Limnology,2018,36(4):1280-1293.
[21] UHLIG G,SAHLING G.Long-term studies on Noctiluca scintillans in the German Bight population dynamics and red tide phenomena 1968-1988[J].Netherlands Journal of Sea Research,1990,25(1/2):101-112.
[22] 邹景忠,董丽萍,秦保平.渤海湾富营养化和赤潮问题的初步探讨[J].海洋环境科学,1983,2(2):41-54.
[23] 尹翠玲,张秋丰,邹涛,等.渤海湾天津近岸海域夜光藻赤潮生消过程初探[J].海洋湖沼通报,2013(2):99-104.
[24] 宋书群,李才文,孙军.夜光藻有性繁殖研究进展[J].生态学报,2016,36(9):2451-2459.
[25] 陆斗定,张志道,朱根海,等.浙江近海夜光藻的分布及其生态学特点[J].东海海洋,1994,12(3):62-69.
[26] 杨鸿山,朱启琴,戴国梁.长江口杭州湾海区两次赤潮的调查与初步研究[J].海洋环境科学,1990,9(1):23-27.
[27] 徐兆礼.长江口夜光藻(Noctiluca scintillans)年间变化和水域富营养化趋势[J].海洋与湖沼,2009,40(6):793-798.
[28] 郑丽平,荆红梅.亚热带和热带环境下夜光藻的摄食压力[J].应用海洋学学报,2018,37(1):146-150.