(1.上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室,上海 201306; 2.水产科学国家级实验教学示范中心,上海 201306;3.农业农村部淡水水产种质资源重点实验室,上海 201306)
近年来,随着大规模、集约化的养殖,龟类各类疾病的突发日益增多[1]。同时,学界也进行了相关研究,上海海洋大学水族宠物医学实验室对龟类疾病进行了大量研究,在病原学方面,报道了绿海龟Chelonia mydas背甲坏死病的病原真菌[2]、巴西龟Trachemys scriptaelegans等宠物龟眼炎的病原菌[3];在病理学方面,报道了巴西龟肺炎眼炎综合征的病理学[4],分析了宠物龟的灰白甲疾病[5]及菱斑龟Malaclemys terrapm肝病的组织病理变化[6];在临床药理学方面,报道了恩诺沙星[7]及吡喹酮[8]在中华草龟体内的药物代谢动力学及毒理学的研究。
中华草龟Chinemys reevesiis隶属于爬行纲Reptile龟鳖目Testudines龟科Emydidae,拥有较高的食用、观赏和药用价值,已成为中国重要的养殖品种[9]。嗜水气单胞菌Aeromonas hydrophila属革兰氏阴性菌,为气单胞菌属Aeromonas中的一种[10],是引起淡水养殖动物病害的主要病原细菌[11]。目前,已知嗜水气单胞菌是中华鳖Trionyx sinensis体表疾病穿孔病、腐皮病、疥疮病、水泡病、烂颈病、红底板的主要病原菌[12-18],同时也是引起淡水养殖鱼类细菌性败血症的主要病原菌[19]。
江西省南昌市某养龟场近几年出现严重疫情,此次病例中,中华草龟腹甲干裂发黑症状严重,是发现的首例腹甲类新型疾病,致死率高达40%,患病龟不愿露出水面,食量大减,不爱爬动。在养殖场中种龟池受精率从95%降至70%,孵化率从80%~90%降至20%~30%,产卵场出现较多软壳蛋,软壳率达到20%。本研究中,针对该养殖场龟出现的病症,对中华草龟腐皮裂甲病的病原菌进行分离鉴定,并对其组织病理变化进行观察,旨在为临床防治提供技术依据,也为研究中华草龟体表疾病提供科学依据。
1 材料与方法
1.1 材料
11只患病中华草龟种龟(编号为1~11号)取自江西南昌某养龟场种龟池;健康中华草龟购自湖南呈宝龟类繁养有限公司(平均体质量为0.433 kg/只),于上海海洋大学水族宠物医学实验室驯养两周后进行人工回感试验,驯养期间不喂食,水温控制在28 ℃。
主要试剂:沙氏葡萄糖琼脂培养基(SDA)(北京三药科技开发公司);血琼脂培养基、细菌生化微量鉴定管、药敏纸片(均为杭州微生物试剂有限公司);革兰氏染液(河南美凯生物科技有限公司);DNA 抽提试剂盒、DreamTaq-TM DNA Polymerase、SanPrep柱式DNAJ胶回收试剂盒、DNA Ladder Mix Maker、PCR扩增引物(均为生工生物工程(上海)股份有限公司)。
主要仪器:DYY-5稳压电泳仪(北京六一仪器厂); 2720 thermal cycler PCR 仪(Applied Biosystems);FR980凝胶成像仪(上海复日科技仪器有限公司);HC-2518R冷冻高速离心机(Bio Basic Inc生工生物工程股份有限公司); X光造影仪(上海查理宠物医院)。
1.2 方法
1.2.1 病龟病理解剖观察 用医用酒精棉对患病草龟体表消毒,将濒临死亡和刚死亡的患病草龟在无菌条件下进行解剖和临床诊断,留取代表性样品的脏器组织切块、固定,用于组织病理制片。
1.2.2 病原菌分离纯化及形态观察 解剖病龟后,将接种环在酒精灯上灼烧,冷却后用其刮取病龟的腹甲、肝脏、肺、肾脏组织并迅速划线接种于琼脂培养基上,标记编号后置于28 ℃恒温培养箱中培养18~24 h,多次分离纯化优势菌,并观察优势菌在培养基上菌落的颜色、大小、形态等。
1.2.3 血琼脂培养基鉴定菌的溶血性 在无菌条件下,用接种环蘸取分离纯化好的优势菌株划线接种到血琼脂培养基上,标记编号后置于恒温培养箱(28 ℃)中培养18~24 h,观察菌株的溶血性。
1.2.4 革兰氏染色镜检 在无菌条件下进行革兰氏染色,在显微镜油镜下观察菌株的形态和染色特征,判定其结果。
1.2.5 生理生化试验 将菌悬液用移液枪转移到生化鉴定管中,培养24~48 h后观察结果。
1.2.6 16S rDNA序列及其系统发育分析 按照基因组DNA抽取试剂盒提取纯化菌株的DNA,将其作为模板进行PCR扩增。PCR反应体系(20 μL):10×PCR Buffer 2 μL,上、下游引物各0.5 μL,Dntp 0.5 μL,用双蒸水补足至20 μL。PCR反应条件:96 ℃下预变性1 min;96 ℃下变性10 s,50 ℃下退火复性5 s,60 ℃下延伸4 min,共进行30个循环。将目的片段切胶回收纯化后送往生工生物工程(上海)股份有限公司测序并构建系统发育树。引物序列为27F:AGAGTTTGATCMGGCTCAG,1492R:GGTTACCTTGTTACGACTT。
1.2.7 疑似病原菌的人工回感试验 将分离得到的PF-11菌株扩增培养后,对健康的54 只中华草龟进行腹腔注射(菌悬液浓度为1×108 CFU/mL)、菌悬液浸泡(菌悬液浓度为1×105 CFU/mL)和斜面悬挂3种方式感染,每一种感染方式设试验组、平行组、对照组,每组6只中华草龟。①腹腔注射:将分离纯化的菌株配制成浓度为1×108 CFU/mL的菌悬液,以0.2 mL/只的剂量腹腔注射试验组草龟(编号b1、b2、b3、b4、b5、b6)和平行组草龟(编号bⅠ、bⅡ、bⅢ、bⅣ、bⅤ、bⅥ),对照组草龟(编号B1、B2、B3、B4、B5、B6)注射无菌生理盐水0.2 mL/只; ② 菌液浸泡:用分离纯化的菌株配制浓度为1×105 CFU/mL的水体,将试验组草龟(编号a1、a2、a3、a4、a5、a6)和平行组草龟(aⅠ、aⅡ、aⅢ、aⅣ、aⅤ、aⅥ)放入其中浸泡,对照组(编号A1、A2、A3、A4、A5、A6); ③ 斜面悬挂:将嗜水气单胞菌(PF-11菌株)接种到1.5 mL离心管中,采用斜面培养,待菌株生长24 h后,沿斜面剪出椭圆形横截面,使之与试验组草龟(编号d1、d2、d3、d4、d5、d6)和平行组草龟(编号dⅠ、dⅡ、dⅢ、dⅣ、dⅤ、dⅥ)甲桥上的盾片吻合,固定方法参照绿海龟背甲坏死病菌株的固定方法[2],对照组(编号D1、D2、D3、D4、D5、D6)。
将试验组、平行组、对照组的中华草龟分开饲养,每天观察记录其状态,以及发病和死亡情况。
1.2.8 病原菌药敏试验 采用K-B药敏纸片法,每个平板放3个药敏片,标记编号后置于28 ℃恒温培养箱中培养18~24 h, 用游标卡尺测量抑菌圈直径。每组试验设3个重复,最后取其平均值作为最终结果。
1.2.9 组织病理检验 用施立特迷你电钻在龟腹甲干裂变色处取样,置于EDTA液中脱钙20 d。解剖取病龟心、肝、脾、肺、肾等组织切成约5 mm组织块,置于体积分数为10%的中性福尔马林中固定24 h后,冲水5 h。用体积分数为50%~100%的乙醇溶液对试验龟甲和组织块逐级脱水、透明。于56~58 ℃下用石蜡包埋,切片厚度为5~7 μm,于60 ℃下烘片1 h,H.E染色,中性树胶封片,在显微镜(徕卡DM3000)下观察并拍照。
2 结果与分析
2.1 病龟的临床症状和病理解剖观察
记录11只患病中华草龟雌雄、背甲长、背甲宽、背甲厚、体质量、临床症状及病理解剖结果(表1)。临床症状上,腹甲分为3种情况:4号、9号龟(图1A、B)腹甲外观正常;1号(图1E、F)、3号、7号龟腹甲局部干裂发黑;2、5、6、8、10、11号龟(图1I、J)腹甲大部分干裂、发黑。病理解剖上,11只龟均表现出肝脏发黑、肺发白、肠道无内容物、有腹水、内脏团伴有恶臭味。病龟精神状态均表现呆滞,不爱爬动。从腹甲的3种情况中各选一例病龟(9、1、11号)做对比,结果如图1所示。
表1 患病中华草龟临床症状和病理解剖观察结果
Tab.1 Observation of clinical symptoms and pathological anatomy of sick Chinses pond turtle Chinemys reevesiis
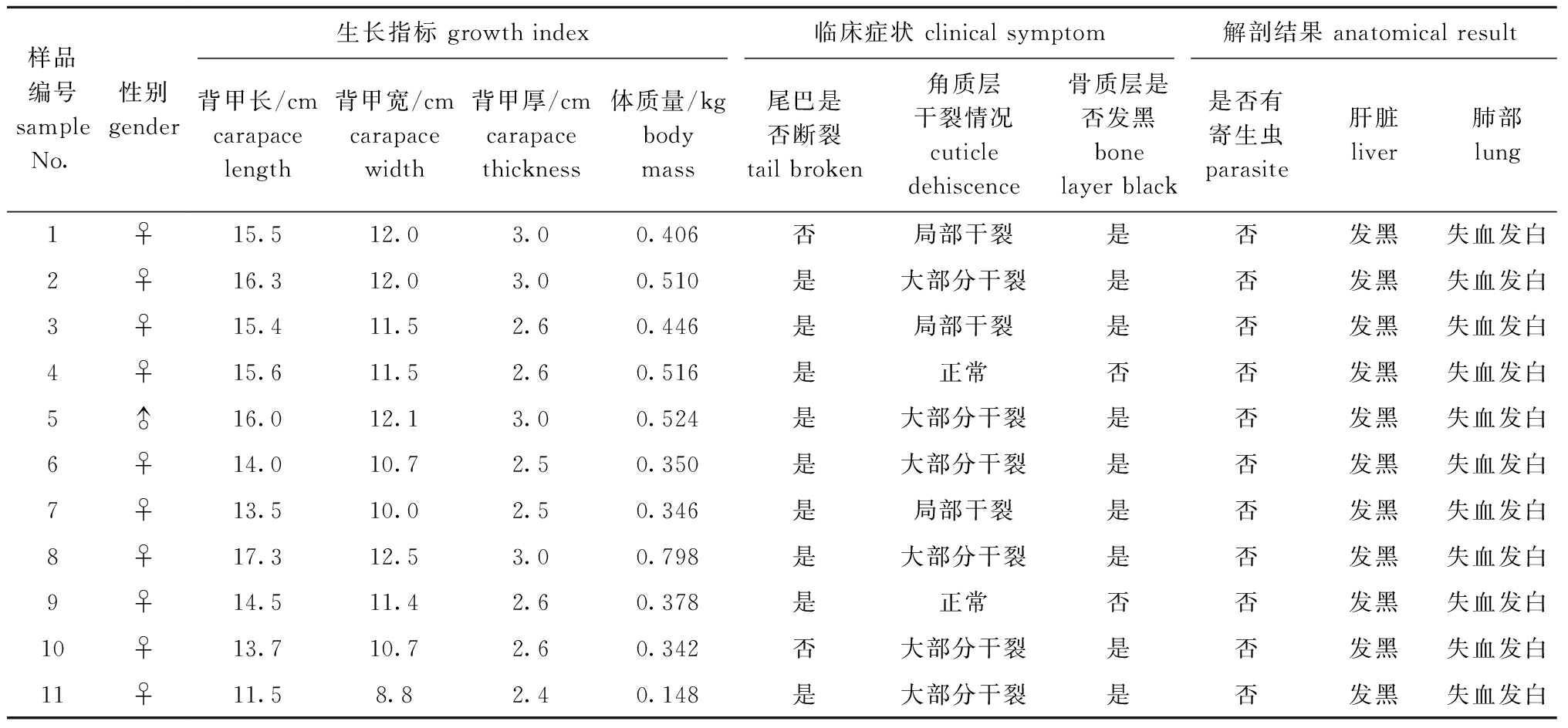
样品编号sample No.性别gender生长指标 growth index临床症状 clinical symptom解剖结果 anatomical result背甲长/cmcarapace length背甲宽/cmcarapace width背甲厚/cmcarapace thickness 体质量/kgbodymass尾巴是否断裂tail broken角质层干裂情况cuticle dehiscence骨质层是否发黑bone layer black是否有寄生虫parasite肝脏liver肺部lung1♀15.512.03.00.406否局部干裂是否发黑失血发白2♀16.312.03.00.510是大部分干裂是否发黑失血发白3♀15.411.52.60.446是局部干裂是否发黑失血发白4♀15.611.52.60.516是正常否否发黑失血发白5♂16.012.13.00.524是大部分干裂是否发黑失血发白6♀14.010.72.50.350是大部分干裂是否发黑失血发白7♀13.510.02.50.346是局部干裂是否发黑失血发白8♀17.312.53.00.798是大部分干裂是否发黑失血发白9♀14.511.42.60.378是正常否否发黑失血发白10♀13.710.72.60.342否大部分干裂是否发黑失血发白11♀11.58.82.40.148是大部分干裂是否发黑失血发白
2.2 病原菌的分离纯化及形态观察
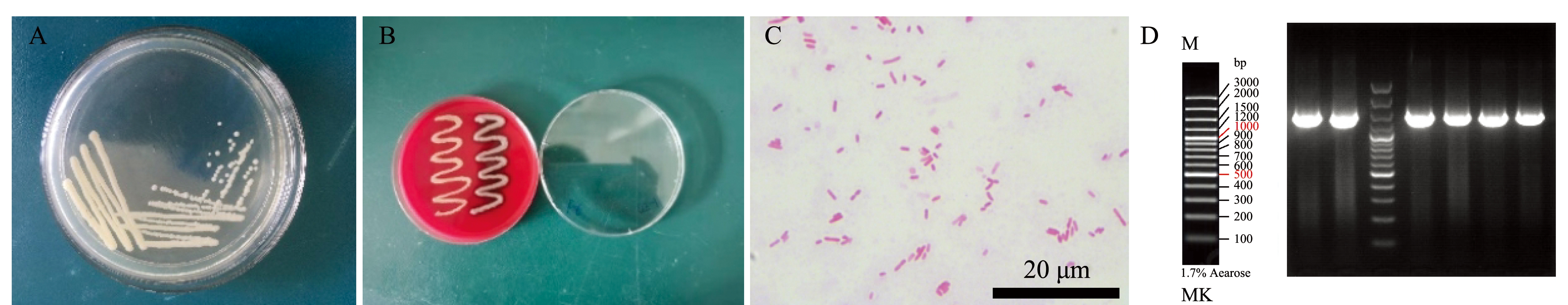
从患病中华草龟的腹甲、肝脏、肺3处组织中共提取33 株菌株,将分离纯化的菌株在培养基上显示,均具有颜色呈白色、形状标点状、表面光滑隆起、边缘整齐、显湿润、易被接种环挑起的菌落特征(图2A)。
2.3 血琼脂培养基鉴定及革兰氏染色镜检
血琼脂培养基鉴定结果表明,有5 株菌株呈阳性,其他菌株呈阴性,其中5 株阳性菌分别为取自1号病龟肝脏组织编号GZ-1的菌株,5号病龟肝脏组织编号GZ-5的菌株,5号病龟肺组织编号F-5的菌株,10号病龟肺组织编号F-10的菌株,11号病龟腹甲组织编号PF-11的菌株。图2B为PF-11菌株阳性结果和F-6菌株阴性结果。
革兰氏染色结果表明,血琼脂培养基呈阳性的5 株菌均为革兰氏阴性菌,呈短杆状,图2C为PF-11菌株革兰氏染色结果。
2.4 生理生化试验结果
生理生化试验结果表明:血琼脂培养基呈阳性的5株菌对葡萄糖产酸、葡萄糖产气、蔗糖、甘露糖、肌醇、蛋白胨水、阿拉伯糖、V-P试验、精氨双水解酶反应呈阳性,而对赖氨酸脱羧酶反应呈阴性,在0%和3%的NaCl胨水中(浑浊)生长,在8%和10%的NaCl胨水中未变浑浊(表2)。参照《常见细菌系统鉴定手册》,这5 株菌与弧菌科的嗜水气单胞菌基本相似,初步鉴定为嗜水气单胞菌。
2.5 16S rDNA序列及其系统发育分析
血琼脂培养基呈阳性的5株菌株经PCR扩增得到长度约1 500 bp的16S rRNA片段,图2D为PCR电泳结果。将得到的产物回收获得株菌的16S rDNA部分基因序列。在NCBI网站,将已知序列在GenBank数据库中进行相似性搜索,该菌已提交至GenBank(登陆号为MK007301.1),结果表明,GZ-1、GZ-5、F-5、F-10、PF-11与嗜水气单胞菌的一致性高达100%。通过最大简约法将PF-11菌株构建系统发育树(图3),结果表明,本次试验提取的菌株与嗜水气单胞菌的亲缘关系最近。
2.6 疑似病原菌人工回感试验结果
从表3可见:疑似病原菌回感试验第7天时,浸泡组死亡1 只;第13 天时,悬挂组死亡1只,浸泡组死亡2 只;第15 天时,悬挂组中6 只、浸泡组中5 只均出现阳性症状;第18 天时,悬挂组中3 只出现阳性症状,注射组中1 只死亡,浸泡组中3只出现阳性症状;持续至试验第27天时,悬挂组中共10 只出现阳性结果(出现阳性症状和死亡),注射组中仅1 只出现阳性结果(死亡),浸泡组中共11只出现阳性结果(出现阳性症状和死亡)。阳性症状(图4A~C)表现为角质层干裂和骨质层发黑,对照组均未发现阳性结果,整个试验周期为27 d。这表明,这3种人工回感方式中浸泡感染效果最好。
选择出现典型阳性症状的a2、d4及b6草龟样本进行解剖,发现其均存在肝性腹水、淤血发黑、肿大等临床症状,此外,a2和b6肝表面出现白色结节,a2肺部充血肿大。对腹甲、肝脏、肺组织中提取的细菌进行16S rDNA序列分析,得到与自然发病中华草龟相同的嗜水气单胞菌,结果再次验证了该菌是导致中华草龟腐皮裂甲病的病原菌。
表2 5株阳性菌的主要生理生化指标
Tab.2 Main physiological and biochemical indicators of five positive bacterial strains
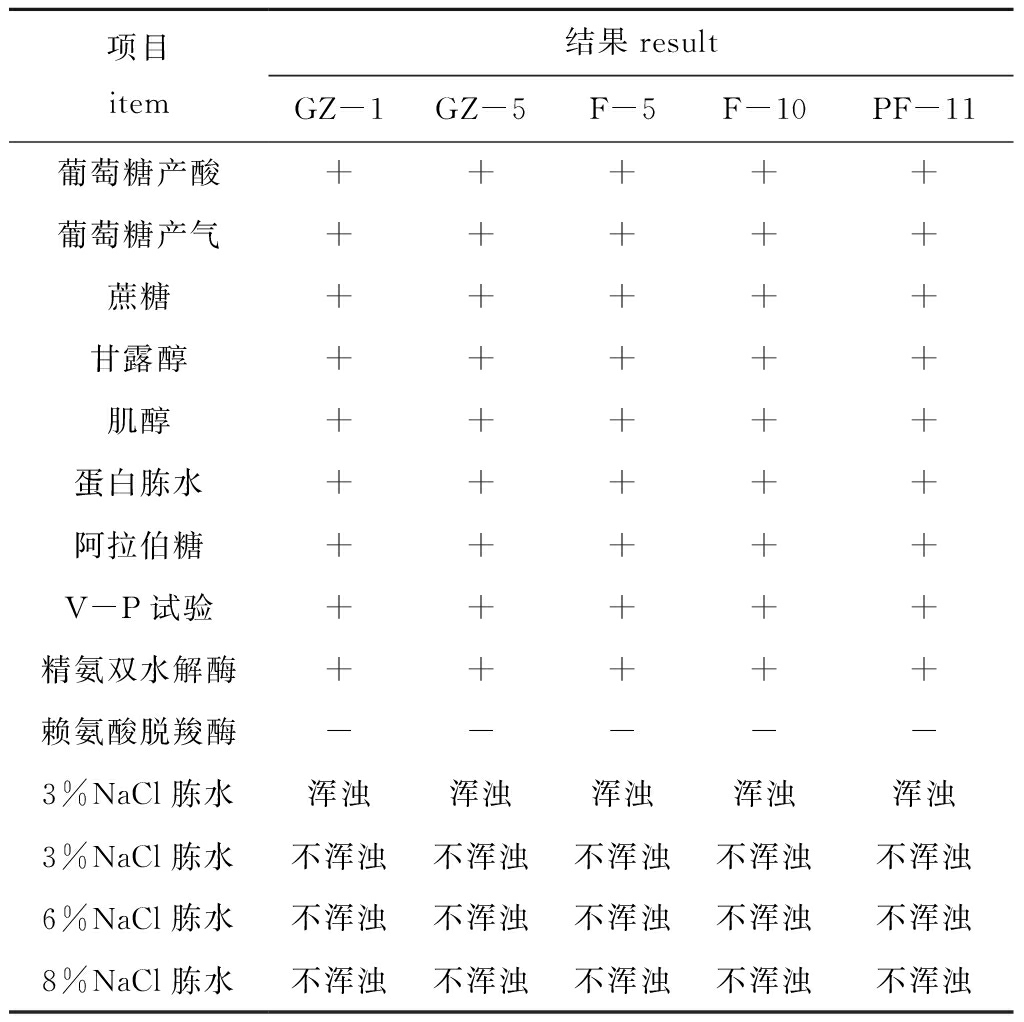
项目item结果resultGZ-1GZ-5F-5F-10PF-11葡萄糖产酸+++++葡萄糖产气+++++蔗糖+++++甘露醇+++++肌醇+++++蛋白胨水+++++阿拉伯糖+++++V-P试验+++++精氨双水解酶+++++赖氨酸脱羧酶-----3%NaCl胨水浑浊浑浊浑浊浑浊浑浊3%NaCl胨水不浑浊不浑浊不浑浊不浑浊不浑浊6%NaCl胨水不浑浊不浑浊不浑浊不浑浊不浑浊8%NaCl胨水不浑浊不浑浊不浑浊不浑浊不浑浊
注:+,阳性;-,阴性。
Note,+,positive;-,negative.
2.7 病原菌药敏试验结果
药敏试验结果表明:5 株菌株具有高度一致性,对头孢哌酮、头孢噻肟、头孢他啶、庆大霉素、阿米卡星、卡那霉素、奈替米星、左氧氟沙星、氧氟沙星、恩诺沙星有强敏感性;对苯唑西林、氨苄西林、羧苄西林、阿莫西林、四环素等有耐药性;对氯霉素抗菌药中介(表4)。
表3 中华草龟腹甲腐皮干裂病疑似病原菌的人工回感试验
Tab.3 Results of artificial infection test for suspected pathogens of Chinese pond turtle Chinemys reevesiis
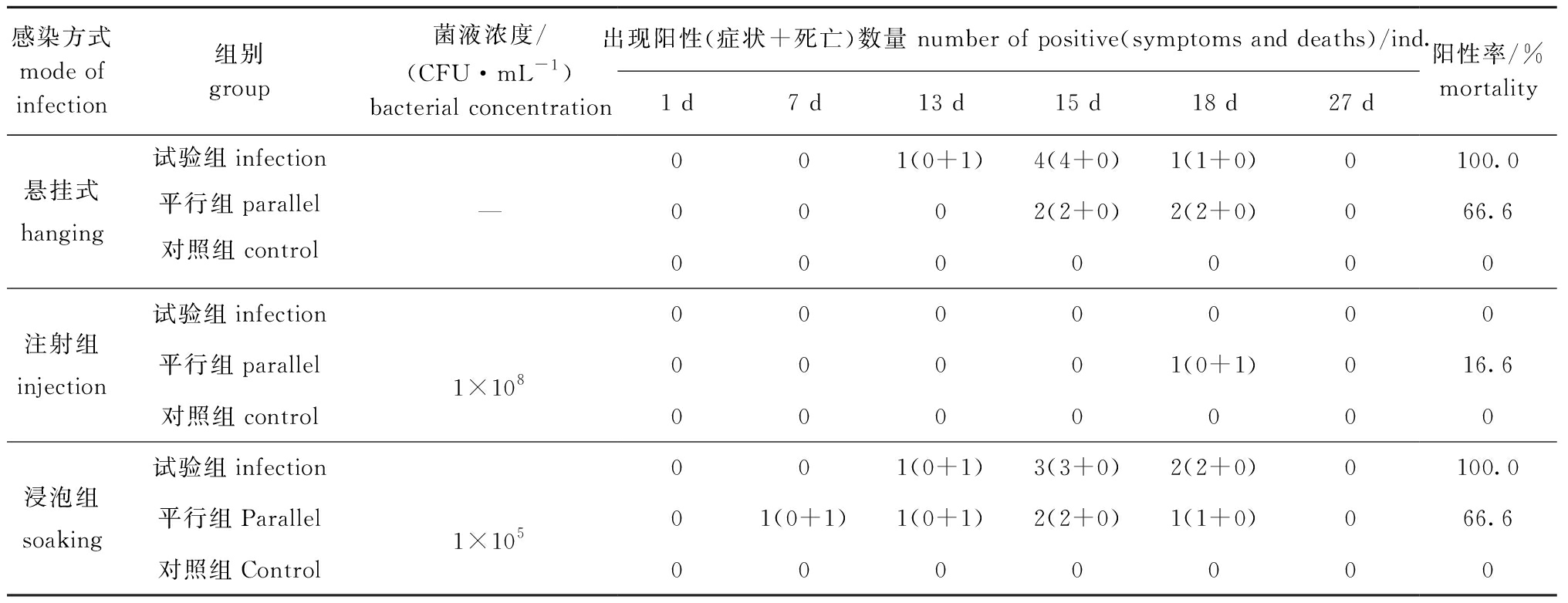
感染方式mode of infection组别group菌液浓度/(CFU·mL-1)bacterial concentration出现阳性(症状+死亡)数量 number of positive(symptoms and deaths)/ind.1 d7 d13 d15 d18 d27 d阳性率/%mortality悬挂式hanging试验组infection平行组parallel对照组control—001(0+1)4(4+0)1(1+0)0100.00002(2+0)2(2+0)066.60000000注射组injection试验组infection平行组parallel对照组control1×108000000000001(0+1)016.60000000浸泡组soaking试验组infection平行组Parallel对照组Control1×105001(0+1)3(3+0)2(2+0)0100.001(0+1)1(0+1)2(2+0)1(1+0)066.60000000
2.8 腹甲及主要内脏器官组织病理特征
从11只样品龟中选取腹甲正常的9号样品龟和腹甲角质层干裂、骨质层发黑的1号样品龟,对其组织病理观察显示:9号样品龟腹甲的病理特征为松质骨层中的骨髓腔浸润大量的嗜酸性粒细胞,以出现炎症为主,无结构坏死特征(图5A、B);1号样品龟腹甲的病理特征为密质骨发生裂解坏死病变,以组织结构坏死为主,同时骨髓腔浸润大量的嗜酸性粒细胞,有组织炎症特征(图5C、D)。对1号、9号样品龟主要内脏器官组织病理观察显示:肺泡隔毛细血管高度扩张出血,肺泡腔中见大量炎性细胞(图5E);脾脏组织中有大量炎性细胞(图5F);肾脏组织出现嗜酸性结节(图5G);肝脏内炎性细胞增多,含铁血黄素增多(图5H)。
3 讨论
3.1 中华草龟腐皮裂甲病病原的诊断
目前,有关龟鳖类体表疾病研究报道较多,但本研究病例中中华草龟腹甲出现角质层腐皮症状,与中华鳖[20-21]和黄喉拟水龟[22]腐皮病的临床症状表现一致,与中华鳖的疥疮病[23]、穿孔病[24],以及与中华草龟、巴西龟、黄头侧颈龟的灰白甲病[5]及绿海龟灰白甲病[2]不一致,而腹甲骨质层变黑和角质层裂开的症状是发现的首例腹甲类新型疾病。
本研究中,对从患病中华草龟提取的疑似病原菌进行16S rDNA基因序列比对及系统发育分析,结果显示,该菌与嗜水气单胞菌的一致性为100%。人工感染试验中,健康中华草龟出现同样症状,验证了中华草龟腐皮裂甲病的致病菌为嗜水气单胞菌,这与中华鳖腐皮病[25]和中华鳖腐皮疥疮并发症[23]的病原体结果一致,但与中华鳖的腐皮病病原为普通变形杆菌Proteus vulgaris[21]、产吲哚金黄杆菌Chryseobacterium indologenes[26],中华鳖穿孔病病原为摩氏摩根氏菌Morganella morganii[27],黄喉拟水龟腐皮病病原体为类香味菌新种Myroides sp.[22],以及绿海龟灰白甲病病原体为腐皮镰刀菌Fusarium solani结果[2]不一致。嗜水气单
表4 中华草龟腹甲腐皮干裂病病原菌药敏试验结果
Tab.4 Results of drug susceptibility test for pathogens in Chinese pond turtle Chinemys reevesiis
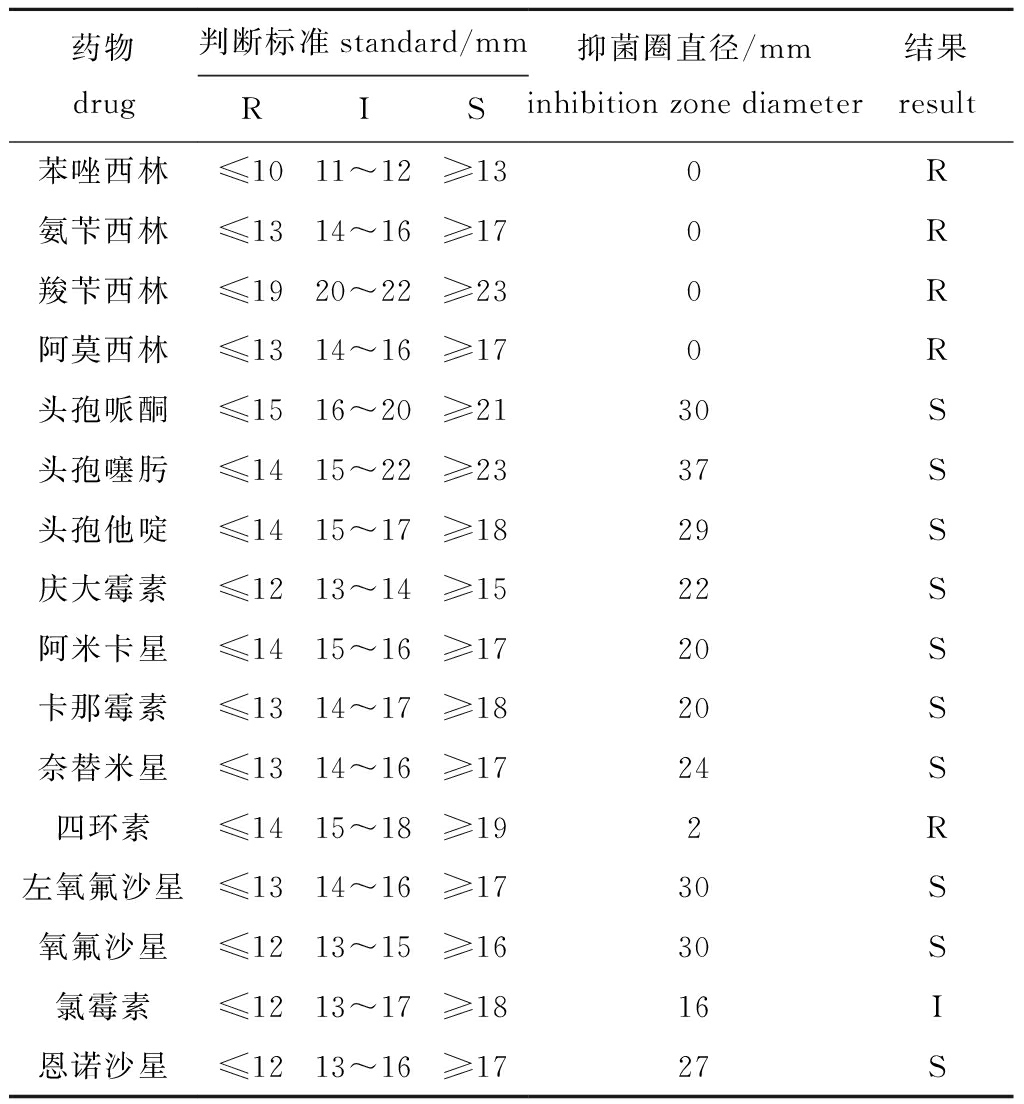
药物drug判断标准standard/mmRIS抑菌圈直径/mminhibition zone diameter结果result苯唑西林≤1011~12≥130R氨苄西林≤1314~16≥170R羧苄西林≤1920~22≥230R阿莫西林≤1314~16≥170R头孢哌酮≤1516~20≥2130S头孢噻肟≤1415~22≥2337S头孢他啶≤1415~17≥1829S庆大霉素≤1213~14≥1522S阿米卡星≤1415~16≥1720S卡那霉素≤1314~17≥1820S奈替米星≤1314~16≥1724S四环素≤1415~18≥192R左氧氟沙星≤1314~16≥1730S氧氟沙星≤1213~15≥1630S氯霉素≤1213~17≥1816I恩诺沙星≤1213~16≥1727S
注:S—敏感;I—中介;R—耐药。
Note:S—sensitivity;I—intermediary;R—resistant.
胞菌是可感染人和动物的重要病原,可感染水产动物并引发暴发性死亡。导致龟鳖腹甲感染的因素较多,而本研究中中华草龟腹甲腐皮裂甲病的病原体属首次报道。
3.2 中华草龟腐皮裂甲病的病理诊断
本试验中,中华草龟腐皮裂甲病的病理特征为腹甲骨髓腔浸润大量的嗜酸性粒细胞、密质骨发生裂解坏死病变,这与中华草龟、巴西龟、黄头侧颈龟等宠物龟灰白甲病[5]病理结果一致,但骨髓腔未发现黑色素沉积。肝、肺、脾、肾内脏组织内浸润大量嗜酸性粒细胞的炎症特征与中华鳖腐皮病[28]、中华鳖穿孔病[29]的实质器官组织有炎症病变一致,但与实质器官组织萎缩坏死且呈败血症的[29]病理结果不一致。
中华草龟腐皮裂甲病理机制是其腹甲先出现组织炎症病症,随着病情严重,后期腹甲组织结构发生裂解坏死,表观上一开始无明显特征,中后期腹甲角质层开始裂开,骨质层开始发黑腐烂,最终死亡,这与裂甲后体腔开放进水有关。
3.3 中华草龟腐皮裂甲病的预防和控制建议
针对细菌性疾病研究,建议首先以预防为主,包括对生态环境的调控、中草药的使用、疫苗接种等。建议使用抗生素为中华草龟腐皮裂甲病的主要治疗方法。本试验药敏结果表明,该病致病菌对头孢哌酮、头孢噻肟、头孢他啶、庆大霉素、阿米卡星、卡那霉素、奈替米星、左氧氟沙星、氧氟沙星、恩诺沙星等抗生素有强敏感性,这为该病的治疗提供了科学依据,就近选择以上为主成份的渔药使用。但需注意的是嗜水气单胞菌有一定耐药性,这提醒实践中应合理使用抗生素,严禁滥用,要严格遵循药品说明书,避免增加抗药性及药物残留等弊端,同时结合定期消毒,平时做好检疫工作,使用复方中草药及疫苗综合防治该病,做好预防工作的同时还要“早发现,早治疗”。
参考文献:
[1] MAHMOUD H K,AL-SAGHEER A A,REDA F M,et al.Dietary curcumin supplement influence on growth,immunity,antioxidant status,and resistance to Aeromonas hydrophila in Oreochromis niloticus[J].Aquaculture,2017,475:16-23.
[2] 庞溦,张晓雨,潘连德,等.绿海龟背甲坏死病病原真菌的鉴定及其药敏特性[J].上海海洋大学学报,2019,28(5):782-791.
[3] 陈晨,潘连德.宠物龟眼炎的病原鉴定及临床药物治疗的研究[J].上海海洋大学学报,2011,20(2):244-251.
[4] 李玉平,赵凌恭,余春明,等.巴西龟肺炎眼炎综合征的病理学观察[J].中国兽医杂志,2011,47(2):56-57.
[5] 鲍晓颖,庞溦,潘连德,等.3种宠物龟“灰白甲”病组织病理学研究[J].大连海洋大学学报,2020,35(2):205-212.
[6] 雷洁,王伟喆,潘连德.养殖菱斑龟肝病组织病理研究[J].上海海洋大学学报,2012,21(6):989-995.
[7] 章宇思,潘连德,洪滨.连续肌注恩诺沙星对中华草龟的急性和慢性毒理研究[J].大连海洋大学学报,2017,32(6):643-650.
[8] 张晓雨,庞溦,潘连德,等.灌胃吡喹酮在中华草龟体内的代谢动力学研究[J].大连海洋大学学报,2020,35(1):89-95.
[9] HSIEH C Y,CHANG T C,SHEN Y L,et al.Pathological and PCR detection of mycobacteriosis in pond-cultured Chinese soft shell turtles,Trionyx sinensis[J].Aquaculture,2006,261(1):10-16.
[10] BRENNER D J,KRIEG N R,STATE J T,et al.Bergey’s manual of systematic bacteriology volume 2:the proteobacteria[M].2nd ed.New York:Springer,2005:105-245.
[11] PODOK P,LIMSUWAN C,PURIVIROJKUL W,et al.Effect of Bacillus spp. on inhibition of pathogenic bacteria Aeromonas hydrophila and Streptococcus agalactiae in Nile tilapia (Oreochromis niloticus)[C]//Proceedings of the 49th Kasetsart University Annual Conference,Kasetsart University,Thailand,1-4 february,2011.Volume 3.Subject:Fisheries.Kasetsart University,2011:65-72.
[12] 毛宁,杨岩花,赖琼华,等.鳖“穿孔病”病原菌及其免疫防治[J].水产学报,1998,22(3):234-239.
[13] 杜爱芳,蔡渭明.鳖穿孔病病原的分离鉴定与药敏试验[J].浙江农业学报,2000,12(1):42-45.
[14] 史秋梅,汤生玲,高桂生,等.甲鱼暴发性传染病的病原分离及治疗试验[J].中国兽医学报,1998,18(4):346-348.
[15] 赵小平,汪官余,郑永华,等.中华鳖“烂颈病”病因学的初步研究[J].淡水渔业,2005,35(6):44-46.
[16] 郑曙明,陈章宝,贺荣.中华鳖皮肤溃烂病的病原研究[J].四川畜牧兽医学院学报,1998,13(4):1-5.
[17] 刘杰,胡大胜,黄钧,等.山瑞鳖红底板病病原菌的分离鉴定及药敏试验[J].南方农业学报,2015,46(4):712-716.
[18] GARNER M M,HERRINGTON R,HOWERTH E W,et al.Shell disease in river cooters (Pseudemys concinna) and yellow-bellied turtles (Trachemys scripta) in a Georgia (USA) lake[J].Journal of Wildlife Diseases,1997,33(1):78-86.
[19] 钟妮娜,汪开毓.鲤鱼细菌性败血症及穿孔病病原菌与嗜水气单胞菌标准株特性的比较研究[J].四川农业大学学报,2001,19(1):94-96.
[20] 孙红祥,舒妙安.中华鳖几种常见疾病病原的分离鉴定及药敏试验[J].中国兽医学报,2002,22(2):140-142.
[21] 郑天伦,张海琪.中华鳖腐皮病的病原鉴定与药敏研究[J].浙江农业学报,2015,27(1):32-36.
[22] 兰云,胡秀彩,沈晓静,等.黄喉拟水龟腐皮病病原菌的分离鉴定及药敏试验[J].动物医学进展,2014,35(9):127-131.
[23] 曾丹,钟蕾,罗方兴,等.中华鳖“腐皮、疖疮”并发症致病菌的病原分离与药敏试验分析[J].湖南师范大学(自然科学学报),2013,36(4):74-78.
[24] YE Q Z,CHAN S M,HE J G,et al.A fragment amplified from Aeromonas sobria has protective immunity against diseases caused by A.hydrophila in soft-shelled turtle Trionyx sinensis[C]//Proceedings of the 3rd world fisheries congress:feeding the world with fish in the next millennium the balance between production and environment.American Fisheries Society,2003:331-336.
[25] 吕孙建,刘莉,曹铮,等.一株中华鳖气单胞菌噬菌体的分离及功能鉴定[J].江苏农业科学,2018,46(2):108-111.
[26] 杨移斌,艾晓辉,宋怿,等.中华鳖源致病性产吲哚金黄杆菌分离、鉴定及药敏特性分析[J].水生生物学报,2018,42(4):786-793.
[27] 马有智,舒妙安.一种中华鳖穿孔病病原菌的分离和特性研究[J].浙江大学学报(农业与生命科学版),2000,26(4):414-416.
[28] 吴惠仙,薛俊增.中华鳖腐皮病的病理组织学研究[J].浙江大学学报(理学版),2004,31(4):451-455.
[29] 蔡完其,赵金良.中华鳖穿孔病病理变化[J].中国水产科学,1998,5(4):17-22.
 11号),采用病原菌分离纯化、生理生化试验、疑似病原菌人工回感试验、病原菌药敏试验、组织病理检验等方法进行了病因分析及鉴定。结果表明:该病典型的临床症状为腹甲角质层干裂、骨质层发黑,病龟精神状态均表现呆滞、不爱爬动;病理解剖显示,患病龟肝脏发黑,肺发白,胃肠道无内容物、有腹水,内脏团伴有恶臭味;组织病理观察显示,多数病龟密质骨发生裂解坏死,骨髓腔浸润大量嗜酸性粒细胞,同时内脏组织有炎症特征;进一步从病龟腹甲、肝脏、肺组织分离获得5株菌株,经细菌形态学观察、生理生化试验、16S rDNA基因序列及系统发育分析等鉴定为嗜水气单胞菌Aeromonas hydrophila;人工回感染试验显示,感染龟与自然发病龟的临床症状一致,且在回感中华草龟脏器中再分离到相同的菌株;药敏试验显示,该菌对头孢类、庆大霉素、阿米卡星、卡那霉素、喹诺酮类抗菌药物高度敏感,对青霉素类、四环素抗菌类药物有耐药性。研究表明,中华草龟腐皮裂甲病的病原菌是嗜水气单胞菌,头孢类、庆大霉素、阿米卡星、卡那霉素、喹诺酮类等抗菌药物可作为该病临床防治的首选药品。
11号),采用病原菌分离纯化、生理生化试验、疑似病原菌人工回感试验、病原菌药敏试验、组织病理检验等方法进行了病因分析及鉴定。结果表明:该病典型的临床症状为腹甲角质层干裂、骨质层发黑,病龟精神状态均表现呆滞、不爱爬动;病理解剖显示,患病龟肝脏发黑,肺发白,胃肠道无内容物、有腹水,内脏团伴有恶臭味;组织病理观察显示,多数病龟密质骨发生裂解坏死,骨髓腔浸润大量嗜酸性粒细胞,同时内脏组织有炎症特征;进一步从病龟腹甲、肝脏、肺组织分离获得5株菌株,经细菌形态学观察、生理生化试验、16S rDNA基因序列及系统发育分析等鉴定为嗜水气单胞菌Aeromonas hydrophila;人工回感染试验显示,感染龟与自然发病龟的临床症状一致,且在回感中华草龟脏器中再分离到相同的菌株;药敏试验显示,该菌对头孢类、庆大霉素、阿米卡星、卡那霉素、喹诺酮类抗菌药物高度敏感,对青霉素类、四环素抗菌类药物有耐药性。研究表明,中华草龟腐皮裂甲病的病原菌是嗜水气单胞菌,头孢类、庆大霉素、阿米卡星、卡那霉素、喹诺酮类等抗菌药物可作为该病临床防治的首选药品。

 ),肺部发白(←);E—1号龟背甲;F—1号龟腹甲,腹甲局部发黑干裂(
),肺部发白(←);E—1号龟背甲;F—1号龟腹甲,腹甲局部发黑干裂(