小鳞拟松鲷Datnioides pulcher,俗称印度尼西亚虎鱼,隶属于鲈形目Perciformes拟松鲷科Lobotidae拟松鲷属Datnioidide,是一种重要经济鱼类。自然分布于东南亚半岛的湄南河流域、湄公河流域,以及印尼苏门答腊及加里曼丹岛西部等低纬度热带地区。小鳞拟松鲷属于猎食性鱼类,喜捕食活饵。因其肉味鲜美,肌间刺较少,在原产地主要作为食用鱼。中国无拟松鲷鱼类的自然分布,主要作为名贵观赏鱼被引入,常用来与龙鱼混养,寓意“龙腾虎跃”。国内外对拟松鲷鱼类的研究鲜有报道,仅见对曼谷拟松鲷Datnioides undecimradiatus[1]和小鳞拟松鲷[2]两种拟松鲷线粒体的相关研究,以及对小鳞拟松鲷[3]微卫星特征的分析研究,而在其他方面如形态特征、生长特性及染色体核型等方面的研究尚未见报道。补充小鳞拟松鲷基础生物学资料,可为更深层次的研究打下基础。
形态学性状是鱼类类别的划分依据,同时受到行为、环境及季节变化等多方面的影响[4]。掌握鱼类生长发育特性及规律,可丰富其生长基础研究,也可为鱼类常规化养殖提供指导。目前,有关鱼类形态结构与生长发育特性的研究较多[5-6],但有关小鳞拟松鲷尚无相关报道。因此,本研究中拟对小鳞拟松鲷的内外部形态特征、生长特性及核型特征等进行研究,以期为补充小鳞拟松鲷基础生物学资料,并为其分类鉴定和养殖提供参考依据。
1 材料与方法
1.1 材料
试验共用两批不同批次的试验鱼,用于内外部形态特征、染色体制备研究的成鱼于2017年由印度尼西亚引进,用于生长特性试验的幼鱼于2018年11月经进口鱼商从印度尼西亚购进,均养殖于中国水产科学研究院珠江水产研究所观赏渔业基地。
1.2 方法
1.2.1 形态特性试验 随机挑选10尾小鳞拟松鲷成鱼作为解剖样本,对其各鳍条数目及鳍条与条纹的相对位置进行记录统计,并观察各鳍条是否存在分支鳍条。统计侧线鳞及测线上下方的鳞片数目、左右两边鳃弓数目及外鳃弓鳃耙数目,并解剖试验样本观察其内部各器官形态特征。
1.2.2 幼鱼生长特性试验 生长特性试验期间,试验幼鱼养殖在水族缸(130 cm×45 cm×55 cm)中,水温稳定在30 ℃左右,缓慢循环水流,持续曝气。每天投喂一次冷冻过的红虫、小虾及鱼肉,投饵量约为池内鱼体总质量的3%~5%。生长特性试验开始共养殖50尾120日龄的小鳞拟松鲷幼苗,幼鱼初始体质量为(0.84±0.31)g,体长为(3.71±0.36)cm,养殖试验持续155 d,试验结束时幼鱼剩余41尾,期间死亡9尾。试验过程中,在120、135、165、182、197、212、260、275日龄时,随机取30尾试验鱼,使用斯乐疲,按说明书剂量进行麻醉,然后测量鱼体全长、体长、体高、头长、眼径、口裂长、体宽、眼间距等指标数据(图1)(精确到0.01 cm),鱼体质量使用电子天平称量(精确到0.01 g)。前后采集8次共240个数据。可量性状的测量依据孟庆闻等[7]的方法。采用m=aLb(a为生长的条件因子,b为幂指数)研究其体质量与体长的关系。
1.2.3 染色体核型分析 染色体制备参照朱新平等[8]的方法。挑选2尾小鳞拟松鲷雄性成鱼头肾及中肾作为试验材料,其中,2尾鱼体质量分别为376、435 g,体长分别为28.5、31.1 cm,染色体制片完成后用显微镜进行观察,100倍油镜下拍照,取115个状态较好的中期分裂相细胞,确定染色体的数目,并选出10个分散良好、形态清晰的染色体分裂相细胞,参照Levan等[9]的染色体分类标准进行分类排列。
1.2.4 生长指标计算 各项生长指标计算公式为
瞬时生长率=(lnm2-lnm1)/(t2-t1)×100%,
体质量日均增量mz=(m2-m1)/(t2-t1),
体长日均增量Lz=(L2-L1)/(t2-t1),
肥满度K=m/L3×100%。
其中:m1、m2分别为养殖t1、t2时的体质量(g);t1和t2分别为不同的养殖时间(d);L1、L2分别为养殖t1、t2时的体长(cm);m、L分别为鱼体质量(g)和体长(cm)。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,使用Photoshop CC 2017制作染色体组型图,使用 Excel 2016进行数据统计分析,计算可量形状间各项比值,绘制生长曲线图及绘制试验鱼的核型模式图[10]。
2 结果与分析
2.1 外部与内部形态特征
2.1.1 外部形态特征 小鳞拟松鲷成鱼体侧扁,侧面观近似橄榄形,体色呈暗黄色,体表有若干条黑色条纹,黑条呈现空心或间断。条纹数分布较特殊,大部分小鳞拟松鲷鱼体两侧黑纹均为7条或8条,也存在极其特殊的个体,如鱼体一侧有7条黑纹,而另一侧有8条黑纹,即两侧黑纹数量不一致。大部分小鳞拟松鲷第一条暗纹身体左右两侧不相连,其余暗纹于背部相连,在腹部有部分相连。第一条暗纹贯穿眼部,最后一条暗纹在尾柄端,鳃盖延伸至第二条暗纹处。
小鳞拟松鲷成鱼吻尖、口裂中等、左右对称,下颌长于上颌,牙齿发达。左右两侧各两个鼻孔,呈前后分布。眼大,凸出,眼间距大。体被细小鳞片,左右两边侧线明显,起始于第二条暗纹,呈弓形延伸至尾柄处。弓形顶点位于第三条暗纹处,随后侧鳞线位置逐渐降低。
侧线鳞106~113,侧线上鳞18~25,侧线下鳞34~36。背鳍分为第一背鳍和第二背鳍且相连。其中,第一背鳍存在坚硬鳍棘,起始于第二条与第三条暗纹之间,终止于第五条暗纹附近,第二背鳍存在分支鳍条,延伸至尾柄处。胸鳍无硬棘,存在分枝鳍条。腹鳍胸位,有鳍棘,位于第二条与第三条暗纹之间,存在分支鳍条。臀鳍有鳍棘,尾鳍相比较其体型较大,介于扇形与截形之间。小鳞拟松鲷的鳍式为:(D.)背鳍Ⅺ~Ⅻ 15~17,胸鳍(P.) 16~18,腹鳍(V.)Ⅱ 5~7,臀鳍(A.)Ⅲ~Ⅳ 9~12,尾鳍(C.)15~17;脊椎骨数量为22~24。小鳞拟松鲷成鱼体长最大可达55 cm,体质量可达3 587 g(图2)。
小鳞拟松鲷左右两边各具4 条鳃弓(图3),每条鳃弓上有2个半鳃,共8个半鳃,且鳃间隔不发达,第一条鳃弓外鳃耙16~19条,具有6枚鳃盖条骨。
2.1.2 内部形态特征 小鳞拟松鲷具有22~24节脊椎骨及8根肋骨,肌间刺较少;心脏有明显的动脉球;左右两侧均有性腺,呈对称分布,于泄殖孔处相连,雌鱼怀卵量大,卵直径小;胃部较大、胃壁厚、肠道较短;肝脏呈红色,两叶;胆囊呈黄绿色,脾脏呈黑褐色;头肾位于脊椎骨最前方的下部,中肾依附在脊椎骨下部呈暗红色;无鳔管(图4)。

1—全长;2—体长;3—头长;4—眼径;5—体高;6—口裂长;7—体宽;8—眼间距。
1—total length;2—body length;3—head length;4—interorbital;5—body height;6—crack length;7—body width;8—eye spacing.
图1 小鳞拟松鲷测量指标
Fig.1 Measured indices of Datnioides pulcher


图2 小鳞拟松鲷外部形态及鳞片
Fig.2 External morphology and scale of Datnioides pulcher
2.2 生长特征
2.2.1 可量与可比性状 本试验中在8个日龄时间点均测量小鳞拟松鲷幼鱼全长、体长、体高、头长、眼径、口裂长、体宽、眼间距等8个可量数据指标,并计算可比性状比例,取其平均值,结果如表1所示。
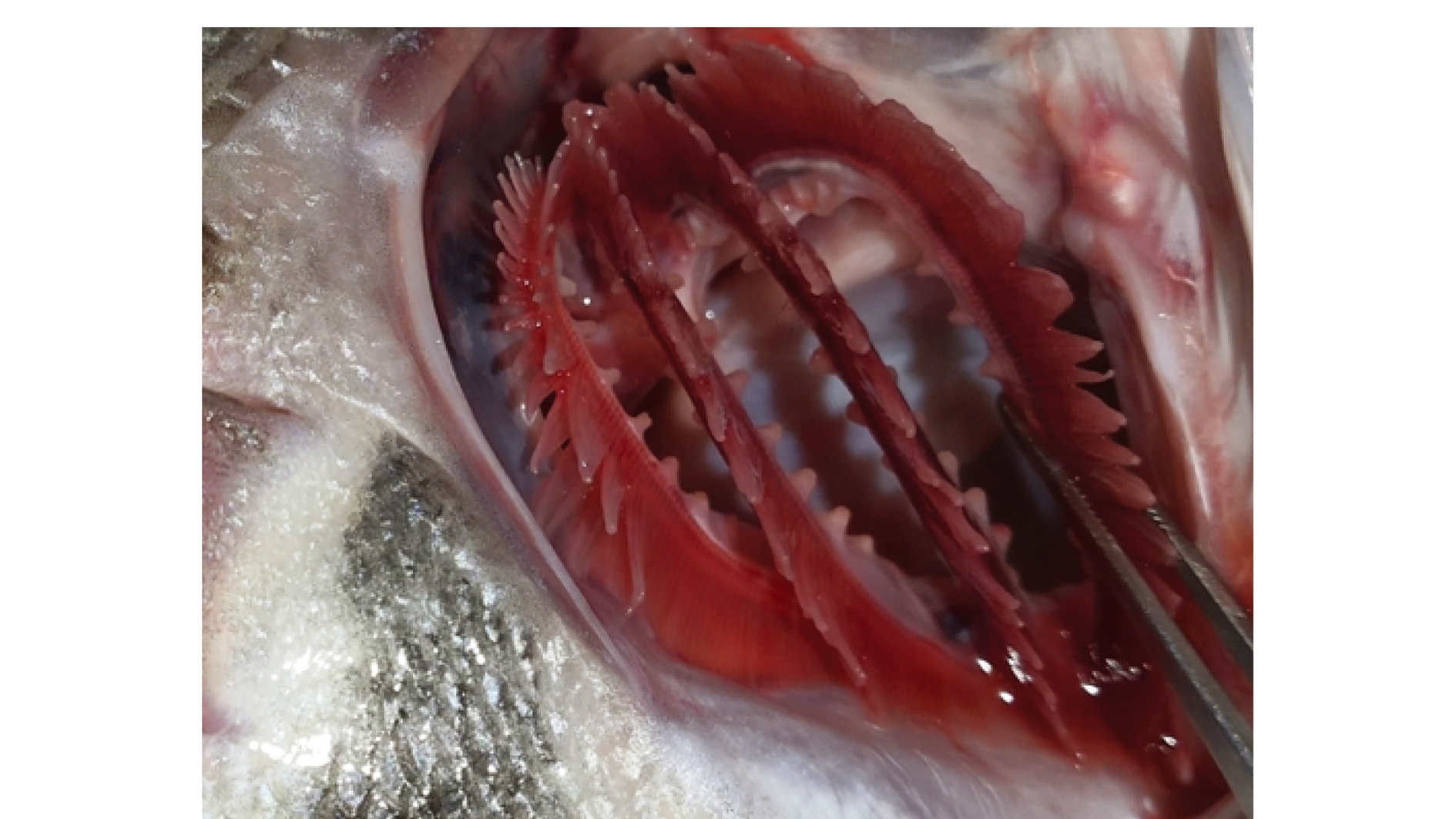
图3 小鳞拟松鲷右侧鳃弓
Fig.3 Right gill arch of Datnioides pulcher
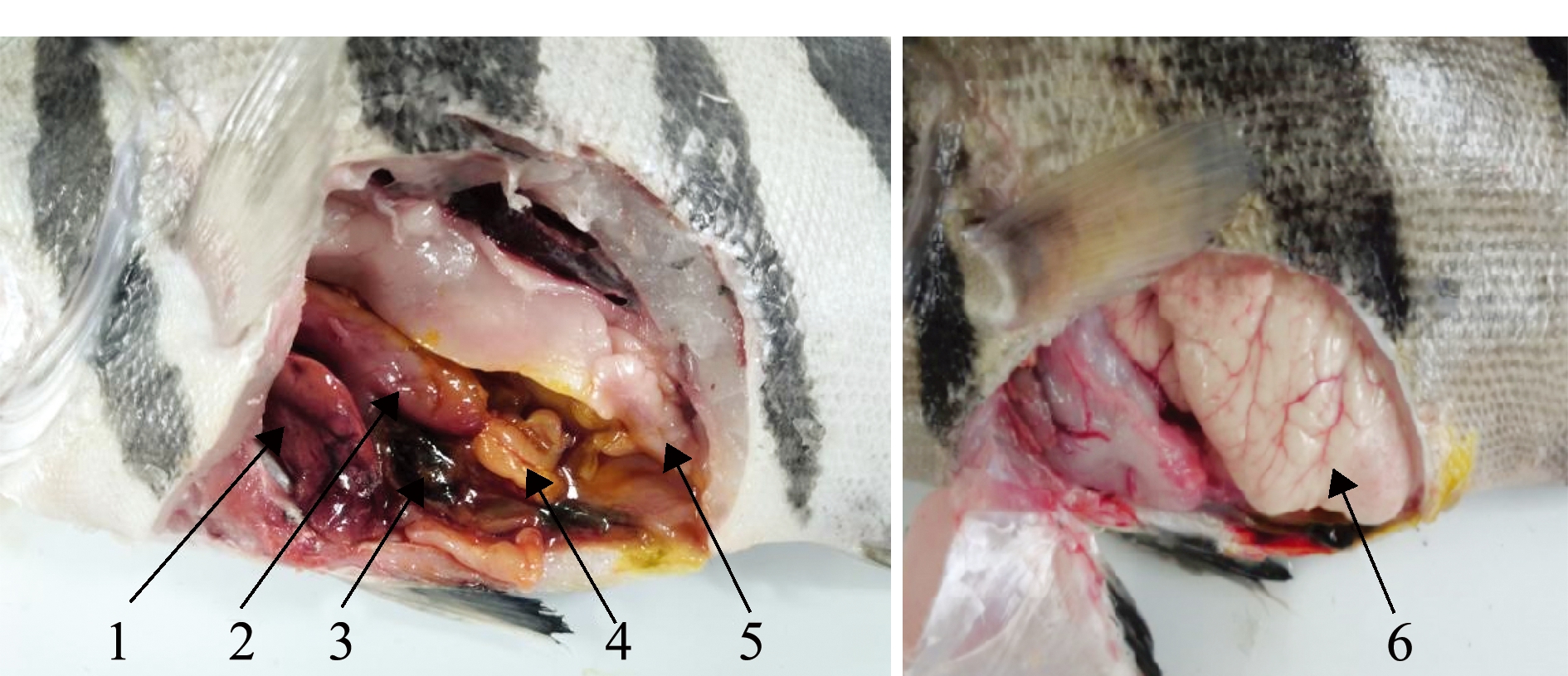
1—肝脏;2—胃;3—脾脏;4—肠;5—精巢;6—卵巢。
1—liver;2—stomach;3—spleen;4—intestine;5—testis;6—ovary.
图4 小鳞拟松鲷内部结构(左雄右雌)
Fig.4 Organs of Datnioides pulcher (left:male;right:female)
表1 小鳞拟松鲷形态可量性状比值(n=240)
Tab.1 Morphological measurable proportionate character values of Datnioides pulcher(n=240)
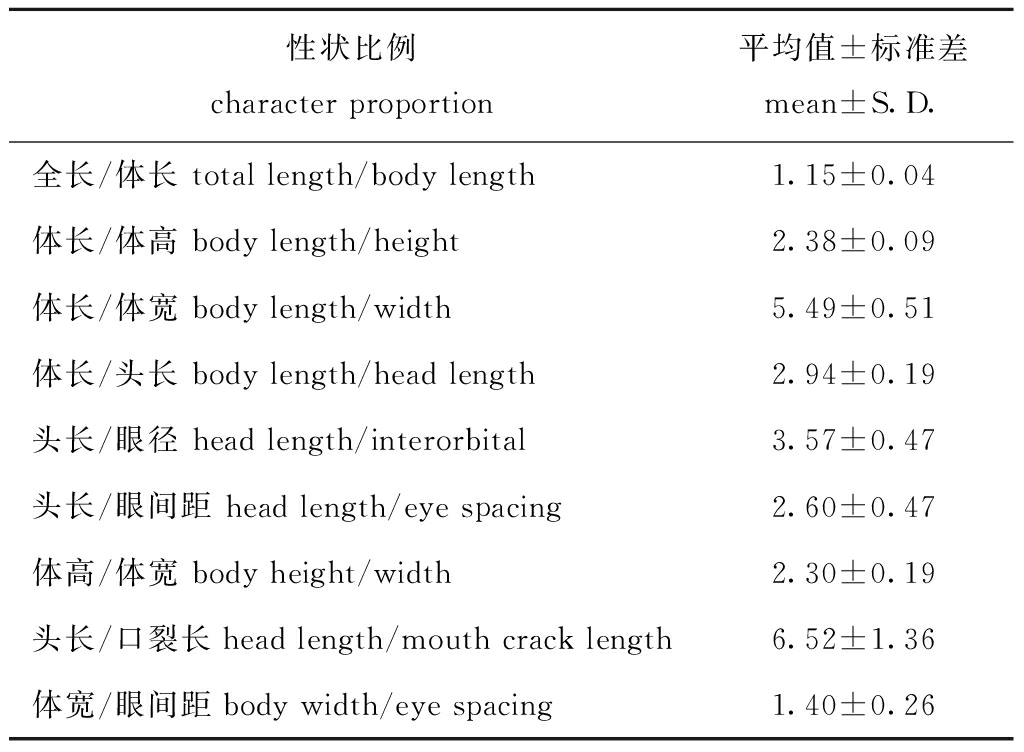
性状比例character proportion平均值±标准差mean±S.D.全长/体长 total length/body length1.15±0.04体长/体高 body length/height2.38±0.09体长/体宽 body length/width5.49±0.51体长/头长 body length/head length2.94±0.19头长/眼径 head length/interorbital3.57±0.47头长/眼间距 head length/eye spacing2.60±0.47体高/体宽 body height/width2.30±0.19头长/口裂长head length/mouth crack length6.52±1.36体宽/眼间距body width/eye spacing1.40±0.26
2.2.2 幼鱼全长、体质量与体长的相关性 小鳞拟松鲷幼鱼8个日龄时间点的数据见表2,其中,165日龄时瞬间生长率最大,生长最快。对表2的体长、全长和体质量数据进行统计分析,结果表明,全长与体长的关系式可用y=1.123x+0.141 2(R2=0.998 6)表示,而体质量与体长的关系符合幂函数关系式,其关系方程为y=0.025 3x3.025 1(R2=0.991 2),为异速生长(图5)。
表2 小鳞拟松鲷幼鱼生长性能
Tab.2 Growth of juvenile Datnioides pulcher

日龄/dage全长/cmtotallength 体长/cmbodylength体质量/gbodymass瞬时生长率/(%·d-1)instantaneous growth rate日均增量/g,cmdaily increment全长total length 体长body length体质量body mass体长body length肥满度/%condition factor1203.71±0.363.16±0.320.84±0.312.741353.95±0.413.40±0.331.04±0.361.420.420.0130.0162.651655.04±0.514.36±0.432.22±0.752.530.810.0390.0322.681825.47±0.534.73±0.452.74±0.921.240.480.0280.0222.591976.04±0.675.23±0.603.83±1.292.230.660.0360.0332.682126.48±0.775.67±0.885.19±2.302.030.470.0290.0292.852608.94±0.947.85±0.8613.54±4.641.960.670.1700.0422.802759.39±0.968.22±0.8315.71±5.100.990.330.1450.0252.83
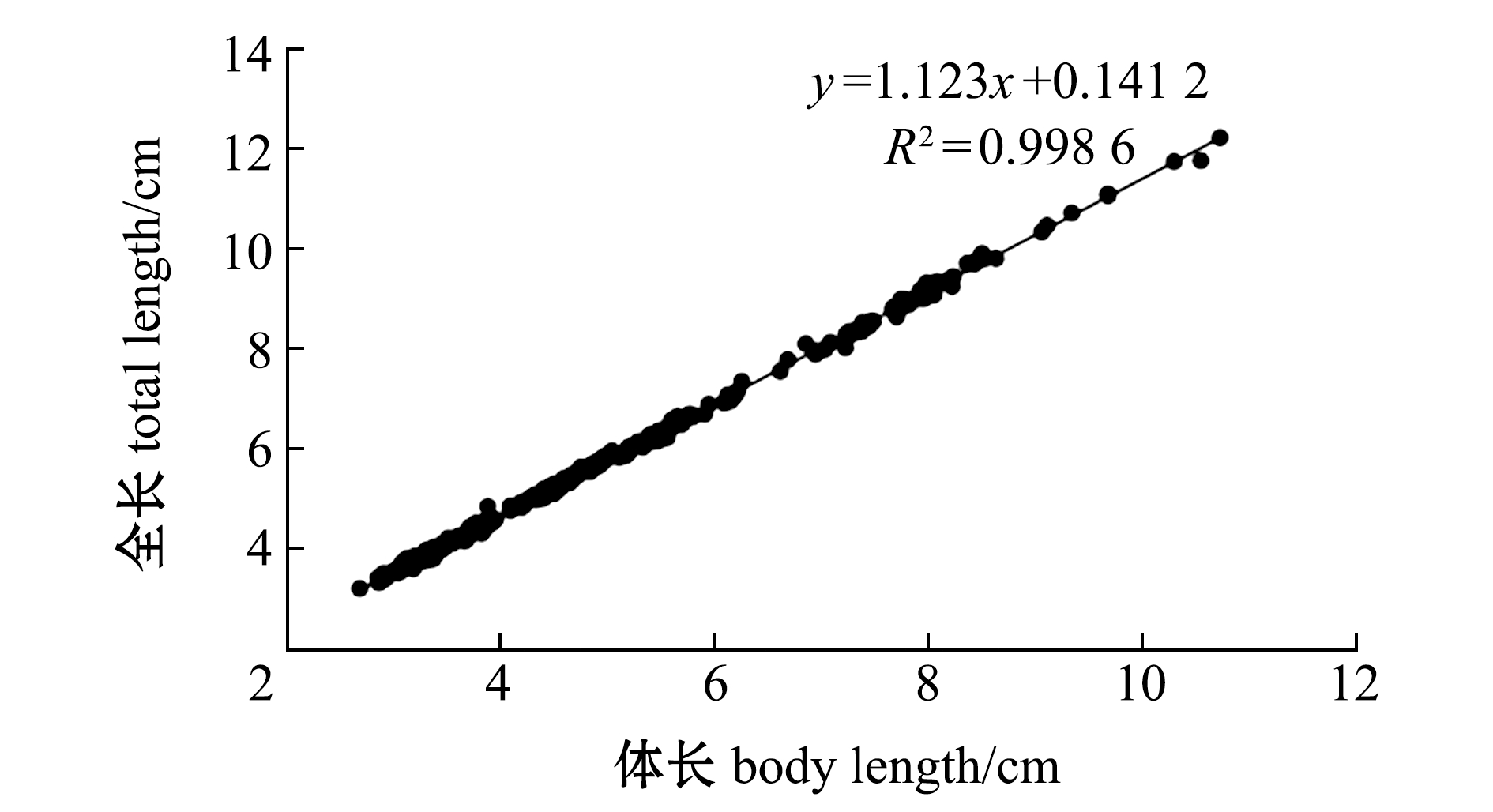
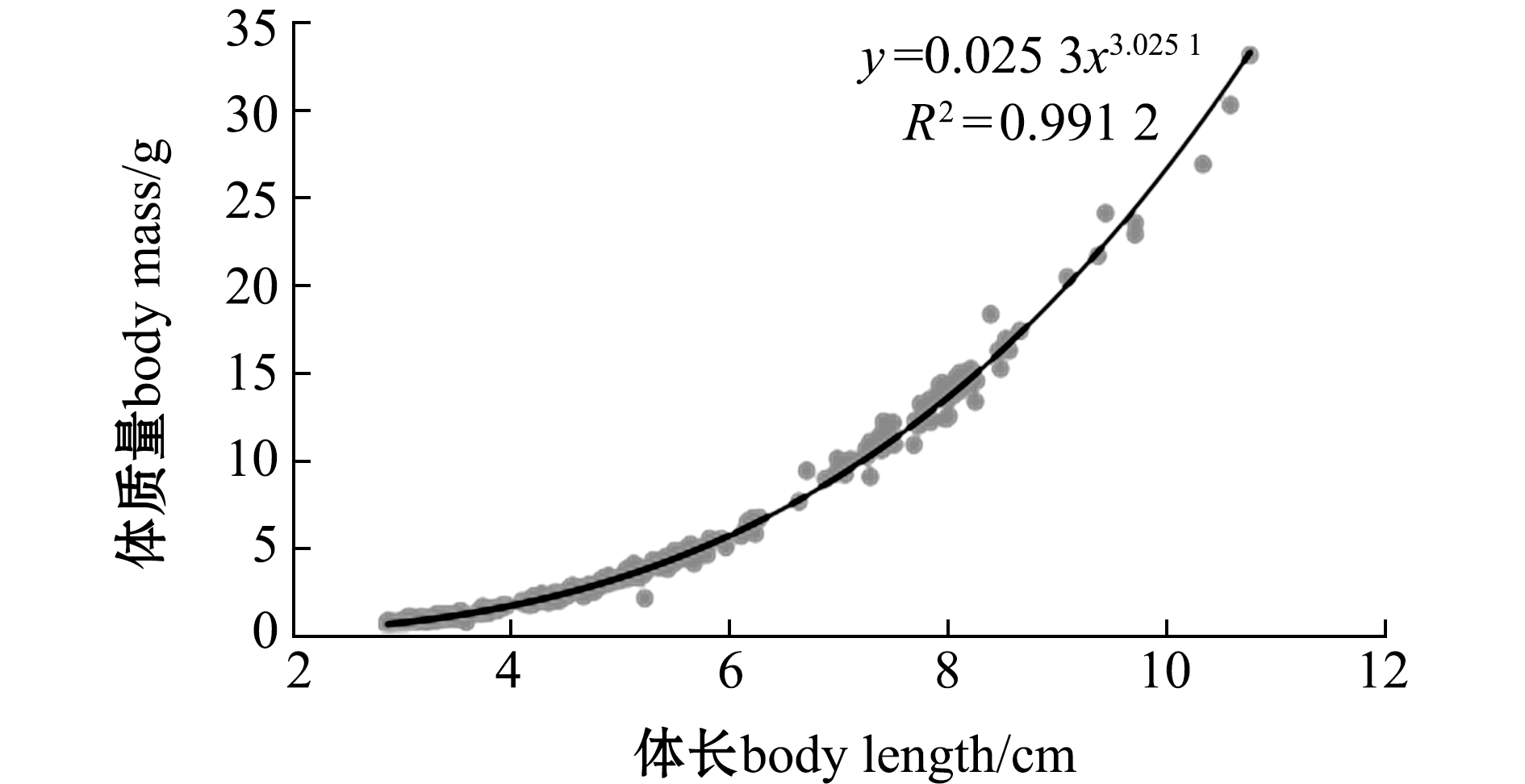
图5 全长、体质量与体长的关系曲线
Fig.5 Curve of total length and body mass versus body length
2.3 核型特征
2.3.1 染色体数目 从2个试验个体的染色体玻片中,选取115个小鳞拟松鲷中期分裂相良好的染色体进行统计分析,结果见表3。根据众数原理,确定小鳞拟松鲷的二倍体染色体数目为2n=48。
表3 小鳞拟松鲷染色体数目统计
Tab.3 Chromosome number statistics of Datnioides pulcher
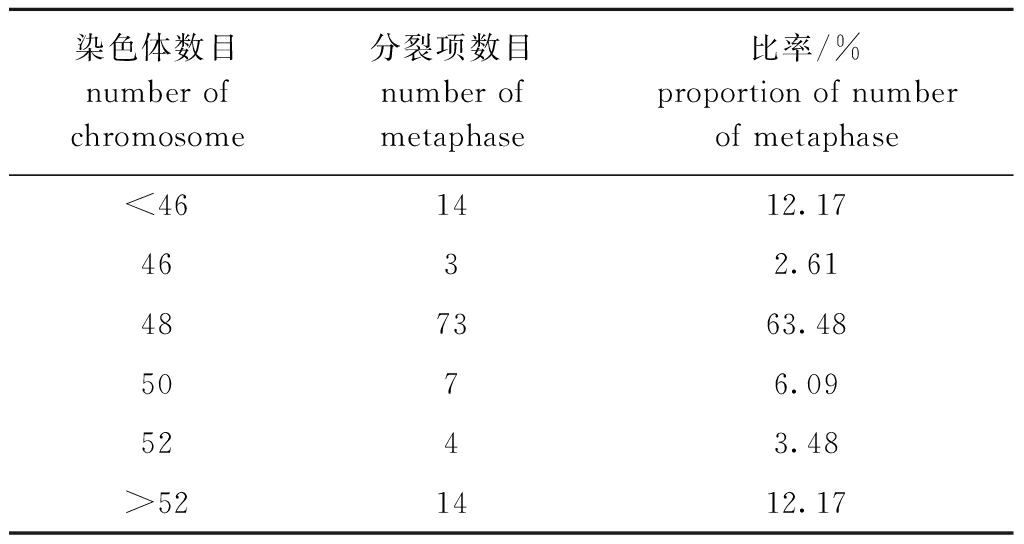
染色体数目number of chromosome分裂项数目number of metaphase比率/%proportion of number of metaphase<461412.174632.61487363.485076.095243.48>521412.17
注:染色体数中分裂项数目占观察数(115个)的比例。
Note:The ratio of the number of division phase in the number of chromosomes to the number of observations (115).
2.3.2 核型 小鳞拟松鲷染色体中期分裂相及配对结果见图6,根据染色体臂比将染色体分为2个中部着丝点染色体(m)、2个亚中部着丝点染色体(sm)、20个亚端部着丝点染色体(st)和24个端部着丝点染色体(t)。核型公式为2n=48=2m+2sm+20st+24t,臂数(NF)=52。
染色体臂比的统计结果如表4所示,其中染色体中无异型性染色体、次缢痕及随体等典型性特征。
小鳞拟松鲷、奥利亚罗非鱼[11]和淡水黑鲷[12]等鲈形目鱼类的核型公式及部分参数比较见表5,由核型公式可知,在染色体类别中小鳞拟松鲷的t型占比较大,m型占比较小。
3 讨论
3.1 小鳞拟松鲷形态特征
小鳞拟松鲷与中国本土分布的斑鳜Siniperca scherzeri[13]、鳜Siniperca chuatsi[14]等鱼类形态比较接近。将小鳞拟松鲷与斑鳜、鳜3种鱼类形态数据进行比较(表6),可以看出,小鳞拟松鲷与斑鳜、鳜鳍式接近,差别主要在于斑纹及体长与体高之比。斑鳜体被不规则小斑点,尾鳍存在空心斑[13],鳜体侧有狭长黑纹,不规则暗棕斑点及斑块[15],而小鳞拟松鲷体被黑色条纹,会出现空心纹。斑鳜体长与体高之比为3.4~4.0[13],小鳞拟松鲷为2.19~2.60,明显比斑鳜体形更短而高。鳜体长与体高之比为2.2~3.1[15],与小鳞拟松鲷体型上相似。这表明,拟松鲷科与鱼旨科在鲈形目中是亲缘关系比较接近的两个科。
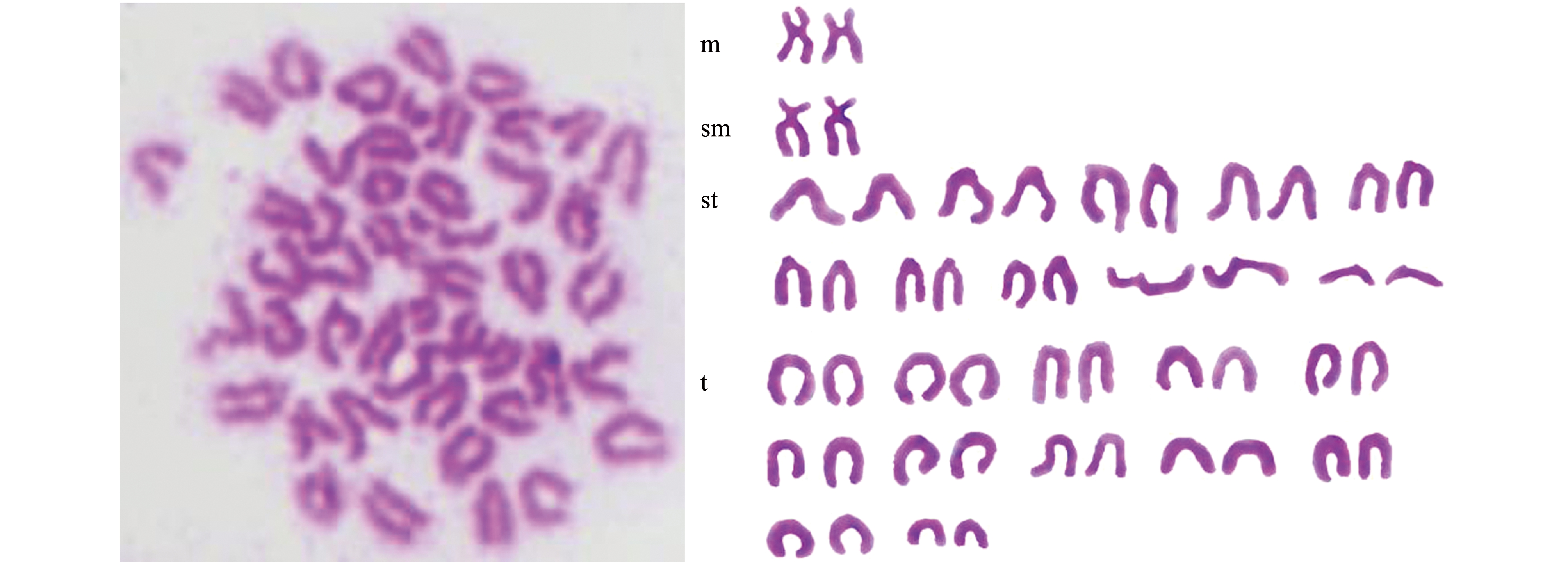
m—中部着丝粒;sm—亚中部着丝粒;st—亚端部着丝粒;t—端部着丝粒。
m—metacentrics;sm—submetacentrics;st—subtelocentrics;t—telocentrics.
图6 小鳞拟松鲷染色体核型
Fig.6 Karyotype of Datnioides pulcher
表4 染色体的相对长度和臂比值
Tab.4 Chromosome length and arm ratio
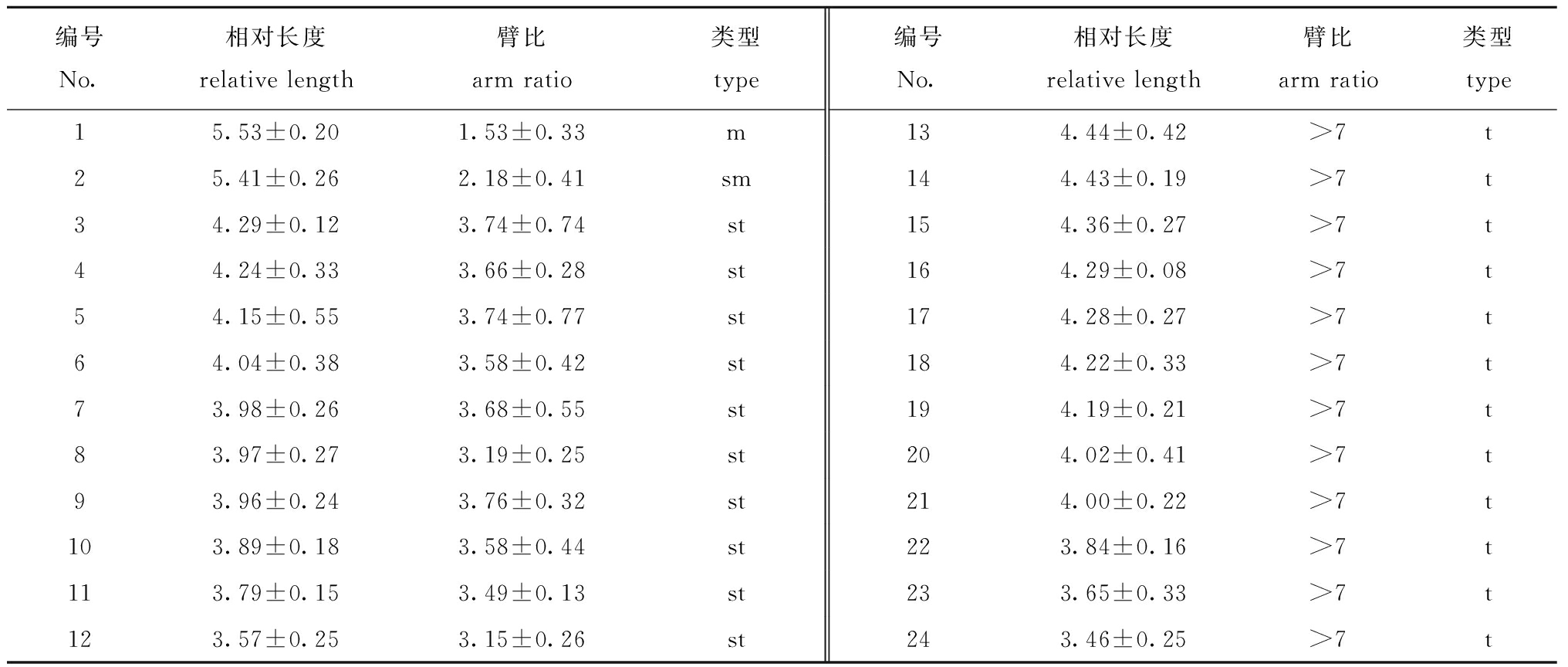
编号No.相对长度relative length臂比arm ratio类型type编号No.相对长度relative length臂比arm ratio类型type15.53±0.201.53±0.33m134.44±0.42>7t25.41±0.262.18±0.41sm144.43±0.19>7t34.29±0.123.74±0.74st154.36±0.27>7t44.24±0.333.66±0.28st164.29±0.08>7t54.15±0.553.74±0.77st174.28±0.27>7t64.04±0.383.58±0.42st184.22±0.33>7t73.98±0.263.68±0.55st194.19±0.21>7t83.97±0.273.19±0.25st204.02±0.41>7t93.96±0.243.76±0.32st214.00±0.22>7t103.89±0.183.58±0.44st223.84±0.16>7t113.79±0.153.49±0.13st233.65±0.33>7t123.57±0.253.15±0.26st243.46±0.25>7t
表5 小鳞拟松鲷、奥利亚罗非鱼与淡水黑鲷的核型公式及部分参数比较
Tab.5 Comparison of karyotypes and some parameters among Datnioides pulcher,Oreochromis aurea and Hephaestus fuliginosus

种类species核型公式karyotype染色体数(2n)chromosome number染色体臂数number of chromosome arm文献来源reference小鳞拟松鲷 Datnioides pulcher2m+2sm+20st+24t4852本文奥利亚罗非鱼 Oreochromis aurea6sm+24st+14t4450曹丽萍等[11]淡水黑鲷 Hephaestus fuliginosus4m+44t4652孟庆磊等[12]
3.2 小鳞拟松鲷生长特性
幼鱼体质量与体长的关系可反映鱼类的生长状态[16]。有研究表明,不同温度下哲罗鱼Hucho taimen幼鱼[17]、达氏鳇与西伯利亚鲟杂交幼鱼[18]及黄颡鱼Pelteobagrus fulvidraco幼鱼[19]等均呈现异速生长[20]。本研究中生长试验共进行了155 d,对试验数据分析表明,小鳞拟松鲷在幼鱼阶段的生长类型也为异速生长,试验鱼体质量生长速度快于体长的生长速度,鱼的体型趋向于短宽型。在实际养殖生产中,可依据体长与体质量幂函数关系式,对小鳞拟松鲷生长发育规律做出推测,并以此决定饵料投喂量,避免养殖成本的增加,以实现利益最大化。
表6 小鳞拟松鲷与斑鳜、鳜主要性状对比
Tab.6 Comparison of main characters of Datnioides pulcher with spotted mandarinfish Siniperca scherzeri and mandarinfish Siniperca chuatsi
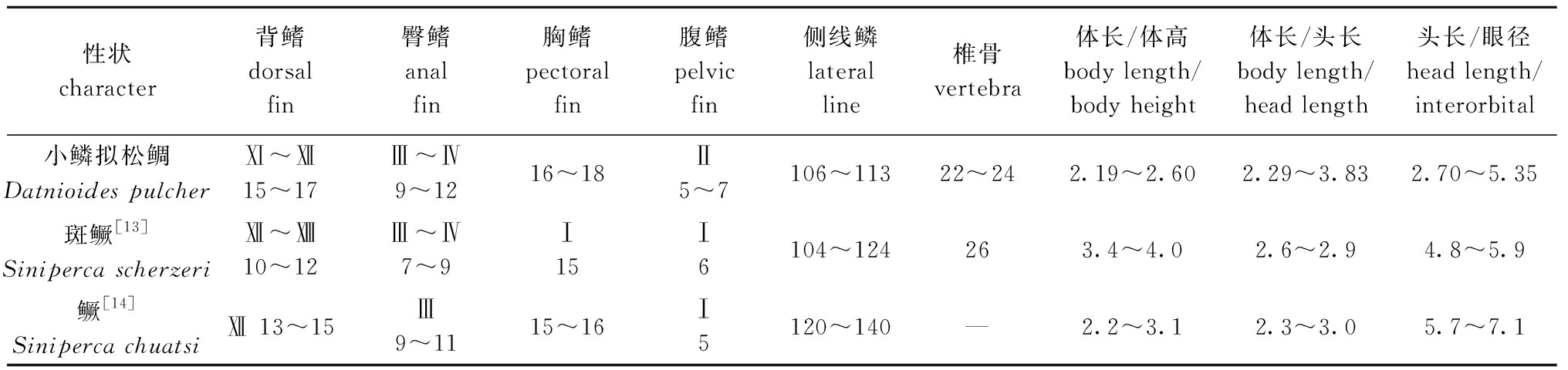
性状character背鳍dorsal fin臀鳍anal fin胸鳍pectoral fin腹鳍pelvic fin侧线鳞lateral line椎骨vertebra体长/体高body length/body height体长/头长body length/head length头长/眼径head length/interorbital小鳞拟松鲷Datnioides pulcherⅪ~Ⅻ15~17Ⅲ~Ⅳ9~1216~18Ⅱ5~7106~11322~242.19~2.602.29~3.832.70~5.35斑鳜[13]Siniperca scherzeriⅫ~10~12Ⅲ~Ⅳ7~9Ⅰ 15Ⅰ 6104~124263.4~4.02.6~2.94.8~5.9鳜[14]Siniperca chuatsiⅫ 13~15Ⅲ 9~1115~16Ⅰ 5120~140—2.2~3.12.3~3.05.7~7.1
3.3 小鳞拟松鲷核型分析
本研究中采用活体注射植物血凝素(PHA)法制备染色体。一般情况下,秋水仙素处理时间有2、5、4 h 3种[21-22],本试验中,小鳞拟松鲷染色体制备所需秋水仙素处理时间为2 h时,获得的染色体分裂相更为理想。不同种鱼类染色体制备需要的低渗时间不同,本研究中低渗时间为25 min效果最好,所获得的染色体分裂相最多。
鲈形目鱼类在鱼类系统发生系统中处于高位类,m和sm型染色体较少,而t和st型染色体较多[20]。对已做过核型分析的57种鲈形目研究发现[23],染色体数目为48的鱼类占57.9%,反映了多数鲈形目鱼类的染色体数目特征。本研究中,染色体数目多于48的,可能是多个染色体细胞破裂后染色体叠加导致,而染色体数目少于48,可能是细胞破裂时染色体散失导致的,因此,染色体数目会存在随机性差异。研究表明,同种鱼类其性别也会影响核型公式。而本研究中用于染色体分析的2个试验个体均为雄性,故并未观察到有性别影响核型公式的现象[24]。
染色体是遗传物质的载体,每个物种都具有独特的染色体,鱼类的染色体核型类型与其进化程度存在一定的关系[25]。进化上越是处于上位,其染色体臂越收敛,端着丝点染色体多,染色体臂数越少,并以此将真骨鱼类划分为低位类、中位类和高位类3个演化群体。由小鳞拟松鲷的核型公式可知,t和st型染色体较多,在演化上属于高位类。胡国宏等[22]认为,具有较多t型染色体的物种较为原始,具有较多m和sm型染色体的物种是特化种类,即染色体臂数较多的种类为进化类型。小鳞拟松鲷存在较多的t型染色体,因此,在进化中属于较为原始的物种。
4 结论
1)本研究中首次对小鳞拟松鲷内部各器官、内外部形态特征进行了具体描述。
2)小鳞拟松鲷在幼鱼阶段的生长类型为异速生长,全长与体长呈线性关系,体质量与体长呈幂函数关系。
3)小鳞拟松鲷核型公式为2n=48=2m+2sm+20st+24t,NF=52,核型符合高位类鱼类形态特征,染色体中无异型性染色体、次缢痕及随体等典型性特征。
[1] WANG L,CHEN Z Z,GAO J Z,et al.The complete mitochondrial genome of Mekong tiger fish Datnioides undecimradiatus (Roberts & Kottelat,1994)[J].Mitochondrial DNA Part B,2016,1(1):367-368.
[2] WANG L,CHEN Z Z,GAO J Z,et al.The complete mitochondrial genome of Indonesian tiger fish Datnioides microlepis (Bleeker 1854)[J].Mitochondrial DNA Part B,2016,1(1):328-329.
[3] 屈政委,宋红梅,汪学杰,等.印尼虎鱼RAD-seq数据中微卫星标记的初步筛选及特征分析[J].淡水渔业,2019,49(4):9-15.
[4] 汪学杰,牟希东,胡隐昌,等.布氏鲷形态特征和染色体核型的研究[J].大连水产学院学报,2010,25(2):187-190.
[5] 李文龙,韩英,石振广,等.达氏鳇稚幼鱼生长特性的研究[J].大连海洋大学学报,2012,27(2):125-128.
[6] 黄小林,杨育凯,李涛,等.黄斑篮子鱼仔、稚、幼鱼形态观察与生长研究[J].南方水产科学,2018,14(5):88-94.
[7] 孟庆闻,缪学祖,俞泰吉,等.鱼类学[形态·分类][M].上海:上海科学技术出版社,1989:173-177.
[8] 朱新平,邹国民,胡红,等.何氏细鲃鱼染色体组型[J].遗传,1990,12(3):20-21.
[9] LEVAN A,FREDGA K,SANDBERG A A.Nomenclature for centromeric position on chromosomes[J].Hereditas,1964,52(2):201-220.
[10] 乔永刚,宋芸.利用EXCLE制作核型模式图[J].农业网络信息,2006(10):97-98.
[11] 曹丽萍,丁炜东,贾永义,等.奥利亚罗非鱼(♀)×鳜(♂)杂交后代及其双亲的染色体核型分析[J].农业生物技术学报,2006,14(2):187-190
[12] 孟庆磊,安丽,王成武,等.淡水黑鲷染色体核型分析[J].淡水渔业,2010,40(3):76-79.
[13] 骆小年,梁旭方,周怡,等.斑鳜养殖生物学研究进展[J].水产科学,2014,33(1):56-62.
[14] 李明峰.鳜鱼生物学研究进展[J].现代渔业信息,2010,25(7):16-21.
[15] 沈文新.鳜鱼的生物学特征及鳜鱼苗的人工繁殖技术[J].上海农业科技,2018(4):70-71.
[16] 华元渝,胡传林.鱼种质量与长度相关公式(W=aLb)的生物学意义及其应用[M]//中国鱼类学会.鱼类学论文集.北京:科学技术出版社,1981:125-131.
[17] 赵晓临,徐浩然,孙玉芝,等.哲罗鱼稚、幼鱼在不同温度下的生长特性[J].水产学杂志,2018,31(5):1-5.
[18] 刘建魁,李文龙,石振广,等.达氏鳇(♀)×西伯利亚鲟(♂)杂交幼鱼生长特性初步研究[J].淡水渔业,2008,38(6):63-67.
[19] 宋学宏,陈祖培,王志林,等.黄颡鱼当年幼鱼的生长特性[J].水利渔业,2003,23(4):3-5.
[20] KAN M K I,KHATUN M J,KIBRIA A K M G.Study the quality of eggs of different genotypes of chickens under semi-scavenging system at bangladesh[J].Pakistan Journal of Biological Science,2004,12(7):2163-2166.
[21] 梁述章,宋炜,蒋科技,等.棘头梅童鱼染色体核型分析[J].渔业科学进展,2019,40(4):172-177.
[22] 胡国宏,孙广华,张雅斌,等.怀头鲇的核型分析[J].大连水产学院学报,2005,20(4):318-321.
[23] 楼允东.鱼类育种学[M].北京:中国农业出版社,1999:335-337.
[24] ZHANG S K,ZHENG J,ZHANG J,et al.Cytogenetic characterization and description of an X1X1X2X2/X1X2Y sex chromosome system in Collichthys lucidus (Richardson,1844)[J].Acta Oceanologica Sinica,2018,37(4):34-39.
[25] 小岛吉雄.鱼类细胞遗传学[M].林义浩,译.广州:广东科学技术出版社,1990:8-33.