变温动物无法使身体的温度保持恒定,其体温只能随环境的变化而变化。鱼类作为典型的变温动物,其行为和体内生理变化都在一定范围内受到水温变化的影响,因此,水温对鱼类的生存具有重要的影响。当水温急剧降低,会使鱼类产生冷应激。然而即使在同一低温胁迫下,不同的鱼类对于冷胁迫耐受却存在较大的差别,而造成这种低温耐受差异的分子机制还有待进一步研究。
模式动物斑马鱼Danio rerio是一种广温性的鱼类,其体型较小,性成熟周期短,能够忍受水温季节性较广的温度波动[1-2]。有试验表明,斑马鱼在一定时间内能够忍受9 ℃的低温[1],与斑马鱼相比,罗非鱼Oreochromis niloticus忍受低温的能力则较弱。同样的降温策略下比较罗非鱼和斑马鱼的耐寒性发现,经历8 ℃、12 h的低温后罗非鱼出现了死亡的现象,但是斑马鱼只是出现了身体失去平衡的现象,并没有死亡,这表明在这种降温策略下斑马鱼比罗非鱼的耐寒能力更强[3]。研究者通过对两种鱼类死亡前各时间点各组织的凋亡信号检测,发现罗非鱼的鳃组织在8 ℃、6 h时出现大量的凋亡信号,但是斑马鱼鳃中却几乎没有凋亡信号,并且这种凋亡信号只在鳃组织中比较明显,在其他组织几乎检测不到[3]。除此之外,一些鱼类的鳃组织在应对低温刺激时表现出很强的形态可塑性[4-6],并且有许多关于鱼类鳃组织响应低温刺激的转录表达谱分析[7-8],这些均表明鳃组织细胞凋亡可能是鱼类耐受低温的薄弱环节。
细胞凋亡(apoptosis)是一种机体在一定程度的压力条件下为了避免受到压力的损伤而采取的一种积极主动的适应性措施[9]。在细胞凋亡早期,可以通过对受到压力导致的不能恢复的细胞进行清除以达到保护组织免受压力损伤的目的,但是当细胞凋亡积累到一定程度时也会使组织受到不可恢复的损伤甚至最终导致机体死亡。肿瘤抑制因子P53是一种能够促凋亡的转录因子,同时也能抑制抗凋亡基因的转录,所以在凋亡发生中其起到重要作用[10]。但是过量的P53对细胞来说是有毒的,因此,细胞会形成一种负反馈机制监测P53发挥作用[11-12]。在这个负反馈调控中MDM2(murine double minutes 2)是一个主要的调控子[13],其N末端结构域和P53的N末端结构域特异性结合,一方面遮住了P53的N末端转录结构域直接阻止其转录活性[14],另一方面启动P53泛素化导致其被蛋白酶体系统降解[15]。除此之外,MDM2包含核输出信号,可以通过直接的相互作用诱导P53核输出,从而抑制细胞凋亡[16-17]。由于MDM2既能受到P53的诱导也反过来能抑制P53的功能[12],因此,这种调控呈现出一种反馈回路的调控模式。此外,MDM2-P53反馈回路会受到核糖体生物发生过程的调控[18],如核糖体蛋白(ribosomal proteins,RPs)RPL11与MDM2结合抑制其泛素化连接酶的活性,从而激活P53[18-19]。
由于斑马鱼和罗非鱼在同样的低温处理下,其鳃组织凋亡的信号出现的时间差异很大[3],那么这种差异是否与RPL11/MDM2/P53通路有关,为了研究这个问题,本试验中将罗非鱼和斑马鱼暴露在同一梯度低温下,观察罗非鱼、斑马鱼在低温下呈现出不同的运动能力和反应情况,通过Western blot和实时荧光定量PCR(Quantitative real time polymerase chain reaction,RT-qPCR)技术检测RPL11/MDM2/P53通路中相关蛋白和基因表达量的变化,分析这些信号通路在不同低温耐受能力的鱼中呈现出的表达模式,旨在为不同鱼类低温耐受能力机制研究提供参考。
1 材料与方法
1.1 材料
野生型罗非鱼亲鱼取自青岛罗非鱼良种场,野生型斑马鱼亲鱼取自中科院生物化学与细胞生物学研究所,均在水产种质资源发掘与利用教育部重点实验室恒温鱼房内人工繁殖和饲养。试验用罗非鱼和斑马鱼发育到4个月时分别按雌雄比为1∶1的比例筛选试验用鱼,然后统一在28 ℃下条件下暂养2个月,最后取6月龄的鱼用于试验研究。
1.2 方法
1.2.1 低温处理方法和样品采集 按照Hu等[3]的降温策略,待水温降到8 ℃后,分别于0、3、6、9 h取斑马鱼和罗非鱼的鳃组织存放于液氮中,用于组织蛋白提取和RNA样品制备。然后取28 ℃下养殖的斑马鱼和罗非鱼鳃组织作为对照样品。在每个取样时间点分别取3尾罗非鱼和18尾斑马鱼,其中每3尾斑马鱼的鳃组织混合作为一个样品提取蛋白,每个样品设3个重复,另取9尾斑马鱼每3尾鱼的鳃组织单独作为一个样品用来提取RNA。
1.2.2 鳃组织蛋白提取和RNA样品收集 将斑马鱼鳃组织从液氮中取出,放置于冰上的锡箔纸上,待其将要融化时放到洁净的提前加入RIPA裂解液(购自Sigma,使用前加入PMSF)的玻璃匀浆器中,于冰上轻轻匀速研磨组织直到组织裂解,然后将裂解液移至离心管中,放置于冰上继续裂解。
罗非鱼鳃组织取出后置于提前加入液氮的研钵中研磨至粉末状,用药匙将粉末分别转移到提前加入RIPA裂解液和TRIZOL reagent(购自Thermo Fisher Scientific公司)的离心管中,放置于冰上继续裂解15 min,直至组织完全裂解。待组织样品充分裂解后,将其在4 ℃、12 000 r/min的条件下离心20 min,将上清液转移到新的离心管中。对获得的上清液蛋白进行BCA法蛋白浓度测定(试剂盒购自Thermo Fisher Scientific公司),根据测得浓度添加裂解液至所有样品保持在同一浓度水平。然后根据获得的蛋白体积按比例加入4×Protein SDS PAGE loading(购自TaKaRa),混匀后于95~100 ℃水中煮15 min,保存于-20 ℃冰箱中用于后续Western blot试验。
1.2.3 蛋白Western blot试验 按照常规方法配制12%(体积分数)SDS-PAGE 蛋白凝胶。将蛋白样品加入蛋白胶孔中,给予合适的电压使蛋白在凝胶上面分离,然后将蛋白转移到PVDF膜上,用50 g/L脱脂牛奶封闭2 h,吸出封闭牛奶,直接加入20 g/L脱脂牛奶稀释过的一抗(anti-β-actin抗体购自杭州华安生物有限公司,anti-P53抗体和anti-RPL11抗体购自Abcam公司)于4 ℃孵育过夜或者室温孵育2 h,然后吸出一抗,加入1×TBST漂洗液(购自生工生物工程(上海)股份有限公司)洗涤3次,每次5 min。再加入二抗于室温孵育2 h,回收二抗后加入1×TBST漂洗液洗涤3次,每次5 min。在洗好的膜中尽快加入ECL显影液(购自Thermo Fisher Scientific公司)曝光拍照。
1.2.4 RNA提取和定量PCR试验 将斑马鱼鳃组织从液氮中取出置于冰上面的锡箔纸上,待其将要融化时放到洁净的提前加入TRIZOL reagent的玻璃匀浆器中,于冰上轻轻匀速研磨组织直到组织裂解,然后将裂解液移至离心管中,放置于冰上继续裂解,直至组织完全裂解;待组织样品充分裂解后,严格按照TRIZOL reagent的操作说明提取样品中RNA,最后加入40 μL DEPC水(购自生工生物工程(上海)股份有限公司)溶解RNA;对得到的RNA样品进行浓度测定并置于超低温冰箱(-80 ℃)中冻存。对提取的RNA样品进行去基因组的反转录试验(去DNA反转录试剂盒购自TaKaRa公司)得到cDNAs。用在线IDT软件设计qPCR引物,引物序列见表1和表2。用SYBR Green法对目的基因及内参基因表达量进行检测。
表1 用于定量PCR的罗非鱼引物
Tab.1 Primers for tilapia qPCR
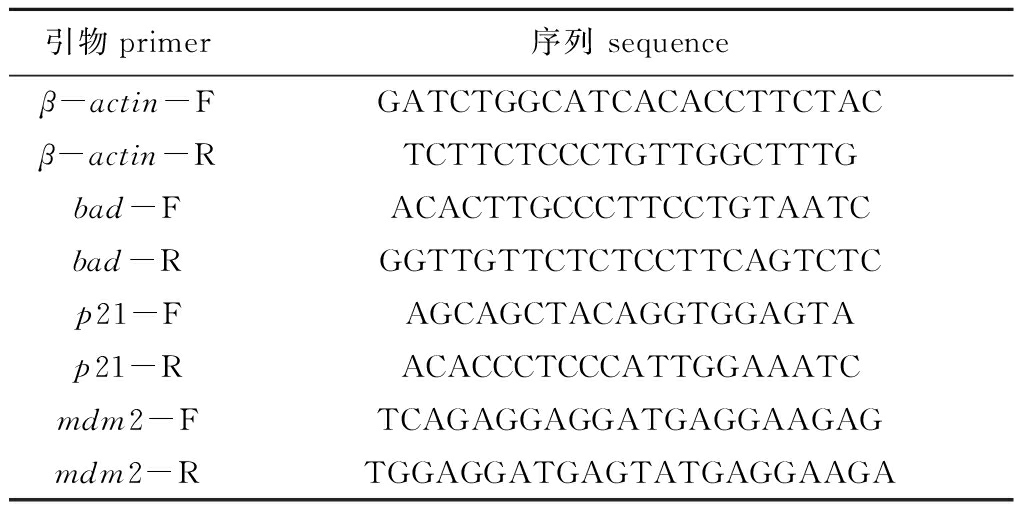
引物primer序列 sequenceβ-actin-FGATCTGGCATCACACCTTCTACβ-actin-RTCTTCTCCCTGTTGGCTTTGbad-FACACTTGCCCTTCCTGTAATCbad-RGGTTGTTCTCTCCTTCAGTCTCp21-FAGCAGCTACAGGTGGAGTAp21-RACACCCTCCCATTGGAAATCmdm2-FTCAGAGGAGGATGAGGAAGAGmdm2-RTGGAGGATGAGTATGAGGAAGA
表2 用于定量PCR的斑马鱼引物
Tab.2 Primers for zebrafish qPCR
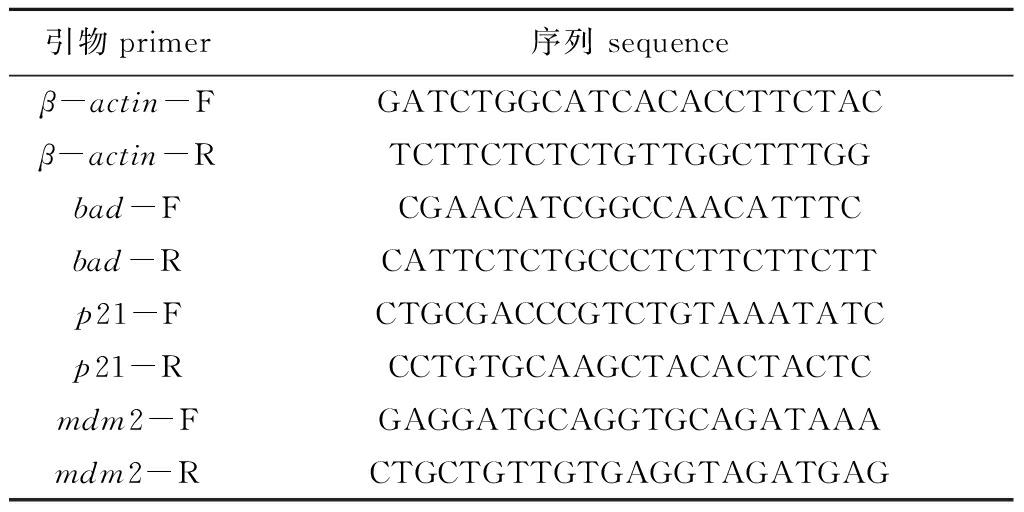
引物primer序列 sequenceβ-actin-FGATCTGGCATCACACCTTCTACβ-actin-RTCTTCTCTCTGTTGGCTTTGGbad-FCGAACATCGGCCAACATTTCbad-RCATTCTCTGCCCTCTTCTTCTTp21-FCTGCGACCCGTCTGTAAATATCp21-RCCTGTGCAAGCTACACTACTCmdm2-FGAGGATGCAGGTGCAGATAAAmdm2-RCTGCTGTTGTGAGGTAGATGAG
1.3 数据处理
利用Image J软件对Western blot试验结果进行定量分析。试验结果以平均值±标准差(mean ± S.D.)表示。用t检验对低温各组与常温下蛋白或基因表达进行差异显著性分析。用SPSS 20软件进行单因素方差分析(One-way ANOVA),用Turkey’s法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 罗非鱼和斑马鱼对低温胁迫的耐受差异
使用Hu等[3]的降温步骤,将养殖鱼类的水温从28 ℃匀速降到18 ℃,这个过程耗时12 h;在18 ℃停留12 h后,继续匀速降到8 ℃,这个降温过程耗时12 h;然后在8 ℃低温下再经历9 h。在整个降温过程中会停止投喂食物以免因水质破坏导致多重不可控制的应激发生。刚开始降温时,在水温到达8 ℃之前两种鱼都能保持身体平衡,但是运动能力出现不同程度的减弱,鳃的张合频率稍稍变快。待水温刚降到8 ℃后斑马鱼还能继续保持身体的平衡,但是不喜运动,而罗非鱼则慢慢出现失去平衡的状态,直至到达6 h以后,斑马鱼逐渐开始出现失去平衡的现象。9 h后罗非鱼的鳃不再张合,但是解剖发现其心脏还在跳动,故判断此时罗非鱼并没有死亡;但是斑马鱼在9 h后鳃还能张合。以上的现象均说明,在缓慢降温的策略下斑马鱼比罗非鱼更耐低温。
2.2 低温对罗非鱼和斑马鱼RPL11/MDM2/P53通路的影响
2.2.1 低温对RPL11和P53蛋白表达水平的影响低温下,两种鱼的RPL11和P53蛋白表达量见图1。
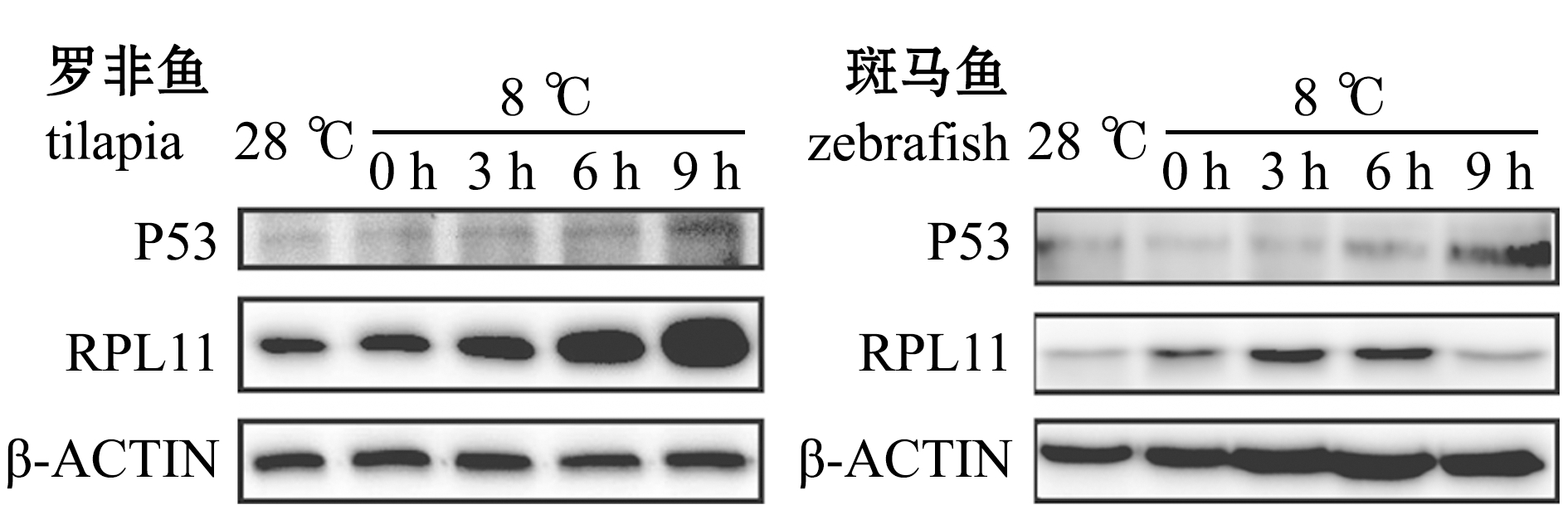
图1 各个温度和时间点P53和β-ACTIN的Western blot结果
Fig.1 Western blot of P53 and β-ACTIN at different temperature and time
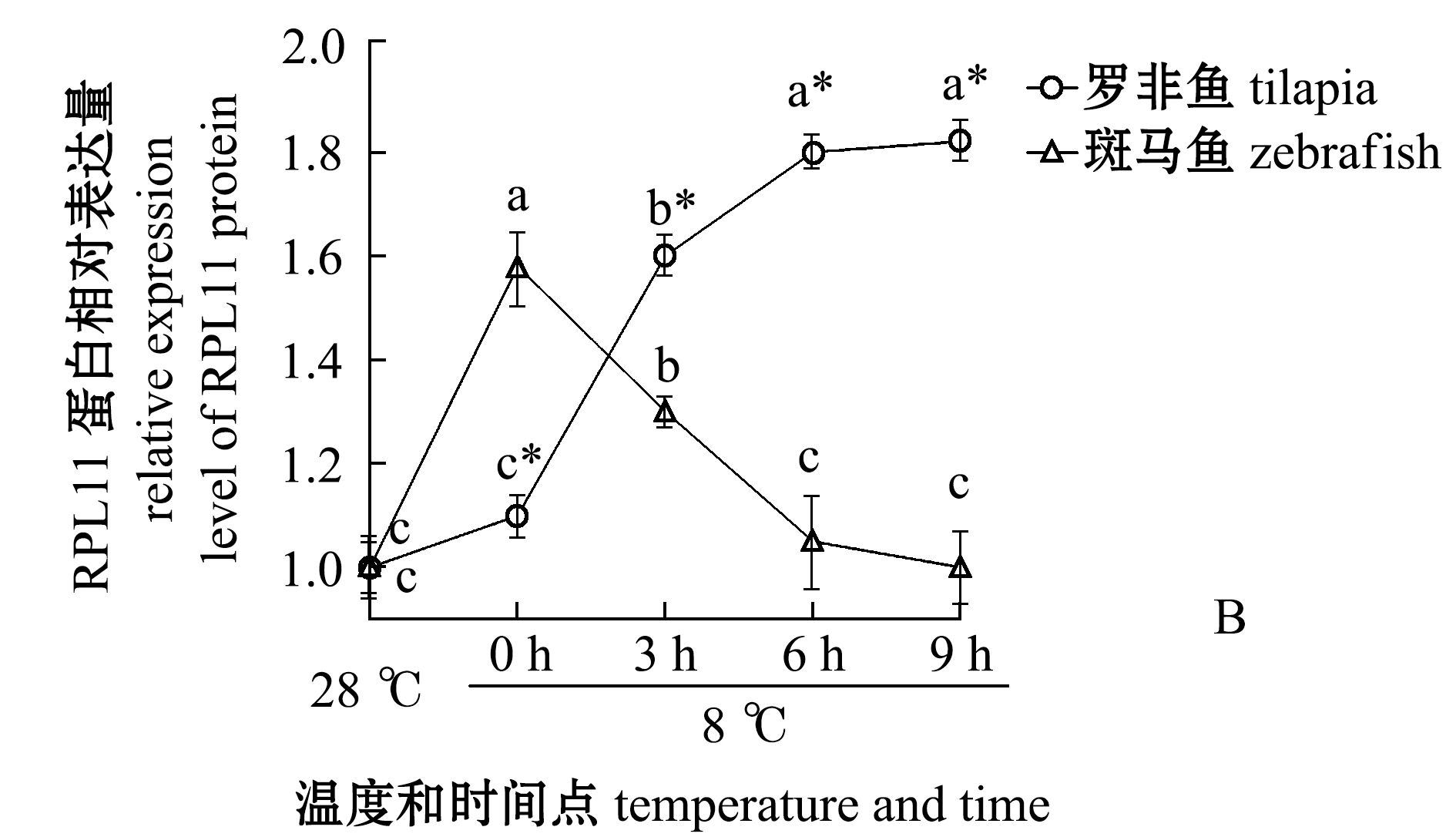
从图2可见:罗非鱼的P53和RPL11蛋白表达量随着低温处理时间的延长呈现升高的趋势,特别是在0 h和3 h均出现了非常明显的表达量增加,6 h后RPL11表达量趋于稳定,但是P53表达量持续累积,这可能是低温压力激活核糖体的压力响应程序,诱导RPL11蛋白表达量升高,RPL11与MDM2结合抑制其泛素化连接酶的活性,导致P53累积引起凋亡;斑马鱼P53表达量在0 h和3 h几乎没有变化,直至6 h才出现明显的升高,这与罗非鱼鳃组织出现凋亡信号早于斑马鱼的现象[3]是一致的,但是RPL11表达量在0 h后表现出显著下降趋势,这与罗非鱼中0 h后RPL11表达量显著升高的现象相反。
这表明,在罗非鱼体内核糖体生物发生进程可能是对低温压力进行响应,通过抑制P53被泛素化达到快速积累P53的目的,大量积累的P53诱导鳃组织的凋亡。与罗非鱼相比较,斑马鱼P53表达量升高的时间点明显更晚,并且此过程中也没有伴随着RPL11的表达量升高。
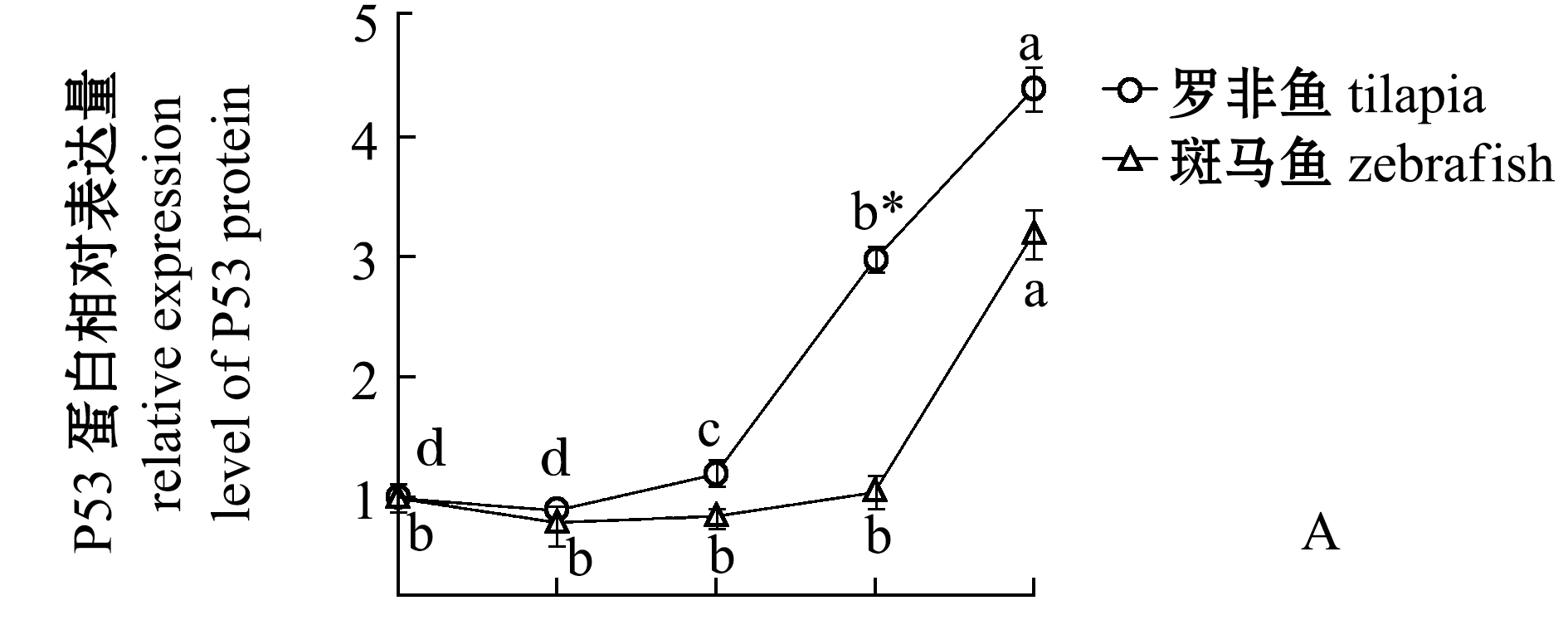
*表示同一时间下两个基因组间有显著性差异(P<0.05);标有不同字母者表示同一基因不同时间下有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note: *means significant difference within two gene groups at same time (P<0.05);The means with different letters within the same gene are significantly different in the different time at the 0.05 probability level, and the means with the same letter within the same gene are not significant differences, et sequentia.
图2 在罗非鱼和斑马鱼中各个温度和时间点P53和RPL11蛋白水平的定量分析
Fig.2 Quantitative analysis of P53 and RPL11 in tilapia and zebrafish at different temperature and time
2.2.2 低温对罗非鱼和斑马鱼RPL11/MDM2/P53通路中mdm2 mRNA表达水平的影响 为了确定P53表达量升高是由于MDM2-P53这条信号通路所起的作用,对mdm2转录水平表达量进行分析。从图3可见:在罗非鱼中,8 ℃、6 h 前mdm2表达量变化不大,并且处于低表达水平,此时有利于P53蛋白表达量的积累,6 h后mdm2表达量显著升高(P<0.05),这可能是由于RPL11的表达量趋于稳定,并且P53大量积累诱导mdm2表达量升高导致的;在斑马鱼中,8 ℃、0 h mdm2表达量出现升高的变化,这不利于P53的积累,直到 8 ℃、6 h后mdm2表达量开始下降,P53开始大量积累。
2.3 低温对罗非鱼和斑马鱼RPL11/MDM2/P53通路中P53下游靶基因表达量的影响
为了研究P53凋亡活性的分子机制,对罗非鱼和斑马鱼各个时间点的鳃组织中P53下游靶基因bad和p21在mRNA水平上的表达变化进行分析。bad属于Bcl2家族的基因[20],具有促进细胞凋亡的作用。从图4可见,罗非鱼在6 h后bad和p21两个基因都表现出明显的转录上调,这暗示低温下这两个基因可能被激活的P53上调。
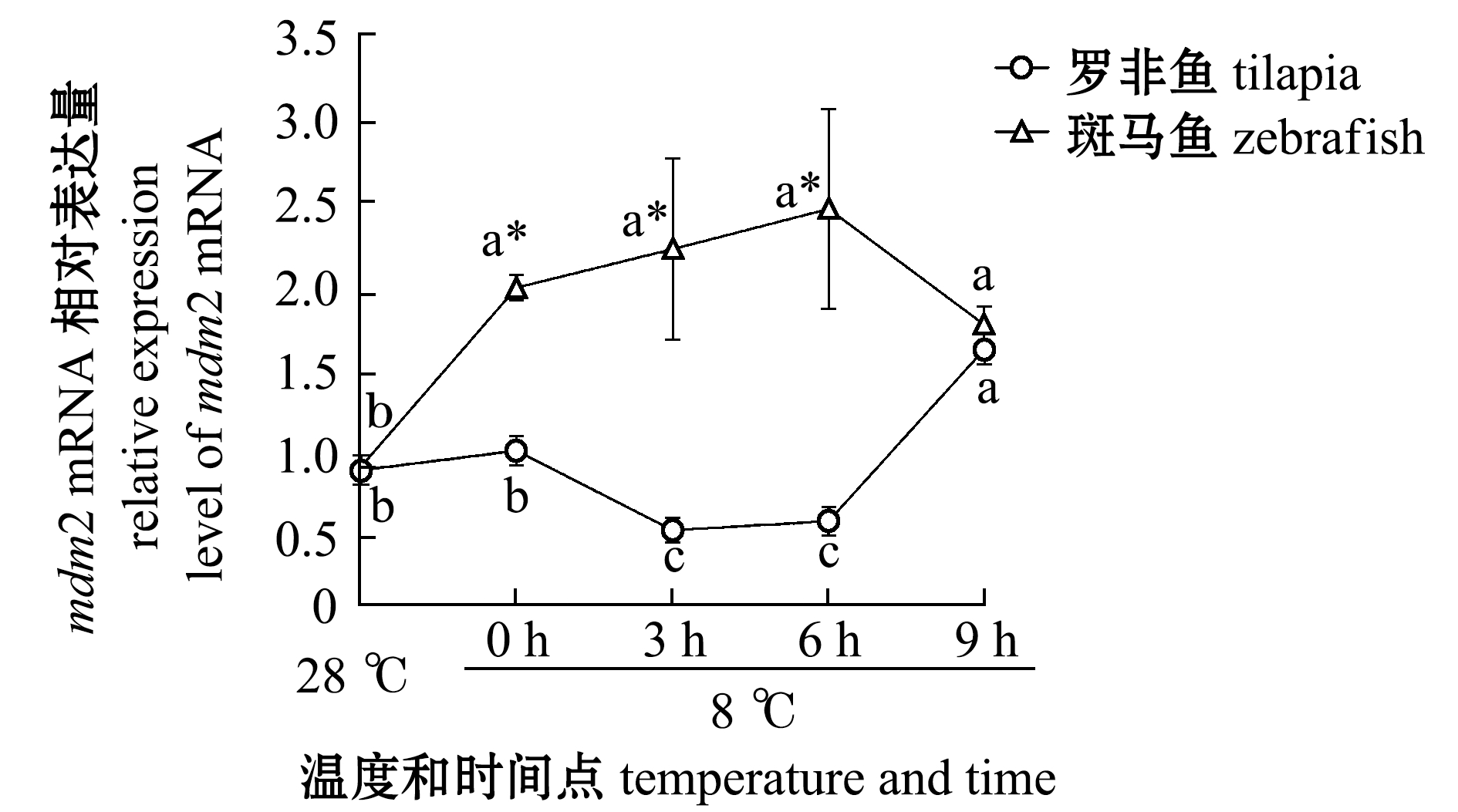
图3 两种鱼在不同温度和时间点的mdm2转录水平定量PCR
Fig.3 qPCR of mdm2 transcript levels relative to β-actin in the two fish species at different temperature and time
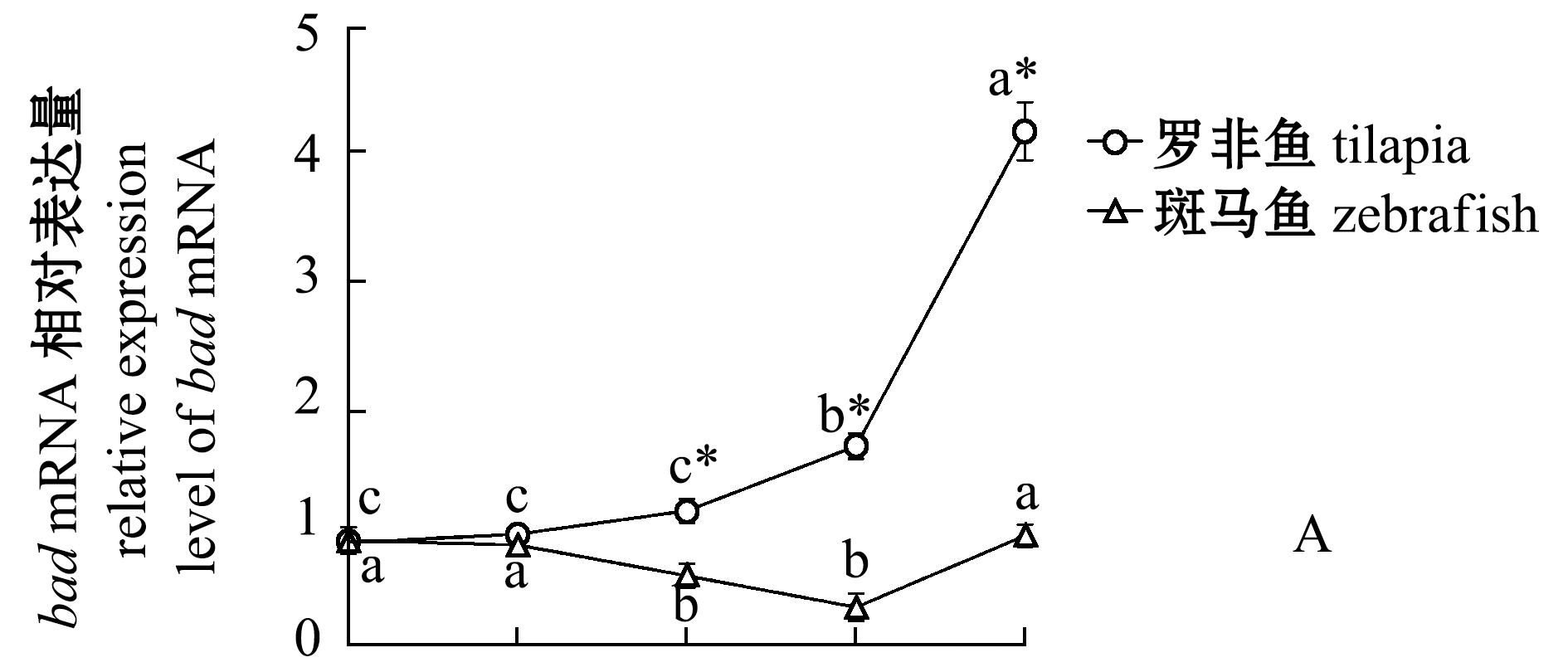
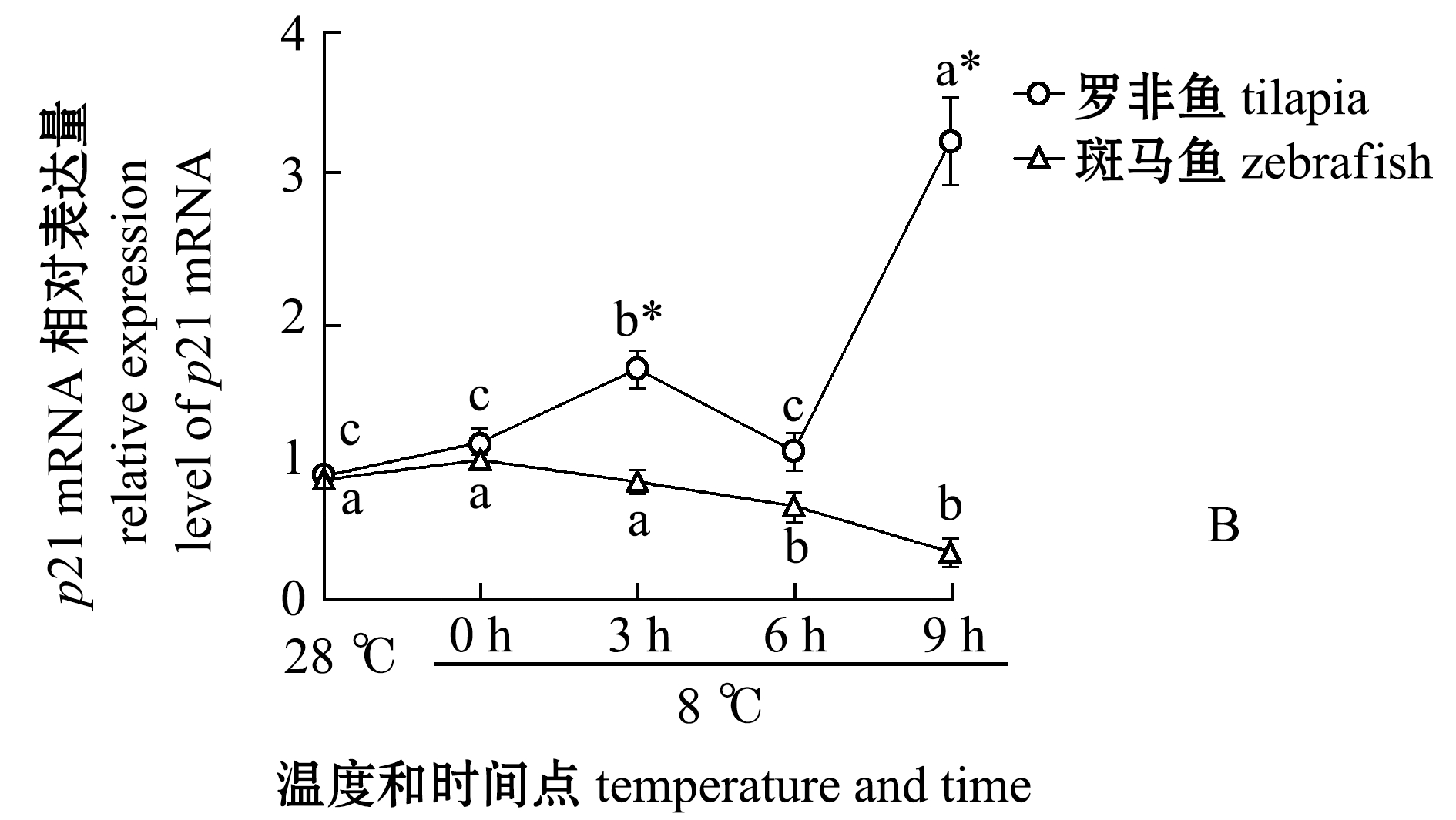
图4 两种鱼在不同温度和时间点的bad 和 p21转录水平定量PCR
Fig.4 qPCR of bad and p21 transcript levels in the two fish species at different temperature and time
3 讨论
3.1 低温下细胞内P53积累导致其发生凋亡
鱼鳃组织最先与外部环境温度波动有直接的接触,因此,可能是鱼类低温耐受的薄弱环节。有研究表明,对低温下斑马鱼和罗非鱼的各个组织进行凋亡信号检测,发现罗非鱼鳃组织在8 ℃、6 h时是最早出现凋亡的,而同一时间点下斑马鱼并未出现凋亡[3]。本试验中通过蛋白定量分析发现,在罗非鱼鳃组织中试验3 h后P53蛋白表达量持续性显著升高,但是斑马鱼鳃组织中在6 h时才开始积累P53蛋白(图2)。因此,罗非鱼比斑马鱼更早出现凋亡信号的原因可能与P53的积累有关。
3.2 MDM2与RPL11相互作用诱导P53积累
有研究表明,核糖体蛋白(ribosomal proteins,RPs),如 RPL5[21]、RPL11 [22] 和RPL23[23]能够通过与MDM2结合阻止其对P53的降解和泛素化,从而实现P53的积累。还有研究表明,敲降RPS6能诱导RPL11激活P53[21],敲降RPL29或RPL30能提高MDM2与RPL11的相互作用,从而诱导P53[22]。本试验结果显示,罗非鱼试验中8 ℃、0 h时RPL11蛋白表达量开始出现升高,而mdm2的转录水平维持在较低水平(图3),导致P53表达量到3 h出现显著升高,P53表达量的不断升高最终导致6 h时出现凋亡信号[3]。虽然在8 ℃、6 h后斑马鱼鳃中P53的表达量有一定的升高,但是在8 ℃、9 h前在斑马鱼鳃中并未检测到凋亡信号[3],这可能是由于其体内P53的表达水平和罗非鱼相比还是较低的,并且P53下游靶基因的表达也未升高。这表明,在斑马鱼体内低温诱导RPL11/MDM2/P53信号发生的时间比罗非鱼晚或者是斑马鱼响应低温的途径和罗非鱼是不同的,这种差异化的表达模式对研究鱼类在响应低温胁迫时所产生差异的分子机制提供了研究思路。
通过比较分析这两种鱼RPL11/MDM2/P53通路中各组分的表达情况发现,参与到该通路的基因和蛋白的表达量在两种鱼体内表达模式有所差异。根据本试验结果及Hu等[3]的研究,作者推测罗非鱼中低温诱导RPL11高表达,通过RPL11/MDM2的调控导致P53快速并且大量积累,激活P53下游凋亡相关基因表达,最终导致凋亡信号大量积累并造成鳃组织不可逆的损伤(图5A);但是在斑马鱼中低温诱导下RPL11表达量反而降低,导致P53表达量缓慢升高,最终出现凋亡的时间较罗非鱼晚(图5B),这可能是其较罗非鱼更耐低温的原因之一。因此,鳃组织凋亡信号的时间及强度可以作为低温下组织受损程度的指示剂。并且低温能诱导罗非鱼中与凋亡相关的RPL11/MDM2/P53通路中相关蛋白的变化,并且这种表达变化模式和耐低温能力较强的斑马鱼是不同的,这些不同物种差异性的基因表达模式可能是罗非鱼和斑马鱼低温耐受能力差异的原因之一,但是其确切的分子机制有待进一步研究。

图5 低温下RPL11/MDM2/P53信号通路参与细胞凋亡调控模式
Fig.5 Pattern diagrams of RPL11/MDM2/P53 pathway involved in cell apoptosis under cold stress
4 结论
1) 与斑马鱼相比较,罗非鱼积累P53的过程较快,并且此过程中伴随着PRL11表达量的升高,而斑马鱼则相反。
2) 在罗非鱼中,8 ℃、6 h前mdm2处于低表达水平,此时有利于P53蛋白表达量积累,6 h后mdm2表达量出现显著升高,可能是P53大量积累导致的;在斑马鱼中,8 ℃、0 h时mdm2表达量出现升高的变化,这不利于P53积累,8 ℃、6 h后mdm2表达量开始下降,P53开始大量积累。
3) 本试验中发现,参与到该通路的基因和蛋白的表达量在两种鱼体内表达模式有所差异,这可能是导致其耐寒能力差异的原因之一。
[1] CORTEMEGLIA C,BEITINGER T L.Temperature tolerances of wild-type and red transgenic zebra danios[J].Transactions of the American Fisheries Society,2005,134(6):1431-1437.
[2] SCHAEFER J,RYAN A.Developmental plasticity in the thermal tolerance of zebrafish Danio rerio[J].Journal of Fish Biology,2006,69(3):722-734.
[3] HU P,LIU M L,LIU Y M,et al.Transcriptome comparison reveals a genetic network regulating the lower temperature limit in fish[J].Scientific Reports,2016,6:28952.
[4] SOLLID J,DE ANGELIS P,GUNDERSEN K,et al.Hypoxia induces adaptive and reversible gross morphological changes in crucian carp gills[J].Journal of Experimental Biology,2003,206(20):3667-3673.
[5] SOLLID J,WEBER R E,NILSSON G E.Temperature alters the respiratory surface area of crucian carp Carassius carassius and goldfish Carassius auratus[J].The Journal of Experimental Biology,2005,208(6):1109-1116.
[6] BOWDEN A J,GARDINER N M,COUTURIER C S,et al.Alterations in gill structure in tropical reef fishes as a result of elevated temperatures[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2014,175:64-71.
[7] CHOU M Y,HSIAO C D,CHEN C S,et al.Effects of hypothermia on gene expression in zebrafish gills:upregulation in differentiation and function of ionocytes as compensatory responses[J].The Journal of Experimental Biology,2008,211(19):3077-3084.
[8] HU P,LIU M L,ZHANG D,et al.Global identification of the genetic networks and cis-regulatory elements of the cold response in zebrafish[J].Nucleic Acids Research,2015,43(19):9198-9213.
[9] TAYLOR R C,CULLEN S P,MARTIN S J.Apoptosis:controlled demolition at the cellular level[J].Nature Reviews Molecular Cell Biology,2008,9(3):231-241.
[10] 孙廷哲,陈春,沈萍萍.p53:凋亡的组织者[EB/OL].中国科技论文在线.(2007-12-26)[2019-10-10].http://www.paper.edu.cn/releasepaper/content/200712-707.
[11] PICKSLEY S M,LANE D P.What the papers say:the p53-mdm2 autoregulatory feedback loop:a paradigm for the regulation of growth control by p53?[J].BioEssays,1993,15(10):689-690.
[12] WU X,BAYLE J,OLSON D,et al.The p53-mdm-2 autoregulatory feedback loop[J].Genes & Development,1993,7(7A):1126-1132.
[13] MOMAND J,ZAMBETTI G P,OLSON D C,et al.The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation[J].Cell,1992,69(7):1237-1245.
[14] CHEN J,MARECHAL V,LEVINE A J.Mapping of the p53 and mdm-2 interaction domains[J].Molecular and Cellular Biology,1993,13(7):4107-4114.
[15] KUBBUTAT M H G,JONES S N,VOUSDEN K H.Regulation of p53 stability by Mdm2[J].Nature,1997,387(6630):299-303.
[16] BOYD S D,TSAI K Y,JACKS T.An intact HDM2 RING-finger domain is required for nuclear exclusion of p53[J].Nature Cell Biology,2000,2(9):563-568.
[17] LOHRUM M A E,WOODS D B,LUDWIG R L,et al.C-terminal ubiquitination of p53 contributes to nuclear export[J]. Molecular and Cellular Biology,2001,21(24):8521-8532.
[18] HOLMBERG OLAUSSON K,NIST R M,LINDSTROM M S.p53-dependent and -independent nucleolar stress responses[J].Cells,2012,1(4):774-798.
R M,LINDSTROM M S.p53-dependent and -independent nucleolar stress responses[J].Cells,2012,1(4):774-798.
[19] CHEN H B,HAN L Q,TSAI H,et al.PICT-1 is a key nucleolar sensor in DNA damage response signaling that regulates apoptosis through the RPL11-MDM2-p53 pathway[J].Oncotarget,2016,7(50):83241-83257.
[20] 李捷萌,陈彦青,刘荣国.粒体凋亡途径与Bcl-2家族蛋白研究进展[J].医学综述,2008,14(4):489-490.
[21] FUMAGALLI S,DI CARA A,NEB-GULATI A,et al.Absence of nucleolar disruption after impairment of 40S ribosome biogenesis reveals an rpL11-translation-dependent mechanism of p53 induction[J].Nature Cell Biology,2009,11(4):501-508.
[22] SUN X X,WANG Y G,XIRODIMAS D P,et al.Perturbation of 60 S ribosomal biogenesis results in ribosomal protein L5- and L11- dependent p53 activation[J].Journal of Biological Chemistry,2010,285(33):25812-25821.
[23] DAI M S,ZENG S X,JIN Y T,et al.Ribosomal protein L23 activates p53 by inhibiting MDM2 function in response to ribosomal perturbation but not to translation inhibition[J].Molecular and Cellular Biology,2004,24(17):7654-7668.