福建省是鳗鲡Anguillid sp.养殖大省,鳗鲡产值在该省水产品贸易中占重要地位,因此,对鳗鲡疫病的研究尤为重要。鳗鲡疫病的病原有病毒性、细菌性、寄生虫等,目前对其病毒性疾病缺乏有效防控措施。该类疾病暴发时,常呈现出大范围的区域传播态势,给养殖行业造成了巨大的经济损失[1]。“脱黏败血综合征”是养殖鳗鲡白仔、黑仔阶段普遍发生的一种传染性疫病,自20世纪90年代就普遍发生。本试验在前期研究中,利用鳗鲡卵巢细胞系(Eel ovary, EO)从病料中分离出鳗鲡疱疹病毒(Anguillid herpesvirus,AngHV),流行病学致病性分析表明,AngHV就是鳗鲡“脱黏败血综合征”的致病病原[2]。
AngHV为线性双链DNA病毒,隶属于鱼蛙疱疹病毒亚科Alloherpesviridae鲤疱疹病毒属Cyprinivirus[3]。目前,鲤疱疹病毒属中研究较多的包括对鲤科鱼类危害较大的鲤疱疹病毒Ⅱ型(cyprinid herpesvirus 2, CyHV-2)和鲤疱疹病毒Ⅲ型(cyprinid herpesvirus 3, CyHV-3)等病毒,并已开展了病原学、流行病学、感染机制、诊断及防控等方面的研究[4-5],但基因功能方面的研究较少。基因序列分析表明,AngHV与CyHV-3的遗传距离最近,有40个同源基因,但序列的一致性均较低,仅为19%~58%。因此,有必要对AngHV基因开展深入研究。
AngHV基因组全长248.5 kbp,由一段长序列及两侧11 kbp末端重复序列组成,具136个开放阅读框(ORF)[6-7]。其病毒粒子由核衣壳、间质层和囊膜组成,预测含有7个衣壳蛋白、11个囊膜蛋白和22个被膜蛋白[8]。囊膜蛋白作为重要的结构蛋白,与病毒入侵宿主细胞、胞间传递、组织嗜好性及宿主范围等方面密切相关[9-12],也常常被用来开发基因工程疫苗[13-14]。蛋白质组学分析表明,ORF8是AngHV的结构蛋白,并大量存在于病毒粒子的囊膜中[8]。对病毒基因表达时序的研究,有助于了解病毒复制周期、基因功能、病毒与宿主的相互作用及疾病控制[15]。目前,国内外尚未见对鳗鲡疱疹病毒ORF8基因及蛋白特征研究的报道。本研究中,通过设计引物,从AngHV-FJ病毒株中克隆ORF8基因,并对其序列进行生物信息学分析,表明其符合囊膜蛋白的基本特征;采用RT-PCR方法分析该基因在病毒入侵细胞过程中的转录时相,并进一步实现了ORF8在大肠杆菌中的高效表达,获得了高纯度的融合表达蛋白,以期为免疫诊断试剂和疫苗研究提供研究基础。
1 材料与方法
1.1 材料
AngHV福建株(AngHV-FJ) 由福建省农科院生物技术研究所分离,EO 细胞、表达载体pET-32a、克隆菌株Escherichia coli DH5α、表达宿主菌E.coli BL21 (DE3)均由福建省农科院生物技术研究所保存。
1.2 方法
1.2.1 AngHV-FJ的细胞扩繁及基因组DNA的提取 EO 细胞用L-15细胞培养基(含体积分数为10%的胎牛血清(美国Hyclone生物公司))于26 ℃细胞培养箱中培养。铺满单层的EO细胞按照感染复数(multiplicity of infection, MOI)为1.0的比例接种AngHV-FJ病毒,待大部分细胞出现细胞病变(CPE)时,利用Pure LinkTM Viral RNA/DNA Mini Kit(美国英杰生命技术有限公司(Invitrogen))提取基因组DNA,置于-20 ℃下保存备用。
1.2.2 AngHV-FJ ORF8基因的克隆 以AngHV标准株的基因组(NC_013668)为参考,设计ORF8基因的特异性引物,分别在上下游加入BamHⅠ、EcoRⅠ酶切位点(宝日医生物技术(北京)有限公司(TaKaRa))。引物序列:ORF8-F为ggatccATGTATAAGGCGTTGAGC,ORF8-R为gaattcTTACGCCCTGGCGTTGGT。以提取的AngHV-FJ基因组DNA为模板,进行ORF8基因序列的PCR扩增。PCR产物经凝胶电泳后,利用DNA胶回收试剂盒(生工生物工程(上海)股份有限公司)纯化,并与pMD19-T载体(宝日医生物技术(北京)有限公司(TaKaRa))连接,利用质粒小量抽提试剂盒(生工生物工程(上海)股份有限公司)提取质粒,经PCR和双酶切鉴定后,阳性克隆测序(生工生物工程(上海)股份有限公司)验证,获得质粒T-ORF8。
1.2.3 AngHV-FJ ORF8 基因的生物信息学分析 利用NCBI的Blast在线工具对扩增获得序列进行比对分析,利用Softberry进行基因转录启动子分析;利用ExPASy的Protparam预测蛋白理化性质,利用CDD工具分析编码蛋白保守功能域,利用TMHMM分析跨膜结构域,利用SignalP-4.1预测蛋白的信号肽,利用Psort预测蛋白的亚细胞定位,利用BepiPred对蛋白的B细胞抗原表位进行预测。
1.2.4 AngHV-FJ ORF8基因的表达时序分析 EO细胞按照MOI为1.0的比例接种AngHV-FJ病毒,在接种病毒后的0、3、6、24、48、72、96、120 h收集细胞,采用TRIzol法提取细胞总RNA,经DNase消化后,用PrimeScriptTM 1st Strand cDNA Synthesis Kit(宝日医生物技术(北京)有限公司(TaKaRa))合成cDNA,于-80 ℃下保存备用。设计特异性扩增内参基因ACTB和ORF8的引物序列:ACTB-F为TCCAGGCCGACGTAGCACAG,ACTB-R为TGGCCCCCGAGGAGCAC;ORF8-F为ATGTATAAGGCGTTGAGC,ORF8-R为TTACGCCCTGGCGTTGGT进行PCR扩增。利用琼脂糖凝胶电泳对PCR产物进行分析。
1.2.5 表达质粒32a-ORF8的构建 分别将质粒T-ORF8和pET-32a用BamHⅠ/EcoRⅠ双酶切,获得的片段利用DNA胶回收试剂盒(生工生物工程(上海)股份有限公司)纯化,利用T4 DNA连接酶(宝日医生物技术(北京)有限公司(TaKaRa))连接,转化至感受态E.coli DH5α细胞中,提取质粒,经双酶切确认,获得质粒32a-ORF8。
1.2.6 质粒32a-ORF8的诱导表达 将质粒32a-ORF8转化至感受态E.coli BL21( DE3)细胞中,挑选平板上阳性克隆,于LB液体培养基中37 ℃下培养过夜,次日接种于新鲜LB中,培养至吸光度OD600 nm为0.6~0.8时,加入IPTG至终浓度为1 mmol/L, 37 ℃下再培养12 h,离心收集细菌菌体,超声破碎后进行SDS-PAGE分析。
1.2.7 融合蛋白的Western blot鉴定 上述样品经SDS-PAGE电泳后,用半干转移法转至PVDF膜,将膜放入含50 g/L脱脂奶粉的TBST缓冲液中37 ℃下封闭1 h, 用TBST 缓冲液洗膜后,与1∶5 000倍稀释于TBS中的鼠抗 His-Tag单克隆抗体(英国艾博抗生物技术有限公司(Abcam))在室温孵育1 h,再用TBST缓冲液洗膜后,与1∶15 000倍稀释于TBST缓冲液中的HRP标记的羊抗鼠IgG(美国Cell Signaling Technology (CST)) 室温孵育1.5 h,用TBST洗膜后,采用Super ECL Plus化学发光液(北京兰博利德商贸有限公司(LabLead))显色,用ChemiScope 6000 Touch成像系统拍照(上海勤翔生物科技有限公司)。
1.2.8 融合表达蛋白的纯化 收集表达菌,超声破碎后进行蛋白的SDS-PAGE分离,染色后,将含目的条带的凝胶切下,在研钵(-80 ℃预冷)中研磨后,利用PAGE-胶蛋白微量回收试剂盒(生工生物工程(上海)股份有限公司)回收蛋白,置于-80 ℃下保存备用。
2 结果与分析
2.1 AngHV-FJ ORF8基因的克隆
利用设计的引物对ORF8-F/ORF8-R,从AngHV-FJ基因组中扩增出约650 bp的特异性条带(图1(a)),连接至pMD19-T载体,提取质粒后进行双酶切鉴定(图1(b)),经测序验证,确定克隆的就是AngHV-FJ的ORF8序列,将质粒命名为T-ORF8。
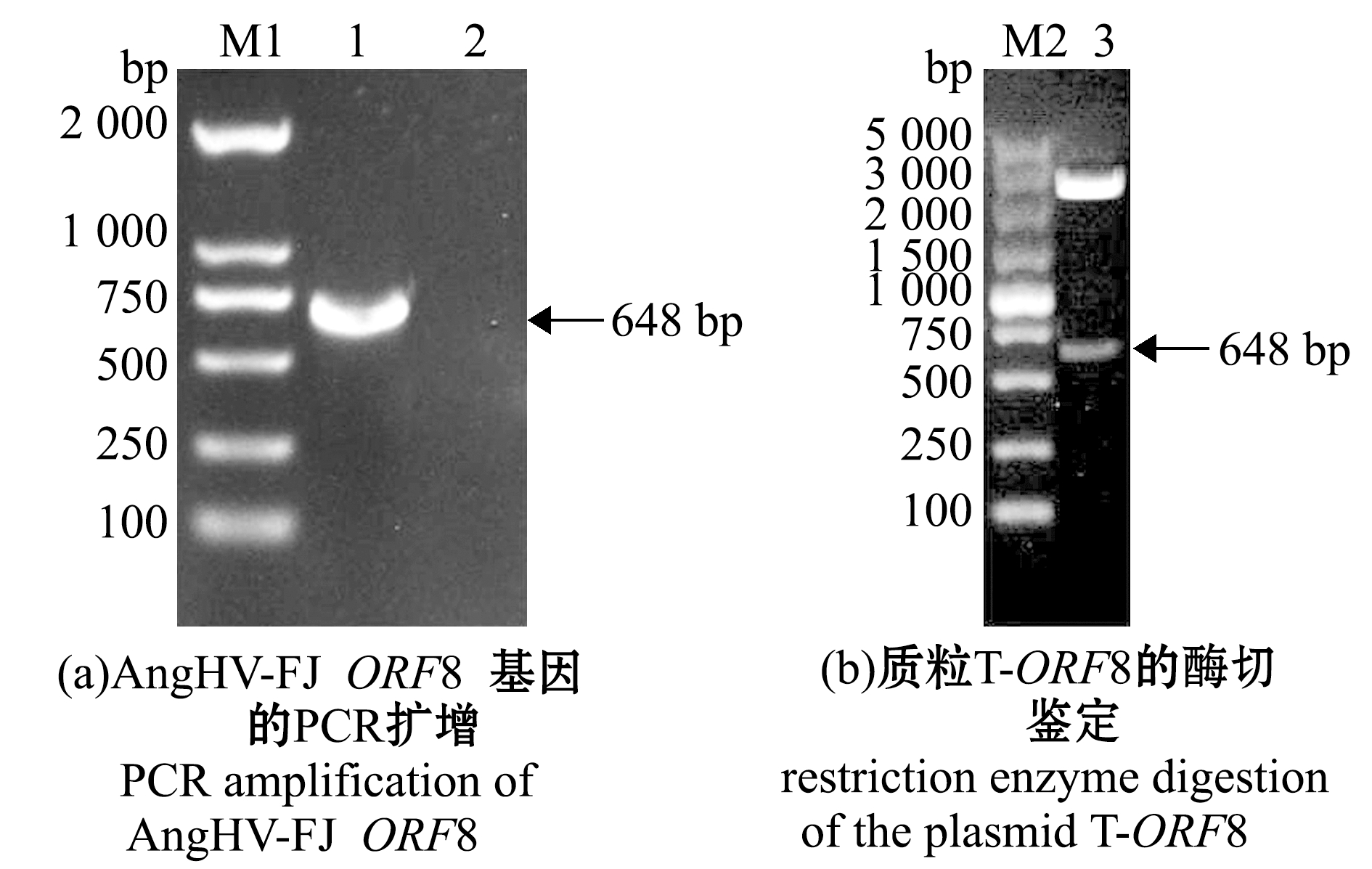
M1—DL2000 DNA Marker;M2—DL5000 DNA Marker;1—ORF8;2—阴性对照;3—BamHⅠ/EcoRⅠ双酶切。
M1—DL2000 DNA Marker; M2—DL5000 DNA Marker;1—ORF8;2—negative control; 3—double enzyme digestion by BamHⅠ/EcoRⅠ.
图1 AngHV-FJ ORF8基因的PCR扩增及克隆
Fig.1 PCR amplification and cloning of AngHV-FJ ORF8
2.2 AngHV-FJ ORF8基因的生物信息学分析
2.2.1 AngHV-FJ ORF8 基因序列分析 Blast分析表明,AngHV-FJ ORF8的基因序列与GenBank中参考株AngHV-1的 (NC_013668)ORF8序列一致性为99.84%,仅在基因的第544 bp碱基处出现点突变(T→C),对应基因编码的氨基酸由Y→H。Softberry的基因转录启动子分析显示,在上游-10 bp和-35 bp处分别存在为TATAAG和TTGTCT的启动子序列,在-20 bp处存在转录因子rpoD15的潜在结合位点,序列为TTTTGTTT;在终止密码子TAA下游41 bp处存在poly A尾,序列为AATAAAAA。
2.2.2 AngHV-FJ ORF8蛋白特征分析 Protparam分析显示,预测ORF8基因编码的蛋白相对分子质量为23 700,等电点为5.72,属于酸性蛋白;不稳定系数为19.65,比较稳定;总平均亲水性为-0.206,为亲水性蛋白。CDD、TMHMM、SignalP-4.1、Psort和BepiPred分析显示,ORF8蛋白不含保守功能区,在氨基酸序列的第158~180位存在跨膜结构,无信号肽结构,亚细胞定位于细胞质膜,并存在10个潜在抗原位点,表明ORF8蛋白可能具有较好的免疫原性(表1)。
表1 AngHV-FJ ORF8蛋白的B细胞抗原表位预测
Tab.1 Prediction of the B cell antigenic epitopes of AngHV-FJ ORF8 protein in B cells
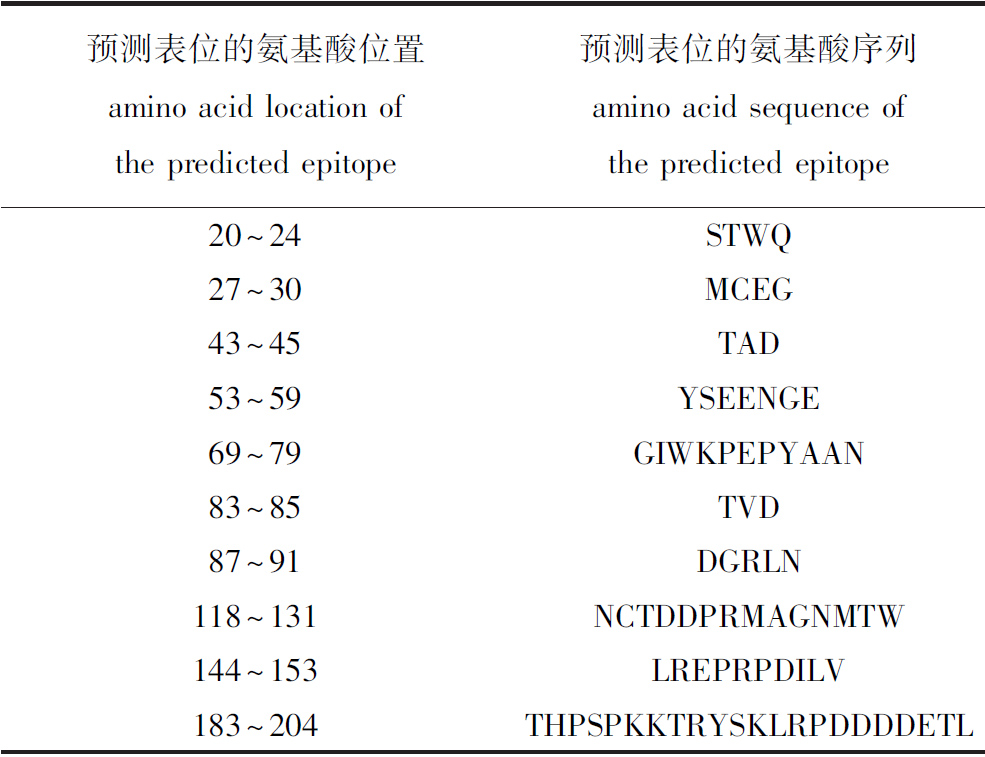
预测表位的氨基酸位置amino acid location of the predicted epitope预测表位的氨基酸序列amino acid sequence of the predicted epitope20~24STWQ27~30MCEG43~45TAD53~59YSEENGE69~79GIWKPEPYAAN83~85TVD87~91DGRLN118~131NCTDDPRMAGNMTW144~153LREPRPDILV183~204THPSPKKTRYSKLRPDDDDETL
2.3 AngHV-FJ ORF8基因的转录时相分析
AngHV感染EO细胞后120 h,多数细胞发生CPE。为了解AngHV入侵细胞后ORF8的表达情况,本试验中在EO细胞感染AngHV-FJ后的不同时间点收集细胞,利用RT-PCR方法对ORF8的转录时相进行了分析。结果显示,ORF8在病毒感染细胞后3 h就可以检出,在24 h达到高峰,随后表达量无明显变化,作为对照的内参基因ACTB在所有时间点的表达量无显著性差异(图2)。这表明,ORF8基因可能是AngHV的早期基因,在病毒感染早期发挥作用。
2.4 AngHV-FJ ORF8基因在大肠杆菌中的表达
质粒T-ORF8用BamHⅠ/EcoRⅠ双酶切,回收目的片段,与表达载体pET-32a连接,连接质粒用BamHⅠ/EcoRⅠ双酶切鉴定,结果出现大小约650 bp的特异性条带(图3),这表明成功构建了表达质粒32a-ORF8。将该质粒转化至E.coli BL21,IPTG诱导表达,菌体进行SDS-PAGE分析。结果显示,与未经诱导的全菌蛋白相比,含pET-32a载体的诱导菌在相对分子质量为20 400处有明显的蛋白条带,而含32a-ORF8的诱导菌在约44 000处有明显的蛋白条带(图4(a))。
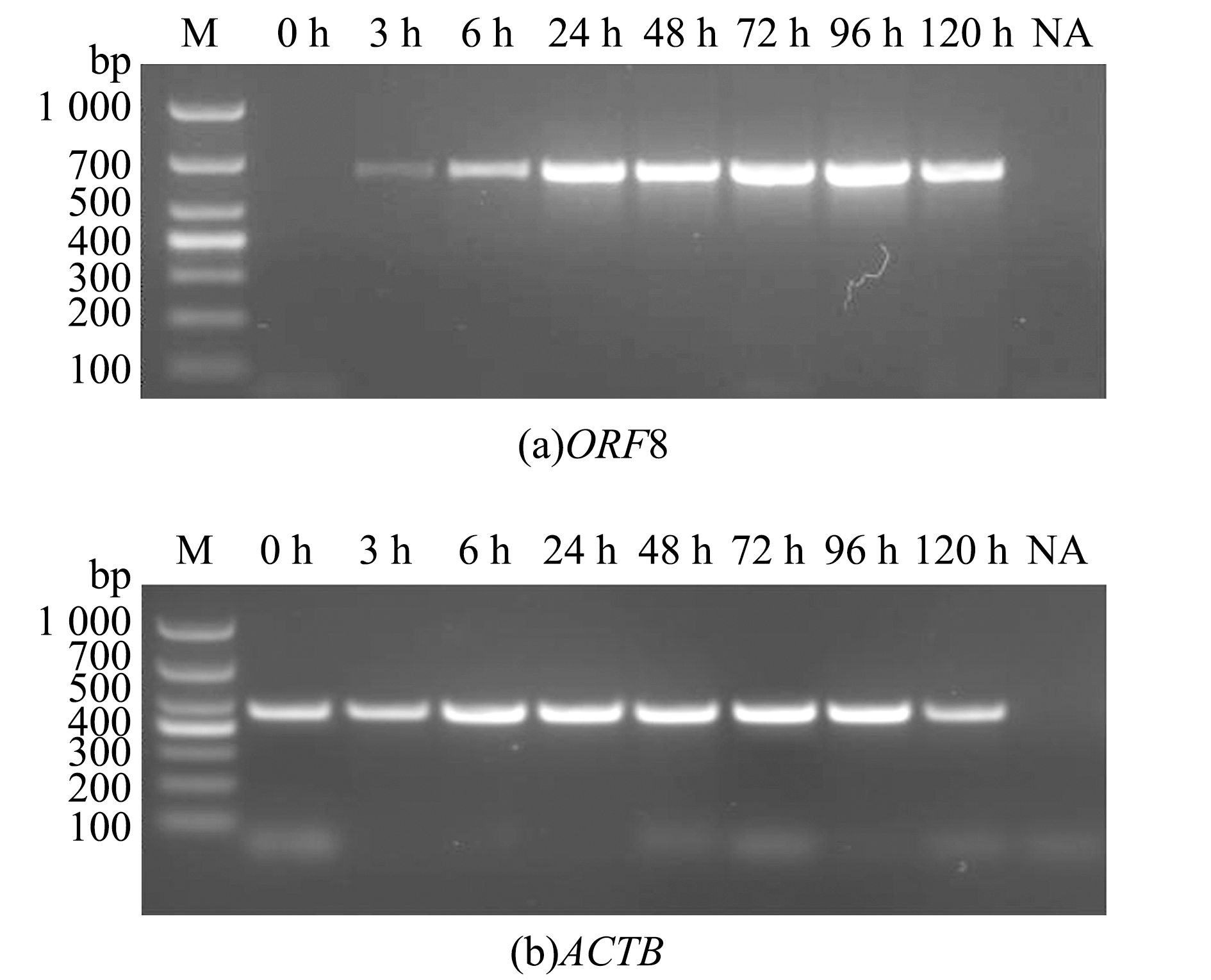
M—DL1000 Marker; NA—阴性对照。
M—DL1000 Marker; NA—negative control.
图2 AngHV感染EO细胞后ORF8转录时相的RT-PCR分析
Fig.2 ORF8 transcription profiles in AngHV infected EO cells by RT-PCR analysis
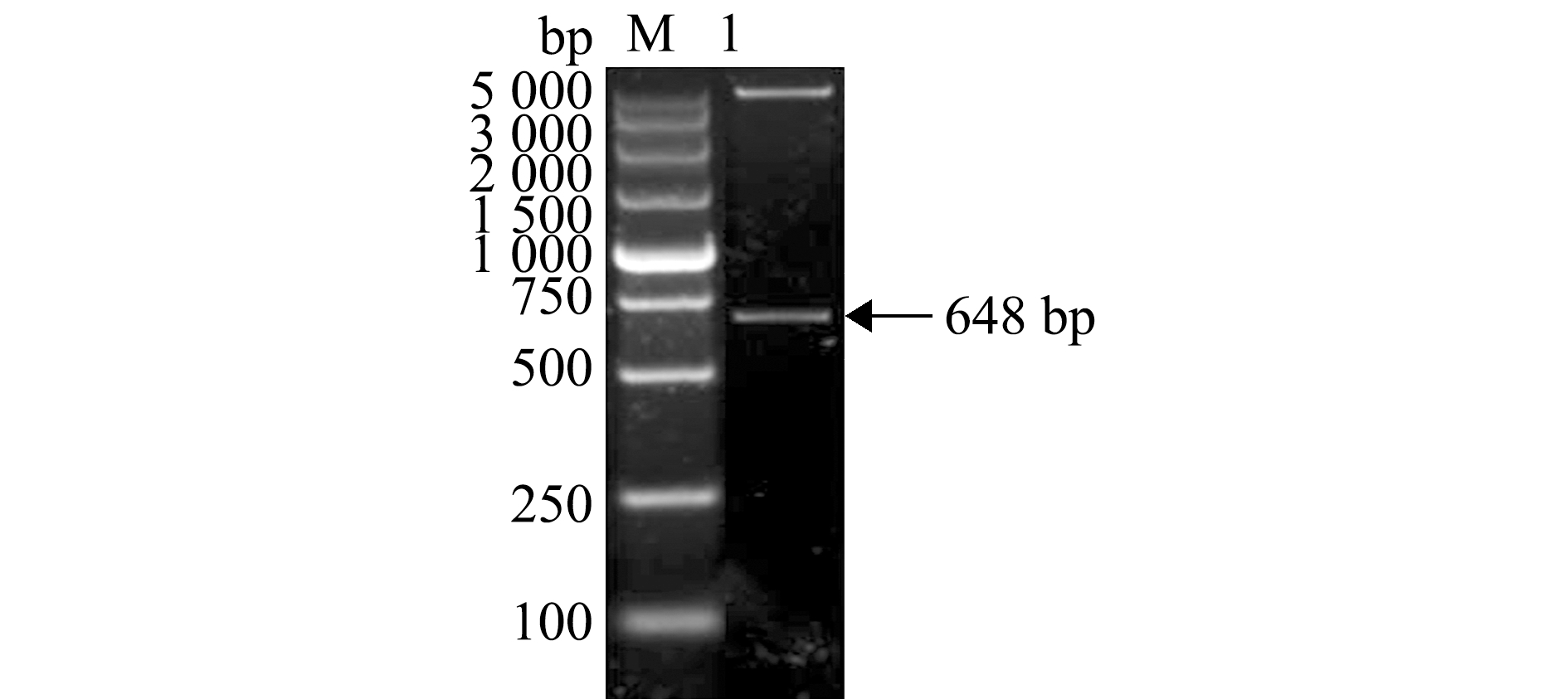
M—DL5000 DNA Marker; 1 —BamHⅠ/EcoRⅠ双酶切。
M—DL5000 DNA Marker; 1—double enzyme digestion by BamHⅠ/EcoRⅠ.
图3 质粒32a-ORF8酶切鉴定
Fig.3 Restriction enzyme digestion of the plasmid 32a-ORF8
进一步的Western blot分析表明,与未经诱导的全菌蛋白相比,含pET-32a载体的诱导菌可被鼠抗His-Tag单克隆抗体检测到相对分子质量为20 400的蛋白条带,而含32a-ORF8的诱导菌可被鼠抗His-Tag单克隆抗体检测到相对分子质量约44 000的蛋白条带(图4(b)),表明表达的ORF8蛋白与预期23 700的大小一致,实现了ORF8基因在E.coli BL21(DE3)中的完全表达。
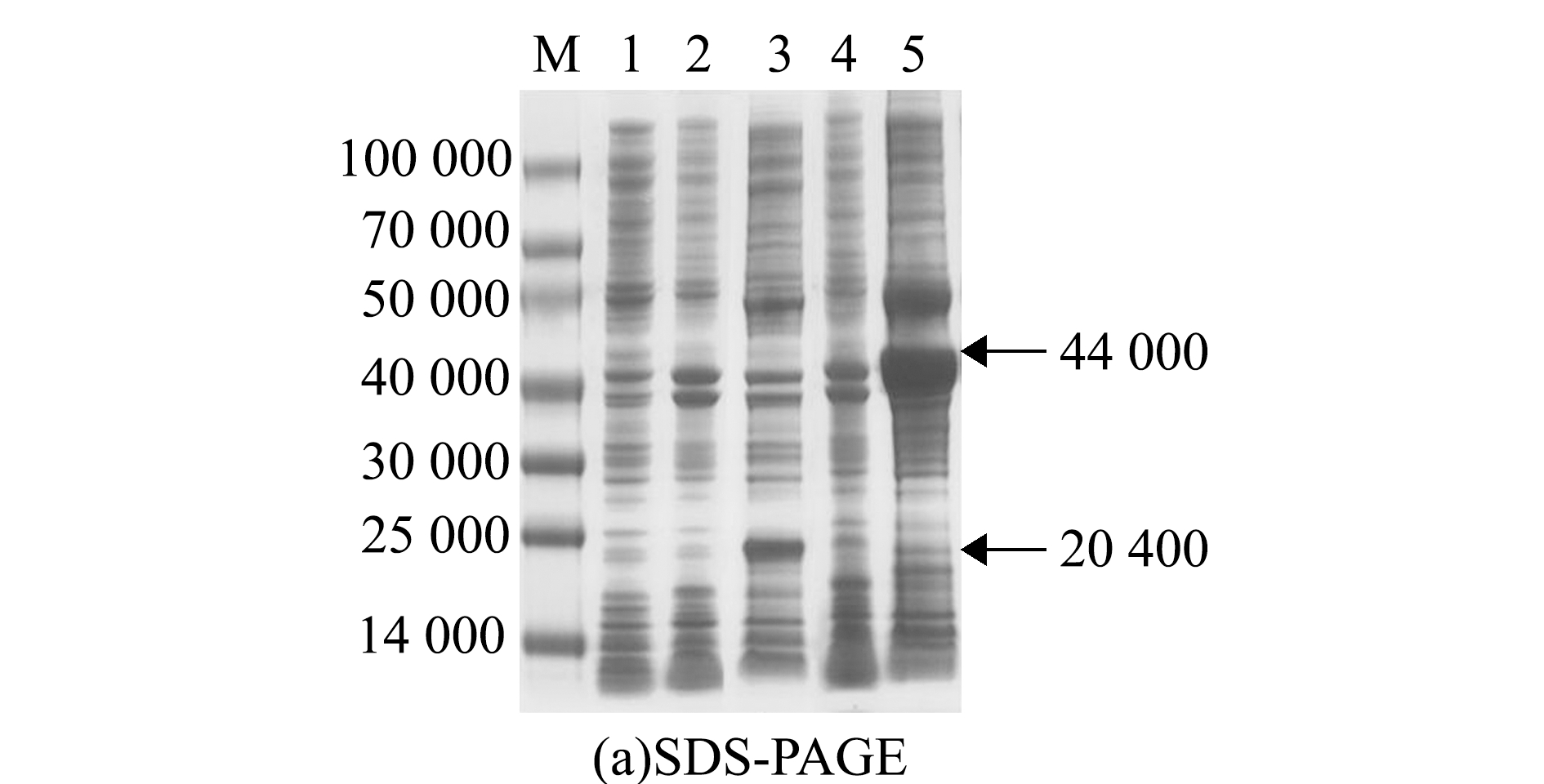

M—预染标准分子量蛋白Marker;1—BL21全菌蛋白;2—未经诱导的BL21/pET-32a全菌蛋白;3—诱导的BL21/pET-32a全菌蛋白;4—未诱导的BL21/32a-ORF8全菌蛋白;5—诱导的BL21/32a-ORF8全菌蛋白。
M—predyed standard molecular weight protein Marker; 1—total cell protein of BL21; 2—uninduced total cell protein of BL21/pET-32a; 3—induced total cell protein of BL21/pET-32a; 4—uninduced total cell protein of BL21/32a-ORF8; 5—induced total cell protein of BL21/32a-ORF8.
图4 AngHV-FJ ORF8在大肠杆菌中表达的SDS-PAGE和Western blot分析
Fig.4 SDS-PAGE and Western blot analysis of the expression of AngHV-FJ ORF8 in Escherichia coli
2.5 ORF8蛋白的纯化
收集诱导表达的ORF8蛋白条带,用PAGE-胶蛋白微量回收试剂盒纯化后,进行SDS-PAGE检测。结果显示,与含32a-ORF8的诱导菌全菌蛋白相比,回收蛋白为与ORF8蛋白大小一致的单一条带,表明成功获得了高纯度的ORF8表达蛋白(图5)。
3 讨论
3.1 AngHV-FJ ORF8基因序列的特征
生产实践中,AngHV给鳗鲡养殖业者造成了极大的经济损失[16] ,但学界目前对于该病毒的研究还不深入。AngHV是具囊膜的双链DNA病毒,囊膜蛋白可参与病毒包膜和宿主细胞膜间的膜融合[17-19],对病毒囊膜蛋白进行研究,可以加深人类对宿主与病毒关系的认识,有助于阐明其发病机制,制定有效的防治策略[11]。本研究中克隆了AngHV的ORF8基因,并对ORF8基因及其编码的蛋白特征进行了生物信息学分析,结果显示,ORF8基因编码蛋白稳定性较好,亲水性较强,存在跨膜结构,定位于细胞质膜上,且存在多个抗原表位,符合囊膜蛋白的基本特征。在进一步的研究中将对蛋白进行功能鉴定,以探讨其在病毒感染中的具体作用。
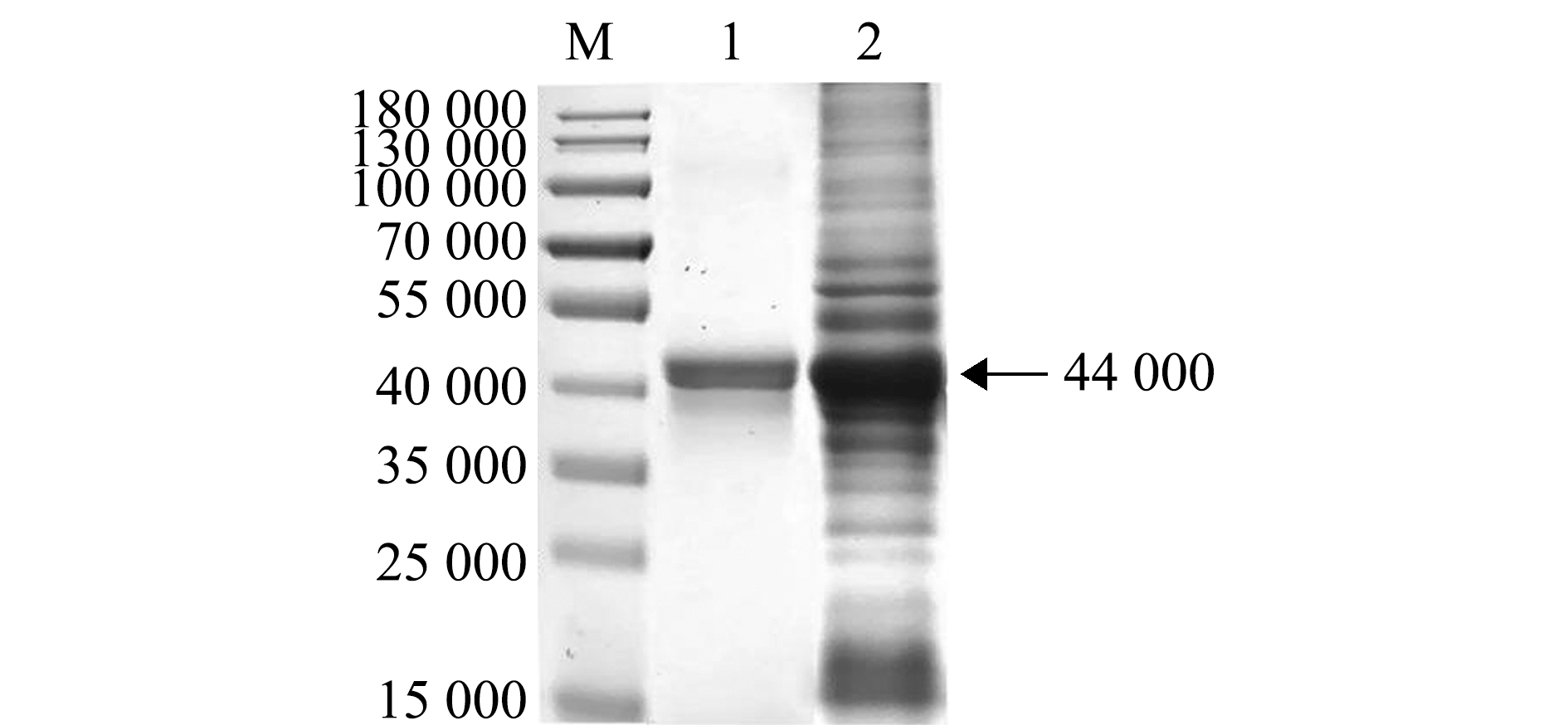
M—预染标准分子量蛋白Marker;1—纯化的ORF8蛋白;2—诱导的BL21/32a-ORF8全菌蛋白。
M—predyed standard molecular weight protein Marker; 1—the purified ORF8 protein; 2—induced total cell protein of BL21/32a-ORF8.
图5 回收纯化AngHV ORF8蛋白的SDS-PAGE分析
Fig.5 SDS-PAGE analysis of the purified AngHV ORF8 protein
3.2 AngHV-FJ ORF8基因的表达时序
疱疹病毒在感染过程中,基因按照表达时序性一般分为3种类别——极早期基因(immediate-early gene, IE)、早期基因(early gene, E)和晚期基因(late gene, L)[20-21],但三者间无较明确的界限[22]。一般来说,疱疹病毒的早期基因在病毒感染后的2~4 h开始表达[23]。本研究中显示,ORF8的转录本在病毒感染3 h即检测到,在感染24 h后达到峰值,因此,该基因可能在病毒感染和复制的早期就发挥作用[22]。
3.3 AngHV-FJ ORF8蛋白表达的应用
准确的病原诊断是病毒疾病预防和治疗的基础。目前,相关领域已建立了多种基于PCR的AngHV检测方法[24],但还未见免疫学检测方法的报道。病毒的囊膜蛋白多具有良好的免疫原性[25-27],如CyHV-2[28-31]、CyHV-3[32-35]和鲫疱疹病毒(Carassius auratus herpesvirus, CaHV)[36],常应用于建立相应的免疫学检测方法和作为制备亚单位疫苗的抗原。因此,本研究在分析ORF8抗原表位的基础上,实现了ORF8在大肠杆菌中的高效表达,并获得了高纯度的纯化蛋白。表达的蛋白与预期大小一致,说明ORF8蛋白可能并不存在翻译后修饰,这为下一步的抗体制备、免疫效果评价及免疫学诊断方法的建立奠定了前期基础,对于鳗鲡疱疹病毒疾病的防控研究具有重要意义。
[1] 张奇亚,桂建芳.水生病毒学[M].北京:高等教育出版社,2008:22-23.
[2] 葛均青,杨金先,龚晖,等.鳗鲡疱疹病毒的分离与鉴定[J].水产学报,2014,38(9):1579-1583.
[3] DAVISON A J,EBERLE R,EHLERS R,et al.The order Herpesvirales[J].Archives of Virology,2009,154(1):171-177.
[4] 郑树城,王庆,李莹莹,等.鲤疱疹病毒3型研究进展[J].病毒学报,2016,32(1):108-120.
[5] 袁锐,陈静,刘训猛,等.鲤疱疹病毒2型研究进展[J].水产学杂志,2019,32(1):38-45.
[6] AOKI T,HIRONO I,KUROKAWA K,et al.Genome sequences of three koi herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide[J].Journal of Virology,2007,81(10):5058-5065.
[7] VAN BEURDEN S J,BOSSERS A,VOORBERGEN-LAARMAN M H A,et al.Complete genome sequence and taxonomic position of anguillid herpesvirus 1[J].The Journal of General Virology,2010,91(6):880-887.
[8] VAN BEURDEN S J,LEROY B,WATTIEZ R,et al.Identification and localization of the structural proteins of anguillid herpesvirus 1[J].Veterinary Research,2011,42(1):105.
[9] 杨丽莎.疱疹病毒gH蛋白功能研究进展[J].中国畜牧兽医文摘,2018,34(4):64.
[10] 练蓓,程安春,汪铭书.疱疹病毒gC基因及其编码蛋白研究进展[J].中国动物传染病学报,2009,17(2):82-86.
[11] BRIDEAU A D,ENQUIST L W,TIRABASSI R S.The role of virion membrane protein endocytosis in the herpesvirus life cycle[J].Journal of Clinical Virology,2000,17(2):69-82.
[12] 马瑜,孟红.单纯疱疹病毒侵入相关糖蛋白的研究进展[J].国际病毒学杂志,2006,13(3):94-96.
[13] MAKAROVA K S,ARAVIND L,KOONIN E V.A novel superfamily of predicted cysteine proteases from eukaryotes,viruses and Chlamydia pneumoniae[J].Trends in Biochemical Sciences,2000,25(2):50-52.
[14] VAN GINNEKEN V,BALLIEUX B,WILLEMZE R,et al.Hematology patterns of migrating European eels and the role of EVEX virus[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2005,140(1):97-102.
[15] D’COSTA S M,YAO H,BILIMORIA S L.Transcription and temporal cascade in Chilo iridescent virus infected cells[J].Archives of Virology,2001,146(11):2165-2178.
[16] HAENEN O L M,DIJKSTRA S G,VAN TULDEN P W,et al.Herpesvirus anguillae (HVA) isolations from disease outbreaks in cultured European eel,Anguilla anguilla in The Netherlands since 1996[J].Bulletin-European Association of Fish Pathologists,2002,22(4):247-257.
[17] RYCKMAN B J,CHASE M C,JOHNSON D C.HCMV gH/gL/UL128-131 interferes with virus entry into epithelial cells:evidence for cell type-specific receptors[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(37):14118-14123.
[18] GIANNI T,AMASIO M,CAMPADELLI-FIUME G.Herpes simplex virus gD forms distinct complexes with fusion executors gB and gH/gL in part through the C-terminal profusion domain[J].The Journal of Biological Chemistry,2009,284(26):17370-17382.
[19] SATHIYAMOORTHY K,HU Y X,MÖHL B S,et al.Structural basis for Epstein-Barr virus host cell tropism mediated by gp42 and gHgL entry glycoproteins[J].Nature Communications,2016,7:13557.
[20] MCGEOCH D J,RIXON F J,DAVISON A J.Topics in herpesvirus genomics and evolution[J].Virus Research,2006,117(1):90-104.
[21] RECHENCHOSKI D Z,FACCIN-GALHARDI L C,LINHARES R E C,et al.Herpesvirus:an underestimated virus[J].Folia Microbiologica (Praha),2017,62(2):151-156.
[22] VAN BEURDEN S J,PEETERS B P,ROTTIER P J,et al.Genome-wide gene expression analysis of anguillid herpesvirus 1[J].BMC Genomics,2013,14:83.
[23] KNIPE D M,CLIFFE A.Chromatin control of herpes simplex virus lytic and latent infection[J].Nature Reviews Microbiology,2008,6(3):211-221.
[24] 葛均青,杨金先,李友娟,等.鳗鲡病毒性疾病病料中鳗鲡疱疹病毒的PCR检测[J].福建农业学报,2012,27(9):961-964.
[25] 杜华华.对虾白斑综合征病毒囊膜蛋白VP28基因的表达及其重组蛋白抗病性研究[D].杭州:浙江大学,2006.
[26] 谭爱萍,邹为民,赵飞,等.锦鲤疱疹病毒主要囊膜蛋白基因的PCR扩增与序列分析[J].中国水产科学,2008,15(5):880-884.
[27] 魏克强,许梓荣.家蚕蛹表达对虾白斑综合征病毒囊膜蛋白Vp28和Vp19的免疫原性[J].中国兽医学报,2006,26(4):360-362.
[28] 李双,向涛,周海峰,等.鲤疱疹病毒Ⅱ型ORF72基因克隆、蛋白原核表达和抗体制备[J].江苏农业科学,2019,47(14):62-65.
[29] 余琳,吕利群,王浩.Ⅱ型鲤疱疹病毒ORF121蛋白的多克隆抗体制备及鉴定[J].水产学报,2019,43(6):1463-1471.
[30] 周勇,范玉顶,徐进,等.鲤疱疹病毒Ⅱ型ORF4基因的克隆、表达与免疫学检测方法[J].淡水渔业,2017,47(1):61-65.
[31] 廖红,林华,郝中香,等.鲤疱疹病毒2型ORF5截短基因的克隆表达及免疫原性研究[J].中国兽医科学,2016,46(11):1394-1400.
[32] 梁思源,吕春爽,安红艳,等.锦鲤疱疹病毒ORF126-ORF27融合蛋白的表达及免疫原性分析[J].中国水产,2017(10):96-99.
[33] 王世会,贾智英,李池陶,等.锦鲤疱疹病毒ORF72基因克隆及结构功能分析[J].水产学杂志,2016,29(3):9-15.
[34] 袁海延,于慧,周景祥,等.锦鲤疱疹病毒ORF146基因的克隆、表达及免疫原性的研究[J].中国兽药杂志,2015,49(6):13-16.
[35] 张子鹏,余涛.锦鲤疱疹病毒ORF30和ORF131蛋白的原核表达及纯化[J].中国农业信息,2014(2):135-136.
[36] 王子豪,张奇亚.鲫疱疹病毒ORF31R(CaHV-31R)的特征及其编码蛋白与细胞器共定位[J].水产学报,2019,43(5):1263-1270.