中国水产资源丰富,水产品的生产量及消费量均位于世界前列,然而中国水产品精深加工水平较低,大量的水产加工副产物(如头、骨、皮、鳞、内脏、碎肉等),以及低值鱼、虾、贝、藻等水产资源常被废弃,不仅浪费大量优质蛋白资源,而且污染环境。生物活性肽是指蛋白原料经酶解、分离、纯化后制备出的具有特定生理功能的肽类物质[1]。目前,越来越多的水产蛋白源生物活性肽被分离鉴定,如从海鞘Halocynthia roretzi[2]、草鱼Ctenopharyngodon idella[3]、凤尾鱼Coilia mystus[4]、微藻Chlorella vulgaris[5]、黑鲨鱼Carcharhinus falciformis皮[6]、牡蛎Saccostrea cucullata[7-8]等蛋白水解物中分离出抗氧化肽,从大西洋鲭Scomber scombrus[9]、鳀Engraulis japonicus[10]、海藻Saccharina longicruris[11]、雪蟹Chionoecetes opilio[12]等蛋白水解物中分离出抗菌肽,从大西洋鲑Salmo salar明胶[13]、大马哈鱼Oncorhynchus keta皮[14]、比目鱼Paralichthys olivaceus肌肉[15]等蛋白水解物中分离出降血压肽,从菲律宾蛤仔Ruditapes philippinarum[16]、牡蛎Saccostrea cucullata[17]、螺旋藻Spirulina platensis[18]等蛋白水解物中分离出抗癌/抗肿瘤肽。此外,以阿拉斯加鳕Eleginus gracilis骨骼[19]、波纹巴非蛤Paphia undulata[20]、贻贝Mytilus coruscus[21]等蛋白水解物制备的免疫调节肽,以及以鳕鱼皮[22]、南极磷虾Euphausia superba[23]、牡蛎[24]、鳀Engraulis japonicus[25]、罗非鱼皮[26]等蛋白水解物制备矿物质离子结合活性肽等。以水产品加工副产物及低值的鱼、虾、贝、藻等为蛋白原料制备水产蛋白源生物活性肽,既可减少环境污染,提高水产品高值化利用率,还可提高水产加工企业利润率和水产资源的综合利用率,具有重大社会经济效益。本研究中,通过对水产蛋白源生物活性肽的酶解制备、纯化鉴定、功能分类、结构特征及作用机制等进行综述,以期为水产蛋白源生物活性肽的理论研究和产业化高值利用提供科学参考。
1 水产蛋白源生物活性肽的制备、纯化及鉴定
1.1 酶解法制备生物活性肽
目前,酶解法是较为常用且安全有效获得生物活性肽的方法,酶解反应过程易控,条件温和,无有害物质产生,能制备特定的易于分离的活性肽[27]。由于蛋白质的水解程度会影响其所产生肽段的生物利用度和生物活性,因此,选择最适的水解条件(如温度、pH、酶制剂和酶与底物比例等)至关重要。目前,用于制备生物活性肽的蛋白酶主要有胃蛋白酶、碱性蛋白酶、中性蛋白酶、胰蛋白酶、复合蛋白酶(protamex)和风味蛋白酶等。根据已有的研究发现,制备抗氧化肽时,大多利用胃蛋白酶进行酶解;制备抗菌肽时,主要利用protamex酶;制备降血压肽及抗肿瘤肽时,常用胃蛋白酶和胰蛋白酶;制备矿物质结合肽时,常用胰蛋白酶(表1)。同一种原料,经不同的蛋白酶酶解后,其酶解产物会表现出不同的活性,如Alemán等[28]分别利用7种蛋白酶水解鱿鱼明胶蛋白,结果发现:Alcalase酶(来源于地衣芽孢杆菌的碱性丝氨酸型内切蛋白酶)水解产物是最有效的血管紧张素转换酶(ACE)抑制剂(IC50 为0.34 mg/mL);而Esperase酶(一种由芽孢杆菌Bacillus sp.分泌的丝氨酸型碱性蛋白酶)水解产物对人乳腺癌(IC50为0.13 mg/mL)和神经胶质瘤(IC50为0.10 mg/mL)的细胞毒性作用最强;胰蛋白酶、Savinase酶(赛威蛋白酶,一种由芽孢杆菌Bacillus sp.分泌的丝氨酸型蛋白酶)、Esperase酶和Alcalase酶水解产物的自由基清除能力最高。此外,除了使用一种酶制备活性多肽外,两个或多个酶组合也成为制备特定多肽的热门方法。最常见的是模拟人体胃肠消化,先后利用胃蛋白酶和胰蛋白酶酶促分解蛋白质,从而获得目的多肽。Wang等[18]先后利用3种胃肠道内肽酶(胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶)对螺旋藻进行水解,其水解产物对3种癌细胞(人乳腺癌细胞MCF-7、人肝癌细胞HepG-2和人胃癌细胞SGC-7901)均表现出抗增殖活性。除此之外,Wang等[4]利用碱性蛋白酶(pH 8.0,55 ℃,2 h)与中性蛋白酶(pH 8.0,55 ℃,3 h)双酶组合水解凤尾鱼鱼粉,获得抗氧化寡肽。
表1 水产蛋白源生物活性肽
Tab.1 Bioactive peptides derived from fishery proteins
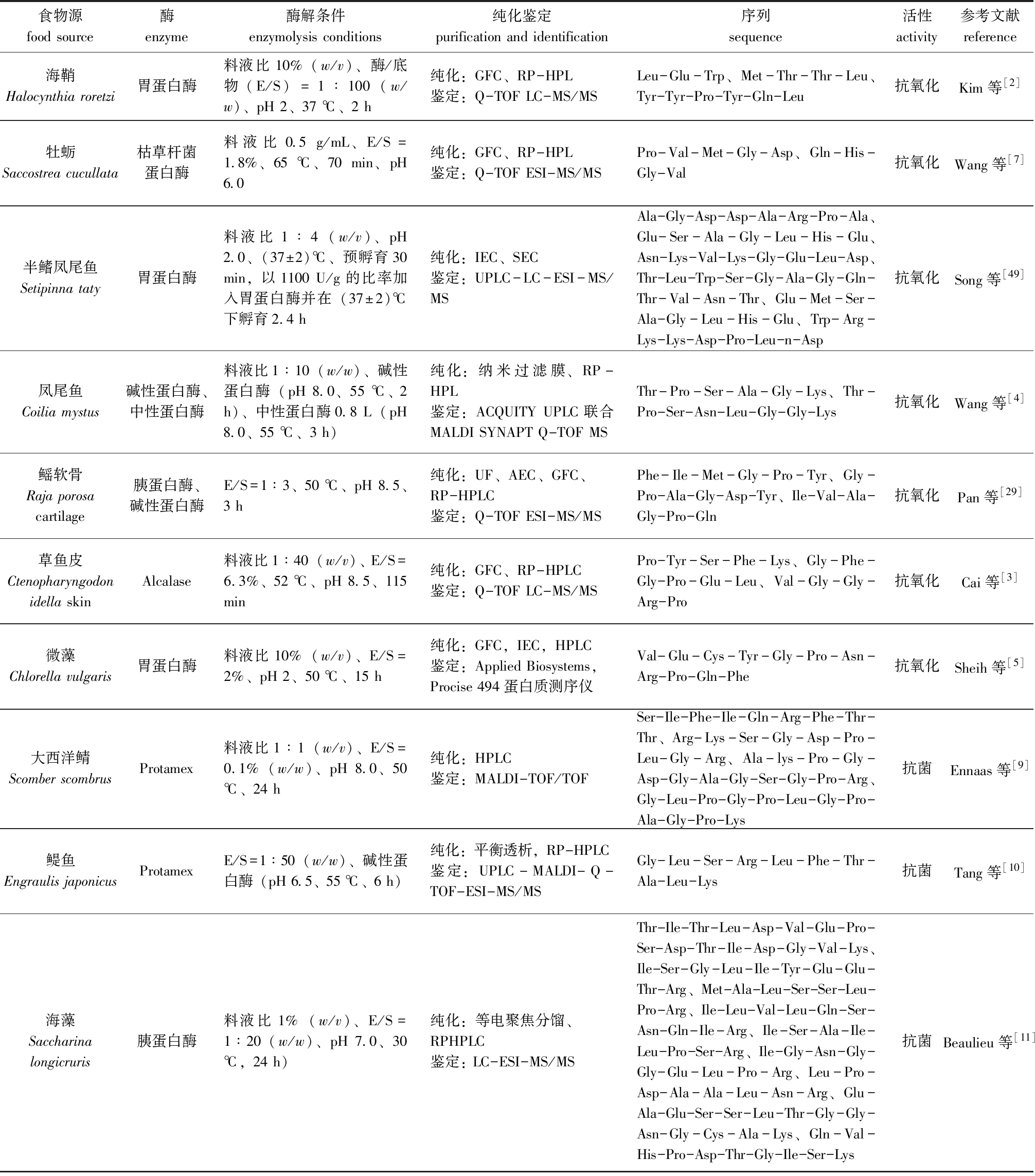
食物源food source酶enzyme酶解条件enzymolysis conditions纯化鉴定purification and identification序列sequence活性activity参考文献reference海鞘Halocynthia roretzi胃蛋白酶料液比10% (w/v)、酶/底物(E/S)=1∶100(w/w)、pH 2、37 ℃、2 h纯化:GFC、RP-HPL鉴定:Q-TOF LC-MS/MSLeu-Glu-Trp、Met-Thr-Thr-Leu、Tyr-Tyr-Pro-Tyr-Gln-Leu抗氧化Kim等[2]牡蛎Saccostrea cucullata枯草杆菌蛋白酶料液比0.5 g/mL、E/S=1.8%、65 ℃、70 min、pH 6.0纯化:GFC、RP-HPL鉴定:Q-TOF ESI-MS/MSPro-Val-Met-Gly-Asp、Gln-His-Gly-Val抗氧化Wang等[7]半鳍凤尾鱼Setipinna taty胃蛋白酶料液比1∶4(w/v)、pH 2.0、(37±2)℃、预孵育30 min,以1100 U/g的比率加入胃蛋白酶并在(37±2)℃下孵育2.4 h纯化:IEC、SEC鉴定:UPLC-LC-ESI-MS/MSAla-Gly-Asp-Asp-Ala-Arg-Pro-Ala、Glu-Ser-Ala-Gly-Leu-His-Glu、Asn-Lys-Val-Lys-Gly-Glu-Leu-Asp、Thr-Leu-Trp-Ser-Gly-Ala-Gly-Gln-Thr-Val-Asn-Thr、Glu-Met-Ser-Ala-Gly-Leu-His-Glu、Trp-Arg-Lys-Lys-Asp-Pro-Leu-n-Asp抗氧化Song等[49]凤尾鱼Coilia mystus碱性蛋白酶、中性蛋白酶料液比1∶10(w/w)、碱性蛋白酶(pH 8.0、55 ℃、 2 h)、中性蛋白酶0.8 L(pH 8.0、55 ℃、3 h)纯化:纳米过滤膜、RP-HPL鉴定:ACQUITY UPLC联合MALDI SYNAPT Q-TOF MSThr-Pro-Ser-Ala-Gly-Lys、Thr-Pro-Ser-Asn-Leu-Gly-Gly-Lys抗氧化Wang等[4]鳐软骨Raja porosacartilage胰蛋白酶、碱性蛋白酶E/S=1∶3、50 ℃、pH 8.5、3 h纯化:UF、AEC、GFC、RP-HPLC鉴定:Q-TOF ESI-MS/MSPhe-Ile-Met-Gly-Pro-Tyr、Gly-Pro-Ala-Gly-Asp-Tyr、Ile-Val-Ala-Gly-Pro-Gln抗氧化Pan等[29]草鱼皮Ctenopharyngodon idella skinAlcalase料液比1∶40(w/v)、 E/S=6.3%、52 ℃、pH 8.5、115 min纯化:GFC、RP-HPLC鉴定:Q-TOF LC-MS/MSPro-Tyr-Ser-Phe-Lys、Gly-Phe-Gly-Pro-Glu-Leu、Val-Gly-Gly-Arg-Pro抗氧化Cai等[3]微藻Chlorella vulgaris胃蛋白酶料液比10%(w/v)、E/S=2%、pH 2、50 ℃、15 h纯化:GFC,IEC,HPLC鉴定:Applied Biosystems,Procise 494蛋白质测序仪Val-Glu-Cys-Tyr-Gly-Pro-Asn-Arg-Pro-Gln-Phe抗氧化Sheih等[5]大西洋鲭Scomber scombrusProtamex料液比1∶1(w/v)、E/S=0.1%(w/w)、pH 8.0、50 ℃、24 h纯化:HPLC鉴定:MALDI-TOF/TOFSer-Ile-Phe-Ile-Gln-Arg-Phe-Thr-Thr、Arg-Lys-Ser-Gly-Asp-Pro-Leu-Gly-Arg、Ala-lys-Pro-Gly-Asp-Gly-Ala-Gly-Ser-Gly-Pro-Arg、Gly-Leu-Pro-Gly-Pro-Leu-Gly-Pro-Ala-Gly-Pro-Lys抗菌Ennaas等[9]鳀鱼Engraulis japonicusProtamexE/S=1∶50(w/w)、碱性蛋白酶(pH 6.5、55 ℃、6 h)纯化:平衡透析,RP-HPLC鉴定:UPLC-MALDI-Q-TOF-ESI-MS/MSGly-Leu-Ser-Arg-Leu-Phe-Thr-Ala-Leu-Lys抗菌Tang等[10]海藻Saccharina longicruris胰蛋白酶料液比1%(w/v)、E/S=1∶20(w/w)、pH 7.0、30 ℃,24 h)纯化:等电聚焦分馏、RPHPLC鉴定: LC-ESI-MS/MSThr-Ile-Thr-Leu-Asp-Val-Glu-Pro-Ser-Asp-Thr-Ile-Asp-Gly-Val-Lys、Ile-Ser-Gly-Leu-Ile-Tyr-Glu-Glu-Thr-Arg、Met-Ala-Leu-Ser-Ser-Leu-Pro-Arg、Ile-Leu-Val-Leu-Gln-Ser-Asn-Gln-Ile-Arg、Ile-Ser-Ala-Ile-Leu-Pro-Ser-Arg、Ile-Gly-Asn-Gly-Gly-Glu-Leu-Pro-Arg、Leu-Pro-Asp-Ala-Ala-Leu-Asn-Arg、Glu-Ala-Glu-Ser-Ser-Leu-Thr-Gly-Gly-Asn-Gly-Cys-Ala-Lys、Gln-Val-His-Pro-Asp-Thr-Gly-Ile-Ser-Lys抗菌Beaulieu等[11]
综上所述,不同的蛋白酶具有不同的酶切位点,其剪切蛋白后可产生不同氨基酸序列的肽段,从而具有不同的生物活性。因此,可根据不同的原料、不同的制备目的,选择其最适合的酶或酶组合来制备具有特定活性的目标肽。
1.2 生物活性肽的纯化及鉴定
蛋白质经过酶解后获得的酶解产物中包含许多不同分子量大小的肽段,经过逐步的分离纯化后可获得生物活性较高的目标肽段。通常使用超滤(ultrafiltration,UF)对酶解产物中不同分子量大小的组分进行初步的分离,利用离子交换色谱(ion-exchange chromatography,IEC)或凝胶色谱(gel filtration chromatography,GFC)对超滤后显示出最高活性的组分进行二次分离,最后使用反相高效液相色谱(reversed phase high performance liquid chromatography,RP-HPLC)对活性最高的组分进行鉴定前的纯化。此外,在制备矿物质离子结合活性肽时还需经过固定化金属亲和层析色谱(immobilized metal affinity chromatography,IMAC),进而获得具有特定离子结合活性的肽段。纯化出目标肽段后需对其进行氨基酸序列的鉴定及肽链结构的表征,以便于日后对其进行化学合成以实现目标肽产品的产业化。研究时通常利用质谱法(mass Spectrometry,MS)对未知肽链进行氨基酸序列的鉴定,利用核磁共振(nuclear magnetic resonance,NMR)、紫外光谱(ultraviolet-visible spectroscopy,UV-vis)、傅立叶红外光谱(fourier transform infrared spectroscopy,FTIR)等对肽链进行结构分析。在分离目标活性多肽及鉴定肽链的氨基酸序列和结构特征时,需将上述多个方法联合使用。例如,有研究利用GFC、RP-HPLC和Q-TOF LC-MS/MS(液相色谱-串联质谱)分别从海鞘[2]、牡蛎[7]、鳐Raja porosa软骨[29]和草鱼皮[3]蛋白水解物中分离鉴定出抗氧化肽。利用UF、IEC、GFC、RP-HPLC和Milligen 6600蛋白质测序仪分别从菲律宾蛤仔[16]和贻贝[21]蛋白水解物中分离鉴定出抗癌肽和免疫调节肽。利用羟基磷灰石色谱(hydroxyapatite chromatography,HAC)、IMAC、GFC、RP-HPLC及LC-ESI-MS/MS(liquid chromatography electrospray ionisation tandem mass spectrometry,液相色谱电离串联质谱)分别从南极磷虾[23]、牡蛎[24]、阿拉斯加鳕鱼皮[30]、鳀肌肉[25]等蛋白水解物中分离鉴定出钙、锌、铁结合活性肽。
2 水产蛋白源生物活性肽的功能分类
2.1 抗氧化肽
生物分子的氧化是一种自由基介导的氧化反应,在需氧生物的氧代谢过程中不可避免地形成有害自由基,如超氧阴离子和羟基与身体中的其他基团或物质迅速反应,导致细胞或组织损伤,进而造成疾病发生[2]。目前,有许多研究表明,蛋白多肽是潜在且优良的食品抗氧化添加剂。从海鞘(Leu-Glu-Trp,相对分子质量为446.23;Met-Thr-Thr-Leu,相对分子质量为464.18;Tyr-Tyr-Pro-Tyr-Gln-Leu,相对分子质量为845.41)[2]、牡蛎(Pro-Val-Met-Gly-Asp,相对分子质量为518;Gln-His-Gly-Val,相对分子质量为440)[7]、凤尾鱼(Thr-Pro-Ser-Ala-Gly-Lys,相对分子质量为559)[4]、草鱼皮(Pro-Tyr-Ser-Phe-Lys,相对分子质量为640.74;Gly-Phe-Gly-Pro-Glu-Leu,相对分子质量为618.89;Val-Gly-Gly-Arg-Pro,相对分子质量为484.56)[3]、微藻(Val-Glu-Cys-Tyr-Gly-Pro-Asn-Arg-Pro-Gln-Phe,相对分子质量为1309)[5]、黑鲨鱼皮(Pro-Gly-Gly-Thr-Met,相对分子质量为461)[6]、中华圆田螺肉Cipangopaludina cahayensis(相对分子质量<1000)[31]等蛋白水解物中鉴定出的抗氧化肽,其相对分子质量主要在400~1500。从已鉴定出的抗氧化肽氨基酸序列中总结发现,肽链富含一个或多个Leu、Pro、Val、Gly等疏水性氨基酸及Met、Trp、Phe等芳香族氨基酸。其DPPH(1,1-二苯基-2-三硝基苯肼)清除IC50值为1.29~10.00 mmol/L,羟自由基清除IC50值为2.606~6.063 mmol/L,Trolox当量等效IC50值为0.0077~0.9600 mmol/L,并具有Fe2+结合能力及亚油酸乳液体系模拟的脂质过氧化抑制能力。此外,用于测定抗氧化的指标较多,来源不同的抗氧化肽对同一指标的抗氧化能力不同,如Kim等[2]从海鞘蛋白水解物中鉴定出Leu-Glu-Trp、Met-Thr-Thr-Leu和Tyr-Tyr-Pro-Tyr-Gln-Leu 3种抗氧化肽,其中Leu-Glu-Trp对DPPH自由基的清除活性最高,Leu-Glu-Trp和Tyr-Tyr-Pro-Tyr-Gln-Leu对氧自由基清除能力高于谷胱甘肽。
因此,为了比较不同原料中抗氧化肽的总抗氧化能力,应制定统一的标准,以衡量不同原料抗氧化肽的抗氧化能力,为产业化生产抗氧化肽制剂提供依据。天然水产蛋白源抗氧化肽因其具有安全性和有效性,逐渐被视为人工合成抗氧化剂的替代品,可用于食品、制药和化妆品等行业。
2.2 抗菌肽
抗菌肽是许多生物先天免疫系统的主要成分,在保护宿主物种免受微生物入侵方面起重要作用。目前,由于细菌对抗菌药物的耐药性越来越高,寻求新型广谱性的抗菌物质已成为研究热点。研究发现,鳀(Gly-Leu-Ser-Arg-Leu-Phe-Thr-Ala-Leu-Lys, 相对分子质量为1104.66)[10]、大西洋鲭(Ser-Ile-Phe-Ile-Gln-Arg-Phe-Thr-Thr,相对分子质量为1094.7;Arg-Lys-Ser-Gly-Asp-Pro-Leu-Gly-Arg,相对分子质量为1042.5);Ala-lys-Pro-Gly-Asp-Gly-Ala-Gly-Ser-Gly-Pro-Arg,相对分子质量为1111.6;Gly-Leu-Pro-Gly-Pro-Leu-Gly-Pro-Ala-Gly-Pro-Lys,相对分子质量为1102.5)[9]、雪蟹酶解物[12]、海藻酶解物[11]、草鱼鱼鳞酶解物[32]等水产蛋白抗菌肽对金黄色葡萄球菌Staphylococcus aureus、枯草杆菌Bacillus subtilis、肺炎链球菌Streptococcus pneumoniae、大肠杆菌Escherichia coli、李斯特菌Listeria innocua、副溶血性弧菌Vibrio parahemolyticus表现出抑制生长的作用。鳀抗菌肽对金黄色葡萄球菌和枯草杆菌的抗菌能力最强,其最小抑菌浓度为16 μg/mL,对大肠杆菌和肺炎链球菌的最小抑菌浓度分别为32、64 μg/mL[10]。当肽浓度为2×105 μg/mL时,大西洋鲭抗菌肽对李斯特菌和大肠杆菌表现出完全抑制[9]。草鱼鱼鳞酶解物对金黄色葡萄球菌、沙门氏菌、副溶血性弧菌、大肠杆菌、黑曲霉、毛霉、根霉菌、酵母菌的最小抑菌浓度范围为16~64 μg/mL,表现出了广谱的抑菌活性[32]。
综上所述,通过分析抗菌肽氨基酸序列发现,肽链中主要由Gly、Pro、Ala、Ile等疏水性氨基酸及Thr、Lys等氨基酸组成,其相对分子质量一般大于1000。由于水产蛋白源抗菌肽具有广谱且有效的抗菌活性,有望成为治疗耐药性传染病的优良替代品。
2.3 降血压肽
高血压是世界范围内的流行病,影响着全球15%~20%的成年人。目前,治疗高血压相关疾病(如心力衰竭、中风、心肌梗死、糖尿病、肾病等)最有效的治疗方法是抑制肾素或血管紧张素Ⅰ转化酶(angiotensin converting enzyme,ACE)的活性。然而,目前治疗高血压的药物(卡托普利、赖诺普利等)虽然在控制高血压方面有效,但也会产生副作用[14]。天然来源的水产蛋白降血压肽由于其安全有效的优点,已逐渐成为治疗高血压研究中的热点。近年的研究发现,从大马哈鱼皮(Gly-Leu-Pro-Leu-Asn-Leu-Pro,相对分子质量为770)[14]、大西洋鲑明胶(Gly-Gly-Pro-Ala-Gly-Pro-Ala-Val;Gly-Pro-Val-Ala;Gly-Phe)[13]、比目鱼肌肉(Met-Glu-Val-Phe-Val-Pro,相对分子质量为721.2;Val-Ser-Gln-Leu-Thr-Arg,相对分子质量为703.4)[15]、扇贝(Val-Trp,相对分子质量为304.17)[33]、牡蛎酶解物(相对分子质量<3000)[34]等蛋白水解产物中可分离出降血压肽,其中源自大马哈鱼皮的降血压肽对ACE的抑制活性最高,其IC50为18.7 μmol/L,显著低于比目鱼肌肉降血压肽(IC50分别为79、105 μmol/L)、扇贝降血压肽(IC50为86.9 μmol/L)及大西洋鲑明胶降血压肽(IC50分别为673.16、445.61、178.14 μmol/L)。此外,Lineweaver-Burk图表明,水产蛋白源降血压肽可分别作为ACE的竞争性和非竞争性抑制剂,对自发性高血压大鼠使用这些肽后,其心率、收缩压、舒张压和平均动脉血压均显著降低[13-15]。目前已商业化生产的狐鲣Sarda orientalis降血压肽制剂(Leu-Lys-Pro-Asn-Met),自发性高血压大鼠口服5周后,血压降低了(11.7±1.3)mmHg,且在临床研究中似乎无任何副作用[35]。
根据上述降血压肽的氨基酸序列总结得出,降血压肽中富含Gly、Pro、Ala、Val等氨基酸,肽链相对分子质量小于1000。许多研究证明,水产蛋白源降血压肽具有显著的肾素或ACE抑制活性,可单独使用或作为药物的辅助剂用于降低血压和改善与药物相关的副作用。
2.4 抗癌肽及免疫调节肽
细胞凋亡作为程序性细胞死亡的一种形式是响应癌症疗法的主要机制之一,由于调节凋亡途径和选择性诱导细胞凋亡通常不会引起炎症或免疫反应,细胞凋亡成为癌症治疗的优选方式[36]。研究发现,水产蛋白肽,如菲律宾蛤仔(Ala-Val-Leu-Val-Asp-Lys-Gln-Cys-Pro-Asp,相对分子质量为1950)[16]、牡蛎(Leu-Ala-Asn-Ala-Lys,相对分子质量为515.29)[17]、螺旋藻(His-Val-Leu-Ser-Arg-Ala-Pro-Arg,相对分子质量为935.1)[18]、鱿鱼明胶Esperase酶解物(相对分子质量为500~1400)[28]、金钱龟Cuora trifasciata(Ser-Ser-Pro-Gly-Pro-Pro-Val-His,相对分子质量为777.39)[37]等抗癌肽,对HepG-2(人肝癌细胞)、 MCF-7/MDA-MB-231(人乳腺癌细胞)、SGC-7901(人胃腺癌细胞)、A549(人肺癌细胞)、HT-29(人结肠癌细胞)、U87(人神经胶质瘤细胞)、PC-3(前列腺癌细胞)等癌细胞表现出有效的抗增殖效果,其IC50值为0.10~1.58 mg/mL。
免疫系统在预防和控制疾病方面至关重要,许多合成型药物已被证明可用于调节人体免疫功能,然而,大多数通过微生物或化学方法合成的免疫调节药物具有毒性或副作用,这限制了其在预防和治疗慢性疾病中的用途[38]。源于波纹巴非蛤(Pro-His-Thr-Cys,相对分子质量为457;Val-Gly-Try-Thr,相对分子质量为439;Glu-Phe,相对分子质量为295;Leu-Phe,相对分子质量为279;Glu-Gly-Ala-Lys,相对分子质量为404;Trp-Leu,相对分子质量为318)[20]、阿拉斯加鳕(Asn-Gly-Met-Thr-Tyr,相对分子质量为584;Asn-Gly-Leu-Ala-Pro,相对分子质量为470;Trp-Thr,相对分子质量为305;Pro-Thr-Gly-Ala-Asp-Tyr,相对分子质量为622)[19, 39]、贻贝(Gly-Val-Ser-Leu-Leu-Gln-Gln-Phe-Phe-Leu)[21]、青蛤(Arg-Val-Ala-Pro-Glu-Glu-His-Pro-Val-Glu-Gly-Arg-Tyr-Leu-Val,相对分子质量为1750.81)[38]、鲑(Pro-Ala-Tyr,相对分子质量为349.15)[40]的水产蛋白免疫调节肽,具有多个免疫调节靶点,通过刺激脾淋巴细胞、巨噬细胞等免疫细胞的增殖,促进细胞因子(白细胞介素IL-1b、IL-2、IL-4、IL-6、环氧化酶COX-2、肿瘤坏死因子TNF-α)的表达,激活NF-κB(核因子κB)和MAPK(丝裂原活化蛋白激酶)信号通路来发挥免疫调节功能。
综上可知,抗癌肽主要由4~15个氨基酸组成,相对分子质量为500~2000,且肽链中富含Leu、Pro、Ala、Lys、Arg等氨基酸。免疫调节肽中富含一个或多个Pro、Leu、Phe、Met等疏水性氨基酸,且大多数免疫调节肽的相对分子质量小于1000。
2.5 矿物质结合活性肽
矿物质是构成人体组织和维持正常生理功能所必需的7大营养素之一,膳食矿物质的缺乏会导致许多疾病。矿物质结合活性肽是指具有结合矿物质离子活性的肽类物质,其与矿物质离子结合后,可促进或增强矿物质离子在肠道中的生物利用度。从南极磷虾[23]、太平洋鳕鱼骨[41]的酶解产物中可分别纯化鉴定出钙离子结合活性肽Val-Leu-Gly-Tyr-Ile-Gln-Ile-Arg(相对分子质量为960.58)、Lys-Gly-Asp-Pro-Gly-Leu-Ser-Pro-Gly-Lys(相对分子质量为954.5)。从牡蛎[24]、阿拉斯加鳕鱼皮[22]蛋白水解物中可分别纯化鉴定出锌离子结合活性肽His-Leu-Arg-Gln-Glu-Glu-Lys-Glu-Glu-Val-Thr-Val-Gly- Ser-Leu-Lys(相对分子质量为1882.0)、Gly-Pro-Ala-Gly-Pro-His-Gly-Pro-Pro-Gly(相对分子质量为842)。从阿拉斯加鳕鱼皮[30]、鳀鱼肌肉[25]蛋白水解物中可分别纯化鉴定出铁离子结合活性肽Ser-Cys-His(相对分子质量为305)、Glu-Leu-Glu-Gly-Glu-Val-Asp-Ala-Glu-Gln-Lys(相对分子质量为7593.90)、Glu-Gln-Asp-Thr-Ser-Ala- His-Leu-Glu-Arg-Met-Lys(相对分子质量为8105.95)。
Caco-2细胞试验表明,从阿拉斯加鳕鱼皮[42]、鳀[43]、海参Stichopus japonicus卵子[44]等水产蛋白中制备分离的矿物质结合活性肽在Caco-2细胞模型中均显示出可增加钙、锌、铁等矿物离子的摄取,促进矿物质离子的转运,进而提高矿物质离子的吸收率。此外,动物试验表明,从罗非鱼鳞片蛋白[45]中制备的钙离子结合活性肽可显著增加大鼠幼崽股骨中骨矿物质的密度、股骨钙含量及血清钙值,增强小肠对钙的吸收。鸭蛋蛋白肽-Fe2+结合物(DPs-Fe2+)[46]及三肽铁(Arg-Glu-Glu-Fe2+)[47]均可使缺铁性贫血大鼠的体质量、器官系数和血液学参数恢复到正常水平(P<0.05),并调节细胞顶膜的Fe2+转运蛋白(divalent metal transporter 1,DMT1)、细胞基底膜的铁蛋白转运蛋白(ferroportin 1,FPN1)及铁离子调节蛋白(Hepcidin)表达,这表明DPs-Fe2+和Arg-Glu-Glu-Fe2+均可作为潜在的Fe2+补充剂。鳕骨骼蛋白肽-Fe2+结合物[48]可使缺铁性贫血大鼠的体质量、身高和血液参数恢复到正常水平,与FeSO4相比,鳕骨骼蛋白肽-Fe2+结合物显著增加了缺铁性贫血大鼠体质量,并有效改善血红蛋白、血清铁离子和转铁蛋白水平,还可恢复铁离子与转铁蛋白的结合能力。
续表1 水产蛋白源生物活性肽
Cont.Tab.1 Bioactive peptides derived from fishery proteins

食物源food source酶enzyme酶解条件enzymolysis conditions纯化鉴定purification and identification序列sequence活性activity参考文献reference雪蟹Chionoecetes opilioProtamex料液比1∶2(w/v)、E/S =1∶1(v/w)、40 ℃、1 h纯化:固相萃取(SPE)鉴定:RP-HPLC联合LC-MS/MSPhe-Ala-Pro-Thr-Gly-Pro-Thr-Thr-Glu-Val-Lys-Ser、Ala-Ala-Ile-Glu-Glu-Gly-Ile-Val-Pro-Gly-Gly-Gly-Val-Ala-Leu抗菌El等[12]大西洋鲑明胶Salmo salargelatin胃蛋白酶、Corolase PP料液比2%(w/v)、胃蛋白酶(E/S=1%(w/w)、pH 2.0、37 ℃、1.5 h)、Coro-lase PP(E/S=2.5%(w/w)、pH 7.5、37 ℃、2.5 h)纯化:RP-HPLC鉴定:UPLC-ESI-MS/MSGly-Gly-Pro-Ala-Gly-Pro-Ala-Val、Gly-Pro-Val-Ala、Pro-Pro、Gly-Phe降血压Neves等[13]大马哈鱼皮 Oncorhynchus keta skin胰蛋白酶E/S=1∶100(w/w)、37 ℃、pH 7.0、12 h纯化:GFC、RP-HPLC鉴定:Q-TOF LC-MS/MSGly-Leu-Pro-Leu-Asn-Leu-Pro降血压Lee等[14]牙鲆肌肉Paralichthys olivaceus muscle胃蛋白酶料液比1∶20(w/v)、E/S=1∶100(w/w)、50 ℃、pH 2.0、18 h纯化:UF、GFC、RP-HPLC鉴定:Q-TOF ESI-MS/MSMet-Glu-Val-Phe-Val-Pro、Val-Ser-Gln-Leu-Thr-Arg降血压Ko等[15]菲律宾蛤仔Ruditapes philippinarumα-胰凝乳蛋白酶料液比2%(w/v)、40 mg酶、pH 7.0、37 ℃、8 h纯化:UF、IEC、RP-HPLC鉴定: Milligen 6600蛋白质测序仪Ala-Val-Leu-Val-Asp-Lys-Gln-Cys-Pro-Asp抗癌、抗肿瘤Kim等[16]牡蛎Saccostrea cucullata蜡状芽孢杆菌SU12产生的蛋白酶E/S=1%(w/w)、40 ℃、pH 7.0、4 h纯化:GFC、UPLC鉴定:Q-TOF LC-MS/MSLeu-Ala-Asn-Ala-Lys抗肿瘤Umayaparvathi等[17]钝顶螺旋藻Spirulina platensis胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶料液比3%、胃蛋白酶(E/S=6%(w/w)、37 ℃、pH 2.0、2 h)、胰蛋白酶(E/S=3%、37 ℃、pH 8.0、3 h)、胰凝乳蛋白酶(E/S=5%、37 ℃、pH 8.0、3 h)纯化:UF、GFC鉴定:MALDI-TOF-MS/MSHis-Val-Leu-Ser-Arg-Ala-Pro-Arg抗癌Wang等[18]阿拉斯加鳕鱼骨Eleginus gracilis bone胰蛋白酶料液比25 g/L、E/S=24 U/mg、50 ℃、pH 8、290 min纯化:IEC、GFC、RP-HPLC鉴定:Q-TOF-ESI-MS/MSAsn-Gly-Met-Thr-Tyr、Asn-Gly-Leu-Ala-Pro、Trp-Thr、Pro-Thr-Gly-Ala-Asp-Tyr免疫调节Hou等[19,39]波纹巴非蛤Paphia undulata碱性蛋白酶料液比1∶3(w/v)、E/S=4.321 U/g、51 ℃、3.14 h纯化:UF、GFC、RP-HPLC鉴定:ESI-MS/MSPro-His-Thr-Cys、Val-Gly-Try-Thr、Glu-Phe、Leu-Phe、Glu-Gly-Ala-Lys、Trp-Ile、Trp-Leu免疫调节He等[20]贻贝Mytilus coruscus风味酶料液比1∶50(w/v)、E/S=1∶50(w/w)、52 ℃、pH 7.0、1.5 h纯化:UF、IEC、GFC、RP-HPLC鉴定:Milligen 6600蛋白质测序仪Gly-Val-Ser-Leu-Leu-Gln-Gln-Phe-Phe-Leu免疫调节Kim等[21]阿拉斯加鳕鱼皮Eleginus gracilisskin胰蛋白酶E/S=0.6% (w/w)、pH 8.0、37 ℃、6 h纯化:IMAC、GFC-FPLC、RP-HPLC鉴定:LC-ESI-MS/MSGly-Pro-Ala-Gly-Pro-His-Gly-Pro-Pro-Gly结合钙、锌、铁Cuo等[22]太平洋鳕鱼骨Gadus macrocephacusbone胰蛋白酶、中性蛋白酶料液比1∶40(w/v)、胰蛋白酶∶中性蛋白=1∶1、E/S=1∶100(w/w)、50 ℃、pH 7.2、8 h纯化:羟基磷灰石色谱(HAC)、RP-HPLC鉴定:LC-ESI-MS/MSLys-Gly-Asp-Pro-Gly-Leu-Ser-Pro-Gly-Lys结合钙Zhang等[41]南极磷虾Euphausia superba胰蛋白酶料液比1∶2(w/v)、E/S=2%(w/w)、50 ℃、pH 8、4 h纯化:羟基磷灰石色谱(HAC)、SEC、RP-HPLC鉴定:LTQ Orbitrap XLVal-Leu-Gly-Tyr-Ile-Gln-Ile-Arg结合钙Hou等[23]牡蛎Saccostrea cucullata胃蛋白酶料液比1∶3(w/v)、E/S=1.5∶100(w/w)、40 ℃、pH 1.5、5 h纯化:IMAC-Zn2+、RP-HPLC鉴定:LC/LTQHis-Leu-Arg-Gln-Glu-Glu-Lys-Glu-Glu-Val-Thr-Val-Gly-Ser-Leu-Lys结合锌Chen等[24]阿拉斯加鳕鱼皮Eleginus gracilisskin胰蛋白酶E/S=0.6% (w/w)、pH 8.0、37 ℃、6 h纯化:IMAC-Fe2+、GFC-FPLC、RP-HPLC鉴定:LC-ESI-MS/MSSer-Cys-His结合铁Guo等[30]太平洋鳕鱼皮Gadus macrocephacus skin胰蛋白酶E/S=4% (w/w)、pH 7.5、37 ℃、4 h纯化:IMAC-Fe2+、RP-HPLC鉴定:UPLC -LC-ESI-MS/MSGly-Pro-Ala-Gly-Pro-His-Gly-Pro-Pro-Gly-Lys-Asp-Gly-Arg、Ala-Gly-Pro-His-Gly-Pro-Pro-Gly-Lys-Asp-Gly-Arg、Ala-Gly-Pro-Ala-Gly-Pro-Ala-Gly-Ala-Arg结合铁Wu等[50]鳀鱼肌肉Engraulis japonicus muscle胰蛋白酶E/S=4∶100(w/w)、37 ℃、pH 8.0、4 h纯化:SEC、IMAC-Fe3+、RP-HPLC鉴定:MALDI TOF/TOFGlu-Leu-Glu-Gly-Glu-Val-Asp-Ala-Glu-Gln-Lys、Glu-Gln-Asp-Thr-Ser-Ala-His-Leu-Glu-Arg-Met-Lys结合铁Wu等[25]
分析钙、锌、铁离子结合活性肽氨基酸序列发现,其肽链中基本含有Gly、Pro、His等氨基酸,且低分子量(相对分子质量<1000)和高分子量(相对分子质量>1000)肽均可结合矿物质离子。
3 生物活性肽的结构特征
3.1 分子量
不同的原料根据不同的制备目的,会利用不同的酶进行水解,由于水解度不同,会产生不同分子量大小的肽段。研究表明,大多数抗氧化肽含有2~20个氨基酸残基,相对分子质量为400~1500。源自草鱼皮蛋白水解物的3种抗氧化肽,其相对分子质量分别为640.74、618.89和484.56[3]。从鳐软骨蛋白水解物中分离鉴定的3种抗氧化肽,其相对分子质量分别为726.90、578.58和583.69[29]。对海鞘[2]、牡蛎[7]、凤尾鱼鱼粉[4]、草鱼皮[3]、鲣Katsuwonus pelamis肌肉[51]、鳐软骨[29]等蛋白水解物的抗氧化活性研究均表明,小分子量组分的抗氧化活性高于大分子量的组分,其原因可能是较小分子量的肽与自由基的反应更充分更完全。与此相似,在抗癌活性中,小分子量的肽显示出更高的抗癌活性,这是因为小分子量的肽比大分子量的肽具有更高的分子迁移率和扩散性,可改善与癌细胞的相互作用,增强抗癌能力[52]。而大多数鉴定出的抗菌肽,其相对分子质量基本在1000以上。Beaulieu等[11]研究发现,大分子量的海藻水解产物(相对分子质量>10 000)对金黄色葡萄球菌具有显著的抑菌活性。此外,在鲢蛋白水解物中,由其最大分子量的组分而制备的肽-锌结合物对大肠杆菌和金黄色葡萄球菌具有最高的抗菌活性[53]。在带鱼蛋白水解物中,由其分子量最大的多肽制备的肽-Fe2+复合物显示出最高的抗菌活性[54]。在矿物质结合活性肽中,小分子量(<1000)和大分子量(>1000)的肽均可结合矿物质离子。从阿拉斯加鳕鱼皮水解物中分离鉴定出的铁离子结合活性肽,其相对分子质量为345[30],而从鳀鱼肌肉蛋白水解物中分离鉴定出的铁离子结合活性肽的相对分子质量分别为7594、8106[25]。
综上所述,不同原料、不同制备条件获得的同一活性肽具有相似的分子量,且抗氧化肽、降血压肽、抗癌肽和免疫调节肽的分子量一般较小,而抗菌肽主要是大分子量肽,在矿物质结合活性肽中既有小分子量(<1000)肽,也有大分子量(>1000)肽。
3.2 氨基酸组成
多肽链由两个及两个以上的氨基酸组成,其生物活性与其氨基酸的组成及含量密切相关。氨基酸的组成是抗氧化活性的关键因子,研究表明,大多数抗氧化肽、降血压肽、抗癌/抗肿瘤肽和免疫调节肽富含Pro、Trp、Phe、Leu、Gly、Val等疏水性氨基酸及Tyr、Phe、Trp等芳香族氨基酸;抗菌肽中富含疏水性氨基酸Gly、Ala、Pro及酸性氨基酸Glu;矿物质结合肽中富含Gly、His、Glu、Ala、Pro等氨基酸。如从草鱼皮蛋白酶解物中纯化的抗氧化肽,Trp、Tyr和Phe对自由基清除有较大贡献[3],源自凤尾鱼鱼粉[4]的抗氧化肽,其肽序列中的疏水性氨基酸残基(如Pro、Leu、Ala、Gly)通过提供电子或供体电子来稳定活性自由基。芳香族氨基酸残基可作为氢供体,并抑制自由基介导的过氧化链反应,含有更多苯丙氨酸的肽链显示出较强的抗氧化活性[51]。肽的支链氨基酸(Val、Leu和Ile)和非极性脂肪族氨基酸(Leu和Ala)对肽的抗氧化活性也有较大贡献[55]。酪氨酸、色氨酸和苯丙氨酸残基的电子致密芳环有助于与促氧化金属离子的结合,增强抗氧化活性[56]。富含甘氨酸残基的高疏水性肽可结合富含脂多糖的疏水性细菌膜,进而具有更高的抗菌活性[57]。通过分析源自鲢抗菌肽的氨基酸组分后发现,含有更多酸性氨基酸(如Glu和Asp)的肽在其复合物中显示出更多的锌结合含量,且羧基(包括羰基)是肽链中锌离子的主要结合位点[53]。此外,纯化的具有最高抗菌活性的带鱼蛋白肽-Fe2+复合物富含Glu、Asp和Ala[54]。有研究报道,许多ACE抑制肽含有色氨酸、亮氨酸、甲硫氨酸、酪氨酸和苯丙氨酸,这些氨基酸羧基末端含有芳香族或疏水性氨基酸,在ACE抑制活性中起重要作用[14]。与此相似,免疫调节肽中最常见残基也是疏水性氨基酸(如Val、Leu、Pro、Phe等),已有研究证明,疏水性氨基酸、谷氨酰胺、谷氨酸、酪氨酸、色氨酸、半胱氨酸、天冬酰胺和天冬氨酸的一个或多个残基促进肽的免疫调节活性[20]。Jacquot等[58]报道,带有2~3个正电荷的较长疏水性肽具有更强的刺激小鼠脾细胞增殖的潜力。免疫调节肽通过与靶细胞表面上的特异性受体结合调节先天性和适应性免疫应答[59]。此外,肽链中的几种氨基酸残基和基团(如羧基,磺基-氢基,负电荷和离子键)在多肽链发挥其生物活性中起着重要作用。在矿物质结合活性肽中,其结合能力与肽链中Asp和Glu的羧基及His咪唑的富氮基团有关[60]。罗非鱼蛋白的钙结合活性肽Trp-Glu-Trp-Leu-His-Tyr-Trp中Glu的羧基和His的咪唑基团决定钙离子的结合[61]。研究发现:Leu-Ala-Asn中的Asn、肽亚氨基和羰基的羧酸酯基团可以参与锌的配位[62];亲水性肽的锌螯合物似乎比疏水性质的螯合物具有更高的抗细菌活性,且羧基(包括羰基)是合成肽中锌离子的主要结合位点[53];铁离子结合的主要位点对应于羧酸盐基团,且在较小程度上对应于肽键[63] ;磺基-氢基参与肌肉蛋白肽结合铁,肽中Cys残基与铁的结合也受到邻近或相邻残基的影响,而组氨酰残基有助于铁结合,促进肌肉组织的铁吸收[64]。
4 生物活性肽的作用机制
不同的生物活性肽具有不同的分子量、氨基酸组成和空间结构,并通过不同的分子作用机制发挥其生物活性。
抗氧化肽Phe-Pro-Leu-Pro-Ser-Phe中Leu残基在自由基清除过程起着至关重要的作用,当用Ala取代Leu时,该肽的自由基清除能力和细胞保护作用几乎丧失,且该肽可以增加PI3K(胞内磷脂酰肌醇激酶)、Akt(蛋白激酶B)、磷酸化Akt、mTOR(哺乳动物雷帕霉素靶蛋白)、磷酸化mTOR等蛋白表达水平,表明肽Phe-Pro-Leu-Pro-Ser-Phe通过PI3K/Akt/mTOR信号传导途径建立了保护氧化损伤和促进细胞存活的潜在机制[65]。
从鲃蛋白水解物中分离出的抗菌肽在与细菌细胞膜作用过程中,通过增加膜的通透性,释放细胞内的K+,诱导膜损伤机制,进而对李斯特菌显示出显著的抗菌活性[66]。章鱼小肽(OSP)与Zn2+结合后形成的OSP-Zn结合物对大肠杆菌表现出显著的抗菌能力,OSP-Zn通过破坏细胞膜结构和氧化应激介导的细胞凋亡途径发挥抗菌作用[67]。
利用分子对接技术研究降血压肽Leu-Pro-Glu-Ser- Val-His-Leu-Asp-Lys(LL-9)、Val-Leu-Ser-Thr-Ser-Phe-Pro-Pro-Lys(VL-9)对AEC抑制作用的分子机制,结果发现,肽氨基酸残基通过与ACE氨基酸残基间的氢键、疏水力、范德华力及静电作用与ACE结合,VL-9通过结合ACE的S2(His513、His353、Glu281)和S′1(Glu162)活性位点,而LL-9通过结合AEC的S1(Thr345)和S2(Tyr520)、Lys511、Gln281活性位点,肽VL-9、LL-9通过与ACE活性位点的有效相互作用抑制其活性,进而起到降血压的作用[68]。
抗癌肽对癌细胞具有高选择性而优先结合到含有负电荷和高流动性的细胞外膜,改变癌细胞的细胞膜通透性,此外,还可通过线粒体途径和死亡受体途径诱导癌细胞的程序性细胞死亡,从而起到抗癌的作用[69]。
免疫调节肽中,富含酸性氨基酸且分子量较大的肽链可增加细胞免疫因子IFN-γ(γ-干扰素)的分泌,而小分子量肽通过刺激单核细胞分泌TNF-α进而起到免疫调节的作用[59]。
矿物质结合活性肽中,铁离子结合活性肽结合铁离子后可提高铁离子在肠道中的溶解度,肽-铁结合物通过肽转运途径将铁离子转入细胞内,或肽-铁结合物中的铁离子经胞膜上的铁离子通道进入细胞内,进而提高肠道铁离子的吸收[43]。此外,乳清蛋白浓缩物-铁(WPC-Fe)结合物可增加雄性贫血断奶大鼠血清中的血红蛋白、铁蛋白和转铁蛋白的水平,促进铁离子的转运[70]。
综上所述,不同功能活性的水产蛋白肽通过不同的作用机制发挥其独特的生理活性。
5 存在问题及展望
水产蛋白源生物活性肽在肠道消化期间保持可溶且呈电中性,转运入胞内消耗能量少,转运速度快,载体不易饱和,生理功效明显,安全性高,来源丰富(如可利用低值鱼、虾、贝、藻及其加工副产物等为原料),且其在细胞模型或动物模型中的各类生物活性已得到试验性证实,因此,具有作为人体膳食补充剂的强大潜力,在功能性食品成分和配料领域具有广阔应用前景。如抗氧化肽可用于化妆品中,降血压肽可用于替代具有副作用的降血压药物,抗癌/抗肿瘤肽可用于癌症的预防与治疗,促矿物质吸收肽可作为矿物质缺乏人群的膳食矿物质补充剂等。目前,国外已经有工业化生产并销售的水产活性肽,如利用日本沙丁鱼制备的降血压活性肽饮料等。随着研究的深入,以水产蛋白为原料制备生物活性肽将具有广阔的应用前景。
尽管以水产蛋白为原料制备功能性食品已有不少研究,但绝大多数研究仅限于试验基础上的成果,在这些功能性产品商品化生产前,还需对其生物利用度、与不同食品基质的相容性、长期稳定性和体内效率等进行更多研究,主要包括以下几个方面。
(1) 对于抗氧化肽,目前大多只研究其对体外自由基的清除能力,以及亚油酸乳液体系模拟的脂质过氧化的抑制能力,而关于体内抗氧化效果的研究报道相对较少,且抗氧化肽在人体内的安全性评价亟须进一步研究。
(2) 降血压肽、抗肿瘤肽、免疫调节肽及矿物质离子结合肽应重点探究其在胃肠道消化过程中的耐消化性能力及相关的稳态化保护技术,同时对肽进入靶细胞的细胞通路/途径,以及肽在细胞中发挥生理作用的机制等方面开展研究。
(3) 探明目标肽剂量与生理效应间的关系,需开展更多相关的营养和代谢组学研究。
(4) 活性肽产品在商业化之前需评估肽产品的临床安全性,研究不同加工条件及食品辅料对目标肽结构和功能的影响,从而保障其生物活性。
[1] Guo Lidong,Harnedy P A,Li Bafang,et al.Food protein-derived chelating peptides:biofunctional ingredients for dietary mineral bioavailability enhancement[J].Trends in Food Science & Technology,2014,37(2):92-105.
[2] Kim S S,Ahn C B,Moon S W,et al.Purification and antioxidant activities of peptides from sea squirt (Halocynthia roretzi) protein hydrolysates using pepsin hydrolysis[J].Food Bioscience,2018,25:128-133.
[3] Cai Luyun,Wu Xiaosa,Zhang Yuhao,et al.Purification and characterization of three antioxidant peptides from protein hydrolysate of grass carp (Ctenopharyngodon idella) skin[J].Journal of Functional Foods,2015,16:234-242.
[4] Wang Limei,Sun Jiang,Ding Shuhui,et al.Isolation and identification of novel antioxidant and antimicrobial oligopeptides from enzymatically hydrolyzed anchovy fish meal[J].Process Biochemistry,2018,74:148-155.
[5] Sheih I C,Wu T K,Fang T J.Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation systems[J].Bioresource Technology,2009,100(13):3419-3425.
[6] 颜阿娜,陈声漾,陈旭,等.一种新型抗氧化五肽的纯化、鉴定与表征[J].食品科学,2019,40(10):43-49.
[7] Wang Qiukuan,Li Wei,He Yunhai,et al.Novel antioxidative peptides from the protein hydrolysate of oysters (Crassostrea talienwhanensis)[J].Food Chemistry,2014,145:991-996.
[8] 杨大俏,王锦旭,李来好,等.近江牡蛎膜分离联产制备多糖多肽及其功能特性研究[J].大连海洋大学学报,2020,35(1):126-133.
[9] Ennaas N,Hammami R,Beaulieu L,et al.Purification and characterization of four antibacterial peptides from protamex hydrolysate of Atlantic mackerel (Scomber scombrus) by-products[J].Biochemical and Biophysical Research Communications,2015,462(3):195-200.
[10] Tang Wenting,Zhang Hui,Wang Li,et al.Targeted separation of antibacterial peptide from protein hydrolysate of anchovy cooking wastewater by equilibrium dialysis[J].Food Chemistry,2015,168:115-123.
[11] Beaulieu L,Bondu S,Doiron K,et al.Characterization of antibacterial activity from protein hydrolysates of the macroalga Saccharina longicruris and identification of peptides implied in bioactivity[J].Journal of Functional Foods,2015,17:685-697.
[12] El Menif E,Offret C,Labrie S,et al.Identification of peptides implicated in antibacterial activity of snow crab hepatopancreas hydrolysates by a bioassay-guided fractionation approach combined with mass spectrometry[J].Probiotics and Antimicrobial Proteins,2019,11(3):1023-1033.
[13] Neves A C,Harnedy P A,O’Keeffe M B,et al.Peptide identification in a salmon gelatin hydrolysate with antihypertensive,dipeptidyl peptidase IV inhibitory and antioxidant activities[J].Food Research International,2017,100:112-120.
[14] Lee J K,Jeon J K,Byun H G.Antihypertensive effect of novel angiotensin I converting enzyme inhibitory peptide from chum salmon (Oncorhynchus keta) skin in spontaneously hypertensive rats[J].Journal of Functional Foods,2014,7:381-389.
[15] Ko J Y,Kang N,Lee J H,et al.Angiotensin I-converting enzyme inhibitory peptides from an enzymatic hydrolysate of flounder fish (Paralichthys olivaceus) muscle as a potent anti-hypertensive agent[J].Process Biochemistry,2016,51(4):535-541.
[16] Kim E K,Kim Y S,Hwang J W,et al.Purification and characterization of a novel anticancer peptide derived from Ruditapes philippinarum[J].Process Biochemistry,2013,48(7):1086-1090.
[17] Umayaparvathi S,Meenakshi S,Vimalraj V,et al.Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster (Saccostrea cucullata)[J].Biomedicine & Preventive Nutrition,2014,4(3):343-353.
[18] Wang Zhujun,Zhang Xuewu.Isolation and identification of anti-proliferative peptides from Spirulina platensis using three-step hydrolysis[J].Journal of the Science of Food and Agriculture,2017,97(3):918-922.
[19] Hou Hu,Fan Yan,Li Bafang,et al.Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J].Food Chemistry,2012,134(2):821-828.
[20] He Xiaoqing,Cao Wenhong,Pan Guangkun,et al.Enzymatic hydrolysis optimization of Paphia undulata and lymphocyte proliferation activity of the isolated peptide fractions[J].Journal of the Science of Food and Agriculture,2015,95(7):1544-1553.
[21] Kim E K,Kim Y S,Hwang J W,et al.Purification of a novel nitric oxide inhibitory peptide derived from enzymatic hydrolysates of Mytilus coruscus[J].Fish & Shellfish Immunology,2013,34(6):1416-1420.
[22] Guo Lidong,Harnedy P A,O’Keeffe M B,et al.Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J].Food Chemistry,2015,173:536-542.
[23] Hou Hu,Wang Shikai,Zhu Xiao,et al.A novel calcium-binding peptide from Antarctic krill protein hydrolysates and identification of binding sites of calcium-peptide complex[J].Food Chemistry,2018,243:389-395.
[24] Chen Da,Liu Zunying,Huang Wenqian,et al.Purification and characterisation of a zinc-binding peptide from oyster protein hydrolysate[J].Journal of Functional Foods,2013,5(2):689-697.
[25] Wu Haohao,Liu Zunying,Zhao Yuanhui,et al.Enzymatic preparation and characterization of iron-chelating peptides from anchovy (Engraulis japonicus) muscle protein[J].Food Research International,2012,48(2):435-441.
[26] 李瑞杰,胡晓,李来好,等.罗非鱼皮酶解物钙离子结合能力及其结合物的抗氧化活性[J].南方水产科学,2019,15(6):106-111.
[27] 胡晓,吴静,王子怀,等.响应面法优化酶解罗非鱼皮制备抗氧化肽的工艺研究[J].食品工业科技,2016,37(21):195-200,204.
[28] Alemán A,Pérez-Santín E,Bordenave-Juchereau S,et al.Squid gelatin hydrolysates with antihypertensive,anticancer and antioxidant activity[J].Food Research International,2011,44(4):1044-1051.
[29] Pan Xin,Zhao Yuqin,Hu Fayuan,et al.Preparation and identification of antioxidant peptides from protein hydrolysate of skate (Raja porosa) cartilage[J].Journal of Functional Foods,2016,25:220-230.
[30] Guo Lidong,Hou Hu,Li Bafang,et al.Preparation,isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J].Process Biochemistry,2013,48(5-6):988-993.
[31] 吴明泽,王笑,胡祥昊,等.中华圆田螺肉抗氧化肽的分离纯化及小鼠体内外活性研究[J].食品与机械,2019,35(12):151-157.
[32] 王雪燕,陈瑛,张嘉敏,等.草鱼鱼鳞抗菌肽与肉桂精油联合抑菌作用及机理[J/OL].食品科学,1-10.(2020-01-08).https://www.cnki.net/KCMS/detail/11.2206.TS.20200108.1514.049.html
[33] 李晶晶,尤海琳,张亚飞,等.扇贝裙边ACE抑制肽的分离鉴定及其降血压活性研究[J].大连海洋大学学报,2018,33(6):782-787.
[34] 张可佳,张胜男,祁艳霞,等.牡蛎ACE抑制肽对原发性高血压大鼠的降压效果及其性质研究[J].大连海洋大学学报,2018,33(6):788-794.
[35] Fujita H,Yamagami T,Ohshima K.Effects of an ACE-inhibitory agent,katsuobushi oligopeptide,in the spontaneously hypertensive rat and in borderline and mildly hypertensive subjects[J].Nutrition Research,2001,21(8):1149-1158.
[36] 李宁,石爱民,刘红芝,等.生物活性肽抗癌活性及其作用机制研究进展[J].中国食品学报,2019,19(11):261-269.
[37] 何胜洁.金钱龟抗肿瘤肽的分离纯化及其纳米粒子的制备[D].广州:华南理工大学,2015.
[38] Li Wei,Ye Shengwang,Zhang Zhuangwei,et al.Purification and characterization of a novel pentadecapeptide from protein hydrolysates of Cyclina sinensis and its immunomodulatory effects on RAW264.7 cells[J].Marine Drugs,2019,17(1):30.
[39] Hou Hu,Fan Yan,Wang Shikai,et al.Immunomodulatory activity of Alaska pollock hydrolysates obtained by glutamic acid biosensor-artificial neural network and the identification of its active central fragment[J].Journal of Functional Foods,2016,24:37-47.
[40] Ahn C B,Cho Y S,Je J Y.Purification and anti-inflammatory action of tripeptide from salmon pectoral fin byproduct protein hydrolysate[J].Food Chemistry,2015,168:151-156.
[41] Zhang Kai,Li Jiawei,Hou Hu,et al.Purification and characterization of a novel calcium-biding decapeptide from Pacific cod (Gadus macrocephalus) bone:molecular properties and calcium chelating modes[J].Journal of Functional Foods,2019,52:670-679.
[42] Chen Qianru,Guo Lidong,Du Fen,et al.The chelating peptide (GPAGPHGPPG) derived from Alaska pollock skin enhances calcium,zinc and iron transport in Caco-2 cells[J].International Journal of Food Science & Technology,2017,52(5):1283-1290.
[43] Wu Haohao,Zhu Suqin,Zeng Mingyong,et al.Enhancement of non-heme iron absorption by anchovy (Engraulis japonicus) muscle protein hydrolysate involves a nanoparticle-mediated mechanism[J].Journal of Agricultural and Food Chemistry,2014,62(34):8632-8639.
[44] Sun Na,Cui Pengbo,Lin Songyi,et al.Characterization of sea cucumber (Stichopus japonicus) ovum hydrolysates:calcium chelation,solubility and absorption into intestinal epithelial cells[J].Journal of the Science of Food and Agriculture,2017,97(13):4604-4611.
[45] Chen Da,Mu Xinmin,Huang Hai,et al.Isolation of a calcium-binding peptide from tilapia scale protein hydrolysate and its calcium bioavailability in rats[J].Journal of Functional Foods,2014,6:575-584.
[46] Li Bo,He Hui,Shi Wen,et al.Effect of duck egg white peptide-ferrous chelate on iron bioavailability in vivo and structure characterization[J].Journal of the Science of Food and Agriculture,2019,99(4):1834-1841.
[47] Xiao Chen,Lei Xinggen,Wang Qingyu,et al.Effects of a tripeptide iron on iron-deficiency anemia in rats[J].Biological Trace Element Research,2016,169(2):211-217.
[48] Ma Xiaoming,Liu Chuyi,Song Wenshan,et al.Evaluating the efficacy of a ferrous-ion-chelating peptide from Alaska pollock frame for the improvement of iron nutritional status in rats[J].Food & Function,2019,10(8):4888-4896.
[49] Song Ru,Wei Rongbian,Ruan Guangqiang,et al.Isolation and identification of antioxidative peptides from peptic hydrolysates of half-fin anchovy (Setipinna taty)[J].LWT-Food Science and Technology,2015,60(1):221-229.
[50] Wu Wenfei,Li Bafang,Hou Hu,et al.Identification of iron-chelating peptides from Pacific cod skin gelatin and the possible binding mode[J].Journal of Functional Foods,2017,35:418-427.
[51] Chi Changfeng,Hu Fayuan,Wang Bin,et al.Influence of amino acid compositions and peptide profiles on antioxidant capacities of two protein hydrolysates from skipjack tuna (Katsuwonus pelamis) dark muscle[J].Marine Drugs,2015,13(5):2580-2601.
[52] Chalamaiah M,Yu Wenlin,Wu Jianping.Immunomodulatory and anticancer protein hydrolysates (peptides) from food proteins:a review[J].Food Chemistry,2018,245:205-222.
[53] Jiang Liangping,Wang Bo,Li Bo,et al.Preparation and identification of peptides and their zinc complexes with antimicrobial activities from silver carp (Hypophthalmichthys molitrix) protein hydrolysates[J].Food Research International,2014,64:91-98.
[54] 林慧敏.带鱼下脚料酶解小肽亚铁螯合物结构鉴定及其生物活性研究[D].福州:福建农林大学,2012.
[55] Ren Yao,Wu Hui,Li Xiaofeng,et al.Purification and characterization of high antioxidant peptides from duck egg white protein hydrolysates[J].Biochemical and Biophysical Research Communications,2014,452(4):888-894.
[56] Sun Jianzhong,Kaur H,Halliwell B,et al.Use of aromatic hydroxylation of phenylalanine to measure production of hydroxyl radicals after myocardial ischemia in vivo.Direct evidence for a pathogenetic role of the hydroxyl radical in myocardial stunning[J].Circulation Research,1993,73(3):534-549.
[57] Kushibiki T,Kamiya M,Aizawa T,et al.Interaction between tachyplesin I,an antimicrobial peptide derived from horseshoe crab,and lipopolysaccharide[J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics,2014,1844(3):527-534.
[58] Jacquot A,Gauthier S F,Drouin R,et al.Proliferative effects of synthetic peptides from β-lactoglobulin and α-lactalbumin on murine splenocytes[J].International Dairy Journal,2010,20(8):514-521.
[59] Rodríguez-Carrio J,Fernández A,Riera F A,et al.Immunomodulatory activities of whey β-lactoglobulin tryptic-digested fractions[J].International Dairy Journal,2014,34(1):65-73.
[60] Zachariou M,Hearn M T W.Application of immobilized metal ion chelate complexes as pseudocation exchange adsorbents for protein separation[J].Biochemistry,1996,35(1):202-211.
[61] Xia Yichen,Bamdad F,Gänzle M,et al.Fractionation and characterization of antioxidant peptides derived from barley glutelin by enzymatic hydrolysis[J].Food Chemistry,2012,134(3):1509-1518.
[62] Wang Chan,Li Bo,Ao Jing.Separation and identification of zinc-chelating peptides from sesame protein hydrolysate using IMAC-Zn2+ and LC-MS/MS[J].Food Chemistry,2012,134(2):1231-1238.
[63] Huang Guangrong,Ren Zhangyan,Jiang Jiaxin.Separation of iron-binding peptides from shrimp processing by-products hydrolysates[J].Food and Bioprocess Technology,2011,4(8):1527-1532.
[64] Seth A,Mahoney R R.Iron chelation by digests of insoluble chicken muscle protein:the role of histidine residues[J].Journal of the Science of Food and Agriculture,2001,81(2):183-187.
[65] Chen Taotao,Chen Zheng,Wang Huimin,et al.Underlying action mechanism of a novel antioxidant peptide derived from Allium tuberosum Rottler protein hydrolysates and its protective effects on hydrogen peroxide induced cell injury[J].Journal of Functional Foods,2018,40:606-613.
[66] Sila A,Hedhili K,Przybylski R,et al.Antibacterial activity of new peptides from barbel protein hydrolysates and mode of action via a membrane damage mechanism against Listeria monocytogenes[J].Journal of Functional Foods,2014,11:322-329.
[67] Lin Yanlan,Tang Xu,Xu Liangzong,et al.Antibacterial properties and possible action mechanism of chelating peptides-zinc nanocomposite against Escherichia coli[J].Food Control,2019,106:106675.
[68] Mirzaei M,Mirdamadi S,Ehsani M R,et al.Production of antioxidant and ACE-inhibitory peptides from Kluyveromyces marxianus protein hydrolysates:purification and molecular docking[J].Journal of Food and Drug Analysis,2018,26(2):696-705.
[69] Chen Cuixia,Hu Jing,Zeng Ping,et al.Molecular mechanisms of anticancer action and cell selectivity of short α-helical peptides[J].Biomaterials,2014,35(5):1552-1561.
[70] Caetano-Silva M E,Cilla A,Bertoldo-Pacheco M T,et al.Evaluation of in vitro iron bioavailability in free form and as whey peptide-iron complexes[J].Journal of Food Composition and Analysis,2018,68:95-100.