近年来,由于受到全球气候变化、生态环境破坏、水质污染和过度捕捞等多种因素的影响,全球渔业资源量呈逐年减少趋势,其中,具有重要经济价值的水产经济物种的种质退化和单产降低问题尤为突出,严重制约了渔业经济和水产养殖产业的健康可持续发展。优质的种质是进行常规水产动物繁殖、人工育种及资源保存的重要基础材料,自20世纪50年代英国学者Blaxter[1]利用低温冷冻技术首次成功冷冻保存大西洋鲱Clupea harengus的精巢(Testis)以来,低温保存技术已广泛应用于鱼[2-3]、贝[4-5]、虾[6]和蟹[7-8]等水产动物的种质资源保存和新种创制工作中,并取得了较为丰硕的成果。然而,传统的水产动物配子低温冷冻保存技术仍不完善,存在季节依赖和配子成熟度依赖等诸多局限,难以用于保护未达到性成熟或者难以产生成熟配子的濒危物种的种质资源。
精原干细胞(Spermatogonial stem cells,SSCs)是雄性动物睾丸(Testicle)或精巢特定区域存在的一类具有调节干细胞特性的细胞。胚胎干细胞(Embryonic stem cells,ESs)是从动物早期发育胚胎内细胞团分离得到的一类未分化的全能性细胞[9]。研究表明,无论是精原干细胞还是胚胎干细胞均具有体外培养无限增殖、自我更新和多向分化等特性[10-11]。20世纪80年代,研究人员从小鼠Mus musculus体内首次成功分离精原干细胞和胚胎干细胞[12-13],随后有学者提出将这两种具有多向分化潜能的细胞作为生物的一种种质资源进行保存的设想。之后,对小鼠、牛Bos bubalus和猪Sus scrofa等[14-21]陆生动物精原干细胞和胚胎干细胞的低温冷冻保存技术研究工作陆续展开,目前,陆生动物精原干细胞和胚胎干细胞的低温冷冻保存技术已日趋完善和逐步成熟。
近年来,通过借鉴陆生动物精原干细胞和胚胎干细胞低温冷冻的相关技术,水产动物精原干细胞和胚胎干细胞的低温冷冻保存研究也逐渐展开并取得了一定的进展。为了进一步梳理近年来的相关科研成果,本文综述了水产动物精原干细胞和胚胎干细胞冷冻保存技术及其应用情况,以期进一步丰富和完善水产动物精子和胚胎冷冻及保存技术的资料体系,为充分利用低温冷冻保存技术提高水产经济动物优质种质资源保护和新种创制效率提供参考。
1 精原干细胞和胚胎干细胞基本特征
1.1 水产动物精原干细胞
精原干细胞是存在于雄性动物体精巢或睾丸内的一类能够进行自我更新且具有多能性分化能力的成体干细胞[22]。对于大多数水产动物而言,精原干细胞是雄性机体内最大的生殖细胞,且胞内含有大量的可以为细胞分裂提供能量的线粒体[23-28],但研究发现,魁蚶Scapharca broughtonii和凡纳滨对虾Litopenaeus vannamei这两种水产动物体内的初级精母细胞无论在细胞体积,还是在胞内线粒体的含量上都要明显高于体内的精原干细胞[29-30]。绝大多数水产动物的精原干细胞在外形上呈圆形或椭圆形,但在个别虾类中也发现了多角形或卵圆形的精原干细胞[28,30](表1)。与水产动物成熟的精子(直径0.9~8.0 μm)相比,水产动物精原干细胞的体积相对较大,其直径一般为3.00~12.85 μm,水产动物精原干细胞细胞核均为近圆形,核直径通常为4.5~7.7 μm,占整个精原干细胞总体积的12.5%~70.0%。值得注意的是,不同水产动物精原干细胞的分布位置各不相同,主要为雄性的精小叶、精小管、基底膜和精巢管(表1)。
表1 水产动物精原干细胞形态、大小及存在位置比较
Tab.1 Morphology, cell diameter and location of spermatogonial stem cells in animals in aquaculture

物种 species形态 shape细胞直径 cell diameter/μm位置 position长薄鳅Leptobotia elongata[23]圆形或椭圆形12.06~12.85精小叶孔雀鱼Poecilia reticulata[24]椭圆形长径>7.8 μm, 短径>6.1 μm精小管三疣梭子蟹Portunus trituberculatus[25]卵圆形长径为(9.86±1.18)μm, 短径为(7.22±1.00)μm精小叶锯缘青蟹Scylla serrata[26]椭圆形—基底膜三角帆蚌Hyriopsis cumingii[27]圆形或椭圆形3~5基底膜魁蚶Scapharca broughtonii[29]卵圆形—精小管斑节对虾Penaeus monodon[28]卵圆形或多角形9~10精巢管凡纳滨对虾Litopenaeus vannamei[30]多角形11.5精巢管
精原干细胞起源于动物体内的A型精原细胞,按照细胞形态的不同,A型精原细胞可分为未分化的单个精原细胞(Asingle,As型)、成对的精原细胞(Apaired,Apr型)和成串的精原细胞(Aaligned,Aal型)3种类型[31]。传统观点认为,只有As型精原细胞才是精原干细胞,其仅占睾丸生殖细胞总数的0.02%~0.03%[31],但是,最近研究发现,部分Apr型及Aal型精原细胞也具有形成克隆及自我更新等一系列干细胞的潜能[32-33]。
1.2 水产动物胚胎干细胞
胚胎干细胞是从动物早期发育胚胎内细胞团分离得到的一种未分化的永久性细胞类群[9]。哺乳动物的胚胎干细胞在形态上主要表现为细胞核质比高,核仁明显,排列紧密,细胞聚集生长,集落呈鸟巢状、馒头状和岛状等[34]。水产动物的胚胎干细胞与哺乳动物极其相似,其细胞核占据细胞体的大部分,核仁明显,细胞聚集呈集落样生长[34]。
与原肠期胚胎和原肠期后继续发育的胚胎相比,胚胎干细胞具有自我复制和多潜能分化的能力,其一方面保留了自我复制能力,即在一定的培养条件下,胚胎干细胞可以稳定和不断地进行自我复制,产生的新一代细胞可表现出与原代细胞相同的性状、功能和基因表达图谱[35];另一方面,胚胎干细胞在特定条件下可以定向分化为生物体内具有特定组织功能的细胞[36]。此外,相较于成熟精子或已经分化的细胞而言,在相同体外条件下胚胎干细胞可操作性更强。如Fan等[37]和沙珍霞等[38]利用显微注射技术分别将罗非鱼Oreochromis spp.和花鲈Lateolabrax maculatus的胚胎干细胞移植到囊胚期胚胎中并成功获得了嵌合体幼鱼,进而证实了胚胎干细胞的发育潜力及其体外的可操作性。
2 干细胞分离方法及冷冻保存技术
2.1 水产动物精原干细胞分离及冷冻保存技术
水产动物研究领域中相继在斑马鱼Danio rerio等模式物种[39],以及虹鳟Oncorhynchus mykiss和罗非鱼等少数重要经济物种[40-42]中开展了精原干细胞研究工作,而关于这些水产动物精原干细胞冷冻保存技术的研究则主要集中于精原干细胞的分离、冷冻保存液的配方、冷冻保存过程与方式等方面。
(1)精原干细胞的分离。大多数研究选用处于青春期或性成熟期的雄性水产动物为对象。首先,解剖获得目标对象的睾丸或者精巢;随后,快速破碎睾丸或者精巢组织,在破碎好的组织中加入一定量的胰蛋白酶进行消化分离,获得组织细胞混悬液;最后,根据不同种类细胞的相对密度、体积、贴壁速度及表面标记等,采用不同方法对细胞混悬液进行分离以获得精原干细胞。目前,用于从组织细胞混悬液中分离精原干细胞的方法主要有密度梯度离心法(Density gradient centrifugation method,DGCM)、差速贴壁法(Differential adherence method,DAM)、克隆环法(Cloning ring method,CRM)、机械法(Mechanical method,MM)和差异电镀法(Differential plating,DP)等,其中,密度梯度离心法和差速贴壁法是两种比较常用的方法。虽然有报道指出,克隆环法和机械法对吉富罗非鱼Yoshitomi tilapia的精原干细胞也有较好的分离效果[40],但克隆环体积相对较小、操作难度较大,且每次能够分离的精原干细胞数量较少,而机械法容易刮到其他细胞群落造成污染,因此,使用这两种方法分离和纯化精原干细胞的相应步骤,仍需进一步的优化和完善。
(2)冷冻保存基础液和抗冻剂。冷冻保存液可有效防止细胞膜免受冷冻降温过程中形成的机械剪切力及胞内胞外形成的冰晶损伤,保护细胞膜的完整性[43]。用于配子和胚胎的冷冻保护液主要由基础液(稀释液)和抗冻剂组成,其中,基础液(稀释液)是为了提供体外的生存环境,抑制精子活力,防止精子被激活;抗冻剂的作用主要是保护细胞不被温度速降过程中由冰晶产生的机械剪切力所损伤。目前,在冷冻保存哺乳动物精原干细胞基础液(稀释液)中通用的组成成分有胎牛血清(Fetal bovine serum,FBS)和杜氏伊格尔培养基/F12完全培养基(Dulbecco’s modified eagle medium/Ham’s F 12 nutrient medium,DMEM/F12)[44-46],而水产动物精原干细胞冷冻保存液成分较复杂,除上述哺乳动物通用两种成分之外,还有谷氨酰胺(Glutamine)、磷酸盐缓冲液(Phosphate buffered saline,PBS)、海藻糖(Trehalose)和鸡蛋黄(Egg yolk)等。不同水产动物冷冻保存精原干细胞所使用的基础液(稀释液)组成差异较大,应用最多的有胎牛血清[40-41,48],其次还有DMEM/F12培养基[41,47-48]、海藻糖和鸡蛋黄[42,49],而谷氨酰胺与磷酸盐缓冲液[47]则使用最少。在抗冻剂的选择上,二甲基亚砜(Dimethyl sulfoxide,DMSO)是哺乳动物与水产动物在冷冻保存精原干细胞中使用最多的抗冻保护剂。如对吉富罗非鱼、尼罗罗非鱼Oreochromis niloticus、星塘鳢Asterropteryx semipunctata、虹鳟和美洲鲥Alosa sapidissima等水产动物精原干细胞的冷冻保存上,均使用了终浓度为10%~12%的二甲基亚砜,另外,Lee等[49]用1.3 mol/L的甲醇(Methyl alcohol,MeOH)作为抗冻剂也取得了较好的保护效果(表2),除此之外,还有1,2丙二醇(1,2-Propanediol,1,2-Pro)和甘油(Glycerol,Gly)等也常被作为抗冻剂使用,但在物种适用范围上不如二甲基亚砜广泛。
表2 水产动物精原干细胞冷冻保存液比较
Tab.2 Cryopreservation solutions of spermatogonial stem cells from animals in aquaculture
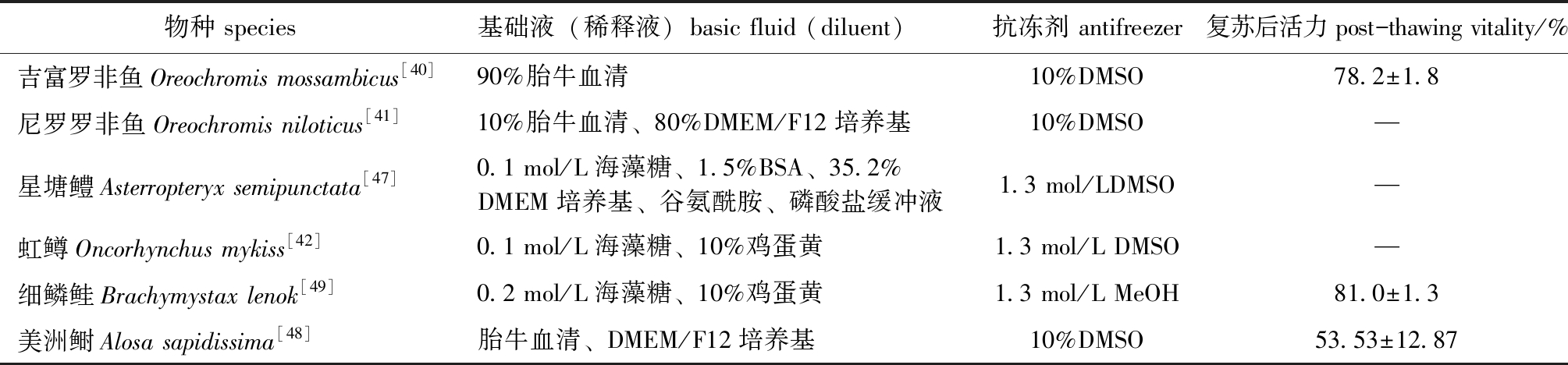
物种 species基础液(稀释液)basic fluid (diluent)抗冻剂 antifreezer复苏后活力 post-thawing vitality/%吉富罗非鱼Oreochromis mossambicus[40]90%胎牛血清10%DMSO78.2±1.8尼罗罗非鱼Oreochromis niloticus[41]10%胎牛血清、80%DMEM/F12培养基10%DMSO—星塘鳢Asterropteryx semipunctata[47]0.1 mol/L海藻糖、1.5%BSA、35.2%DMEM培养基、谷氨酰胺、磷酸盐缓冲液1.3 mol/LDMSO—虹鳟Oncorhynchus mykiss[42]0.1 mol/L海藻糖、10%鸡蛋黄1.3 mol/L DMSO—细鳞鲑Brachymystax lenok[49]0.2 mol/L海藻糖、10%鸡蛋黄1.3 mol/L MeOH81.0±1.3美洲鲥Alosa sapidissima[48]胎牛血清、DMEM/F12培养基10%DMSO53.53±12.87
(3)精原干细胞的冷冻保存过程与方式。在冷冻过程中,随着温度下降,细胞内外都会形成冰晶,对细胞产生物理伤害。研究发现,冰晶化只有在温度为-60~0 ℃条件下缓慢降温才能生成,降温越慢,冰晶越大,在-25~-15 ℃时形成的冰晶最多,对细胞危害最大,因此,在冷冻保存过程中,尽量避开这个有害温度区,才能更好地保护冻存的细胞[43]。目前,液氮保存是冷冻保存精原干细胞的主要方式,在将细胞投入液氮之前,主要有平衡降温和仪器降温两种降温方法。平衡降温法是将目标细胞处在不同温度节点进行平衡,该方法操作简单,可应用于生产实践,但缺点是降温速度控制不精确,该降温法中主要的温度节点有常温(22~23 ℃)、冰上或4 ℃、-20 ℃及-80 ℃,最后投入液氮保存。但并非所有的水产动物精原干细胞在冷冻保存过程中都选择了所有的温度节点,在首个温度节点的选择上有较大差异,如吉富罗非鱼[40]与虹鳟[42]选择在4 ℃、冰上进行平衡处理,平衡时间分别为30、60 min,而尼罗罗非鱼[41]与美洲鲥[48]则选择-80 ℃作为首次温度节点进行平衡,平衡时间分别为12 h、24~48 h。同时,吉富罗非鱼与虹鳟在后续的平衡处理中也选择了-80 ℃进行平衡,平衡时间分别为12 h、90 min,不同的是吉富罗非鱼在-80 ℃平衡之前,还选择在-20 ℃平衡1 h (表3)。综上发现,根据可查文献中所有水产动物胚胎干细胞的冷冻保存均选择在-80 ℃下进行平衡,但平衡时间有所差异,大部分选择平衡12 h过夜的方式,如吉富罗非鱼、尼罗罗非鱼,不同的水产动物平衡时间不同,平衡时间最短的是虹鳟,平衡90 min后投入液氮,平衡时间最长的是美洲鲥,经24~48 h缓慢降温至-80 ℃,平衡温度与平衡时间的长短有明显的种属差异。仪器降温法主要是使用程序降温仪来完成,该方法操作简单、控温速度精确,但较难应用到实际生产。主要步骤:设定降温速度、降温、液氮保存。在星塘鳢Asterropteryx semipunctata与满洲鳟精原干细胞的冷冻保存过程中,使用降温仪以-0.5~1、-1 ℃/min的速度降温至-80 ℃时分别平衡4~8 h、90 min,最后用液氮冷冻保存。
(4)复苏。精原干细胞冷冻保存一段时间后进行复苏,复苏的方法较为一致,均使用水浴短时解冻的方法,水浴时的温度多为25~37 ℃(表3),但虹鳟精原干细胞复苏时水浴温度为10 ℃[42],可能与虹鳟是冷水性鱼类有关。
表3 水产动物精原干细胞冷冻保存过程及方式比较
Tab.3 Cryopreservation processes and methods of spermatogonial stem cells from animals in aquaculture

物种species冷冻时间/dfreezing time冷冻方法freezing method复苏方法thawing method复苏后活力/%post-thawing vitality吉富罗非鱼 Oreochromis mossambicus[40]604 ℃平衡30 min→-20 ℃平衡1 h→-80 ℃过夜(12 h)→液氮26 ℃水浴解冻78.2±1.8尼罗罗非鱼 Oreochromis niloticus[41]21-80 ℃过夜(12 h)→液氮25 ℃水浴解冻—星塘鳢 Asterropteryx semipunctata[47]—常温(22~23 ℃)平衡10 min→-0.5~1 ℃/min降温至-80 ℃(4~8 h)→液氮30 ℃水浴解冻—虹鳟 Oncorhynchus mykiss[42]365、 5×365冰上平衡60 min→-80 ℃(90 min)→液氮10 ℃水浴解冻—细鳞鲑Brachymystax lenok[49]2-1 ℃/min降温至-80 ℃平衡90 min→液氮30 ℃水浴解冻81.0±1.3美洲鲥 Alosa sapidissima[48]250-80 ℃ 24~48 h→液氮37 ℃水浴解冻53.53±12.87
(5)生产应用。目前,在生产实践中已经初步开展了多个经济鱼类品种精原干细胞冷冻的产业化应用,此外,还有研究将解冻复苏后的尼罗罗非鱼、满洲鳟和美洲鲥的精原干细胞通过体外移植方式,分别移植到成年罗非鱼、三倍体鳟鱼幼鱼和斑马鱼仔鱼中,发现这些冷冻复苏后的精原干细胞均能正常存活并发育成正常成熟的精子[41,48-49],这为经济鱼类新种创制提供了新的基础育种材料,也为保护未达到性成熟或难以产生成熟配子的濒危物种的种质资源提供了新的参考和借鉴。
2.2 水产动物胚胎干细胞分离及冷冻保存技术
近年来,水产动物研究领域已相继在斑马鱼等[50]模式物种,以及罗非鱼和花鲈等[37-38]少数重要经济物种中开展了胚胎干细胞的研究工作,而对于水产动物胚胎干细胞的冷冻保存技术研究则主要集中于胚胎干细胞的分离、冷冻保存液的配方、冷冻保存过程与方式等方面。
(1)胚胎干细胞的分离。对水产动物胚胎干细胞进行分离的方法主要采用早期胚胎培养法,即根据不同物种确定培养基(基础培养基和添加物),然后将胚胎接种于饲养层上,待胚胎干细胞充分增殖后,挑取细胞集落再经过胰酶消化后离散,再接种到新的饲养层,经过几次传代筛选后即可得到大量较纯的胚胎干细胞[50-51]。在哺乳动物胚胎干细胞的培养基[15-16,52]中,通用的基础培养基和添加物有10%~15%胎牛血清、85%~90%高糖杜氏伊格尔培养基(葡萄糖浓度为4.5 g/L)、0.1 mmol/L巯基乙醇、2 mmol/L谷氨酰胺和碱性成纤维生长因子等。相较于哺乳动物,水产动物胚胎干细胞的培养基组成成分更为复杂,在南亚野鲮Labeo rohita[50]和豹纹斑马鱼Brachydanio frankei[51]胚胎干细胞培养基中,除哺乳动物通用的成分[胎牛血清、高糖杜氏伊格尔培养基(葡萄糖浓度为4.5 g/L)、巯基乙醇和碱性成纤维生长因子]之外,还添加了20 mmol/L的4-羟乙基哌嗪乙磺酸(4-hydroxyethyl piperazineethylsulfonic acid,Hepes)、100 IU/mL的青霉素、0.1 mg/nL的链霉素、1 mmol/L的非必需氨基酸、8 mmol/L的亚硒酸钠和1 mmol/L的丙酮酸。其中,南亚野鲮胚胎干细胞培养基中还添加了1%的胚胎提取物和10 ng/mL的人白血病抑制因子[50],豹纹斑马鱼胚胎干细胞培养基中添加了5 ng/mL的表皮生长因子和5 ng/mL的亮氨酸抑制因子[51]。
(2)冷冻保存基础液和抗冻剂。哺乳动物胚胎干细胞冷冻保存使用的基础液(稀释液)多采用胎牛血清和杜氏伊格尔培养基[15-16,52-54],另有研究采用小牛血清(Calf serum)[54]和一些其他添加剂如谷氨酰胺(Glutamine)[52]等,而在抗冻剂上则多选用二甲基亚砜。目前,关于水产动物胚胎干细胞冷冻保存的研究相对较少,仅见南亚野鲮和豹纹斑马鱼的相关报道[50-51]。其中,南亚野鲮胚胎干细胞冷冻保存中使用的基础液(稀释液)与哺乳动物略有不同,为高糖杜氏伊格尔培养基(葡萄糖浓度为4.5 g/L)、胎牛血清及终浓度为0.2 mol/L海藻糖的混合液,而在抗冻剂上则选择了哺乳动物常用的二甲基亚砜。在豹纹斑马鱼胚胎干细胞的冷冻保存中,采用了与哺乳动物极为相似的基础液(杜氏伊格尔培养基∶胎牛血清=4∶1),但是在抗冻剂上则选择了哺乳动物中不常使用的乙二醇(Ethylene glycol,EG)[50](表4)。但就这两种动物胚胎干细胞冷冻保存中所用基础液和防冻液与哺乳动物之间差异的机制尚不明确,仍需进一步研究。
表4 水产动物胚胎干细胞冷冻保存液比较
Tab.4 Cryopreservation solutions for embryonic stem cells from animals in aquaculture

物种 species 基础液(稀释液)basic fluid (diluent)抗冻剂antifreezer复苏后存活率/%survival rate after thawing南亚野鲮 Labeo rohita[50]高糖杜氏伊格尔培养基、20%胎牛血清、0.2 mol/L海藻糖0.8 mol/L二甲基亚砜(DMSO)≥60豹纹斑马鱼 Brachydanio frankei[51]杜氏伊格尔培养基、20%胎牛血清1.8 mol/L乙二醇(EG)65
(3)胚胎干细胞的冷冻保存过程和方式。哺乳动物多使用程序降温仪进行降温处理[15-16,52,54],降温过程和方式为:设定-1 ℃/min降温速度,降温至-80 ℃后投入液氮中冷冻保存。在水产动物中仅见用于南亚野鲮和豹纹斑马鱼胚胎干细胞冷冻保存中。南亚野鲮[50]采用了与哺乳动物相同的冷冻保存过程和方式。豹纹斑马鱼[51]与哺乳动物略有差别,豹纹斑马鱼先在4 ℃平衡10 min后再进行程序降温,降温速度和温度节点与哺乳动物相同。
(4)复苏。胚胎干细胞冷冻保存一段时间后进行复苏,此方面研究较少,如南亚野鲮和豹纹斑马鱼胚胎干细胞冷冻保存一段时间后,进行复苏,复苏方式与哺乳动物方式一致,均为37 ℃水浴短时快速解冻(表5)。
表5 水产动物胚胎干细胞冷冻保存过程及方式比较
Tab.5 Cryopreservation processes and methods of embryonic stem cells from animals in aquaculture

物种species冷冻时间freezing time冷冻方法freezing method复苏方法freezing method复苏后存活率/%survival rate after thawing南亚野鲮 Labeo rohita[50]30 d、 60 d-1 ℃/min到-80 ℃,最后投入液氮37 ℃水浴解冻≥60豹纹斑马鱼 Brachydanio frankei[51]1 h4 ℃平衡10 min,-1 ℃/min到-80 ℃,最后投入液氮37 ℃水浴解冻65
(5)生产应用。目前,在水产动物胚胎干细胞冷冻保存方面仅建立了南亚野鲮和豹纹斑马鱼的胚胎干细胞冷冻保存方法并小规模应用于生产实践。但是,水产动物胚胎干细胞冷冻体系仍不完善,仍有大量水产动物种类尚未进行研究,水产动物胚胎干细胞冷冻保存研究仍亟待加强。
3 存在问题及展望
3.1 存在问题
水产动物精原干细胞和胚胎干细胞低温冷冻保存技术的出现和发展,一方面克服了水产动物配子低温冷冻存在的季节依赖性、配子数量依赖性和配子成熟度依赖性等局限,另一方面为保护濒危水生物种的种质资源和丰富水产养殖动物新种创制基础材料提供了新的思路和线索。然而,与哺乳动物(人、牛和马等)精原干细胞和胚胎干细胞低温冷冻保存相关研究相比,水产动物相关研究仍有较大差距,主要可归因于以下3点:(1)水产动物精原干细胞和胚胎干细胞的分离和纯化方法相对单一,无法精细分离不同时期的精原干细胞和胚胎干细胞,且对仪器设备、场地条件和操作人员技术水平的要求较高,目前仅局限于在实验室条件下进行,规模化和产业化程度较低;(2)缺乏评价水产动物精原干细胞和胚胎干细胞质量的科学体系,加之目前水产动物精原干细胞和胚胎干细胞的冷冻保存程序和步骤仍然比较繁琐,因此,无法避免低质量精原干细胞和胚胎干细胞引起的冷冻存活率低等问题;(3)在冷冻保存液和防冻液配方方面,水产动物目前仍主要借鉴哺乳动物,但与哺乳动物相比,水产动物精原干细胞和胚胎干细胞在渗透压环境和激活诱导方式等方面均有较大差距,因此,造成水产动物精原干细胞和胚胎干细胞的冷冻保存效果较差和复苏诱导成活率较低。
3.2 展望
未来水产动物精原干细胞和胚胎干细胞低温冷冻保存研究仍需着重加强以下4个方面的工作:(1)要着力研发适用于不同水产动物精原干细胞和胚胎干细胞分离和纯化的高通量、大体积、自动化的分离设备,制定分离不同细胞期精原干细胞和胚胎干细胞的规范化方法和操作规程,不断提高水产动物精原干细胞和胚胎干细胞冷冻保存的规模化和产业化程度。(2)要针对不同水产动物物种,建立有效的精原干细胞和胚胎干细胞质量评价体系,同时,在现有基础上不断完善和优化不同水产动物精原干细胞和胚胎干细胞的冷冻程序。(3)系统掌握不同水产动物精原干细胞和胚胎干细胞的最适渗透压环境和激活诱导方式,进一步筛选出适合水产动物精原干细胞和胚胎干细胞低温冷冻保存且针对性强、效果显著、经济节约的冷冻保存液和防冻液配方。(4)广泛开展各种水产动物精原干细胞和胚胎干细胞冷冻保存工作,建立不同水产动物精原干细胞和胚胎干细胞的资源库和保存平台,为中国水产动物物种的种质保存提供技术支撑。
[1] Blaxter J H S.Sperm storage and cross-fertilization of spring and autumn spawning herring[J].Nature,1953,172(4391):1189-1190.
[2] Suquet M,Dreanno C,Fauvel C,et al.Cryopreservation of sperm in marine fish[J].Aquaculture Research,2000,31(3):231-243.
[3] 田永胜,马允,解子牛,等.哲罗鲑精子冷冻保存[J].农业生物技术学报,2016,24(1):90-97.
[4] 杨培民,杨爱国,刘志鸿,等.虾夷扇贝精子的冷冻保存及其杂交试验应用研究[J].上海水产大学学报,2007,16(4):351-356.
[5] Hassan M M,Qin J G,Li Xiaoxu.Sperm cryopreservation in oysters:a review of its current status and potentials for future application in aquaculture[J].Aquaculture,2015,438:24-32.
[6] 王文琪,杨敬昆,徐世宏,等.3种对虾精子超低温冷冻保存技术研究[J].海洋科学,2017,41(9):81-86.
[7] 陈东华,李艳东,贾林芝,等.冷冻保护剂及预冷时间对河蟹精子体外冷冻保存的影响[J].水生生物学报,2008,32(4):579-585.
[8] 许星鸿,阎斌伦,徐加涛,等.日本蟳精子超低温冷冻保存技术的研究[J].水产科学,2010,29(10):601-604.
[9] 郑瑞珍.胚胎干细胞研究进展[J].生物工程进展,1994,14(2):18-27.
[10] 王菊花.山羊精原干细胞体外增殖及其分化的调控[D].合肥:安徽农业大学,2014.
[11] 刘春霞.绵羊胚胎干细胞分离、培养、鉴定及诱导分化的研究[D].呼和浩特:内蒙古农业大学,2013.
[12] Evans M J,Kaufman M H.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156.
[13] Martin G R.Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells[J].Proceedings of the National Academy of Sciences of the United States of America,1981,78(12):7634-7638.
[14] Lee Y A,Kim Y H,Kim B J,et al.Cryopreservation of mouse spermatogonial stem cells in dimethylsulfoxide and polyethylene glycol[J].Biology of Reproduction,2013,89(5):109.
[15] Benson C M K,Benson J D,Critser J K.An improved cryopreservation method for a mouse embryonic stem cell line[J].Cryobiology,2008,56(2):120-130.
[16] Kashuba C M,Benson J D,Critser J K.Rationally optimized cryopreservation of multiple mouse embryonic stem cell lines:I—comparative fundamental cryobiology of multiple mouse embryonic stem cell lines and the implications for embryonic stem cell cryopreservation protocols[J].Cryobiology,2014,68(2):166-175.
[17] Kim K J,Lee Y A,Kim B J,et al.Cryopreservation of putative pre-pubertal bovine spermatogonial stem cells by slow freezing[J].Cryobiology,2015,70(2):175-183.
[18] Zheng Peng,Hu Pengfei,Tian Yaguang,et al.Isolation,purification and cryopreservation of cells from neonatal bovine testis[J].Journal of Northeast Agricultural University:English Edition,2013,20(1):37-42.
[19] Pashaiasl M,Khodadadi K,Richings N M,et al.Cryopreservation and long-term maintenance of bovine embryo-derived cell lines[J].Reproduction,Fertility and Development,2013,25(4):707-718.
[20] Pan Chuanying,Yu Shuai,Zhang Pengfei,et al.Effect of sucrose on cryopreservation of pig spermatogonial stem cells[J].Journal of Integrative Agriculture,2017,16(5):1120-1129.
[21] Lee Y A,Kim Y H,Ha S J,et al.Cryopreservation of porcine spermatogonial stem cells by slow-freezing testis tissue in trehalose[J].Journal of Animal Science,2014,92(3):984-995.
[22] Yoshida S,Sukeno M,Nabeshima Y I.A vasculature-associated niche for undifferentiated spermatogonia in the mouse testis[J].Science,2007,317(5845):1722-1726.
[23] 王志坚,殷江霞,张耀光.长薄鳅的精巢发育和精子发生[J].淡水渔业,2009,39(1):3-9.
[24] 郭明申,刘龙,穆淑梅,等.孔雀鱼精子发生的显微与超微结构[J].河北大学学报:自然科学版,2006,26(6):653-658.
[25] 管卫兵,宣富君,戴小杰,等.东海三疣梭子蟹精子发生及精荚形成[J].中国水产科学,2009,16(2):173-182.
[26] 王艺磊,张子平,李少菁.锯缘青蟹精子发生的超微结构[J].动物学报,1997,43(3):249-254.
[27] 弭忠祥,王大威,王国夫,等.三角帆蚌精子超微结构的观察[J].电子显微学报,2002,21(5):578-579.
[28] 洪水根,李祺福,郭永刚,等.斑节对虾精子发生的超微结构[J].动物学报,1998,44(1):1-4.
[29] 叶婧,姜建湖.魁蚶精子发生的超微结构[J].上海海洋大学学报,2012,21(2):199-203.
[30] 许尤厚,刘学东,张吕平,等.凡纳滨对虾精子发生的超微结构研究[J].热带海洋学报,2010,29(4):89-93.
[31] 林南河,朱子珏,李铮.精原干细胞自我更新与分化机制的研究进展[J].上海交通大学学报:医学版,2018,38(4):445-449.
[32] Nakagawa T,Sharma M,Nabeshima Y I,et al.Functional hierarchy and reversibility within the murine spermatogenic stem cell compartment[J].Science,2010,328(5974):62-67.
[33] Nakagawa T,Nabeshima Y I,Yoshida S.Functional identification of the actual and potential stem cell compartments in mouse spermatogenesis[J].Developmental Cell,2007,12(2):195-206.
[34] 胡洋.尼罗罗非鱼及斑马鱼胚胎细胞分离培养的研究[D].湛江:广东海洋大学,2010.
[35] 李向东,王秀丽.胚胎干细胞自我更新与诱导分化[J].大连医科大学学报,2017,39(5):417-422,432.
[36] 时洋,沈军生,毋涛涛,等.人胚胎干细胞向内皮细胞的分化诱导[J].中国组织工程研究,2016,20(23):3394-3399.
[37] Fan Zhenhua,Liu Linyan,Huang Xiaohuan,et al.Establishment and growth responses of Nile tilapia embryonic stem-like cell lines under feeder-free condition[J].Development,Growth & Differentiation,2017,59(2):83-93.
[38] 沙珍霞,刘洋,陈松林,等.花鲈胚胎干细胞移植及嵌合体的构建[J].高技术通讯,2006,16(2):186-190.
[39] Kawasaki T,Siegfried K R,Sakai N.Differentiation of zebrafish spermatogonial stem cells to functional sperm in culture[J].Development,2016,143(4):566-574.
[40] 王爱珍.吉富罗非鱼精原干细胞分离与体外培养的研究[D].湛江:广东海洋大学,2013.
[41] Lacerda S M S N,Batlouni S R,Costa G M J,et al.A new and fast technique to generate offspring after germ cells transplantation in adult fish:the Nile tilapia (Oreochromis niloticus) model[J].PLoS One,2010,5(5):e10740.
[42] Lee S,Iwasaki Y,Yoshizaki G.Long-term (5 years) cryopreserved spermatogonia have high capacity to generate functional gametes via interspecies transplantation in salmonids[J].Cryobiology,2016,73(2):286-290.
[43] 朱士恩.动物配子与胚胎冷冻保存原理及应用[M].北京:科学出版社,2012.
[44] 王玉燕,柴玮杰,高珉之,等.小鼠精原干细胞冷冻保存技术的研究[J].预防医学论坛,2008,14(12):1060-1062.
[45] 吴应积,罗奋华,张岩,等.一种绵羊精原干细胞分离纯化、传代长期培养、冻存及复苏的方法:中国,CN104004708A[P].2014-08-27.
[46] 师如意,张秀娟,白银山,等.猪精原干细胞超微结构观察与体外冻存条件的优化研究[J].华南农业大学学报,2014,32(2):1-5.
[47] Hagedorn M M,Daly J P,Carter V L,et al.Cryopreservation of fish spermatogonial cells:the future of natural history collections[J].Scientific Reports,2018,8:6149.
[48] 吴栩灵,洪孝友,李凯彬,等.美洲鲥雄性生殖细胞冷冻保存及移植[J].水生生物学报,2018,42(3):599-605.
[49] Lee S,Yoshizaki G.Successful cryopreservation of spermatogonia in critically endangered Manchurian trout (Brachymystax lenok)[J].Cryobiology,2016,72(2):165-168.
[50] Dash S N,Routray P,Dash C,et al.Use of the non-toxic cryoprotectant trehalose enhances recovery and function of fish embryonic stem cells following cryogenic storage[J].Current Stem Cell Research & Therapy,2008,3(4):277-287.
[51] Routray P,Dash C,Dash S N,et al.Cryopreservation of isolated blastomeres and embryonic stem-like cells of leopard danio,Brachydanio frankei[J].Aquaculture Research,2010,41(4):579-589.
[52] 袁晓华,王淑芬,杨世华,等.不同防冻剂对兔胚胎干细胞慢速冷冻保存的影响[J].动物学研究,2007,28(1):81-87.
[53] 杨兴东.小鼠胚胎冷冻保存的研究[D].雅安:四川农业大学,2006.
[54] 杨鹏飞,丛笑倩,程启康,等.人胚胎干细胞程序降温保存的实验研究[J].实验生物学报,2005,38(3):247-256.