皱纹盘鲍Haliotis discus hannai广泛分布于中国山东及其以北海域,是重要的经济鲍鱼类。中国是世界第一养殖鲍鱼大国,其养殖产量呈逐年上升趋势,2018年中国鲍鱼总产量约为16.3万t,相比2017年增长了9.85%[1]。鲍鱼的主要流通形式有鲜活品、干品、即食类产品和冷冻品等。季节性、地域性等限制因素使得鲜品鲍鱼的流通存在困难,鲍鱼死后由于其体内蛋白质含量较高,在微生物及内源酶的作用下极易腐败变质[2],故远距离销售需要对其进行加工。目前,国内外对鲍鱼品质的研究主要围绕不同部位[3]、不同品种[4-5]、不同养殖模式[6]及不同加工方式[7-8]等方面,而关于冷冻鲍鱼品质的研究较少。冷冻鲍鱼价格适中,能在一定程度上保持新鲜品的口感与滋味,并且随着中国冷链运输行业的快速发展,开展对冷冻鲍鱼品质方面的研究具有重要的现实意义。
肌原纤维蛋白与胶原蛋白是维持肌肉结构完整性的两种关键性蛋白,其相对含量和性质对鲍鱼肌肉的质构特性存在着重要影响[9],许多学者均对此进行了研究。Olaechea等[10]对鲍鱼的韧性与其胶原蛋白含量关系的研究发现,两者存在高度相关性,胶原含量越高鲍鱼肌肉越紧实;Xin等[11-12]对生鲍鱼、冷藏鲍鱼、煮制鲍鱼等研究表明,鲍鱼肌肉的结构参数与流变学参数存在一定的相关性;肖桂华等[3]对鲍鱼腹足肌肉的质地研究发现,不同部位肌肉存在显著性差异,其中,粗蛋白质含量与弹性呈显著性正相关,而胶原蛋白含量与其硬度、咀嚼性等具有相关性。对于鲍鱼不同部位质地的研究大多以鲜活或加热处理后的鲍鱼为对象,而对于冷冻鲍鱼质地方面的研究目前较少。鲍鱼腹足肌肉中闭壳肌占比较大,约40%,其主要成分为肌原纤维蛋白,在加工处理过程中易受到影响而发生变性、降解等[13]。另外,有研究表明,冻结方式、冻藏温度等可能会引发鲍鱼解冻后营养物质流失,肉质变硬甚至闭壳肌部分糜烂等问题[14]。本研究中,以商品速冻鲍鱼为研究对象,从食品原料学角度出发研究其主要可食部位的营养成分和组织结构差异,探究商品速冻鲍鱼的食用价值及处理后产品不同部位肌肉的结构差异性,以期为鲍鱼的速冻加工提供技术参考。
1 材料与方法
1.1 材料
试验用速冻皱纹盘鲍共8只,购于上海某食品公司,体质量(去壳、去内脏)为(11.42±0.29)g,壳长为(6.46±0.08)cm。
试验试剂:苯酚、无水乙醇(上海麦克林生化科技有限公司);Tris(中国Solarbio公司);SDS-聚丙烯酰胺凝胶电泳试剂(美国Sigma公司);氢氧化钠(国药集团化学试剂有限公司);Van Gieson试剂盒(上海源叶生物科技有限公司)。
试验仪器:Foss kjeltec 8400全自动凯氏定氮仪(丹麦Foss有限公司);L-8800氨基酸自动分析仪(日本Hitachi公司);LEICA RM2245石蜡切片机(德国莱卡);光学显微镜(上海明兹精密仪器有限公司)。
1.2 方法
1.2.1 样品前处理 商品速冻鲍鱼处理流程:清洗、漂烫、冷却、速冻、镀冰衣和真空袋装处理。工厂处理完毕后,将鲍鱼加冰袋置于塑料泡沫箱中,后经冷链物流保鲜车运回实验室,路途耗时约8 h。样品到达实验室后置于-18 ℃冰箱中保存。试验前将鲍鱼置于冰箱(4 ℃)中过夜解冻,将可食部位分成闭壳肌(AD)部分和足肌(PS)两部分(图1-A)。
1.2.2 基本营养成分测定 参照GB 5009.3—2016《食品中水分的测定》的方法测定水分含量,采用凯氏定氮法(GB 5009.5—2016)、索氏抽提法(GB 5009.6—2016)、高温灼烧法(GB 5009.4—2016)、分光光度法(GB 9695.31—2008)分别测定粗蛋白质、粗脂肪、灰分、总糖含量。
1.2.3 氨基酸组成含量的测定及营养评价 氨基酸含量测定参考GB 5009.124—2016,使用氨基酸自动分析仪完成测定。
营养评价参考汪婷等[15]方法,计算公式为
样品蛋白质中氨基酸含量(mg/g)=[样品中某种氨基酸含量/样品中蛋白质含量(%)]×6.25×1000,
(1)
氨基酸评分(AAS)=样品蛋白质中氨基酸含量(mg/g)/ [FAO/WHO评分标准模式中相应必需氨基酸含量(mg/g)],
(2)
化学评分(CS)=样品蛋白质中氨基酸含量(mg/g)/全鸡蛋蛋白质中同种氨基酸含量(mg/g)。
(3)
1.2.4 肌浆蛋白、肌原纤维蛋白及胶原蛋白的提取和含量测定 鲍鱼肌浆蛋白及肌原纤维蛋白的提取参照张龙[16]的方法,胶原蛋白的提取参考游银川[9]的方法,并稍做修改。步骤如下:取2.5 g鲍鱼肉,加入10倍体积的去离子水均质1 min后搅拌30 min,以5000 g离心10 min,留沉淀,重复2次。沉淀中加入10倍体积的0.5 mol/L NaCl溶液搅拌24 h,以5000 g离心10 min,留沉淀,重复2次。沉淀中加入10倍体积0.1 mol/L NaOH溶液搅拌过夜,以除去非胶原部分,以15 000 g离心30 min,将所得沉淀用去离子水洗至中性。向沉淀中加入10倍体积0.5 mol/L乙酸搅拌24 h,以15 000 g离心30 min,随后在沉淀中加入4倍体积0.5 mol/L乙酸,用胃蛋白酶(酶∶底物=1∶200)酶解48 h,以15 000 g离心30 min,取上清液,加入4 mol/L NaCl,使其终浓度为0.8 mol/L,搅拌30 min后静置2 h,再以12 000 g离心20 min,取沉淀。用适量的0.5 mol/L 乙酸溶解,后加入0.02 mol/L Na2HPO4(pH 8.0)溶液透析24 h,以3000 g离心10 min,弃上清液。取沉淀先复溶于0.5 mol/L乙酸中,后加入0.1 mol/L乙酸充分透析,最后得冻干溶液即为酶促溶性胶原蛋白(PSC)。
肌浆蛋白及肌原纤维蛋白含量的测定采用双缩脲法;胶原蛋白含量的测定参考GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》,鲍鱼腹足中羟脯氨酸含量占胶原蛋白的10.2%[17-18]。
1.2.5 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析 采用SDS-聚丙烯凝胶电泳对蛋白的分布和分子量进行测定,其中浓缩胶质量分数为5%,分离胶质量分数为7.5%。
1.2.6 光学显微镜观察 图1-B中箭头所示为速冻鲍鱼闭壳肌与足肌的取样位置。分别选取中心位置肌肉(AD处)和靠近裙边位置肌肉(PS处),将其切成0.4 cm×0.4 cm×0.4 cm的正方体浸入10%福尔马林中固定24 h,用70%、80%、90%、95%、100%乙醇逐级脱水,再用二甲苯透明、浸蜡、包埋、切片、烤片,最后用Van Gieson染色,在光学显微镜下观察并拍照。

图1 速冻皱纹盘鲍肌肉部位划分及取样位置
Fig.1 Division of muscle parts and sampling position of frozen disk abalone Haliotis discus hannai
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,所有试验组测定均设置3个平行,使用SPSS17.0软件进行方差分析,采用Duncan法进行组间多重比较,显著性水平设为 0.05。
2 结果与分析
2.1 速冻鲍鱼不同部位肌肉营养成分比较
2.1.1 基本营养成分 从表1可见:皱纹盘鲍闭壳肌和足肌两部分在营养成分含量方面存在一定差异;闭壳肌中的水分、粗蛋白质、灰分及总糖含量均显著高于足肌(P<0.05),而水分含量则显著低于足肌(P<0.05);两部分肌肉中粗脂肪含量无显著性差异(P>0.05)。与其他水产动物相比,速冻皱纹盘鲍的粗蛋白质含量高于巴沙鱼肉[19]及白氏文昌鱼肉[20]等,而粗脂肪含量远低于华贵栉孔扇贝柱[21]、克氏原螯虾肉[22]、舌鳎鱼肉[19]、草鱼和鲤肉[23]等,具有高蛋白低脂肪的特点。
表1 速冻皱纹盘鲍不同部位肌肉基本营养成分(湿质量)
Tab.1 Proximate composition in different parts of frozen disk abalone Haliotis discus hannai(wet weight) w/%

部位 part水分 moisture粗蛋白质 crude protein粗脂肪 crude lipid灰分 ash总糖 total sugar闭壳肌adductor80.45±0.14b14.59±1.25a0.05±0.00a0.83±0.06a2.91±0.08a足肌pedal muscle86.24±0.15a10.35±0.83b0.11±0.05a0.57±0.00b2.30±0.00b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
2.1.2 氨基酸组成及含量 从表2可见:速冻鲍鱼闭壳肌和足肌中的总氨基酸组成基本一致,均可检测出15种氨基酸;闭壳肌和足肌两部分肌肉中的总氨基酸含量存在显著性差异(P<0.05),分别为98.76、73.01 mg/g,其中必需氨基酸有7种,其总含量分别为34.70、25.83 mg/g,两者有显著性差异(P<0.05);两部分肌肉中半必需氨基酸有2种,其总含量分别为12.90、9.36 mg/g,两者有显著性差异(P<0.05),非必需氨基酸有6种,其总含量分别为51.15、37.82 mg/g,两者有显著性差异(P<0.05);两部分肌肉中含量最高的氨基酸均是谷氨酸(Glu),其次为精氨酸(Arg)、天冬氨酸(Asp),含量最低的氨基酸为组氨酸(His)。
表2 速冻皱纹盘鲍不同部位肌肉氨基酸组成
Tab.2 Amino acid composition in different parts of muscle in frozen disk abalone Haliotis discus hannai mg/g

氨基酸amino acid闭壳肌adductor足肌pedal muscle苏氨酸Thr4.93±0.16a3.61±0.67b缬氨酸Val4.19±0.24a3.18±0.65b蛋氨酸Met2.80±0.20a2.09±0.46b异亮氨酸Ile4.10±0.24a2.98±0.98a亮氨酸Leu7.92±0.39a5.86±1.06b苯丙氨酸Phe3.53±0.16a3.01±0.51a赖氨酸Lys7.24±0.24a5.09±1.19b必需氨基酸EAA34.70±1.47a25.83±3.90b组氨酸His1.76±0.05a1.11±0.56b精氨酸Arg11.14±0.38a8.25±1.69b半必需氨基酸12.90±0.43a9.36±1.59b天冬氨酸Asp10.66±0.41a7.83±1.31b丝氨酸Ser4.92±0.28a4.06±0.74a谷氨酸Glu17.20±0.81a12.09±2.36b甘氨酸Gly6.63±0.18a7.07±0.87a丙氨酸Ala8.17±2.09a3.54±1.57b酪氨酸Tyr3.58±0.18a3.22±1.30a非必需氨基酸NEAA51.15±0.93a37.82±5.76b氨基酸总量TAA98.76±2.34b73.01±11.26aEAA/TAA/%0.35±0.01a0.35±0.00aUAA/TAA/%0.48±0.01a0.47±0.01a
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same line are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same line are not significant differences
2.1.3 氨基酸营养评价 表3是采用FAO/WHO评分模式与鸡蛋蛋白氨基酸评分模式对速冻鲍鱼闭壳肌和足肌两部分肌肉进行氨基酸评分(AAS)与化学评分(CS)的结果。两种评分模式下,两部分肌肉中的蛋氨酸(Met)评分均最低,为第一限制性氨基酸;从AAS评分来看,闭壳肌中的赖氨酸(Lys)评分最高,为0.91,足肌中苏氨酸(Thr)评分最高,为0.57;从CS评分来看,两部分肌肉中的苏氨酸(Thr)评分均最高,分别为0.72和0.49(表3)。
表3 速冻皱纹盘鲍不同部位肌肉中必需氨基酸组成评价
Tab.3 An evaluation of essential amino acids in different parts of muscle in frozen disk abalone Haliotis discus hannai
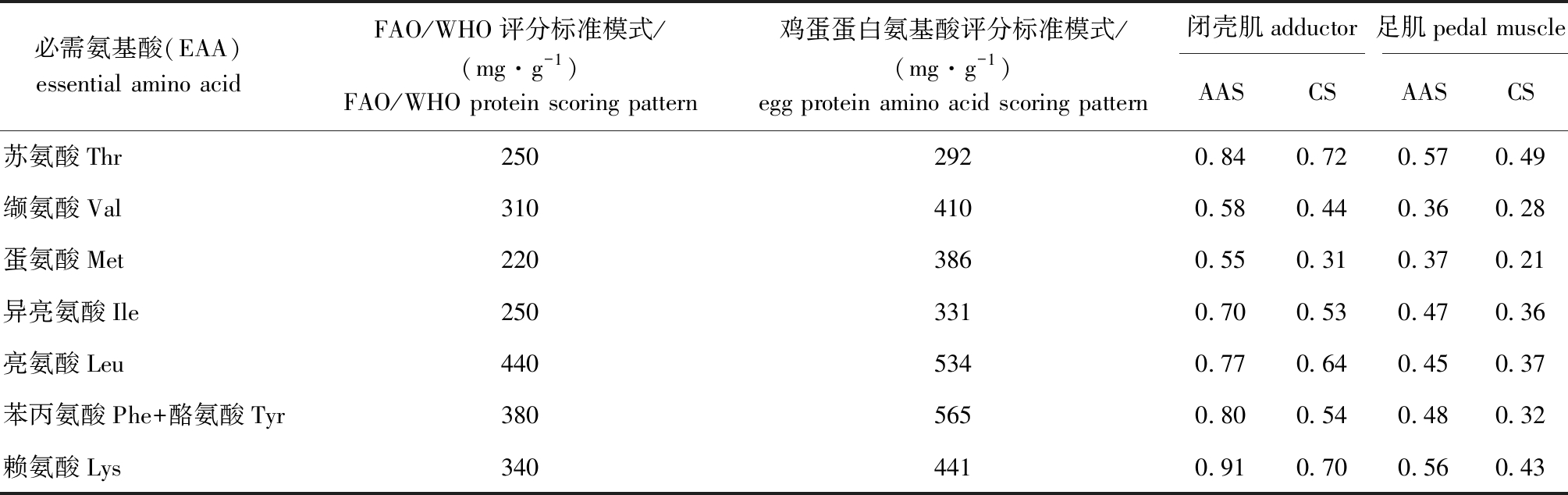
必需氨基酸(EAA) essential amino acid FAO/WHO评分标准模式/(mg·g-1)FAO/WHO protein scoring pattern鸡蛋蛋白氨基酸评分标准模式/(mg·g-1)egg protein amino acid scoring pattern 闭壳肌adductor足肌pedal muscleAASCSAASCS苏氨酸Thr2502920.840.720.570.49缬氨酸Val3104100.580.440.360.28蛋氨酸Met2203860.550.310.370.21异亮氨酸Ile2503310.700.530.470.36亮氨酸Leu4405340.770.640.450.37苯丙氨酸Phe+酪氨酸Tyr3805650.800.540.480.32赖氨酸Lys3404410.910.700.560.43
2.2 速冻鲍鱼不同部位肌肉质地比较
2.2.1 蛋白组成分析 从图3可见:鲍鱼肌肉闭壳肌中肌浆蛋白含量与肌原纤维蛋白含量均显著高于足肌部分(P<0.05),而胶原蛋白含量则显著低于足肌部分,后者约为前者的两倍(P<0.05);加工处理后两部分肌肉中肌浆蛋白与肌原纤维蛋白的含量比例约为1∶1,肌浆蛋白含量约为68 mg/g,肌原纤维蛋白含量约为50 mg/g。
2.2.2 蛋白分布 从图4可见:肌浆蛋白中含有大量的酶类(如组织蛋白酶、肌酸激酶、水解酶等)、小清蛋白和细胞色素C等水溶性物质[24],两部位肌肉中肌浆蛋白的分布基本相似,除相对分子质量大于245 000的条带外,大部分条带的相对分子质量为35 000~48 000;肌原纤维蛋白中副肌球蛋白(相对分子质量为96 000)含量相对较高,其次为肌动蛋白(相对分子质量为46 000)、肌球蛋白重链(相对分子质量为200 000)和原肌球蛋白(相对分子质量为40 000)[13,25]。从图4中3、4条带还可以看出,在相对分子质量为75 000~180 000 及35 000~48 000范围内闭壳肌中存在些许蛋白条带,而足肌中蛋白条带颜色很浅或已消失,两部分肌肉纤维蛋白在相对分子质量为75 000附近出现了一条颜色较深的蛋白条带,而在相对分子质量为96 000 附近的蛋白条带颜色较浅。

注:标有不同字母者表示同一种蛋白不同组织间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters in the same protein are significantly different in different tissues at the 0.05 probability level, and the means with the same letters are not significant differences
图3 速冻皱纹盘鲍不同部位肌肉蛋白含量
Fig.3 Protein content in different parts of muscle in frozen disk abalone Haliotis discus hannai

注:M为标准蛋白;1、3、5分别为闭壳肌部分肌浆蛋白、肌原纤维蛋白和胶原蛋白;2、4、6分别为足肌部分肌浆蛋白、肌原纤维蛋白和胶原蛋白
Note: M,Maker; 1,3,5,sarcoplasmic protein,myofibrillar protein and collagen of adductor muscle; 2,4,6,sarcoplasmic protein,myofibrillar protein and collagen of pedal muscle
图4 速冻皱纹盘鲍不同部位肌肉SDS-PAGE图
Fig.4 SDS-PAGE in different parts of muscles in frozen disk abalone Haliotis discus hannai
鲍鱼的胶原蛋白主要为Ⅰ型和Ⅴ型,其中Ⅰ型广泛存在于间质结缔组织中,Ⅴ型广泛存在于细胞周围结缔组织中[26-27]。
鲍鱼肌肉酶促溶性胶原蛋白的α亚基是由3条α1肽链组成,相对分子质量约为175 000,比α链分子量更高的为β和γ链,它们分别为α链的二聚体和三聚体[17]。图4中5、6条带的蛋白分布基本相似,而条带6颜色明显更深,与上述测得的胶原含量结果(图3)一致。图中胶原蛋白的β和γ链发生了完全降解,α链存在且在相对分子质量为63 000~75 000间有降解的蛋白条带。
2.2.3 微观组织分析 图5为速冻鲍鱼闭壳肌和足肌部分在光学显微镜下的纵切面图。根据Van Gieson染色原理,肌纤维呈现黄色,而胶原纤维呈现红色。由图5可知,闭壳肌中肌纤维纵横交错、具有一定的方向性,纤维较细,其周围分布的小红点为胶原蛋白[3],纤维间空隙较小。足肌中肌纤维呈平行排列,纤维较粗,纤维间的红点比闭壳肌密集,说明此部分胶原蛋白含量较高,这也与之前所测的蛋白含量(图3)结果相符。

图5 速冻皱纹盘鲍不同部位肌肉组织结构纵切面图
Fig.5 Longitudinal section structure in different parts of muscle in frozen disk abalone Haliotis discus hannai
3 讨论
3.1 速冻鲍鱼的肌肉营养成分
赖氨酸被称为“生长性氨基酸”[28],为人体限制性氨基酸。速冻鲍鱼肌肉中含有丰富的赖氨酸与苏氨酸,可以促进机体内蛋白质的合成及增强机体免疫力[29-30]。闭壳肌和足肌中必需氨基酸与总氨基酸的比值无显著性差异(P>0.05),低于FAO/WHO的理想模式推荐比例(EAA/TAA=0.40)[31],这与刘先进等[4]、郭远明等[5]的研究结果一致。闭壳肌在必需氨基酸、非必需氨基酸、氨基酸总量及AAS和CS评分方面均高于足肌,可以认为闭壳肌的营养价值相对较高,是获取氨基酸的优质部位,但加工处理造成了两部分肌肉在基本营养组成方面存在一些差异,这与各组织在生物体内发挥的功能密切相关[32],需要进一步研究。
3.2 速冻鲍鱼的肌肉质地
3.2.1 蛋白组成 一般来说,水产品中肌浆蛋白占总蛋白的20%~35%,盐溶性蛋白占60%~70%,不溶性蛋白(主要为胶原蛋白)占3%~10%[33]。本研究中,高含量的肌浆蛋白可能是由于加工处理对肌肉细胞骨架造成了破坏,导致肌原纤维蛋白发生降解、疏水性基团暴露、肌原纤维蛋白含量降低、肌浆蛋白相对含量增大。肌原纤维蛋白是构成细胞骨架的重要盐溶性蛋白,其含量在一定程度上可以反映蛋白质变性情况。商品鲍鱼一般均会经过漂烫处理,处理温度在60~90 ℃。本试验中肌原纤维蛋白的降解,一方面可能是由于漂烫导致,肌原纤维的变性温度为40~60 ℃[34-36],加热促使肌原纤维蛋白变性,溶解度降低,含量减少。王耀耀[25]在pH为7.0、离子强度为0.6 mol/L(NaCl)的条件下加热鲍鱼肌肉时也发现,鲍鱼肌原纤维蛋白在40~50 ℃时发生急剧变性。另一方面可能是由于蛋白冷冻变性造成。随着冻藏时间的增加,盐溶性蛋白含量会逐渐降低[24,37-38]。胶原蛋白是结缔组织的主要成分,也是肌肉中另一种有重要作用的蛋白质。胶原蛋白不仅可以作为蛋白质与多糖相互作用网络的重要组成部分,还可以影响细胞骨架的网络结构,介导细胞黏附及细胞迁移[26]。足肌部分胶原含量较高,这与之前学者的研究结果一致[3,10]。
3.2.2 蛋白分布 在商业冻藏温度(-18 ℃)下,尽管酶活受到抑制,但仍可以缓慢地发挥作用[24,39],且当温度上升时(温度波动、解冻),酶活性可以迅速恢复。本研究中,速冻鲍鱼肌肉水溶性蛋白集中在相对分子质量为35 000~48 000的条带,初步推测可能是一些酶类,如肌酸激酶及油醛-3-磷酸脱氢酶等[40],但仍然需要通过免疫印迹或质谱的方法加以确定,并通过酶活力测定判断其是否仍具有生物活性。肌原纤维蛋白是维持细胞骨架完整性的功能性蛋白,在速冻处理过程中,肌原纤维蛋白会发生变性,聚集形成一些大分子的不溶物或氧化导致巯基形成分子内二硫键或氧化其他基团[41],从而造成含量降低。本研究中,两部分肌肉浓缩胶顶端出现的条带推测可能是肌原纤维蛋白中某些蛋白以Tyr-Tyr、羰基与氨基等方式共价交联所导致的[42]。胶原分解的第一步需要专一性的酶将胶原分子的三股螺旋结构打开,后与其他非专一性酶发生作用。本研究中胶原蛋白的降解可能是冻藏过程及解冻过程中胶原酶及其他酶共同作用所导致。蒋晓庆[27]在研究草鱼肉中胶原条带在冰藏和微冻条件下的降解情况中发现,γ 链和β链分别在冰藏的第6天和第15天发生完全降解,且胶原蛋白在加入粗胶原酶后发生了类似的降解。
3.2.3 微观组织 通过对肌肉的微观组织观察,可以清晰地了解到不同组织、细胞的形态结构,对于海洋软体动物来说,纤维束的直径、粗细及纤维与纤维间的距离等都会影响鲍鱼肌肉的质地,纤维束越小,肌肉越紧实[43]。本研究中,鲍鱼闭壳肌中较细的肌纤维正好反映了其较好的嫩度。在鲜活鲍鱼的组织结构中,肌纤维纵横交错贯穿于肌肉细胞中,纤维间隙较小,而在本研究中,两部分肌肉,尤其是足肌部分肌纤维已凝结成块,产生较大空隙,部分呈平行排列,推测有可能是鲍鱼受到了加热处理所导致[44]。但本次试验对象为速冻鲍鱼,在冻藏过程中冰晶的产生及增加也可能对肌纤维产生了挤压造成纤维间空隙变大,故加热和冻藏的共同作用对肌肉组织的影响程度需要进一步的探究。总体来说,闭壳肌部分肌纤维变形较小,接近新鲜鲍鱼肉,嫩度较好,而足肌部分受加工影响较大,品质相对于闭壳肌较差。
4 结论
(1)冷冻鲍鱼的蛋白质含量丰富,脂肪含量远低于其他水产品,是补充优质蛋白(赖氨酸与苏氨酸)的来源。
(2)闭壳肌与足肌两部分肌肉中的肌浆蛋白、胶原蛋白分布相似,而肌原纤维蛋白分布差异较大且两部分肌肉中蛋白含量存在显著性差异。
(3)微观结构表明,两部分肌肉的肌纤维存在差异,这可能就是导致两部分肌肉质地差异的原因。因此,在以后的加工过程中应充分考虑两部分肌肉的性质差异,选择合适的加工方式,降低营养损失。
[1] 农业农村部渔业渔政管理局.2019中国渔业统计年鉴[J].北京:中国农业出版社,2019.
[2] 郑瑞生,王则金,童金华,等.鲍鱼冻藏过程生化及感官指标变化研究[J].中国食品学报,2012,12(11):170-177.
[3] 肖桂华,朱蓓薇,董秀萍,等.鲍鱼腹足不同部位的质构特性及组织结构研究[J].食品科技,2010,35(11):155-159.
[4] 刘先进,陈胜军,李来好,等.四种鲍鱼肌肉营养成分分析与品质评价[J].食品与发酵工业,2018,44(5):227-231.
[5] 郭远明,张小军,严忠雍,等.皱纹盘鲍和杂色鲍肌肉主要营养成分的比较[J].营养学报,2014,36(4):403-405.
[6] 刘先进.不同品种、产地与养殖模式鲍鱼营养品质评价与鲍鱼内脏多糖活性功能研究[D].上海:上海海洋大学,2018.
[7] 刘倩,高澄宇,黄金发,等.鲍鱼冷风干燥和自然晾晒试验的比较分析[J].渔业现代化,2012,39(4):42-47.
[8] 张亚琦.鲍鱼的物性学研究及加工工艺探讨[D].青岛:中国海洋大学,2008.
[9] 游银川.皱纹盘鲍肌肉质构相关蛋白酶的研究[D].厦门:集美大学,2016.
[10] Olaechea R P,Ushio H,Watabe S,et al.Toughness and collagen content of abalone muscles[J].Bioscience,Biotechnology,and Biochemistry,1993,57(1):6-11.
[11] Gao Xin,Tang Zhixu,Zhang Zhaohui,et al.Rheological properties and structural changes in different sections of boiled abalone meat[J].Journal of Ocean University of Qingdao,2003,2(1):44-48.
[12] Gao Xin,Tashiro Y,Ogawa H.Rheological properties and structural changes in steamed and boiled abalone meat[J].Fisheries Science,2002,68(3):499-508.
[13] 郝林娟,陈俊,郝更新,等.鲍鱼不同部位肌肉的成分和热特性[J].食品工业科技,2017,38(24):1-5.
[14] 白利霞.冷冻带壳鲍鱼加工工艺的研究[D].福州:福建农林大学,2011.
[15] 汪婷,黄凯,孙琳琳,等.禾花鲤肌肉营养成分分析与安全性评价[J].南方农业学报,2019,50(7):1579-1586.
[16] 张龙.菲律宾蛤仔(Ruditapes philippinarum)的蛋白分布特性[D].大连:大连海洋大学,2016.
[17] 袁起新.鲍鱼胶原蛋白的提取、分离及性质研究[D].大连:大连工业大学,2011.
[18] Iso N,Mizuno H,Saito T,et al.An analysis of the stress-relaxation curve obtained from a sample of raw meat sample[J].Nippon Suisan Gakkaishi,1983,49(6):949-952.
[19] 姜鹏飞,郭敏强,祁立波,等.巴沙鱼与龙利鱼肌肉中营养成分分析及安全性评价[J].大连工业大学学报,2018,37(5):340-344.
[20] 林虬,颜孙安,姚清华,等.不同种文昌鱼营养成分分析与评价[J].营养学报,2017,39(5):510-512.
[21] 祝亚辉,曹文红,刘忠嘉,等.热加工处理对华贵栉孔扇贝柱特征风味形成的影响[J].食品科学,2017,38(20):131-138.
[22] 王广军,孙悦,郁二蒙,等.澳洲淡水龙虾与克氏原螯虾肌肉营养成分分析与品质评价[J].动物营养学报,2019,31(9):4339-4348.
[23] 杨华,张建斌,吴晓,等.冰温贮藏对鲢、草、鲤鱼糜制品品质的影响[J].食品科学,2016,37(12):273-278.
[24] 卢涵.鳙鱼肉低温贮藏过程中蛋白氧化、组织蛋白酶活性与品质变化规律的研究[D].北京:中国农业大学,2017.
[25] 王耀耀.鲍鱼肌原纤维蛋白的提取及性质研究[D].大连:大连工业大学,2011.
[26] 王诚.胶原蛋白酶在鲤鱼肌肉软化过程中的作用及机理研究[D].厦门:集美大学,2013.
[27] 蒋晓庆.草鱼片低温贮藏过程中胶原变化及品质控制研究[D].无锡:江南大学,2016.
[28] 杨立,张波涛,邵凤娟.巢湖太湖新银鱼营养成分分析及营养评价[J].科学养鱼,2018(8):72-74.
[29] 王一冰,蒋守群,苟钟勇,等.赖氨酸的生物学功能及肉鸡营养需要量的研究[J].广东畜牧兽医科技,2018,43(6):17-20.
[30] 李俊明,贺强,袁超,等.苏氨酸的营养生理功能及其在畜禽日粮中的应用[J].中国饲料,2014(11):35-38.
[31] 李正中.花粉、灵芝与珍珠中必需氨基酸的定量测定与分析比较[J].氨基酸杂志,1988(4):41-43.
[32] Neves R J.Bivalve molluscs:biology,ecology,and culture[J].Transactions of the American Fisheries Society,2004,133(5):1290.
[33] 熊善柏.水产品保鲜储运与检验[M].北京:化学工业出版社,2007.
[34] Martens H,Stabursvik E,Martens M.Texture and colour changes in meat during cooking related to thermal denaturation of muscle proteins[J].Journal of Texture Studies,1982,13(3):291-309.
[35] Davey C L,Gilbert K V.Temperature-dependent cooking toughness in beef[J].Journal of the Science of Food and Agriculture,1974,25(8):931-938.
[36] Wright D J,Leach I B,Wilding P.Differential scanning calorimetric studies of muscle and its constituent proteins[J].Journal of the Science of Food and Agriculture,1977,28(6):557-564.
[37] 崔瑞颖,焦学芹,崔波,等.冻藏对海湾扇贝闭壳肌蛋白质变性及组织结构的影响[J].食品工业科技,2013,34(22):298-301.
[38] Pan Saikun,Wu Shengjun.Effect of chitooligosaccharides on the denaturation of weever myofibrillar protein during frozen storage[J].International Journal of Biological Macromolecules,2014,65:549-552.
[39] Nambudiri D D,Gopakumar K.ATPase and lactate dehydrogenase activities in frozen stored fish muscle as indices of cold storage deterioration[J].Journal of Food Science,1992,57(1):72-76.
[40] Papa I,Taylor R G,Astier C,et al.Dystrophin cleavage and sarcolemma detachment are early post mortem changes on bass (Dicentrarchus labrax) white muscle[J].Journal of Food Science,1997,62(5):917-921.
[41] Poole L B,Nelson K J.Discovering mechanisms of signaling-mediated cysteine oxidation[J].Current Opinion in Chemical Biology,2008,12(1):18-24.
[42] Li Chunqiang,Xiong Youling.Disruption of secondary structure by oxidative stress alters the cross-linking pattern of myosin by microbial transglutaminase[J].Meat Science,2015,108:97-105.
[43] Øiseth S K,Delahunty C,Cochet M V,et al.Why is abalone so chewy? Structural characterization and relationship to textural attributes[J].Journal of Shellfish Research,2013,32(1):73-79.
[44] 刘倩.鲍鱼干制水发和贮藏过程中质构及流变学特性变化[D].青岛:中国海洋大学,2014.