贝类是海洋生物中重要的经济资源类群,是中国海水养殖的第一大产业。根据2018年《中国渔业统计年鉴》统计,在国内渔业生产中,贝类产量达1528万t[1]。市售扇贝产品形式丰富多样,其中以活品价值最高,活品品质控制是产业升值的核心问题。而虾夷扇贝Patinopecten yessoensis作为中国主要的经济贝类之一,养殖产业主要分布在黄海海域,近年来,国内外有关活品虾夷扇贝研究主要围绕流通过程中扇贝生化代谢展开[2-4]。
目前,对于扇贝从采捕至码头各个环节中,在生命科学和食品科学领域存在一个研究盲区,该盲区是活品供应链的品质易逝期,易逝期处置对于后期活力恢复及贮藏稳定性有不可忽视的延迟效应。杨婷婷等[5]研究表明,活品虾夷扇贝在捕后24 h呈现非愉悦的风味特征,经海水暂养1~2 d后,活品风味及品质恢复明显,以鲜、甜的愉悦风味特征为主。同样,刘慧慧等[6]对活品菲律宾蛤仔Ruditapes philippinarum的研究发现,离水初期的急骤胁迫会导致蛤仔风味快速下降,而经短时间的缺氧静置(3 d内)其生化指标及风味品质均呈现恢复。本研究团队通过实地调研[7],了解到目前国内虾夷扇贝采捕方式主要分为人工潜水采捕和拖网采捕,其中,人工潜水采捕有利于保护海底生态环境,但这种采捕方式成本高,潜水员危险大;拖网采捕工作效率高,也是主要的采捕方式。历经网具、起网、甲板卸载、分选装箱及海上转运,采捕及捕后活体频繁遭受击打及露空等胁迫,捕后早期经受的急骤胁迫所导致的应激胁迫压力,对后续暂养净化期间的恢复,以及后续流通环节的活品稳定性具有重要影响。
本研究中,针对虾夷扇贝离水早期面临的最重要的胁迫因素,即缺氧和撞击,对易逝期间扇贝活力的变化及后易逝期复水效果展开研究,并结合感官分析与生化指标分析,对扇贝活体的活力变化进行了跟踪分析,旨在探讨易逝期的胁迫处置对后易逝期扇贝活力恢复的影响。
1 材料与方法
1.1 材料
试验用虾夷扇贝为2018年12月份大连本地产商品规格虾夷扇贝。壳长平均为110 mm,平均体质量为137 g,共购买200只活品底播虾夷扇贝,均为大连长兴水产品市场当日到货,采用泡沫箱密封(碎冰降温),于1 h内运至大连海洋大学水产品加工与贮藏实验室,然后立即进行分选和贮藏处理,剔除活力弱或死亡的虾夷扇贝。
1.2 方法
1.2.1 胁迫处置及复水方案设计
(1)易逝期模拟。易逝期初始点设计:运抵实验室的虾夷扇贝活体原料处于应激状态,将其立刻置于辽宁省水产设施养殖与装备技术工程研究中心循环海水系统中进行24 h缓冲(图1)。循环海水为经3次沉淀的自然海水,溶解氧浓度为6.3 mg/L,温度为6.9 ℃。将缓冲24 h后的扇贝记为初始状态I组(initial),待进入易逝期胁迫处理。

图1 活体虾夷扇贝原料暂养缓冲示意图
Fig.1 Illustration of holding treatment for live yesso scallop Patinopecten yessoensis
易逝期胁迫处置:易逝期处置为冷却缺氧36 h,试验设缺氧组E(emersed)和碰击缺氧组E-S(emersed with mechanical shocking)两个处理组。冷却缺氧的方式为,取缓冲扇贝(I组)放置在泡沫箱内(每箱10只,共6箱),覆盖浸湿的海绵及冰袋贮藏36 h,记为E组,冷却缺氧环境参数的变化如图2所示,平均温度为2.8 ℃,湿度维持在83.9%左右。为模拟扇贝在捕捞操作中反复碰撞的实际情况,并参考Woll等[8]的试验研究,将摔打处理方式设定为,先将扇贝(I组)于1 m高处自由跌落至水泥地,连续15次摔打后用同样方式冷却缺氧贮藏(每箱10只,共6箱),记为E-S组。同时设湿藏对照组,将缓冲扇贝(I组)平铺于网筐中全程置于循环海水中湿藏,记为C组。
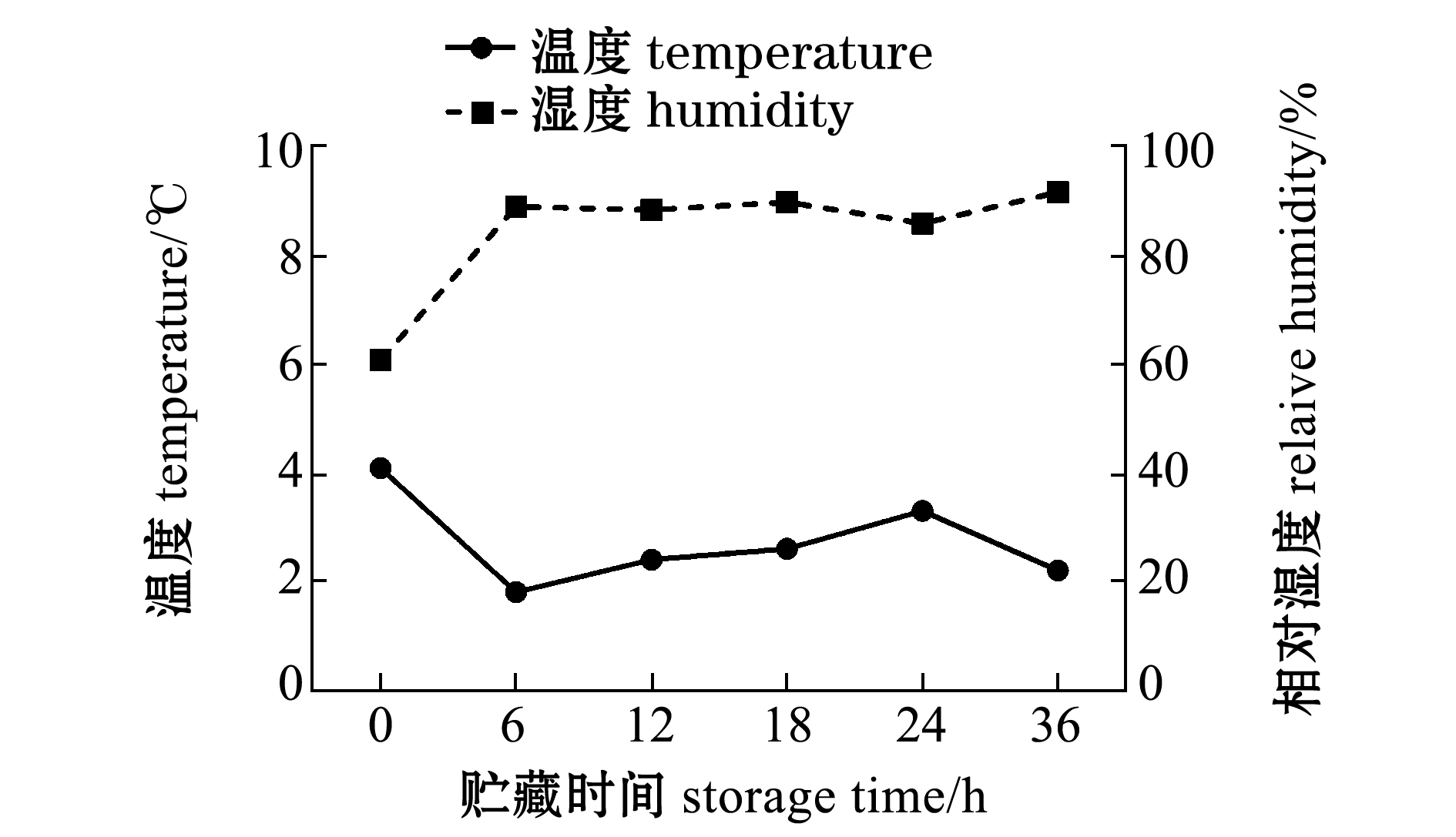
图2 易逝期冷却缺氧环境的温度及湿度
Fig.2 Atmosphere temperature and humidity under chilled emersed storage druing a quality determination period(QDP)
(2)后易逝期复水处置。将上述易逝期胁迫36 h的处理组E和E-S扇贝放入循环海水系统中复水3 d记为复水组E′和E-S′,期间每日观察死亡情况,至死亡率为50%时终止贮藏。试验全程设暂养对照组C(control)。
试验共设原料组R、缓冲组I、对照组C(湿藏组),易逝期胁迫组E和E-S,以及后易逝期复水组E′和E-S′等,各组处置细则详见表1。
表1 活体虾夷扇贝各处理组设置与取样细则
Tab.1 Information on treatments and sampling specification of live yesso scallop Patinopecten yessoensis

进程 process处理组 treatment group编码 coding处置与采样说明 treatment and sampling instruction原料raw原料rawR活体原料抵达实验室,分选后待缓冲处理原料,采样10只缓冲relaying初始点initialI循环海水系统中缓冲24 h,缓冲后作为离水点,采样10只易逝期QDP缺氧emersionE缓冲扇贝冷却缺氧36 h,分别于3、6、12、24、36 h采样,每次10只缺氧碰撞emersion with shockE-S缓冲扇贝于1 m高自由跌落至水泥地面,反复操作15次后进行冷却缺氧36 h,分别于3、6、12、24、36 h采样,每次10只后易逝期P-QDP缺氧组复水re-immersed EE′冷却缺氧结束,将剩余活体扇贝放入循环海水系统中复水3 d,于3 d后采样,每次10只缺氧碰撞组复水re-immersed E-SE-S′冷却缺氧结束,将剩余活体扇贝放入循环海水系统中复水3 d,于3 d后采样,每次10只对照组control湿藏组controlC缓冲扇贝全程置于循环海水系统中暂养,分别于3、6、12、24、36、108 h后采样,每次10只
1.2.2 分析测试
(1)各部位占比及肥满度。感官分析后,将活贝样品经手工开壳,再依次分离闭壳肌、外套膜、性腺和鳃等软体组织后称重,随即用液氮处理后于-80 ℃下保存待测。闭壳肌、性腺及外套膜为虾夷扇贝的可食部位,可食部位组织质量占总质量的百分比即为肥满度[9],并计算各部位的占比。
(2)感官分析。缩边程度:虾夷扇贝中心轴处外套膜与贝壳边缘的距离,用直尺测量。
活力强度:空气中处于开壳状态活贝受外界刺激后主动闭合的时间。刺激方式采用针灸针轻微刺入闭壳肌,根据扇贝活力状态,发生闭合的响应时间不同。受刺激后10 s内发生自主闭合判定为强活力,10 s内无自主闭合判定为弱活力。
图像记录:将活贝左壳剖离,平置余下的半壳扇贝进行拍照记录,采用样品摄影装置。
(3)生化分析。pH值:取2.0 g扇贝横纹肌,加入20 mmol/L的碘乙酸钠10 mL,冰浴下用玻璃棒捣碎,静置后用精密pH计测定闭壳肌pH值。
腺苷三磷酸(ATP)及其关联化合物:取1.0 g扇贝横纹肌,加入10 mL 5% PCA溶液,冰浴条件下捣碎10 min,用2 mol/L KOH调pH后定容至20 mL,离心并取上清液,过滤后加入1 mL 0.1 mol/L磷酸缓冲液,用高效液相色谱法进行分析。
磷酸精氨酸(ArP):提取方法同ATP关联物,采用高效液相色谱法进行分析。
腺苷酸能荷(adenylate energy charge,AEC):计算公式为
AEC=(2ATP+ADP)/[2(ATP+ADP+AMP)]。
糖原含量:用蒽酮比色法于620 nm下测定吸光度后计算葡萄糖含量。糖原含量为葡萄糖含量的1.11倍。
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示,采用SPSS 软件对试验数据进行单因素方差分析和组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 易逝期的初始点
为模拟易逝期,采捕离水前活体的状态即易逝期起始点是关键。考虑到抵达实验室的原料处于急骤应激状态,故先将扇贝置于循环海水系统中暂养缓冲,目的是消除活体高强胁迫压力,最大程度地模拟离水点状态即易逝期初始点。本试验中,活体扇贝原料(10只)的壳长、壳高、壳厚分别为(110.1±4.0)、(113.7±3.0)、(22.7±2.0)mm,体质量为(137±22)g。经计算得出:扇贝各部位质量占全贝质量的百分比依次为贝壳57.5%、软体组织40.1%、闭壳肌10.3%;总可食部位占扇贝总质量的比例即肥满度为28.4%;总软体组织中闭壳肌占25.7%,生殖腺和外套膜分别占15.6%和29.5%。
表2为活体虾夷扇贝原料暂养缓冲24 h的效果。原料(R组)采捕经运输到达水产市场,因频繁暴露在空气中,体腔液流失致使体质量下降,经缓冲后扇贝体质量明显增加,扇贝缩边程度减小;生化指标经缓冲后均有所恢复,其中,糖原、ATP含量和ACE值明显上升,扇贝活力增加。由此可见,24 h循环海水缓冲有明显恢复效果。
表2 活体虾夷扇贝原料暂养缓冲效果
Tab.2 Effects of holding on stress relief of raw live yesso scallop Patinopecten yessoensis

组别group缩边/mmshrinkage体质量/gbody weightpH值pH value糖原/(mg·g-1)glycogenATP/(μmol·g-1)ADP/(μmol·g-1)磷酸精氨酸ArP/(μmol·g-1)腺苷酸能荷AECR(原料 raw)4.31387.3021.065.0711.158.480.89I(缓冲 relay)0.11577.3229.475.650.499.600.95
2.2 易逝期胁迫对活品能量指标的影响
2.2.1 ATP及其关联化合物含量及AEC值 从图3可见:0~36 h缺氧贮藏过程中,缺氧E组的ATP含量前12 h基本保持不变,随后由5.52 μmol/g缓慢下降到36 h的4.84 μmol/g,而缺氧碰撞E-S组在12 h后下降幅度较对照组明显,36 h达到最小值3.89 μmol/g;E组与E-S组ADP含量在24 h内变化趋势相似,36 h两组ADP含量均略有增加;与对照组相比,易逝期内两个处理组虾夷扇贝的AEC值均呈下降趋势。

图3 易逝期虾夷扇贝ATP关联化合物含量及AEC值
Fig.3 ATP-related compound content and AEC value of yesso scallop Patinopecten yessoensis under chilled storage emmersed during quality determination period
2.2.2 ArP含量 从图4可见:与对照组相比,缺氧E组和缺氧碰撞E-S组在短期内(12 h),ArP变化趋势无明显差异,均呈下降趋势;随着缺氧时间延长,二者的变化呈现明显差异。

图4 易逝期虾夷扇贝ArP含量变化
Fig.4 Changes in ArP content of yesso scallop Patinopecten yessoensis under chilled storage emmersed during quality determination period
2.2.3 pH值及糖原含量 从图5可见:与对照组相比,缺氧E组贮藏36 h的过程中,肌肉pH值呈缓慢下降趋势,E、E-S处理组在易逝期前12 h下降趋势相似,缺氧碰撞E-S组在12 h后下降趋势比E组更加明显,在36 h达到最小值7.17;E组和E-S组在易逝期内糖原含量均呈下降趋势,随着缺氧时间延长,E-S组的糖原含量在12 h后快速下降,36 h时糖原含量仅为初始值的65%。
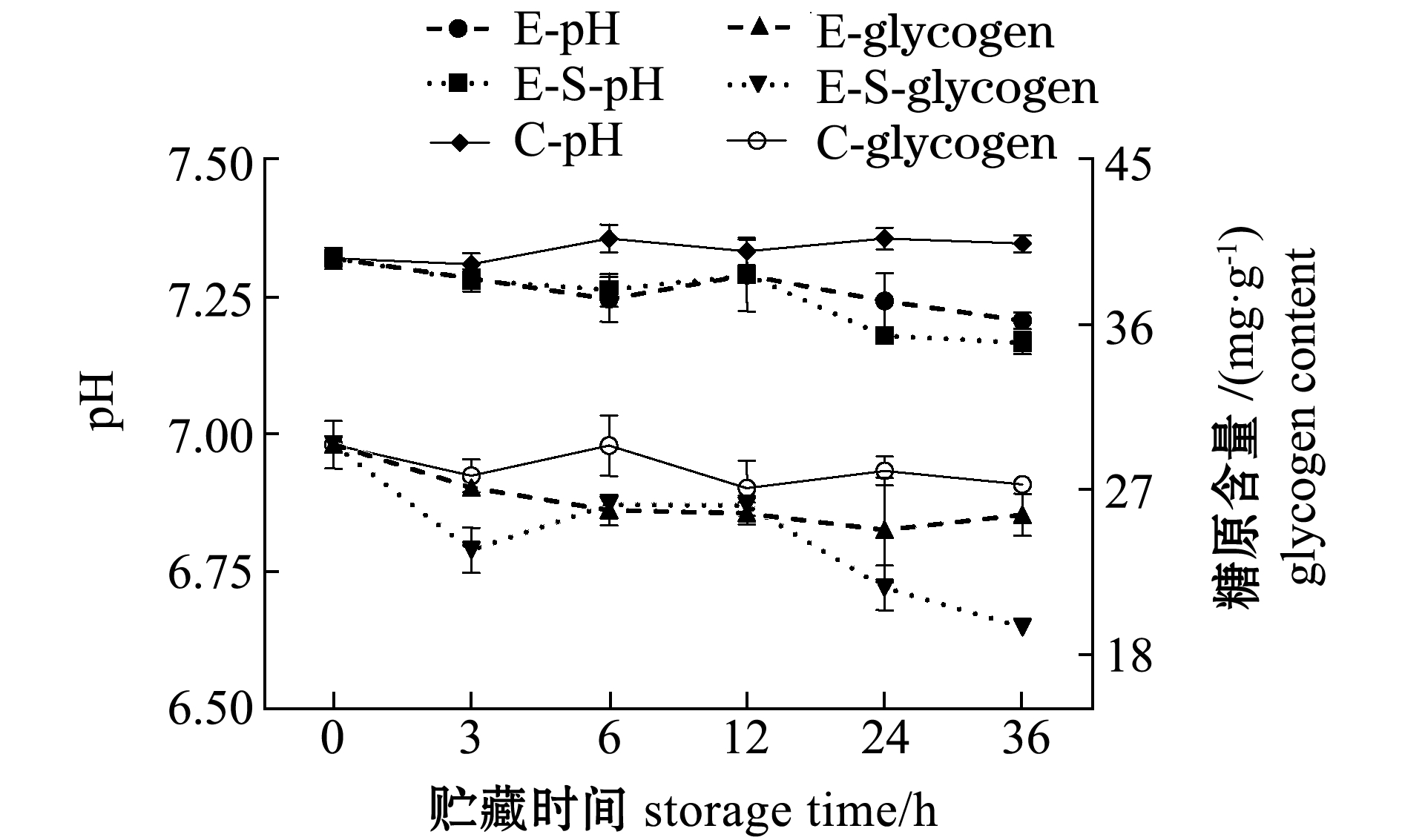
图5 易逝期虾夷扇贝pH和糖原含量变化
Fig.5 Glycogen content and pH of yesso scallop Patinopecten yessoensis under chilled storage emmersed during quality determination period
2.3 后易逝期扇贝活力恢复效果
2.3.1 ATP及其关联化合物含量及AEC值 从图6可见:初始点I组扇贝ATP、ADP含量及AEC值分别为5.65 μmol/g、0.49 μmol/g及0.95;复水后E、E-S两个处理组的ATP含量及AEC值的恢复性与初始点相比均有显著性差异(P<0.05),E组ATP含量及AEC值分别由易逝期的4.84 μmol/g及0.91恢复至5.21 μmol/g及0.96(E′组),接近初始点I组;E-S组ATP及AEC则未恢复且持续下降,由易逝期的3.90 μmol/g及0.94下降到3.52 μmol/g及0.79(E-S′组)。

注:标有不同字母者表示同一指标不同贮藏条件组间有显著性差异(P<0.05),标有相同字母者表示无显著性差异(P>0.05),下同
Note: The means with different letters in same index are significantly different in different groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图6 后易逝期虾夷扇贝ATP关联化合物含量及AEC值变化
Fig.6 ATP-related compound content and AEC value of yesso scallop Patinopecten yessoensis re-immersed during post quality determination period
2.3.2 ArP含量 从图7可见:初始点I组扇贝ArP含量为9.59 μmol/g,缺氧E组复水3 d后含量恢复至9.16 μmol/g(E′组),与对照组接近;缺氧碰撞E-S组虽然在冷却缺氧结束时ArP含量与初始点I组扇贝ArP含量无显著性差异(P>0.05),但复水3 d后ArP含量持续下降至4.38 μmol/g(E-S′组)(P<0.05)。
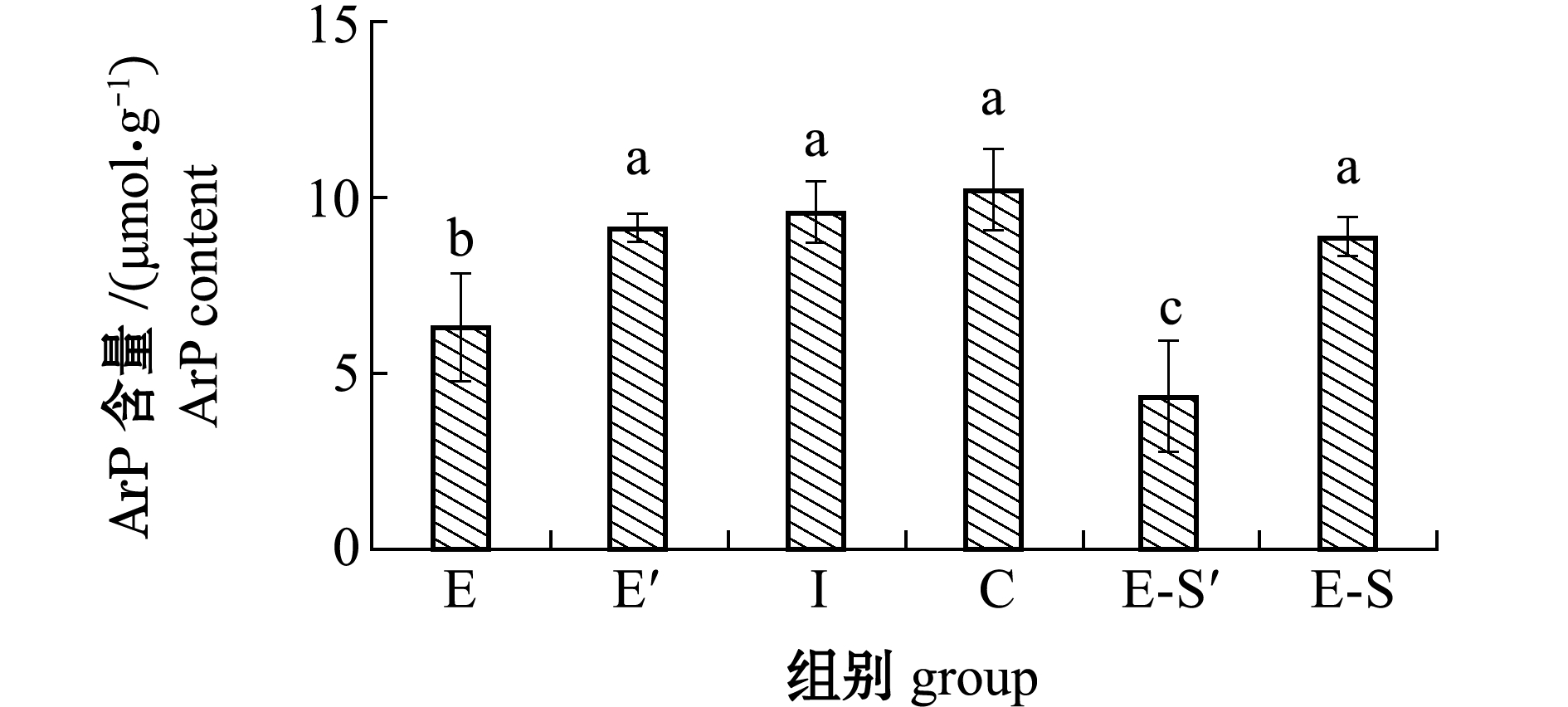
图7 后易逝期虾夷扇贝ArP含量变化
Fig.7 Changes in ArP content of yesso scallop Patinopecten yessoensis re-immersed during post quality determination period
2.3.3 pH值及糖原含量 从图8可见:复水3 d后,缺氧E组虾夷扇贝肌肉pH值恢复到7.29(E′组),与初始点I组肌肉pH 7.32接近(P>0.05),而缺氧碰撞E-S组在冷却缺氧结束后pH值继续下降至6.90(E-S′组),与初始点I组有显著性差异(P<0.05);复水3 d后,E组扇贝糖原含量恢复至27.84 mg/g(E′组),E-S组在冷却缺氧期间糖原与初始点I组相比显著下降(P<0.05),其与复水后(E-S′组)无明显变化(P>0.05)。
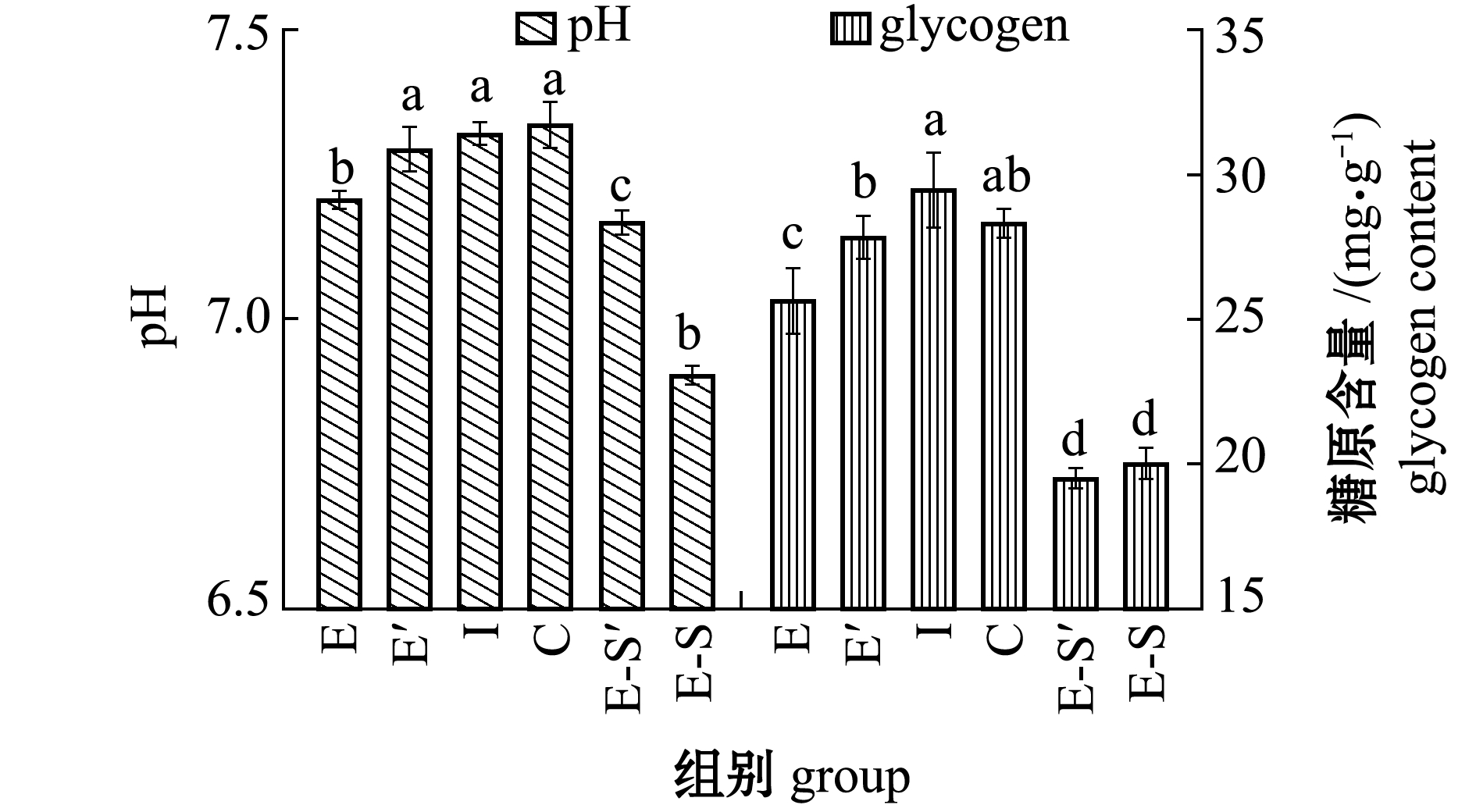
图8 后易逝期虾夷扇贝pH和糖原含量变化
Fig.8 Changes in glycogen content and pH of yesso scallop Patinopecten yessoensis re-immersed during post quality determination period
2.4 扇贝活力的感官特性变化
从表3可见:初始点I组扇贝均处于强活力状态,外部刺激后迅速发生强有力的自主闭合,10 s内闭合次数不等,为3~5次;缺氧组在初期活力表现良好,刺激外套膜和闭壳肌后10 s内自主闭合且有力,缺氧贮藏12 h之后活力弱的扇贝开始出现,经3 d复水后,样品扇贝均恢复至强活力状态;缺氧碰撞组扇贝在缺氧贮藏3 h就开始出现活力下降,弱活力扇贝达10%,且随着缺氧时间延长,活力弱的扇贝数量越来越多,在复水3 d后,活力极差,多数扇贝闭壳肌无自主收缩能力,弱活力扇贝数量达90%,且内部组织表面附着黏液。
表3 胁迫强度对虾夷扇贝感官活力(弱活力状态扇贝占比)的影响
Tab.3 Effects of stress intensity on sensory vitality of yesso scallop Patinopecten yessoensis (percent of weak scallop in total scallop) %
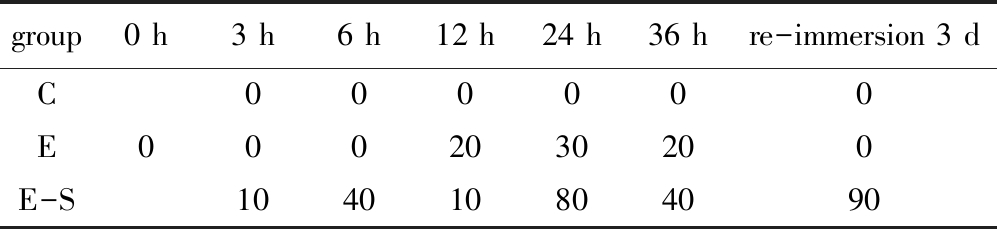
group0 h3 h6 h12 h24 h36 hre-immersion 3 dC000000E0002030200E-S104010804090
软体组织缩边程度及外观变化分析结果如图9、图10所示,初始点I组扇贝外套膜饱满,几乎无缩边;随着干露时间延长,缺氧组E和缺氧碰撞E-S组逐渐出现缩边现象,胁迫强度与缩边程度呈现正相关;至贮藏36 h时,E组扇贝的外套膜缩边程度平均从0.0 mm增加到6.8 mm左右,E-S组则从0.0 mm增加到9.0 mm左右,缩边的同时伴随着体腔液流失。复水3 d后,E组扇贝缩边现象有所恢复,外套膜恢复饱满各部位清楚可见;同样,E-S组缩边程度显著增加,由9.0 mm增加到23.1 mm,外套膜缩边则未恢复且失去与贝壳粘连性,各软体组织边缘模糊,整体品质下降明显。
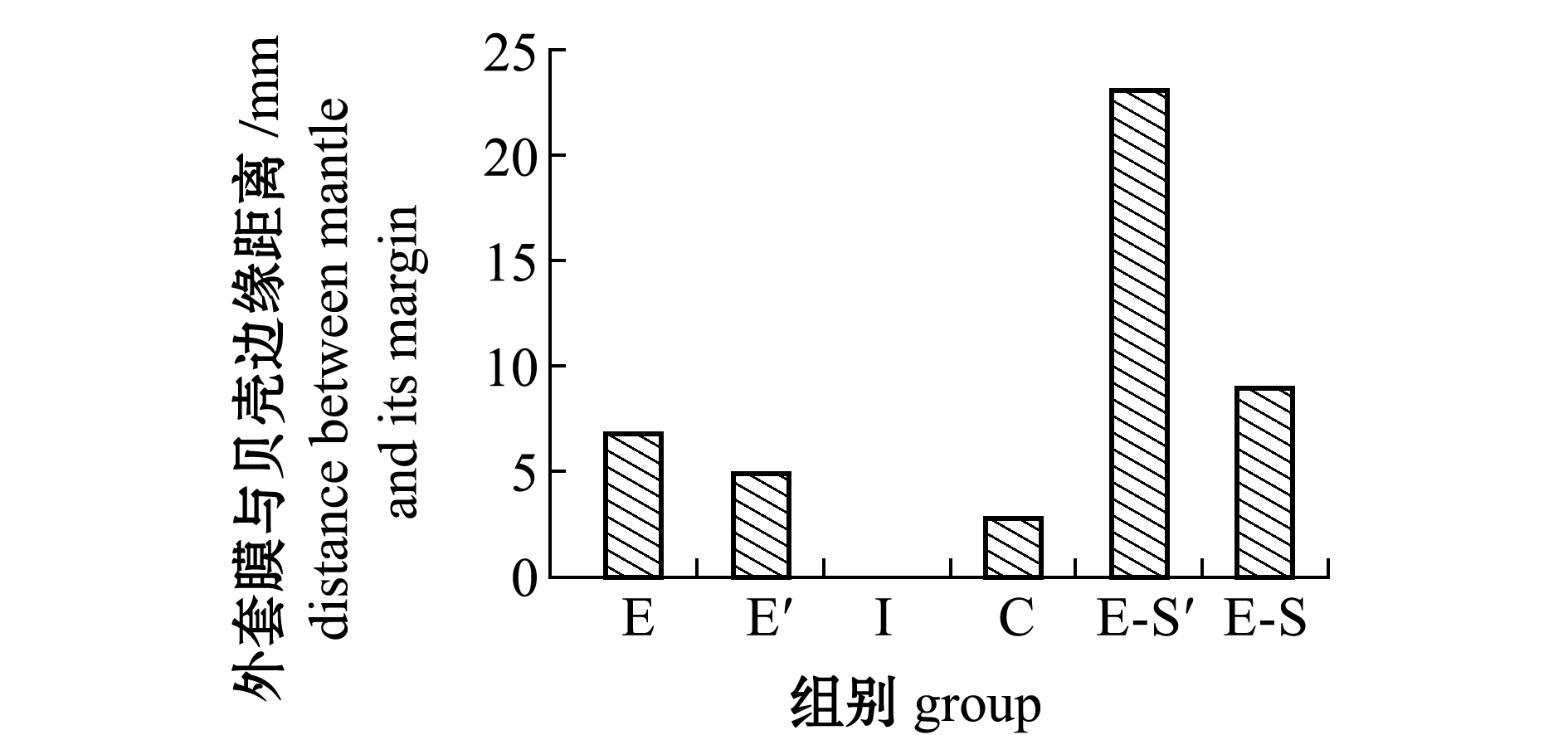
图9 易逝期及后易逝期活体虾夷扇贝外套膜缩边情况
Fig.9 Mantle shrinkage of live yesso scallop Patinopecten yessoensis during QDP and P-QDP

图10 易逝期及后易逝期期间的活品虾夷扇贝外观及软体组织形态
Fig.10 Soft tissue appearance of live yesso scallop Patinopecten yessoensis during QDP and P-QDP
3 讨论
3.1 易逝期胁迫对活体扇贝生理状态的影响
本研究表明,在相同冷却缺氧贮藏条件下,离水初期遭受高强度物理胁迫的扇贝与无摔打扇贝相比,易逝期内具有更强烈的应激反应,同时,摔打对扇贝活力影响滞后,在易逝期内就出现了明显的延迟效应,两个处理组在12 h之后生理代谢差异越来越明显,品质有所区别。
ATP在提供能量时转化成ADP和AMP[6], ATP主要通过三羧酸循环产生,这一过程需要氧气参与。本研究中,在冷却缺氧中虾夷扇贝无充足氧气,无法维持ATP含量稳定,所以两个处理组的ATP均有下降趋势;与缺氧E组相比,离水后遭受高强度碰击的E-S组,在12 h后ATP呈现陡然下降的趋势。
AEC值广泛应用于评价贝类的生理状态,能够灵敏地反映贝类所受到的胁迫,AEC值为0.8~0.9时贝类状态良好可繁殖,为0.5~0.7时贝类处于缓慢生长但可恢复繁殖状态,为0.5以下时贝类无法繁殖且为不可逆状态[10]。Maguire等[11]在研究中发现,扇贝缺氧6 h后AEC值变化呈类似的趋势。磷酸精氨酸(ArP)是无脊椎动物体内重要的磷酸原,其作用类似于脊椎动物体内的磷酸肌酸[12]。当ATP大量消耗时,ArP在精氨酸激酶的作用下,可将高能磷酸盐转移给ADP从而合成ATP,此时ArP起到了ATP“缓冲池”作用[13]。本研究中在易逝期内,在磷酸精氨酸激酶作用下ArP合成ATP,为缺氧贮藏提供了能量,所以缺氧E组和缺氧碰撞E-S组虾夷扇贝的ArP整体上均呈下降趋势。郑尧[13]在缺氧条件下闭壳肌中能量物质的变化研究中发现,ArP含量在缺氧3 d后几乎完全耗尽,与本研究结果一致。
pH值是反映贝类生化状态的指标,本研究中由于供氧量低,缺氧组扇贝主要进行无氧呼吸产生章鱼碱等酸性物质,随贮藏时间延长pH值下降,也有可能是由OpDHs生成opins引起的[14]。将狮爪扇贝Nodipecten subnodosus活体解剖后闭壳肌冰藏,其肌肉pH在15 d内无明显变化[15],可能是由于冰藏鲜品与冻品代谢通路不一样。Fatima等[16]研究表明,若pH显著增加,则表明随着时间的推移细菌的碱性代谢物积累,龙虾肌肉在冰中储存15 d后,细菌数量较少且肌肉无腐败。
糖原又称肝糖或糖元,是一种动物淀粉,由葡萄糖结合而成的支链多糖;尽管磷酸盐和L-天冬氨酸是厌氧能量提供的主要基质,但糖原是厌氧能量过程中的主要能量来源[17]。在冷却缺氧贮藏过程中,糖原是扇贝饥饿状态下的主要供能物质[18],本研究中,与对照组相比,两个处理组糖原含量持续下降,扇贝闭壳肌中的生理性糖原分解似乎受磷酸化酶活性的变化调节,这取决于葡萄糖、AMP和ATP的浓度[19]。
3.2 不同胁迫强度对后易逝期活体扇贝活力恢复效果的影响
本研究表明,易逝期内缺氧胁迫对扇贝生理影响较强烈,但扇贝返回“舒适”环境后状态可恢复,缺氧并不会对活体造成负面的延迟效应,物理撞击虽然在易逝期内对生化指标影响表现不明显,但复水后扇贝活力明显下降,表明易逝期撞击形成的物理胁迫对活体活力造成了不可逆性损伤,对后易逝期活品呈现明显的负面延迟效应。
本研究中,缺氧组E复水后ATP关联物含量逐渐接近初始值,生化代谢趋于稳定;而缺氧碰撞E-S组扇贝ATP关联物含量与初始值具有显著性差异。刘金洋等[10]在虾夷扇贝缺氧复水研究中也发现同样现象,扇贝在低温下干藏0、12、24 h后复水,ATP含量呈恢复趋势。AEC值更直观显示了虾夷扇贝复水3 d后的生理状态,缺氧组E状态良好,缺氧碰撞E-S组不仅未恢复且活力更差。值得关注的是,易逝期结束时,E组与E-S组的AEC值并无显著性差异,易逝期的滞后表现在复水后二者的差异。捕后早期物理撞击胁迫对扇贝活体的延迟效应不可忽视,对后续的活品扇贝流通品质极为不利。ArP变化相对于ATP能从更早的阶段灵敏准确地反映活品品质,复水后E-S组ArP含量持续下降,与缺氧组E组扇贝品质出现明显区别。糖酵解生成的丙酮酸被氧化成乙酸,可导致pH不断下降[20],故扇贝摔打后可能由于代谢模式改变,即使回到循环海水环境中,酸性物质也持续积累导致pH值持续下降。Hummel等[21]发现,在糖原含量较高的动物中,开始3~7 d内分别在高温和低温下糖原不被使用,在这一潜伏期后,糖原浓度往往下降,同时伴随着高死亡率和乙酸浓度的增加。本研究中复水后,扇贝的呼吸方式恢复至有氧方式,生理代谢恢复正常,糖原含量有所积累,但缺氧碰撞组由于扇贝活力较弱,故糖原含量低且无恢复。刘金洋等[10]的试验也证明,与缺氧、温度胁迫相比,摔打后扇贝复水期间糖原含量低且无恢复,再次证明了早期物理撞击对虾夷扇贝的复水后生理影响强烈且不可逆。
3.3 不同胁迫强度对扇贝活力及感官的影响
感官评价方法对于水产品品质评价非常重要,广泛用于水产原料的鲜度判别及水产品风味品质特性分析。针对水产品鲜度,Bernardi等[22]开发了一种感官方法即质量指数方法(QIM),是基于质量测量的结构化缩放,并提供关于新鲜度的准确信息,以及对特定鱼类剩余保质期的预测;随后,Lanzarin等[23]运用Bernardi等[22]创立的QIM法对冰藏亚马逊大西洋马鲛进行货架期预测。
有关贝类的感官分析,目前主要围绕活品风味品质进行评价,杨婷婷等[5]通过建立感官分析描述词以便能够客观评价活品底播虾夷扇贝的风味品质,刘慧慧[24]建立了活品菲律宾蛤仔感官评价小组,通过征集、筛选感官描述词,最终确立了30个菲律宾蛤仔的感官描述词。对于贝类活力状态的感官评价尚缺乏深入科学的研究报道。感官法是贝类活力评价最直接有效的方法,本研究团队基于研究实践操作经验积累及相关科学理论,尝试建立标准化刺激响应方案,籍此规范活品虾夷扇贝感官活力评价方法。本研究中,结合对“缩边”和软体组织等变化的观测,经多种尝试,发现针灸针刺激扇贝外套膜和闭壳肌,可模仿海星触角的方法,从而判断扇贝活力及对外界刺激反应是否灵敏,其优点是简单便捷、样品保存完好且对活力无影响,测试人员几乎不需要专业培训。
结合感官分析与生化指标分析结果,可知捕后早期胁迫强度越大,扇贝越易逝;适度胁迫复水后扇贝活力可恢复,过度胁迫扇贝活力可恢复性极差甚至不可恢复,具有明显的延迟效应。然而,活品活力变化过程复杂,需将此方法进一步细化,以便更真实准确地反映虾夷贝类捕后活力变化情况。
4 结论
(1)活体原料经缓冲后对消除外界胁迫应激有积极影响,缓冲后各项活力指标均得以有效恢复,其中ATP含量、糖原含量及AEC值均上升。
(2)易逝期缺氧和碰击胁迫对活体虾夷扇贝均造成活力损伤,各项生化指标均呈下降趋势,感官活力缺氧E组和缺氧碰撞E-S组两个处理组出现不同程度的缩边,与E组相比,E-S组对外界刺激响应更加迟钝。
(3)后易逝期结束时,E组和E-S组活品可恢复性呈现显著差异,E组各项生命指标有所恢复并对外部刺激的反应灵敏,而E-S组生命指标不可恢复且对外部刺激的反应非常迟缓。
可见,品质易逝期QDP内胁迫强度的调控对后易逝期P-QDP环节活品活力状态有延迟效应;早期胁迫强度越高,复水后的活力可恢复性越低,势必会影响活品的货架寿命。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2018中国渔业统计年鉴[M].北京:中国农业出版社,2018.
[2] 宋扬,张晴,周晏琳,等.虾夷扇贝横纹肌和平滑肌的蛋白分布及理化性质[J].水产学报,2017,41(11):1798-1805.
[3] Duncan P F.Post-harvest physiology of the scallop Pecten maximus (L.)[D].Glasgow:University of Glasgow,1993.
[4] 周晏琳,郑尧,刘慧慧,等.干露对活品虾夷扇贝闭壳肌SOD酶活性及其性质的影响[J].大连海洋大学学报,2018,33(5):651-657.
[5] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
[6] 刘慧慧,刘俊荣,田元勇,等.易逝期干露对菲律宾蛤仔活品净化及贮藏特性的影响[J].大连海洋大学学报,2019,34(1):109-118.
[7] 于笛,刘俊荣,杨君德,等.海水养殖虾夷扇贝供应链可追溯管理体系的探讨[J].水产科学,2013,32(2):117-124.
[8] Woll A K,Bakke S.Stress and mortality in the supply chain of live scallops Pecten maximus L.,from scuba diver to market[J].Aquaculture Research,2017,48(2):594-607.
[9] 周晏琳.基于抗氧化机制的活品虾夷扇贝品质评价[D].大连:大连海洋大学,2019.
[10] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
[11] Maguire J A,Coleman A,Jenkins S,et al.Effects of dredging on undersized scallops[J].Fisheries Research,2002,56(2):155-165.
[12] Chen Le,Qiu Junlang,Tang Yijia,et al.Rapid in vivo determination of tetrodotoxin in pufferfish (Fugu) muscle by solid-phase microextraction coupled to high-performance liquid chromatography tandem mass spectrometry[J].Talanta,2017,171:179-184.
[13] 郑尧.虾夷扇贝闭壳肌中的章鱼碱脱氢酶及其捕后变化[D].大连:大连海洋大学,2018.
[14] Gäde G,Grieshaber M K.Pyruvate reductases catalyze the formation of lactate and opines in anaerobic invertebrates[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1986,83(2):255-272.
[15] Pacheco-Aguilar R,Marquez-Ríos E,Lugo-Sánchez M E,et al.Postmortem changes in the adductor muscle of Pacific lions-paw scallop (Nodipecten subnodosus) during ice storage[J].Food Chemistry,2008,106(1):253-259.
[16] Fatima R,Qadri R B.Quality changes in lobster (Panulirus polyphagus) muscle during storage in ice[J].Journal of Agricultural and Food Chemistry,1985,33(1):117-122.
[17] Grieshaber M K,Hardewig I,Kreutzer U,et al.Physiological and metabolic responses to hypoxia in invertebrates[M]//Reviews of Physiology,Biochemistry and Pharmacology.Berlin,Heidelberg:Springer,1993:43-147.
[18] Patrick S,Faury N,Goulletquer P.Seasonal changes in carbohydrate metabolism and its relationship with summer mortality of Pacific oyster Crassostrea gigas (Thunberg) in Marennes-Oléron bay (France)[J].Aquaculture,2006,252(2-4):328-338.
[19] Hata K,Yokoyama I,Suda M,et al.Purification and properties of glycogen phosphorylase from the adductor muscle of the scallop,Patinopecten yessoensis[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1987,87(4):747-753.
[20] Kawabe S,Takada M,Shibuya R,et al.Biochemical changes in oyster tissues and hemolymph during long-term air exposure[J].Fisheries Science,2010,76(5):841-855.
[21] Hummel H,De Wolf L,Zurburg W,et al.The glycogen content in stressed marine bivalves:the initial absence of a decrease[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1989,94(4):729-733.
[22] Bernardi D C,Mársico E T,De Freitas M Q.Quality Index Method (QIM) to assess the freshness and shelf life of fish[J].Brazilian Archives of Biology and Technology,2013,56(4):587-598.
[23] Lanzarin M,Ritter D O,Novaes S F,et al.Quality index method (QIM) for ice stored gutted Amazonian Pintado (Pseudoplatystoma fasciatum×Leiarius marmoratus) and estimation of shelf life[J].LWT - Food Science and Technology,2016,65:363-370.
[24] 刘慧慧.采捕后菲律宾蛤仔的代谢规律与品质评价[D].大连:大连海洋大学,2018.