近年来,海水养殖业面临着养殖水体水质恶化、各类病害肆虐发生等严重问题[1]。其中,在各类海洋经济动植物养殖中,由纤毛虫原生动物所导致的病害尤为严重[2-3]。然而,国内目前防治危害性纤毛虫的有效方法较少,在养殖过程中通常使用高锰酸钾、鲁哥氏液、福尔马林、抗生素、含铜离子类制剂等化学药物对病害性纤毛虫进行杀灭[4-8],这些药物如果长期使用不仅会对养殖环境造成污染,而且对食品安全也存在一定隐患[9-11]。研究表明,中草药在控制纤毛虫病害方面具有高效、环保、价廉、低残留、低成本、易制备、功能多样等优点[12-13]。因此,使用中草药杀灭病害性纤毛虫符合水产养殖健康、无公害的要求[14]。
本试验中所用悬游双眉虫Diophrys appendiculata[15]是养殖中常见的病害种,可在鱼虾贝育苗中暴发疫情,使代谢废物大量增加、水质恶化,并给养殖动物带来严重危害。目前,尚未见用中草药对其进行防治的报道。本试验中,以悬游双眉虫为试验动物,在光照(14L∶10D)、全黑暗两种条件下,研究了13种中草药对悬游双眉虫的急性毒性效应,旨在防治病害性纤毛虫的最适光照条件下,筛选出高效、低毒的中草药,为防治养殖水体中的悬游双眉虫提供相应的方法,同时也为悬游双眉虫的毒理学研究提供基础数据。
1 材料与方法
1.1 材料
试验用悬游双眉虫Diophrys appendiculata由中国海洋大学原生动物学实验室种库惠赠。
试验所用中草药购自天津市南开区华瑞大药房,分别为白藓皮Cortex dictamni、苦参sophorae flavescentis、穿心莲Herba andrographis、川楝子Fructus toosendan、使君子Fructus quisqualis、土槿皮Pseudolarix amabilis、仙鹤草Agrimonia pilosa、鹤虱Carpesium abrotanoides、槟榔Areca catechu、皂角Gleditsia sinensis、百部Radix stemonae、蛇床子Fructus cnidii和天南星Rhizoma arisaematis。
1.2 方法
1.2.1 种群培养活化 试验前将悬游双眉虫置于灭菌的人工海水(盐度30)中,以商业干酵母为食进行扩大培养,至其种群密度为7×105 ind./L,悬游双眉虫在恒温28 ℃、光照强度2000 lx、光照(14L∶10D)和全黑暗条件下培养。
1.2.2 药物制备 将13种中草药粉碎后,用电子分析天平各取1 g,用蒸馏水为提取溶剂,料液比为1∶10(g∶mL),使其终浓度相当于原药液(1×105 mg/L)。使用超声波清洗器超声波提取15 min,4 ℃下静置24 h,用滤纸过滤后,以4000 r/min离心10 min,于4 ℃下保存备用[16]。
1.2.3 药物对悬游双眉虫杀灭效果的测定 试验分别在光照(14L∶10D)、全黑暗两种条件下进行,使用六孔培养板,虫体密度为1×104 ind./L,各中草药原药液经稀释后,得到中草药溶液中药物质量浓度为900 mg/L,用于检测对悬游双眉虫的杀灭效果[17],另设不含中草药的对照组,每个处理组设3个重复。试验持续48 h,每隔12 h测定一次悬游双眉虫种群密度,用终浓度为2%的戊二醛固定[18],用1 mL浮游动物计数框计数,每孔重复计数两次,两次计数误差不超过15%[2]。
1.2.4 急性毒性试验 通过药物筛选试验,将筛选出对悬游双眉虫具有明显杀灭效果的槟榔、土槿皮和仙鹤草进行急性毒性试验,根据预试验结果,按等间距法[19]设置正式试验的药物质量浓度,各中草药原药液经稀释后得到的具体药物质量浓度分别为:槟榔对悬游双眉虫的药物质量浓度为0(对照)、30、40、50、60、70、80 mg/L;土槿皮为0(对照)、190、210、230、250、270、290 mg/L;仙鹤草为0(对照)、310、340、370、400、430、460 mg/L。每个处理组设3个重复,试验开始后连续观察6 h,随后每隔12 h观察并计算一次。
1.3 数据处理
采用SPSS 24软件对试验数据进行统计分析,显著性水平设为0.05。通过Sigmaplot 12.5软件获得急性毒性试验对悬游双眉虫种群生长的影响图,采用概率单位法测定半致死质量浓度(LC50)[19]。
2 结果与分析
2.1 杀灭悬游双眉虫的中草药筛选
从图1可见:在14L∶10D光照条件下,中草药药液中药物浓度为900 mg/L时,13种中草药组悬游双眉虫种群密度与对照组间均存在显著性差异(P<0.05);皂角、川楝子、百部、穿心莲、白藓皮、苦参、蛇床子、使君子、鹤虱、天南星对悬游双眉虫的种群生长均起到了明显的促进作用(P<0.05),仅仙鹤草、槟榔和土槿皮对虫体有杀灭作用,且随时间延长,杀灭效果越来越强,仙鹤草在48 h时对虫体几乎完全杀灭,槟榔和土槿皮在12 h内对悬游双眉虫的杀灭作用达到了100%。
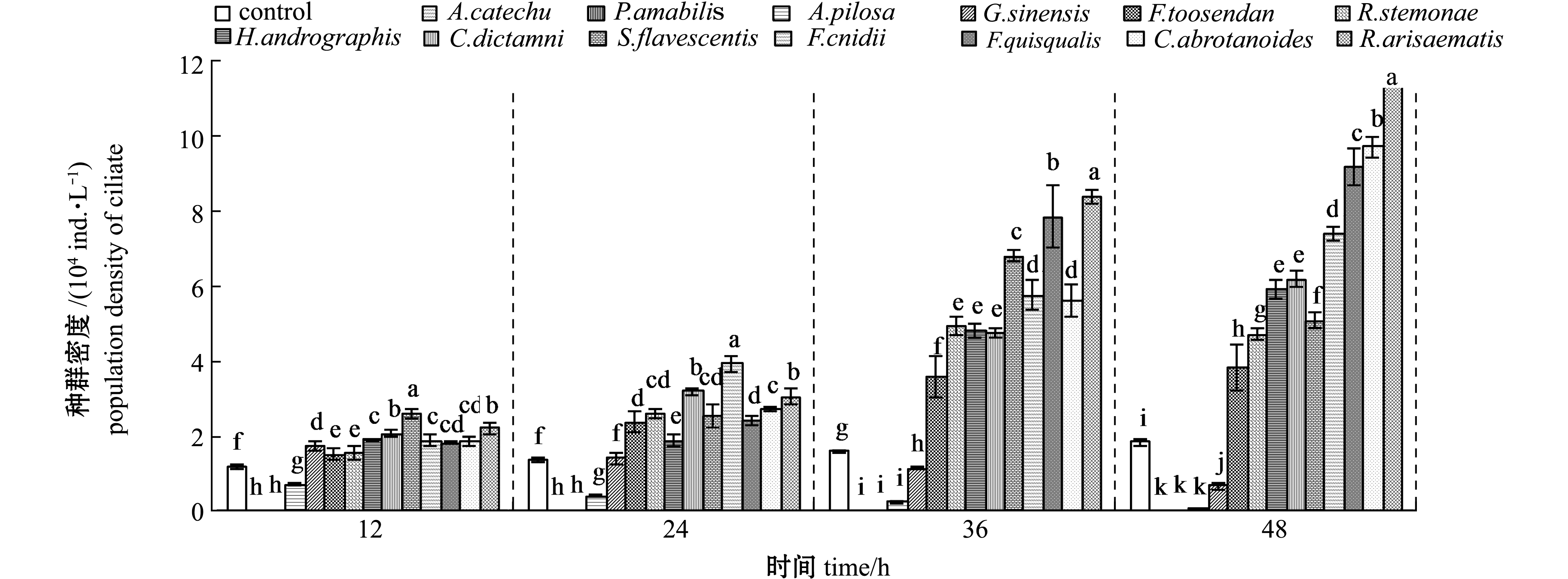
注:标有不同字母者表示同一时间下不同溶液组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters in the same time are significant differences in different groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 光照(14L∶10D)条件下中草药(浓度900 mg/L)对悬游双眉虫种群生长的影响
Fig.1 Growth curves of ciliate Diophrys appendiculata exposed to Chinese herbal medicines(900 mg/L)at light-dark (14L∶10D)
从图2可见:在全黑暗条件下,13种中草药组悬游双眉虫种群密度与对照组间均存在显著性差异(P<0.05);除槟榔、土槿皮和仙鹤草外,其余中草药在48 h内对悬游双眉虫生长均起到了促进作用(P<0.05);与光照组(14L∶10D)相比,全黑暗组对照在24 h后的种群密度要高于光照组,全黑暗组的仙鹤草随时间延长对虫体的杀灭效果逐渐增强,但悬游双眉虫的种群密度要高于光照组;全黑暗组和光照组槟榔均可在12 h内将悬游双眉虫全部杀灭。这进一步证明,无论是光照还是全黑暗条件下,槟榔、土槿皮、仙鹤草3种中草药对悬游双眉虫均有明显的杀灭效果。
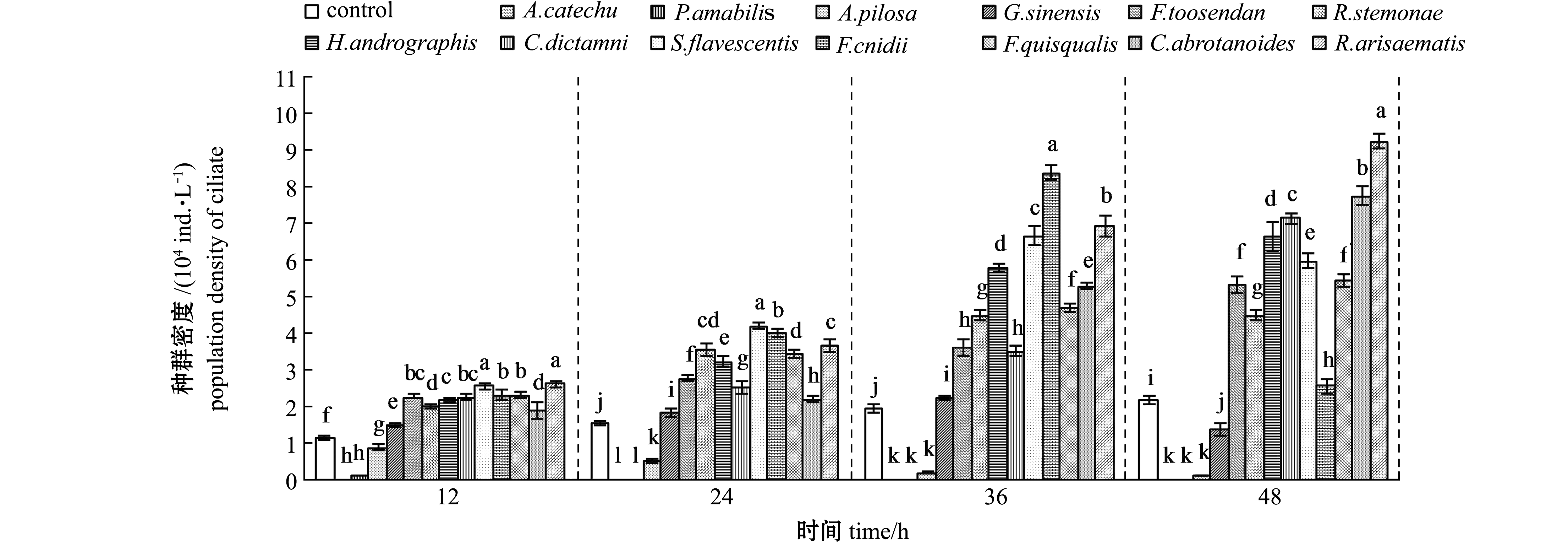
图2 全黑暗条件下中草药(浓度900 mg/L)对悬游双眉虫种群生长的影响
Fig.2 Growth curves of ciliate Diophrys appendiculata exposed to Chinese herbal medicines(900 mg/L) at complete darkness
2.2 急性毒性试验
2.2.1 3种中草药对悬游双眉虫的急性毒性 从图3可见:对照组中悬游双眉虫的种群生长符合逻辑斯蒂生长曲线,无明显停滞期,指数生长期持续到48 h时达到种群最大密度;全黑暗组的种群最大密度高于光照组(14L∶10D);两组处于稳定期的时间均较短,进入衰退期的时间也大致相同。
从图3-A、B可见:经槟榔处理后,30 mg/L试验组的悬游双眉虫种群生长符合逻辑斯蒂生长曲线,36 h时达到种群最大密度,全黑暗组的种群最大密度高于光照组(14L∶10D),与对照相比,光照和全黑暗组虫体状态无明显变化,但运动速度会受到一定影响,96 h时,光照组的死亡率达42.2%,全黑暗组死亡率达39.4%;40 mg/L以上的试验组,虫体数量呈明显呈下降趋势,虫体的游动速度也受到明显的影响,其中,80 mg/L试验组受到影响最为明显,随着时间延长,此组虫体状态由运动迟缓到多数个体附底,棘毛迅速摆动,虫体不爬行,数量明显下降,光照组在12 h时的死亡率为58.9%,48 h时全部死亡,而全黑暗组在96 h时的死亡率达到97.8%。
从图3-C、D可见:经仙鹤草处理后,12 h时,浓度为310 mg/L试验组虫体较活泼,棘毛摆动迅速,种群数量上升,未引起死亡,340 mg/L及以上试验组虫体会出现死亡现象;24 h时,浓度为310 mg/L试验组虫体运动迟缓,少数个体变形,种群数量下降不明显,310、340、370、400、430、460 mg/L光照组(14L∶10D)死亡率分别为7.8%、18.9%、31.7%、43.3%、54.4%、63.3%,全黑暗组死亡率分别为5.6%、11.1%、20.6%、30.0%、45.6%、51.1%;36 h时,各试验组种群数量均明显下降,多数虫体运动缓慢,部分附底旋转运动,虫体收缩明显;48 h时,光照组浓度为460 mg/L试验组多数虫体附底运动,棘毛摆动缓慢,虫体呈透明状,光照组死亡率为91.1%;72 h时,光照组死亡率为100%,全黑暗组死亡率为54.4%;96 h时全黑暗组死亡率为77.8%。
从图3-E、F可见:土槿皮作用于悬游双眉虫后,12 h时,190 mg/L试验组虫体受影响较小,未引起死亡;24 h时,210 mg/L试验组只有少数虫体运动缓慢,其余个体正常游泳,230 mg/L及以上试验组虫体体积变小,游动能力下降;48 h时,各处理组多数虫体贴于六孔板底部,游泳速度明显减慢,290 mg/L试验组受影响程度最为明显,棘毛摆动迟缓,190、210、230、250、270、290 mg/L光照组(14L∶10D)死亡率分别为32.2%、43.3%、52.2%、60%、67.8%、74.4%,各浓度对应全黑暗组死亡率分别为10.5%、20.5%、31.7%、42.2%、54.4%、66.7%;96 h时,290 mg/L试验组虫体变小变圆且在原地颤动,光照组虫体死亡率为90.0%,全黑暗组死亡率为84.4%。

图3 槟榔、土槿皮、仙鹤草对悬游双眉虫急性毒性的影响
Fig.3 Acute toxicity of three types of Chinese herbal medicines to ciliate Diophrys appendiculata
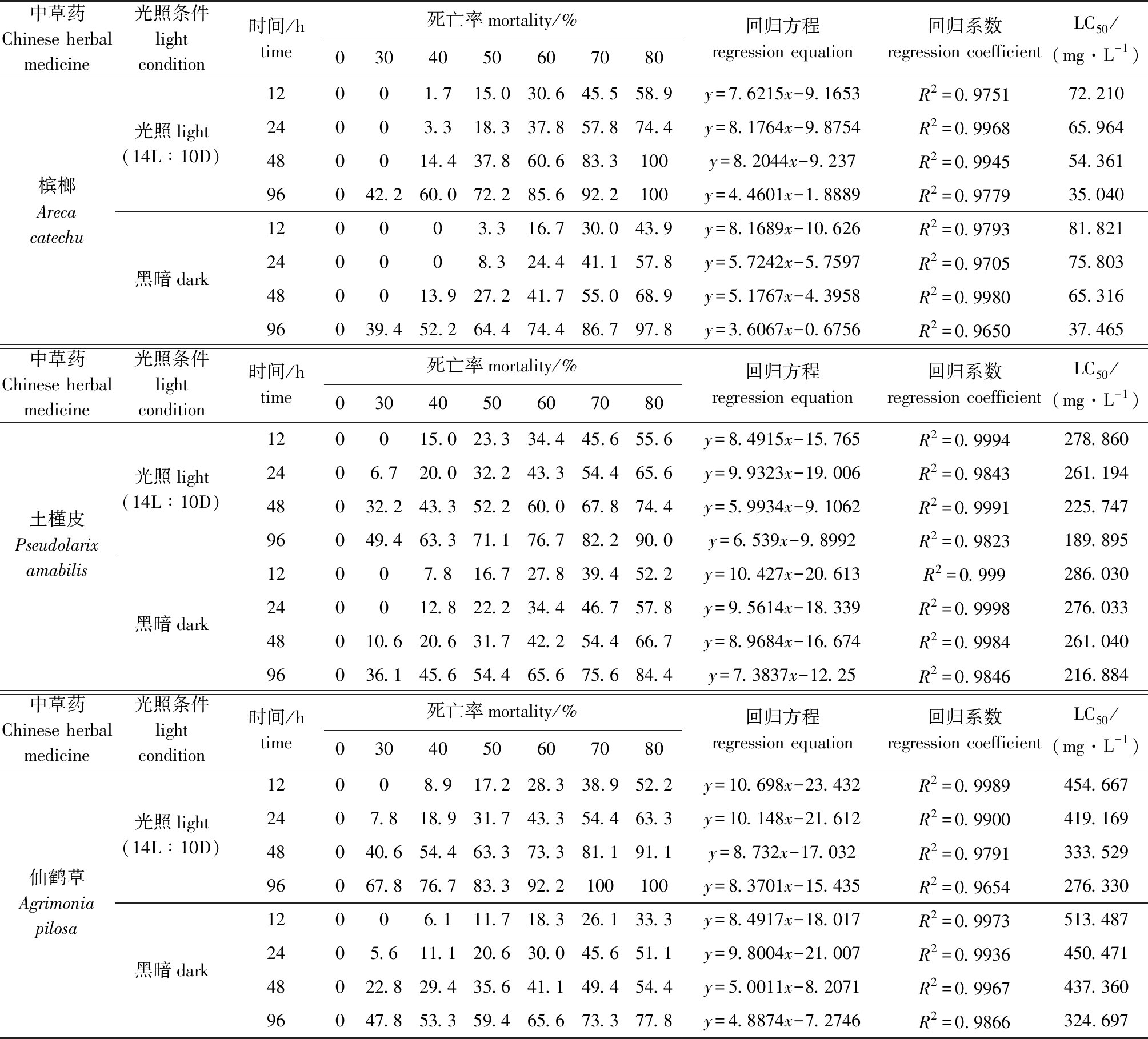
2.2.2 3种中草药对悬游双眉虫的LC50 采用概率单位分析法,得出3种中草药对悬游双眉虫的死亡率概率单位与所加药物质量浓度对数的线性回归方程为(表1):光照组(14L∶10D),槟榔、土槿皮和仙鹤草对悬游双眉虫的死亡率概率单位与所加药物质量浓度对数24 h的线性回归方程分别为y=8.1764x-9.8754(R2=0.9968)、y=9.9323x-19.006(R2=0.9843)、y=10.148x-21.612(R2=0.99),24 h LC50分别为65.964、261.194、419.169 mg/L;全黑暗组,槟榔、土槿皮和仙鹤草对悬游双眉虫的死亡率概率单位与所加药物质量浓度对数24 h的线性回归方程分别为y=5.7242x-5.7597(R2=0.9705)、y=9.5614x-18.339(R2=0.9998)、y=9.8004x-21.007(R2=0.9936),24 h LC50分别为75.803、276.033、450.471 mg/L;槟榔、土槿皮和仙鹤草均在光照(14L∶10D)条件下对悬游双眉虫的杀灭效果较好,悬游双眉虫对3种药物的敏感性依次为槟榔>土槿皮>仙鹤草。
表1 3种中草药对悬游双眉虫的半致死浓度(LC50)
Tab.1 LC50 of three types of Chinese herbal medicines to ciliate Diophrys appendiculata
中草药Chinese herbal medicine光照条件light condition时间/htime死亡率mortality/%0304050607080回归方程regression equation回归系数regression coefficientLC50/(mg·L-1)槟榔Areca catechu光照light(14L∶10D)黑暗dark12 001.715.030.645.558.9y=7.6215x-9.1653R2=0.975172.21024 003.318.337.857.874.4y=8.1764x-9.8754R2=0.996865.96448 0014.437.860.683.3100y=8.2044x-9.237R2=0.994554.36196 042.260.072.285.692.2100y=4.4601x-1.8889R2=0.977935.04012 0003.316.730.043.9y=8.1689x-10.626R2=0.979381.82124 0008.324.441.157.8y=5.7242x-5.7597R2=0.970575.80348 0013.927.241.755.068.9y=5.1767x-4.3958R2=0.998065.31696 039.452.264.474.486.797.8y=3.6067x-0.6756R2=0.965037.465中草药Chinese herbal medicine光照条件light condition时间/htime死亡率mortality/%0304050607080回归方程regression equation回归系数regression coefficientLC50/(mg·L-1)土槿皮Pseudolarix amabilis光照light(14L∶10D)黑暗dark12 0015.023.334.445.655.6y=8.4915x-15.765R2=0.9994278.86024 06.720.032.243.354.465.6y=9.9323x-19.006R2=0.9843261.19448 032.243.352.260.067.874.4y=5.9934x-9.1062R2=0.9991225.74796 049.463.371.176.782.290.0y=6.539x-9.8992R2=0.9823189.89512 007.816.727.839.452.2y=10.427x-20.613R2=0.999286.03024 0012.822.234.446.757.8y=9.5614x-18.339R2=0.9998276.03348 010.620.631.742.254.466.7y=8.9684x-16.674R2=0.9984261.04096 036.145.654.465.675.684.4y=7.3837x-12.25R2=0.9846216.884中草药Chinese herbal medicine光照条件light condition时间/htime死亡率mortality/%0304050607080回归方程regression equation回归系数regression coefficientLC50/(mg·L-1)仙鹤草Agrimonia pilosa光照light(14L∶10D)黑暗dark12 008.917.228.338.952.2y=10.698x-23.432R2=0.9989454.66724 07.818.931.743.354.463.3y=10.148x-21.612R2=0.9900419.16948 040.654.463.373.381.191.1y=8.732x-17.032R2=0.9791333.52996 067.876.783.392.2100100y=8.3701x-15.435R2=0.9654276.33012 006.111.718.326.133.3y=8.4917x-18.017R2=0.9973513.48724 05.611.120.630.045.651.1y=9.8004x-21.007R2=0.9936450.47148 022.829.435.641.149.454.4y=5.0011x-8.2071R2=0.9967437.36096 047.853.359.465.673.377.8y=4.8874x-7.2746R2=0.9866324.697
3 讨论
3.1 光照对悬游双眉虫种群生长的影响
光照是生态系统中重要的非生物因子,对水生生物的生长和发育有着重要的影响,既能促进又能抑制水生生物的生长[20]。研究表明,光照对褶皱臂尾轮虫Brachionus plicatilis种群的增长具有明显的促进作用,光照周期越长,种群密度增长越快[21];角毛藻Chaetoceros sp.在光照强度为5000 lx 时生长最快,当光照强度低于1000 lx时,其生长会受到明显抑制[22]。本研究中发现,光照(14L∶10D)条件会抑制悬游双眉虫的种群增长,全黑暗条件下其种群密度要大于光照(14L∶10D)条件下的种群密度,这与王海博[23]得出的光照会抑制扇形游仆虫Euplotes octocarinatus种群增长的结果基本一致,推测光照对纤毛虫种群生长的影响与其体内的感光物质或感光基因有关。
3.2 中草药对悬游双眉虫的杀灭效果
近年来,水产养殖业中化学药物应用较广,对人类副作用较大,高药残、高耐药性药物在水产领域正逐渐被禁用[24]。因此,谨慎用药在水产动物疾病防治及水生生物优势种群控制中尤为重要[25]。中草药具有天然、无毒、制备方便、价格低廉[12-13]等优点,因此,使用中草药防治病害性纤毛虫及控制养殖水体中纤毛虫的优势种群效果较好。长期以来,中草药在水产养殖中被用作引诱剂、生长促进剂和抗菌剂[26-27],可以作为抗生素、化学药物和其他合成化合物的有效替代品[28]。
槟榔碱是槟榔的有效驱虫成分,可对寄生虫的神经系统有极强的麻痹作用,从而使虫体失活[29]。本试验中研究发现,13种中草药水提物中仅有槟榔、土槿皮和仙鹤草对悬游双眉虫具有明显杀灭作用。鉏超等[30]研究发现,100 mg/L的槟榔水提液能在1 h内有效杀灭多子小瓜虫Ichthyophthirius multifiliis。马泽宁[31]研究发现,槟榔和贯众浓度为30 mg/L时,作用1 h可使多子小瓜虫的死亡率达到100%。本研究中发现,槟榔的药物浓度高于40 mg/L时,对悬游双眉虫作用效果明显,药物浓度为80 mg/L时效果最强,48 h可使悬游双眉虫的死亡率达到100%。王高学等[32]将槟榔作用于中型指环虫Dactylogyrus intermedius及感染中型指环虫的金鱼Carassius auratus时发现,药物浓度为100 mg/L的槟榔在48 h 时对虫体的杀灭作用达到100%,这与本试验结果基本一致,且药物浓度为600 mg/L的槟榔才会使鱼体中毒,由此可见,在水产养殖中槟榔对于纤毛虫引起的疾病是一种理想的杀虫药物。
土槿皮中含有黄烷醇类化合物表儿茶素,通过与细胞膜组成成分相互作用,改变细胞膜的物理特性,造成细胞内容物渗漏;调控相关基因,控制蛋白质表达,影响细胞正常代谢;产生活性氧并造成胞内外氧化应激,导致生物大分子受到氧化损伤,从而起到抑菌杀虫的功效[33]。暨杰[34]用土槿皮杀灭鱼类指环虫的研究中发现,当药物质量浓度为80 mg/L时,土槿皮对虫体的杀灭作用达到100%。本研究中发现,土槿皮药物浓度为290 mg/L的试验组受影响程度最为明显,此浓度值明显高于暨杰[34]所研究的指环虫杀灭浓度,其96 h时使悬游双眉虫的死亡率达到了90%。胡梁及等[17]研究发现,土槿皮作用于金鼓鱼Scatophagus argus的中毒剂量为300 mg/L,因此,当使用土槿皮控制水生生物优势种群时要充分控制用药量。
仙鹤草含有黄酮类化合物,其可破坏细胞膜的完整性,使膜电子传递、核苷酸合成及ATP活性等功能受损,从而起到抑菌杀虫的作用[35]。喻运珍等[36]研究发现,1000 mg/L的仙鹤草对棘头虫有明显的杀灭作用,其可在4 h内使虫体全部死亡。本研究中,仙鹤草药物浓度为460 mg/L试验组在72 h时使悬游双眉虫的死亡率达到100%,这与王彬等[37]得出的仙鹤草对多子小瓜虫Ichthyophthirius multifiliis生长影响结果基本一致。本试验表明,仙鹤草更有利于控制悬游双眉虫的生长。
本试验中通过比较槟榔、土槿皮和仙鹤草在12、24、48、96 h的半致死质量浓度表明,悬游双眉虫对3种药物的敏感性大小依次为槟榔>土槿皮>仙鹤草,这表明槟榔对悬游双眉虫具有较强的急性致死毒性,本研究结果可为养殖水体中悬游双眉虫的防治提供相应方法,同时也为悬游双眉虫的毒理学研究提供生态学基础数据。中草药成分复杂,今后可对多种溶剂提取其不同有效成分或复方制剂有效成分的治疗机制进行深入研究,进一步了解其药理作用。
4 结论
(1)13种中草药中仅槟榔、土槿皮和仙鹤草在光照(14L∶10D)条件下对悬游双眉虫有明显杀灭效果,三者对悬游双眉纤毛虫的24 h LC50分别为65.964、261.194、419.169 mg/L。
(2)槟榔的杀灭作用最强,其药物浓度为80 mg/L时在48 h时可使悬游双眉虫全部致死。因此,槟榔可作为首选药物对养殖水体中优势种群的病害性纤毛虫进行治理。
[1] 陈相瑞,岑哲科.我国海水养殖病害纤毛虫的研究概述[J].生物学教学,2016,41(8):5-6.
[2] 齐红莉,汤荣成,徐海龙,等.三氯异氰尿酸对海洋拟阿脑虫种群生长的影响[J].水生态学杂志,2018,39(3):94-98.
[3] 区超华,钟楚俊,贺顺连.过氧乙酸对神仙鱼小瓜虫病的治疗实验[J].河北渔业,2019(2):21-24.
[4] 吴建绍,李雷斌,朱志煌,等.硫酸铜对双斑东方鲀刺激隐核虫病的治疗效果研究[J].水产科学,2019,38(3):305-312.
[5] 邱彦涛,宋微波.3种药物对寡毛双眉虫Diophrys oligothrix(纤毛虫门,腹毛目)的急性毒杀作用[J].应用与环境生物学报,2002,8(6):623-626.
[6] 赵也.两种四环素类抗生素对三种纤毛虫的毒性效应研究[D].哈尔滨: 哈尔滨师范大学,2017.
[7] 宫春光,殷蕊,孙桂清,等.一例红鳍东方鲀眼点淀粉卵涡鞭虫病的防治[J].科学养鱼,2018(6):66-67.
[8] 郭春山,李文全,张丽.大菱鲆盾纤毛虫病的病因及防治方法[J].河北渔业,2012(10):33.
[9] 王洪彬,朱利霞,杨楠,等.常用中草药对水产动物致病菌体外抑菌效果研究[J].中国畜牧兽医,2018,45(5):1357-1366.
[10] 蔡婷,朱盛山,蔡延渠,等.化学药在水产养殖中的应用及问题浅析[J].水产养殖,2015,36(6):13-16.
[11] 陈丽婷,郇志利,王晓清,等.中草药添加剂在水产养殖中的应用研究进展[J].水产科学,2014,33(3):190-194.
[12] Zhong Zhihong,Guo Weiliang,Lei Yang,et al.Antiparasitic efficacy of honokiol against Cryptocaryon irritans in pompano,Trachinotus ovatus[J].Aquaculture,2019,500:398-406.
[13] Pu Hongyu,Li Xiaoyu,Du Qingbo,et al.Research progress in the application of Chinese herbal medicines in aquaculture:a review[J].Engineering,2017,3(5):731-737.
[14] 张永明.大菱鲆(Scophthalmus maximus)盾纤毛虫病的病理学观察及中草药防治效果研究[D].青岛:中国海洋大学,2009.
[15] 宋微波,王梅.海水养殖水体中的病害纤毛虫[J].海洋科学,1993(4):41-47.
[16] 聂江力,王亭,石聪,等.五倍子水提液对铜绿微囊藻生长抑制效应的研究[J].植物研究,2011,31(2):231-234.
[17] 胡梁及,张雄飞,徐丰都,等.24种中草药对鱼类车轮虫杀灭作用的研究[J].黑龙江畜牧兽医,2016(3):208-210.
[18] 类彦立,徐奎栋.海洋底栖原生动物生态学研究方法学综述[J].海洋科学,2007,31(5):49-57.
[19] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:74-80.
[20] 武模戈.光照对水生动物的影响[J].河南教育学院学报:自然科学版,2001,10(2):38-39.
[21] 徐海龙,马志华,郭立,等.光照、pH及盐度对褶皱臂尾轮虫培养效果的影响[J].水产科学,2013,32(2):85-88.
[22] 栾会妮,梁亚,杨磊,等.盐度、温度和光照对耐高温角毛藻藻株生长的影响[J].浙江海洋大学学报:自然科学版,2019,38(3):217-223,243.
[23] 王海博.光照对纤毛虫原生动物种群增长的影响[D].济南:山东大学,2015.
[24] 杨先乐,郭珺.孔雀石绿的禁用及其替代药物美婷[J].食品科学技术学报,2013,31(2):11-14.
[25] 夏与晴,刘文珍,傅松哲,等.25种中草药及其联合用药配伍对5种水产养殖常见致病菌的抑菌作用[J].大连海洋大学学报,2019,34(1):7-14.
[26] 罗实亚.诱食剂在水产养殖中的应用研究进展[J].贵州农业科学,2012,40(9):183-185.
[27] 王裕玉,杨雨虹,刘大森.水产饲料中中草药类诱食剂的研究进展[J].中国饲料,2010(23):32-34.
[28] 周雄,周汉林,王定发,等.中草药添加剂在养殖生产中的应用现状及展望[J].贵州农业科学,2016,44(7):77-80.
[29] 张战峰.槟榔碱的合成及毒性与药理药效初步评价[D].北京:中国农业科学院,2007.
[30] 鉏超,张其中,罗芬.20种中草药杀灭离体小瓜虫的药效研究[J].淡水渔业,2010,40(1):55-60.
[31] 马泽宁.单味中草药与复方贯众对小瓜虫杀灭试验[J].中国水产,2019(2):78-79.
[32] 王高学,徐钰,王建华,等.29种天然植物提取物对指环虫杀灭作用的研究[J].淡水渔业,2006,36(3):3-8.
[33] 陈书媛,戴申,龚雨顺.儿茶素类化合物抑菌作用及其作用机制的研究进展[J].食品安全质量检测学报,2017,8(9):3316-3322.
[34] 暨杰.土荆皮杀灭鱼类指环虫活性成分的研究[D].杨凌:西北农林科技大学,2013.
[35] 刘位杰,梁敬钰,孙建博,等.仙鹤草化学成分及药理作用研究进展[J].海峡药学,2016,28(2):1-7.
[36] 喻运珍,艾桃山,王玉群,等.23种植物提取物对棘头虫杀灭活性观察[J].水利渔业,2004,24(6):82-83.
[37] 王彬,张其中,陈本亮,等.40种中草药杀灭离体多子小瓜虫效果研究[J].广东农业科学,2017,44(7):147-153.