杀鲑气单胞菌Aeromonas salmonicida隶属气单胞菌科Aeromonadacea气单胞菌属Aeromonas,为已知最古老的鱼类病原体之一[1-2]。杀鲑气单胞菌是鲑科Salmonidae鱼类重要的病原菌,可引发鲑科鱼类“疖疮病”[3]。最初学界认为,杀鲑气单胞菌具有宿主专一性,但深入研究后发现其宿主并不仅限于此,还可感染鲤Cyprinus carpio[4]、鳕Gadus morhua[5]、许氏平鲉Sebastes schlegeli[6]、乌鳢Channa argus[7]、异育银鲫Carassius auratus gibelio[8]、大菱鲆Scophthatmus maximus[9]等多种鱼类。1992年Toranzo等[10]首次从西班牙某养殖场患病大菱鲆体内分离到杀鲑气单胞菌,随后类似病例相继在丹麦[11]、挪威[12]和中国[13]等地被报道。杀鲑气单胞菌的感染给大菱鲆养殖业造成了重大经济损失。
大菱鲆隶属于鲽形目Pleuronectoidei菱鲆科Scophthalmidae瘤棘鲆属Psetta,原产于大西洋东北沿岸,俗称欧洲比目鱼,在中国又称“多宝鱼”,是一种极具经济价值的冷水性鱼类[14-16]。2017年,中国大菱鲆年产量高达45 500 t,年产值已达29 575万美元(http://www.fao.org/fishery/statistics),大菱鲆已成为中国鲽鲆类养殖第一大品种。然而,随着大菱鲆养殖集约化程度不断提高、养殖密度日益加大,大菱鲆病害频发,各种病毒性疾病、细菌性疾病和寄生虫病的报道日渐增多[17-19]。2018年4月,辽宁省大连市某养殖场大菱鲆暴发了流行性疾病,其皮肤呈串珠状隆起、变白且隆起部分皮下肌肉出血、化脓、溃烂,两天内累计死亡率高达10%,作者从患病大菱鲆体内分离得到一株病原菌DLPJC01(GenBank登录号:MK881070),通过分子生物学鉴定及人工感染试验证实,该病原菌为杀鲑气单胞菌无色亚种。吕俊超等[20]虽于2008年报道了杀鲑气单胞菌感染大菱鲆的组织病理学变化,但病鱼却未出现典型疖疮症状,组织内也未发现细菌存在。而本研究中病鱼体表疖疮症状典型,且各器官组织内有大量细菌定殖,与之前报道有明显差异。因此,本研究中在分析该分离株致病性的同时研究了患典型“疖疮病”大菱鲆的病理损伤特征,以期为进一步研究杀鲑气单胞菌的致病机制及临床防控提供参考。
1 材料与方法
1.1 材料
患病大菱鲆共计10尾,体质量为(180±10)g,体长为(15±3)cm,取自辽宁省大连市某养殖场海上养殖网箱。
健康大菱鲆共计30尾,体质量为(15±3)g,体长为(6±1)cm,购自辽宁省大连市某养殖场,暂养于大连市海珍品疾病防控重点实验室循环水养殖系统中。
药敏纸片、细菌生化微量鉴定管购于杭州微生物试剂有限公司;结晶紫、伊红、革兰氏染色试剂盒购于北京索莱宝科技有限公司,细菌DNA提取试剂盒购于天根生化科技(北京)有限公司。
1.2 方法
1.2.1 临床检查与病原菌分离 首先用肉眼观察患病大菱鲆外观症状,取病鱼鳃丝与体表黏液镜检。然后解剖病鱼,观察病鱼内脏器官异常病变。无菌条件下取病鱼肝、脾、肾等组织,划线接种于含2%NaCl的NA平板,28 ℃下培养24 h,挑取优势菌株分离纯化。观察菌落形态,挑取单个菌落进行革兰氏染色。
1.2.2 人工感染试验 分离菌株在含2%NaCl的NA平板上28 ℃条件下培养24 h,用无菌生理盐水冲洗平板上菌落,采用麦氏比浊法[21]调节菌悬液浓度至1×108 、1×109 cfu/mL。健康大菱鲆于实验室暂养一周后,按照注射细菌浓度分组,分为1×108 、1×109 cfu/mL和对照组3组,每组10 尾鱼。试验组每尾鱼腹腔注射0.1 mL菌液,对照组注射0.1 mL生理盐水。注射后观察大菱鲆的发病症状及死亡情况,连续观察15 d。
1.2.3 生理生化鉴定及药敏试验 参照细菌生化微量鉴定管说明书鉴定分离菌株。采用纸片扩散法,将浓度为1×107 cfu/mL菌液均匀涂布于含2%NaCl的NA平板后贴上药敏纸片,28 ℃下培养24 h并测量抑菌圈直径。
1.2.4 16S rDNA测序分析与系统发育树构建 使用细菌DNA提取试剂盒提取分离菌株的DNA后进行16S rDNA基因的PCR扩增。16S rDNA基因扩增引物(27F: 5′AGAGTTTGATCCTGGCTCAG3′;1492R:5′GGTTACCTTGTTACGACTT3′),预期扩增片段大小约为1500 bp。PCR反应体系为:ddH2O 18.25 μL,10×PCR Buffer 2.5 μL,Taq DNA酶 0.25 μL,dNTP 1 μL,上、下游引物各1 μL,DNA模板1 μL。PCR反应程序为:94 ℃下预变性5 min;94 ℃下循环变性30 s,54 ℃下退火复性30 s,72 ℃下延伸90 s,共进行30个循环;最后在72 ℃下再延伸10 min。PCR扩增产物经10 g/L琼脂糖凝胶电泳检测后并送至北京华大基因有限公司测序。测序结果在GenBank中用Blast软件进行比对,选择相似度较高的序列用MEGA5软件进行系统发育树的构建。系统进化树分支置信度用1000次重复自举检验,在计算过程中,系统自动省略不确定和缺失的位点。
1.2.5 病理切片制作与观察 取自然发病大菱鲆的肝、脾、肾、肠道、脑、鳃等组织,用10%甲醛溶液固定48 h,以健康大菱鲆组织为对照。修块后逐级脱水,透明、浸蜡,常规石蜡包埋后切片,切片厚度为4 μm。经H.E染色,中性树胶封片后用Leica DM4000 LED拍照系统观察并拍照。
2 结果与分析
2.1 患病鱼的临床症状与病原菌分离结果
病鱼体色发黑,体表黏液增多,靠近背鳍部分的背部肌肉呈串珠状隆起,甚至连成一片,且隆起部位发白,划开隆起的肌肉组织发现大菱鲆皮下肌肉出血、化脓、溃烂(图1)。取病鱼鳃丝和体表黏液镜检未发现寄生虫。解剖发现,部分病鱼腹腔内出现带血腹水,病鱼肝、脾、肾等内脏器官充血及出血,脾脏和肾脏肿大,肠道发炎。
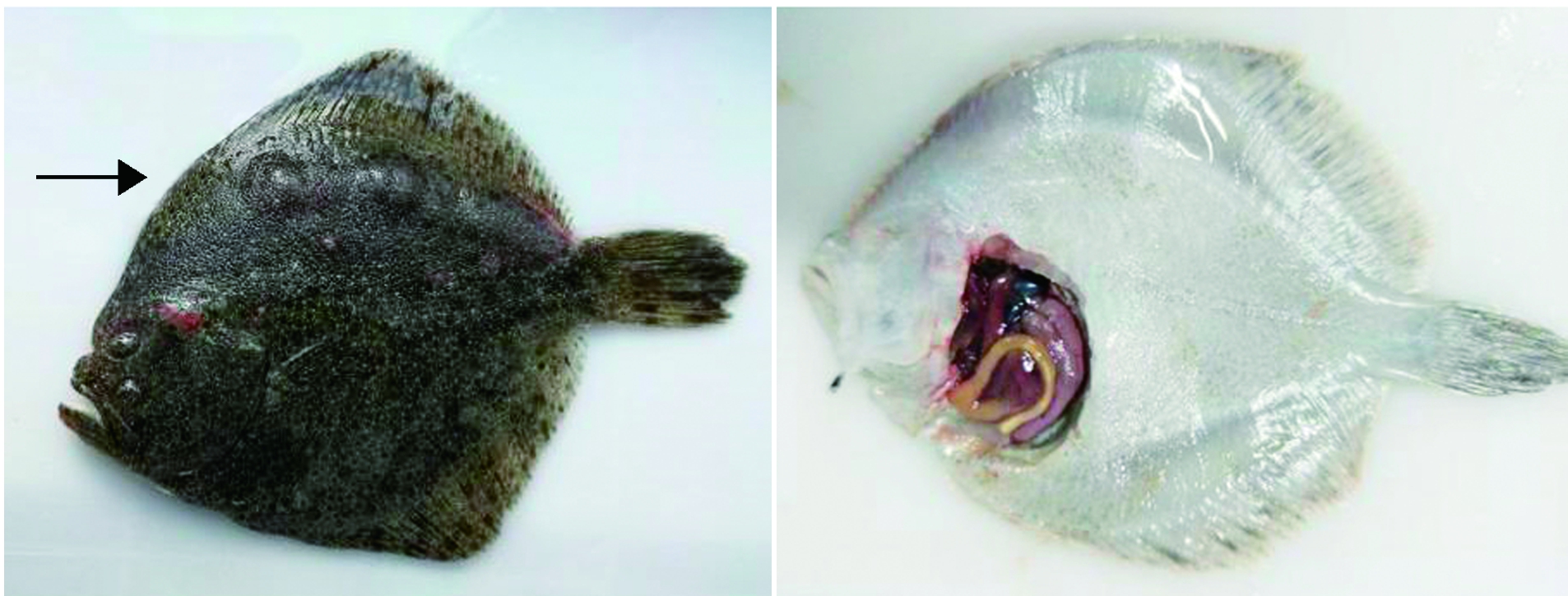
图1 患病大菱鲆的临床特征
Fig.1 Clinical sydromes of diseased turbot
从发病大菱鲆体内分离得到一株优势菌,在28 ℃条件下,该菌株在含2%NaCl的NA培养基上形成白色、中央略隆起、边缘光滑、直径为(0.9±0.1)mm的圆形菌落,且革兰氏染色结果为阴性。
2.2 人工感染试验结果
从表1可见:1×108 cfu/mL试验组大菱鲆死亡率达30%,1×109 cfu/mL试验组大菱鲆全部死亡,死亡大菱鲆均与自然发病条件下病鱼症状相同;对照组无任何异常。
表1 人工感染试验结果
Tab.1 Challenage experiments results of the isolated strains DLPJC01

注射浓度concentration试验鱼数量/ind.number of test fish死亡数量/ind.number of dead fish死亡率/%mortality对照组control10001×108 cfu/mL103301×109 cfu/mL1010100
2.3 生理生化鉴定与药物敏感性结果
从表2可见,生理生化比对发现,该菌株与杀鲑气单胞菌无色亚种最为接近。
表2 DLPJC01与杀鲑气单胞菌无色亚种的理化特性比较
Tab.2 Comparisons of physicochemical characteristics of strain DLPJC01 with Aeromonas salmonicida subsp.achromogenes

鉴定项目 characteristic itemstrain DLPJC01A.salmonicida subsp.achromogenes运动性mobility--产生吲哚indole++木糖xylose--M.R反应M.R reaction++V.P反应V.P reaction+-硫化氢H2S--柠檬酸盐citrate--半乳糖galactose-+棉籽糖raffinose--尿素urea--麦芽糖maltose++鼠李糖rhamnose--阿拉伯糖arabinose--阿拉伯糖醇arabinitol--硝酸盐还原nitrate reduction++0%NaCl生长growth at 0% NaCl++苯丙氨酸脱氨酶phenylalanine deaminase--精氨酸双水解酶arginine bihydrolytic enzyme++明胶水解gelatin hydrolysate++纤维二糖cellobiose+-赤藓醇erythritol--乳糖lactose--D-甘露醇D-mannitol+-D-甘露糖D-mannose++水杨苷salicin--山梨醇sorbitol--D-葡萄糖产气gas from D-glucose--乙酰氨基葡萄糖N-acetyl glucosamine-+蔗糖sucrose++七叶苷esculin--D-葡萄糖产酸acid from D-glucose++鸟氨酸脱羧酶ornithine decarboxylas--
注:+为阳性;-为阴性
Note:+,positive;-,negative
从表3可见:该菌株对庆大霉素、头孢曲松、链霉素、头孢噻肟、新霉素5种抗生素高度敏感;对红霉素中度敏感;对复方新诺明、环丙沙星、卡那霉素等13种抗生素完全耐药。
表3 菌株DLPJC01抗生素药敏试验结果
Tab.3 Antibiotic susceptibility of strain DLPJC01

药物drug抑菌直径判断标准/mmjudgement standard of inhibition zone diameter耐药resistant中度敏感medium sensitive高度敏感high sensitive抑菌圈直径/mmdiameter of inhibitory zone敏感性sensitivity庆大霉素 gentamicin≤1213-14≥1518.50±0.02S磺胺甲恶唑sulfon-amidazole≤1213~16≥17—R卡那霉素 kanamycin≤1314~17≥1810.50±0.04R多西环素 doxycyc-line≤1213~15≥1610.00±0.01R头孢曲松 ceftriaxone≤1320~22≥2329.50±0.05S头孢噻吩 cefotaxime≤1415~17≥18—R青霉素 penicillin≤14—≥15—R链霉素 streptomycin≤1112~14≥1517.00±0.06S阿莫西林 amoxicillin≤1314~17≥18—R利福平 rifampin≤1617~19≥20—R氟苯尼考 florfenicol≤1213~17≥18—R红霉素 erythromycin≤1314~22≥2317.50±0.05I氯霉素 chloramphen-icol≤1213~17≥18—R复方新诺明 paedi-atriccompound sulfa-methoxazole tablet≤1011-15≥16—R诺氟沙星 norfloxacin≤1213~16≥1710.50±0.03R环丙沙星 ciprofloxa-cin≤1516~20≥2112.00±0.04R妥布霉素 tobramycin≤1213~14≥1510.50±0.01R头孢噻肟 cefotaxime sodium≤1623~25≥2226.50±0.05S新霉素neomycin≤1213~16≥1722.00±0.02S
注: S为高度敏感; I为中度敏感; R为耐药;耐药性参照药物说明书
Note:S,high sensitive;I,medium sensitive;R,resistant;Drug sensibility refers to drug instructions
2.4 16S rDNA基因序列测定与系统发育分析
以分离菌株DLPJC01的DNA为模板,扩增的16S rDNA基因条带均与预期相符,测序结果在GenBank中进行Blast比对,结果显示,与登录号为KX238884.1的杀鲑气单胞菌无色亚种Aeromonas salmonicida subsp.achromogenes相似度最高,可达99.9%以上。系统发育树构建结果也显示,DLPJC01菌株与杀鲑气单胞菌聚为一支(图2)。
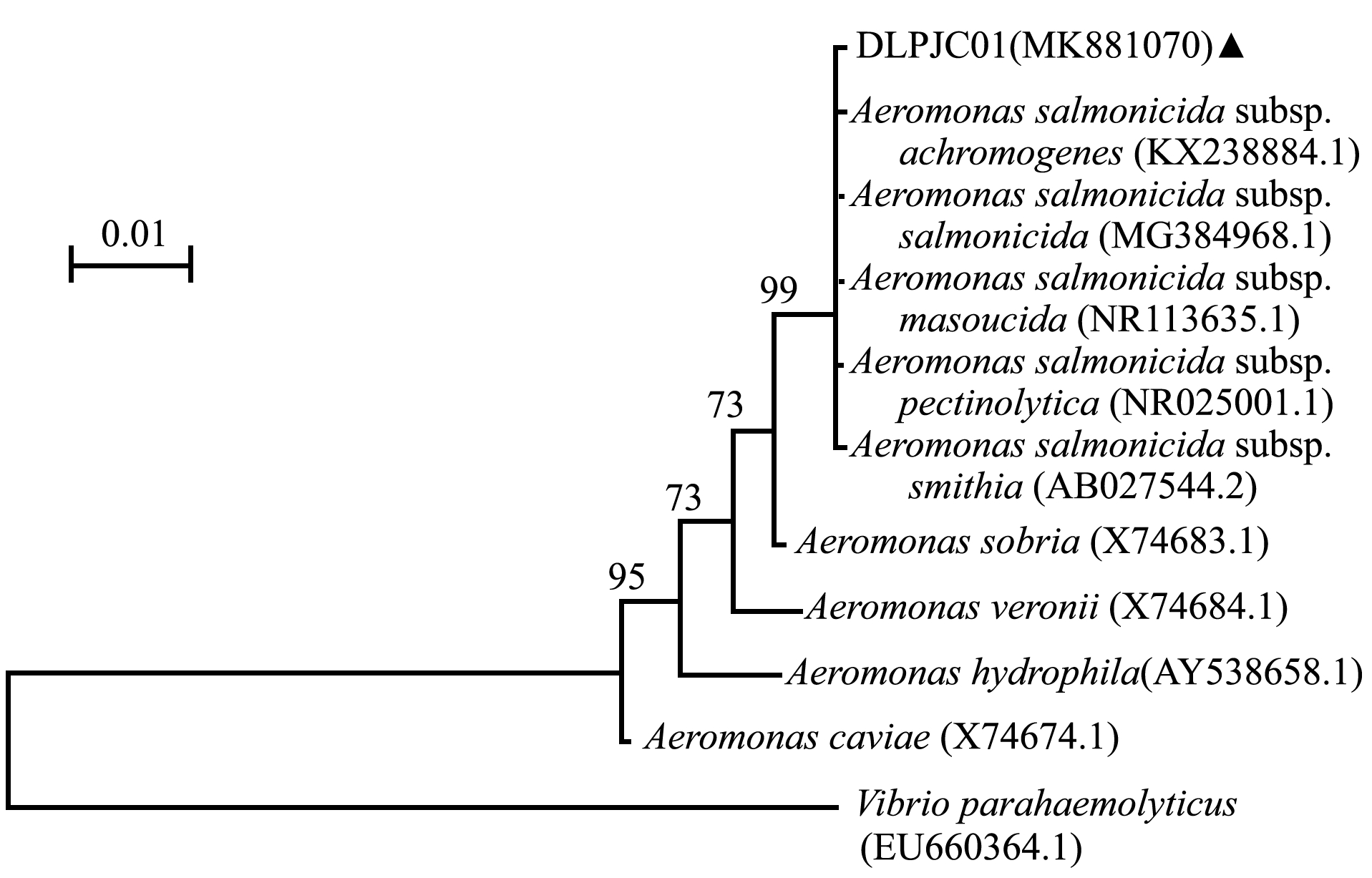
图2 基于16S rDNA序列构建的菌株DLPJC01和杀鲑气单胞菌相关菌株系统发育树
Fig.2 Phylogenetic tree of strain DLPJC01 and strains of Aeromonas salmonicida subsp. achromogenes based on 16S rDNA sequence
2.5 组织病理变化
显微镜下观察健康和自然发病大菱鲆各器官的组织切片,可见患病大菱鲆的鳃、肝脏、脾脏、肾脏、肠道和肌肉等处的组织均有极为明显的病理变化(图3)。鳃组织以鳃小片明显水肿、增宽、间隔缩小为主要特征;鳃小片上皮细胞与毛细血管成片剥离(→),大部分上皮细胞肿胀、变圆、相互离散,严重时完全脱落仅残留光滑的血管内皮细胞;毛细血管扩张淤血,内有大量蓝紫色细菌团块形成栓子(★),阻塞了毛细血管使其扩张,呈气球状甚至破裂出血(图3-B)。肝组织的病变相对较轻,主要表现为小静脉、中央静脉和肝血窦扩张、淤血,部分区域红细胞溶血;部分小静脉血浆淤积,可见残留的红细胞碎片和细胞核,且组织中可见蓝紫色的细菌团块(图3-D)。脾实质组织呈多发性灶性坏死,坏死组织红染,细胞精细结构消失,仅残留基本的细胞轮廓(→),为典型的凝固性坏死,有的区域甚至溶解液化;组织中有大量蓝紫色的细菌团块(★),细菌团块交错分布于着色深浅不一的坏死组织中,使整个脾脏在镜下呈花斑状(图3-F)。肾间质呈多发性灶性坏死,部分坏死组织溶解、消失导致肾间质疏松,肾间质中还可见大量的蓝紫色细菌团块(★);多数肾小管坏死,呈红染状,肾小管上皮细胞肿胀、变圆,出现大量蛋白质样红染颗粒,严重时肾小管上皮细胞核碎裂、染色质边移,甚至整个细胞完全碎裂,肾小管结构完全崩解(→)(图3-H)。肠道病变以肠上皮细胞核染色质边移为主要特征,肠绒毛黏液细胞明显增多;肠上皮细胞肿胀、坏死,脱落甚至填满了肠绒毛间的间隙(图3-J)。肌纤维轻度水肿、间隙增宽,周围可见呈条索状分布的蓝紫色细菌;严重区域肌纤维溶解、断裂,肌浆凝固性坏死,坏死组织中可见淋巴细胞和中性粒细胞浸润,同时脂肪细胞出现炎症(图3-L)。

注:A为正常大菱鲆鳃组织;B为患病大菱鲆鳃组织;C为正常大菱鲆肝组织;D为患病大菱鲆肝组织;E为正常大菱鲆脾组织;F为患病大菱鲆脾组织;G为正常大菱鲆肾组织;H为患病大菱鲆肾组织;I为正常大菱鲆肠道;J为患病大菱鲆肠道;K为正常大菱鲆肌肉组织;L为患病大菱鲆肌肉组织
Note:A,gill tissue of normal turbot;B, gill tissue of diseased turbot;C,liver tissue of normal turbot;D,liver tissue of diseased turbot;E,spleen tissue of normal turbot;F,spleen tissue of diseased turbot;G,renal tissue of normal turbot;H,renal tissue of diseased turbot;I,intestine of normal turbot;J,intestine of diseased turbot;K,muscle tissue of normal turbot;L,muscle tissue of diseased turbot
图3 感染杀鲑气单胞菌无色亚种大菱鲆的组织病理学损伤(H.E染色)
Fig.3 Pathohistological lesions of turbot infected by Aeromonas salmonicida subsp.achromogenes (H.E staining)
3 讨论
3.1 鱼类感染杀鲑气单胞菌的临床症状
杀鲑气单胞菌是养殖鲑鳟最重要的一种病原菌,病鱼通常表现为体侧或尾部形成特征性脓肿,严重时脓肿部位溃烂形成溃疡[22]。非鲑鳟鱼类感染杀鲑气单胞菌可引起局部感染,严重时引起皮肤溃疡,称为“非典型”疖疮病[23]。吕俊超等[20]报道的感染杀鲑气单胞菌无色亚种的大菱鲆仅出现了口周围皮肤皮下出血的症状,而本研究中患病大菱鲆的“疖疮”症状主要表现为背部肌肉出现串珠状隆起甚至连成一片,且隆起的肌肉组织发白,这种症状与之前报道的大菱鲆疖疮病有明显差异。
3.2 杀鲑气单胞菌的致病机理
Farto等[24]研究发现,感染杀鲑气单胞菌亚种的鲑12 h后,细菌即可侵入大菱鲆的鳃、肠道、肝脏和肾脏,并在感染后期侵入肌肉组织,且细菌在组织中持续存在并导致大菱鲆死亡。而Björnsdóttir等[25]用杀鲑气单胞菌无色亚种人工感染大菱鲆后则在大菱鲆鳃组织内发现蓝紫色细菌团块。本研究中在患病大菱鲆的鳃、肝、脾、肾等组织中同样观察到大量蓝紫色的细菌团块,这种现象与杀鲑气单胞菌无色亚种无运动性的特点有关[26]。菌株只能在侵染的部位分裂增殖,继而形成蓝紫色的细菌团块。在鳃组织中的细菌团块堵塞了鳃小片毛细血管,形成栓塞,进而导致鳃组织血液循环障碍、扩张淤血甚至破裂出血,影响大菱鲆的呼吸功能。鱼类的肾脏和脾脏是重要的免疫器官,鱼类肾脏可有效抵御外界病原的入侵,脾脏则可为鱼体提供充足的血液和免疫细胞[27]。吕俊超等[20]研究仅发现杀鲑气单胞菌无色亚种可引起大菱鲆肾小管上皮细胞水样变性并与周围组织分离,脾脏中红髓和白髓界限不清等病理变化,而本研究中观察发现,患病大菱鲆的肾脏、脾脏内有大量蓝紫色细菌团块,呈多发性灶性坏死,且部分坏死组织溶解液化,可见免疫器官受损致使细菌在病鱼体内迅速扩散,从而造成鱼体严重损伤甚至死亡。
3.3 杀鲑气单胞菌感染的药物治疗
本研究中从患病大菱鲆体内分离纯化得到菌株DLPJC01,与《常见细菌系统鉴定手册》[26]中标准菌株相比,缺乏利用半乳糖、乙酰氨基葡萄糖作为碳源的能力,而具有V.P反应和利用纤维二糖、D-甘露醇的能力。在Pedersen等[28]的研究中也同样发现了一些生理生化指标与标准菌株不同的“非典型”杀鲑气单胞菌,说明这种“非典型”杀鲑气单胞菌的情况普遍存在。这可能是分离株生存环境、宿主的自身特性引起的,也可能与该菌的致病力有关。药敏试验结果显示,该菌株对复方新诺明在内的13种抗菌药物完全不敏感,这表明养殖过程中出现了滥用抗菌药物的现象。2016年“多宝鱼药物残留事件”给大菱鲆养殖业蒙上了一层阴影,因此,养殖生产中不能盲目用药、滥用药,而应该在药敏试验结果的指导下进行针对性治疗。
[1] 刘帅,王荻,卢彤岩,等.实时荧光定量PCR扩增特异性vapA基因检测杀鲑气单胞菌[J].水产学报,2017,41(12):1928-1935.
[2] Ling Xiaodong,Dong Weitao,Zhang Yong,et al.A recombinant adenovirus targeting typical Aeromonas salmonicida induces an antibody-mediated adaptive immune response after immunization of rainbow trout[J].Microbial Pathogenesis,2019,133:103559.
[3] Cipriano R C,Bullock G L.Furunculosis and Other Diseases Caused by Aeromonas salmonicida[M].Washington:National Fish Health Research Laboratory,2001.
[4] Irie T,Watarai S,Iwasaki T,et al.Protection against experimental Aeromonas salmonicida infection in carp by oral immunisation with bacterial antigen entrapped liposomes[J].Fish & Shellfish Immunology,2005,18(3):235-242.
[5] Magnadóttir B,Bambir S H,Gudmundsdóttir B K,et al.A typical Aeromonas salmonicida infection in naturally and experimentally infected cod,Gadus morhua L.[J].Journal of Fish Diseases,2002,25(10):583-597.
[6] Han H J,Kim D Y,Kim W S,et al.A typical Aeromonas salmonicida infection in the black rockfish,Sebastes schlegeli Hilgendorf,in Korea[J].Journal of Fish Diseases,2011,34(1):47-55.
[7] 周冬仁,罗毅志,杭小英,等.1株乌鳢源杀鲑气单胞菌杀鲑亚种的分离与鉴定[J].海洋湖沼通报,2015(3):64-70.
[8] 王亚冰,梁利国,高金伟,等.异育银鲫源杀鲑气单胞菌杀鲑亚种的分离鉴定[J].微生物学通报,2016,43(7):1532-1539.
[9] Lago E P,Nieto T P,Farto R.Virulence factors of Aeromonas salmonicida subsp.salmonicida strains associated with infections in turbot Psetta maxima[J].Diseases of Aquatic Organisms,2012,99(2):145-151.
[10] Toranzo A E,Barja J L.First report of furunculosis in turbot reared in floating cages in northwest Spain[J].Bulletin-European Association of Fish Pathologists,1992,12(5):147-149.
[11] Pedersen K,Larsen J L.First report on outbreak of furunculosis in turbot Scophthalmus maximus caused by Aeromonas salmonicida subsp. salmonicida in Denmark[J].Bulletin of the European Association of Fish Pathologists,1996,16(4):129-133.
[12] Larsen J L,Pedersen K.A typical Aeromonas salmonicida isolated from diseased turbot (Scophtalmus maximus L.)[J].Acta Veterinaria Scandinavica,1996,37(2):139-146.
[13] 郭羿,叶仕根,王诗瑶,等.养殖大菱鲆红斑溃疡病病原菌的生物学特性研究[J].大连海洋大学学报,2018,33(3):289-294.
[14] 雷霁霖,刘新富,关长涛.中国大菱鲆养殖20年成就和展望——庆祝大菱鲆引进中国20周年[J].渔业科学进展,2012,33(4):123-130.
[15] 王波,雷霁霖,张榭令,等.工厂化养殖的大菱鲆生长特性[J].水产学报,2003,27(4):358-363.
[16] 米娜莎,王栋.中国大菱鲆产业现状及发展趋势分析[J].海洋科学,2011,35(6):96-99.
[17] Valle A,Estensoro I,Fontenla F,et al.Immune response in turbot exposed to the ciliate parasite Philasterides dicentrarchi[J].Fish & Shellfish Immunology,2019,91:402.
[18] 秦蕾,王印庚,史成银,等.一种虹彩病毒感染大菱鲆的病理学研究[J].渔业科学进展,2009,30(5):6-12.
[19] Padrós F,Zarza C,Dopazo L,et al.Pathology of Edwardsiella tarda infection in turbot,Scophthalmus maximus (L.)[J].Journal of Fish Diseases,2006,29(2):87-94.
[20] 吕俊超,张晓华,王燕,等.养殖大菱鲆病原菌——杀鲑气单胞菌无色亚种的分离鉴定和组织病理学研究[J].中国海洋大学学报:自然科学版,2009,39(1):91-95.
[21] 余泽辉,张佳,耿毅,等.齐口裂腹鱼无乳链球菌的分离鉴定及其感染的病理损伤[J].中国水产科学,2014,21(6):1244-1252.
[22] 李绍戊,王荻,连浩淼,等.大西洋鲑杀鲑气单胞菌无色亚种的分离鉴定和致病性研究[J].水生生物学报,2015,39(1):234-240.
[23] Rupp M,Pilo P,Müller B,et al.Systemic infection in European perch with thermoadapted virulent Aeromonas salmonicida (Perca fluviatilis)[J].Journal of Fish Diseases,2019,42(5):685-691.
[24] Farto R,Milton D L,Bermúdez M B,et al.Colonization of turbot tissues by virulent and avirulent Aeromonas salmonicida subsp.salmonicida strains during infection[J].Diseases of Aquatic Organisms,2011,95(2):167-173.
[25] Björnsdóttir B,Gudmundsdóttir S,Bambir S H,et al.Experimental infection of turbot,Scophthalmus maximus (L.),by Aeromonas salmonicida subsp.achromogenes and evaluation of cross protection induced by a furunculosis vaccine[J].Journal of Fish Diseases,2005,28(3):181-188.
[26] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[27] 曹笑楠.草鱼出血性疾病病原体的鉴定、致病性及免疫防治研究[D].新乡:河南师范大学,2018.
[28] Pedersen K,Kofod H,Dalsgaard I,et al.Isolation of oxidase-negative Aeromonas salmonicida from diseased turbot Scophthalmus maximus[J].Diseases of Aquatic Organisms,1994,18(2):149-154.