近年来,水产养殖业迅速发展,然而高养殖密度,高蛋白、高脂肪饲料的频繁使用,抗病药物的滥用等使得养殖环境日益恶化,鱼类病害较为严重[1]。肝脏作为鱼体最大的代谢器官,在鱼类消化、排泄、解毒及免疫等多种生命活动中发挥重要作用,但其易受到各种毒物、病原累及[2-3],导致肝组织受损,进而引起代谢紊乱诱发细菌和病毒感染,甚至导致鱼类死亡,给养殖业造成重大损失。大量研究发现,许多中草药及其提取物都具有显著的保肝作用[4],其作用机理显示主要与中药的清除氧自由基、抗氧化、抑制细胞色素P450酶系CYP450[5-6]及抑制NF-κB活性有关[7]。CYP450酶分布于多种组织和器官中,其中肝脏中含量最为丰富,可参与体内外多种化合物代谢,在肝损伤发生过程中起到了十分重要的作用。研究证明,在经典的CCl4诱导肝损伤模型中,CCl4通过CYP450作用代谢为三氯甲烷自由基(CCl3·)进而引起膜脂质过氧化,这是造成肝损伤的一个重要原因[8]。
大黄素(emodin, EMD),作为虎杖、大黄等传统中药的有效单体成分,在临床和生产上被广泛应用。大黄素具有显著的抗炎、抗肿瘤、抗肝纤维化作用[9]。大黄素的肝保护作用主要与抑制肝脏炎症、抑制肝星形细胞的增殖活化及调节促纤维化因子表达等方面有关[10]。目前,大黄素对鱼类肝损伤的保护作用及机理研究尚未见报道,为了阐明大黄素在鱼类上的保肝作用,本研究中以CCl4诱导建鲤Cyprinus carpio Jian肝损伤,并建立在体肝损伤模型,探讨大黄素的肝保护作用及对肝细胞色素酶的影响,以期为保肝药物开发提供科学依据。
1 材料与方法
1.1 材料
试验用建鲤由中国水产科学研究院淡水渔业研究中心渔场提供,健康无伤,规格齐整,饲养于循环水系统中(每个缸体积为240 L),饲养条件温度为(27±2)℃,pH为6.8~7.6,DO>5 mg/L,总氨氮<0.05 mg/L,H2S<0.01 mg/L。每天投喂量为鱼体质量的2%,驯养1周。
药品与试剂:CCl4(分析纯)购于国药集团化学试剂有限公司,配制成30%的CCl4-橄榄油溶液(CCl4∶橄榄油=3∶7);大黄素标准品购自美国SIGMA公司(St.Louis,Missourk, USA);DPPH(1,1-二苯基-2-三硝基苯肼)购于上海严谨科技有限公司;考马斯亮蓝试剂、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、乳酸脱氢酶(LDH)、白蛋白(Alb)、总蛋白(TP)、超氧化物歧化酶 (SOD)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽(GSH)、总抗氧化能力(T-AOC)和丙二醛(MDA)含量测定试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 试验饲料的制备 基础饲料包括面粉17.4%、鱼粉6.0%、菜籽粕27.0%、米糠粕10.0%、棉籽粕10.0%、豆粕24.0%、磷脂1.0%、豆油1.0%、磷酸二氢钙1.5%、氯化胆碱0.1%、维生素预混料1.0%、矿物质预混料1.0%。在基础饲料中分别添加0.1%、0.3%、0.5%的大黄素,同时减少等量面粉,配制成3种试验饲料,试验饲料营养水平见表1。
表1 饲料组成及营养水平
Tab.1 Ingredients and nutrient levels of experimental diets w/%

组别group大黄素EMD面粉flour粗蛋白质crude protein粗脂肪crude lipid粗灰分crude ash对照组 control017.431.64.66.4模型组 CCl4017.431.64.66.4药物低剂量组low dose EMD0.117.331.64.66.4药物中剂量组 medium dose EMD0.317.131.64.66.4药物高剂量组 high dose EMD0.516.931.64.66.4
1.2.2 试验设计及饲养管理 将初始体质量为150 g左右的健康建鲤随机分为5组,每组20尾,分别为空白对照组、模型对照组(CCl4)、低剂量药物组(1 g/kg EMD)、中剂量药物组(3 g/kg EMD)和高剂量药物组(5 g/kg EMD),每组设2个平行,每个平行10尾,放在10个缸中饲养。其中,空白和模型组均投喂基础饲料,低、中、高剂量药物组分别投喂含1、3、5 g/kg大黄素的试验饲料。每天投喂2次,记录投喂饵料量,每次投喂量为鱼体质量的2%,共养殖60 d。养殖试验结束后,给空白组鱼腹腔注射等量橄榄油, CCl4组和中药组腹腔注射30%的CCl4, 注射剂量为0.05 mL/10 g鱼体,禁食72 h,以诱导肝损伤。整个养殖及试验过程中建鲤死亡率为0。
用MS-222麻醉鱼后,对各组鱼称重、采集血液与肝组织,每组20个样品均进行测定。
1.2.3 大黄素抗氧化活性分析 采用DPPH法测定药物的抗氧化能力[11]。将DPPH用无水乙醇充分溶解后,配制成浓度为2×10-4 mol/L的溶液。将大黄素配制成0、1、2、3、4、5、6 μg/mL水溶液。取2 mL DPPH乙醇溶液,加入2 mL不同浓度的大黄素溶液,混匀后避光静置30 min,在517 nm下测定每个大黄素溶液的吸光值。DPPH的抑制率与清除自由基的能力成正比,其计算公式为
抑制率=(A1-A2)/A×100%。
(1)
其中:A为2 mL DPHH溶液与2 mL无水乙醇混合后在517 nm处的吸光度;A1为2 mL DPHH溶液与2 mL大黄素溶液混合后在517 nm处的吸光度;A2为2 mL 大黄素溶液与2 mL无水乙醇混合后在517 nm处的吸光度。
1.2.4 生长指标的测定与计算 饲养试验结束后,计算出每组鱼的相对增重率(RWR,%)、特定生长率(SGR,%/d)、饵料系数(FCR)和肝指数(LI,%),计算公式为
RWR=(Wt-W0)/W0×100%,
(2)
SGR=(lnWt-lnW0)/t×100%,
(3)
FCR=F/(Wt-W0),
(4)
LI=WL/Wt×100%。
(5)
其中:Wt、W0分别为试验终末和初始鱼的体质量(g);t为饲喂时间(d);F为投喂饲料量(g);WL为肝脏质量(g)。
1.2.5 血清和肝组织生化指标的测定 用CCl4注射建鲤72 h后,采用一次性注射器,从试验鱼尾静脉采血,血样于4 ℃下静置2 h后以3000 r/min离心15 min,分离血清,于-20 ℃下保存备用。按照试剂盒操作说明分别测定血清中相关生化指标。
对采血后的鱼进行解剖,在肝脏右中叶相同部位取肝脏组织,用预冷的生理盐水漂洗血液,剪去肝脏表面附着的结缔组织,再用滤纸吸去表面水分后称重并剪碎,移入匀浆管中,加入9 倍体积的生理盐水 (体积分数为0.86%) 进行匀浆。该匀浆以2000 r/min 离心15 min,收集上清备用。按照试剂盒操作说明分别测定肝匀浆中各项生化指标。
1.2.6 肝微粒体中CYP450酶含量的测定 采用差速离心法获取建鲤肝微粒体[12]。建鲤采净血液后迅速取出肝脏,用滤纸吸净表面水分后称重并剪碎,用KCl-磷酸缓冲液(0.1 mol/L,pH 7.4)漂洗3次,洗净血水。每克肝脏加入3 mL 的KCl-磷酸缓冲液,在冰上制备匀浆。肝匀浆于4 ℃下以10 000 r/min离心20 min,弃沉淀。上清液再于4 ℃下以25 000 r/min离心30 min,弃上清,沉淀部分即为肝微粒体。向肝微粒体中加入含30%甘油的KCl-Tris-HCl 缓冲液(0.1 mol/L,pH 7.4),吹打悬浮后分装于超低温冰箱(-80 ℃)中保存。肝微粒蛋白浓度采用考马斯亮蓝法测定[13]。
取0.5 mL肝微粒体悬液(0.5 g/L)与适量连二亚硫酸钠混合,平均分成两份,加入比色杯中并用一氧化碳充气约30 s。在450 nm和490 nm处测定样品吸光度,计算CYP450含量[14]:
CYP450含量(nmol/mg)=(A450 nm-A490 nm)×1000 /[91×蛋白浓度(g/L)]。
(6)
1.2.7 肝组织中CYP1A、CYP3A mRNA的表达检测 将建鲤处死后,迅速获取适量肝组织置于液氮中储存。按照RNAiso Reagent试剂盒操作抽提总RNA。用紫外分光光度计测定RNA的浓度及纯度, 当A 260 nm/A 280 nm值达到1.8~2.0 时可以进行反转录,以Oligo (dT)18为引物进行RT反应合成cDNA。实时荧光定量PCR反应按照TaKaRa 公司生产的ExScriptTM RT-PCR Kit (Perfect Real Time: SYBR Green I) 进行。基因特异引物及内参β-actin 引物分别按照建鲤CYP1A、CYP3A和β-actin 基因序列采用Primer 5.0软件设计。用2ΔΔCT法对目的基因表达进行相对定量分析[15]。引物如下:
CYP1A-F: 5′TGACAAGGACAACATCCGAGAC 3′,
CYP1A-R: 5′ATAGACGACAGCCCAAGACAGAG 3′;
CYP3A-F: 5′CACCGCTTTATTTCCTTTCATC 3′,
CYP3A-R: 5′CTCGCTTCTTCTTGTGGCCT 3′;
β-actin-F: 5′GTCAAGTCCGTTGAGATGCACC 3′,
β-actin-R: 5′GGATGATGACCTGAGCATTGAAGC 3′。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 15软件进行单因素方差分析(One way-ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 大黄素清除自由基的能力
从图1可见:大黄素浓度较低时,清除DPHH能力近似线性关系,大黄素浓度为3 μg/mL时,其清除能力达到65%;随着大黄素浓度的增加,大黄素清除DPPH自由基的能力渐趋平缓,大黄素浓度为6 μg/mL时,其清除自由基能力达到81%。
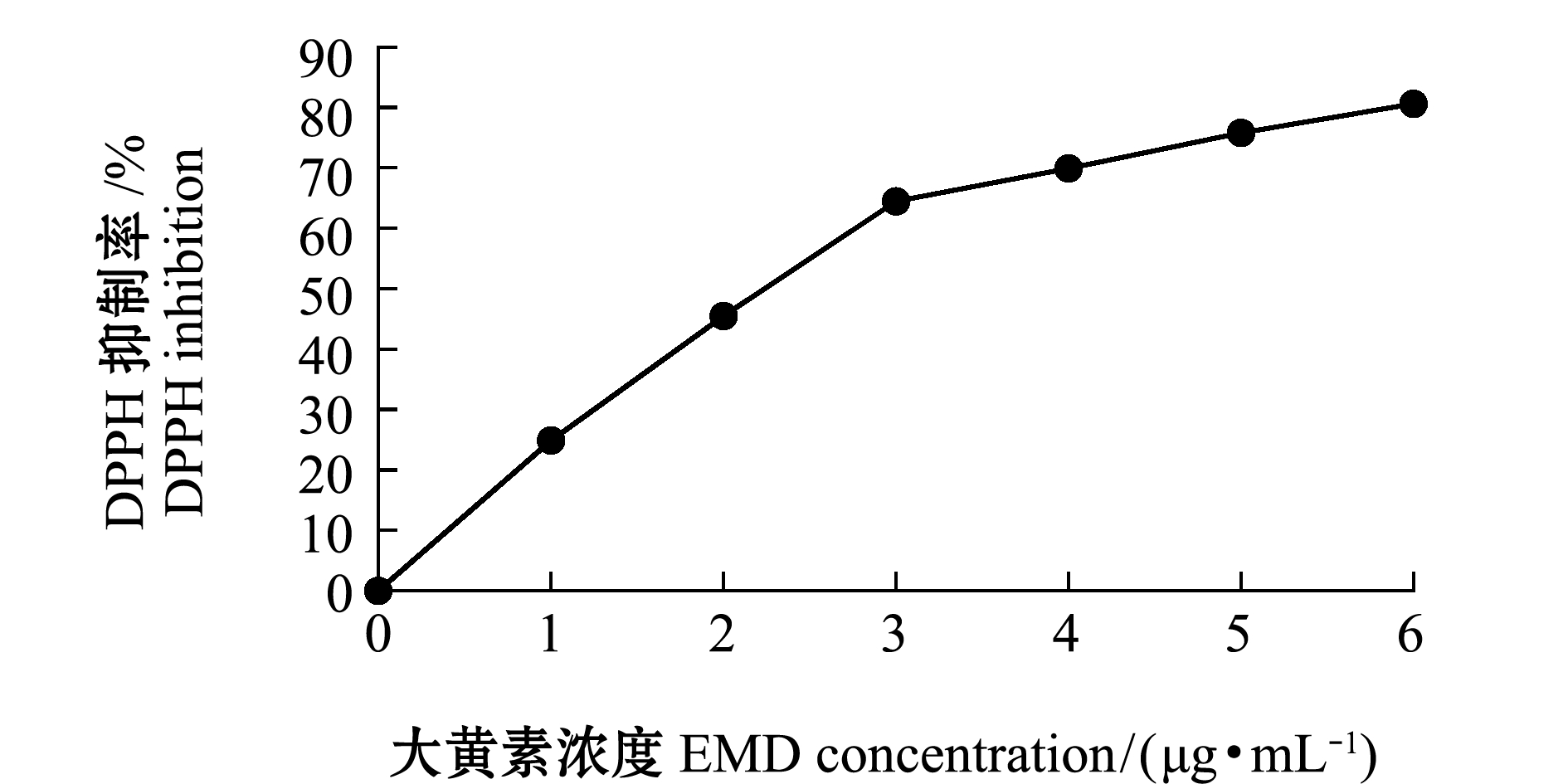
图1 大黄素对DPPH自由基的清除能力
Fig.1 Scavenging capacity of EMD on DPPH free radical
2.2 建鲤生长指标的变化
试验组饲喂不同浓度的大黄素饲料60 d,在注射CCl4造模前,对建鲤生长指标进行了测定。从表2可见:与空白对照组相比,饲喂含3、5 g/kg大黄素饲料能显著提高建鲤的终体质量、相对增重率和特定生长率(P<0.05),显著降低饵料系数(P<0.05),且这种影响随着大黄素含量的升高,效果愈加明显;模型组与空白组均饲喂基础饲料,两组建鲤生长指标无显著性差异(P>0.05)。
表2 大黄素对建鲤生长指标的影响
Tab.2 Effects of EMD on growth index of common carp

组别group初始体质量/ginitial body weight终末体质量/gfinal body weight相对增重率/%relative weight gain特定生长率/(%·d-1)specific growth rate饵料系数food conversion ratiocontrol150.12± 8.09279.37± 11.18a86.07 ±7.79a1.04± 0.07a2.16± 0.14aCCl4151.33 ± 8.10284.56± 11.51a88.04 ±7.37a1.05± 0.08a2.09 ± 0.12a1 g/kg EMD152.37± 9.47308.85± 13.21ab102.65 ± 5.74ab1.18± 0.09b1.94± 0.04a3 g/kg EMD150.68± 8.35330.14± 13.88b119.09 ± 6.44b1.31± 0.08b1.85± 0.09b5 g/kg EMD151.79± 9.07345.32± 15.46b127.46± 8.10b1.37±0.08b1.83± 0.06b
注:同列中标有不同字母表示组间有显著性差异 (P<0.05),标有相同字母表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different among the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences (P>0.05), et sequentia
2.3 建鲤血清中生化指标的变化
从表3可见: CCl4作用建鲤72 h 后,与空白对照组相比,模型组血清中的GOT、GPT 和LDH 活性均显著升高(P<0.05),Alb和TP含量显著下降(P<0.05); 而3、5 g/kg大黄素能显著抑制CCl4诱导GOT水平升高,5 g/kg大黄素能显著抑制CCl4诱导GPT 和LDH水平的升高(P<0.05),同时也能显著恢复血清中Alb和TP含量(除1 g/kg大黄素组外)(P<0.05),且随着用药剂量的提高,其作用愈加明显。
表3 大黄素对建鲤血清生化指标的影响
Tab.3 Effects of EMD on biochemical indices in serum of common carp
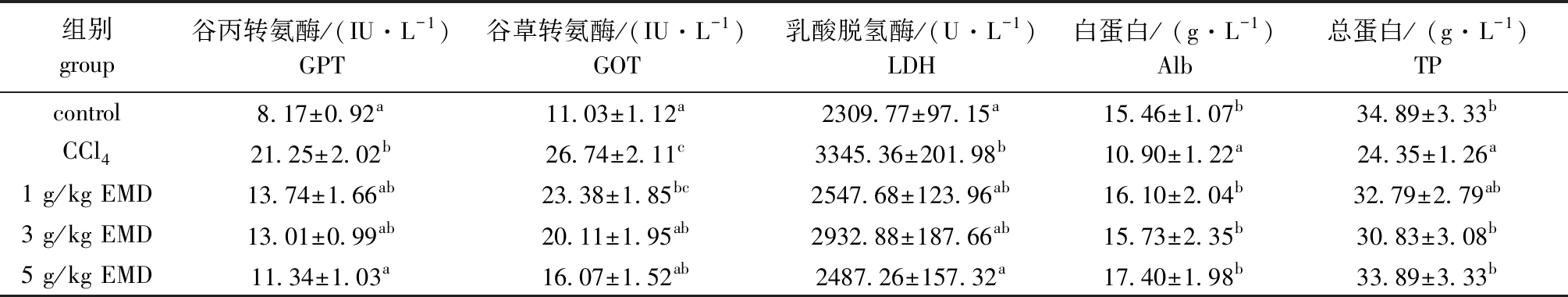
组别group谷丙转氨酶/(IU·L-1)GPT谷草转氨酶/(IU·L-1)GOT乳酸脱氢酶/(U·L-1)LDH白蛋白/ (g·L-1)Alb总蛋白/ (g·L-1) TPcontrol8.17±0.92a11.03±1.12a2309.77±97.15a15.46±1.07b34.89±3.33bCCl421.25±2.02b26.74±2.11c3345.36±201.98b10.90±1.22a24.35±1.26a1 g/kg EMD13.74±1.66ab23.38±1.85bc2547.68±123.96ab16.10±2.04b32.79±2.79ab3 g/kg EMD13.01±0.99ab20.11±1.95ab2932.88±187.66ab15.73±2.35b30.83±3.08b5 g/kg EMD11.34±1.03a16.07±1.52ab2487.26±157.32a17.40±1.98b33.89±3.33b
2.4 肝组织中抗氧化指标、肝微粒体中CYP450酶及肝指数的变化
从表4可见:CCl4作用建鲤72 h后,与空白对照组相比,模型组肝组织中T-AOC和SOD活性均显著下降(P<0.05),GSH-Px和GSH消耗明显,MDA大量生成(P<0.05);3、5 g/kg大黄素能显著防止肝组织中T-AOC、SOD、GSH-Px及GSH水平下降并显著抑制MDA生成(P<0.05),且随着大黄素剂量升高,其作用愈加显著。
从表4还可见:CCl4作用建鲤72 h后,与空白对照组相比,模型组肝微粒体中CYP450酶含量显著增加(P<0.05),表明CCl4对CYP450酶有诱导作用,而3、5 g/kg大黄素饲料组建鲤肝微粒体中CYP450酶含量显著降低(P<0.05),这表明大黄素能抑制CCl4对CYP450酶的诱导,且中、高剂量大黄素抑制效果优于低剂量,即大黄素对CYP450酶的抑制作用有剂量依赖性;同时,CCl4诱导建鲤肝损伤后,引起肝组织肿大,CCl4组建鲤肝指数较空白对照组显著增大(P<0.05),而3、5 g/kg大黄素能显著抑制CCl4导致的建鲤肝组织肿大,肝指数明显降低,且随着大黄素剂量的升高,恢复效果愈加显著(P<0.05)。
表4 大黄素对建鲤肝组织中抗氧化指标和肝微粒体中CYP450酶含量及肝指数的影响
Tab.4 Effects of EMD on antioxidant ability in the liver, and CYP450 enzyme content in liver microsomes and hepato-somatic index of common carp

组别group总抗氧化能力/(U·mg-1 prot)T-AOC超氧化物歧化酶/(U·mg-1 prot)SOD谷胱甘肽过氧化物酶/(mg·g -1 prot)GSH-Px还原型谷胱甘肽/(mg·g -1 prot)GSH丙二醛/(nmol·mg-1 port)MDACYP450酶含量/(nmol·mg-1)content of CYP450肝指数/% hepato-somaticindexcontrol8.10±0.65b187.45±14.35b218.43±19.34b165.75±14.25b9.06±1.13a0.32±0.09a1.7±0.42aCCl44.42±0.32a97.14±5.59a117.86±11.42a87.11±5.59a18.44±1.09b0.66±037b3.14±0.91b1 g/kg EMD5.65±0.23ab102.87±10.88a197.65±17.24ab85.22±13.01a13.25±1.02ab0.53±0.33ab2.62±0.86ab3 g/kg EMD7.44±0.81b177.52±14.86b221.42±13.17b157.83±14.30b11.42±0.95a0.47±0.28a2.23±0.75a5 g/kg EMD8.03±0.74b192.28±13.77b247.52±14.35b152.93±13.34b9.98±1.01a0.40±0.12a1.97±0.39a
2.5 肝组织中CYP3A、CYP1A基因表达量的变化
从图2可见:CCl4腹腔注射建鲤72 h后,模型组肝组织中CYP3A和CYP1A的mRNA表达量较空白对照组显著升高(P<0.05);与模型组相比,大黄素能显著抑制CCl4诱导的CYP3A(除1 g/kg大黄素组外)和CYP1A表达量的上调(P<0.05),且随着大黄素剂量的升高,抑制作用愈加显著。

注:标有不同字母者表示同一基因中不同组间有显著性差异 (P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters at same gene are significantly, different among the groups at the 0.05 probability level, and the means with the same letters are not significant differences (P>0.05)
图2 大黄素对建鲤肝组织中CYP3A和CYP1A mRNA表达量的影响
Fig.2 Effect of EMD on expression levels of CYP3A and CYP1A mRNA in the liver of common carp
3 讨论
3.1 大黄素对建鲤生长的影响
随着水产养殖业的发展,绿色养殖、健康养殖在生产过程中越来越重要。中草药作为天然药物,具有资源丰富、污染少及毒副作用小的优点,其作为饲料添加剂被广泛应用于动物的养殖[16]。杨维维等[17]在探讨大黄素对克氏螯虾生长的影响时发现,饲料中添加50~75 mg/kg的大黄素,可显著提高克氏螯虾的成活率,降低饵料系数。明建华等[18]发现,饲料中添加大黄素可显著提高团头鲂的增重率和特定生长率,降低死亡率及饵料系数。本研究中也得到了一致的结果,饲料中添加大黄素后,建鲤的终体质量、相对增重率和特定生长率得到了显著提高,而饵料系数显著下降,这表明饲料中添加大黄素可帮助建鲤消化吸收、促进其进食,从而加速鱼体的生长,提高饵料的利用效率。
3.2 大黄素对建鲤肝功能指标的影响
作为经典的诱导动物肝损伤模型的毒物CCl4,其肝损伤机制主要与自身和其自由基代谢产物有关。CCl4经肝微粒体CYP450酶活化分解产生三氯甲烷自由基( CCl3·),引起肝细胞膜和细胞器膜脂质过氧化,从而改变了膜的流动性和通透性,最终导致肝细胞受损,此过程目前被认为是主要的肝损伤机制[19]。本研究中将30%的CCl4-橄榄油溶液腹腔注射建鲤72 h后,血清中GOT、GPT和LDH活性上升,证明CCl4改变了肝细胞膜的通透性,导致了胞浆内可溶性酶的溶出;同时肝细胞受损后,其合成白蛋白的能力降低,导致白蛋白和总蛋白含量下降。而5 g/kg的大黄素可显著抑制CCl4诱导的酶含量上升,表明大黄素可以抵抗磷脂氧化,稳定细胞膜。展玉涛等[20]利用CCl4制备大鼠肝纤维化模型研究了大黄素对肝功能的影响,结果也发现,大黄素能明显抑制CCl4诱导的血清GOT水平的提高,恢复白蛋白和总蛋白含量。
大量研究表明,大黄素具有理想的抗氧化作用。Yen等[21]研究蒽醌和蒽酮的抗氧化活性时发现,大黄素和芦荟大黄素具有较强的还原活性和清除羟基自由基的作用,在0.25 mg/mL浓度下的清除率分别达到26.2%和41.8%,表明其抗氧化机制可能依赖于清除羟自由基。罗霄山[22]发现,原代培养大鼠肝细胞在芦荟大黄素预培后,CCl4导致的肝组织中GSH损耗及MDA生成得到了明显的抑制。杨维维等[17]的研究也表明,饲料中添加大黄素能显著提高克氏螯虾的肝脏抗氧化能力,肝组织中GSH、SOD含量均显著上升。本研究中利用DPHH法测定大黄素清除自由基能力,发现大黄素为6 μg/mL时,清除自由基能力达到了81%;建鲤饲喂大黄素2个月后,能显著抵抗CCl4导致的肝大,肝指数显著降低,生长性能得到显著提高,能明显抑制CCl4导致的肝组织匀浆中的SOD、GSH-Px及GSH含量的损耗,且显著抑制脂质过氧化代谢产物MDA的大量生成,T-AOC水平得到显著提高,这些结果与其他学者的研究结论一致。大黄素对CCl4诱导的建鲤肝损伤的保护作用应与其抗氧化能力有关。
3.3 大黄素对建鲤肝微粒体中CYP450酶的影响
CYP450酶系作为机体的生物转化系统,可以广泛的代谢体内外源性物质[23]。CCl4在体内进行代谢活化的过程中,CYP450酶系发挥了关键作用,Shibata等[24]研究表明,肝组织中CYP2E1基因与CCl4诱导的肝损伤关系密切,Zhou等[25]研究认为,CYP1A1、CYP1A2及CYP3A4等代谢在CCl4的生物转化过程中同样具有重要作用。鱼类CYP1A基因在1988年被克隆后,发现其能被外源性化合物诱导且表现出剂量依赖效应[26],苯并芘、多环芳烃、二噁英等农药都是CYP1A的诱导剂[27],这种诱导作用使得CYP1A成为检测水体污染的指标之一。CYP3A在肝脏和小肠中含量丰富,分别约占CYP总量的30%和70%,是参与临床常用药物氧化代谢的主要酶系,是CYP家族中最重要的亚族成员[28]。研究CYP1A和CYP3A在CCl4代谢过程中的变化对剖析CCl4的损伤机理、防护及药物的选择都有指导意义[29]。 郑天慧等[30]在比较3种化学品导致的急性肝损伤大鼠模型中CYP450酶的变化时发现,CCl4能抑制大鼠CYP1A2和CYP3A4活性。而刘移民等[31]研究发现,CCl4对人体淋巴细胞瘤细胞株中CYP2E1和CYP3A4基因有明显的诱导作用,且表现出剂量效应关系。沈俊辉等[32]研究发现,CCl4对大鼠肝组织中CYP3A表达显著上调。由此可见,目前CYP450酶各亚族在CCl4诱导的肝损伤过程中含量变化表现并不统一,但与CCl4作用时间和剂量有关联[33]。本研究中CCl4作用建鲤72 h后,模型组肝微粒体中CYP450酶含量显著增加,肝组织中CYP1A、CYP3A mRNA表达量也显著上调。这表明CCl4可以通过诱导CYP450酶活性及CYP1A和CYP3A的表达,进一步促进CCl4人代谢,使得毒性产物累积,导致建鲤肝组织的损伤。本研究中采用大黄素饲喂建鲤60 d后,大黄素能显著降低肝组织CYP450酶含量,且表现出剂量效应。这表明大黄素对肝组织的保护作用与抑制CCl4对CYP450酶的诱导有关。
综上所述,大黄素对CCl4诱导的建鲤肝损伤具有保护作用且存在剂量效应。可能与其强大的抗氧化能力及抑制CCl4对CYP450酶的诱导有关。
[1] 孟祥林,丁庆秋.鱼类肝胆综合症的发病原因及防治方法[J].水利渔业,2004,24(3):65.
[2] Arnold H,Pluta H J,Braunbeck T.Sublethal effects of prolonged exposure to disulfoton in rainbow trout (Oncorhynchus mykiss):cytological alterations in the liver by a potent acetylcholine esterase inhibitor[J].Ecotoxicology and Environmental Safety,1996,34(1):43-55.
[3] Moutou K A,Braunbeck T,Houlihan D F.Quantitative analysis of alterations in liver ultrastructure of rainbow trout Oncorhynchus mykiss after administration of the aquaculture antibacterials oxolinic acid and flumequine[J].Diseases of Aquatic Organisms,1997,29(1):21-34.
[4] 夏瑾瑜,李泽望.中草药保肝作用机理的研究概况[J].中西医结合肝病杂志,1994,4(4):50-52.
[5] Shim J Y,Kim M H,Kim H D,et al.Protective action of the immunomodulator ginsan against carbon tetrachloride-induced liver injury via control of oxidative stress and the inflammatory response[J].Toxicology and Applied Pharmacology,2010,242(3):318-325.
[6] Lee K J,Choi J H,Kim H G,et al.Protective effect of saponins derived from the roots of Platycodon grandiflorum against carbon tetrachloride induced hepatotoxicity in mice[J].Food and Chemical Toxicology,2008,46(5):1778-1785.
[7] Reyes-Gordillo K,Segovia J,Shibayama M,et al.Curcumin protects against acute liver damage in the rat by inhibiting NF-κB,proinflammatory cytokines production and oxidative stress[J].Biochimica et Biophysica Acta (BBA)-General Subjects,2007,1770(6):989-996.
[8] Castro G D,Díaz Gómez M I,Castro J A.DNA bases attack by reactive metabolites produced during carbon tetrachloride biotransformation and promotion of liver microsomal lipid peroxidation[J].Research Communications in Molecular Pathology and Pharmacology,1997,95(3):253-258.
[9] 张喜平.大黄素的药理作用研究概况[J].中国药理学通报,2003,19(8):851-854.
[10] 李元,郭顺根,吴宇泽,等.大黄素抗肝纤维化作用机制研究进展[J].中国组织化学与细胞化学杂志,2007,16(3):378-381.
[11] 李政,王国良,金珊,等.31种常见抗菌中药对DPPH自由基清除作用的分析[J].海洋水产研究,2005,26(1):38-40.
[12] 张宁,喻文娟,王翔凌,等.草鱼肝微粒体的提取及CYP酶活性的测定[J].海洋渔业,2007,29(2):148-152.
[13] 简暾昱,徐帆,廖春龙,等.3种方法测定大鼠肝微粒体蛋白含量的比较[J].中国药师,2011,14(3):342-345.
[14] Omura T,Sato R.The carbon monoxide-binding pigment of liver microsomes.II.Solubilization,purification,and properties[J].The Journal of Biological Chemistry,1964,239(7):2379-2385.
[15] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[16] 孙裔雷,王荻,刘红柏.复方中草药对虹鳟抗氧化能力的影响[J].大连海洋大学学报,2015,30(2):170-174.
[17] 杨维维,沈美芳,刘文斌,等.大黄素对克氏螯虾生长、免疫、肝脏抗氧化以及肠道消化酶的影响[J].江苏农业学报,2013,29(6):1405-1410.
[18] 明建华,谢骏,徐跑,等.大黄素、维生素C及其配伍对团头鲂生长、生理生化指标、抗病原感染以及两种HSP70s mRNA表达的影响[J].水产学报,2010,34(9):1447-1459.
[19] Recknagel R O,Glende Jr E A,Dolak J A,et al.Mechanisms of carbon tetrachloride toxicity[J].Pharmacology & Therapeutics,1989,43(1):139-154.
[20] 展玉涛,陈颖伟,卫新革,等.大黄素对肝纤维化大鼠肝功能的影响[J].实用肝脏病杂志,1999,4(4):196-197.
[21] Yen G C,Duh P D,Chuang D Y.Antioxidant activity of anthraquinones and anthrone[J].Food Chemistry,2000,70(4):437-441.
[22] 罗霄山.芦荟大黄素对CCl4损伤原代培养大鼠肝细胞的保护作用[J].中医药学刊,2003,21(7):1101-1102.
[23] Omura T.Forty years of cytochrome P450[J].Biochemical and Biophysical Research Communications,1999,266(3):690-698.
[24] Shibata S.A drug over the millennia:pharmacognosy,chemistry,and pharmacology of licorice[J].Yakugaku Zasshi:Journal of the Pharmaceutical Society of Japan,2000,120(6):849-862.
[25] Zhou Shufeng,Koh H L,Gao Yihui,et a1.Herbal bioactivation:the good,the bad and the ugly[J].Life Sciences,2004,74(8):935-968.
[26] Haasch M L,Sutherland L A,Wejksnora P J,et al.Effect of acrylamide monomer on hepatic CYP1A1 monooxygenase induction in rainbow trout[J].Comparative Biochemistry and Physiology Part C:Comparative Pharmacology,1992,102(2):281-286.
[27] Jung D K J,Klaus T,Fent K.Cytochrome P450 induction by nitrated polycyclic aromatic hydrocarbons,azaarenes,and binary mixtures in fish hepatoma cell line PLHC-1[J].Environmental Toxicology and Chemistry,2001,20(1):149-159.
[28] 刘萍,黄颖,胡本荣,等.甲基莲心碱对大鼠肝CYP450酶含量及CYP2D1,CYP3A1,CYP2E1 mRNA的影响[J].中国实验方剂学杂志,2010,16(10):161-164.
[29] Kronbach T,Fischer V,Meyer U A.Cyclosporine metabolism in human liver:identification of a cytochrome P-450III gene family as the major cyclosporine-metabolizing enzyme explains interactions of cyclosporine with other drugs[J].Clinical Pharmacology & Therapeutics,1988,43(6):630-635.
[30] 郑天慧,刘伟,李淑萍,等.不同急性肝损伤大鼠模型对5种CYP450酶的影响[J].中国药学杂志,2017,52(12):1023-1028.
[31] 刘移民,Yan Yan,Lyn-Cook B D.四氯化碳与乙醇对3种细胞色素P450酶基因表达的影响[J].中国职业医学,2002,29(2):16-18.
[32] 沈俊辉,黄春芳,马鑫,等.CYP450基因在大鼠肝硬化模型中的表达研究[J].河北医科大学学报,2013,34(9):1001-1004.
[33] Chaudhury S,Mehendale H M.Amplification of cci4 toxicity by chlordecone:destruction of rat hepatic microsomal cytochrome p-450 subpopulation[J].Journal of Toxicology and Environmental Health,1991,32(3):277-294.