Sox(Sry-related high mobility group box)基因家族是能够编码哺乳动物雄性决定基因Sry样HMG box(两者具有60% 以上氨基酸序列相似性)的一系列基因[1],之后这些基因在非哺乳动物中也陆续发现。研究表明,Sox基因在性腺分化和早期胚胎发育中具有重要作用,目前,Sox9基因已被许多学者作为研究脊椎动物性别决定与性腺发育过程的关键基因。在哺乳动物和鸟类中,Sox9基因在性腺分化中的两性差异表达模式表明了Sox9基因在其性别决定和性腺发育过程中的重要功能。与哺乳动物不同,鱼类的性别决定机制比较复杂,如在黄鳝Monopterus albus[2]、斑马鱼Danio rerio[3]、青鳉Oryzias latipes[4-5]、鲤Cyprinus carpio[6]和黄颡鱼Pelteobagrus fulvidraco[7]等一些硬骨鱼类中发现有两种Sox9基因,且它们在性腺中的表达模式有所不同。而在斜带石斑鱼Epinephelus coioides[8]、尼罗罗非鱼Oreochromis niloticus[9]、牙鲆Paralichthys olivaceus[10]、金钱鱼Scatophagus argus[11]和圆斑星蝶Verasper variegatus[12]中仅发现了一种Sox9基因,且其两性差异表达模式均为精巢强于卵巢。这些研究结果表明,Sox9基因在鱼类性别决定和性腺发育中可能发挥着重要的作用。
许氏平鲉Sebastes schlegeli是中国北方重要的养殖鱼类,具有个体大、生长速度快、抗病力强、卵胎生、味质鲜美等优点。目前,许氏平鲉苗种主要来源于海捕野生苗,人工苗种供给率低,且长期过度捕捞对其资源和遗传多样性也会造成一定程度的破坏。因此,大量人工繁育速生、抗病能力强的许氏平鲉苗种已成为保护许氏平鲉资源及养殖业可持续发展的必要手段[13]。目前,国内外关于许氏平鲉的研究主要集中在人工育苗、胚胎发育及早期形态发育等方面[14-17]。而对于许氏平鲉性腺发育及性别决定等分子机制研究甚少。许氏平鲉是卵胎生鱼类,其繁殖习性与卵生鱼类有所差异,因此,对许氏平鲉Sox9性别相关基因的研究,将有利于丰富鱼类性别决定及性腺发育的生物学知识,也有利于许氏平鲉繁殖和育种工作的开展。本研究中,通过同源克隆、RACE技术、实时定量 PCR、启动子序列生物信息学分析及其细胞定位等技术对许氏平鲉Sox9基因进行了分析,旨在为鱼类性别分化和分子调控机制提供理论基础。
1 材料与方法
1.1 材料
试验用成体许氏平鲉雌、雄鱼各3尾,体长为(27±2) cm,体质量为(758±15)g,购自山东省青岛市南山水产市场。不同发育时期的仔鱼各5尾,取自烟台泰华海珍品有限公司。
1.2 方法
1.2.1 组织样品的制备 成体许氏平鲉取样当天麻醉后立即解剖,取每尾鱼(雌雄鱼各3尾)的肌肉、 肝、全脑、 肾、 鳃、 脾、 肠、 心、 精巢、 卵巢组织,用于成体各组织定量表达分析。 Omoto 等[18]研究表明,许氏平鲉仔鱼在25日龄时性腺开始分化。本试验中根据性腺分化的关键时期(25 日龄) 选取出生后1、 5、 10、 15、 25、 35日龄的仔鱼各5尾,取每尾鱼的躯干部用于仔鱼发育时期定量表达分析。各样品用液氮速冻后转移至-80 ℃超低温冰箱中保存备用。
用于Sox9基因细胞定位的材料取自上述成体许氏平鲉的精巢和卵巢,并将其放在1×PBS中漂洗3次,切成1.0 cm×1.0 cm×0.5 cm的组织块,放于4% PFA-1×PBS中4 ℃下固定过夜,固定后保存在100%甲醇中备用。
1.2.2 总RNA和基因组DNA的提取 用Trizol法提取不同发育时期仔鱼和成体各组织的总RNA,操作方法根据Trizol Reagent 使用说明书进行。提取的总RNA样品经DNaseI(TaKaRa)处理后,利用跨内含子设计的β-actin引物(表1)进行PCR扩增,检测 DNA 是否去除干净。用苯酚-氯仿法从肌肉组织中提取基因组DNA,并通过琼脂糖凝胶电泳和分光光度计测定总RNA和基因组DNA的质量和数量。随后用反转录试剂盒M-MLV(TaKaRa)对许氏平鲉成体组织和仔鱼发育时期样品的总 RNA进行cDNA合成。
1.2.3 许氏平鲉Sox9基因克隆 运用同源克隆方法,根据已发表的鱼类Sox9基因保守区序列,设计简并引物Sox9-CP-FW/RV(表1),并以许氏平鲉精巢和卵巢组织的混合cDNA为模板进行PCR扩增。PCR反应条件为:95 ℃下预变性5 min;95 ℃下变性30 s,65 ℃下退火30 s,72 ℃下延伸30 s,以后每个循环退火温度降低1 ℃,共进行10个循环(退火温度从65 ℃降到55 ℃);随后95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸30 s,共进行25个循环;最后再在72 ℃下延伸10 min。
表1 试验所用引物
Tab.1 Primers used in this study
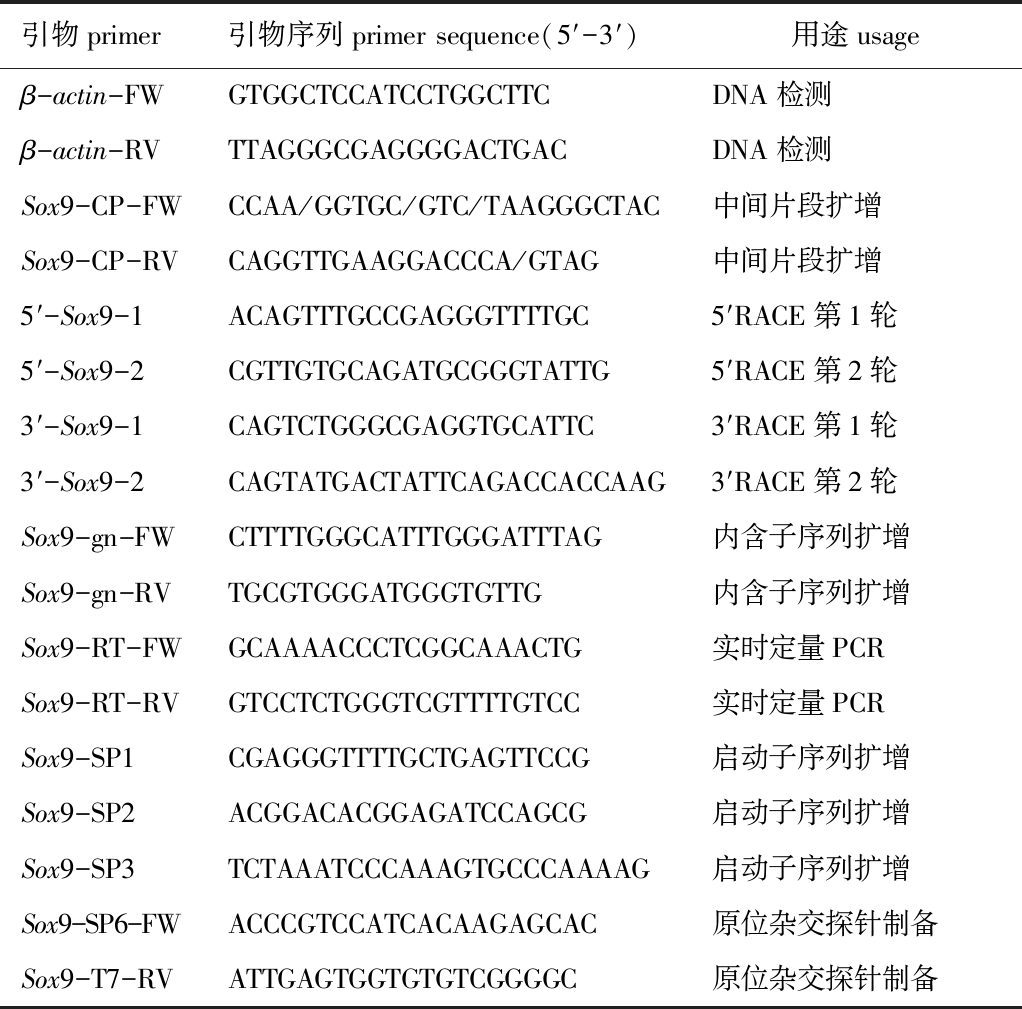
引物primer引物序列primer sequence(5′-3′)用途usageβ-actin-FWGTGGCTCCATCCTGGCTTCDNA检测β-actin-RVTTAGGGCGAGGGGACTGACDNA检测Sox9-CP-FWCCAA/GGTGC/GTC/TAAGGGCTAC中间片段扩增Sox9-CP-RVCAGGTTGAAGGACCCA/GTAG中间片段扩增5′-Sox9-1ACAGTTTGCCGAGGGTTTTGC5′RACE第1轮5′-Sox9-2CGTTGTGCAGATGCGGGTATTG5′RACE第2轮3′-Sox9-1CAGTCTGGGCGAGGTGCATTC3′RACE第1轮3′-Sox9-2CAGTATGACTATTCAGACCACCAAG3′RACE第2轮Sox9-gn-FWCTTTTGGGCATTTGGGATTTAG内含子序列扩增Sox9-gn-RVTGCGTGGGATGGGTGTTG内含子序列扩增Sox9-RT-FW GCAAAACCCTCGGCAAACTG实时定量PCRSox9-RT-RVGTCCTCTGGGTCGTTTTGTCC实时定量PCRSox9-SP1CGAGGGTTTTGCTGAGTTCCG启动子序列扩增Sox9-SP2ACGGACACGGAGATCCAGCG启动子序列扩增Sox9-SP3TCTAAATCCCAAAGTGCCCAAAAG启动子序列扩增Sox9-SP6-FWACCCGTCCATCACAAGAGCAC原位杂交探针制备Sox9-T7-RVATTGAGTGGTGTGTCGGGGC原位杂交探针制备
根据所获得的核心cDNA片段序列,各设计一条特异引物和一条巢式引物用于5′RACE和3′RACE(表1)。用BD SMARTTM RACE cDNA Amplification kit (Clonetech) 进行RACE反应,具体步骤可参考试剂盒说明书。根据许氏平鲉Sox9 基因全长cDNA序列,设计跨越5′UTR和3′UTR的一对特异引物Sox9-gn-FW/RV用于内含子序列扩增(表1)。以许氏平鲉肌肉组织DNA为模板, 运用LA Taq酶(TaKaRa)进行PCR反应。PCR反应条件同“1.2.3”节,只是中间两次延伸温度由72 ℃变为68 ℃,其他条件和程序不变。
利用已克隆得到的许氏平鲉Sox9基因全长,在靠近基因的5′侧翼区设计3个反向嵌套特异引物SP1、SP2、SP3 用于Sox9基因启动子序列的扩增。并运用染色体步移试剂盒(TaKaRa)进行3次巢式PCR反应。PCR反应条件具体参考试剂盒说明书。以上反应所得的PCR产物,均用15 g/L 的琼脂糖凝胶进行电泳检测,并根据目的条带大小,用DNA凝胶回收试剂盒(Zymo Research, Irvine CA, USA) 对目的DNA进行回收纯化。将回收产物连接到pMD18-T (TaKaRa)载体上,并将连接产物转化到Trans5α (TransGenBiotech) 感受态细胞中,采用载体特异引物M13-47/48进行菌落PCR阳性检测, 挑取阳性克隆测序。
1.2.4 许氏平鲉Sox9 cDNA序列及启动子序列分析 利用NCBI Blast工具(http://blast.ncbi.nlm. nih.gov/Blast),将得到的核心片段与GenBank中已有的核酸序列进行相似性分析,进一步确定所得的Sox9基因。运用DNASTAR Lasergene及DNAMAN 7.0软件分析Sox9基因cDNA序列,预测ORF。通过比对Sox9 DNA与cDNA序列,并结合其他硬骨鱼类内含子情况,确定许氏平鲉Sox9基因的内含子位置及数目。同时采用ClustalX 1.81软件比对不同物种间Sox9蛋白的氨基酸序列。运用MEGA 5.0 软件,采用NJ法构建系统进化树。
运用生物信息学软件NNPP(Neural Network Promoter Prediction, http://www. fruitfly.org/seq_ tools/promoter.html)对所获得的Sox9基因启动子序列进行分析,确定基因的转录起始结合位点(TSS)。并利用TFSEARCH (http://www.cbrc.jp/research/db/TFSEARCH. html)、Alibaba 2.1 program(http://www.generegulation.com/pub/programs/alibaba2/index. html)、Match Program(http://www. gene-regulation.com/pub/programs.html#match)、TESS(http://www.cbil.upenn.edu/cgi-bin/tess)等软件对该基因的转录因子结合位点进行预测。
1.2.5 实时定量PCR(qPCR) 取许氏平鲉成体各组织和仔鱼发育时期样品各1 μg RNA,反转录成cDNA,取1 μL cDNA (10 ng/μL)产物进行qPCR反应。根据全长Sox9 cDNA序列设计特异引物Sox9-RT-FW/RV(表1),并选用本实验室筛选出的比较稳定的Rpl17为内参基因[19]。qPCR标准反应体系(20 μL)包括:cDNA模板(10 ng) 1 μL, 2×SYBR® Premix Ex TaqTM II (TaKaRa) 10 μL,正、反向引物(10 μmol/L)各0.4 μL, ROX Reference Dye II 0.4 μL,无菌水7.8 μL。qPCR反应程序(两步法)为:95 ℃下预变性30 s;95 ℃下变性15 s,60 ℃下退火/延伸45 s,共进行40个循环,并运行熔解曲线确定扩增产物的特异性。每一试验样品重复扩增3次。基因相对表达水平采用2-ΔΔCT方法计算[21]。
1.2.6 许氏平鲉Sox9基因在性腺组织中的细胞定位分析 采用原位杂交方法检测许氏平鲉Sox9基因在成体性腺组织中的细胞定位情况。避开Sox9基因保守区,设计一对特异引物Sox9-SP6-FW/Sox9-T7-RV(表1),并以含有目的基因的质粒为模板进行PCR扩增,用15 g/L琼脂糖凝胶电泳检测PCR产物,并使用凝胶回收试剂盒ZymocleanTM回收目的片段作为合成探针用的模板。探针的体外转录采用T7/SP6 RNA Polymerase(TaKaRa)试剂盒,详细步骤参照试剂盒说明书。合成的探针用NucAway Spin Columns进行纯化。经10 g/L 琼脂糖凝胶电泳检测后,置于-80 ℃下保存备用。
取保存于甲醇中的性腺组织块,用无水乙醇充分脱水,二甲苯梯度透明,并置于55 ℃蜡浴中透蜡。将经过透蜡的组织进行蜡块包埋,用切片机制成厚度为7 μm的切片。将切片用乙醇梯度复水,蛋白酶K处理。用1×PBST洗去消化液,用4% PFA-1×PBS固定30 min,再用1×PBST浸洗3次。将切片置于60 ℃杂交炉中预杂交3 h,然后加入Sox9 RNA探针于60 ℃杂交炉中杂交过夜。杂交后第2天移走RNA探针杂交液,并用SSCT梯度清洗切片,加入按1∶2000比例稀释的anti-Dig-AP抗体,4 ℃下孵育12~16 h。杂交后第3天用1×PBST洗去多余抗体,加入NBT-BCIP显色液避光显色。每隔10 min 观测显色情况。染色结束后,用1×PBST洗净染液,用1%中性红复染。使用显微镜(Nikon Eclipse Ti-U)观察并记录结果。
1.3 数据处理
采用SPSS 19.0软件进行单因素方差分析(One-way ANOVA)及Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 许氏平鲉Sox9基因序列分析
利用DNASTAR软件将同源克隆得到的核心片段与RACE技术获得的两端侧翼序列进行全长cDNA拼接,得到了许氏平鲉Sox9完整的cDNA序列(GenBank:KJ624404)。从图1可见:许氏平鲉Sox9 cDNA全长2039 bp,包括5′非翻译区(5′UTR)336 bp, 3′非翻译区(3′UTR)242 bp,开放阅读框(ORF)1461 bp;在3′UTR中含有多聚腺苷酸加尾信号(aataaa)和PolyA尾。经分析,许氏平鲉Sox9基因的ORF可编码486个氨基酸,预测相对分子质量为53 090。通过Sox9全长cDNA序列与其对应基因组DNA序列比对分析可知,许氏平鲉Sox9基因含有3个外显子和2个内含子,内含子大小分别为503 bp和265 bp,且内含子和外显子的边界都符合“GT-AG”原则。

注:大写字母为编码区;小写字母为非编码区和内含子;编码区下单个字母为氨基酸;加粗字体为起始密码子和终止密码子;下划线为HMG盒;阴影框为多聚腺苷酸尾(aataaa)
Note: Capital letters,coding regions; Letters,untranslated regions (UTR) or intron; A single letter code below the coding regions, amino acids; Bold letters, start and stop codons; Underline, HMG box; Shaded box, polyadenylation signal (aataaa)
图1 许氏平鲉Sox9基因核苷酸序列
Fig.1 Nucleotide sequence of the Sox9 gene in black rockfish Sebastes schlegeli
2.2 氨基酸序列比对和系统进化树的构建
通过与人类Homo sapiens、小鼠Mus musculus、非洲爪蟾Xenopus laevis及其他硬骨鱼类的Sox9蛋白序列比对,可以看出在许氏平鲉Sox9蛋白第107~178氨基酸位置有一个高度保守的HMG结构域(图2)。在该HMG盒内存在一个特征性基序AQAARRKL,两个核定位信号NLS1(KRPMNAFMVWAQAARRK)和NLS2(RRRK),同时还含有一个富含亮氨酸的核输出信号NES(LSKTLGKLWRLL)。进一步分析显示,许氏平鲉Sox9氨基酸序列与哺乳动物Sox9氨基酸序列的相似性较低,其中与人类的一致性为78.0%,与小鼠的一致性为78.2%,与硬骨鱼类斑马鱼的Sox9b一致性最低,为73.2%,与其他硬骨鱼类的Sox9氨基酸序列则具有较高的相似性,其中与牙鲆和斜带石斑鱼的一致性最高,分别为 93.9% 和94.1%。
根据已发表的各个物种的Sox9氨基酸序列构建NJ分子系统进化树,结果显示,哺乳类(如人类,小鼠)、鸟类(如鸡)和两栖类(如非洲爪蟾)的Sox9蛋白聚在一起,硬骨鱼类的斑马鱼Sox9b则分出了较独立的一支,而许氏平鲉、三棘刺鱼等其他硬骨鱼类的Sox9蛋白聚为一支(图3)。
2.3 Sox9基因启动子序列的生物信息学分析
从图4-A可见:用染色体步移法得到了许氏平鲉Sox9基因的启动子序列(GenBank:KJ624401),长度为2252 bp。运用NNPP软件对5′UTR序列及染色体步移得到的序列进行分析,确定了转录起始位点TSS。在转录起始位点上游未检测到典型的TATA box及GC box。
从图4-B可见:利用TFSEARCH、Match Program、Alibaba 2.1和TESS等在线生物学软件对Sox9基因启动子转录因子结合位点进行了预测,预测结果显示,在得到的Sox9基因启动子中,存在特化蛋白Sp1、转录激活蛋白AP-1、八聚体结合蛋白Oct-1、叉头框蛋白FOXD3、肝核因子HNF3β、雌激素受体ER、环磷酸腺苷应答元件结合蛋白CREB、 GATA-2、GATA-3、VBP和核因子NF-κB等蛋白结合位点。此外,在Sox9基因启动子中还预测到了性别相关转录因子SRY、Sox5和Sox9结合位点。

注:黑色方框为HMG盒; 单下划线为核定位信号NLS1;双下划线为核定位信号NLS2;虚线为核输出信号NES
Note: Black box, HMG-box; Single underline, nuclear localization signal 1 (NLS1); Double underline, nuclear localization signal 2 (NLS2); Dotted line, nuclear export signal (NES)
图2 许氏平鲉Sox9氨基酸序列与其他脊椎动物Sox9氨基酸序列比对分析
Fig.2 Alignment analysis of Sox9 amino acid sequences between black rockfish Sebastes schlegeli and other vertebrates
2.4 Sox9基因在仔鱼发育时期及成鱼组织的表达
从图5-A可见:许氏平鲉Sox9 mRNA在仔鱼发育阶段(出生后1、5、10、15、25、35日龄)均有不同程度的表达;在出生后5日龄和10日龄时表达量有降低的趋势,15日龄和25日龄时表达量逐渐上升,随后在35日龄时表达量又有所下降。
从图5-B可见:许氏平鲉Sox9基因在成体肝、心、脑、肾、脾、鳃、肌肉、肠、精巢、卵巢等组织中均有不同程度的表达,在脑、鳃和精巢组织中表达量较高,且显著高于其他组织(P<0.05),在肌肉、心、肾和脾中表达量较低;许氏平鲉Sox9基因在成鱼性腺中表现出性别两相性差异,即在精巢中的表达水平要显著高于卵巢(P<0.05)。
2.5 Sox9基因在成鱼性腺中的细胞定位分析
采用组织切片原位杂交技术观察许氏平鲉Sox9基因在成鱼性腺细胞中的定位表达情况。图6-A和图6-D是性腺组织切片的H.E染色,可以看出,此阶段性腺发育各时期细胞比较完全,适用于细胞定位分析。原位杂交结果显示:许氏平鲉Sox9基因在精巢的生殖细胞(精原细胞、精母细胞和精细胞)和Sertoli细胞中均有表达(图6-C),且在生殖细胞中的表达强于Sertoli细胞;在卵巢的卵母细胞中同样检测到了Sox9基因转录本,且在早期发育的卵母细胞中表达信号较强,同时Sox9基因在卵巢滤泡细胞中有微弱表达(图6-F)。
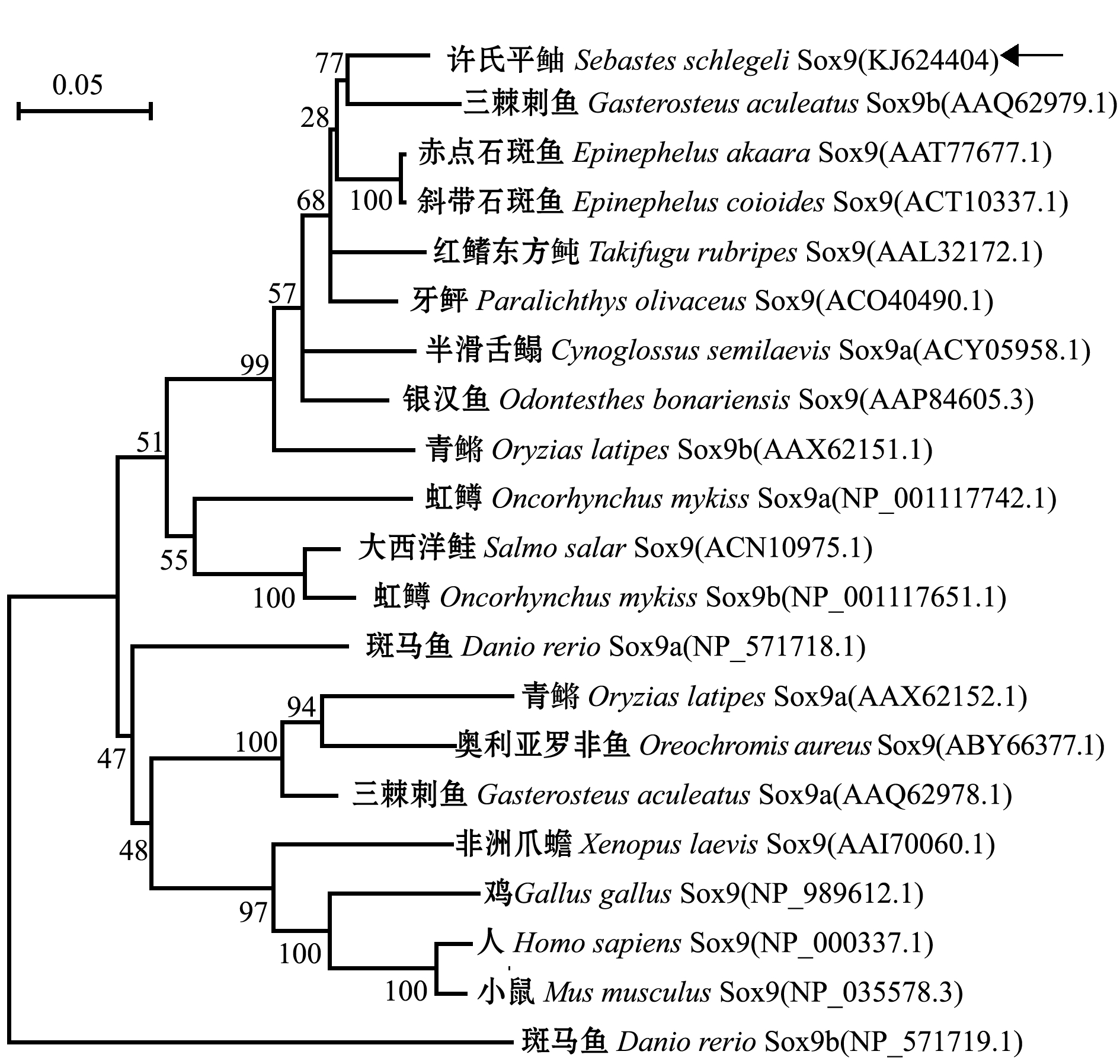
注:分支节点上的数字代表置信度;标尺表示进化距离
Note:Numbers above the nodes indicate bootstrap values and the scale bar indicates genetic distance
图3 许氏平鲉Sox9蛋白的系统进化分析
Fig.3 Phylogenetic analysis of Sox9 protein in black rockfish Sebastes schlegeli
3 讨论
3.1 Sox9基因的保守性
本研究中从许氏平鲉性腺中克隆得到了Sox9基因全长cDNA及基因组DNA序列。Sox9 mRNA全长2039 bp,编码486个氨基酸,在107~178氨基酸位置有一个保守的 HMG 盒。该HMG 盒与NCBI数据库中大多数物种Sox9氨基酸序列是一致的,均含有一个特征性基序AQAARRKL,两个独立的核定位信号NLS1和NLS2,以及一段富含亮氨酸的核输出信号NES。许氏平鲉Sox9基因DNA序列包含3个外显子和2个内含子,这与哺乳类、鸟类、两栖类及其他硬骨鱼类的Sox9基因结构相似。分子系统进化树分析显示,许氏平鲉Sox9与其他硬骨鱼类的Sox9蛋白聚在一起,这说明Sox9蛋白结构在鱼类中比较保守。
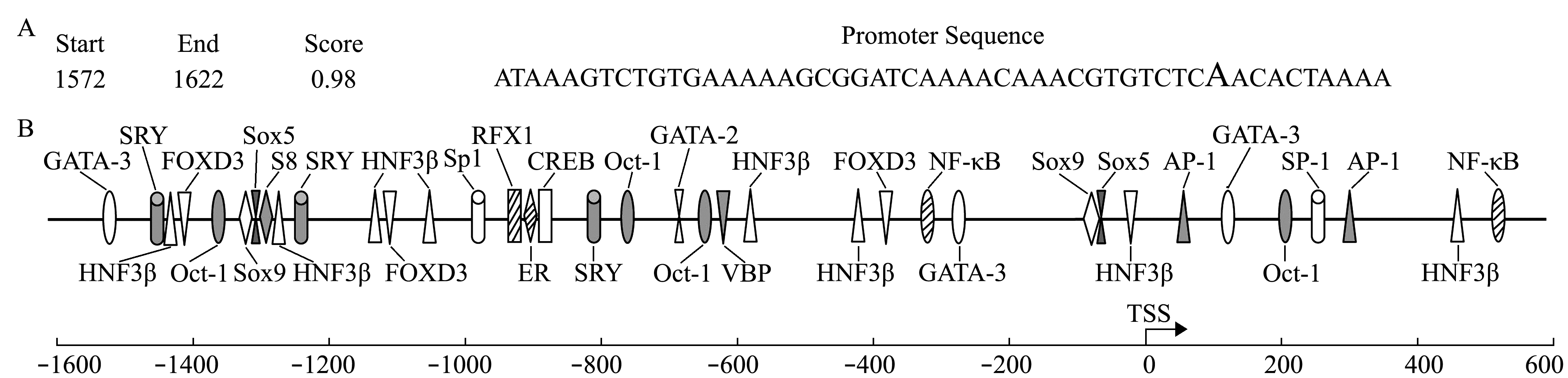
注:TSS为转录起始位点
Note: TSS, transcript start site
图4 许氏平鲉Sox9基因启动子转录起始位点(A)及转录因子结合位点(B)示意图
Fig.4 Schematic diagram of transcription start site (A) and putative regulatory motifs (B) in the promoter of the Sox9 gene in black rockfish Sebastes schlegeli

注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences
图5 许氏平鲉Sox9基因表达模式的定量分析
Fig.5 Quantitative analyses of the expression profiles of the Sox9 gene in black rockfish Sebastes schlegeli

注:A、D为精巢和卵巢的H.E染色;B、E为正义探针对照组,杂交后无信号;C、F为Sox9基因反义探针杂交分析,杂交信号为深蓝色。Sg为精原细胞;Sc为精母细胞;St为精细胞;SC为支持细胞;Oc为卵母细胞;Fc为滤泡细胞;Bs为褐色物质
Note: A and D, H.E. staining in the testis and ovary; B and E,the sense probe and control,not stained; C and F, the antisense probe analysis for Sox9 gene, stained dark blue. Sg, spermatogonium; Sc, spermatocyte; St, spermatid; SC, sertoli cell; Oc, oocyte; Fc, follicle cell; Bs, brown substance
图6 许氏平鲉Sox9 基因在成体性腺中的原位杂交分析
Fig.6 In situ hybridization analysis of Sox9 mRNA expression in adult gonads of black rockfish Sebastes schlegeli
3.2 许氏平鲉Sox9基因的命名
Sox9基因在不同的物种中存在不同数目的亚型,在人类、小鼠和鸡等高等脊椎动物中仅找到了一种,而在硬骨鱼如斑马鱼、青鳉等低等脊椎动物中则找到了两种Sox9基因,命名为Sox9a 或Sox9b[3-5]。Volff[20]指出,在硬骨鱼类中存在两种类型的Sox9基因,也许是由鱼类特有的基因组复制导致的。目前,Sox9基因亚型的命名无公认标准,a或b仅用于区分同一物种内的不同亚型,而无法用于鉴定真正的直系同源基因,因此,系统发生分析的结果往往比较混乱。本研究中对系统进化树分析发现,许氏平鲉Sox9与三棘刺鱼、石斑鱼、牙鲆的Sox9和半滑舌鳎Sox9a在一簇上,同一簇上出现不同的分型,使得进化树看起来比较混乱。这与尼罗罗非鱼[8]、斜带石斑鱼[9]、牙鲆[10]、金钱鱼[11]和圆斑星蝶[12]情况相似,本研究在许氏平鲉中目前只发现了一种Sox9基因,系统进化树分析显示,与三棘刺鱼Sox9b聚为一支,考虑到在许氏平鲉中有可能存在另外一种亚型,而此亚型的出现可能导致进化树构建时聚类发生改变,所以暂时命名为Sox9基因。
3.3 许氏平鲉Sox9基因的启动子分析
对启动子结构和功能的研究是基因调控机制的研究热点之一。目前,鱼类性别决定和分化相关的基因调控机制尚不明确。研究Sox9性别相关基因的启动子将有助于本试验中更好地理解相关转录因子在性腺发育中的作用机制。通过染色体步移法得到许氏平鲉Sox9基因启动子序列,综合多个生物信息学软件最终确定了多个转录因子结合位点。其中,与已发表的许氏平鲉Sox3基因启动子[21]有共同的转录因子结合位点,如AP-1、GATA-3、Oct-1、FOXD3及性别相关蛋白SRY、Sox5、Sox9等结合位点。这些转录因子有可能共同调控着Sox3和Sox9基因的表达,从而影响性腺的发育。在人类中,SRY基因与Sox9、Sox3基因共同作用决定睾丸的形成[22]。 Kanai等[23]发现,哺乳动物SRY性别决定基因能够直接调控Sox9基因的表达。比较有趣的是,本试验中不仅在许氏平鲉Sox3启动子中预测到了Sox9蛋白结合位点[21],而且发现该蛋白结合位点也存在于许氏平鲉Sox9基因自身启动子中。预测结果提示,Sox9基因在性别调控机制中也许作为Sox3基因的上游基因,对Sox3基因表达起调控作用的同时,对自身也有一定的反馈调节作用。
另外,在许氏平鲉Sox9基因启动子区还预测到了Sp1、CREB、NF-kB、ER等结合位点。有研究报道,人类Sox9基因近端启动子受Sp1和CREB结合蛋白的调控[24]。核因子NF-kB广泛存在于各种细胞,在免疫应答、炎症、细胞增殖、分化及凋亡等许多生物学过程中发挥作用。Ushita等[25]发现,NF-kB能够强烈激活Sox9基因启动子。雌激素只有与雌激素受体ER结合才能发挥生物学效应。Cheng等[26]发现,小鼠ERβ能够调控雄激素受体和排卵相关因子的表达。Lassiter等[27]发现,ER在硬骨鱼早期胚胎发育和性腺分化中起重要作用。因此,本试验中推测这些转录因子也许能够直接作用于许氏平鲉Sox9基因的启动子,从而影响性腺的发育。本研究中完成的许氏平鲉Sox9基因的启动子序列的生物信息学分析结果,为今后进一步研究Sox9基因的表达调控机制奠定了基础。
3.4 Sox9基因的表达
组织学观察显示,许氏平鲉在出生后大约25日龄(全长约20 mm)左右性腺开始分化[18]。实时定量PCR检测显示,许氏平鲉Sox9基因在仔鱼发育时期各阶段均有不同程度的表达,在出生后5日龄和10日龄时表达量有降低趋势,15日龄和25日龄(性腺分化关键时期)时表达量逐渐上升。这与圆斑星鲽的表达模式相似,即圆斑星鲽Sox9基因在仔鱼20~50日龄时表达量逐渐下降,在60日龄 (性腺分化时期) 时表达量上升[12]。因此,本试验中推测许氏平鲉Sox9基因在出生后25日龄(性腺分化时期)时的表达量达到较高的水平可能与仔鱼性腺分化有关。
目前,有关Sox9基因在各脊椎动物中的组织差异表达模式已有研究报道。在哺乳动物中发现,Sox9基因与雄性性别的决定和性腺发育相关,有可能是SRY基因最靠近的下游基因[24]。在硬骨鱼中,Sox9不同类型的基因在性腺中的表达模式有所不同,如斑马鱼有Sox9a和Sox9b两个Sox9基因,Sox9a在脑、精巢等多种组织中表达,在卵巢中不表达,而Sox9b仅在卵巢中表达[3]。 Zhou等[2]在黄鳝中克隆得到Sox9a1和Sox9a2两个Sox9a基因,它们在精巢、卵巢和间性性腺(精卵巢)中均有表达。在青鳉中先后发现了Sox9a基因(只在卵巢中表达)和Sox9a2基因(精巢中表达)[4-5]。俞菊华等[7]在黄颡鱼中克隆得到了Sox9a1和Sox9a2两个基因,Sox9a1基因在脑、精巢和卵巢中均有表达,Sox9a2基因只在卵巢中表达,Sox9a2可能参与了雌性性别决定和卵巢发育过程。另外,在尼罗罗非鱼[9]、斜带石斑鱼[8]、牙鲆[10]和金钱鱼[11]中目前仅找到一种Sox9基因,且主要在精巢中显著表达。以上研究结果表明,不同类型Sox9基因在鱼类中并未呈现出统一的性别差异表达模式。但通过已报道的研究可知,斑马鱼Sox9a、青鳉Sox9a2,以及斜带石斑鱼、尼罗罗非鱼、牙鲆和金钱鱼的Sox9基因的表达模式与哺乳类Sox9基因还是一致的,均在精巢中有较高水平的表达,表明Sox9基因可能参与了精巢的分化和发育过程。本研究中在许氏平鲉中克隆得到了一种Sox9基因,该基因在精巢中的表达显著高于卵巢,表现了性别两相性差异,这与对尼罗罗非鱼、斜带石斑鱼、牙鲆、金钱鱼和圆斑星鲽等Sox9基因的研究结果是一致的。另外,在许氏平鲉的脑和鳃组织中检测到了较高水平的Sox9转录本,这种现象在其他硬骨鱼中也有报道,如金钱鱼[11]和圆斑星鲽[12]。有关许氏平鲉Sox9基因是否在脑或鳃发育中起重要作用还有待进一步验证。
目前,Sox9基因在其他硬骨鱼中的细胞定位研究已有相关报道。尼罗罗非鱼Sox9基因在未分化性腺的生殖细胞周围细胞中表达,而性腺分化后仅在精巢的生殖细胞周围细胞中表达[9]。斜带石斑鱼Sox9基因仅存在于精巢的Sertoli中[8]。斑马鱼Sox9a基因在精巢组织的Sertoli细胞中表达,而Sox9b基因则在卵巢的卵母细胞中表达[3]。Yokoi等[4]发现,青鳉Sox9基因仅在卵巢的卵母细胞中表达。随后Nakamoto等[5]在青鳉中得到了精巢型Sox9a2基因,该基因定位于精巢的精原细胞周围体细胞中,而在卵巢中不存在。在许氏平鲉中,本试验中只发现一种Sox9基因,原位杂交结果分析显示,许氏平鲉Sox9基因和其他硬骨鱼类的细胞定位表达模式不同, 许氏平鲉Sox9基因综合了斑马鱼和青鳉两种硬骨鱼Sox9基因的细胞定位表达模式,即许氏平鲉Sox9基因在精巢的生殖细胞和Sertoli细胞,以及在卵巢的卵母细胞和滤泡中均有表达。结合已有研究可以看出,Sox9在不同硬骨鱼类中对性腺发育的贡献有所不同,许氏平鲉Sox9基因可能在两性性腺的发育中发挥重要作用。
[1] Foster J W,Dominguez-Steglich M A,Guioli S,et al.Campomelic dysplasia and autosomal sex reversal caused by mutations in an SRY-related gene[J].Nature,1994,372(6506):525-530.
[2] Zhou Rongjia,Liu Li,Guo Yiqing,et al.Similar gene structure of two Sox9a genes and their expression patterns during gonadal differentiation in a teleost fish,rice field eel (Monopterus albus)[J].Mol Repord Dev,2003,66(3): 211-217.
[3] Rodríguez-Marí A,Yan Yilin,BreMiller R A,et al.Characterization and expression pattern of zebrafish anti-Müllerian hormone(amh) relative to sox9a,sox9b,and cyp19a1a,during gonad development[J].Gene Expr Patterns,2005,5(5):655-667.
[4] Yokoi H,Kobayashi T,Tanaka M,et al.Sox9 in a teleost fish,medaka (Oryzias latipes):evidence for diversified function of Sox9 in gonad differentiation[J].Mol Reprod Dev,2002,63(1):5-16.
[5] Nakamoto M,Suzuki A,Matsuda M,et al.Testicular type Sox9 is not involved in sex determination but might be in the development of testicular structures in the medaka,Oryzias latipes[J].Biochem Biophys Res Commun,2005, 333(3):729-736.
[6] 杜启艳,常重杰,王凤羽,等.鲤鱼中Sox9b基因的克隆和表达[J].实验生物学报,2005,38(5):397-403.
[7] 俞菊华,李建林,曹丽萍,等.黄颡鱼Sox9基因的分离及分析[J].农业生物技术学报,2005,13(5):620-623.
[8] Xia Wei,Zhou Li,Yao Bo,et al.Differential and spermatogenic cell-specific expression of DMRT1 during sex reversal in protogynous hermaphroditic groupers[J].Mol Cell Endocrinol,2007,263(1-2):156-172.
[9] Kobayashi T,Nagahama Y.Molecular aspects of gonadal differentiation in a teleost fish,the Nile tilapia[J].Sex Dev,2009,3(2-3):108-117.
[10] 文爱韵,尤锋,孙鹏,等.牙鲆Sox9基因的克隆与表达研究[J].海洋科学进展,2011,29(1):97-104.
[11] 陈建华,何毛贤,牟幸江,等.金钱鱼Sox9 cDNA克隆及其表达分析[J].动物学杂志,2015,50(1):93-102.
[12] 张乐乐,边力,常青,等.圆斑星鲽Sox9基因的克隆与表达[J].渔业科学进展,2018,39(6):72-80.
[13] 刘丽娟,任利华,姜向阳,等.黑鲪(Sebastes schtegeli)遗传多样性的等位酶研究[J].海洋与湖沼,2009,40(4):479-483.
[14] 徐国成,李建军,李信书,等.许氏平鲉近海网箱养殖技术[J].水产养殖,2018,39(6):23-26.
[15] Hwang H K,Son M H,Myeong J I,et al.Effects of stocking density on the cage culture of Korean rockfish (Sebastes schlegeli)[J].Aquaculture,2014,434:303-306.
[16] 赵吉,冯启超,温海深.卵胎生许氏平鲉胚胎离体培养及发育形态学[J].水产学报,2016,40(8):1195-1202.
[17] 陈辅利,高光智,刘磊.投饵量对许氏平鲉幼鱼生长和水环境中污染指标的影响[J].大连海洋大学学报,2012,27(2):177-181.
[18] Omoto N,Koya Y,Chin B,et al.Gonadal sex differentiation and effect of rearing temperature on sex ratio in black rockfish (Sebastes schlegeli)[J].Ichthyol Res,2010,57(2):133-138.
[19] Ma Liman,Wang Wenji,Liu Conghui,et al.Selection of reference genes for reverse transcription quantitative real-time PCR normalization in black rockfish (Sebastes schlegeli)[J].Mar Genomics,2013,11:67-73.
[20] Volff J N.Genome evolution and biodiversity in teleost fish[J].Heredity,2005,94(3):280-294.
[21] Ma Liman,Wang Wenji,Shang Renjie,et al.Characterization of Sox3 gene in an ovoviviparous teleost,black rockfish (Sebastes schlegeli)[J].J Ocean Univ China,2019,18(2):431-440.
[22] Graves J A M.Evolution of the mammalian Y chromosome and sex-determining genes[J].J Exp Zool,1998,281(5):472-481.
[23] Kanai Y,Koopman P.Structural and functional characterization of the mouse Sox9 promoter:implications for campomelic dysplasia[J].Hum Mol Genet,1999,8(4):691-696.
[24] Piera-Velazquez S,Hawkins D F,Whitecavage M K,et al.Regulation of the human SOX9 promoter by Sp1 and CREB[J].Exp Cell Res,2007,313(6):1069-1079.
[25] Ushita M,Saito T,Ikeda T,et al.Transcriptional induction of SOX9 by NF-κB family member RelA in chondrogenic cells[J].Osteoarthr Cartilage,2009,17(8):1065-1075.
[26] Cheng Guojun,Zhang Weihua,Mäkinen S,et al.A role for the androgen receptor in follicular atresia of estrogen receptor beta knockout mouse ovary[J].Biol Reprod,2002,66(1):77-84.
[27] Lassiter C S,Kelley B,Linney E.Genomic structure and embryonic expression of estrogen receptor beta a (ERβa) in zebrafish (Danio rerio)[J].Gene,2002,299(1-2):141-151.