石斑鱼广泛分布于中国、日本、韩国及其他亚洲国家,因其高品质的鱼肉营养价值和较高的商业价值而被认为是最重要的海洋经济鱼类之一[1]。作为一种广受欢迎的海水鱼类,其产量在中国逐年增加,2018年达13.15万t[2]。石斑鱼属于雌雄同体、雌性先熟的海水鱼类,目前,国内有关石斑鱼类养殖的生物学研究报道主要集中在环境胁迫[3]、营养成分[4]、形态观察[5],以及杂交试验及养殖研究[6-8]等方面。
黑边石斑鱼Epinephelus fasciatusu为石斑鱼属的一种,广泛分布在中国南海[9]、日本本州以南[10]、印度洋,以及太平洋的热带和温带地区。由于其生长快速且对环境的适应能力较强,已成为东亚地区重要的水产资源之一。有研究表明,黑边石斑鱼的产卵峰值发生在满月后[10],但有关其性腺发育及产卵的详细过程尚未见报道。此外,黑边石斑鱼虽在温带和热带区域均有分布,但有关其在所有海域中是否能发育成熟并产卵,尚未有明确的结论。
硬骨鱼类的繁殖不仅受到内分泌系统如脑-垂体-性腺轴(BPG轴)的调控[11-12],还综合受到其他因素如水温、光照和年龄等的影响[13]。研究表明,石斑鱼性腺发育成熟与体长、体质量和年龄有关[14-16]。黑边石斑鱼的生长体长最大为50 cm左右,属于中小型鱼类,一般在2龄左右时性腺初步发育成熟。因此,与其他石斑鱼相比,黑边石斑鱼具有作为周年取样标本的优势。目前,国内外尚未见对其在相关海域进行周年采样的调查报告。本研究中,对日本长崎市东中国海海域进行一周年的连续采样,分析黑边石斑鱼卵巢周年发育的情况及血清中性激素含量变化,以期为石斑鱼的成熟诱导和探寻最佳人工繁殖条件提供理论依据。
1 材料与方法
1.1 材料
自2016年8月—2017年9月,采用渔船捕捞作业和垂钓法相结合的方式,在日本长崎市东中国海海域每月随机采样,并分别记录每月采样的数量,共计获得样本数量140尾,其中,2016年10月由于采样后其体弱死亡导致数量不足而无法进行样本分析。将所捕获的雌性黑边石斑鱼作为试验鱼。采样期间同时记录海水温度的变化。
1.2 方法
1.2.1 血液和卵巢样品的采集 所捕获的成鱼用2-苯氧乙醇麻醉后,测量其全长和体质量。从尾柄部采血,血液在4 ℃ 下以8000 g离心20 min后取上层血清保存在超低温冰箱(-80 ℃)中。取下卵巢,测定其质量,计算其性腺指数(GSI,%),计算公式为
GSI=WG/WB×100%。
其中:WG为卵巢质量(g);WB为体质量(g)。此后,将卵巢固定在波恩试剂中,24~48 h后转移至70%的酒精中保存,用于组织学分析。
1.2.2 生殖腺的组织学观察 将石斑鱼性腺用常规梯度酒精脱水,二甲苯透明,石蜡(熔点54 ℃)包埋,连续切片,厚度为5 μm。采用苏木精-伊红(H.E)染色,中性树胶封片,在光学显微镜(Olympus FX380型)下观察及显微摄影,以各个体中卵母细胞最发达的阶段作为生殖腺的发育阶段,依据国内外学者[17-20]的标准对性腺发育进行分期,共分为6个时期。
(1) 第Ⅰ时相:核仁外周期(Peri-nucleolus stage, Pn),细胞体积小;细胞质少,显强嗜碱性;核仁1~2个,分布在核的中央或边缘。细胞质被苏木精染色深,核呈现巨大化,核中出现很多小的核仁。
(2) 第Ⅱ时相:卵黄囊泡期(Yolk vesicle stage,Yv),小生长期。卵径大小悬殊;核仁数个,分布在核的边缘;单层滤泡膜。卵母细胞生长,细胞质中出现卵黄胞和油球。
(3) 第Ⅲ时相:次级卵黄球期(Secondary yolk stage, Sy),大生长期。核周细胞质出现油滴,环形带状分布,并向胞质边缘扩散;双层滤泡膜。卵母细胞快速生长,卵黄球迅速累积,占细胞质的大半。
(4) 第Ⅳ时相:三级卵黄球期(Tertiary yolk stage, Ty),大生长晚期。卵黄颗粒形成,油滴增多,后来充满细胞质。细胞质中已经积累了大量卵黄,但是核移动还未开始。
(5) 第Ⅴ时相:成熟期(Ripe, Ri),细胞核移至动物极,核膜溶解,核仁消失;卵黄颗粒逐渐融合;油滴融合形成油球。核移动到动物极一侧。
(6) 第Ⅵ时相:退化期(Degeneration, De),卵膜模糊而断裂;卵黄被吞噬,细胞质和卵黄胶液化并形成许多空泡。细胞核破裂,通过吸水达到透明化的状态。
1.2.3 血清中雌二醇浓度检测 雌二醇(Estradiol, E2)浓度检测参照左永松等[21]的方法。详细步骤为:将-80 ℃冷冻的血清样品经过4 ℃解冻后再次离心取得上层血清,然后将血清经甲醇-乙醚低温冷冻蒸发系统进行类固醇的提纯,经过3次冷冻蒸发后的血清样品可用于检测。采用EIA(Enzyme immunoassy)酶联免疫试剂盒(Cayman Chemical公司)测定E2浓度。
1.2.4 血清中性成熟激素DHP和20β-S浓度检测 按照“1.2.3”节中的提纯步骤,获得黑边石斑鱼提纯的血清样本。采用酶联免疫吸附法ELISA(Enzyme-linked Immunosorbent Assay)测定血清中17α、20β双羟孕酮(20β-dihydroxy-4-pregnen-3-one, DHP)和17α、20β、21-三羟孕酮(21-trihydroxy-4-pregnen-3-one,20β-S)的浓度。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。采用SPSS 18.0软件对试验数据进行比较分析,采用Kolmogorov-Smirnov 法或 Shapiro-Wilk 法进行正态分布检测,利用ANOVA检验及 Tukey’s HSD 法进行差异性比较分析,显著性水平设为0.05。
2 结果与分析
2.1 采样海域水温的变化
从图1可见,水温于2016年8月达到最高(29 ℃),2017年2月逐渐下降至13 ℃,之后再次上升,2017年8月为27 ℃,9月达到28 ℃。
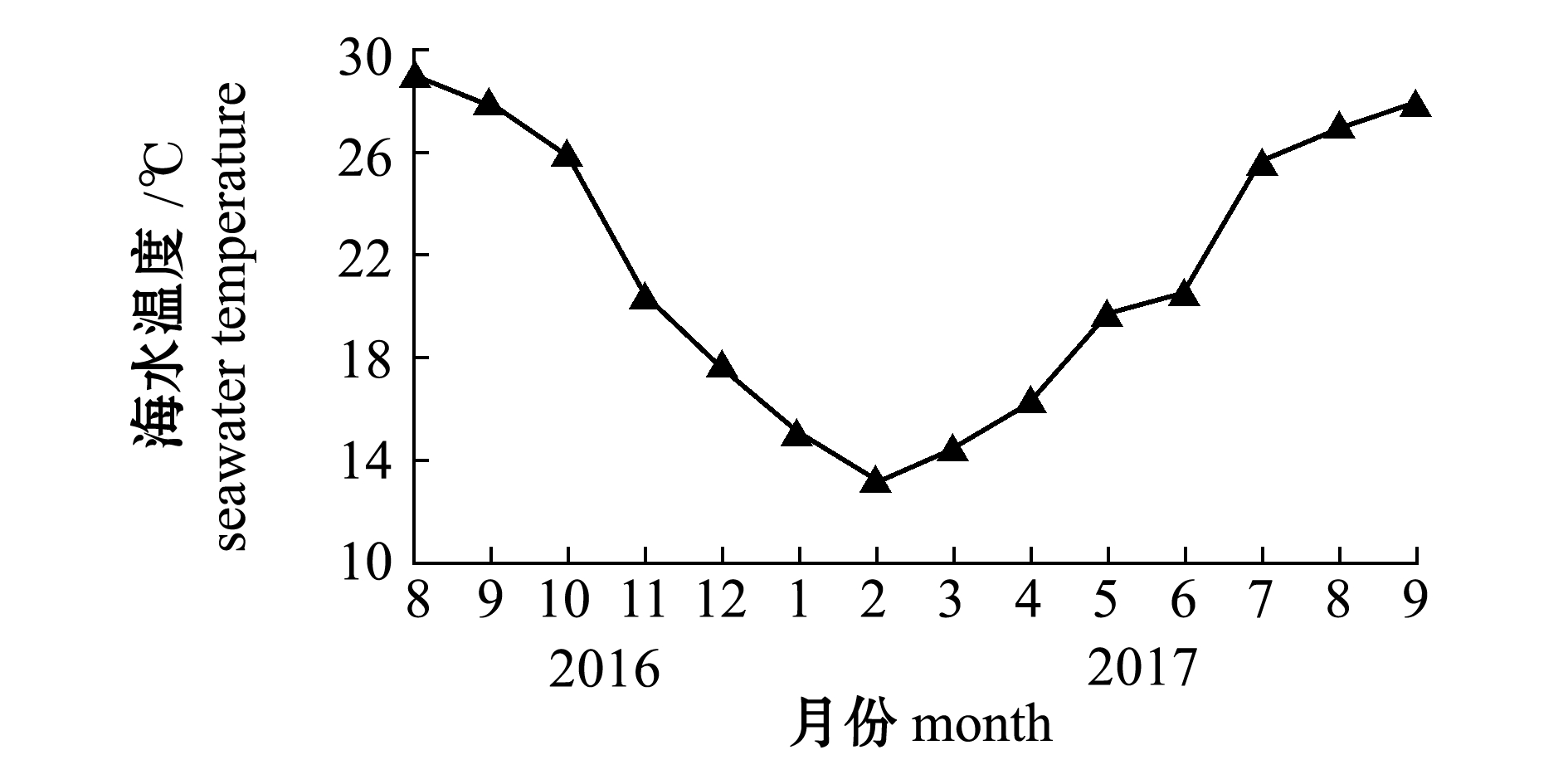
图1 长崎市东中国海采样期间平均海水温度的变化
Fig.1 Changes in the average seawater temperature in East China sea coastal Nagasaki city during the sampling periods
2.2 黑边石斑鱼体长、体质量、性腺质量和性腺指数的变化
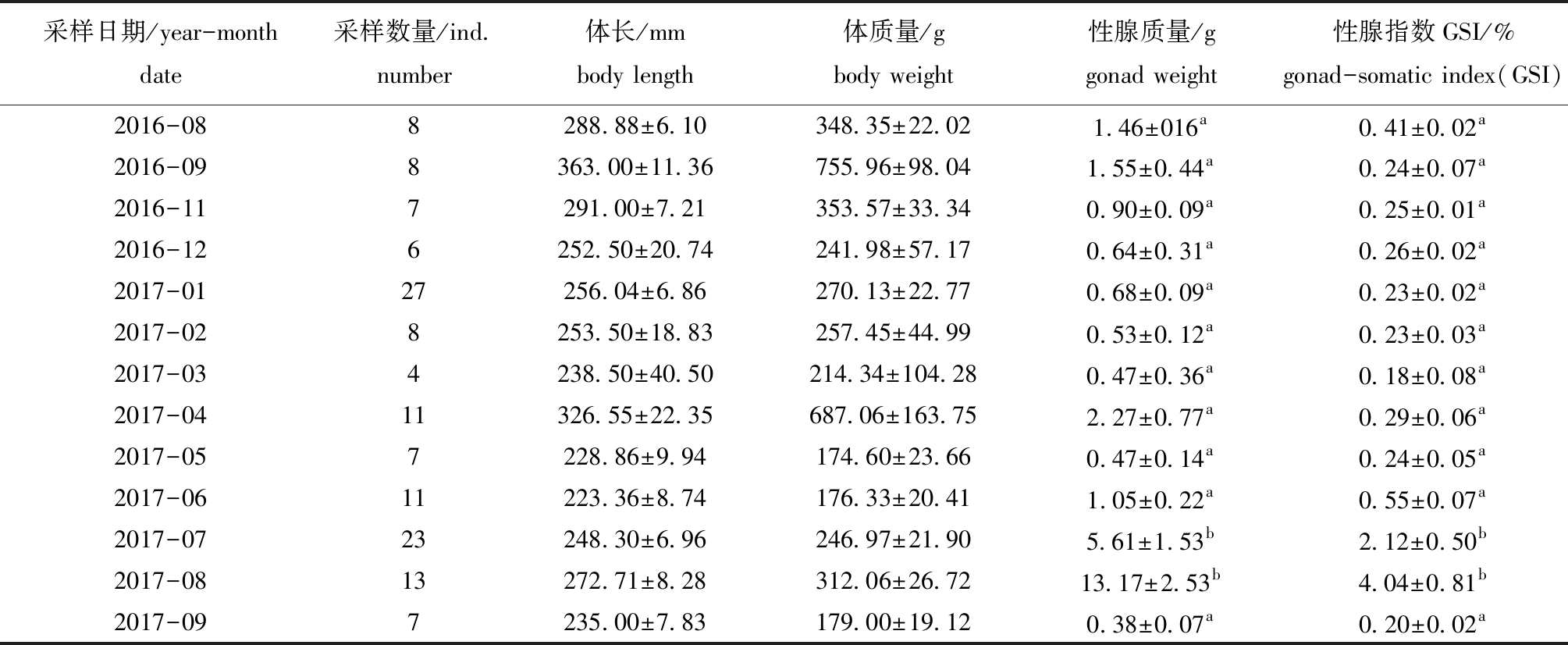
从表1可见:2016年8月采集的样本体长为(288.88±6.10)mm,体质量为(348.35±22.02)g,经过1年生长,至2017年9月,采集的样本体长为(235.00±7.83)mm, 体质量为(179.00±19.12)g;2016年8月—2017年6月,采集的样本个体的平均GSI变化范围为0.18%~0.55%,但从2017年7月开始,GSI上升至2.12%,8月时GSI达到最大,为4.04%,2017年9月GSI开始减少,仅为0.20%,且2017年7—8月黑边石斑鱼的性腺质量和性腺指数均显著高于其他时间段(P<0.05)。
表1 2016年8月—2017年9月黑边石斑鱼采样时间、数量及其生长指数的变化(n=140)
Tab.1 Sampling time, number, and changes in growth index of blacktip grouper from August 2016 to September 2017(n=140)
采样日期/year-month date采样数量/ind.number体长/mmbody length体质量/gbody weight性腺质量/ggonad weight性腺指数GSI/%gonad-somatic index(GSI)2016-088288.88±6.10348.35±22.021.46±016a0.41±0.02a2016-098363.00±11.36755.96±98.041.55±0.44a0.24±0.07a2016-117291.00±7.21353.57±33.340.90±0.09a0.25±0.01a2016-126252.50±20.74241.98±57.170.64±0.31a0.26±0.02a2017-0127256.04±6.86270.13±22.770.68±0.09a0.23±0.02a2017-028253.50±18.83257.45±44.990.53±0.12a0.23±0.03a2017-034238.50±40.50214.34±104.280.47±0.36a0.18±0.08a2017-0411326.55±22.35687.06±163.752.27±0.77a0.29±0.06a2017-057228.86±9.94174.60±23.660.47±0.14a0.24±0.05a2017-0611223.36±8.74176.33±20.411.05±0.22a0.55±0.07a2017-0723248.30±6.96246.97±21.905.61±1.53b2.12±0.50b2017-0813272.71±8.28312.06±26.7213.17±2.53b4.04±0.81b2017-097235.00±7.83179.00±19.120.38±0.07a0.20±0.02a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia
2.3 卵巢中卵母细胞的发育阶段
黑边石斑鱼卵巢中卵母细胞的发育阶段及其频率变化如图2和图3所示。从图3可见:在2016年8—9月,卵巢中卵母细胞大部分为核仁外周期的卵母细胞,为发育的Pn阶段(图2-Pn),少部分为三级卵黄球期,为发育的Ty阶段(图2-Ty);2016年11月—2017年3月也均为Pn阶段;从2017年4月开始,卵巢中出现了卵黄囊泡期的卵母细胞,为发育的Yv阶段(图2-Yv)。从2017年6月开始,次级卵黄球期的卵母细胞也被检测到,为发育的Sy阶段(图2-Sy);在2017年7—8月,三级卵黄球期(图2-Ty)、成熟期(图2-Ri)和退化期(图2-De)的卵母细胞占了大半甚至全部,此阶段为石斑鱼繁殖产卵期;到2017年9月,卵母细胞再次发育为Pn阶段(图2-Pn)。

注:Pn为核仁外周期; Yv为卵黄囊泡期; Sy为次级卵黄球期; Ty为三级卵黄球期; Ri为成熟期; De为退化期;比例尺=300 μm
Note:Pn, perinucleolus phase; Yv, yolk vesicle; Sy, secondary yolk; Ty, tertiary yolk; Ri, ripe; De, degeneration; scale bar=300 μm
图2 雌性黑边石斑鱼性腺在不同发育阶段的切片图
Fig.2 Histological sections of the female blacktip grouper at different gonadal developmental stages
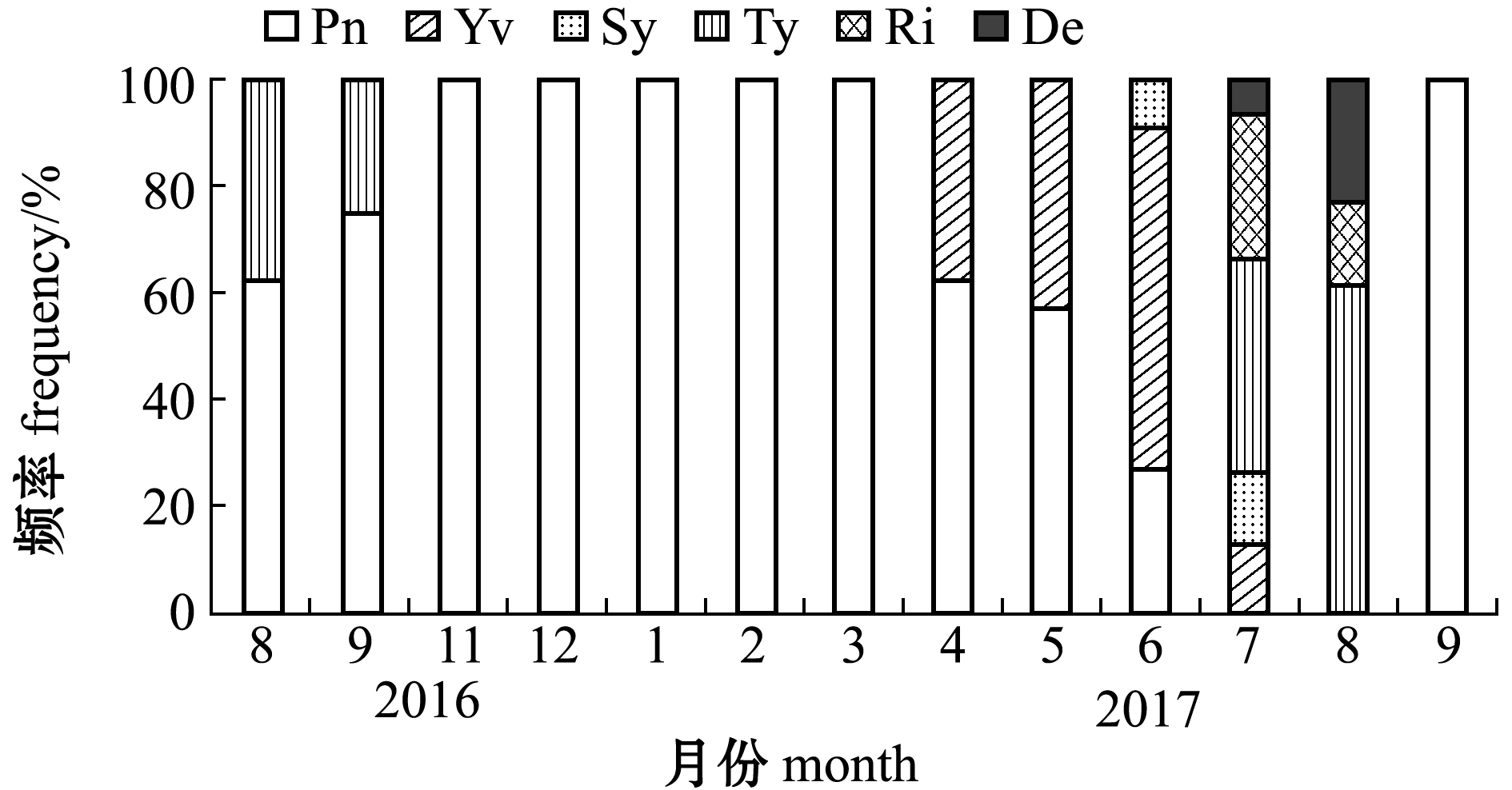
图3 雌性黑边石斑鱼性腺在不同发育阶段的频率变化
Fig.3 Changes in the frequency of different gonadal developmental stages in the female blacktip grouper
2.4 血清中性激素浓度的变化
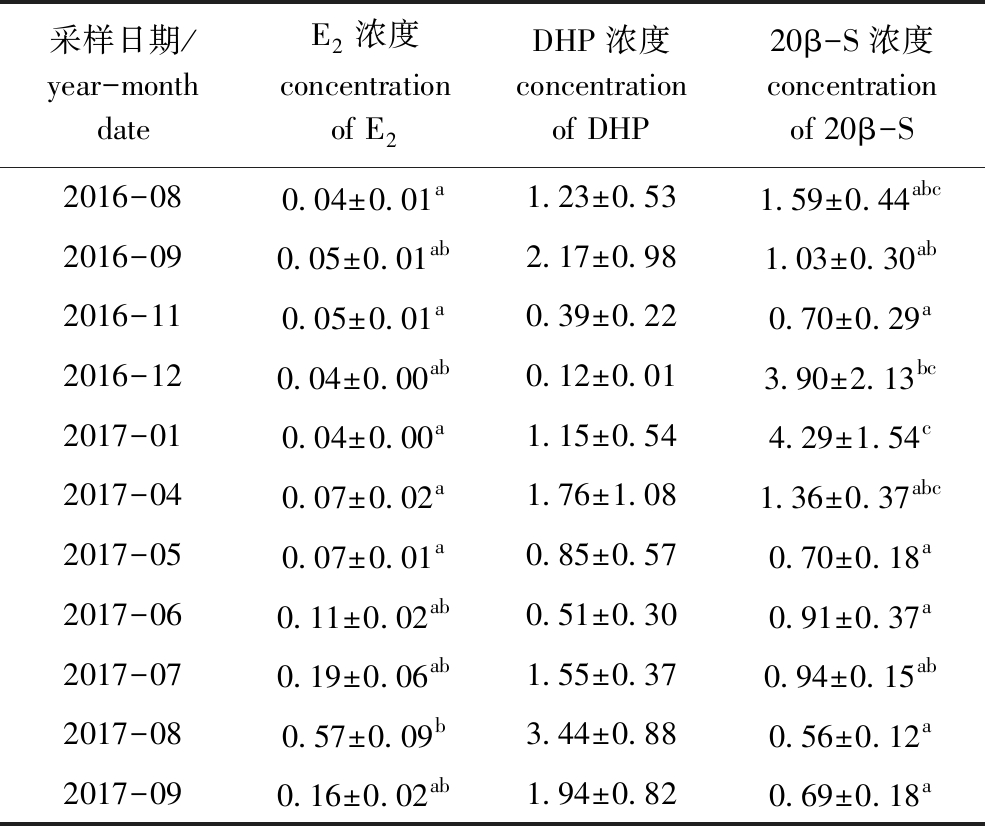
从表2可见:2017年8月其血清中E2的浓度显著高于2016年8月和11月,以及2017年1、4、5月(P<0.05),E2浓度在2017年6—7月有增加的趋势,但较2017年8月无显著性变化(P>0.05);黑边石斑鱼血清中DHP浓度虽然在试验期间无显著性差异(P>0.05),但在2017年8月有明显增加的趋势;黑边石斑鱼血清中20β-S浓度在2017年1月显著高于2016年9月和11月及2017年5—9月(P<0.05)。
表2 2016年8月—2017年9月黑边石斑鱼血清中性激素浓度的变化
Tab.2 Changes in the concentration of serum sex hormones in the blacktip grouper from August 2016 to September 2017 ng/mL
采样日期/year-monthdateE2浓度concentration of E2DHP浓度concentration of DHP20β-S浓度concentration of 20β-S2016-080.04±0.01a1.23±0.531.59±0.44abc2016-090.05±0.01ab2.17±0.981.03±0.30ab2016-110.05±0.01a0.39±0.220.70±0.29a2016-120.04±0.00ab0.12±0.013.90±2.13bc2017-010.04±0.00a1.15±0.544.29±1.54c2017-040.07±0.02a1.76±1.081.36±0.37abc2017-050.07±0.01a0.85±0.570.70±0.18a2017-060.11±0.02ab0.51±0.300.91±0.37a2017-070.19±0.06ab1.55±0.370.94±0.15ab2017-080.57±0.09b3.44±0.880.56±0.12a2017-090.16±0.02ab1.94±0.820.69±0.18a
3 讨论
3.1 水温对黑边石斑鱼卵巢发育和产卵的影响
本研究中,黑边石斑鱼卵母细胞发育成熟过程中卵黄囊泡出现在4月,卵黄形成期出现在6月,产卵期为7—8月,部分个体推测至9月产卵。有研究显示,七带石斑鱼E.septemfasciatus卵黄囊泡及卵黄球形成期在3月开始出现,5月迎来产卵期[22]。此外,在之前作者对褐石斑鱼E.bruneus的研究中表明,卵母细胞的卵黄球期出现在2月,卵黄球形成期出现在4月,在5—6月确认产卵[23]。而蜂巢石斑鱼E.merra的产卵期为5—7月[21,24]。这些研究结果表明,在不同种类的石斑鱼中,导致其性腺发育成熟的开始时期和产卵期的差异主要与其生活海域的水温相关。以卵黄开始形成期的水温为例,七带石斑鱼、褐石斑鱼、黑边石斑鱼、蜂巢石斑鱼温度分别为15、16、20、22 ℃。此外,各石斑鱼在产卵时期的水温也有所不同:七带石斑鱼为20~23 ℃,褐石斑鱼为19~22 ℃,黑边石斑鱼为25~27 ℃,蜂巢石斑鱼为25~28 ℃。这些数据表明,黑边石斑鱼和蜂巢石斑鱼成熟和产卵所需要的水温比其他石斑鱼高。
较高水温虽然能促进卵巢发育成熟,但过高水温则可能对某些石斑鱼的产卵产生抑制作用。在对赤点石斑鱼E.akaara[25]和豹纹鳃棘鲈Plectropomus leopardus[26]的研究表明,若产卵时水温为28 ℃左右会抑制成熟。本研究中,在2017年7—8月水温为25~27 ℃,所捕获的黑边石斑鱼卵巢处于成熟状态;而在2016年8—9月和2017年9月所捕获的黑边石斑鱼卵巢处于未成熟或产卵后的状态,此时的水温为28~29 ℃,该结果证实28 ℃以上的水温可能会抑制其卵巢发育成熟。
3.2 月周期变化对卵巢发育和产卵的影响
在对多数石斑鱼如蜂巢石斑鱼[27]、褐点石斑鱼E.fuscoguttatus[28]和霜点石斑鱼E.rivulatus[29]的研究显示,月周期变化对其发育成熟和产卵均有重要影响,主要表现为潮汐满月时大部分石斑鱼会产生洄游产卵现象。Kawabe等[30]研究表明,黑边石斑鱼潮汐满月后其产卵达到峰值。但本研究中黑边石斑鱼1个月中却能连续多次产卵,表明其具有不固定的月周期产卵模式。此外,在日本高知县水产试验场对黑边石斑鱼的调查表明,其产卵时期在新月前后[31]。这些不同的研究结果表明,黑边石斑鱼的产卵周期并不具有统一性,可能会根据栖息地选择不同的产卵模式。
3.3 黑边石斑鱼血清中性激素含量的周年变化
黑边石斑鱼血清中E2浓度从2017年6月开始呈现增加的趋势,7月进一步增加,8月达到峰值;其E2浓度的周年变化与性腺指数GSI的周年变化趋势一致,这表明E2能够诱导合成卵黄蛋白的前驱物质——卵黄磷蛋白(VTG),并被卵母细胞所吸收,从而促进卵巢发育成熟。此外,其结果也与组织学的频率变化一致,表明黑边石斑鱼的产卵期为2017年7—8月。在对斜带石斑鱼E.coioides的研究表明,E2和睾酮(Testosterone, T)浓度在繁殖季节6月显著增加,且GSI迅速提高,表明E2能够诱导肝细胞中卵黄磷蛋白的合成,促进卵巢发育成熟[32],此结论与本试验中对黑边石斑鱼的研究结果一致。
本研究中,黑边石斑鱼血清中DHP浓度在2016年8—9月及2017年1、4、7、8月虽然有增加的趋势,但无显著性差异。而血清中20β-S浓度在2016年1月呈现峰值,之后逐渐降低。DHP和20β-S是促进鱼类卵母细胞发育成熟的诱导激素(MIH)。在大马哈鱼Oncorhynchus rhodurus中,DHP作为成熟诱导激素而存在[33]。本研究中,DHP浓度在黑边石斑鱼产卵期间有增加的趋势,而20β-S浓度从非产卵期到产卵期却呈现减少的趋势,这表明在黑边石斑鱼性腺发育成熟的过程中,DHP较20β-S更具有诱导成熟的功能。此外,DHP浓度在2017年1月和4月的非产卵期也呈现高值。在远东哲罗鱼Hucho perryi中,DHP对卵原细胞的初期增殖有重要影响[34]。本研究结果也表明,在非产卵期间,DHP的高浓度可能对黑边石斑鱼初期卵母细胞的增殖有重要作用。
[1] Liao I C,Lea o E M.The Aquaculture of Groupers[M].Taiwan,China:Asian Fisheries Society,2008:1-242.
o E M.The Aquaculture of Groupers[M].Taiwan,China:Asian Fisheries Society,2008:1-242.
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2018中国渔业统计年鉴[M].北京:中国农业出版社,2018:21-23.
[3] 聂家全,董晓慧,谭北平,等.锰源和锰水平对斜带石斑鱼幼鱼生长、抗氧化功能和矿物元素沉积的影响[J].大连海洋大学学报,2015,30(2):196-202.
[4] 程波,陈超,王印庚,等.七带石斑鱼肌肉营养成分分析与品质评价[J].渔业科学进展,2009,30(5):51-57.
[5] 刘付永忠,王云新,黄国光,等.自然产卵的赤点石斑鱼胚胎及仔鱼形态发育研究[J].中山大学学报:自然科学版,2001,40(1):81-84.
[6] 王燕,张勇,张海发,等.两种杂交石斑鱼及其亲本的形态差异分析[J].水产学报,2014,38(6):778-785.
[7] 于欢欢,李炎璐,陈超,等.棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交F1仔、稚、幼鱼的摄食与生长特性分析[J].中国水产科学,2015,22(5):968-977.
[8] 吴水清,李加儿,区又君,等.斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代仔、稚鱼的异速生长[J].中国水产科学,2014,21(3):503-510.
[9] 陈国宝,李永振.南海主要珊瑚礁鮨科鱼类的组成与分布[J].南方水产科学,2005,1(3):18-25.
[10] Kawabe K,Kato K,Kimura J,et al.Growth of reared blacktip grouper Epinephelus fasciatus in Chichijima,Ogasawara Islands,southern Japan[J].Aquaculture Science,1997,45(2):207-212.
[11] Weltzien F A,Andersson E,Andersen Ø,et al.The brain-pituitary-gonad axis in male teleosts,with special emphasis on flatfish (Pleuronectiformes)[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2004,137(3):447-477.
[12] 林浩然.鱼类生理学[M].广州:中山大学出版社,2011:240-248.
[13] Reinecke M.Influences of the environment on the endocrine and paracrine fish growth hormone-insulin-like growth factor-I system[J].Journal of Fish Biology,2010,76(6):1233-1254.
[14] Ryu Y W,Hur S W,Hur S P,et al.Characterization of pubertal development phases in female longtooth grouper,Epinephelus bruneus via classification of body weight[J].Development & Reproduction,2013,17(1): 55-62.
[15] Crabtree R E,Bullock L H.Age,growth,and reproduction of black grouper,Mycteroperca bonaci,in Florida waters[J].Fishery Bulletin,2016,96(4):735-753.
[16] Burgos J M,Sedberry G R,Wyanski D M,et al.Life history of red grouper (Epinephelus morio) off the coasts of North Carolina and South Carolina[J].Bulletin of Marine Science,2007,80(1):45-65.
[17] Grier H J,Uribe-Aranzábal M C,Pati o R.The ovary,folliculogenesis,and oogenesis in teleosts[M]//Jamieson B.Reproductive Biology and Phylogeny of Fishes (Agnathans and Bony Fishes).New Hampshire:Science Publishers,2009:25-84.
o R.The ovary,folliculogenesis,and oogenesis in teleosts[M]//Jamieson B.Reproductive Biology and Phylogeny of Fishes (Agnathans and Bony Fishes).New Hampshire:Science Publishers,2009:25-84.
[18] Yamamoto K,Yamazaki F.Rhythm of development in the oocyte of the gold-fish,Carassius auratus[J].Bulletin of the Faculty of Fisheries Hokkaido University,1961,12(2):93-110.
[19] 崔丹,刘志伟,刘南希,等.金钱鱼性腺发育及其组织结构观察[J].水产学报,2013,37(5):696-704.
[20] 王盈颖.赤点石斑鱼和青石斑鱼性分化过程中性腺发育的研究[D].厦门:厦门大学,2015.
[21] 左永松,仲地政人,中村将,等.HCG与LHRHa对雌性蜂巢石斑鱼产卵期间生理变化的影响及比较[J].上海海洋大学学报,2013,22(6):841-848.
[22] Shein N L,Chuda H,Arakawa T,et al.Ovarian development and final oocyte maturation in cultured sevenband grouper Epinephelus septemfasciatus[J].Fisheries Science,2004,70(3):360-365.
[23] Chuda H,Tsuchihashi Y,Tsuji M.Chapter 6:technique and issues of seed production and aquaculture in the longtooth grouper and sevenband grouper[M]//Soyano K,Teruya K,Chuda H.Frontiers of Fisheries Science in Groupers.Tokyo:Kouseisha Kouseikaku, 2015:81-95.(in Japanese).
[24] Bhandari R K,Alam M A,Higa M.Evidence that estrogen regulates the sex change of honeycomb grouper (Epinephelus merra),a protogynous hermaphrodite fish[J].Journal of Experimental Zoology,2005,303(6): 497-503.
[25] Okumura S,Okamoto K,Oomori R,et al.Spawning behavior and artificial fertilization in captive reared red spotted grouper,Epinephelus akaara[J].Aquaculture,2002,206(3-4):165-173.
[26] Samoilys M A.Periodicity of spawning aggregations of coral trout Plectropomus leopardus (Pisces:Serranidae) on the northern great barrier reef[J].Marine Ecology Progress Series,1997,160:149-159.
[27] Lee Y D,Park S H,Takemura A,et al.Histological observations of seasonal reproductive and lunar-related spawning cycles in the female honeycomb grouper Epinephelus merra in Okinawan waters[J].Fisheries Science,2002,68(4):872-877.
[28] Pet J S,Mous P J,Muljadi A H,et al.Aggregations of Plectropomus areolatus and Epinephelus fuscoguttatus (groupers,Serranidae) in the Komodo National Park,Indonesia:monitoring and implications for management[J].Environmental Biology of Fishes,2005,74(2):209-218.
[29] Mackie M.Reproductive behavior of the halfmoon grouper,Epinephelus rivulatus,at Ningaloo Reef,Western Australia[J].Ichthyological Research,2007,54(3):213-220.
[30] Kawabe K,Kato K,Kimura J.Year round spawning of reared blacktip grouper,Epinephelus fasciatus,in Chichijima,Ogasawara Islands,southern Japan[J].Aquaculture Science,2000,48(3):467-473.
[31] Okamura Y.The technology development for seedling production of Epinephelus fasciatus[J].Kochi Prefectural Fisheries Experimental Station,1992:1-8.
[32] 赵会宏,刘晓春,刘付永忠,等.斜带石斑鱼雌鱼卵巢发育与血清性类固醇激素的生殖周期变化[J].中山大学学报:自然科学版,2003,42(6):56-59,63.
[33] Nagahama Y,Adachi S.Identification of maturation-inducing steroid in a teleost,the amago salmon (Oncorhynchus rhodurus)[J].Developmental Biology,1985,109(2):428-435.
[34] Miura C,Higashino T,Miura T.A progestin and an estrogen regulate early stages of oogenesis in fish[J].Biology of Reproduction,2007,77(5):822-828.