大型溞Daphnia magna Straus作为水域生态系统的重要物种,具有广温性和广盐性,其分布广泛,习居于淡水池塘、水渠、湖泊、咸水湖及海岸等低盐度积水中[1]。由于大型溞具有发育期短、生殖量大、方便易得、可大规模培养及对水中污染物非常敏感等优点[2],其生态毒理学价值得到了众多环境保护机构和标准制定组织(如EPA、OECD、ISO、BS、NF、DEV等)的重视[3],现已成为一种公认的生态毒理学受试生物,在水环境监测和水生生物毒理试验中被广泛应用。目前,国内外学者以大型溞作为受试生物,分别在抗生素药物[4]、农药[5]、紫外线辐射[6]、石油及化工污染物[7-8]、持久性有机污染物[9]、重金属污染等方面进行了毒理学研究,其中重金属对大型溞生态毒理学研究尤为广泛。
重金属作为常见的水环境污染物,具有水环境中较难降解、易对水生生物产生富集毒性、严重破坏水域生态系统等特点[10],因此,研究重金属对大型溞的生态毒理学效应具有重要意义。本研究中概述了水环境中重金属的积累途径,以及重金属对大型溞的单一毒性和联合毒性的研究进展,旨在应用大型溞生态毒理学为重金属污染监测和生态风险防控提供参考。
1 水环境重金属积累途径
重金属一般是指密度大于5 g/cm3或相对原子质量大于40且具有相似外层电子分布特征的一类金属元素,其可通过地质风化作用、大气循环、工业过程、农业污染、生活污染和地表径流等方式进入水环境,在水环境中具有分布广泛、毒性强、迁移转化强和易于生物积累等污染特征[11],表1为一些重金属在水环境中的积累途径[12]。
表1 水环境中重金属的积累途径
Tab.1 Accumulation pathways of heavy metals in water environment
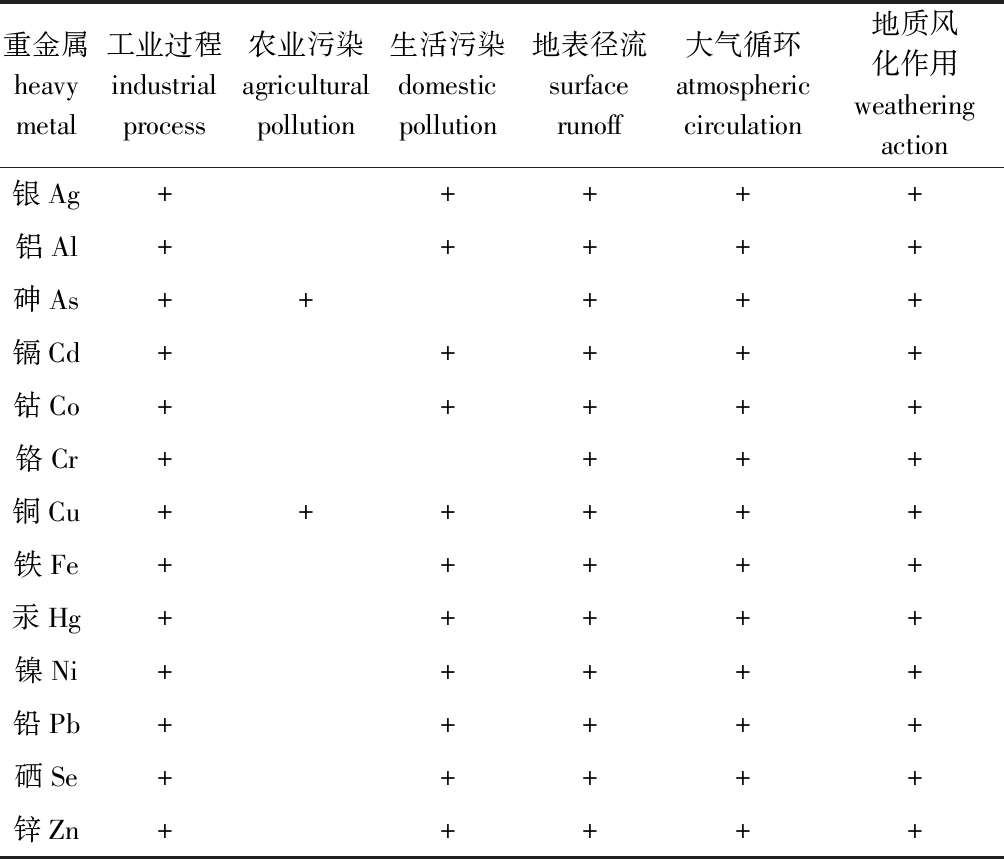
重金属heavy metal工业过程industrial process 农业污染agricultural pollution生活污染domestic pollution地表径流surface runoff大气循环atmospheric circulation地质风化作用weathering action银Ag+++++铝Al+++++砷As+++++镉Cd+++++钴Co+++++铬Cr++++铜Cu++++++铁Fe+++++汞Hg+++++镍Ni+++++铅Pb+++++硒Se+++++锌Zn+++++
注:工业过程包括开采、冶炼、电镀和石油精炼等;农业污染包括农药和化肥使用等;生活污染包括水排放和金属制品丢弃等;地表径流包括地表水携带;大气循环包括化石燃料燃烧和垃圾焚烧等;地质风化作用包括自然风化和金属矿化等
Note:Industrial process includes mining, smelting, electroplating and oil refining; agricultural pollution includes pesticide and chemical fertilizer application; domestic pollution includes water discharge and metal products disposal; surface runoff includes surface water carrying; atmospheric circulation includes fossil fuel combustion and waste incineration; geological weathering includes natural weathering and metal mineralization
2 大型溞在重金属毒性研究中的评价方法
急性和慢性毒性试验可应用于制定水环境标准和重金属污染评估。急性毒性试验是指在短时间内,大型溞接触高浓度重金属时,引起大型溞群体产生一定比例的有害影响试验,多以大型溞的存活率作为指标,以半数有效浓度(EC50)、半数致死浓度(LC50)作为毒性参数;慢性毒性试验是指重金属对大型溞的低浓度、长时间的试验,毒性作用迟缓,短时间内不会使其致死,表现为大型溞生长发育减慢、生殖量减少、个体死亡率增加和种群数量下降[11,13]。
单一毒性试验可了解重金属对大型溞毒性变化的特点,并为判断不同化学形态重金属的毒性强弱、不同溞体对重金属的耐受性、溞体的重金属积累途径、水环境中重金属污染程度和制定水质标准等提供基础数据。单一毒性试验是指在急性和慢性毒性试验的基础上,多种重金属对大型溞独立作用,可分为单一急性毒性试验和单一慢性毒性试验。
联合毒性试验可进一步掌握重金属联合作用方式,并为揭示水环境中重金属联合作用的毒性机理、丰富生态毒理学研究内容及进行重金属复合污染评估提供科学参考[14]。联合毒性试验是指在单一毒性试验基础上,研究两种或两种以上重金属同时或相继对大型溞发生作用时产生的毒性[11],可分为联合急性毒性试验和联合慢性毒性试验。
3 大型溞在重金属毒性研究中的应用
3.1 重金属单一毒性试验
3.1.1 急性毒性试验 单一急性毒性试验时间短、操作简便,因此,在重金属单一毒性研究中被广泛应用。早期的一些研究主要集中于重金属对大型溞的急性毒性参数的测定[15-17]。其他一些研究逐渐开始关注重金属对大型溞生长和发育的影响,早期发育阶段的大型溞对Zn、Cu、Cd和Pb 4种重金属的耐受性比成体阶段更强[18],并且Anderson[19]通过测定10种重金属对大型溞的64 h EC50发现,大型溞在蜕皮时更易受到重金属影响,因此,毒性试验需要保证足够长的暴露时间才能得出正确的结果,这些均为后续的研究奠定了基础。重金属种类较多,目前,毒性研究多集中于Zn、Cu、Cd和Pb 4种重金属,其中,对Cd的研究尤为深入。王茜等[20]证实了在溞体内累积的Cd可对溞体产生氧化损伤、减弱摄食能力,导致大型溞神经系统传导异常。虽然Cd对大型溞神经系统有一定的影响,但大型溞对Cd的抗性并不会随子代遗传,Bodar等[21]的研究证实了这一点,大型溞F1中获得了对Cd的抗性,但将F1幼溞置于无Cd的测试液中,则获得的对Cd的抗性在21 d内丢失。此外,Cd在试验水与原水间的毒性参数差异显著,理论上大型溞试验水中48 h LC50的浓度要明显大于原水,即在原水中,较小浓度Cd就能使大型溞达到半数致死,理论值与实际值存在延迟效应[22]。其原因可能是实验室环境与实际环境营养水平不同,不同营养水平大型溞后代对Cd的敏感性不同,同一龄期最小体型的幼溞对Cd的敏感性是最大体型幼溞的3倍[23]。
大型溞对不同环境介质中不同形态重金属的生物可利用性研究已引起学者们关注。研究表明,水体上覆水中溶解态Cd和沉积物中可交换态Cd是影响大型溞Cd毒性主要形态[24];而对其他环境介质的相关研究中,使用nTiO2(二氧化钛纳米粒子)分别与Ag、As和Cu混合,证实了nTiO2的存在增加了3种重金属对幼溞的毒性[25],采用EDTA或DTPA作为环境介质络合了6种重金属离子,证实络合后毒性的大幅度降低与各金属螯合物的稳定常数相关[26]。不同形态和不同环境介质中重金属对大型溞毒性不同,而常见形态的重金属毒性大小也会显示出很大差异,Münzinger等[27]通过研究得出,在同一试验条件下不同产地的大型溞对同一重金属的毒性大小会产生不同的结果,所以当产地、蜕皮时间、生长阶段、营养状态、延迟效应等不同的大型溞对重金属的毒性大小会产生更大的差异。因此,可以解释国内外学者以大型溞为受试生物时,测定多种重金属时产生的不同毒性(表2),这与国外学者采用重金属对模糊网纹溞Ceriodaphnia dubia Richard[28-30]和褶皱臂尾轮虫Brachionus plicatilis Müller[31-33]的研究结果相似。
表2 重金属对大型溞的毒性比较
Tab.2 Toxicity of heavy metals to water fleas Daphnia magna
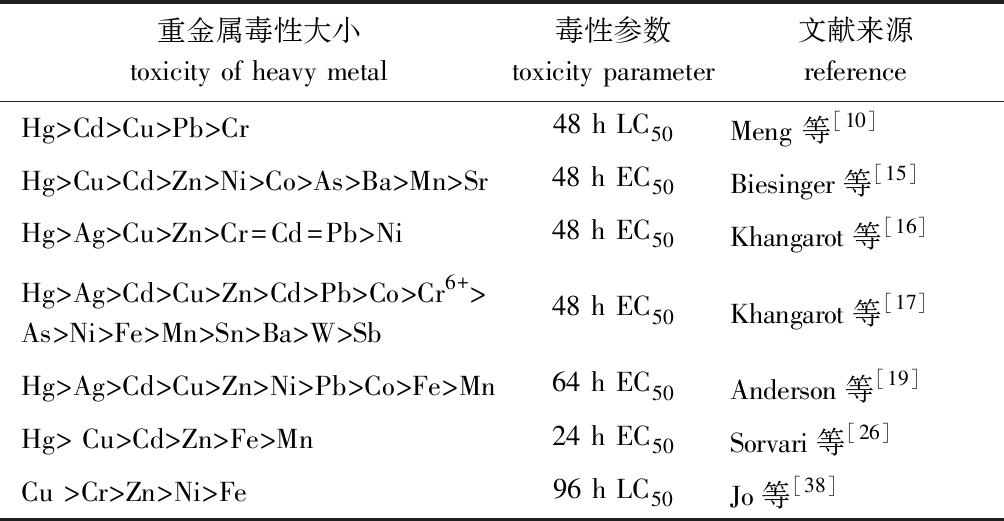
重金属毒性大小toxicity of heavy metal毒性参数toxicity parameter文献来源referenceHg>Cd>Cu>Pb>Cr48 h LC50Meng 等[10]Hg>Cu>Cd>Zn>Ni>Co>As>Ba>Mn>Sr48 h EC50Biesinger等[15]Hg>Ag>Cu>Zn>Cr=Cd=Pb>Ni48 h EC50Khangarot等[16]Hg>Ag>Cd>Cu>Zn>Cd>Pb>Co>Cr6+>As>Ni>Fe>Mn>Sn>Ba>W>Sb48 h EC50Khangarot等[17]Hg>Ag>Cd>Cu>Zn>Ni>Pb>Co>Fe>Mn64 h EC50Anderson等[19]Hg> Cu>Cd>Zn>Fe>Mn24 h EC50Sorvari等[26]Cu >Cr>Zn>Ni>Fe96 h LC50Jo等[38]
随着对重金属化学和大型溞生理毒性的研究日益增多,国外学者首先建立起毒性预测模型,如生物配体模型(BLM),通过BLM可预测单一重金属对大型溞产生的毒性,因此,BLM被广泛应用于单一急性毒性试验,但预测急性毒性的BLM,仅个别预测值与观测值之间吻合度高,如利用BLM研究水中Cu和Cd对大型溞急性毒性预测时[34-35],不是所有种类的BLM均可达到准确预测毒性的目的。Heijerick等[36]在传统BLM基础上,开发了大型溞预测急性锌的BLM,并采用不同pH、硬度和溶解有机碳(DOC)含量的17种测试液来验证开发的BLM,结果虽然证实了预测值和观测值之间显著相关,但88%的预测值与观测值之间存在1.3倍误差,存在着较大误差的原因可能是BLM以化学平衡为前提,而许多研究结果是否建立在平衡状态下有待商榷。此外,Al-Reasi等[37]证实DOC和腐质可减轻Cu对大型溞的毒性,这一试验结果可能验证了重金属与有机质的结合也可导致BLM出现误差这一推测。
虽然单一急性毒性试验可以在短期内较好地研究多种重金属的毒性参数及毒性大小,但其不能全面系统评价单一重金属对大型溞的整体毒性,这时则需进行单一慢性毒性试验。
3.1.2 慢性毒性试验 单一慢性毒性试验是在长时间低剂量浓度下,研究单一重金属对大型溞的毒性,以弥补急性毒性试验的不足,并为进一步揭示重金属对大型溞的整体毒性提供数据支持。随着慢性毒性试验研究的深入,一些研究逐渐集中于重金属的积累途径、富集作用和毒性预测。Liu等[39]研究发现,大型溞从食物来源对Cr累积时比从水相中积累的金属同化效率(AE)高,但随大型溞到斑马鱼的食物链传递过程中,斑马鱼对Cd和Zn的富集程度与大型溞对这2种重金属积累途径无关,不同积累途径的重金属会对大型溞产生不同的影响,同种重金属也会因大型溞产地不同而出现不同的结果,这些都进一步揭示了重金属与大型溞相互作用的复杂性。BLM作为毒性预测的重要手段之一,用来预测重金属急性毒性的BLM不适用于预测慢性毒性,而建立的慢性BLM预测值与观测值同样也存在较大误差[40-41],原因可能也是化学平衡状态、重金属与有机质的结合等[37]。因此,修正BLM可尝试从研究重金属对大型溞毒性作用机理、重金属与竞争化学因子间的化学平衡状态(如重金属与DOC的动力学结合过程),以及矫正模型表达式中的参数等几方面进行,并将研究结果纳入模型中以减少误差值,这样修正后的急性和慢性毒性有两种BLM,可整体对某一重金属污染提供科学的毒性预测。
综上可知,单一慢性毒性试验是在单一急性毒性试验的基础上,进一步研究了长时间低剂量浓度下生长繁殖过程中大型溞对重金属的积累途径和毒性预测。单一急性毒性试验和单一慢性毒性试验结合,可以揭示出单一重金属对大型溞造成的整体毒性,并可为制定水质标准及进一步探讨重金属联合毒性提供数据支持。
3.2 重金属联合毒性试验
随着单一毒性试验的广泛开展,研究者逐渐意识到在实际水体中往往存在多种重金属污染物,多种重金属污染物间又存在着相互作用,此时仅仅依靠重金属对大型溞的单一毒性试验结果来对重金属污染水体进行评估显得尤不合适,因此,国内外学者逐步开展了联合毒性试验[42-43]。
3.2.1 急性毒性试验 联合急性毒性试验作为联合毒性试验中的重要组成部分,在大型溞毒性试验中被逐步应用。重金属混合物可增大大型溞的敏感性及生殖参数[44],这为后续的研究奠定了基础。大型溞对不同环境介质中重金属混合物的生物可利用性存在一定差异,如纳米水稳型富勒烯nC60可增强Zn-Cr混合物对大型溞的联合毒性,提高了其在大型溞体内的积累和自由基活性[45]。此外,环境介质中水质参数变化对重金属混合物同样也会造成影响,如增加pH、硬度和DOC可使Cu-Cr混合物对大型溞的联合毒性降低[38]。重金属联合作用方式作为联合急性毒性研究的重点,主要有协同作用和拮抗作用两种方式,董晓晓等[46]的研究证实了这一点,且随着暴露时间的延长存在着拮抗作用转换为协同作用这一作用类型,这与重金属混合物对西藏拟溞Daphniopsis tibetana 的生态毒理学研究结果相似[47],其原因可能是溞体具备一定毒性耐受并且与混合物中的某一重金属的结合位点有限,但随着暴露时间的延长,溞体毒性耐受能力减弱,结合位点增加,进而使重金属间呈现协同作用。
联合急性毒性试验研究了不同环境介质的重金属联合作用方式对大型溞毒性效应的影响,其与单一急性毒性试验相比,增加了大型溞生态毒理学研究的基础数据,但仅仅依靠联合急性毒性试验也不能更好地揭示出长时间作用下多种重金属的相互作用机理,此时就需要进行联合慢性毒性试验。
3.2.2 慢性毒性试验 联合慢性毒性试验是采用长时间作用研究多种重金属的联合作用方式,旨在进一步揭示多种重金属相互作用机理,在重金属复合污染评估中极其重要,应用前景广阔。为探明重金属联合作用时产生拮抗作用的原因,Münzinger等[3]通过研究证实了Cr耐受溞体均比正常溞体显示出更强的耐受性,这为进一步探究拮抗作用机理提供了科学参考。由于相关水质标准均是基于单一重金属所制定,这势必会忽略重金属联合毒性的影响,因此,国内外学者开展了评价水质标准的研究。如Biesinger等[42]通过研究证实,当重金属按照各自安全浓度两两配比时,重金属混合物均会对大型溞的生殖造成显著影响,这表明重金属处于混合状态时安全浓度并不适用,这为进一步评价水质标准提供了数据支持。Enserink等[43]最早以大型溞作为受试生物,成功证实了当重金属混合物的每种重金属浓度与荷兰水质标准中制定的标准浓度相同时,可对大型溞造成严重毒性,即当水环境中重金属以混合物存在时,荷兰水质标准不能起到较好的水质评估作用;而国内学者同样也进行了中国水质标准的评价,Meng等[10]研究显示,在毒性最小的5种重金属混合物的LC50中,绝大多数试验组LC50浓度小于对照组(按照中国渔业水质标准GB 1160-89设计的浓度),其中Cr对大型溞的单一毒性最低,但其存在使得Hg-Cd-Cu-Pb混合物的毒性增加了6倍以上,这些研究均表明,重金属处于混合状态时,水质标准不能较好地发挥作用。
在联合慢性毒性试验中,大型溞对某一重金属的耐受性会提高对其他重金属的耐受性,这使得在研究联合毒性时更加复杂,并且多种重金属联合作用时,其毒性参数远远高于单一毒性试验。因此,与单一毒性试验相比,联合毒性试验极大地丰富了大型溞生态毒理学研究的基础资料,为开展复合污染评估提供了更多的理论数据和科学参考。
4 存在问题及展望
4.1 存在问题
4.1.1 重金属对大型溞的毒性作用机理 目前,重金属对大型溞生态毒理学研究已日趋深入,但无论是单一毒性还是联合毒性试验,关于重金属与水环境理化因子的作用机理,不同积累途径和环境介质中不同形态的重金属对大型溞的作用机理,重金属间的作用方式等仍不明确,因此,应充分利用生物化学和分子生物学等多种技术手段,对环境因子如何改变水中重金属的化学形态及影响大型溞生理生化过程进行监测,对毒理动力学(吸收、消化、体内存储、隔离和排出等)[12]和生态毒理基因组学(转录组学、蛋白质组学、代谢组学和表观基因组学)[48]进行研究,用以解决上述问题并进一步揭示重金属对大型溞的致毒途径和机理。
4.1.2 重金属对大型溞的毒性预测 在重金属对大型溞的生态毒理学研究中,众多研究者关注开发适用于生态毒理学的毒性预测模型,其中,国内外学者广泛应用的主要有BLM。BLM可将重金属的生物可利用性和影响重金属毒性的化学、生理、毒理过程有机结合起来,实质上是指在化学平衡前提下,重金属在生物配体的累积毒性与环境水体中竞争化学因子(Mg2+、Ca2+、H+、DOC等)有机结合的毒性预测模型[12]。目前,BLM在大型溞的生态毒理学研究中,无论是单一急性毒性还是慢性毒性预测,仅有个别重金属种类的BLM,其他重金属BLM(如Cd、Pb等)仍需进行探索和构建。此外,现有的BLM预测值与观测值仍存在相对较大的误差,如何在研究和实践中修正模型减少误差,仍需进行大量工作。
4.1.3 重金属对大型溞的试验设计和应用 在实际重金属污染的水环境中往往存在多种重金属污染物,此时仅仅依靠单一毒性试验结果来判定水质污染状况并不合适[10,42-43],所以应在单一毒性试验基础上,进一步加强和完善联合毒性试验。此外,在重金属对大型溞的生态毒理学研究中,由于不同生长阶段、蜕皮时间、延迟效应、营养状态、产地[18-19,22-23,27]及野生和驯化种群等影响下的大型溞均会对试验结果造成误差,因此,应综合考虑以上影响因素,设计单一和联合毒性试验,并根据二者结果制定标准并进行重金属单一和复合污染评估。
4.2 展望
目前,国内外学者以大型溞为受试生物,在重金属污染方面开展了一系列生态毒理学试验,并取得了显著成效,今后仍需在以下几方面开展进一步研究。
(1) 拓展重金属毒性作用机理研究。重金属对外在理化因子、大型溞及彼此间联合作用方式的毒性作用机理尚未深入,亟须进一步研究。
(2) 研究方法和手段的不断完善和进步。逐步修正和建立BLM。目前的BLM仍存在误差且数量较少,减少误差修正模型,建立其他重金属的BLM,仍需进行大量工作。
(3) 合理制定相关标准。以大型溞作为水环境污染监测的受试生物时,应充分考虑实际水环境中重金属的复合污染情况,在单一和联合毒性试验结果的基础上制定相关标准并进行重金属污染评估。
[1] Cousyn C,De Meester L,Colbourne J K,et al.Rapid,local adaptation of zooplankton behavior to changes in predation pressure in the absence of neutral genetic changes[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(11):6256-6260.
[2] Seda J,Petrusek A.Daphnia as a model organism in limnology and aquatic biology:introductory remarks[J].Journal of Limnology,2011,70(2):337-344.
[3] Münzinger A,Monicelli F.Heavy metal co-tolerance in a chromium tolerant strain of Daphnia magna[J].Aquatic Toxicology,1992,23(3-4):203-216.
[4] DiDelupis G D,Macrí A,Civitareale C,et al.Antibiotics of zootechnical use:effects of acute high and low dose contamination on Daphnia magna Straus[J].Aquatic Toxicology,1992,22(1):53-59.
[5] Barata C,Solayan A,Porte C.Role of B-esterases in assessing toxicity of organophosphorus (chlorpyrifos,malathion) and carbamate (carbofuran) pesticides to Daphnia magna[J].Aquatic Toxicology,2004,66(2):125-139.
[6] Borgeraas J,Hessen D O.UV-B induced mortality and antioxidant enzyme activities in Daphnia magna at different oxygen concentrations and temperatures[J].Journal of Plankton Research,2000,22(6):1167-1183.
[7] Ullrich Jr S O,Millemann R E.Survival,respiration,and food assimilation of Daphnia magna exposed to petroleum- and coal-derived oils at three temperatures[J].Canadian Journal of Fisheries and Aquatic Sciences,1983,40(1):17-26.
[8] Feldmannová M,Hilscherová K,Maršálek B,et al.Effects of N-heterocyclic polyaromatic hydrocarbons on survival,reproduction,and biochemical parameters in Daphnia magna[J].Environmental Toxicology,2006,21(4):425-431.
[9] Zhang Lulu,Liu Jingling,Liu Huayong,et al.The occurrence and ecological risk assessment of phthalate esters (PAEs) in urban aquatic environments of China[J].Ecotoxicology,2015,24(5):967-984.
[10] Meng Qingjun,Li Xiangdong,Feng Qiyan,et al.The acute and chronic toxicity of five heavy metals on the Daphnia magna[C]//Proceedings of the 2008 2nd International Conference on Bioinformatics and Biomedical Engineering.Shanghai,China:IEEE,2008.
[11] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004:201,203,208,250-251.
[12] 王文雄.微量金属生态毒理学和生物地球化学[M].北京:科学出版社,2011:3,114,211-222.
[13] 陆正和,阎斌伦,杨家新.枝角类生态毒理学研究进展[J].水生态学杂志,2010,3(2):106-110.
[14] 沙婧婧,戴媛媛,潘玉龙,等.轮虫在生态毒理学中的研究进展[J].生态毒理学报,2018,13(3):56-70.
[15] Biesinger K E,Christensen G M.Effects of various metals on survival,growth,reproduction,and metabolism of Daphnia magna[J].Journal of the Fisheries Research Board of Canada,1972,29(12):1691-1700.
[16] Khangarot B S,Ray P K.Correlation between heavy metal acute toxicity values in Daphnia magna and fish[J].Bulletin of Environmental Contamination and Toxicology,1987,38(4):722-726.
[17] Khangarot B S,Ray P K.Investigation of correlation between physicochemical properties of metals and their toxicity to the water fleas Daphnia magna Straus[J].Ecotoxicology and Environmental Safety,1989,18(2):109-120.
[18] Bodar C W M,Zee A v d,Voogt P A,et al.Toxicity of heavy metals to early life stages of Daphnia magna[J].Ecotoxicology and Environmental Safety,1989,17(3):333-338.
[19] Anderson B G.The apparent thresholds of toxicity to Daphnia magna for chlorides of various metals when added to Lake Erie water[J].Transactions of the American Fisheries Society,1950,78(1):96-113.
[20] 王茜,郭鹄飞,王兰.镉对大型溞摄食能力和相关生理指标的影响[J].水生生物学报,2018,42(3):616-621.
[21] Bodar C W M,van der Sluis I,Van Montfort J C P,et al.Cadmium resistance in Daphnia magna[J].Aquatic Toxicology,1990,16(1):33-39.
[22] 李爽,徐镜波.镉胁迫对大型溞的毒性效应[J].北华大学学报:自然科学版,2017,18(1):116-120.
[23] Enserink L,Luttmer W,Maas-Diepeveen H.Reproductive strategy of Daphnia magna affects the sensitivity of its progeny in acute toxicity tests[J].Aquatic Toxicology,1990,17(1):15-25.
[24] 范文宏,段勇,林爽,等.水体沉积物结合态镉对大型溞(Daphnia magna)的生物毒性研究[J].生态毒理学报,2009,4(4):544-551.
[25] Rosenfeldt R R,Seitz F,Schulz R,et al.Heavy metal uptake and toxicity in the presence of titanium dioxide nanoparticles:a factorial approach using Daphnia magna[J].Environmental Science & Technology,2014,48(12):6965-6972.
[26] Sorvari J,Sillanpää M.Influence of metal complex formation on heavy metal and free EDTA and DTPA acute toxicity determined by Daphnia magna[J].Chemosphere,1996,33(6):1119-1123.
[27] Münzinger A,Monicelli F.A comparison of the sensitivity of three Daphnia magna populations under chronic heavy metal stress[J].Ecotoxicology and Environmental Safety,1991,22(1):24-31.
[28] Belanger S E,Cherry D S.Interacting effects of pH acclimation,pH,and heavy metals on acute and chronic toxicity to Ceriodaphnia dubia (Cladocera)[J].Journal of Crustacean Biology,1990,10(2):225-235.
[29] Schubauer-Berigan M K,Dierkes J R,Monson P D,et al.pH-dependent toxicity of Cd,Cu,Ni,Pb and Zn to Ceriodaphnia dubia,Pimephales promelas,Hyalella azteca and Lumbriculus variegatus[J].Environmental Toxicology and Chemistry,1993,12(7):1261-1266.
[30] Naddy R B,Cohen A S,Stubblefield W A.The interactive toxicity of cadmium,copper,and zinc to Ceriodaphnia dubia and rainbow trout (Oncorhynchus mykiss)[J].Environmental Toxicology and Chemistry,2015,34(4):809-815.
[31] Arias-Almeida J C,Rico-Martínez R.Toxicity of cadmium,lead,mercury and methyl parathion on Euchlanis dilatata Ehrenberg 1832 (Rotifera:Monogononta)[J].Bulletin of Environmental Contamination and Toxicology,2011,87(2):138-142.
[32] Chishty N,Tripathi A,Sharma M.Evaluation of acute toxicity of zinc,lead and cadmium to zooplanktonic community in upper Berach river system,Rajasthan,India[J].South Asian Journal of Experimental Biology,2012,2(1):20-26.
[33] 刘群,辛荣.3种金属离子对褶皱臂尾轮虫的急性毒性试验[J].养殖与饲料,2017(5):14-15.
[34] De Schamphelaere K A C,Heijerick D G,Janssen C R.Refinement and field validation of a biotic ligand model predicting acute copper toxicity to Daphnia magna[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2002,133(1-2):243-258.
[35] 王飞飞,朱岩,张亚辉,等.应用BLM研究Cd对大型溞的急性毒性[J].桂林理工大学学报,2017,37(2):348-353.
[36] Heijerick D G,De Schamphelaere K A C,Janssen C R.Predicting acute zinc toxicity for Daphnia magna as a function of key water chemistry characteristics:development and validation of a biotic ligand model[J].Environmental Toxicology and Chemistry,2002,21(6):1309-1315.
[37] Al-Reasi H A,Smith D S,Wood C M.Evaluating the ameliorative effect of natural dissolved organic matter (DOM) quality on copper toxicity to Daphnia magna [J].Ecotoxicology,2012,21(2):524-537.
[38] Jo H J,Son J,Cho K,et al.Combined effects of water quality parameters on mixture toxicity of copper and chromium toward Daphnia magna[J].Chemosphere,2010,81(10):1301-1307.
[39] Liu Xuejun,Ni I H,Wang Wenxiong.Trophic transfer of heavy metals from freshwater zooplankton Daphnia magna to zebrafish Danio reiro[J].Water Research,2002,36(18):4563-4569.
[40] Ng Tania Y T,Wang Wenxiong.Dynamics of metal subcellular distribution and its relationship with metal uptake in marine mussels[J].Environmental Toxicology and Chemistry,2005,24(9):2365-2372.
[41] Heijerick D G,De Schamphelaere K A C,van Sprang P A,et al.Development of a chronic zinc biotic ligand model for Daphnia magna[J].Ecotoxicology and Environmental Safety,2005,62(1):1-10.
[42] Biesinger K E,Christensen G M,Fiandt J T.Effects of metal salt mixtures on Daphnia magna reproduction[J].Ecotoxicology and Environmental Safety,1986,11(1):9-14.
[43] Enserink E L,Maas-Diepeveen J L,van Leeuwen C J.Combined effects of metals:an ecotoxicological evaluation[J].Water Research,1991,25(6):679-687.
[44] Burba A.The design of an experimental system of estimation methods for effects of heavy metals and their mixtures on Daphnia magna[J].Acta Zoologica Lituanica,1999,9(2):21-29.
[45] 余言想,魏华,陶贤继,等.纳米水稳型C60(nC60)促进Zn2+和Cr6+在大型溞体内的吸收、抗氧化性和急性毒性[J].生态毒理学报,2014,9(3):569-577.
[46] 董晓晓,刘腾腾,孔强,等.Cu2+、Cd2+和Se4+对大型溞的单一及联合毒性效应[J].山东科学,2012,25(2):38-43.
[47] 霍元子,赵文,魏杰.Cu2+、Zn2+、Co2+、Ni2+、Li+对西藏拟溞的急性与联合毒性效应[J].中国水产科学,2011,18(2):466-471.
[48] Kim H J,Koedrith P,Seo Y R.Ecotoxicogenomic approaches for understanding molecular mechanisms of environmental chemical toxicity using aquatic invertebrate,daphnia model organism[J].International Journal of Molecular Sciences,2015,16(6):12261-12287.