20世纪80年代以来,中国水产养殖产量持续增长,逐步成为农业中发展最快的产业之一[1],水产养殖业的迅速发展受到各种因素的推动,其中包括更多地使用配合饲料及养殖系统的集约化,水产种质资源作为现代水产养殖业发展的第一产业要素[2],优质苗种的需求量随着养殖业的迅速发展大幅度增加,仅靠天然捕捞已无法满足其大量需求[3],因此,开展相关营养学研究提升亲体繁殖能力及后代质量十分重要。
早期国内外对虾蟹类研究表明,虾蟹类配子的质量是决定虾蟹类人工育苗生产中繁育成败的主要因素,虾蟹类的配子质量、亲体性成熟、性腺发育能力、生殖力、受精率、受精卵孵化率,以及其后续自营养阶段幼体存活率和质量(畸形率、体长及生存活力指数等)等均与亲体性腺发育期营养的累积和性成熟密切相关[4-10]。对于鱼类而言,生殖期的营养供给对其亲鱼的性腺发育、配子质量和幼鱼的生长具有重要影响,亲鱼的性腺发育、性成熟、受精率、受精卵孵化率及苗种存活率和质量等均与饲料营养状况(如蛋白质和氨基酸、脂肪和脂肪酸、维生素、矿物质及其他营养素等)密切相关[11-12]。对于刺参等无脊椎动物而言,环境对其季节性繁殖具有重要影响,其中最主要的因素为温度和食物[13];在非繁殖季节,通过控制饲养温度也能诱导贝类的配子发生[14]。因此,确定最有利于刺参性腺发育的培育水温是亲参人工促熟的必要步骤,适宜的水温可以诱导配子的发生,但亲体的繁殖力主要受摄入食物数量和质量的影响[15]。相关营养学研究证实,不同种类水产动物繁殖期间的营养需求存在较大差异[16-17],因此,探究饲料营养成分来源及含量对水产动物性腺发育的影响十分必要。本研究中综述了饲料营养成分来源和含量对水产动物繁殖性能的影响及其作用机制,旨在为繁殖期水产动物饲料营养配比提供科学依据。
1 营养素对水产动物性腺发育的影响
1.1 蛋白质及氨基酸
蛋白质及氨基酸在水产动物的生长发育过程中至关重要,水产动物饲料中的蛋白质是必需的核心营养物质,也是相对昂贵的原料,饲料蛋白质含量和种类直接影响饲料产品的价格和动物生长发育过程[18]。目前,水产动物饲料中常用的蛋白质原料按其来源不同可分为动物性蛋白质原料和植物性蛋白质原料,主要包括鱼粉、肉粉、血粉、昆虫蛋白粉、豆粕、菜籽粕(饼)、棉粕等,饲料中蛋白质含量、蛋白来源及其相应的氨基酸组成对水产动物的繁殖性能具有重要作用。
1.1.1 蛋白质含量 饲料中蛋白质含量对水产动物亲体的繁殖性能具有重要影响,其能促进卵细胞的生长和成熟,促进性早熟,以及有利于性腺指数、生殖力、浮性卵比例、仔鱼产量等。
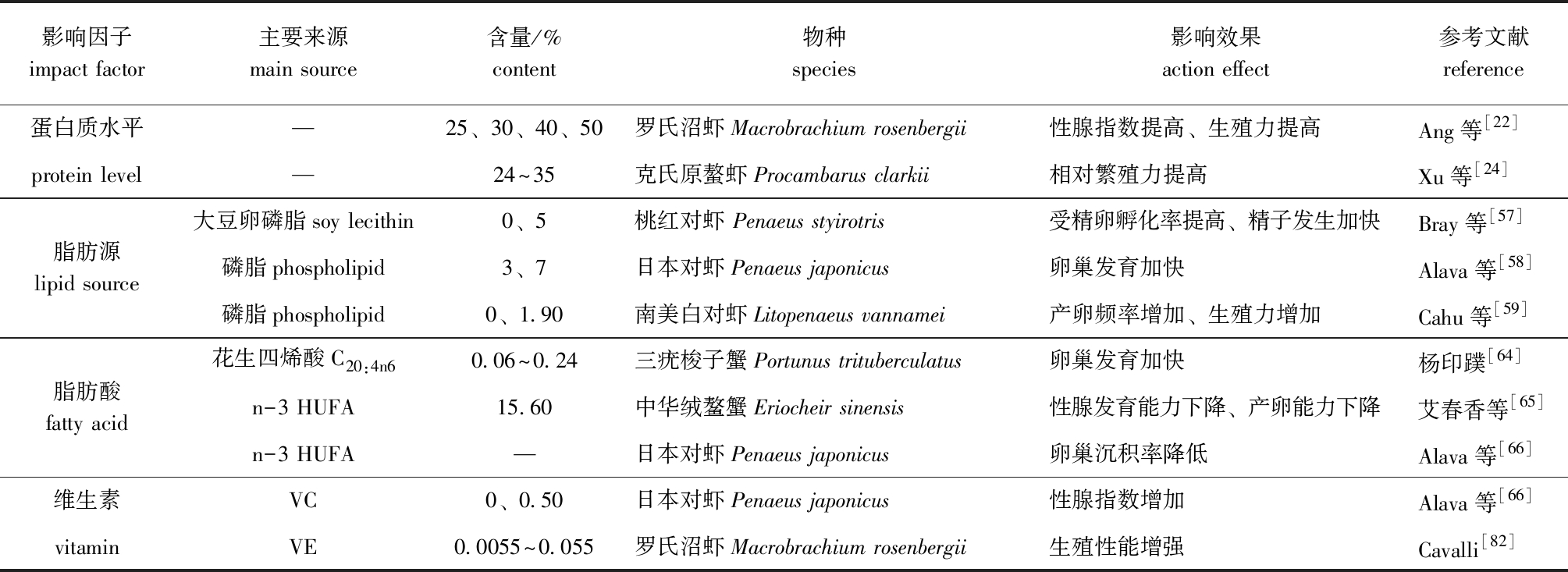
利用蛋白质含量为10%~40%的饲料投喂尼罗罗非鱼Oreochromis niloticus时,高蛋白质组(32%和40%组)鱼达到性成熟的时间较短,卵细胞的成熟和生长较低蛋白组快[19];同样,利用蛋白质水平为25%~45%和25%~40%的饲料饲喂尼罗罗非鱼,45%蛋白组和40%蛋白组的产卵频率、产卵量和繁殖力均得到显著改善[20-21];利用蛋白质水平为25%~50%的饲料饲喂罗氏沼虾Macrobrachium Rosenbergii,发现其亲体的性腺指数和生殖力均以40%组为最高[22];用蛋白质水平为20%~60%的5 种半精制饲料投喂剑尾鱼Xiphophorus helleri,其中50% 和 60% 蛋白组亲鱼的产卵量最高[23];投喂40%~45%蛋白质水平饲料的克氏原螯虾Procambarus clarkii相对繁殖力,显著高于投喂24%~35%蛋白质水平饲料[24]。除此之外,一系列研究发现:凡纳滨对虾其个体繁殖能力强者肝胰腺和卵巢中蛋白质含量显著高于繁殖能力弱者,且蛋白质含量太低时会导致雌体无法产卵[25];从胚胎发育开始至发育结束,中华绒鳌蟹Eriocheir sinensis 胚胎蛋白质含量由67.18%降低至44.56%,脂类和碳水化合物含量无明显变化,这说明中华绒螯蟹胚胎发育过程中蛋白质是主要的能源物质[26]。综上所述,蛋白质可以提升水产动物的繁殖性能,但蛋白质含量存在适宜范围。在适宜蛋白质含量范围内,动物的繁殖性能会随蛋白质含量的升高而有所提高,蛋白质水平过量或不足则降低亲体的繁殖力[27-30],但不同亲体间的最适蛋白质水平存在差异,这种差异的存在可能与亲体的种类、规格,以及饲料中蛋白质来源等密切相关。
1.1.2 蛋白源 水产动物性腺发育过程中蛋白源也是重要的影响因素之一,优质的蛋白源能够提高动物的性腺发育能力。
用乌贼粉部分或完全替代白鱼粉后,真鲷Pagrus major产浮性卵比例和产仔量大幅度提高[31];用以鱿鱼粉为主要蛋白源的饲料投喂金头鲷Sparus aurata,其雌鱼的产卵总数和日产仔量显著提高[32];在金头鲷饲料中以磷虾粉为主要蛋白源能显著提高亲鱼的生殖性能,其原因是磷虾粉含有金头鲷亲鱼性腺发育所需的磷脂酰胆碱和虾青素[33]。然而,并非所有蛋白源都能显著提高饲养动物的性腺发育能力,如用添加了 0~80% 银合欢叶粉的饲料饲养尼罗罗非鱼亲鱼,随着银合欢叶粉含量的增加,雌鱼体质量却出现明显下降,且 0、20% 银合欢叶粉组的平均种苗量显著高于 80% 组[34];在随后的尼罗罗非鱼亲体培养试验中,使用苜蓿粉作为单独蛋白源饲喂尼罗罗非鱼亲鱼,亲鱼体质量、性腺指数和幼苗数量持续下降[35]。
综上所述,不同蛋白源对动物的性腺发育能力影响不同,尤其动物蛋白源与植物蛋白源间存在较大差异,这可能与动物的食性及其对不同类别蛋白源的利用能力等有关。
1.1.3 氨基酸 动物对饲料中蛋白质的需要,实质是对其中氨基酸的需要,饲料蛋白质只有经过消化和水解后,释放出游离氨基酸或肽类物质才能被动物体吸收利用[36-37]。
在香鱼Plecoglossus altivelis饲料中添加0.1%的色氨酸能促使其雄鱼精子提早成熟及雌鱼提前排卵[38];在金头鲷饲料中降低赖氨酸的含量后,卵黄中蛋白质含量出现显著下降,且仔鱼的成活率较低,而在基础饲料中添加必需氨基酸使之与卵细胞组成成分相似时,可使仔鱼的成活率显著增长,同时仔鱼的生长速度也明显提高[39];同样,在去除拉利毛足鲈Colisa lalia亲鱼饲料中的蛋氨酸、赖氨酸时,其产卵率和受精卵孵化率均出现降低,且在蛋氨酸缺乏时,无法产卵[40]。除去常见的必需氨基酸外,一些特定氨基酸也能影响动物的性腺发育能力,如在黄尾鰤Seriola quinqueradiata及尼罗罗非鱼饲料中补充牛磺酸,可显著改善其雌鱼的产卵性能[41-42];牛磺酸对日本鳗鲡Anguilla japonica的精子产生也存在显著影响[43];对大多数鱼类的雄体而言,精子特有的鱼精蛋白中精氨酸的含量较高,因此,在其饲料中添加足量的精氨酸是必要的[44]。表1列出了饲料蛋白质及氨基酸对鱼类性腺发育影响的部分示例。
表1 饲料蛋白质及氨基酸对鱼类性腺发育的影响
Tab.1 Effects of dietary protein and amino acid on gonad development in fish

影响因子 impact factor主要来源 main source含量/%content物种species影响效果action effect参考文献 reference—10、17、25、32、40尼罗罗非鱼Oreochromis niloticus卵细胞的生长和成熟速度较快,达到性成熟的时间较短Gunasekera等[19]蛋白质水平protein level—25、30、35、40、45尼罗罗非鱼Oreochromis niloticus产卵频率快、产卵量提高Siddiqui等[20]—25、30、35、40尼罗罗非鱼Oreochromis niloticus产卵时间间隔缩短、繁殖力提高El-Sayed等[21]—20、30、40、50、60剑尾鱼Xiphophorus helleri产卵量提高何志刚[23]乌贼粉cuttlefish meal57真鲷Pagrus major产浮性卵比例增加、产仔量提高Watanabe等[31]鱿鱼粉squid meal 61.73、63.72金头鲷Sparus aurata雌鱼产卵总数增加、日产仔量提高Fernández-Palacios等[32]蛋白源protein source磷虾粉krill powder—金头鲷Sparus aurata性腺成熟率提高、性腺指数提高Watanabe[33]银合欢叶粉Leucaena leucocephalapowder0、20、40、80尼罗罗非鱼Oreochromis niloticus雌鱼体质量下降、平均种苗量下降Santiago等[34]苜蓿粉alfalfa powder4、10尼罗罗非鱼Oreochromis niloticus亲鱼体质量下降、性腺指数下降、幼苗量下降González等[35]色氨酸Trp0.10香鱼Plecoglossus altivelis雄鱼精子成熟时间缩短、雌鱼排卵时间提前Akiyama等[38]赖氨酸Lys—金头鲷Sparus aurata卵黄蛋白质含量提高、仔鱼成活率提高Harel等[39]氨基酸amino acid蛋氨酸Met—拉利毛足鲈Colisa lalia产卵率下降、受精卵孵化率下降Shim等[40]牛磺酸Tau1黄尾鰤Seriola quinqueradiata雌鱼产卵性能提高Matsunari等[41]牛磺酸Tau0.80尼罗罗非鱼Oreochromis niloticus雌鱼产卵性能提高Al-Feky等[42]牛磺酸Tau—日本鳗鲡Anguilla japonica精子发生过程加快Higuchi等[43]
1.2 脂肪及脂肪酸
脂肪不仅能为水产动物亲体特定的生长发育过程提供能量,还能为其提供必需脂肪酸,饲料中脂肪的含量水平、来源,以及必需脂肪酸的组成等对亲体的性腺发育能力存在较大影响。
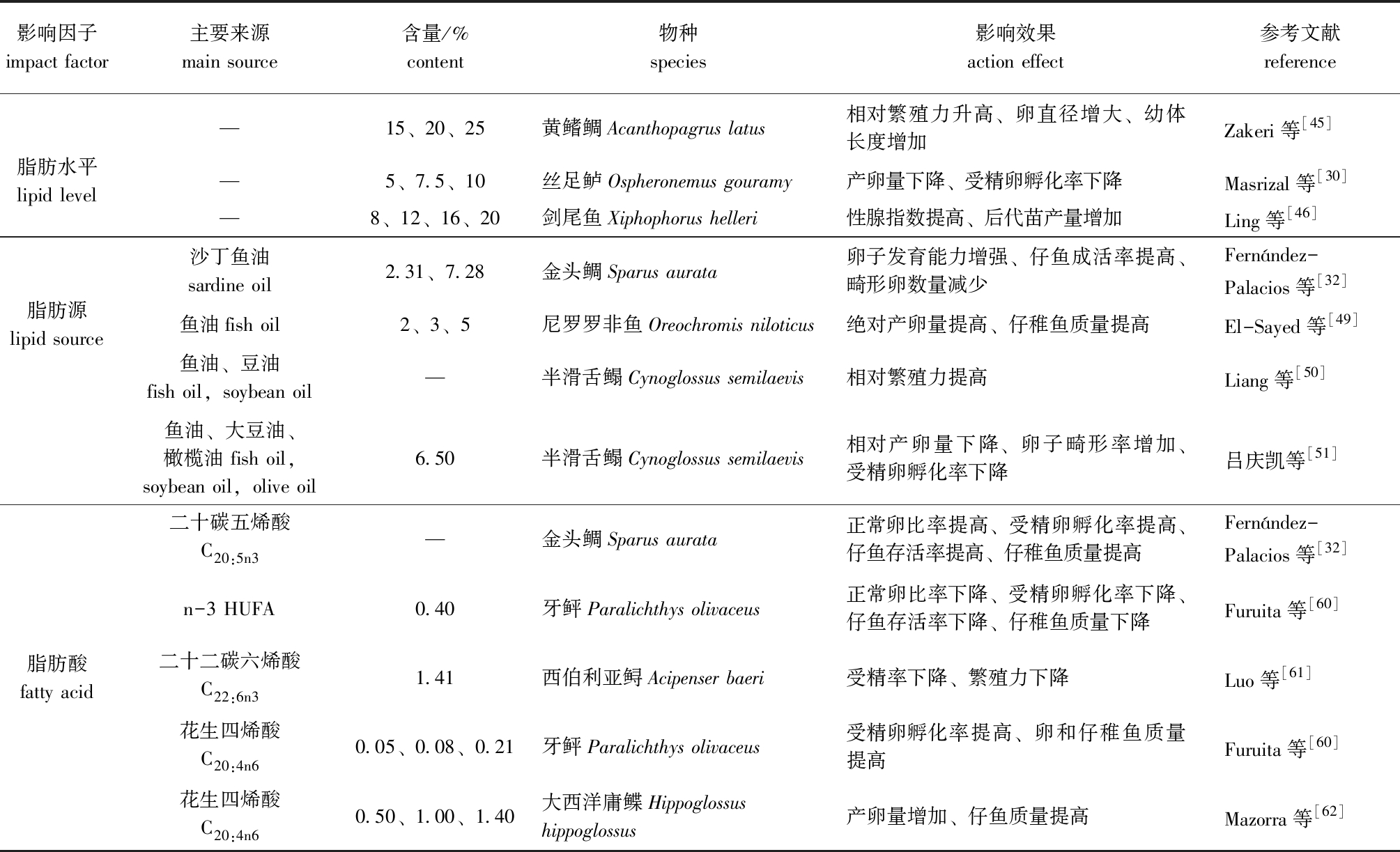
1.2.1 脂肪水平 脂肪作为水产动物主要的能量来源,其含量水平对亲体的性腺发育存在较大影响,主要包括对其产卵量、卵粒直径、受精率、受精卵孵化率及幼体大小和存活率等的影响。
利用脂肪含量为15%~25%的饲料饲喂黄鳍鲷Acanthopagrus latus时,20%脂肪组的相对繁殖力、卵直径和幼体长度显著高于其他组[45];利用脂肪含量为5%~10% 的饲料饲喂丝足鲈Ospheronemus gouramy Lac,低脂肪组产卵量和受精卵孵化率达到最大值,7.5%和10% 组则随着脂肪含量的升高而降低[30];剑尾鱼饲料中脂肪水平为8%~20%时,其性腺指数无显著性变化,而后代苗产量则出现显著变化[46]。水产饲料中脂肪水平对性腺发育的影响研究主要集中在鱼类,而对虾蟹类的研究较少,但目前已有研究发现,虾蟹类卵巢快速发育期伴随着卵黄物质的大量积累,脂类是积累的主要物质之一,这些脂类是胚胎发育重要的能量来源,其数量和质量对胚胎发育过程存在较大影响[47];脂类在中华绒螯蟹成熟卵子中以脂肪滴和卵黄体两种形态存在,其中,脂肪滴为中性脂,卵黄体中的脂类主要为磷脂,这为后续脂肪对虾蟹类性腺发育影响研究提供了重要的数据参考[48]。
1.2.2 脂肪源 饲料中脂肪来源的不同对鱼类繁殖性能的影响存在差异,鱼油曾经一度被认为是较为理想的亲鱼饲料脂肪源。
金头鲷的饲料中添加沙丁鱼油后,其仔鱼的成活率和可发育卵子数量显著提高,且畸形卵数量显著降低[32];尼罗罗非鱼摄食以鱼油为脂肪源的饲料时,其绝对产卵量和仔稚鱼质量显著高于豆油组,但与混合组无显著性差异[49];与此相反,以鱼油和豆油比例7∶1的混合油为脂肪源的饲料饲喂半滑舌鳎Cynoglossus semilaevis亲鱼时,其相对繁殖力比纯鱼油组还高[50];同样,利用鱼油、大豆油、橄榄油3种脂肪源配制的饲料饲喂半滑舌鳎亲鱼,其对照组亲鱼的相对产卵量最高,橄榄油、鱼油、豆油组产卵量按顺序依次降低,对照组的卵子畸形率最低、受精卵孵化率最高,并推断半滑舌鳎亲鱼的产卵期、卵子发育及仔鱼的成长期都需要饲料中维持一定量n-3 HUFA,特别是二十二碳六烯酸(DHA),且在半滑舌鳎卵子发育的过程中,油酸(OA)和亚油酸(LA)被选择性保留下来,单一的植物油或者动物油作为脂肪源均不能较好地为其繁殖过程提供必需脂肪酸[51];在水产动物性腺发育的过程中,卵磷脂和磷脂酰乙醇胺是卵巢中主要的磷脂,磷脂能够改善甲壳类动物的生殖力和产卵频率,改善其精子发生率和受精卵孵化率,并能提高幼体质量[52-56]。在桃红对虾Penaeus styirotris饲料中添加1.5%的大豆卵磷脂,能提高其精子发生率、受精卵孵化率和幼体产量[57];日本对虾Penaeus japonicus饲料中缺乏磷脂时,其卵巢发育受到抑制[58];在南美白对虾Penaeus vannamei饲料中添加2.0%的磷脂,能够提高其产卵频率和生殖力,并提出为了保持较高的产卵频率和繁殖力,亲体饲料中应含有2%以上的磷脂[59]。因此,对虾蟹类而言,磷脂作为体液中最主要的运输型脂质和主要的细胞膜成分,对改善其繁殖性能具有重要作用。
1.2.3 脂肪酸 饲料脂肪源对水产动物亲体性腺发育的影响可能与其脂肪酸的含量和组成比例有关。亲体饲料中n-3高不饱和脂肪酸(n-3 HUFA)和n-6高不饱和脂肪酸(n-6 HUFA)含量,对其繁殖性能具有重要影响。
鱼卵中n-3 HUFA的含量会随饲料中n-3 HUFA的增加而增加,且在金头鲷[32]和牙鲆Paralichthys olivaceus[60]饲料中n-3 HUFA不足或过量时,其受精卵孵化率及仔鱼存活率和质量均显著下降,畸形卵比例显著提高;二十碳五烯酸(EPA)作为一种重要的n-3 HUFA,其在金头鲷饲料中的含量与金头鲷受精卵的数目呈正相关[32];而 Luo等[61]特别强调了DHA对西伯利亚鲟Acipenser baeri繁殖性能的重要影响,饲料中高含量的DHA 可以提高卵粒中EPA、DHA 和总PUFA 含量,以及雌鱼血液中的雌二醇、11-酮基睾酮、黄体激素含量,从而提高雌鱼的繁殖性能。除了n-3 HUFA 外,饲料中n-6 HUFA的含量也能对亲鱼的繁殖力产生影响[50];花生四烯酸(ARA)作为重要的n-6 HUFA,其对牙鲆卵质量、受精卵孵化率和仔稚鱼质量存在显著的影响[60],可显著影响大西洋庸鲽Hippoglossus hippoglossus的产卵量和仔鱼质量[62]。虾蟹类性腺成熟、产卵频率、产卵量、受精卵孵化率及其脂肪酸组成等与饲料中脂肪酸的组成和数量也密切相关[57,63],以不同水平(0.06%~0.60%)的花生四烯酸饲料饲喂三疣梭子蟹Portunus trituberculatus时发现,为保证三疣梭子蟹卵巢发育和正常的生理机能,饲料中ARA的最适添加量为0.06%~0.24%,ARA的含量过高容易诱发三疣梭子蟹的肝胰腺白化症[64]。中华绒鳌蟹亲体饲料中缺乏n-3 HUFA时,其性腺则停止发育或达不到产卵的程度[65];同样,饲料中缺乏n-3 HUFA时,会导致日本对虾Penaeus japonicus卵巢中n-3 HUFA沉积率下降[66]。表2列出了饲料脂肪及脂肪酸对鱼类性腺发育影响的部分示例。
表2 饲料脂肪及脂肪酸对鱼类性腺发育的影响
Tab.2 Effects of dietary fat and fatty acid on gonad development in fish
影响因子 impact factor主要来源 main source含量/%content物种species影响效果action effect参考文献 reference—15、20、25 黄鳍鲷Acanthopagrus latus相对繁殖力升高、卵直径增大、幼体长度增加Zakeri等[45]脂肪水平lipid level—5、7.5、10丝足鲈Ospheronemus gouramy 产卵量下降、受精卵孵化率下降Masrizal等[30]—8、12、16、20剑尾鱼Xiphophorus helleri性腺指数提高、后代苗产量增加Ling等[46]沙丁鱼油sardine oil2.31、7.28金头鲷Sparus aurata卵子发育能力增强、仔鱼成活率提高、畸形卵数量减少Fernández-Palacios等[32]脂肪源lipid source鱼油fish oil2、3、5尼罗罗非鱼Oreochromis niloticus绝对产卵量提高、仔稚鱼质量提高El-Sayed等[49]鱼油、豆油fish oil,soybean oil—半滑舌鳎Cynoglossus semilaevis相对繁殖力提高Liang等[50]鱼油、大豆油、橄榄油 fish oil,soybean oil,olive oil6.50半滑舌鳎Cynoglossus semilaevis相对产卵量下降、卵子畸形率增加、受精卵孵化率下降吕庆凯等[51]二十碳五烯酸C20:5n3—金头鲷Sparus aurata正常卵比率提高、受精卵孵化率提高、仔鱼存活率提高、仔稚鱼质量提高Fernández-Palacios等[32]n-3 HUFA0.40牙鲆Paralichthys olivaceus正常卵比率下降、受精卵孵化率下降、仔鱼存活率下降、仔稚鱼质量下降Furuita等[60]脂肪酸fatty acid 二十二碳六烯酸C22:6n31.41西伯利亚鲟Acipenser baeri受精率下降、繁殖力下降Luo等[61]花生四烯酸C20:4n60.05、0.08、0.21牙鲆Paralichthys olivaceus受精卵孵化率提高、卵和仔稚鱼质量提高Furuita等[60]花生四烯酸C20:4n60.50、1.00、1.40大西洋庸鲽Hippoglossus hippoglossus产卵量增加、仔鱼质量提高Mazorra等[62]
1.3 糖类
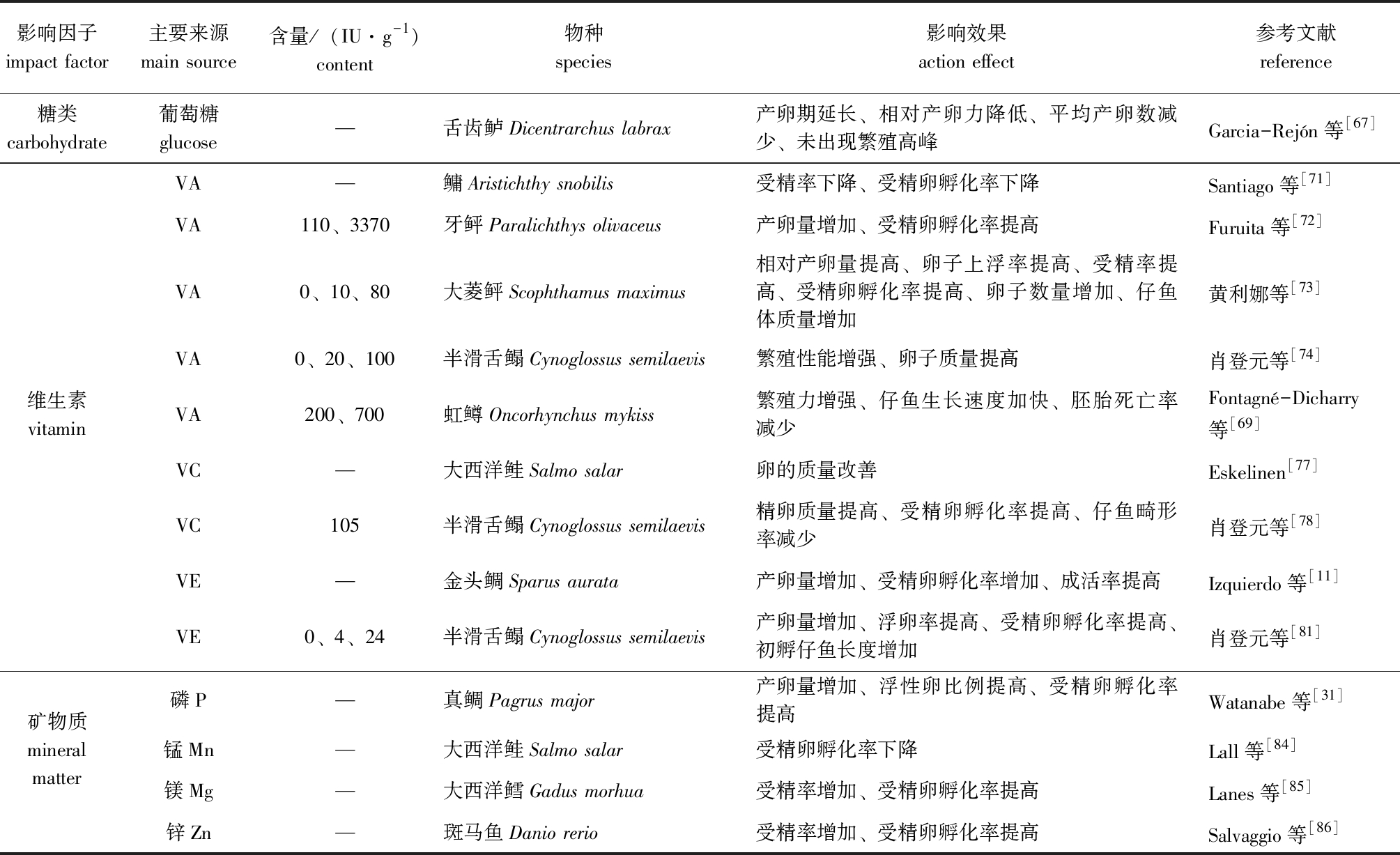
糖类作为饲料中廉价的能源物质,被分解吸收后主要以血液葡萄糖的形式存在,或以糖原的形式储存于肝胰腺中,葡萄糖是鱼类繁殖过程中重要的能量来源物质之一。
舌齿鲈Dicentrarchus labrax在产卵时,伴随着较高的糖异生活力,且雌鱼在生殖过程中对葡萄糖的需求远大于雄鱼[67];分别用3种含糖量不同的饲料(低蛋白高糖、中蛋白中糖和高蛋白低糖)饲喂虹鳟Oncorhynchus mykiss时,低蛋白高糖、中蛋白中糖组相对产卵力、卵的存活率和受精卵孵化率较高蛋白低糖组有显著改善;与此相反,Cerdá等[68]用两组(高蛋白低糖、低蛋白高糖)等能饲料饲喂2龄舌齿鲈雌鱼时,低蛋白高糖组产卵期相对延长,未出现繁殖高峰,平均每尾雌鱼的产卵数和相对产卵力均显著低于高蛋白低糖组,低蛋白高糖饲料对舌齿鲈的生殖性能产生了负面影响。推测出现这种现象的原因可能是不同种类的鱼对糖类的需求量不同,且在试验过程中糖类的添加量也存在差异,故导致糖类对动物的性腺发育影响不同。
1.4 维生素
维生素广泛参与机体的物质代谢及生长发育过程,近年来的相关研究表明,维生素与亲体的性腺发育过程密切相关,其中主要包括维生素A、维生素C和维生素E。
亲鱼饲料中缺乏维生素A时会引起性腺发育障碍[69],摄入适量的维生素A,对于提升鱼类繁殖力、满足其性腺发育的能量和营养需求具有重要作用[70];鳙Aristichthy snobilis亲鱼在摄食缺乏维生素A的饲料后,受精率和受精卵孵化率均出现显著下降[71];用110、3370 IU/g两个水平的维生素A饲料饲喂牙牙鲆,其高水平组的产卵量和受精卵孵化率均显著高于低水平组[72];以维生素A添加量为0(对照组)、10 IU/g(低添加组)和80 IU/g(高添加组)的3组配合饲料饲喂大菱鲆Scophthamus maximus亲鱼,通过比较相对产卵量、卵子上浮率、受精率、受精卵孵化率、卵子与仔鱼大小等指标发现,高添加组的繁殖性能显著优于其他两组[73];维生素的使用与其他营养素相同,存在最适添加量,当实际使用量超过最适添加量时,不仅对性腺发育无显著影响,甚至会降低其性腺发育能力,在半滑舌鳎亲鱼饲料中分别添加0、20、100 IU/g的维生素A,低含量组半滑舌鳎亲鱼的繁殖性能和卵子质量显著优于对照组和高含量组[74];同样,在虹鳟的饲料中添加适量的维生素 A (200 IU/g) 能够提高其繁殖力及仔鱼的生长速度,但过量的维生素 A(700 IU/g)则会导致胚胎死亡率升高[69]。
维生素C影响水产动物亲体的繁殖性能,且应用功能十分广泛,维生素C含量与卵的质量、受精卵孵化率及仔鱼成活率呈正相关[75-76]。在大西洋鲑Salmo salar饲料中补充维生素C能提高其卵的质量[77];在半滑舌鳎亲鱼饲料中添加0.525%的维生素C能促进亲鱼性激素的合成,提高精卵质量,促进受精卵孵化,减少仔鱼畸形率,改善亲鱼的繁殖性能[78]。维生素E又名生育酚,具有抗不育、保持细胞膜完整性的生理功能,这对胚胎的正常发育尤为重要。卵粒中维生素E的含量尤其是VE/HUFA的值与受精率、成活率呈正相关[79];在金头鲷亲鱼饲料中添加维生素E,可抑制因高含量LC-PUFA导致的产卵量、受精卵孵化率和成活率下降[11],且维生素E含量增加到190 mg/kg时,可改善其由于脂肪过量而造成的卵黄囊肥大和仔鱼存活率低的现象[80];在半滑舌鳎亲鱼饲料中分别添加0、200、1200 mg/kg的维生素E,1200 mg/kg组半滑舌鳎亲鱼产卵量、浮卵率、受精率、受精卵孵化率及初孵仔鱼长度均显著提高[81]。除此之外,维生素C和E还可影响虾蟹类性腺发育,二者能调节虾蟹类性腺中类固醇类激素物质的合成,从而调控胚胎发育和促进亲体性腺成熟,提高受精卵孵化率,改善繁殖性能,在日本对虾饲料中添加维生素C,可促进日本对虾性腺发育,且随着性腺指数的增大,维生素C在卵巢中的含量增加[66];维生素E能在罗氏沼虾Macrobrachium rosenbergii卵巢中积累,使卵子和早期幼体中保持较高的维生素E含量水平,从而改善罗氏沼虾的繁殖性能[82]。
1.5 矿物质
目前,有关矿物质对水产动物亲体性腺发育影响的研究较少。矿物质影响亲体繁殖性能的途径主要有两种:一是矿物质缺乏会导致营养不良,影响卵和胚胎发育,改变卵的生化组成和质量;二是矿物质缺乏或过量均会打破机体电解质平衡,诱导应激,从而降低亲体繁殖能力。尽管水产动物可从日常生活水环境中摄取矿物质,但其含量无法满足动物各种生理机能的需求,因此,需要在饲料中添加补充[83]。饲料中缺乏磷时,真鲷亲鱼的产卵量、浮性卵比例和受精卵孵化率显著下降,且不正常卵和畸形幼体数量显著增加[32];同样,虹鳟亲鱼饲料中锰含量低于72 mg/kg时,会导致其受精卵孵化率下降、死亡率升高[84];锌、镁、磷等矿物质的含量对大西洋鳕Gadus morhua和斑马鱼Danio rerio等水产动物的受精率、受精卵孵化率等也存在显著影响[85-86]。表3列出了饲料糖类、维生素及矿物质对鱼类性腺发育影响的部分示例,表4列出了不同营养素对虾蟹类性腺发育影响的部分示例。
表3 饲料糖类、维生素及矿物质对鱼类性腺发育的影响
Tab.3 Effects of dietary carbohydrates, vitamins and minerals on gonad development in fish
影响因子 impact factor主要来源 main source含量/(IU·g-1)content物种species影响效果action effect参考文献 reference糖类carbohydrate葡萄糖glucose—舌齿鲈Dicentrarchus labrax产卵期延长、相对产卵力降低、平均产卵数减少、未出现繁殖高峰Garcia-Rejón等[67]VA—鳙Aristichthy snobilis受精率下降、受精卵孵化率下降Santiago等[71]VA110、3370 牙鲆Paralichthys olivaceus产卵量增加、受精卵孵化率提高Furuita等[72]VA0、10、80大菱鲆Scophthamus maximus相对产卵量提高、卵子上浮率提高、受精率提高、受精卵孵化率提高、卵子数量增加、仔鱼体质量增加黄利娜等[73]VA0、20、100 半滑舌鳎Cynoglossus semilaevis繁殖性能增强、卵子质量提高肖登元等[74]维生素vitaminVA200、700 虹鳟Oncorhynchus mykiss繁殖力增强、仔鱼生长速度加快、胚胎死亡率减少Fontagné-Dicharry等[69]VC—大西洋鲑Salmo salar卵的质量改善Eskelinen[77]VC105半滑舌鳎Cynoglossus semilaevis精卵质量提高、受精卵孵化率提高、仔鱼畸形率减少肖登元等[78]VE—金头鲷Sparus aurata产卵量增加、受精卵孵化率增加、成活率提高Izquierdo等[11]VE0、4、24 半滑舌鳎Cynoglossus semilaevis产卵量增加、浮卵率提高、受精卵孵化率提高、初孵仔鱼长度增加肖登元等[81]磷P—真鲷Pagrus major产卵量增加、浮性卵比例提高、受精卵孵化率提高Watanabe等[31]矿物质mineral matter锰Mn—大西洋鲑Salmo salar受精卵孵化率下降Lall等[84]镁Mg—大西洋鳕Gadus morhua受精率增加、受精卵孵化率提高Lanes等[85]锌Zn—斑马鱼Danio rerio受精率增加、受精卵孵化率提高Salvaggio等[86]
表4 不同营养素对虾蟹类性腺发育的影响
Tab.4 Effects of different nutrients on gonad development of shrimps and crabs
影响因子 impact factor主要来源 main source含量/%content物种species影响效果action effect参考文献 reference蛋白质水平—25、30、40、50罗氏沼虾Macrobrachium rosenbergii性腺指数提高、生殖力提高Ang等[22]protein level—24~35克氏原螯虾Procambarus clarkii相对繁殖力提高Xu等[24]大豆卵磷脂soy lecithin0、5桃红对虾 Penaeus styirotris受精卵孵化率提高、精子发生加快Bray等[57]脂肪源lipid source磷脂phospholipid3、7日本对虾Penaeus japonicus卵巢发育加快Alava等[58]磷脂phospholipid0、1.90南美白对虾Litopenaeus vannamei产卵频率增加、生殖力增加Cahu等[59]花生四烯酸C20:4n60.06~0.24三疣梭子蟹Portunus trituberculatus卵巢发育加快杨印蹼[64]脂肪酸fatty acidn-3 HUFA15.60中华绒鳌蟹Eriocheir sinensis性腺发育能力下降、产卵能力下降艾春香等[65]n-3 HUFA—日本对虾Penaeus japonicus卵巢沉积率降低Alava等[66]维生素VC0、0.50日本对虾Penaeus japonicus性腺指数增加Alava等[66]vitaminVE0.0055~0.055罗氏沼虾Macrobrachium rosenbergii生殖性能增强Cavalli[82]
2 营养素对水产动物性腺发育的影响机制
水产动物的繁殖过程是其生活史中一个重要的环节,主要包括性腺发育、产卵(或排精)、受精、孵化等一系列过程,性腺发育作为其繁殖的开端,可以说是水产动物生殖的关键。目前,已有的关于营养素对水产动物性腺发育影响机制的研究较少,其途径主要包括通过对性腺发育相关基因的表达和内分泌的影响,从而调控其繁殖能力。
(1)分子调控机制。在鱼类性腺发育的过程中存在着一系列过程复杂的分子调控机制,其中,DMRT家族的dmy基因是鱼类性腺发育史中首个被确认的性别决定基因,存在于青鳉的Y染色体上,其在性腺发育过程中主要控制精巢的分化[87];斑马鱼体中存在着可能调控参与amh基因表达的ff1d基因,ff1d基因与sf-1同源,除了在精巢支持细胞表达外,在间质细胞中也有较高表达,amh基因主要参与精细胞增殖与分化,在精巢支持细胞上有较高的表达[88-90];与斜带石斑鱼Epinephelus coioides性反转有关的基因中,sox3基因调控其卵子的发生过程[91], 蜂巢石斑鱼Epinephelus merra性逆转的过程中,foxl2基因的下调与其卵巢的降解有关,除与性别发育有关的基因外,还有一些基因与生殖细胞的发育过程有关,在使用dnd morpholino干扰dnd基因的表达后,PGC的迁移能力会出现相应的下降[92];同时,在斑马鱼和狼鲈Dicentrarchus labrax等多种鱼类的研究中发现,鱼类的性别分化由多个基因调控,调控机制呈现复杂多样化[93]。已有研究表明,对哺乳动物而言,很多营养感应元件存在于繁殖轴中,主要包括胰岛素因子、脂肪因子、葡萄糖转运子、mTOR活化因子和腺苷酸活化蛋白激酶等,通过这些感应元件可以将机体的营养状况与繁殖性能联系在一起[94]。但在水产动物中,诸如此类的研究报道较少,目前,仅报道了雌性真鲷卵巢的活力和脑-垂体-性腺轴基因(GnRH-R、lhβ、fshβ)的表达量相关[95];在斑马鱼的cyp19基因中,cyp19a1基因直接参与卵巢发育过程,cyp19a2基因可能通过对下丘脑-垂体-性腺轴的影响参与性别分化[96];对野生大马哈鱼Oncorhynchus keta的研究发现,在性腺成熟阶段,亲鱼垂体中fshβ和lhβ的mRNA表达水平显著上升,且IGF-I作为垂体-性腺轴的刺激信号,其表达明显升高[97];同时,AMPK磷酸化后,也能影响IGF-I和LH的分泌,从而对卵巢发育产生一定影响[98]。
(2)内分泌调控机制。除受基因调控外,鱼类的性腺发育过程还受内分泌的影响,其中HPG轴(脑-垂体-性腺轴)起主导作用,下丘脑分泌并释放促性腺激素释放激素,促进垂体合成促性腺激素,促性腺激素通过血液到达性腺,促进性腺生成性激素,完成对性腺发育的调控[93]。促性腺激素主要包括促黄体生成素和促卵泡激素,其分别受促黄体生成素释放激素和促卵泡激素释放激素的调控[99],促性腺激素除可单独发挥作用外,其相互间既有拮抗作用又有协同作用。睾酮有促进雄性生殖器官发育及维持雄性第二性征的动物功能,可促进精子的发生和促进精母细胞转化为精子细胞,还可调节促性腺激素的分泌,作为一种重要的性类固醇激素,其与水产动物的繁殖密切相关,在吉富罗非鱼饲料中单独添加维生素E时,其血清中的睾酮含量显著升高,在饲料中添加硒后,睾酮的含量会随着维生素E的添加而出现升高,且只有维生素E的添加量超过90 mg/kg时,维生素E和硒才会对睾酮的分泌过程存在交互作用[100]。
3 存在问题及展望
3.1 存在问题
随着水产产业大规模集约化生产的发展,水产动物相关营养学研究在过去十年里已取得了较大的进展,但水产动物的营养性促性腺研究仍存在以下主要问题:
(1) 研究广度有限。目前,通过营养调控手段增强养殖水产动物繁殖性能的研究较少,研究水平尚处于较为初级的阶段。多数研究结果只针对某一特定营养素或非营养性添加剂对养殖动物繁殖前期或繁殖生理期内的强化作用效果。这主要是亲体营养研究周期较长、评价指标不完善、研究成本较高等原因造成的。
(2) 研究深度不足。缺少对于营养调控产生机制的研究,从已有的研究结果来看,以作用效果为评价指标的情况较多,基本未针对其产生效果原因的深入探讨,这可能是亲体研究复杂性造成的。
(3) 研究对象单一。目前的研究多集中在少数几种养殖动物中,研究并不具有广泛的适用性。针对典型物种繁殖性能的营养调控技术也较为匮乏,例如刺参种参营养调控的研究。
3.2 展望
开展水产动物营养性促性腺发育相关研究,对于科学合理配制亲体饲料、培育优质亲体和提高幼体成活率等具有重要意义。根据实际情况,下一步的研究可从以下几个方面为切入点。
(1) 新型促性腺添加剂的开发与使用。以往的研究和应用多以单一营养素或促繁剂的使用为基础,研究单一因素对水产动物繁殖性能的影响。新型促性腺添加剂是基于多因素协同的复合制剂,在未来发展中应加大研发力度,开发各类新型促性腺营养添加剂,并提高实际生产综合应用效果及成本。
(2) 水产动物繁殖性能营养调控机制。目前,关于水产动物繁殖性能的营养调控研究仍存在研究深度不足等问题,尤其是对于重要的营养素来说,缺少对于其作用机制的深入研究。今后应结合水产动物繁殖生理机制的研究,进一步从分子水平开展多层次、多水平、多途径交叉综合研究,揭示营养因素影响水产动物繁殖力的作用机制。
(3) 典型水产动物繁殖性能的营养调控技术。不同的水产养殖种类,其繁殖动物学的差异较大,针对不同繁殖动物习性的水产动物,深入研究典型水产动物繁殖性能的营养调控技术及营养调控策略也是未来研究的重要方向。
[1] 桂建芳,张晓娟.新时代水产养殖模式的变革[J].长江技术经济,2018(1):25-29.
[2] 刘永新,李梦龙,方辉,等.我国水产种业的发展现状与展望[J].水产学杂志,2018,31(2):50-56.
[3] 艾春香,李少菁,王桂忠,等.虾蟹类亲体生殖营养需求研究的进展[J].台湾海峡,2003,22(2):254-261.
[4] Harrison K E.Broodstock nutrition and maturation diets[M]//D’Abramo L R,Conklin D E,Akiyama D M.Crustacean Nutrition[M].Baton Rouge:The World Aquaculture Society,1997:390-408.
[5] Benzie J A H.A review of the effect of genetics and environment on the maturation and larval quality of the giant tiger prawn Penaeus monodon[J].Aquaculture,1997,155(1-4):69-85.
[6] 季文娟.高度不饱和脂肪酸对中国对虾亲虾的产卵和卵质的影响[J].水产学报,1998,22(3):240-246.
[7] Sangha R S,Chávez-Sánchez M S,Martínez-Palacios C A,et al.Effect of supplementing ascorbic acid (L-ascorbyl-2-polyphosphate) in broodstock diet of the white shrimp Litopenaeus vannamei[J].Journal of the World Aquaculture Society,2000,31(1):137-144.
[8] Millamena O M,Quinitio E.The effects of diets on reproductive performance of eyestalk ablated and intact mud crab Scylla serrata[J].Aquaculture,2000,181(1-2):81-90.
[9] Wouters R,Piguave X,Bastidas L,et al.Ovarian maturation and haemolymphatic vitellogenin concentration of Pacific white shrimp Litopenaeus vannamei (Boone) fed increasing levels of total dietary lipids and HUFA[J].Aquaculture Research,2001,32(7):573-582.
[10] 于建华,李树国.虾蟹类营养繁殖研究进展[J].水产科技,2010(3):12-15.
[11] Izquierdo M S,Fernández-Palacios H,Tacon A G J.Effect of broodstock nutrition on reproductive performance of fish[J].Aquaculture,2001,197(1-4):25-42.
[12] Watanabe T,Vassallo-Agius R.Broodstock nutrition research on marine finfish in Japan[J].Aquaculture,2003,227(1-4):35-61.
[13] Martínez G,Pérez H.Effect of different temperature regimes on reproductive conditioning in the scallop Argopecten purpuratus[J].Aquaculture,2003,228(1-4):153-167.
[14] Heasman M P,O’Connor W A,Frazer A W.Temperature and nutrition as factors in conditioning broodstock of the commercial scallop Pecten fumatus Reeve[J].Aquaculture,1996,143(1):75-90.
[15] 谭杰,李凤辉,陈四清,等.不同培育水温和饲料对刺参人工促熟效果的影响[J].渔业科学进展,2020,41(1):96-103.
[16] Martínez G,Aguilera C,Mettifogo L.Interactive effects of diet and temperature on reproductive conditioning of Argopecten purpuratus broodstock[J].Aquaculture,2000,183(1-2):149-159.
[17] 谭青松,吴凡,杜浩,等.饲料营养对亲鱼生殖性能的影响研究进展[J].水生态学杂志,2016,37(4):1-9.
[18] 李瑾.鱼类蛋白质与氨基酸的营养需要[J].动物科学与动物医学,2002,19(2):46-47.
[19] Gunasekera R M,Shim K F,Lam T J.Effect of dietary protein level on puberty,oocyte growth and egg chemical composition in the tilapia,Oreochromis niloticus (L.)[J].Aquaculture,1995,134(1-2):169-183.
[20] Siddiqui A Q,A1-Hafedh Y S,Ali S A.Effect of dietary protein level on the reproductive performance of Nile tilapia,Oreochromis niloticus (L.)[J].Aquaculture Research,1998,29(5):349-358.
[21] El-Sayed A F M,Mansour C R,Ezzat A A.Effects of dietary protein level on spawning performance of Nile tilapia (Oreochromis niloticus) broodstock reared at different water salinities[J].Aquaculture,2003,220(1-4):619-632.
[22] Ang K J,Lee Y M,Law A T.Protein requirements for Macrobrachium rosenbergii[C]//Asian Fisheries Society.Third Asian Fisheries Forum.Singapore:Asian Fisheries Society,1992:26-30.
[23] 何志刚,Chong S C,Ishak S D,等.饲料中不同蛋白水平对雌剑尾鱼繁殖力的影响[J].饲料与畜牧,2015(3):18-23.
[24] Xu Weina,Liu Wenbin,Shen Meifang,et al.Effect of different dietary protein and lipid levels on growth performance,body composition of juvenile red swamp crayfish (Procambarus clarkii)[J].Aquaculture International,2013,21(3):687-697.
[25] Palacios E,Ibarra A M,Racotta I S.Tissue biochemical composition in relation to multiple spawning in wild and pond-reared Penaeus vannamei broodstock[J].Aquaculture,2000,185(3-4):353-371.
[26] 田华梅,赵云龙,李晶晶,等.中华绒螯蟹胚胎发育过程中主要生化成分的变化[J].动物学杂志,2002,37(5):18-21.
[27] Chong A S C,Ishak S D,Osman Z,et al.Effect of dietary protein level on the reproductive performance of female swordtails Xiphophorus helleri (Poeciliidae)[J].Aquaculture,2004,234(1-4):381-392.
[28] Afzal Khan M,Jafri A K,Chadha N K.Effects of varying dietary protein levels on growth,reproductive performance,body and egg composition of rohu,Labeo rohita (Hamilton)[J].Aquaculture Nutrition,2005,11(1):11-17.
[29] Abidin M Z,Hashim R,Chien A C S.Influence of dietary protein levels on growth and egg quality in broodstock female bagrid catfish (Mystus nemurus Cuv. & Val.)[J].Aquaculture Research,2006,37(4):416-418.
[30] Masrizal Z,Udin M,Zein U,et al.Effect of energy,lipid and protein content in broodstock diets on spawning fecundity and eggs quality of giant gourami (Ospheronemus gouramy Lac)[J].Pakistan Journal of Nutrition,2015,14(7):412-416.
[31] Watanabe T,Arakawa T,Kitajima C,et al.Effect of nutritional quality of broodstock diets on reproduction of red sea bream[J].Nippon Suisan Gakkaishi,1984,50(3):495-501.
[32] Fernández-Palacios H,Izquierdo M,Robaina L,et al.The effect of dietary protein and lipid from squid and fish meals on egg quality of broodstock for gilthead seabream (Sparus aurata)[J].Aquaculture,1997,148(2-3):233-246.
[33] Watanabe T.Effect of broodstock diets on reproduction of fish[C]//Advances in Tropical Aquaculture,Workshop at Tahiti,French Polynesia,1989.
[34] Santiago C B,Aldaba M B,Laron M A,et al.Reproductive performance and growth of Nile tilapia (Oreochromis niloticus) broodstock fed diets containing Leucaena leucocephala leaf meal[J].Aquaculture,1988,70(1-2):53-61.
[35] González F M L,Velazquez M P,Bringas L,et al.Fishmeal replacement by plant proteins in diets of different protein levels for Nile tilapia (Oreochromis niloticus) culture[J].The Israeli journal of aquaculture,2011,566:1-8.
[36] Murai T,Ogata H,Hirasawa Y,et al.Portal absorption and hepatic uptake of amino acids in rainbow trout force-fed complete diets containing casein or crystalline amino acids[J].Nippon Suisan Gakkaishi,1987,53(10):1847-1859.
[37] Broty T.Classification of biological structures[M]//Brody T.Nutritional Biochemistry.2nd ed.San Diego,CA:Academic Press,1999:1-56.
[38] Akiyama T,Shiraishi M,Yamamoto T,et al.Effect of dietary tryptophan on maturation of ayu Plecoglossus altivelis[J].Fisheries Science,1996,62(5):776-782.
[39] Harel M,Tandler A,Kissil G W,et al.The role of broodstock dietary protein in vitellogenin synthesis and oocyte development,and its effects on reproductive performance and egg quality in gilthead sea bream Sparus aurata[C]//Proceedings of the 5th International Symposium on the Reproductive Physiology of Fish.Austin,Texas,USA:Fish Symposium’95,Austin,1995.
[40] Shim K F,Lam T J,Landesman L.Effect of deletion of amino acid from supplement on the growth and reproductive performance of the dwarf gourami,Colisa lalia (Hamilton)[J].J Aquaculture Tropics,1990,5:149-154.
[41] Matsunari H,Hamada K,Mushiake K,et al.Effects of taurine levels in broodstock diet on reproductive performance of yellowtail Seriola quinqueradiata[J].Fisheries Science,2006,72(5):955-960.
[42] Al-Feky S S A,El-Sayed A F M,Ezzat A A.Dietary taurine improves reproductive performance of Nile tilapia (Oreochromis niloticus) broodstock[J].Aquaculture Nutrition,2016,22(2):392-399.
[43] Higuchi M,Celino F T,Tamai A,et al.The synthesis and role of taurine in the Japanese eel testis[J].Amino Acids,2012,43(2):773-781.
[44] Lewis J D,Saperas N,Song Yue,et al.Histone H1 and the origin of protamines[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(12):4148-4152.
[45] Zakeri M,Marammazi J G,Kochanian P,et al.Effects of protein and lipid concentrations in broodstock diets on growth,spawning performance and egg quality of yellowfin sea bream (Acanthopagrus latus)[J].Aquaculture,2009,295(1-2):99-105.
[46] Ling S,Hashim R,Kolkovski S,et al.Effect of varying dietary lipid and protein levels on growth and reproductive performance of female swordtails Xiphophorus helleri (Poeciliidae)[J].Aquaculture Research,2006,37(13):1267-1275.
[47] Lee R F,Walker A.Lipovitellin and lipid droplet accumulation in oocytes during ovarian maturation in the blue crab,Callinectes sapidus[J].Journal of Experimental Zoology,1995,271(5):401-412.
[48] 成永旭,堵南山,赖伟.中华绒螯蟹卵巢和胚胎发育期脂类在卵黄物质中存在的形态及其变化[J].动物学杂志,1999,34(1):51-56.
[49] El-Sayed A F M,Mansour C R,Ezzat A A.Effects of dietary lipid source on spawning performance of Nile tilapia (Oreochromis niloticus) broodstock reared at different water salinities[J].Aquaculture,2005,248(1-4):187-196.
[50] Liang M Q,Lu Q K,Qian C,et al.Effects of dietary n-3 to n-6 fatty acid ratios on spawning performance and larval quality in tongue sole Cynoglossus semilaevis[J].Aquaculture Nutrition,2014,20(1):79-89.
[51] 吕庆凯,梁萌青,郑珂珂,等.饲料中添加不同脂肪源对半滑舌鳎亲鱼繁殖性能和仔鱼质量的影响[J].渔业科学进展,2012,33(6):44-52.
[52] Gehring W R.Maturational changes in the ovarian lipid spectrum of the pink shrimp,Penaeus duorarum duorarum Burkenroad[J].Comparative Biochemistry and Physiology Part A:Physiology,1974,49(3):511-524.
[53] Teshima S,Kanazawa A.Variation in lipid composition during the ovarian maturation of the prawn[J].Nippon Suisan Gakkaishi,1983,49(6):957-962.
[54] Mourente G,Rodriguez A.Variation in the lipid content of wild-caught females of the marine shrimp Penaeus kerathurus during sexual maturation[J].Marine Biology,1991,110(1):21-28.
[55] Ravid T,Tietz A,Khayat M,et al.Lipid accumulation in the ovaries of a marine shrimp Penaeus semisulcatus (De Haan)[J].Journal of Experimental Biology,1999,202(13):1819-1829.
[56] Chansela P,Goto-Inoue N,Zaima N,et al.Composition and localization of lipids in Penaeus merguiensis ovaries during the ovarian maturation cycle as revealed by imaging mass spectrometry[J].PLoS One,2012,7(3):e33154.
[57] Bray W A,Lawrence A L,Lester L J.Reproduction of eyestalk-ablated Penaeus stylirostris fed various levels of total dietary lipid[J].Journal of World Aquaculture Society,1990,21(1):41-52.
[58] Alava V R,Kanazawa A,Teshima S I,et al.Effect of dietary phospholipids and n-3 highly unsaturated fatty acids on ovarian development of kuruma prawn[J].Nippon Suisan Gakkaishi,1993,59(2):345-351.
[59] Cahu C L,Guillaume J C,Stéphan G,et al.Influence of phospholipid and highly unsaturated fatty acids on spawning rate and egg and tissue composition in Penaeus vannamei fed semi-purified diets[J].Aquaculture,1994,126(1-2):159-170.
[60] Furuita H,Tanaka H,Yamamoto T,et al.Effects of n-3 HUFA levels in broodstock diet on the reproductive performance and egg and larval quality of the Japanese flounder,Paralichthys olivaceus[J].Aquaculture,2000,187(3-4):387-398.
[61] Luo Lin,Ai Lichuan,Li Tieliang,et al.The impact of dietary DHA/EPA ratio on spawning performance,egg and offspring quality in Siberian sturgeon (Acipenser baeri)[J].Aquaculture,2015,437:140-145.
[62] Mazorra C,Bruce M,Bell J G,et al.Dietary lipid enhancement of broodstock reproductive performance and egg and larval quality in Atlantic halibut (Hippoglossus hippoglossus)[J].Aquaculture,2003,227(1-4):21-33.
[63] Harrison K E.The role of nutrition in maturation,reproduction and embryonic development of decapod crustaceans:a review[J].Journal of Shellfish Research,1990(9):1-28.
[64] 杨印蹼.饲料中添加花生四烯酸对三疣梭子蟹卵巢发育及成蟹品质的影响[D].上海:上海海洋大学,2013.
[65] 艾春香,陈立侨,温小波,等.维生素E、C和HUFA交互作用对中华绒螯蟹生殖性能的影响[J].水产学报,2002,26(6):533-541.
[66] Alava V R,Kanazawa A,Teshima S I,et al.Effects of dietary vitamins A,E and C on the ovarian development of Penaeus japonicus[J].Nippon Suisan Gakkaishi,1993,59(7):1235-1241.
[67] Garcia-Rejón L,Sanchez-Muros M J,Cerdá J,et al.Fructose 1,6 bisphosphatase activity in liver and gonads of sea bass (Dicentrarchus labrax).Influence of diet composition and stage of the reproductive cycle[J].Fish Physiology and Biochemistry,1997,16(2):93-105.
[68] Cerdá J,Carrillo M,Zanuy S,et al.Influence of nutritional composition of diet on sea bass,Dicentrarchus labrax L.,reproductive performance and egg and larval quality[J].Aquaculture,1994,128(3-4):345-361.
[69] Fontagné-Dicharry S,Lataillade E,Surget A,et al.Effects of dietary vitamin A on broodstock performance,egg quality,early growth and retinoid nuclear receptor expression in rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2010,303(1-4):40-49.
[70] Furuita H,Tanaka H,Yamamoto T,et al.Supplemental effect of vitamin A in diet on the reproductive performance and egg quality of the Japanese flounder Paralichthys olivaceus (T & S)[J].Aquaculture Research,2003,34(6):461-468.
[71] Santiago C B,Gonzal A C.Effect of prepared diet and vitamins A,E and C supplementation on the reproductive performance of cage-reared bighead carp Aristichthys nobilis (Richardson)[J].Journal of Applied Ichthyology,2000,16(1):8-13.
[72] Furuita H,Tanaka H,Yamamoto T,et al.Effects of high dose of vitamin A on reproduction and egg quality of Japanese flounder Paralichthys olivaceus[J].Fisheries Science,2001,67(4):606-613.
[73] 黄利娜,梁萌青,张海涛,等.饲料中添加不同水平维生素A对大菱鲆亲鱼繁殖性能的影响[J].渔业科学进展,2013,34(4):62-70.
[74] 肖登元,梁萌青,王新星,等.饲料中不同水平维生素A对半滑舌鳎亲鱼繁殖性能及后代质量的影响[J].渔业科学进展,2014,35(3):50-59.
[75] Sandnes K,Ulgenes Y,Braekkan O R,et al.The effect of ascorbic acid supplementation in broodstock feed on reproduction of rainbow trout (Salmo gairdneri)[J].Aquaculture,1984,43(1-3):167-177.
[76] Furuita H,Unuma T,Nomura K,et al.Vitamin contents of eggs that produce larvae showing a high survival rate in the Japanese eel Anguilla japonica[J].Aquaculture Research,2009,40(11):1270-1278.
[77] Eskelinen P.Effects of different diets on egg production and egg quality of Atlantic salmon (Salmo salar L.)[J].Aquaculture,1989,79(1-4):275-281.
[78] 肖登元,梁萌青,郑珂珂,等.维生素C对半滑舌鳎亲鱼繁殖性能及后代质量的影响[J].动物营养学报,2014,26(9):2664-2674.
[79] Furuita H,Ohta H,Unuma T,et al.Biochemical composition of eggs in relation to egg quality in the Japanese eel,Anguilla japonica[J].Fish Physiology and Biochemistry,2003,29(1):37-46.
[80] Fernández-Palacios H,Izquierdo M,González M,et al.Combined effect of dietary α-copherol and n-3 HUFA on egg quality of gilthead seabream (Sparus auratus) broodstock[J].Aquaculture,1998,161:475-476.
[81] 肖登元,梁萌青,王新星,等.饲料中添加不同水平的维生素E对半滑舌鳎(Cynoglossus semilaevis)亲鱼繁殖性能及后代质量的影响[J].渔业科学进展,2015,36(2):125-132.
[82] Cavalli R O.Effect of dietary supplementation of vitamins C and E on maternal performance and larval quality of the prawn Macrobrachium rosenbergii[J].Aquaculture,2003,227(1-4):131-146.
[83] 麦康森.水产动物营养与饲料学[M].2版.北京:中国农业出版社,2011.
[84] Lall S P,Hines J A.Manganese bioavailability and requirements of Atlantic salmon (Salmo salar) and brook trout (Salvelinus fontinalis)[C]//Satellite Symposium on Assessment by Physiological and Biochemical Methods of Nutrient Availability in Fish.Brighton,1985:17.
[85] Lanes C F C,Bizuayehu T T,Bolla S,et al.Biochemical composition and performance of Atlantic cod (Gadus morhua L.) eggs and larvae obtained from farmed and wild broodstocks[J].Aquaculture,2012,324-325:267-275.
[86] Salvaggio A,Marino F,Albano M,et al.Toxic effects of zinc choride on the bone development in Danio rerio (Hamilton,1822)[J].Frontiers in Physiology,2016,7:153.
[87] Nagahama Y.The functional morphology of teleost gonads[M]//Hoar W S,Randall D J,Donaldson E M.Fish Physiology.New York:Academic Press,1983:223-275.
[88] 陈戟,胡炜,朱作言.鱼类生殖发育调控研究进展[J].科学通报,2013,58(2):103-114.
[89] Von Hofsten J,Larsson A,Olsson P E.Novel steroidogenic factor-1 homolog (ff1d) is coexpressed with anti-Müllerian hormone (AMH) in zebrafish[J].Developmental Dynamics,2005,233(2):595-604.
[90] Sawyer S J,Gerstner K A,Callard G V.Real-time PCR analysis of cytochrome P450 aromatase expression in zebrafish:gene specific tissue distribution,sex differences,developmental programming,and estrogen regulation[J].General and Comparative Endocrinology,2006,147(2):108-117.
[91] Zhou Li,Yao Bo,Xia Wei,et al.EST-based identification of genes expressed in the hypothalamus of male orange-spotted grouper (Epinephelus coioides)[J].Aquaculture,2006,256(1-4):129-139.
[92] Alam M A,Kobayashi Y,Horiguchi R,et al.Molecular cloning and quantitative expression of sexually dimorphic markers Dmrt1 and Foxl2 during female-to-male sex change in Epinephelus merra[J].General and Comparative Endocrinology,2008,157(1):75-85.
[93] 梁冬冬.牙鲆性类固醇激素合成重要基因表达调控的初步研究[D].北京:中国科学院大学(中国科学院海洋研究所),2017.
[94] Dupont J,Reverchon M,Bertoldo M J,et al.Nutritional signals and reproduction[J].Molecular and Cellular Endocrinology,2014,382(1):527-537.
[95] Okuzawa K,Gen K.High water temperature impairs ovarian activity and gene expression in the brain-pituitary-gonadal axis in female red seabream during the spawning season[J].General and Comparative Endocrinology,2013,194:24-30.
[96] Rodríguez-Marí A,Yan Yilin,BreMiller R A,et al.Characterization and expression pattern of zebrafish anti-Müllerian hormone(amh) relative to sox9a,sox9b,and cyp19a1a,during gonad development[J].Gene Expression Patterns,2005,5(5):655-667.
[97] Onuma T A,Makino K,Katsumata H,et al.Changes in the plasma levels of insulin-like growth factor-I from the onset of spawning migration through upstream migration in chum salmon[J].General and Comparative Endocrinology,2010,165(2):237-243.
[98] Bertoldo M J,Faure M,Dupont J,et al.AMPK:a master energy regulator for gonadal function[J].Frontiers in Neuroscience,2015,9:235.
[99] Weidinger G,Stebler J,Slanchev K,et al.Dead end,a novel vertebrate germ plasm component,is required for zebrafish primordial germ cell migration and survival[J].Current Biology,2003,13(16):1429-1434.
[100] 蒋焕超.VE与硒的交互作用对吉富罗非鱼生长、生殖、抗氧化及免疫力的影响[D].南宁:广西大学,2012.