缢蛏Sinonovacula constricta俗称蛏子,是中国重要的经济贝类, 生活于潮间带中、下区或潮下带的浅海沙滩或泥沙滩,滤食水中有机悬浮物,营埋栖生活。缢蛏在中国北自辽宁、山东,南至广东、福建都有分布[1]。缢蛏肉鲜嫩可口、营养丰富并具有一定的药物功效,不仅具有高蛋白质、低脂肪的优点,还富含碘、硒、锌、锰等多种微量元素,具有健脑益智、清热解毒的作用[2]。由于中国生产地域限制,缢蛏在沿海地区的销售以鲜活为主,在内陆地区的销售,只能依靠蛏肉罐头、蛏干、冷冻蛏肉制品[3]等形式,其食用口感和品质大打折扣,并影响缢蛏的经济价值,限制了缢蛏消费市场的推广。缢蛏的采捕时间相对集中,蛏肉组织较松软、微生物较多,捕捞后新鲜度会很快下降,腐败变质并死亡,给鲜销储运带来不便。对长途运输的负面影响,导致销售半径较小、价格下跌,这在一定程度上制约了缢蛏养殖业的进一步发展。缢蛏的低温保活可为长途运输提供有利条件并能延长产品货架期,保持其色泽美观和营养价值,因此,研究缢蛏的低温保活具有重要的商业意义及现实意义。
在保活储运操作过程中必须注意的关键因素,包括温度、盐度、溶氧、pH、氨氮、污染物等。当重要的环境因素发生变化时,缢蛏体内活性氧代谢及抗氧化系统的运转会被显著影响,导致超氧阴离子等自由基的抑制与产生发生紊乱,使缢蛏产生应激反应。若环境的变化导致缢蛏长期处于应激状态就会使机体抗氧化系统产生不可逆的损伤,影响缢蛏代谢、生长甚至死亡[4]。刘浩明等[5]研究发现,不同浓度Cu2+胁迫下,96 h内缢蛏稚贝抗氧化酶(CAT、SOD)活力与沙滤海水对照组相比发生显著的变化;祁营利等[6]对缢蛏个体进行控温、控湿、清洗对比试验,结果表明,0 ℃时保活效果最好,存活率最高且失重率和开壳率较低,清洗组效果不如带沙组,控湿组的保活效果比不控湿组更高。在活运过程中,温度作为最重要的环境因子之一,与缢蛏的抗氧化能力及代谢功能有密切联系。在一定温度范围内,酶的催化反应速率随着温度的升高而加快,在达到酶的最适催化温度下,酶活力达到最大值,超过酶的最适催化温度后,酶催化反应速度随着温度的升高而降低甚至因高温导致酶失活。温度的急剧变化能直接影响水生生物体内抗氧化系统[5],根本原因就是温度的改变导致机体耗氧量增加[7],造成机体自由基代谢紊乱,自由基在体内大量积累,从而损害机体细胞和组织正常的生理机能和免疫防御能力,进而提高对病原生物的易感性。虽然对贝类保活研究已逐渐受到关注,但目前有关环境因素变化对贝类抗氧化系统影响方面的研究还鲜有报道。为此,本研究中进行了不同冷胁迫方式对保活期中贝类抗氧化系统的影响研究,旨在为活体贝类在养殖、运输和销售过程中的酶活性保持提供理论依据和数据参考。
1 材料与方法
1.1 材料
试验用缢蛏于2018年12月购自上海市浦东新区南汇新城镇芦潮港集贸市场,平均壳长为59 mm,壳宽为19 mm,体质量为(12±0.5)g,共5 kg。选择有活力、双壳完整的个体作为试验对象。
试验仪器主要有低温离心机(H-2050R,湖南湘仪离心机仪器有限公司)、恒温恒湿箱(BPS-100CA,上海一恒科学仪器有限公司)、内切式匀浆机(FSH-2A,江苏金怡仪器科技有限公司)、紫外可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司)等。
1.2 方法
1.2.1 试验设计 首先将海水晶按比例溶解于去离子水中,配制成盐度为20.0±0.5的人工海水,并利用增氧泵(3 W)在暂养期间持续充气,溶氧量>4 mg/L。将5 kg带有泥沙的缢蛏,用人工海水清洗、除去缢蛏体表泥沙等杂物后将贝体平铺(一层)浸于存有人工海水的塑料箱(520 mm×350 mm×285 mm)中净化暂养,贝水质量比为1∶5。缢蛏的适宜生长温度范围为15~21 ℃,冬天生长温度为 15 ℃,最适宜温度为21 ℃,本试验中将水温维持在(20±1)℃,每隔3 h换一次水,暂养时间12 h。将暂养净化后的缢蛏从塑料箱中脱水捞出并分为3组,每组100枚,分别平铺(一层)在覆有吸水海绵的3个小尺寸塑料箱(400 mm×300 mm×120 mm)中,并将浸足人工海水的双层纱布覆于贝体之上,为保证箱体内湿度,每隔24 h向纱布上喷淋人工海水进行补水作业。
将3组缢蛏放入降温装置中,分别采用直接降温、梯度降温及线性降温的冷胁迫方式。其中,梯度降温的处理方式为调节恒温恒湿箱,从(20.0±0.5)℃开始降温,以5 ℃/h的速率降至(15.0±0.5)℃,并在此温度下保持90 min后,再次以5 ℃/h的速率降温至(10.0±0.5)℃,并在此温度下保持90 min,最后再以5 ℃/h的速率降温至(4.0±0.5)℃后,放至4 ℃冷库中开始无水保活过程。线性降温的处理方式为调节恒温恒湿箱,以5 ℃/h的降温速率从(20.0±0.5)℃降至(4.0±0.5)℃后,放至4 ℃冷库中开始无水保活过程。直接降温的处理方式为直接将缢蛏放至4 ℃的冷库中,开始无水保活过程。其中,梯度降温和线性降温方式的冷胁迫时间皆为3 h。
根据以往试验经验,无水保活第8天的缢蛏成活率已低于50%,继续测量各指标已无现实意义,故本试验中测试时间截止到保活第8天。
1.2.2 组织样品采集及粗酶提取液制备 试验在降温前、保活第0、2、4、6、8天的时间点上分别取样,每组随机取9只,取其组织块在冰冷的生理盐水中漂洗,分别取出消化腺和鳃组织作为混合样品,用吸水纸拭干表面水分,用精量天平称重后,放入匀浆管中。按样品质量与体积为1∶9(g∶mL)的比例加入0.86%的生理盐水于匀浆管中,冰浴条件下匀浆,转速为7000~8000 r/min,10 s/次,间隙30 s,连续3~5次。将制备好的10%匀浆液用普通离心机或低温低速离心机(7000 r/min)离心20 min,取上清液用于酶活力测定。
1.2.3 抗氧化酶活力的测定 取混合样品上清液用于测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性,以及还原性谷胱甘肽(GSH)、丙二醛(MDA)、过氧化氢(H2O2)含量。样品上清液总蛋白含量的测定采用BCA法,CAT测定采用紫外比色法,SOD测定采用羟胺法,MDA测定采用TBA法,POD测定采用比色法,H2O2和GSH测定采用分光光度法。均使用南京建成生物工程研究所试剂盒,测定原理、试验步骤和计算方法均参照试剂盒说明书。
1.3 数据处理
采用SPSS 19.0软件对试验结果进行单因素方差分析(One-way ANOVA)及Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同冷胁迫处理组CAT和SOD酶活力的变化
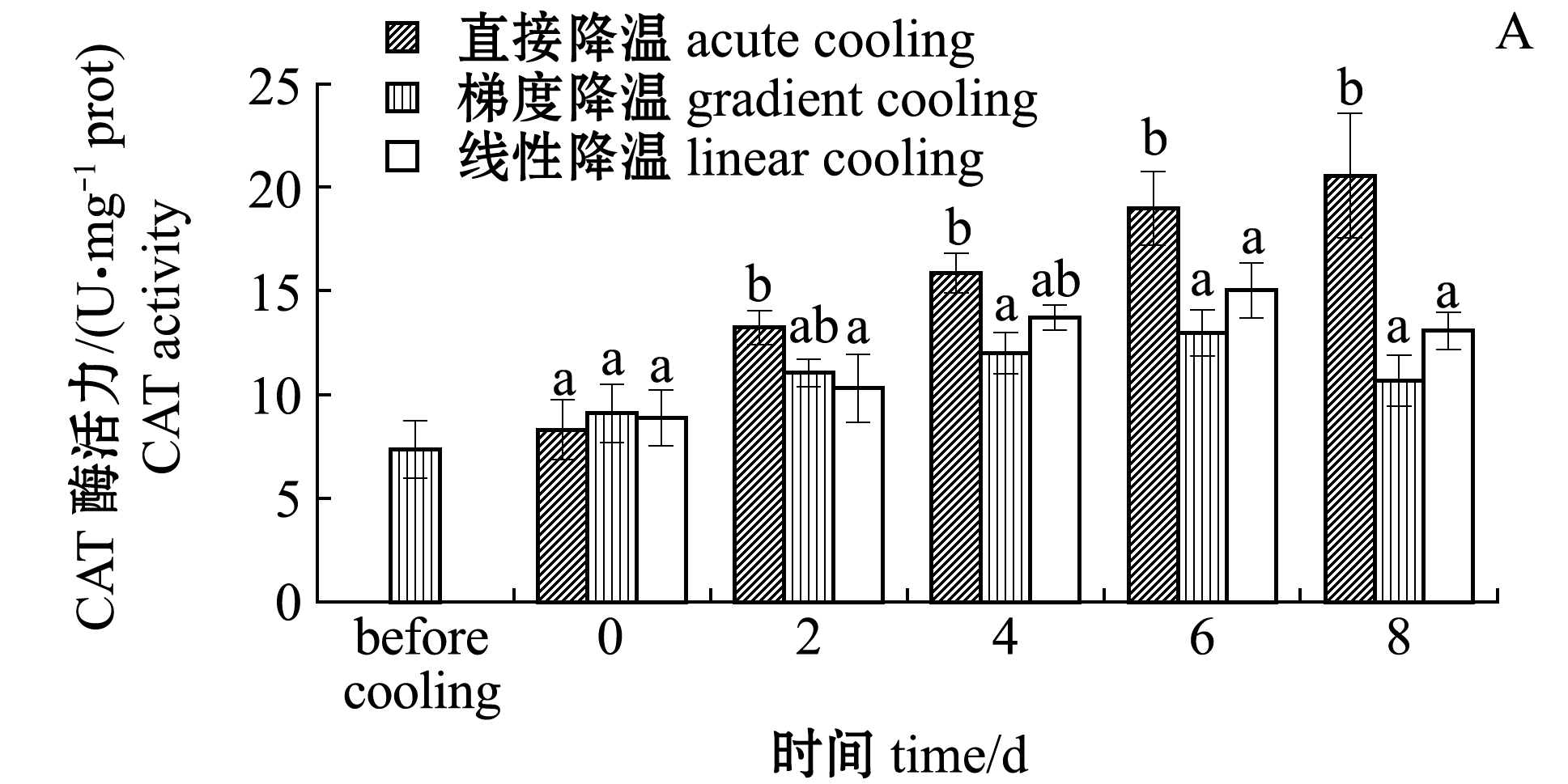
从图1-A可见:不同冷胁迫组缢蛏消化腺和鳃组织混合样中的CAT活力随保活时间的延长总体呈现逐渐上升趋势;相比降温前,直接、梯度和线性降温组的CAT活力在降温后第0天分别增加12.9%、23.7%、20.7%;梯度降温组和线性降温组在保活第6天时达到峰值,分别为12.99、15.05 U/mg,较降温前CAT活力增加76%、104%,第8天时分别下降到10.67、13.09 U/mg;直接降温组的CAT活力在第6、8天时显著高于其他两组(P<0.05),并在第8天时,CAT活力达到最大,为20.57 U/mg,分别较梯度降温组和线性降温组增加92%和57%;在保活期内,梯度降温组和线性降温组的CAT活力无显著性差异(P >0.05)。
从图1-B可见:不同冷胁迫组缢蛏的SOD活力在降温后随保活时间的延长总体呈波动上升趋势;相比降温前,直接、梯度和线性降温组的SOD活力在降温后第0天分别增加46.9%、36.4%和43.9%;在保活第8天时,直接降温组、梯度降温组和线性降温组的SOD活力均达到最大,分别为42.01、38.13、38.81 U/mg,直接降温组在保活第6天时SOD活力显著高于其他两组(P<0.05);在保活期内,线性降温组和梯度降温组的SOD活力无显著性差异(P>0.05)。
2.2 不同冷胁迫处理组MDA和POD含量的变化
从图2-A可见:直接降温组缢蛏的MDA含量随保活时间的延长总体呈上升趋势;梯度降温组和线性降温组在保活0~4 d时,MDA含量与降温前相比变化并不明显,其中保活第0天,梯度和线性降温组的MDA含量较降温前仅增长了5.1%和10.6%;直接降温组、梯度降温组和线性降温组的MDA含量在保活第8天时均达到最高值,分别为14.73、11.80、10.93 nmol/mg;直接降温组在保活第2、4天时的MDA含量显著高于其他两组(P<0.05);在保活期内,梯度降温组与线性降温组的MDA含量变化并无显著性差异(P>0.05)。

注:标有不同字母者表示同一时间下不同处理组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters at same time are significantly different in the different groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia
图1 不同冷胁迫方式下CAT和SOD酶活力的变化
Fig.1 Catalase(CAT) and superoxide dismutase(SOD) activities in zazor clam under different cold acclimation methods
从图2-B可见:不同冷胁迫组缢蛏的POD活力在降温后第0天时明显上升,直接降温组、梯度降温组和线性降温组POD活力分别达到16.45、12.00、14.14 U/mg,分别较降温前增加117%、58%、86%;在保活第2、4天时各组POD活力呈下降趋势,在第4天时达到最低值,直接降温组、梯度降温组和线性降温组的POD活力分别为12.79、8.00、8.39 U/mg,其中梯度降温组和线性降温组的POD活力降至降温前水平;之后POD活力逐渐上升,在保活第8天时,直接降温组和梯度降温组的POD活性达到峰值18.59、13.76 U/mg;直接降温组在4~8 d保活期内POD活力均显著高于其他两组(P<0.05);在保活期内,梯度降温组和线性降温组POD活性无显著性差异(P>0.05)。


图2 不同冷胁迫方式下MDA含量和POD酶活力的变化
Fig.2 Malondialdehyde (MDA) content and peroxidase (POD) activities in zazor clam under different cold acclimation methods
2.3 不同冷胁迫处理组GSH和H2O2含量的变化
从图3-A可见:直接降温组、梯度降温组和线性降温组缢蛏的GSH含量在保活第0、2天时有明显上升趋势,相比降温前,直接和线性降温组的GSH含量在降温后第0天时分别增加25.1%和9.3%,但梯度降温组却下降了7.2%,在第2天时各组GSH含量均达到峰值,分别为16.74、14.83、14.34 mg/g;在保活第4~8天时,各组GSH活性逐渐下降,保活第8天时,直接降温组、梯度降温组和线性降温组的GSH含量分别为8.23、8.91、8.31 mg/g,均低于降温前水平;直接降温组在保活第4天时的GSH含量显著高于其他两组(P<0.05);在保活期内,梯度降温组和线性降温组的GSH活性并无显著性差异(P>0.05)。
从图3-B 可见:保活期内不同冷胁迫组缢蛏H2O2含量均呈波动变化趋势;降温后第0天时,直接降温组的H2O2含量增加18.1%,梯度降温组变化不明显,线性降温组则有5.7%的下降;各组H2O2含量在保活第2天时均达到峰值,并在保活第4天后逐渐下降至降温前水平;梯度降温组和线性降温组的H2O2含量在保活前期内相差不明显,但在保活第4、6、8天时,两组H2O2含量有显著性差异(P<0.05);直接降温组的H2O2含量在保活第2、4、8天时显著高于其他两组(P<0.05)。
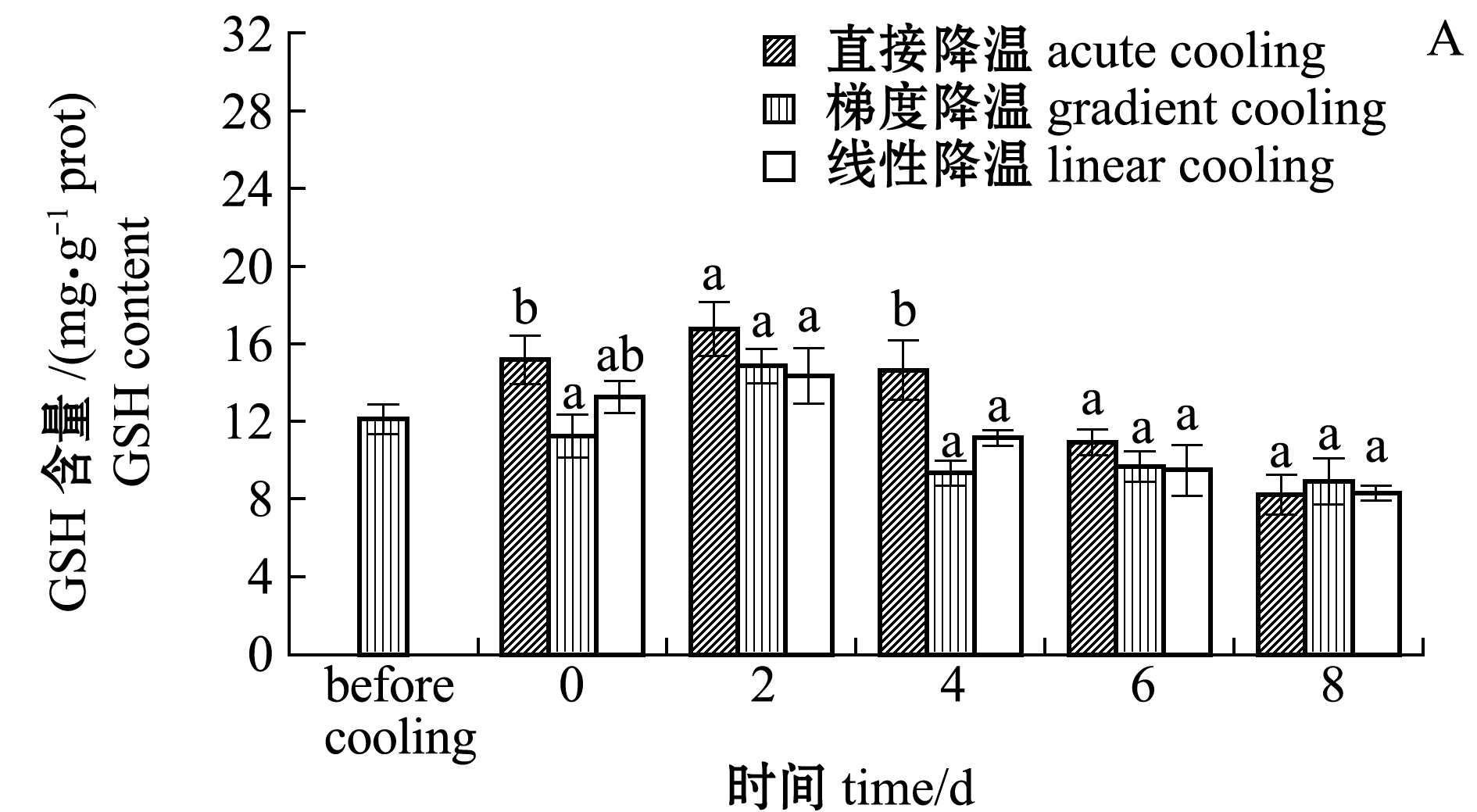
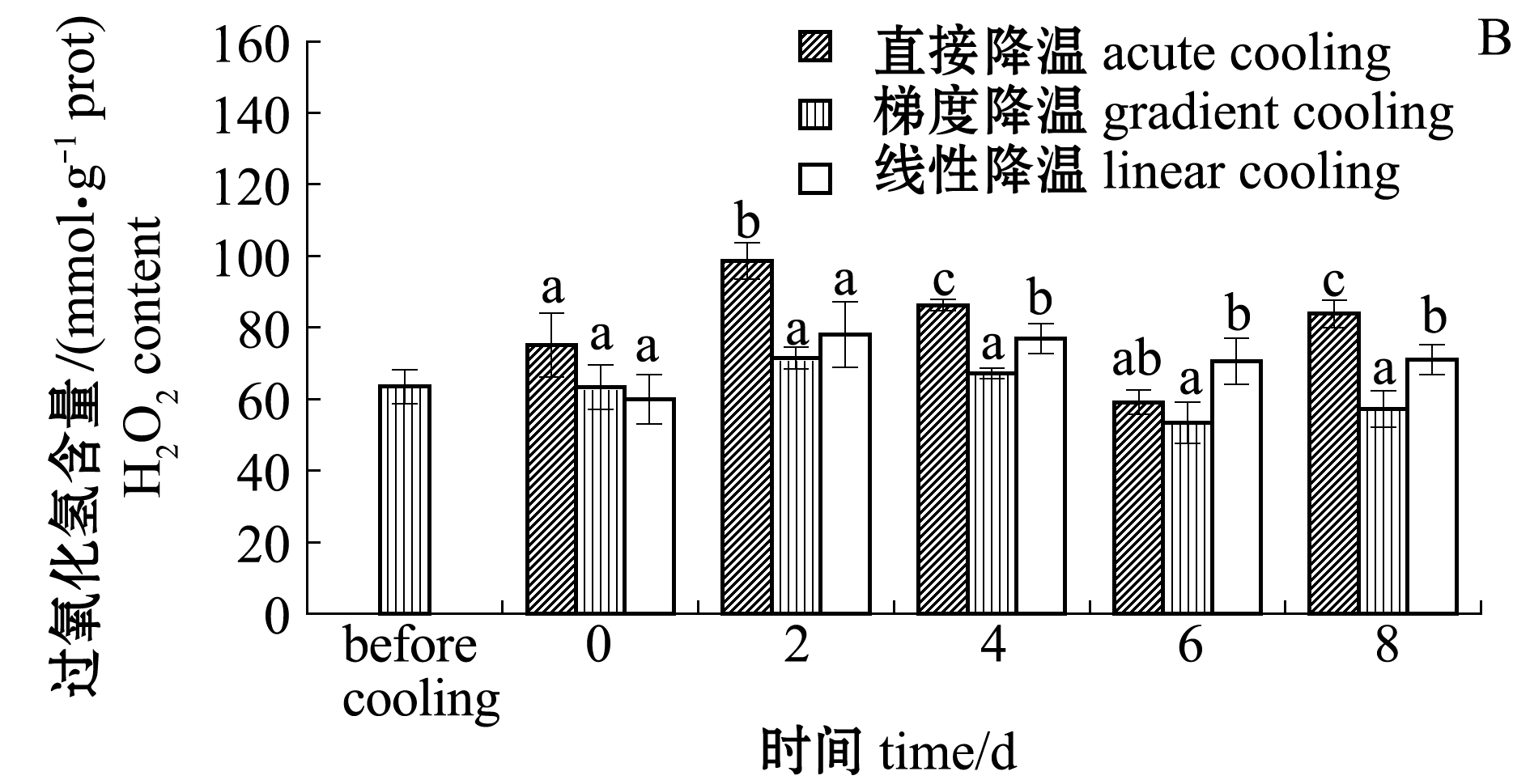
图3 不同冷胁迫方式下GSH和过氧化氢含量的变化
Fig.3 Reduced glutathione (GSH) and Hydrogen peroxide (H2O2) contents in zazor clam under different cold acclimation methods
3 讨论
3.1 不同冷胁迫方式对无水保活期中缢蛏SOD酶活力的影响
超氧化物歧化酶(SOD)是以超氧阴离子自由基![]() 为底物的
为底物的![]() 和H+·在SOD酶的催化作用下转化为H2O2和O2,从而清除
和H+·在SOD酶的催化作用下转化为H2O2和O2,从而清除![]() 使生物体内的超氧阴离子自由基维持在正常的范围[9]。本试验中,在降温后进入无水保活期的缢蛏消化腺和鳃组织混合样中SOD活性较降温前明显升高,并随保活时间的延长呈上升趋势。说明低温逆境下保活时间的延长导致机体中的
使生物体内的超氧阴离子自由基维持在正常的范围[9]。本试验中,在降温后进入无水保活期的缢蛏消化腺和鳃组织混合样中SOD活性较降温前明显升高,并随保活时间的延长呈上升趋势。说明低温逆境下保活时间的延长导致机体中的![]() 大量增加,机体通过生成大量SOD来保持抗氧化系统的稳定,并随着时间延长SOD活性逐渐上升。在保活期内,直接降温组SOD活性均高于梯度降温组和线性降温组甚至达到显著水平。直接降温组为温度突变的降温方式,相较梯度降温组和线性降温组温度渐变的降温方式,SOD活性激增用于催化
大量增加,机体通过生成大量SOD来保持抗氧化系统的稳定,并随着时间延长SOD活性逐渐上升。在保活期内,直接降温组SOD活性均高于梯度降温组和线性降温组甚至达到显著水平。直接降温组为温度突变的降温方式,相较梯度降温组和线性降温组温度渐变的降温方式,SOD活性激增用于催化![]() 更不利于缢蛏体内的活性氧代谢平衡。刘玲等[10]同样研究发现,温度渐变对鼠龙斑幼鱼抗氧化能力影响较小,温度突变加强了鼠龙斑幼鱼应激反应,对其抗氧化能力的影响明显,长时间温度胁迫可能对幼鱼抗氧化系统产生了不可逆的改变。
更不利于缢蛏体内的活性氧代谢平衡。刘玲等[10]同样研究发现,温度渐变对鼠龙斑幼鱼抗氧化能力影响较小,温度突变加强了鼠龙斑幼鱼应激反应,对其抗氧化能力的影响明显,长时间温度胁迫可能对幼鱼抗氧化系统产生了不可逆的改变。
3.2 不同冷胁迫方式对无水保活期中缢蛏CAT酶活力的影响
过氧化氢酶(CAT)是一类普遍存在于原核生物和真核生物中的抗氧化酶,能够将SOD歧化反应产生的H2O2消除,同时也避免了H2O2与![]() 在铁络合物作用下生成比
在铁络合物作用下生成比![]() 更有害的一类自由基(·OH)[11-12],以防止膜脂过氧化。本试验中,在无水保活期内,直接降温组缢蛏CAT活力随保活时间延长逐渐增大,在保活第8天时CAT活力较降温前增加了179%。CAT活性的变化是机体在胁迫条件下免疫能力强弱的重要指标[13],因此,可以通过测定机体内CAT活性的变化来反映环境胁迫对生物的影响程度。在保活过程中,直接降温组CAT活力均高于梯度降温组和线性降温组甚至达到显著水平(P<0.05),这表明温度突变相较温度渐变在低温胁迫下有更强的应激响应。曾鹏等[14]同样研究也发现,受降温速率影响,鲫鱼离水储藏后的急性降温组血液CAT活力较高,而慢性降温组CAT活力较低。本研究中,梯度降温组和线性降温组CAT活力在保活第6天达到峰值后,在保活第8天时出现回落趋势。推测这可能是缢蛏抗氧化系统应对温度变化的一种响应机制,以保护机体抵抗环境变化。
更有害的一类自由基(·OH)[11-12],以防止膜脂过氧化。本试验中,在无水保活期内,直接降温组缢蛏CAT活力随保活时间延长逐渐增大,在保活第8天时CAT活力较降温前增加了179%。CAT活性的变化是机体在胁迫条件下免疫能力强弱的重要指标[13],因此,可以通过测定机体内CAT活性的变化来反映环境胁迫对生物的影响程度。在保活过程中,直接降温组CAT活力均高于梯度降温组和线性降温组甚至达到显著水平(P<0.05),这表明温度突变相较温度渐变在低温胁迫下有更强的应激响应。曾鹏等[14]同样研究也发现,受降温速率影响,鲫鱼离水储藏后的急性降温组血液CAT活力较高,而慢性降温组CAT活力较低。本研究中,梯度降温组和线性降温组CAT活力在保活第6天达到峰值后,在保活第8天时出现回落趋势。推测这可能是缢蛏抗氧化系统应对温度变化的一种响应机制,以保护机体抵抗环境变化。
3.3 不同冷胁迫方式对无水保活期中缢蛏POD酶活力的影响
过氧化物酶(POD)与CAT都是以铁卟啉为辅基的酶类,能够清除过氧化氢,从而防止过量自由基对机体造成的损害。POD与SOD、GSH-Px、CAT一起协同作用,催化以H2O2为氧化剂的氧化还原反应,使其变成H2O[15-16]。本试验中,在无水保活期内,直接降温组缢蛏的POD活性均高于梯度降温组和线性降温组甚至达到显著水平,说明梯度和线性的冷胁迫方式更有利于抗氧化系统状态的维持。各组的POD活性在保活第2、4、6天时维持较低的活性后,在保活第8天时回升至较高水平,推测可能是降温后POD活性随机体产生的超氧阴离子自由基增多而上升,但SOD催化![]() 产生过多的H2O2无法清除,抑制了POD活性,又在保活第8天时随H2O2的逐渐消解,POD活性再次升高。吴丹华等[17]的研究同样得到相似的结论,在8 ℃时低温胁迫下,普通蟹RS的POD活性在第3天时达到峰值,并在第5、7天时维持较低的水平,在第9天时出现回升趋势。
产生过多的H2O2无法清除,抑制了POD活性,又在保活第8天时随H2O2的逐渐消解,POD活性再次升高。吴丹华等[17]的研究同样得到相似的结论,在8 ℃时低温胁迫下,普通蟹RS的POD活性在第3天时达到峰值,并在第5、7天时维持较低的水平,在第9天时出现回升趋势。
3.4 不同冷胁迫方式对无水保活期中缢蛏GSH含量的影响
还原性谷胱甘肽(GSH)是机体组织中重要的非蛋白质巯基化合物,可以清除![]() 及重金属等,并且是GSH-Px和GST两种酶类的底物,为这两种酶分解过氧化氢所必需,具有保护巯基酶和血红蛋白等免受氧化损伤的作用。因此,GSH含量的高低被认为是反映机体受环境因素影响大小的重要指标[18]。本研究中发现,在低温胁迫下,各组缢蛏的GSH含量在保活第2天达到峰值后,出现回落趋势,并且除第8天外,直接降温组的GSH含量在无水保活期内均高于梯度降温组和线性降温组甚至达到显著水平,推测可能是由于温度胁迫作用下,机体产生了过多的活性氧自由基及中间产物,机体产生GSH并在GSH-Px催化作用下与用于H2O2反应生成无害的H2O。其他学者同样研究发现,温度胁迫会导致动物组织的GSH含量增加以保护生物体免受氧化损伤 [19-20]。
及重金属等,并且是GSH-Px和GST两种酶类的底物,为这两种酶分解过氧化氢所必需,具有保护巯基酶和血红蛋白等免受氧化损伤的作用。因此,GSH含量的高低被认为是反映机体受环境因素影响大小的重要指标[18]。本研究中发现,在低温胁迫下,各组缢蛏的GSH含量在保活第2天达到峰值后,出现回落趋势,并且除第8天外,直接降温组的GSH含量在无水保活期内均高于梯度降温组和线性降温组甚至达到显著水平,推测可能是由于温度胁迫作用下,机体产生了过多的活性氧自由基及中间产物,机体产生GSH并在GSH-Px催化作用下与用于H2O2反应生成无害的H2O。其他学者同样研究发现,温度胁迫会导致动物组织的GSH含量增加以保护生物体免受氧化损伤 [19-20]。
3.5 不同冷胁迫方式对无水保活期中缢蛏MDA含量的影响
丙二醛(MDA)是细胞膜脂过氧化作用的产物之一,MDA含量多少可间接反映机体受到自由基损伤的程度[21]。当生物受到逆境胁迫时,能促使机体细胞内线粒体、微粒体和胞浆酶系统和非酶系统反应,通过还原产生过量的氧自由基及中间物质,使生物体内的抗氧化系统失衡,导致氧化应激的产生[22-23]。本研究中,在无水保活期内,各组缢蛏的MDA含量随保活时间的延长均呈上升趋势,并以直接降温组的MDA含量增长尤其显著,保活第8天时的MDA含量较降温前增加了117%,且均高于梯度降温组和线性降温组。MDA含量的持续上升说明机体的抗氧化调节系统并没有恢复,持续的低温胁迫导致活性氧代谢朝着更不利的方向进行,且恢复时间可能与应激反应时间有关,同时也说明了直接降温的冷胁迫方式加速了损伤程度,不利于抗氧化系统平衡态的恢复。洪美玲等[24]同样研究发现,中华绒螯蟹在经历高温胁迫和低温胁迫下后其MDA含量基本呈上升趋势,由此判断,中华绒螯蟹经受温度胁迫后均因自由基产生了一定损伤,并随应激时间的延长氧化损伤持续加剧。
3.6 不同冷胁迫方式对无水保活期中缢蛏过氧化氢含量的影响
抗氧化酶SOD、CAT、POD和底物GSH之间具有协同作用[25]。机体的抗氧化系统在代谢过程中会产生活性氧(ROS)和活性氧中间体(ROI),超氧阴离子![]() 可在SOD的催化作用下生成O2和H2O2,但SOD中的Cu2+可被H2O2还原从而失去活性,POD、CAT可直接催化清除H2O2生成H2O和O2,GSH可与H2O2在GSH-Px的催化作用下生成氧化性谷胱甘肽(GSSG)和H2O,SOD的活性会得到有效保护;
可在SOD的催化作用下生成O2和H2O2,但SOD中的Cu2+可被H2O2还原从而失去活性,POD、CAT可直接催化清除H2O2生成H2O和O2,GSH可与H2O2在GSH-Px的催化作用下生成氧化性谷胱甘肽(GSSG)和H2O,SOD的活性会得到有效保护;![]() 累积同样可导致CAT和POD被毒害而丧失活性,SOD通过催化消除
累积同样可导致CAT和POD被毒害而丧失活性,SOD通过催化消除![]() 又能够保护这2种酶。因此,SOD、CAT、POD等多种酶组成了生物体内动态平衡并相互保护的抗氧化系统[26]。本试验中,在无水保活期内,直接降温组缢蛏的H2O2含量在保活第2天达到峰值,在保活第4、6天逐渐回落,可能是由于在保活初期的低温胁迫下,SOD催化产生了大量的H2O2没有被完全消解,在POD、CAT的共同催化作用下,保活后期的H2O2含量与降温前无明显差别。推测这可能是SOD、CAT、POD和GSH的共同作用可以及时消除过量产生的H2O2,阻止氧化应激的进一步加深,保护机体免遭伤害 [27]。梯度降温组和线性降温组的H2O2含量在保活第2、4和8天时显著低于直接降温组,说明相比温度突变的冷胁迫方式,温度渐变有效抑制了缢蛏机体的氧化应激,减缓损伤形成。
又能够保护这2种酶。因此,SOD、CAT、POD等多种酶组成了生物体内动态平衡并相互保护的抗氧化系统[26]。本试验中,在无水保活期内,直接降温组缢蛏的H2O2含量在保活第2天达到峰值,在保活第4、6天逐渐回落,可能是由于在保活初期的低温胁迫下,SOD催化产生了大量的H2O2没有被完全消解,在POD、CAT的共同催化作用下,保活后期的H2O2含量与降温前无明显差别。推测这可能是SOD、CAT、POD和GSH的共同作用可以及时消除过量产生的H2O2,阻止氧化应激的进一步加深,保护机体免遭伤害 [27]。梯度降温组和线性降温组的H2O2含量在保活第2、4和8天时显著低于直接降温组,说明相比温度突变的冷胁迫方式,温度渐变有效抑制了缢蛏机体的氧化应激,减缓损伤形成。
4 结论
(1)缢蛏在分别采用不同的冷胁迫方式进入无水保活状态后,相较于直接降温的保活前处理方式,梯度和线性降温对缢蛏在保活期内的SOD、CAT、POD等抗氧化酶活力及脂质过氧化状态影响较小,并表现出明显的差异性,缓解了低温胁迫状态下缢蛏的氧化应激,有利于缢蛏机体的抗氧化系统恢复平衡状态,因此,缢蛏低温胁迫过程中应尽量避免温度骤降带来的危害,严格控制温降速率,胁迫时降温速率不应超过5 ℃/h。
(2)SOD、CAT和MDA等指标在低温下随保活时间的变化上升趋势明显,与降温前相比差异显著,这些指标可以作为缢蛏对冷胁迫检测的指标。
[1] 徐凤山,张素萍.中国海产双壳类图志[M].北京:科学出版社,2008:211-213.
[2] 李含.缢蛏综合保活技术研究[D].福州:福建农林大学,2014.
[3] 桑卫国,董明敏,童耿,等.养殖缢蛏调味半干制品的研制[J].食品科技,2008(10):119-122.
[4] Martínez- lvarez R M,Morales A E,Sanz A.Antioxidant defenses in fish:biotic and abiotic factors[J].Reviews in Fish Biology and Fisheries,2005,15(1-2):75-88.
lvarez R M,Morales A E,Sanz A.Antioxidant defenses in fish:biotic and abiotic factors[J].Reviews in Fish Biology and Fisheries,2005,15(1-2):75-88.
[5] 刘浩明,董迎辉,霍礼辉,等.Cu2+对缢蛏稚贝的急性毒性及对抗氧化酶活力和丙二醛含量的影响[J].中国水产科学,2012,19(1):182-187.
[6] 祁营利,李含,邱万伟,等.缢蛏无水保活技术研究[C]//福建省科协第十五届学术年会福建省制冷学会分会场——福建省制冷学会2015年学术年会(创新驱动发展)论文集.宁德:福建省制冷学会,2015:9.
[7] Hochachka P W,Somero G N.Biochemical Adaptation[M].Princeton:Princeton University Press,1984.
[8] 曹善茂,王潇,刘钢,等.温度胁迫对岩扇贝幼贝抗氧化酶活力的影响[J].大连海洋大学学报,2018,33(2):223-227.
[9] 李亚男,张海滨.海洋无脊椎动物抗氧化酶研究进展[J].海洋通报,2018,37(3):241-253.
[10] 刘玲,陈超,李炎璐,等.短期温度胁迫对驼背鲈(♀)×鞍带石斑鱼(♂)杂交子代幼鱼抗氧化及消化酶活性的影响[J].渔业科学进展,2018,39(2):59-66.
[11] 孙淑红,焦传珍,刘小林,等.Cd(Ⅱ)对泥鳅抗氧化酶活性和脂质过氧化的影响[J].大连水产学院学报,2009,24(1):52-56.
[12] 刘冰,梁婵娟.生物过氧化氢酶研究进展[J].中国农学通报,2005,21(5):223-224,232.
[13] 陈昌生,王淑红,纪德华,等.氨氮对九孔鲍过氧化氢酶和超氧化物歧化酶活力的影响[J].上海水产大学学报,2001,10(3):218-222.
[14] 曾鹏,申江,陈天及.低温驯化速度对鲫鱼离水储藏酶活性的影响[J].食品与生物技术学报,2015,34(8):849-855.
[15] 李维信,廖小岗,唐宜,等.镉对大鼠睾丸的损伤及锌保护作用的超微结构研究[J].解剖学报,1988,19(1):74-78,125-126.
[16] 周顺伍.动物生物化学[M].3版.北京:中国农业出版社,1999.
[17] 吴丹华,郑萍萍,张玉玉,等.温度胁迫对三疣梭子蟹血清中非特异性免疫因子的影响[J].大连海洋大学学报,2010,25(4):370-375.
[18] Pompella A,Visvikis A,Paolicchi A,et al.The changing faces of glutathione,a cellular protagonist[J].Biochemical Pharmacology,2003,66(8):1499-1503.
[19] Hermes-Lima M,Zenteno-Savín T.Animal response to drastic changes in oxygen availability and physiological oxidative stress[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2002,133(4):537-556.
[20] Rajagopal S,Van Der Gaag M,Van Der Velde G,et al.Upper temperature tolerances of exotic brackish-water mussel,Mytilopsis leucophaeata (Conrad):an experimental study[J].Marine Environmental Research,2005,60(4):512-530.
[21] 王奇,范灿鹏,陈锟慈,等.三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶(GST)和丙二醛(MDA)的影响[J].生态环境学报,2010,19(5):1014-1019.
[22] 倪多娇.栉孔扇贝抗氧化酶基因的克隆与表达分析[D].青岛:中国科学院研究生院(海洋研究所),2007.
[23] Gamble S C,Goldfarb P S,Porte C,et al.Glutathione peroxidase and other antioxidant enzyme function in marine invertebrates (Mytilus edulis,Pecten maximus,Carcinus maenas and Asterias rubens)[J].Marine Environmental Research,1995,39(1-4):191-195.
[24] 洪美玲,陈立侨,顾顺樟,等.不同温度胁迫方式对中华绒螯蟹免疫化学指标的影响[J].应用与环境生物学报,2007,13(6):818-822.
[25] 杨唐斌,梅尚筠.应激反应与抗氧化酶[J].航天医学与医学工程,1994,7(1):75-78.
[26] 程元恺.脂质过氧化与抗氧化酶[J].工业卫生与职业病,1993,19(4):254-256.
[27] 亢玉静,郎明远,赵文.水生生物体内抗氧化酶及其影响因素研究进展[J].微生物学杂志,2013,33(3):75-80.