热加工是获得安全美味鱼肉制品的常见处理方式。鱼肉在热加工过程中会发生热降解、蛋白氧化、脂质氧化等一系列生物化学反应,从而引起质构特征和蛋白质理化性质的变化。肉类制品的蛋白质含量较高,热加工过程中蛋白质的理化性质改变对肉制品的品质影响较大,特别是肌原纤维蛋白的氧化变性,对鱼肉制品的质构特性和保水性有着重要的作用[1]。
近年来,关于肉类制品热加工过程中质构特性变化的报道逐渐增加。陈丽丽等[2]进行了不同烹饪方式(蒸、煮、油炸)对脆肉鲩Ctenopharyngodon idellus肉质构的影响研究,结果发现,加工后鱼肉硬度减小、弹性增加;向雅芳等[3]在研究不同热处理方式(水煮、汽蒸、真空低温烹饪)对鲈Micropterus salmoides肉品质影响时也发现同样的变化规律。蛋白质在热加工过程中的理化性质变化一直是研究热点。孙丽等[4]研究蒸煮对金枪鱼Thunnus蛋白质的影响时发现,随着温度上升,水溶性蛋白、盐溶性蛋白含量降低,而碱溶性蛋白含量增加;桂萍等[5]研究发现,随着加热温度升高,鲢Hypophthalmichthys molitrix鱼肉与鸡胸肉的混合肉肌原纤维蛋白含量降低且构象发生变化,α螺旋含量减少,肌球蛋白重链条带变浅;Hu等[6]研究发现,经不同烹饪方式(水煮、汽蒸、微波、烤制、油炸)处理鲟Acipenser gueldenstaedtii肉后,羰基值明显变大,从大到小为烤制>油炸>微波>水煮>汽蒸,巯基值明显减小,从小到大为烤制<油炸<微波<水煮<汽蒸。
作为中国主要的淡水鱼养殖产品之一,罗非鱼Oreochromis niloticus肌肉中蛋白质是除水分外含量最高的成分,平均质量分数为 20.79%[7],营养价值较高。目前关于罗非鱼的研究大多集中在罗非鱼贮运过程中的保鲜[8]、护色[9-10]等方面,有关罗非鱼热加工相关特性的研究鲜有报道,对于加热方式引起的罗非鱼片质构特征和蛋白质的具体变化还需进一步了解。本研究中,比较了汽蒸、水煮和空气炸3种加热方式对新鲜罗非鱼片质构特性与蛋白质理化性质的影响,以期为罗非鱼加工企业合理选择热加工方式、丰富加工产品形式提供数据资料。
1 材料与方法
1.1 材料
试验用鲜活罗非鱼购于广州市华润万家超市,体质量为(1000±100)g。
试剂:蛋白定量、蛋白质巯基含量、蛋白质羰基含量测试盒均购自南京建成生物工程有限公司;NuPAGETM Bis-Tris预制胶(10%)、NuPAGETM MOPS SDS 电泳缓冲液(20X)购自英潍捷基(上海)贸易有限公司;BeyoColorTM彩色预染蛋白、2×SDS-PAGE上样缓冲液购自上海碧云天生物技术有限公司;苯甲基磺酰氟(PMSF)购自广州领驭生物科技有限公司;其他常见试剂均为分析纯。
仪器设备:T50型均质机(德国IKA公司)、3K30型台式高速冷冻离心机(德国Sigma公司)、UV2550型紫外-可见分光光度计(日本Shimadzu公司)、CT3质构仪(美国Brookfield公司)、Mini Gel Tank蛋白电泳槽(美国Invitrogen公司)、基础电泳仪(美国BIO-RAD公司)、Image Scanner Ⅲ扫描仪(美国GE公司)、利仁(LIVEN)KZ-D8000B空气炸锅(北京利仁科技股份有限公司)、Alpha1-4冷冻干燥机(德国Christ公司)、IRAffinity-1红外光谱仪(日本岛津公司)。
1.2 方法
1.2.1 样品处理 将新鲜罗非鱼击晕后去内脏、鱼皮后取背部肌肉,切成大小相近的鱼片(约5 cm×3 cm×1.5 cm),随机分为4组(每组3片鱼肉),分别为对照组(新鲜鱼片)、汽蒸组、水煮组、空气炸组,因本试验中只讨论加热方式对罗非鱼品质的影响,故处理组不添加调味料。
3种热处理方式:(1)水煮,将鱼片放入100 ℃沸水中煮5 min,捞出吸去表面水分;(2)汽蒸,蒸锅水沸腾后将鱼片放入蒸锅,100 ℃下蒸5 min,取出后吸去表面水分;(3)空气炸,将鱼片置于200 ℃的空气炸锅炸制10 min。
样品冷却后,先取完整鱼片测定质构特性,然后将鱼片搅碎包装于塑封袋中置于超低温冰箱(-80 ℃)中保存,以待其他指标的检测。检测前,将各处理组鱼肉样品在室温(20 ℃)下解冻1 h。
1.2.2 质构测定 使用Brookfield LFRA-100型质构仪及P/44平底圆柱形探头进行测定,测试模式设定为质地多面剖析(TPA)模式,测试速度为1 mm/s,循环次数为2次,触发点负载为5.0 g,下压距离5 mm,每组试验重复6次,去除最大值和最小值后取平均值。
1.2.3 全蛋白质提取与测定 参考Hu等[6]的方法并稍做修改,准确称取各组碎肉样品2 g置于50 mL离心管中,用尿素-硫脲溶液(7 mol/L尿素,2 mol/L硫脲,2%DTT)30 mL,冰水浴条件下以12 000 r/min均质2 min(均质时每10 s停10 s,以防过热),所得匀浆4 ℃下以12 000 r/min离心15 min后取上清液,按照试剂盒说明书测定蛋白质溶液浓度,测定后立即使用或保存于超低温冰箱(-80 ℃)中备用。
1.2.4 肌原纤维蛋白提取与测定 参考Pazos等[11]的方法并略作改动,准确称取各组碎肉样品2 g置于50 mL离心管中,加入冰浴冷却的Tris-HCl缓冲液(10 mmol/L Tris-HCl,5 mmol/L PMSF,pH 7.2)10 mL,均质及离心过程同“1.2.3”节。离心后弃上清,于沉淀中加入10倍体积的盐溶液(0.6 mol/L NaCl,10.0 mmol/L Tris-HCl缓冲液,5 mmol/L PMSF,pH 7.2)均质混匀,冰水浴静置25~30 min后于4 ℃下以12 000 r/min离心15 min,所得上清液即为肌原纤维蛋白溶液。按照试剂盒说明书测定蛋白质溶液浓度,测定后立即使用或保存于超低温冰箱(-80 ℃)备用。
1.2.5 肌原纤维蛋白二级结构测定 采用傅里叶红外变换光谱(FTIR)分析蛋白二级结构,参考叶锋等[12]的测定方法并稍做修改,制备的肌原纤维蛋白样品经-80 ℃冷冻4 h后再冷冻干燥24 h,然后在干燥条件下用研钵将蛋白磨成细小的粉末状。取少量蛋白样品,与150 mg溴化钾在红外干燥灯照射下研磨充分,用压力器(1400 Pa)加压2 min形成压片,用红外光谱仪进行全波段扫描(4000~400 cm-1),分辨率为4 cm-1,扫描次数为32次。
1.2.6 羰基、巯基含量测定 按照蛋白质羰基含量测试盒(A087)、微量总巯基测试盒(A063-2-1)说明书进行测定。
1.2.7 SDS-PAGE电泳 用蛋白提取液将提取的肌原纤维蛋白稀释到约1 mg/mL,参考赵永强等[13]的方法进行SDS-PAGE电泳,将稀释后的肌原纤维蛋白溶液与2×SDS-PAGE上样缓冲液等体积混合,100 ℃下水浴5 min,以12 000 r/min离心5 min后,上清液作为电泳待测样品。本研究中选择10%预制胶,上样量为10 μL。电泳电压设置为120 V,直到溴酚蓝指示剂达到底部边缘时停止电泳,用考马斯亮蓝R250染色,并脱色至背景无色,最后扫描并分析条带。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 22软件进行方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同加热方式处理后罗非鱼片的质构特性
从表1可见:与对照组鲜鱼片相比,经热加工处理后罗非鱼片的硬度、咀嚼性、胶着性均显著降低(P<0.05),内聚性显著升高(P<0.05);空气炸处理组弹性较对照组和其他处理组显著增加(P<0.05),汽蒸和水煮处理组弹性较对照组显著降低(P<0.05);不同热加工处理的鱼片咀嚼性、内聚性、胶着性存在显著性差异(P<0.05),汽蒸、水煮处理组硬度和弹性无显著性差异(P>0.05),但与空气炸处理组有显著性差异(P<0.05)。
表1 不同加热方式处理后罗非鱼片的质构指标
Tab.1 Texture index of tilapia fillets treated with different heating methods
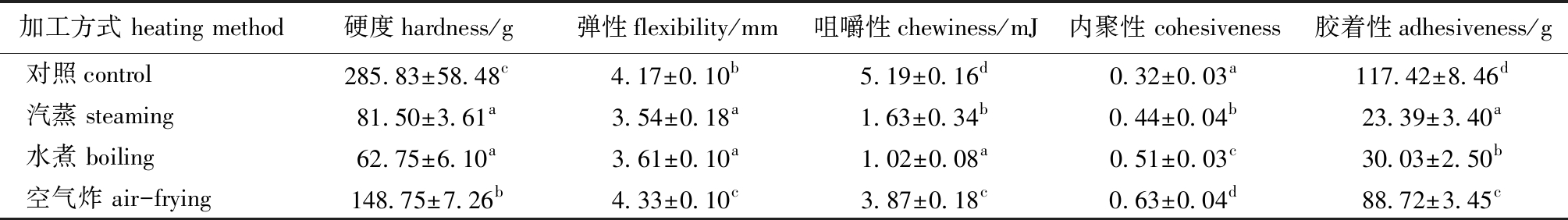
加工方式 heating method硬度hardness/g 弹性flexibility/mm 咀嚼性chewiness/mJ 内聚性 cohesiveness胶着性adhesiveness/g 对照control285.83±58.48c4.17±0.10b5.19±0.16d0.32±0.03a117.42±8.46d汽蒸 steaming81.50±3.61a3.54±0.18a1.63±0.34b0.44±0.04b23.39±3.40a水煮 boiling62.75±6.10a3.61±0.10a1.02±0.08a0.51±0.03c30.03±2.50b空气炸 air-frying148.75±7.26b4.33±0.10c3.87±0.18c0.63±0.04d88.72±3.45c
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia
2.2 不同加热方式处理后罗非鱼片的肌原纤维蛋白、羰基和巯基含量
从表2可见:与对照组相比,经汽蒸、水煮和空气炸热加工处理后,鱼肉肌原纤维蛋白和巯基含量均显著降低(P<0.05),但不同加热方式处理组间无显著性差异(P>0.05);经3种加热方式处理后鱼肉羰基含量显著增加(P<0.05),且空气炸处理组羰基值显著高于汽蒸和水煮处理组(P<0.05)。
表2 不同加热方式处理后罗非鱼片的肌原纤维蛋白、羰基和巯基含量
Tab.2 Contents of myofibrillar protein, carbonyl group and sulfhydryl group of tilapia fillets treated by different heating methods %

加工方式heating method肌原纤维蛋白/(mg·g-1)myofibrillar protein content 羰基/(nmol·mg-1prot)carbonyl content 巯基/(μmol·g-1)sulfhydryl content 对照 control107.62±4.71b1.30±0.34a10.22±0.57b汽蒸 steaming4.16±0.81a3.38±0.42b4.74±0.14a水煮 boiling3.88±0.35a5.00±0.69c4.05±0.00a空气炸 air-frying4.64±0.46a6.85±0.94d4.52±0.04a
2.3 不同加热方式处理后罗非鱼片的肌原纤维蛋白二级结构组成
对不同加热方式处理后的肌原纤维蛋白傅立叶变换光谱图进行基线校正,再进行二阶求导和去卷积,去除不需要的子峰,并用Peakfit软件进行拟合直到残差最小。以峰面积计算各二级结构的比率,其中各二级结构所对应的波长范围[14],以及不同加热方式处理罗非鱼片的肌原纤维蛋白二级结构组成如表3所示。从表3可见:与新鲜对照样品相比,经热加工处理后α螺旋结构占比显著降低(P<0.05),其中,空气炸处理组含量降低幅度超过50%;β转角占比也显著降低(P<0.05),其中,空气炸处理组下降最多,降幅达30%;无规则卷曲占比显著增加(P<0.05),其中,汽蒸处理组增加超过50%;β折叠占比呈不规则变化,汽蒸和水煮处理组含量与新鲜对照组无显著性差异(P>0.05),但空气炸处理组含量显著增加(P<0.05)。
表3 不同加热方式处理后罗非鱼片的肌原纤维蛋白二级结构组成
Tab.3 Secondary structure composition of myofibrillar protein from tilapia fillets treated by different heating methods %
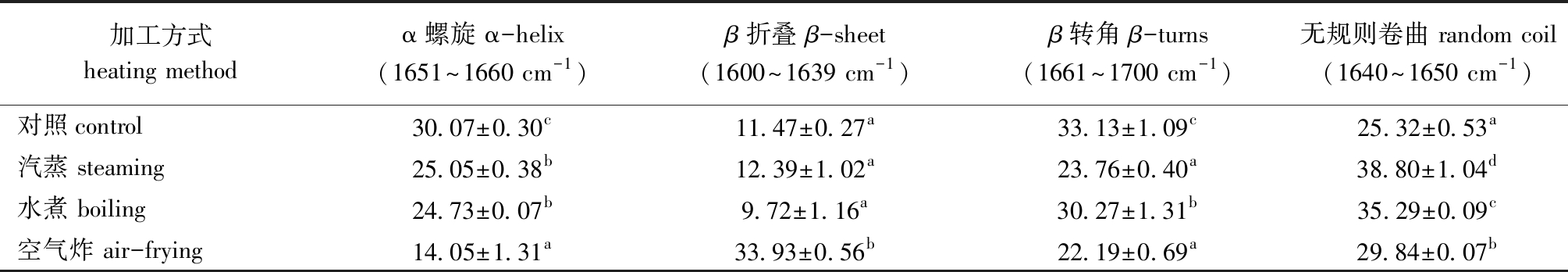
加工方式heating methodα螺旋 α-helix(1651~1660 cm-1)β折叠 β-sheet(1600~1639 cm-1)β转角 β-turns(1661~1700 cm-1)无规则卷曲 random coil(1640~1650 cm-1) 对照control30.07±0.30c11.47±0.27a33.13±1.09c25.32±0.53a汽蒸 steaming25.05±0.38b12.39±1.02a23.76±0.40a38.80±1.04d水煮 boiling24.73±0.07b9.72±1.16a30.27±1.31b35.29±0.09c空气炸 air-frying14.05±1.31a33.93±0.56b22.19±0.69a29.84±0.07b
2.4 SDS-PAGE分析
2.4.1 不同加热方式处理后罗非鱼片肌肉全蛋白质SDS-PAGE图谱 从图1可见:罗非鱼片肌肉蛋白的蛋白质相对分子质量为16 000~220 000,其中,肌球蛋白重链(myosin heavy chain,MHC)、肌动蛋白、原肌球蛋白、肌球蛋白轻链(myosin light chain, MLC)条带相对清晰。新鲜罗非鱼片肌肉中MHC含量最高,其次为肌动蛋白。经加热处理后MHC损失严重并且条带上移,水煮处理条带变化最大,另外,水煮处理后的罗非鱼片肌肉肌动蛋白含量最低,水煮处理的蛋白质条带较对照组蛋白质条带差异最明显。
2.4.2 不同加热方式处理后罗非鱼片肌原纤维蛋白SDS-PAGE图谱 与肌肉全蛋白相比,经热加工处理后样品肌原纤维蛋白SDS-PAGE图谱发生明显变化,条带明显减少且颜色变浅,对照组肌原纤维蛋白主要由肌球蛋白重链、肌动蛋白、肌球蛋白轻链组成,热处理后肌球蛋白重链、肌动蛋白及肌球蛋白轻链均发生了明显降解,经加热处理后条带Ⅰ有明显增加,且依次为水煮>汽蒸>空气炸(图1)。
3 讨论
3.1 不同加热方式对罗非鱼片质构的影响
作为食品的重要品质指标,质构反映了食品的组织特性[15],质构特性主要包括硬度、弹性、咀嚼性等,其中,硬度是决定肉类制品食用价值的主要因素,因为汁液流失、蛋白变性等氧化程度而导致鱼肉组织发生不同程度的软硬变化,由此可知,质构分析对鱼类及其制品的科学研究和产品开发具有重要作用[16]。
通常对肉类食品而言,其硬度和弹性越大,相应咀嚼所需能量就更高,咀嚼性就越大,三者间呈正相关关系[17]。本研究中,新鲜罗非鱼片经热加工处理后,蛋白质受热变性,维持其空间结构的化学键被破坏,细胞间的结合力降低,肉质变软,硬度变小,因此,破碎时所需要的力变小。水煮处理组的罗非鱼片硬度最小,咀嚼性也最小;空气炸处理组鱼肉表面温度迅速升高,水分汽化,鱼肉表面出现干燥层,形成硬壳,因此,相对汽蒸、水煮处理硬度更大,硬度分别约为汽蒸和水煮组的2倍和2.5倍,咀嚼性最大,约为汽蒸和水煮组的2倍和3倍,这与陈丽丽等[2]的研究结果相似。弹性是去掉外力食品恢复原形的能力,且与水分含量、蛋白质(弹性蛋白、胶原蛋白)、肌纤维原本的属性及三者间的相互作用有关,单一或多个因素的变化引起相互作用的变化,从而导致弹性具有差异。本试验中,汽蒸和水煮2种加热方式处理,鱼肉弹性无显著性差异,空气炸处理后鱼肉弹性显著高于汽蒸、水煮。内聚性可以代表肌肉内部的结合情况,热处理后的鱼片由于水分及部分组织液流失,肉质紧密程度发生改变。本研究中,空气炸鱼肉内聚性最高,汽蒸最低。胶着性的变化规律同内聚性,也为空气炸最高,Fox等[18]认为脂肪含量会在一定程度上影响肉品胶着性,本研究中空气炸处理的罗非鱼片胶着性较大,这可能是由于加热处理后其脂肪含量增加引起的。

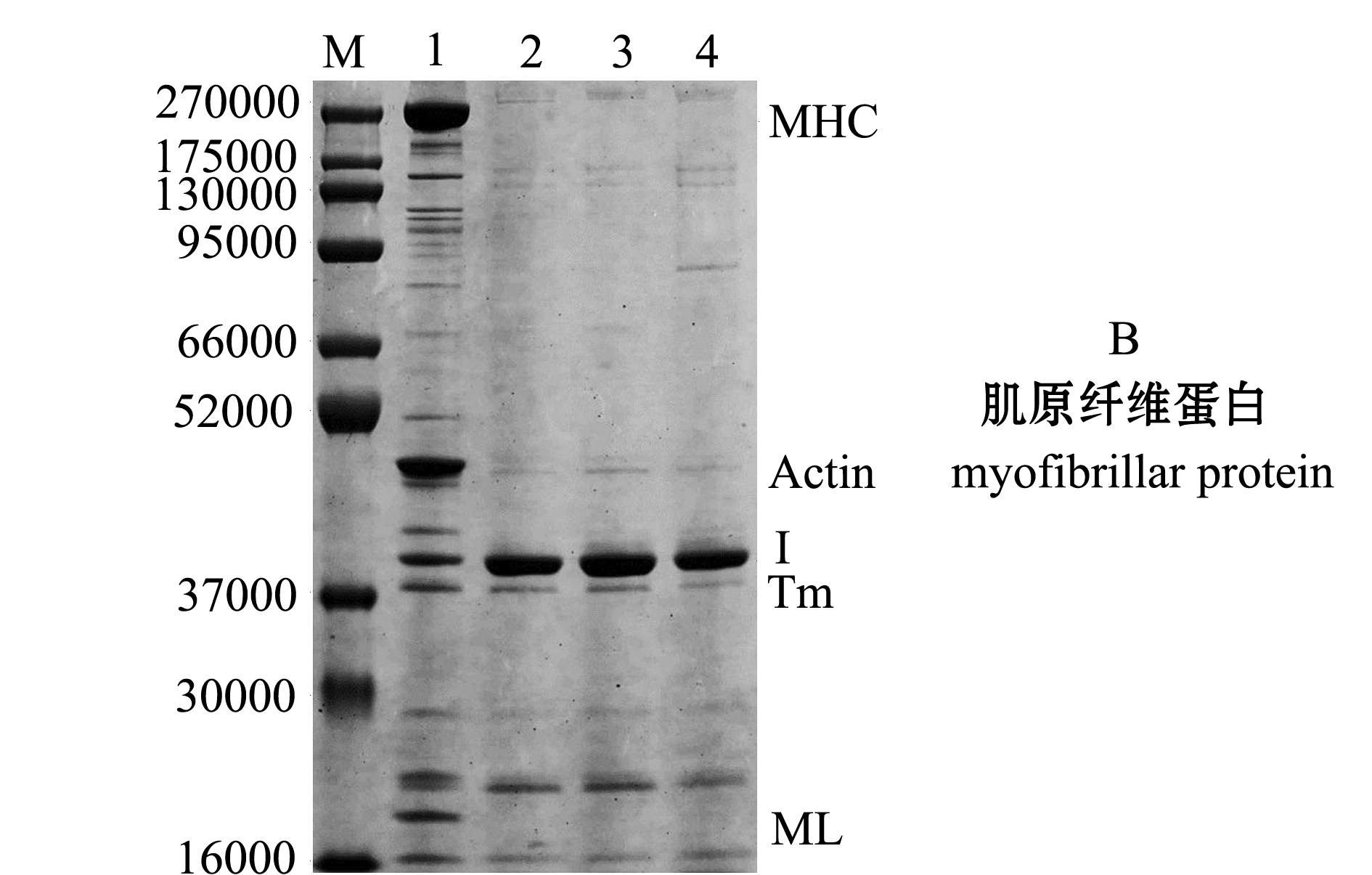
注:M为Marker;1为对照;2为汽蒸;3为水煮;4为空气炸;MHC为肌球蛋白重链(相对分子质量220 000);Actin为肌动蛋白(45 000);Tm为原肌球蛋白;ML为肌球蛋白轻链(17 000~20 000)
Note: M, Marker; 1, control; 2, steaming; 3, boiling; 4, air-frying;MHC, myosin heavy chain (220 000); Actin, 45 000; Tm, tropomyosin; ML, myosin light chain (17 000-20 000)
图1 不同加热方式处理后罗非鱼片肌肉蛋白和肌原纤维蛋白的SDS-PAGE图谱
Fig.1 SDS-PAGE electrophoresis of protein and myofibrillar protein of tilapia fillets treated by different heating methods
3.2 不同加热方式对罗非鱼片肌原纤维蛋白、羰基和巯基含量的影响
新鲜鱼肉中肌原纤维蛋白含量约占鱼肉蛋白总含量的65%~75%,是鱼肉肌肉蛋白中最具代表性的蛋白质,肌原纤维蛋白在加热后会变性形成凝胶,对鱼肉制品的持水性和质构有着重要影响[1]。由于加热过程中鱼肉蛋白质受热变性,水溶性的肌浆蛋白和盐溶性的肌原纤维蛋白受热生成不溶于水和盐的溶液,但溶于 0.1 mol/L NaOH溶液的凝结物[19];Guo等[20]研究推断,肌原纤维蛋白含量下降可能是由巯基氧化后形成二硫键导致肌动球蛋白重链聚合,致使盐溶性蛋白含量下降。范三红等[21]在研究加热处理对鱼肉理化性质的影响中发现,加热温度为70 ℃后,鲭Pneumatophorus japonicus、鳀Engraulis japonicus、沙丁鱼Sardina 3种鱼肉的肌原纤维蛋白溶解度均接近0并不再变化。本研究中加热温度≥100 ℃,因此,3种加热处理后肌原纤维蛋白含量无显著性差异。
一定范围内羰基值与蛋白氧化程度成正比,在加热过程中温度升高加速了蛋白质氧化,自由基攻击氨基酸侧链与肽键产生羰基化合物及其衍生物[22],从而使羰基含量增加。热加工处理会引起羰基值显著增加,范三红等[21]对鲭、鳀、沙丁鱼3种鱼肉在不同温度下的羰基值进行测定,发现羰基值随温度升高而升高,在80 ℃条件下羰基值依次为鲭>沙丁鱼>鳀;Hu等[6]研究发现,经水煮和汽蒸处理的鲟样品羰基值是新鲜样品的2倍,烤制和油炸处理样品的羰基值约为4倍,本研究中由于空气炸处理的加热温度为200 ℃,且加热时间较长,故其羰基值含量显著高于其他两种加热方式。
二硫键含量升高与肌原纤维蛋白的活性巯基被氧化有关,所以蛋白质在加热过程中的变性和氧化程度可以通过测定总巯基含量的变化反映[23]。造成这种现象主要是由于高温条件下部分埋藏在蛋白内部的疏水性基团或巯基基团暴露出来后被氧化,产生二硫键,导致巯基含量下降[24]。加热过程巯基含量并非简单的由高到低,傅新鑫等[25]发现,在蒸制大菱鲆过程中,随着蒸制时间的延长,肌肉总巯基含量先大幅升高然后下降,最后趋于稳定,这是由于在加热初始阶段鱼肉蛋白质间部分作用力被破坏,巯基暴露含量增加,随着加热时间的延长,蛋白质发生交联生成二硫键,使得总巯基含量减少。胡吕霖[26]发现,在烹饪(蒸、煮、微波、烤制、油炸)后均造成了鲟鱼肉样游离巯基的损失,其中,烤制与油炸样中巯基损失量相对较高,分别达到62%、54%,蒸、煮两种加热方式巯基损失无显著性差异,这与本研究结果相似。
通过比较加热处理后肌原纤维蛋白含量、羰基值和巯基值,可以发现汽蒸、水煮和空气炸3种加热方式中,汽蒸处理对罗非鱼肉氧化和热变性程度影响相对较小。
3.3 不同加热方式对罗非鱼片肌原纤维蛋白二级结构组成的影响
蛋白质二级结构是蛋白质复杂空间构象的基础,蛋白质结构与其功能特性密切相关[27],可根据不同空间构型分为螺旋、折叠、转角和卷曲4种结构,前2种相对有序,后2种相对无序。酰胺Ⅰ带(1700~1600 cm-1)主要由C=O 振动引起,因吸收峰位置会被C=O与N-H间氢键作用影响[28],研究者常利用该区间的峰分析蛋白质二级结构的变化。本研究中,新鲜罗非鱼片经3种加热方式加热后,整体表现为螺旋结构减少、无序结构增多,这与李清正等[29]、李长乐[30]的研究结果相似。α螺旋是蛋白质二级结构中最稳定的,通过分子内部的氢键作用维持结构的稳定,加热导致蛋白质分子内的氢键结合力减弱,随着加热温度升高,螺旋解开的程度越高。本研究表明,热加工均会改变蛋白质二级结构,使肌原纤维结构从有序转变为无序。
3.4 不同加热方式对罗非鱼片全蛋白与肌原纤维蛋白SDS-PAGE的影响
本研究中,罗非鱼肌肉蛋白的相对分子质量为16 000~220 000,肌球蛋白重链、肌动蛋白、原肌球蛋白、肌球蛋白轻链条带清晰,这与李娜等[31]的研究结果相似。肌球蛋白条带上移且变浅,一方面可能是蛋白质受热聚集分子量变大,从而条带上移,导致部分分子量过大甚至无法进入胶内[32];另一方面可能是受热分解成较小的蛋白分子,两种情况均会使得蛋白条带颜色变浅。同时,本研究中肌动蛋白条带除了水煮处理组样品条带变浅外,汽蒸和空气炸处理组样品条带无明显变化,反映出肌动蛋白与肌球蛋白相比具有较高的热稳定性,这与部分研究中报道的肌球蛋白重链受热易分解、肌动蛋白热稳定性较高的结论相一致[33-34]。
肌原纤维蛋白是由肌球蛋白、肌动蛋白和肌钙蛋白等组成的复合体,新鲜罗非鱼片肌原纤维蛋白条带主要为肌球蛋白重链、肌动蛋白和肌球蛋白轻链。由于经加热处理后肌原纤维蛋白溶解度显著降低,提取出的肌原纤维蛋白浓度较低,导致在同一上样量的电泳条件下条带不明显;再者,蛋白质受热发生变性和氧化导致蛋白质的聚集与分解,从而导致加热处理后蛋白条带发生变化。条带Ⅰ蛋白含量增加(图1),可能是肌球蛋白重链及肌动蛋白在热加工过程中分解产生的蛋白质聚集形成[35]。
4 结论
(1)新鲜罗非鱼肉经过热加工后,质构特性及蛋白质理化特性都发生了显著变化。(2)空气炸处理后鱼肉的硬度、弹性、咀嚼性、内聚性和胶着性相对较大。(3)经汽蒸、水煮和空气炸加热处理后,鱼肉蛋白质发生氧化与热变性:肌原纤维蛋白溶解性降低,二级结构由有序变为无序,羰基值增大,巯基值减小,其中汽蒸处理后肌原纤维溶解性最高、羰基值最小、巯基值最大。(4)全蛋白SDS-PAGE图谱表明,热加工处理引起罗非鱼肉肌球蛋白重链条带变浅且上移,水煮处理组样品条带变化最为明显,汽蒸处理变化最小。
综上所述,可以推测汽蒸处理对罗非鱼肉氧化变性影响相对较小,一定程度上能避免蛋白过度氧化。另外,肌原纤维蛋白SDS-PAGE图谱显示,热处理引起肌球蛋白重链条带变浅,并且出现分子量为37 000~52 000的小分子蛋白聚集,对于这些小分子蛋白的具体理化性质后续可通过蛋白质组学进行研究。本研究中仅考察了特定温度、时间下不同加热方式对罗非鱼片质构特性与蛋白理化性质影响,而特定加工方式中不同温度与加热时间对罗非鱼片品质性质的影响还需进一步研究。
[1] 吴燕燕,熊添,李来好,等.鱼肉蛋白的热变性研究进展[J].食品工业科技,2018,39(5):343-347.
[2] 陈丽丽,张树峰,袁美兰,等.不同烹饪方式对脆肉鲩鱼肉营养品质的影响[J].中国调味品,2019,44(10):40-45.
[3] 向雅芳,熊光权,乔宇,等.不同热处理方式对鲈鱼品质的影响[J].食品科学,2019,40(21):127-135.
[4] 孙丽,夏文水.蒸煮对金枪鱼肉及其蛋白质热变性的影响[J].食品与机械,2010,26(1):22-25.
[5] 桂萍,罗永康,冯力更.加热温度对混合肉肌原纤维蛋白质结构的影响[J].中国农业大学学报,2018,23(5):93-101.
[6] Hu Lyulin,Ren Sijie,Shen Qing,et al.Proteomic study of the effect of different cooking methods on protein oxidation in fish fillets[J].RSC Advances,2017,7(44):27496-27505.
[7] 王煜坤,郝淑贤,李来好,等.不同地区、品种及养殖模式罗非鱼营养差异分析[J].食品工业科技,2018,39(12):231-237.
[8] 李娜.罗非鱼新鲜度指示蛋白的筛选、特性及在品质评价中的应用研究[D].上海:上海海洋大学,2016.
[9] 赵敏,李来好,杨贤庆,等.罗非鱼片非一氧化碳发色方法的研究[J].南方水产科学,2019,15(4):107-112.
[10] 曹雪涛.罗非鱼片褪色机理及护色技术研究[D].海口:海南大学,2015.
[11] Pazos M,Maestre R,Gallardo J M,et al.Proteomic evaluation of myofibrillar carbonylation in chilled fish mince and its inhibition by catechin[J].Food Chemistry,2013,136(1):64-72.
[12] 叶锋,安英格,秦德志,等.羟基磷灰石结晶对牛血清白蛋白二级结构影响的光谱研究[J].光谱学与光谱分析,2007,27(2):321-324.
[13] 赵永强,李娜,李来好,等.水产品质量与安全控制的蛋白质组学研究[J].大连海洋大学学报,2016,31(3):344-350.
[14] 张秋会,黄现青,李苗云,等.傅里叶红外光谱法研究肌肉蛋白质的二级结构[J].食品与发酵工业,2015,41(10):247-251.
[15] 李里特.食品物性学[M].北京:中国农业出版社,2001.
[16] 赵永强,李娜,李来好,等.鱼类鲜度评价指标及测定方法的研究进展[J].大连海洋大学学报,2016,31(4):456-462.
[17] 林婉玲,杨贤庆,李来好,等.脆肉鲩质构与感官评价的相关性研究[J].现代食品科技,2013,29(1):1-7,72.
[18] Fox J B,Ackerman S A,Jenkins R K.Effect of anionic gums on the texture of pickled frankfurters[J].Journal of Food Science,1983,48(4):1031-1035.
[19] Wattanachant S,Benjakul S,Ledward D A.Effect of heat treatment on changes in texture,structure and properties of Thai indigenous chicken muscle[J].Food Chemistry,2005,93(2):337-348.
[20] Guo Tianying,Xia Yongqing,Wang Jin,et al.Chitosan beads as molecularly imprinted polymer matrix for selective separation of proteins[J].Biomaterials,2005,26(28):5737-5745.
[21] 范三红,刘晓华,胡雅喃,等.加热处理对鱼肉蛋白质理化特性的影响[J].食品工业科技,2014,35(12):104-107,112.
[22] 胡吕霖,任思婕,沈清,等.不同烹饪方式及体外模拟消化环境对鲟鱼蛋白质氧化及消化性的影响[J].食品科学,2018,39(20):63-70.
[23] Cormack P A G,Mosbach K.Molecular imprinting:recent developments and the road ahead[J].Reactive and Functional Polymers,1999,41(1-3):115-124.
[24] Bulaj G.Formation of disulfide bonds in proteins and peptides[J].Biotechnology Advances,2005,23(1):87-92.
[25] 傅新鑫,王垚,李德阳,等.蒸制过程中大菱鲆肌肉理化特性、组织结构及蛋白特性变化[J].食品科学,2018,39(7):56-62.
[26] 胡吕霖.烹饪对鲟鱼蛋白质氧化及消化性的影响研究[D].杭州:浙江大学,2018.
[27] 卢雁,张玮玮,王公轲.FTIR用于变性蛋白质二级结构的研究进展[J].光谱学与光谱分析,2008,28(1):88-93.
[28] Okuno A,Kato M,Taniguchi Y.The secondary structure of pressure-and temperature-induced aggregates of equine serum albumin studied by FT-IR spectroscopy[J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics,2006,1764(8):1407-1412.
[29] 李清正,张顺亮,罗永康,等.温度对复合肌原纤维蛋白结构及其表面疏水性的影响[J].肉类研究,2017,31(2):6-10.
[30] 李长乐.不同处理方式对鲣鱼肌原纤维蛋白性质与结构的影响[D].上海:上海海洋大学,2018.
[31] 李娜,赵永强,李来好,等.冰藏过程中罗非鱼鱼片肌肉蛋白质变化[J].南方水产科学,2016,12(2):88-94.
[32] Kajak-Siemaszko K,Aubry L,Peyrin F,et al.Characterization of protein aggregates following a heating and freezing process[J].Food Research International,2011,44(10):3160-3166.
[33] Wen Siying,Zhou Guanghong,Li Li,et al.Effect of cooking on in vitro digestion of pork proteins:a peptidomic perspective[J].Journal of Agricultural and Food Chemistry,2015,63(1):250-261.
[34] Huang Feng,Huang Ming,Xu Xinglian,et al.Influence of heat on protein degradation,ultrastructure and eating quality indicators of pork[J].Journal of the Science of Food and Agriculture,2011,91(3):443-448.
[35] Cui Chun,Zhou Xuesong,Zhao Mouming,et al.Effect of thermal treatment on the enzymatic hydrolysis of chicken proteins[J].Innovative Food Science & Emerging Technologies,2009,10(1):37-41.