对采捕后肌肉代谢与鱼肉品质关联的研究中,早期主要集中在海洋捕捞品种,除宰杀前处置产生应激反应造成品质下降之外,不同的致死或捕捞方式也会影响鱼肉品质[1]。近20年来,随着渔业生产模式的转变,国外相关研究逐渐转向优势养殖品种,包括欧洲鲈Dicentrarchus labrax、大西洋鲑Salmon salar、虹鳟Oncorhynchus mykiss、金头鲷Sparus aurata和真鳕Gadus morhua等,主要围绕采捕、捕后运输、致晕致死方式等对鱼体代谢及鱼肉品质开展研究[2-6]。相比之下,国内对优势养殖品种采捕的死前应激状态与品质方面的关联缺乏系统深入地研究。
大菱鲆Scophthalmus maximus是中国海水养殖优势经济鱼类之一,具有较高的营养价值,自1992年从欧洲引进中国后,由于其较高的经济价值,市场需求量逐年提高,养殖规模不断扩大,现养殖范围主要分布于辽宁和山东等地[7]。基于中国传统的活鱼消费习惯,目前国内市场销售的大菱鲆主要为活品形式。大菱鲆采捕离水后经运输至销售端,活体历经复杂多变的胁迫因素,使鱼体内能量大量消耗,宰杀后糖原不足,糖酵解时间缩短,造成鱼体提前出现僵直,鱼肉口感和营养价值下降[8],而且在活体运输时由于考虑运输成本,可能会因溶氧量减少、运输密度过大及水质恶化等应激因素积累导致大菱鲆因过度疲劳而死亡,既造成经济损失又导致品质下降。经调查,大菱鲆以活体运输方式运送至市场后,主要致死方式分为敲击头部致死和疲劳濒死2种。敲击头部致死作为市售产品的主要宰杀手段,会因其敲击部位受到损伤,影响感官评价,此外,还可能由于敲击过程中出血,导致放血不充分,造成鱼体发生提前僵直[9]。而疲劳濒死鱼在死亡过程中剧烈挣扎,使鱼体内ATP快速消耗,乳酸蓄积,导致鱼肉的品质下降,食用口感及营养价值都会受到影响[10]。
本研究中,以大菱鲆死前应激与品质关联为出发点,针对不同的捕后处置条件,对比极端致死条件下鱼体生化的变化特性,结合市售鲜活产品品质分析,再通过健康活体断髓速杀后的冰藏稳定性探讨锁鲜的实施程序及初步效果,同时还进行了活鱼流通环节中活体应激恢复研究,旨在解决大菱鲆活鱼流通销售链中存在的低品质问题提供参考依据。
1 材料与方法
1.1 材料
健康活体大菱鲆购于天正(大连)养殖基地,体质量为730~780 g。市售鲜活大菱鲆和濒死组1大菱鲆购于大连市农贸水产市场,濒死组2大菱鲆购于生鲜超市,体质量为720~750 g。
1.2 方法
1.2.1 试验设计 试验设无应激组、锁鲜组、窒息组、应激恢复组、活品组(市售活鱼)和濒死组(市售),各组处理方法如下:
(1)断髓速杀。在养殖基地现场,将活体大菱鲆从暂养池逐条捞出随即断髓速杀,放血、去鳃及内脏,清洗胴体单独包装后装入保温箱内,周身覆冰,处置及运输共历时2 h内运回实验室立即采样,记为无应激组(或健康组);其余鱼体冰藏7 d,记为锁鲜组,锁鲜组单体包装后周身覆冰,于保温箱内冰藏7 d,期间及时补充碎冰。
(2)疲劳致死。将活体大菱鲆从暂养池内捞出后,挣扎致死,记为窒息组。
(3)活鱼暂养。将活体大菱鲆从暂养池逐条捞出后装入盛有海水的运输袋内,充氧并立即运回实验室(处置及运输共历时2 h),记为应激恢复组。应激恢复组大菱鲆置于循环水中暂养7 d,期间不投喂,水温为(13.5±0.2)℃,盐度为27.4±2.0,溶解氧为5.93 mg/L,密度为26 ind./m3。处死方式采用断髓速杀。
(4)市售原料。市售活鱼购于大连市农贸水产市场,断髓速杀处理,记为市售活品组;活品销售过程濒死的鲜品分别购于农贸水产市场和生鲜超市,分别记为濒死组1和濒死组2。
1.2.2 样品处理及指标分析
(1)样品处理。取鱼体背部白色肌肉作为分析样品,采样后立即用液氮速冻后置于超低温冰箱(-80 ℃)中保存,用于后续测定。购自养殖基地的鲜活大菱鲆历经2 h处置及运输抵达实验室后立即取样,取速杀致死胴体记为初始点,运输到实验室后的活鱼记为初期疲劳点。随后冰藏及暂养7 d的组间隔24 h取样一次。购自市场的市售鲜活及濒死原料经20 min运到实验室后立即进行取样。
(2)肌肉糖原。称取2.0 g鱼肉,加入4 mL 30% KOH溶液,沸水浴消化20 min后冷却至室温,加入20 mL无水乙醇,于3 000 g下离心15 min,留沉淀弃上清液,向沉淀中加10 mL蒸馏水、0.05 mL饱和KCl和15 mL无水乙醇,搅拌溶解沉淀物质,于3000 g下离心15 min后弃上清液,搅拌使沉淀溶解后定容至10 mL,静置10 min后取0.5 mL糖原稀释液加入4.5 mL蒸馏水,再取80 μL糖原稀释液,加入320 μL蒽酮显色液,混匀后冷却,在沸水浴中反应10 min,取出用流水快速冷却,静置10 min,在620 nm处测定其吸光度。根据葡萄糖标准曲线计算样品中糖原含量。每个样品设3个平行。
(3)肌肉乳酸。使用南京建成生物工程研究所检测试剂盒测定样品中的乳酸含量。称取1.0 g鱼肉,加入9 mL 0.9%生理盐水,冰浴条件下以1000 r/min均质3次,每次30 s,间隔30 s,利用双缩脲法测定蛋白浓度后,在3000 g、4 ℃条件下离心10 min,取上清液0.2 μL,加入1 mL酶工作液、0.2 mL显色液混匀,37 ℃下水浴,准确反应 10 min,取出后加入终止液混匀。移至96孔酶标板中,在530 nm处测定其吸光度值,计算样品中乳酸含量。每个样品设3个平行,整个试验过程在冰浴中进行。
(4)肌肉pH值。称取2.0 g鱼肉,加入10 mL 20 mmol/L碘乙酸钠溶液,用玻璃棒充分搅拌,静置25 min,测定pH值。每个样品设3个平行。
(5)肌肉核苷酸化合物。称取1.0 g鱼肉,加入10 mL 5%的高氯酸(PCA),待肌肉破碎均匀后,加入2 mol/L的KOH调节pH为2.0 ~ 3.5,再加入超纯水定容至20 mL,在5000 g、4 ℃条件下离心10 min,取上清液过0.45 μm滤膜。取4 mL滤液加入1 mL 0.1 mol/L磷酸盐缓冲液(pH 7.5),每个样品设3个平行,整个试验过程在冰浴中进行。
(6)ATP及其关联物含量的测定。采用高效液相色谱法。色谱柱:日本岛津公司(shim-pack CLC-ODS,6.0 mm×150 mm,5 μm),检测波长为254 nm,温度为40 ℃,流速为1.5 mL/min,检测时间为30 min;流动相为三乙胺溶液∶乙腈溶液(4.2∶15),并用磷酸调pH至5.9。标准物质包括三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、单磷酸腺苷(AMP)、肌苷酸(IMP)、次黄嘌呤苷酸(HxR)、次黄嘌呤(Hx)。
(7)肌肉蛋白组分。称取鱼肉2.0 g,加入8倍体积的0.05 mol/L NaCl-20 mmol/L Tris-HCl(pH 7.5)缓冲溶液,在10 000 r/min条件下均质3次,每次30 s,间隔30 s,所有操作均在冰浴中进行。用双缩脲法测定蛋白浓度后,将均质后的样品蛋白浓度调节为4.0 mg/mL,取肌肉匀浆液150 μL加入300 μL电泳上样液[含有2% SDS、8.0 mol/L尿素、2% β-巯基乙醇、50 mmol/L Tris-HCl(pH 8)],混匀后于100 ℃下加热5 min,制得电泳样品。采用垂直板聚丙烯酰胺凝胶电泳分析,上样量为10.0 μL。浓缩胶质量分数5%,分离胶质量分数7.5%,用考马斯R-250染色30 min,用醋酸甲醇溶液脱色36 h,蛋白标准样品相对分子质量范围为6500~200 000。
2 结果与分析
2.1 速杀处置条件下冰藏大菱鲆的生化稳定性
2.1.1 致死方式对大菱鲆生化特性的影响 本研究中比较了鲜活大菱鲆在两个极端处死条件下的代谢结果,分别处于品质的上限和下限(表1)。将健康活体断髓速杀后,即无应激组大菱鲆的各项生化指标具有窒息组不可比拟的优势。将无应激组大菱鲆断髓速杀致死,经1 h运输抵达实验室后肌肉ATP含量为2.95 μmol/g,而窒息组ATP在大菱鲆挣扎致死过程已全部消耗。从糖原结果分析,窒息组糖原含量由无应激组的5.28 mg/g明显下降至3.06 mg/g,且由于糖原无氧酵解导致乳酸积累,致使肌肉pH值明显下降,由无应激组的7.10降至6.61。可见,相对于窒息处死,断髓速杀的致死方式会使鱼肉的品质更优。
表1 不同致死方式对大菱鲆肌肉生化特性的影响
Tab.1 Effects of slaughtering methods on biochemical properties in muscle of turbot Scophthalmus maximus

组别group致死方式slaughtering methodATP/(μmol·g-1)糖原/(mg·g-1)glycogen乳酸/(mmol·g-1)lactic acidpH值pH value无应激组 stress free断髓速杀 spinal cord cutting2.95±0.155.28±0.010.15±0.017.10±0.02窒息组 asphyxial窒息致死 asphyxiation—3.06±0.000.18±0.016.61±0.08
2.1.2 冰藏期间ATP及其关联物含量的变化 鱼体死后,机体处于无氧酵解状态,ATP迅速被分解为ADP、AMP、IMP、HxR、Hx等代谢产物。从表2可见:断髓速杀的大菱鲆冰藏初期伴随着ATP降解IMP迅速积累,6 d冰藏期间一直呈现IMP突出积累特征,IMP作为鱼体死后的鲜度指标,在冰藏过程中呈现先上升后下降的趋势,贮藏2 d时达到最高值9.81 μmol/g,贮藏6 d时含量仍然能维持较高水平;ATP关联物AMP、ADP、HxR总体上处于平稳趋势;冰藏初始点的肌肉ATP含量为2.95 μmol/g,贮藏1 d后急剧下降至0.6 μmol/g,此后ATP全部降解为其他代谢产物;贮藏2 d后,肌肉中检出HxR,在随后的贮藏过程中含量不断增加。
2.1.3 冰藏期间糖原、乳酸含量及pH值的变化 从表2可见:死后鱼体短时间内依靠消耗糖原继续合成ATP维持细胞活动,锁鲜组初始点(0 d)肌肉糖原含量为5.28 mg/g,贮藏1 d时糖原含量急剧下降至1.25 mg/g,随着贮藏时间的延长糖原持续降解,在贮藏7 d时糖原含量降至0.43 mg/g;贮藏初期的乳酸含量为0.15 mmol/g,由于糖酵解产生的乳酸在肌肉中不断累积,在贮藏6 d时乳酸含量达到最高值0.28 mmol/g;肌肉pH值在初始点为7.10,乳酸蓄积后,在贮藏2 d时达到最低点6.61,随着碱性含氮代谢产物的产生pH呈现上升趋势。可见,大菱鲆在冰藏期间具有良好的生化贮藏稳定性。
表2 冰藏期间大菱鲆ATP关联物、糖原、乳酸含量及pH值的变化
Tab.2 Changes in contents of ATP-related compounds,glycogen, and lactic acid and pH in muscle of turbot Scophthalmus maximus during ice storage
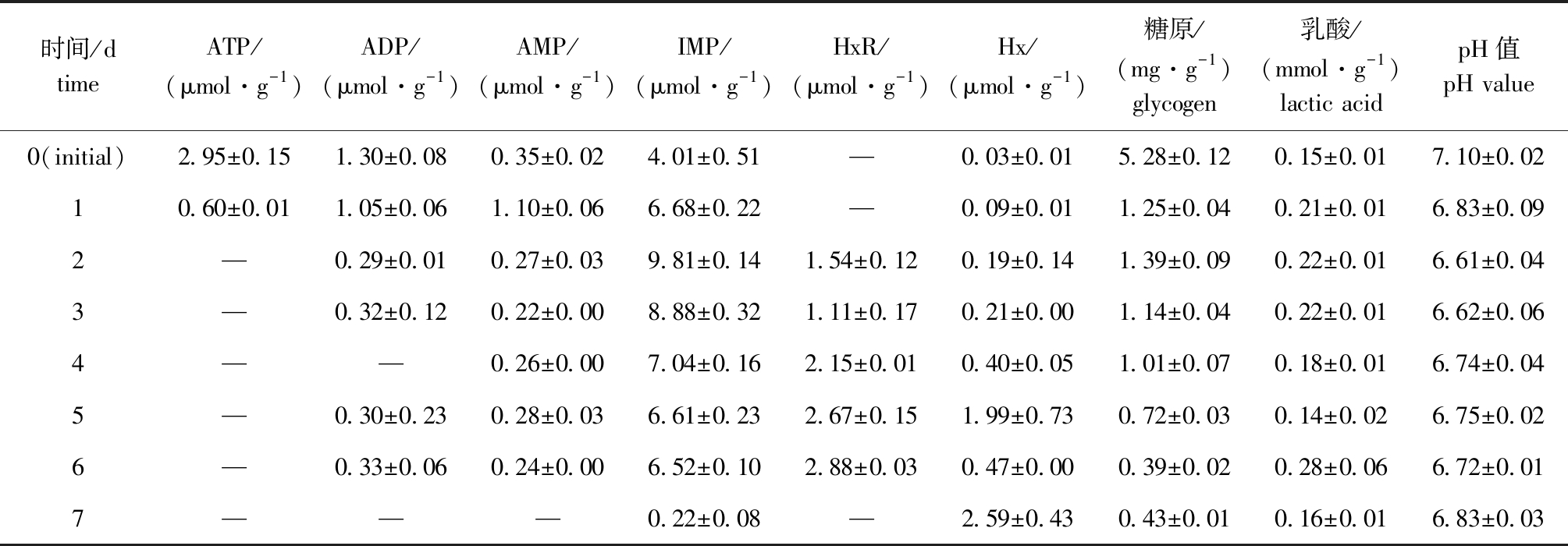
时间/dtimeATP/(μmol·g-1)ADP/(μmol·g-1)AMP/(μmol·g-1)IMP/(μmol·g-1)HxR/(μmol·g-1)Hx/(μmol·g-1)糖原/(mg·g-1)glycogen乳酸/(mmol·g-1)lactic acidpH值pH value0(initial)2.95±0.151.30±0.080.35±0.024.01±0.51—0.03±0.015.28±0.120.15±0.017.10±0.0210.60±0.011.05±0.061.10±0.066.68±0.22—0.09±0.011.25±0.040.21±0.016.83±0.092—0.29±0.010.27±0.039.81±0.141.54±0.120.19±0.141.39±0.090.22±0.016.61±0.043—0.32±0.120.22±0.008.88±0.321.11±0.170.21±0.001.14±0.040.22±0.016.62±0.064——0.26±0.007.04±0.162.15±0.010.40±0.051.01±0.070.18±0.016.74±0.045—0.30±0.230.28±0.036.61±0.232.67±0.151.99±0.730.72±0.030.14±0.026.75±0.026—0.33±0.060.24±0.006.52±0.102.88±0.030.47±0.000.39±0.020.28±0.066.72±0.017———0.22±0.08—2.59±0.430.43±0.010.16±0.016.83±0.03
2.2 暂养处置对活体疲劳应激消除的作用
2.2.1 暂养期间ATP及其关联物含量的变化 鉴于活鱼供应链较为复杂多样,若仅依赖零售端的保活条件,将极大地制约活鱼的货架期,故本研究中尝试捕后销售中间环节的暂养处置。
从表3可见:采捕即捕后初期的装运胁迫致使活体处于应激状态,明显可以看出,暂养期间大菱鲆从疲劳状态逐渐呈现恢复趋势。健康活体大菱鲆经捕捞、捕后处置及活鱼运输至实验室,共历时2 h左右,此时活鱼处于强烈的疲劳应激状态,应激恢复组活鱼肌肉ATP含量仅为1.31 μmol/g,从暂养第2天时开始呈现明显上升趋势,暂养7 d时ATP含量恢复至3.58 μmol/g,而疲劳状态时肌肉IMP含量为5.86 μmol/g,暂养2 d时呈现下降趋势,与ATP呈负相关变化。同时检出少量其他降解产物AMP、ADP、HxR、Hx,其中AMP、ADP、Hx在暂养过程中基本维持平稳状态,而HxR仅在初始点和暂养第3天时检出。
2.2.2 暂养期间糖原、乳酸含量及pH值的变化 从表3可见:在暂养期间肌肉糖原含量持续增加,乳酸含量相应下降;暂养7 d后糖原含量由初始点的4.49 mg/g升至8.17 mg/g,而肌肉乳酸含量由初始点的0.15 mol/g下降至0.10 mol/g;由于乳酸含量减少,pH值逐渐升高。可见,暂养处理有助于大菱鲆鱼肉品质的恢复。
表3 暂养期间大菱鲆ATP关联物、糖原、乳酸含量及pH值的变化
Tab.3 Changes in contents of ATP-related compounds,glycogen, and lactic acid and pH in muscle of turbot Scophthalmus maximus during holding
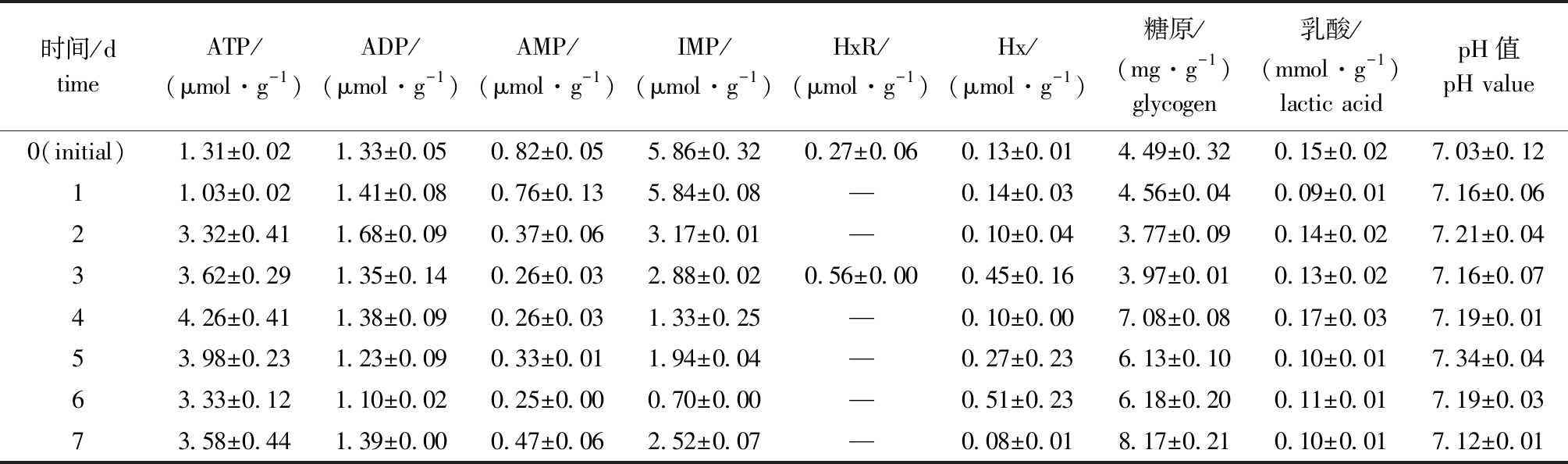
时间/dtimeATP/(μmol·g-1)ADP/(μmol·g-1)AMP/(μmol·g-1)IMP/(μmol·g-1)HxR/(μmol·g-1)Hx/(μmol·g-1)糖原/(mg·g-1)glycogen乳酸/(mmol·g-1)lactic acidpH值pH value0(initial)1.31±0.021.33±0.050.82±0.055.86±0.320.27±0.060.13±0.014.49±0.320.15±0.027.03±0.1211.03±0.021.41±0.080.76±0.135.84±0.08—0.14±0.034.56±0.040.09±0.017.16±0.0623.32±0.411.68±0.090.37±0.063.17±0.01—0.10±0.043.77±0.090.14±0.027.21±0.0433.62±0.291.35±0.140.26±0.032.88±0.020.56±0.000.45±0.163.97±0.010.13±0.027.16±0.0744.26±0.411.38±0.090.26±0.031.33±0.25—0.10±0.007.08±0.080.17±0.037.19±0.0153.98±0.231.23±0.090.33±0.011.94±0.04—0.27±0.236.13±0.100.10±0.017.34±0.0463.33±0.121.10±0.020.25±0.000.70±0.00—0.51±0.236.18±0.200.11±0.017.19±0.0373.58±0.441.39±0.000.47±0.062.52±0.07—0.08±0.018.17±0.210.10±0.017.12±0.01
2.3 市售大菱鲆鲜活品品质对比分析
对市售不同状态下大菱鲆的生化指标进行分析,并以经暂养7 d后疲劳恢复的活体大菱鲆即应激恢复组作为对照,结果显示(表4):市售大菱鲆经市场或超市购回20 min抵达实验室后,市售活鱼肌肉ATP仅为1.70 μmol/g,而市售因疲劳而濒死鱼的肌肉ATP几乎完全降解,而处于理想状态的对照组则高达3.58 μmol/g;活品组、濒死组1和濒死组2大菱鲆的肌肉糖原含量分别为2.81、3.76、3.91 mg/g,而对照组糖原含量则高达8.17 mg/g;乳酸及肌肉pH值4组变化不明显,濒死组1的pH值仅为6.74,相对于对照组较低。可见,暂养处理对大菱鲆品质恢复起到了重要作用。
表4 市售大菱鲆肌肉生化特性分析
Tab.4 Analysis of muscle biochemical characteristics of turbot Scophthalmus maximus in local markets

组别 groupATP/(μmol·g-1)糖原/(mg·g-1)glycogen乳酸/(mmol·g-1) lactic acidpH值 pH value活品组live group 1.70±0.052.81±0.050.08±0.027.02±0.04濒死组1 fatigue 10.57±0.153.76±0.020.11±0.086.74±0.06濒死组2 fatigue 20.59±0.093.91±0.110.14±0.027.02±0.04对照(暂养7 d) recovering3.58±0.448.17±0.210.10±0.017.12±0.01
2.4 不同处理下大菱鲆肌肉蛋白组分的差异
2.4.1 冰藏期间肌肉蛋白组分变化 鱼类肌肉蛋白组成中,肌原纤维蛋白占总蛋白的50%~70%,肌原纤维蛋白的稳定性及其调控机制是解读冷鲜鱼产品品质变化的核心。图1为速杀大菱鲆在冰藏期间全蛋白组分变化,从中可以清晰地分辨出20~30条蛋白条带,主要为肌球蛋白重链(MHC,相对分子质量200 000)、肌动蛋白(actin,44 000)、原肌球蛋白(α-或β-tropomyosin,35 000)、肌球蛋白轻链(MLC,14 000),以及相对分子质量为20 000~40 000的明显条带。从电泳图上显示的条带可以看出,速杀致死的大菱鲆肌肉在冰藏过程中各蛋白质组分并未发生明显降解,由此表明,基于本研究设计的锁鲜处置条件中,处理后的大菱鲆具有较好的冰藏稳定性。
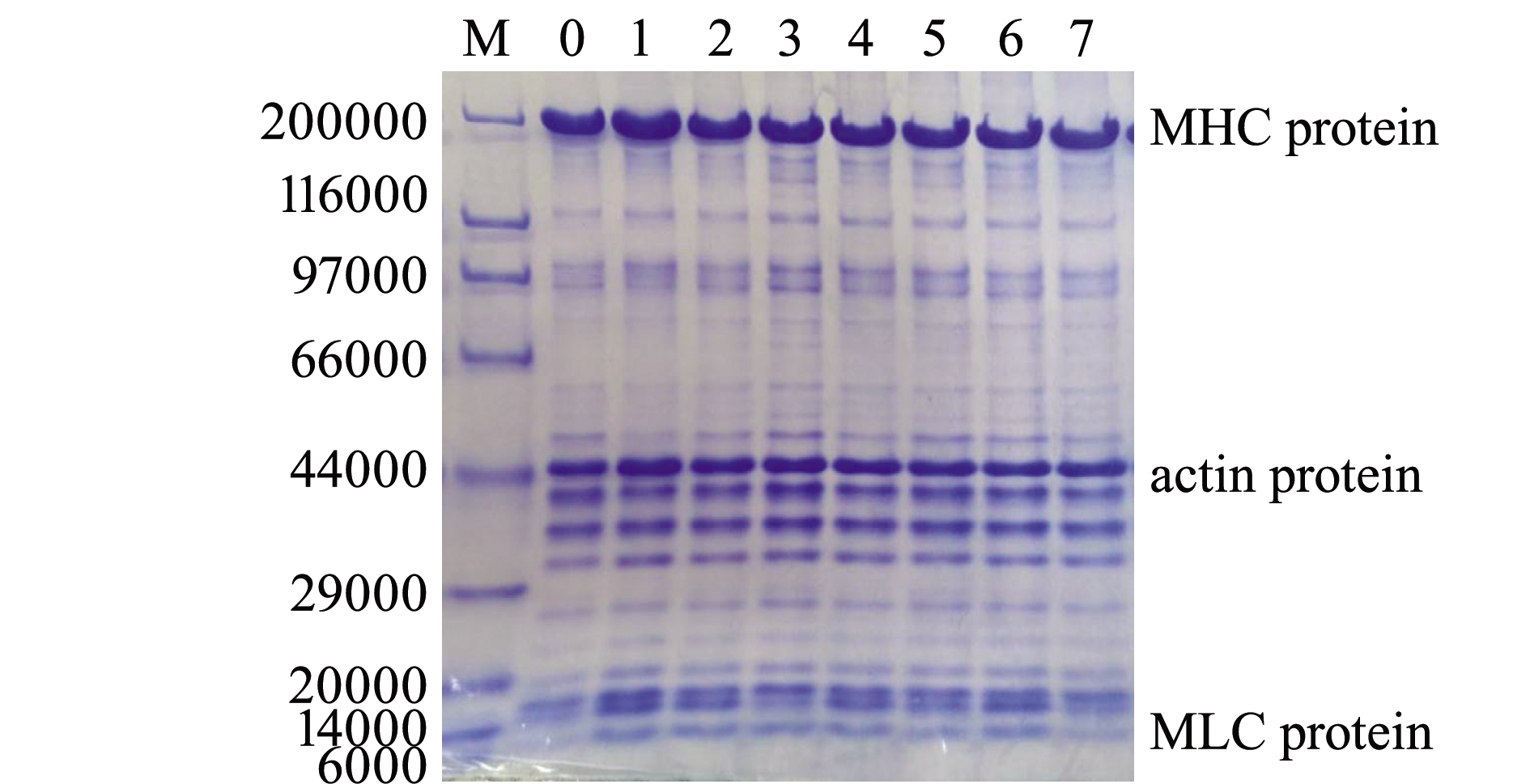
注:M,标准蛋白; 0,无应激组; 1~7,锁鲜组1~7 d
Note:M,Marker; 0,non-stressed group; 1-7,fresh-locking group in 1-7 d
图1 大菱鲆冰藏期间蛋白组分的变化
Fig.1 SDA-PAGE analysis of muscle protein in turbot Scophthalmus maximus during 7 d ice storage
2.4.2 不同处置条件的肌肉蛋白组分对比 不同的致死方式及活体所处的环境都会对肌肉蛋白变化产生影响。在极端致死方式中,窒息死亡相对于断髓速杀方式致死大菱鲆鱼体鲜度从生化特性中表现为迅速下降,同样也可从肌肉蛋白稳定性反映出其鲜度的变化。如图2所示,窒息组的肌球蛋白重链MHC和肌球蛋白轻链MLC相对于健康组(无应激组)降解较为明显,肌动蛋白actin也显示降解明显;而活品组由于活体运输或在售卖过程中的应激疲劳所致的品质下降,使得MHC及actin的降解程度更为严重,甚至超过了冰藏7 d的鲜品。
3 讨论
3.1 不同处置条件对肌肉生化特性的影响
鱼体死后依靠体内糖原无氧糖酵解产生能量,由于不同的致死方式对鱼体产生的影响不同[2],肌肉ATP及糖原含量也有很大的差异。先前的研究报道中,通过刺脑、放血及延髓破坏神经的速杀方法,对竹荚鱼Horse mackerel进行人道处死后,测得ATP含量为6~7 mmol/g,均高于窒息等其他方式致死[11]。本研究中与应激恢复组相比,当场速杀即健康组的初始ATP含量较低,分析原因可能是因为速杀后没有立即进行取样,经过处理及运输2 h后,肌肉中的ATP已经发生降解。但窒息组由于挣扎致死,死后ATP已全部降解。鱼体死后ATP被迅速分解为ADP、AMP、IMP、HxR、Hx等代谢产物,由于5′-核苷酸酶活性较低,导致IMP在体内蓄积[12]。IMP作为鱼肉中重要的鲜味呈味物质[13],在贮藏6 d时其含量依然维持较高水平,可以看出大菱鲆具有较好的冰藏稳定性。对红鳍东方鲀Takifugu rubripes冰藏过程中生化特性的研究表明,速杀后冰藏的红鳍东方鲀冰藏1 d后肌肉中糖原含量由10.92 mg/g降至1.0 mg/g左右[14]。本研究中锁鲜组大菱鲆在冰藏1 d后糖原含量急剧下降,而窒息组糖原含量在死后已经下降至较低水平。对比之下,断髓速杀致死的大菱鲆具有窒息方式致死无可比拟的品质。
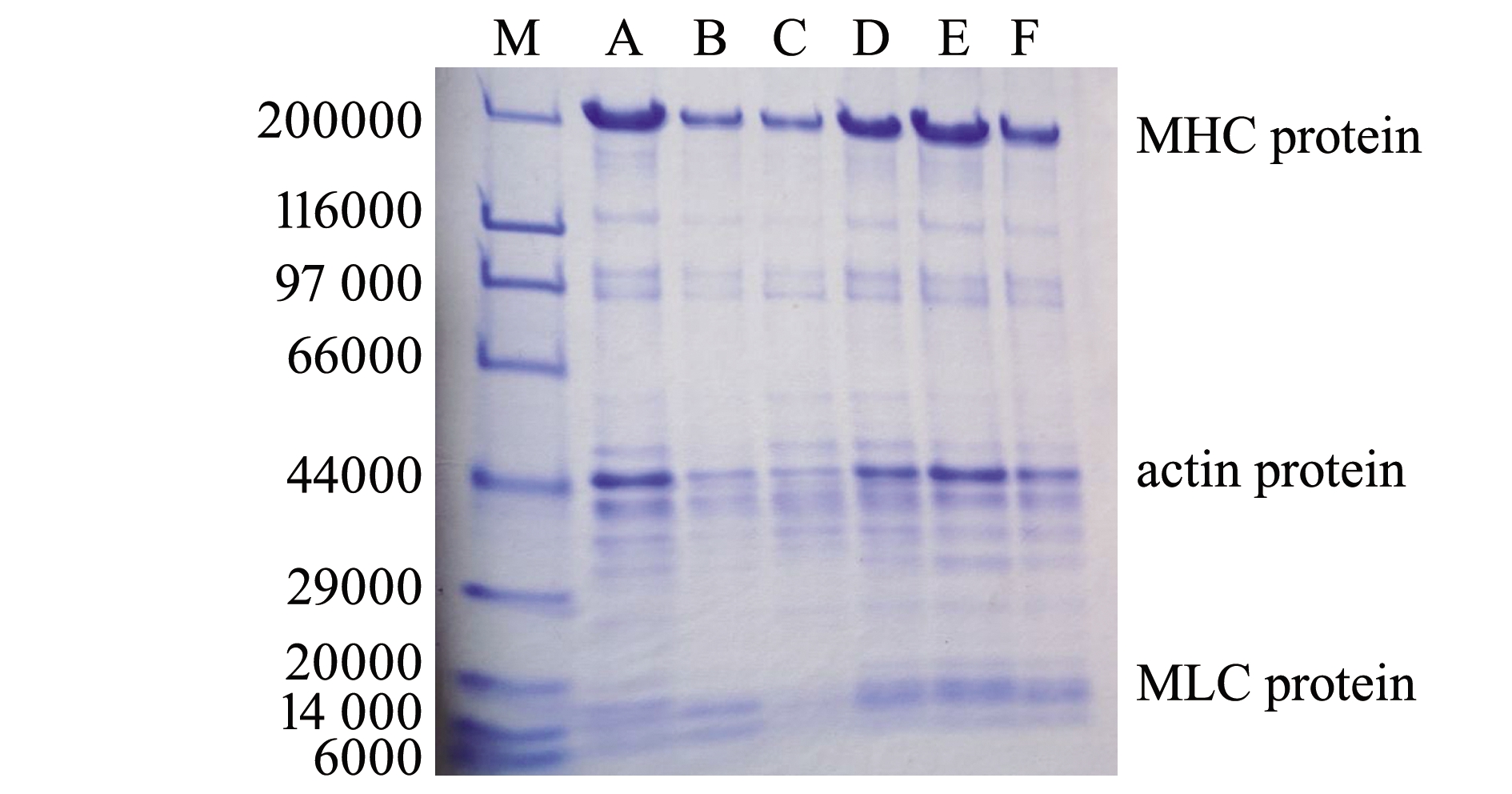
注:M,标准蛋白; A,无应激组; B,活品组; C,濒死组1; D,濒死组2; E,锁鲜组7 d; F,窒息组
Note: M,Marker; A,non-stressed group; B,live group; C,dying-1 group; D,dying-2 group; E,fresh-locking group; F,asphyxia
图2 不同处置条件下大菱鲆蛋白组分的变化
Fig.2 Change in muscle protein in turbot Scophthalmus maximus exposed to various conditions
当肌肉剧烈运动时,氧气供应不足,肌肉代谢机制由三羧酸循环转化为无氧糖酵解,葡萄糖降解产生的丙酮酸形成乳酸累积在细胞内[12],导致体内pH下降。虹鳟及鲤Cyprinus carpio因窒息挣扎而死,体内糖原迅速被消耗,乳酸快速积累,使得虹鳟和鲤的肌肉pH值分别由敲击致死的6.46、6.81下降至6.37、6.72,乳酸含量迅速升至较高水平[15]。本研究中,经断髓速杀致死的健康组大菱鲆pH值处于较高水平,窒息致死大菱鲆由于挣扎,肌肉中乳酸含量增加,相对于健康组的pH值显著降低。速杀方式致死的大菱鲆在随后的冰藏过程中由于乳酸的积累pH急剧下降,冰藏2 d时pH下降至最低值后又呈现上升趋势。这种先下降后上升的变化趋势是由于鱼体死后糖原酵解产生乳酸,ATP降解产生磷酸,使肌肉pH值降低;随着碱性含氮物质生成,pH值又呈现上升趋势[16]。
对于动物源性食品原料,屠宰前的处理条件是造成胴体及质量缺陷的重要因素之一,例如在运输过程中的拥挤、水质恶化、受伤、窒息等[17]。刘慧慧等[18]对捕后菲律宾蛤仔Ruditapes philippinarum生化特性变化的研究发现,从采捕起至加工净化过程中,急性胁迫导致风味急剧下降,是菲律宾蛤仔风味品质的易逝期,而短期的干露静置(3 d 内)使其生化指标及风味品质均呈现恢复。本研究中健康活体大菱鲆经采捕运输到达实验室后,肌肉中ATP含量较低,经暂养处置后ATP在第2天时恢复至正常水平并在7 d的暂养过程中保持平稳趋势。市售组由于售卖时水体环境恶劣或运输过程中的疲劳应激,使得ATP含量也处于较低水平。由此可见,大菱鲆同样存在一个品质易逝期。在关于屠宰前处置对养殖虹鳟品质的影响的研究中,虹鳟经运输后血液中乳酸含量由在养殖场的0.4 mmol/L上升至1.9 mmol/L,乳酸含量显著增加[4]。本研究中活体大菱鲆经采捕运输处置后肌肉乳酸含量较高,暂养后得以恢复至正常水平,而应激恢复组大菱鲆肌肉pH值变化不明显,市售组中pH值较低也是由于应激反应所致。可以看出,应激恢复组是由于运输产生应激导致其品质的下降,而暂养可缓解鱼所处的疲劳状态使得鱼肉品质得到明显恢复。
3.2 不同处置条件对肌肉蛋白组分的影响
肌肉蛋白主要由肌浆蛋白、肌原纤维蛋白和基质蛋白组成,其中肌原纤维含量比例最大[19]。在鱼类肌肉蛋白中,50%~70%是由肌原纤维蛋白构成,而肌球蛋白又占肌原纤维蛋白含量的40%~50%[12]。Li等[20]对养殖大黄鱼Pseudosciaena crocea在贮藏期间蛋白组分变化的研究发现,养殖大黄鱼在冰浆中致死后在4 ℃条件下贮藏20 d,期间MHC及actin蛋白逐渐发生降解。本研究中锁鲜组在冰藏7 d后的肌肉蛋白并无明显变化。进一步证明了离水后速杀大菱鲆在冰藏过程中具有良好的蛋白稳定性。相对于健康组(无应激组),窒息组的蛋白发生明显降解,分析是由于处死方式的不同造成鱼肉品质的差异,而市售大菱鲆肌球蛋白及肌动蛋白均发生了较为明显的降解。
4 结论
采捕离水后,不同时间及不同处置背景下,活体大菱鲆应激压力状态也不相同,导致死亡方式实质上存在内在的差异。本研究中各个样本所展示的肌肉生化特性的差异,与活体应激状态密切相关,最终由鱼肉品质反映出来。本研究主要结论如下:
(1)通过对比断髓速杀和窒息两种致死方式发现,断髓速杀致死的大菱鲆具有窒息方式致死无可比拟的品质。
(2)健康活体大菱鲆经采捕运输后经适宜条件下暂养,品质得以恢复,可以看出捕后大菱鲆存在一个品质易逝期。
(3)与市售鲜活产品相比,离水后即刻断髓速杀的冷鲜大菱鲆所展示的贮藏稳定性可以说明,源头锁鲜处理可以使品质更优。
通过以上结论可以发现,最大程度降低处死前的应激压力、源头锁鲜是提供稳定的高品质终端产品重要前提,有关养殖大菱鲆品质的探索还将展开进一步研究。
[1] Huss H H.Quality and quality changes in fresh fish[R].Rome,Italy:FAO,1995.
[2] Bagni M,Civitareale C,Priori A,et al.Pre-slaughter crowding stress and killing procedures affecting quality and welfare in sea bass (Dicentrarchus labrax) and sea bream (Sparus aurata)[J].Aquaculture,2007,263(1-4):52-60.
[3] Ørnholt-Johansson G,Frosch S,Jørgensen B M.Variation in some quality attributes of Atlantic salmon fillets from aquaculture related to geographic origin and water temperature[J].Aquaculture,2017,479:378-383.
[4] Merkin G V,Roth B,Gjerstad C,et al.Effect of pre-slaughter procedures on stress responses and some quality parameters in sea-farmed rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2010,309(1-4):231-235.
[5] Matos E,Gonçalves A,Nunes M L,et al.Effect of harvesting stress and slaughter conditions on selected flesh quality criteria of gilthead seabream (Sparus aurata)[J].Aquaculture,2010,305(1-4):66-72.
[6] Hultmann L,Phu T M,Tobiassen T,et al.Effects of pre-slaughter stress on proteolytic enzyme activities and muscle quality of farmed Atlantic cod (Gadus morhua)[J].Food Chemistry,2012,134(3):1399-1408.
[7] 雷霁霖,梁萌青,刘新富,等.大菱鲆营养成分与食用价值研究概述[J].海洋水产研究,2008,29(4):112-115.
[8] Poli B M,Parisi G,Scappini F,et al.Fish welfare and quality as affected by pre-slaughter and slaughter management[J].Aquaculture International,2005,13(1-2):29-49.
[9] Ando M,Nishiyabu A,Tsukamasa Y,et al.Post-mortem softening of fish muscle during chilled storage as affected by bleeding[J].Journal of Food Science,1999,64(3):423-428.
[10] Tulli F,Fabbro A,D’Agaro E,et al.The effect of slaughtering methods on actin degradation and on muscle quality attributes of farmed European sea bass (Dicentrarchus labrax)[J].Journal of Food Science and Technology,2015,52(11):7182-7190.
[11] Mishima T,Nonaka T,Okamoto A,et al.Influence of storage temperatures and killing procedures on post-mortem changes in the muscle of horse mackerel caught near Nagasaki Prefecture,Japan[J].Fisheries Science,2005,71(1):187-194.
[12] 渡部终五.水产利用化学基础[M].林华娟,毛伟杰,译.北京:化学工业出版社,2017:27-29.
[13] Seki H,Hamada-Sato N.Effect of various salts on inosinic acid-degrading enzyme activity in white and dark muscle of the Pacific saury[J].Fisheries Science,2015,81(2):365-371.
[14] 冷寒冰,刘俊荣.红鳍东方鲀死后僵直及生化变化特性[J].水产学报,2020,44(1):156-165.
[15] Duran A,Erdemli U,Karakaya M,et al.Effects of slaughter methods on physical,biochemical and microbiological quality of rainbow trout Oncorhynchus mykiss and mirror carp Cyprinus carpio filleted in pre-,in- or post-rigor periods[J].Fisheries Science,2008,74(5):1146-1156.
[16] 吕斌,陈舜胜,邓德文.三种淡水鱼肌肉的糖原、乳酸含量和pH值及在冷藏中的变化[J].上海水产大学学报,2001,10(3):239-242.
[17] Adzitey F.Effect of pre-slaughter animal handling on carcass and meat quality[J].International Food Research Journal,2001,18(2):485-491.
[18] 刘慧慧,刘俊荣,田元勇,等.易逝期干露对菲律宾蛤仔活品净化及贮藏特性的影响[J].大连海洋大学学报,2019,34(1):109-118.
[19] 宋扬,张晴,周晏琳,等.虾夷扇贝横纹肌和平滑肌的蛋白分布及理化性质[J].水产学报,2017,41(11):1798-1805.
[20] Li Tingting,Li Jianrong,Hu Wenzhong.Changes in microbiological,physicochemical and muscle proteins of post mortem large yellow croaker (Pseudosciaena crocea)[J].Food Control,2013,34(2):514-520.