狭鳕Gadus chalcogrammus (Pallas, 1814),曾被称为Theragra chalcogrammus,隶属于硬骨鱼纲鳕形目鳕科,是目前世界上最为重要、最有商业价值的鱼类资源之一[1],狭鳕广泛分布于北太平洋,白令海水域其资源密度最为集中[2],栖息水层为50~360 m[3]。狭鳕占据着北太平洋海洋食物链的中心位置,其主要捕食对象为桡足类[4],同时狭鳕也是许多大型鱼类、海鸟及海洋哺乳动物的重要捕食对象,是该海区生态系统中物质和能量分配的关键物种。
鱼体的能量密度是衡量鱼类身体能量储备水平的重要生物学指标,反映了鱼类不同生活史阶段中的生理状态及营养水平[5]。通常鱼类的能量密度会随着性腺发育程度表现出相应的动态特征,因此,针对性腺组织能量密度变化的研究,有助于更好地了解该鱼种的生殖投入方式及繁殖产卵策略[4]。目前,针对狭鳕的生长[4]、年龄[6-7]及资源量[8]等已有较多报道,但关于该鱼种的繁殖及能量密度方面则鲜有研究。国内关于狭鳕的研究较少,且多集中在20世纪90年代以前。本研究中,分析了西白令海狭鳕性腺组织的能量密度,探究了狭鳕性腺组织的能量密度变化与环境因子间的关系,旨在了解狭鳕随个体生长性腺组织的能量密度变化规律及主要影响因素,为进一步了解该鱼种在北太平洋生态系统能量传递过程中发挥的作用及产卵机制提供基础数据。
1 材料与方法
1.1 材料
狭鳕样本由大型拖网船“开利”轮采集于西白令海,采样时间分别为2017年6—9月和2018年8—10月。调查海域及站位见图1,共收集94尾狭鳕样本,其中2017年50尾,2018年44尾。所有海上采集的样本均置于-20 ℃下冷冻保存。
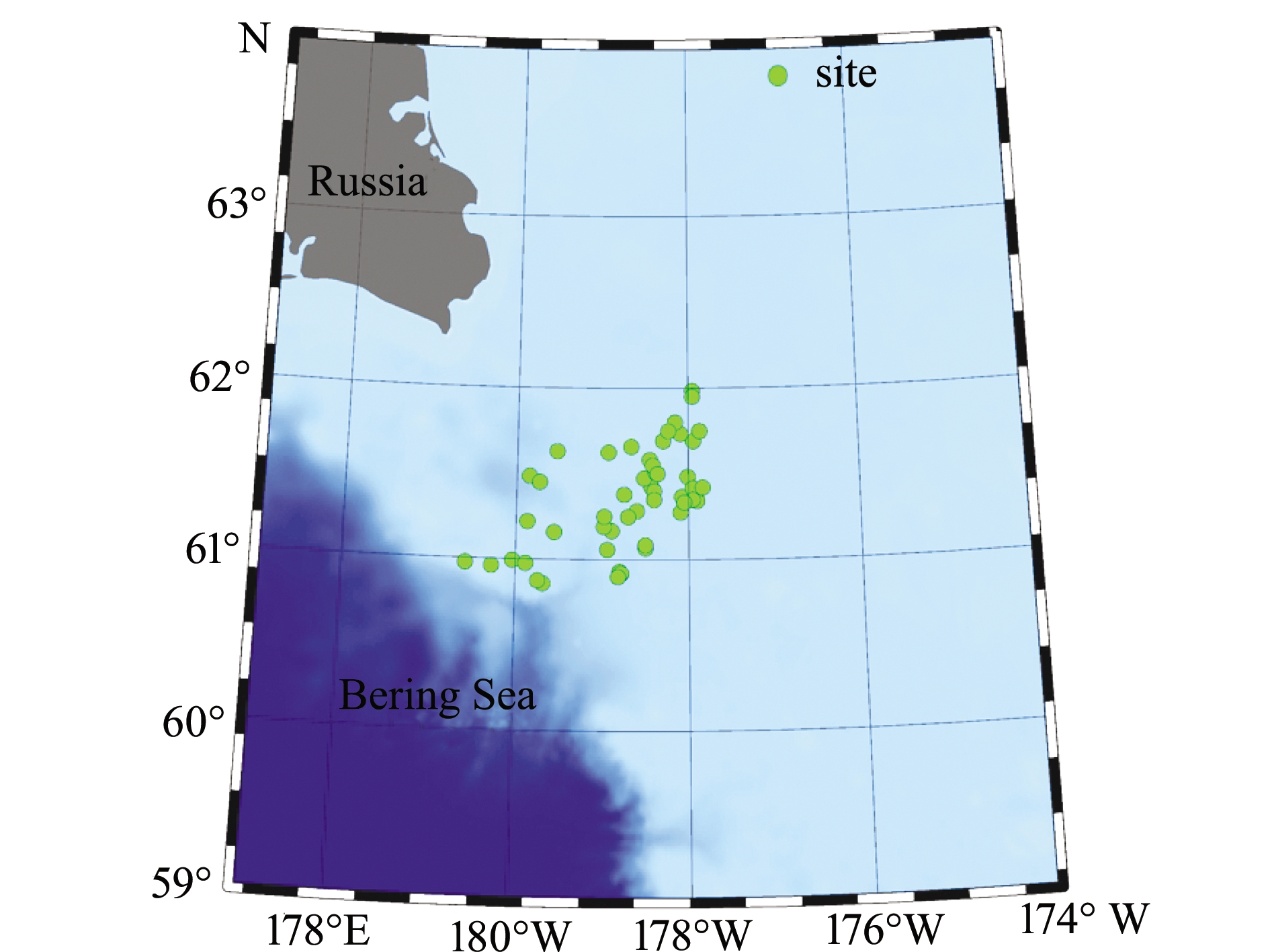
图1 调查区域与采样站位
Fig.1 Surveryed area showing the sampling locations
1.2 方法
1.2.1 样品的采集与处理 样品在实验室解冻后,首先进行生物学测定,测定内容包括体长(L)、体质量(W)和性腺成熟度等,其中,体长测量使用精度为1 mm 的钢尺,体质量测定使用精度为1 g的电子秤。测定并记录生物学指标后,取样本性腺保存于有标记号的塑料管中,用于后续能量密度的测定。以Zhukova[9]的性腺成熟度划分标准为基础,结合狭鳕生殖系统发育情况,对样本进行性成熟度等级鉴别。
采集狭鳕性腺组织样本约2 g,置于冷冻干燥机(Christ Alpha 1-4/L Dplus)于-80 ℃下冷冻干燥;组织样本干燥后,置于研磨机(Retsch MM 400)中研磨粉碎;然后在Parr 6100型氧弹热量仪(Parr Instrument Company, Moline, IL,USA)中测定组织能量密度(energy density, ED)(kJ/g)。
1.2.2 性腺组织能量密度与各因素的相关性分析利用幂函数拟合狭鳕个体的体质量与体长关系,并利用单因子方差分析法进行检验。利用Shaipro-Wilk检验数据的正态性。如数据呈正态分布,利用t检验分析性腺组织能量密度的体长差异性;如数据呈非正态性,则利用非参数Kruskal-Wallis检验。利用Pearson相关分析对能量密度的动态变化与各影响因子的相关性进行分析。
广义加性模型(Generalized additive model,GAM)为广义线性模型的非参数化扩展,适用于处理响应变量与多个解释变量间的非线性或非单调关系[10]。本研究中,以狭鳕性腺组织的能量密度作为响应变量,以体长、经度、纬度和性成熟度作为解释变量,建立GAM模型,分析西白令海的狭鳕性腺组织的能量密度与各影响因子间的关系。GAM模型表达式为
ln(ED)=s(Lati)+s(Long)+s(SM)+s(L)+ε。
其中:ED为能量密度;s为自然立方样条平滑;Lati为纬度;Long为经度;SM为性成熟度;L为体长;ε为残差。利用赤池信息准则(Akaike information criterion,AIC)检验逐步加入因子后模型的拟合程度,其值越小表明模型的拟合效果越佳[11]。利用F检验评估各因子的显著性。GAM模型的运算通过R 3.5.2程序实现。
1.3 数据处理
利用SPSS 19.0软件对试验数据进行分析,显著性水平设为0.05。
2 结果与分析
2.1 体长与体质量
经检验,2017年和2018年狭鳕的体长均符合正态分布,且两年样本的体长间存在显著性差异(t=10.626,P<0.05),故将两个年份的狭鳕样本分开进行分析。2017、2018年的体长范围分别为23.8~39.6、30.5~51.7 cm,平均体长分别为(30.58±2.84)、(39.97±5.14)cm,体质量范围分别为141.5~668.3 g、278.1~1215.3 g,平均体质量分别为(319.17±93.47)、(660.45±244.51)g。2017、2018年狭鳕体长与体质量的关系如图2所示,关系方程分别为

图2 2017年和2018年夏季狭鳕体长与体质量的关系
Fig.2 Relationship between body length and body weight of Alaska pollock Gadus chalcogrammus during summer in 2017 and 2018
W2017=1.357×10-2L2.9354,R2=0.8463,
n=50,P<0.001;
W2018=3.257×10-2L2.6794,R2=0.8899,
n=44,P<0.001。
2.2 性腺组织能量密度与各因素的相关性
经检验,2017年和2018年狭鳕的性腺组织能量密度均符合正态分布,且两年样本性腺组织的能量密度间存在显著性差异(t=3.481,P<0.05),故将两年的能量密度分开分析。2017年和2018年夏季西白令海狭鳕的性腺组织能量密度实测值分别为20.00~26.38 kJ/g(平均为22.28 kJ/g±1.37 kJ/g)和22.09~26.69 kJ/g(平均为24.27 kJ/g±1.09 kJ/g)。随着个体生长发育,性腺组织不断积累能量,并均在性腺成熟度Ⅳ期达到最大值(表1)。
表1 2017年和2018年夏季狭鳕性腺成熟度与性腺组织能量密度的关系
Tab.1 Relationship between sexual maturity and energy density in gonad of Alaska pollock Gadus chalcogrammus during summer in 2017 and 2018
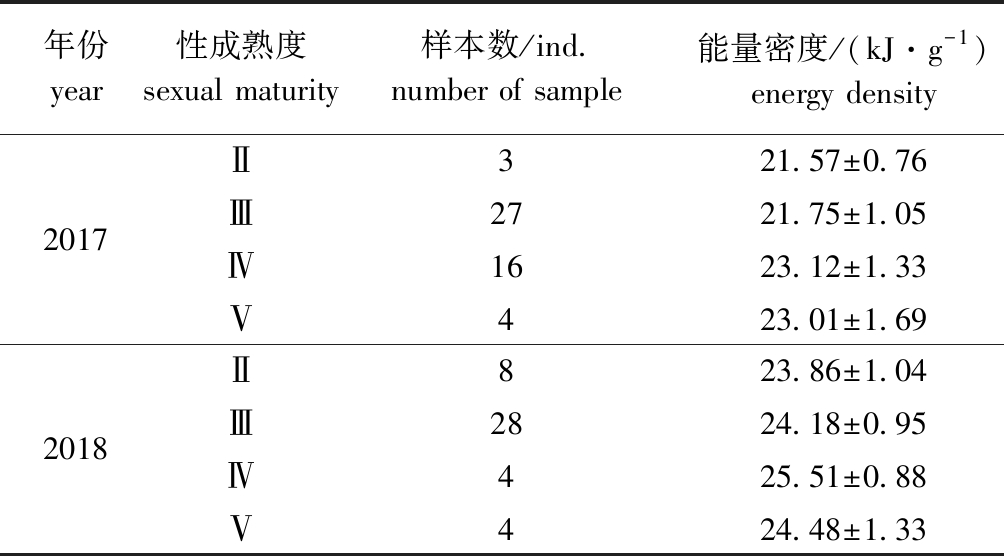
年份year性成熟度sexual maturity样本数/ind.number of sample能量密度/(kJ·g-1)energy density2017Ⅱ321.57±0.76Ⅲ2721.75±1.05Ⅳ1623.12±1.33Ⅴ423.01±1.692018Ⅱ823.86±1.04Ⅲ2824.18±0.95Ⅳ425.51±0.88Ⅴ424.48±1.33
对2017年和2018年狭鳕性腺组织的能量密度与各因子进行相关分析(表2),结果表明,能量密度仅与性成熟度呈显著或极显著性相关(P<0.05或P<0.01),与其他因子均无显著性相关(P>0.05)。
表2 能量密度与各因素的相关系数
Tab.2 Correlation coefficients between energy density of Alaska pollock Gadus chalcogrammus gonadal tissue and various factors

年份year体长 body length体质量body weight性成熟度sexual maturity20170.037-0.1370.384∗∗20180.0220.1650.320∗
注: *表示显著相关(P<0.05), **表示极显著相关(P<0.01)
Note: * means significant correlations(P<0.05), **means very significant correlations(P<0.01)
2.3 影响能量密度的因素
GAM模型分析结果(表3)显示:该模型对2017年和2018年西白令海狭鳕的性腺组织能量密度的总解释率为25.2%和8.82%;贡献最大的因子均为性成熟度,其贡献率分别为15.28%(2017年)和4.93%(2018年),而其他因子对模型的贡献较小。
经检验表明,纬度和性成熟度对2017年狭鳕样本的性腺组织能量密度有显著影响(P<0.05),而2018年样本的性腺组织能量密度与各因子间均无显著性关系(P>0.05)(表3)。同时也发现,随着影响因子的逐步加入,GAM模型的AIC值随之变小,表明模型的拟合程度也有所提高,因此,模型保留了所有影响因子。
表3 GAM模型统计结果
Tab.3 Statistical results of GAM

模型因子 factor年份 year估计自由度 estimated df参考自由度 referred dfF值 F valueP值P value解释偏差/%accumulation of deviance explained赤池信息准则AIC经度 longitude20171.0001.0001.420.23994.81137.7220181.0001.0000.910.34703.78144.25纬度 latitude20171.0001.0004.520.0390∗4.89136.0020181.0001.0000.690.40900.09143.00体长 body length20171.0001.0001.780.18860.22134.1220181.0001.0000.030.86900.02141.01性成熟度 sexual maturity20171.0001.0009.180.0039∗15.28131.4120181.4211.6640.570.40804.93140.00
注:*表示有显著性影响(P<0.05),**表示有极显著性影响(P<0.01)
Note: *means significant effect(P<0.05),** means very significant effect(P<0.01)
从图3可见:2017年,随着经度和纬度的增加,二者对狭鳕性腺组织能量密度的影响逐渐减小;而2018年,随着经度的增加,其对性腺组织能量密度的影响逐渐增大,相反,随着纬度的增加,其对性腺组织能量密度的影响逐渐减小;2017年,体长为24~40 cm的狭鳕个体随着体长的增加,其对性腺组织能量密度的影响逐渐减小,而2018年,体长为30~50 cm的狭鳕个体随着体长的增加,其对性腺组织能量密度的影响略有增大,但基本平稳;性成熟度对能量密度的影响是所有因子中影响最为显著的因子,2018年的狭鳕样本中,能量密度在产卵前(Ⅳ期前)基本保持稳定,但总体来说,两个年份的狭鳕个体随着性成熟度增大,其对能量密度的影响也逐渐增大。
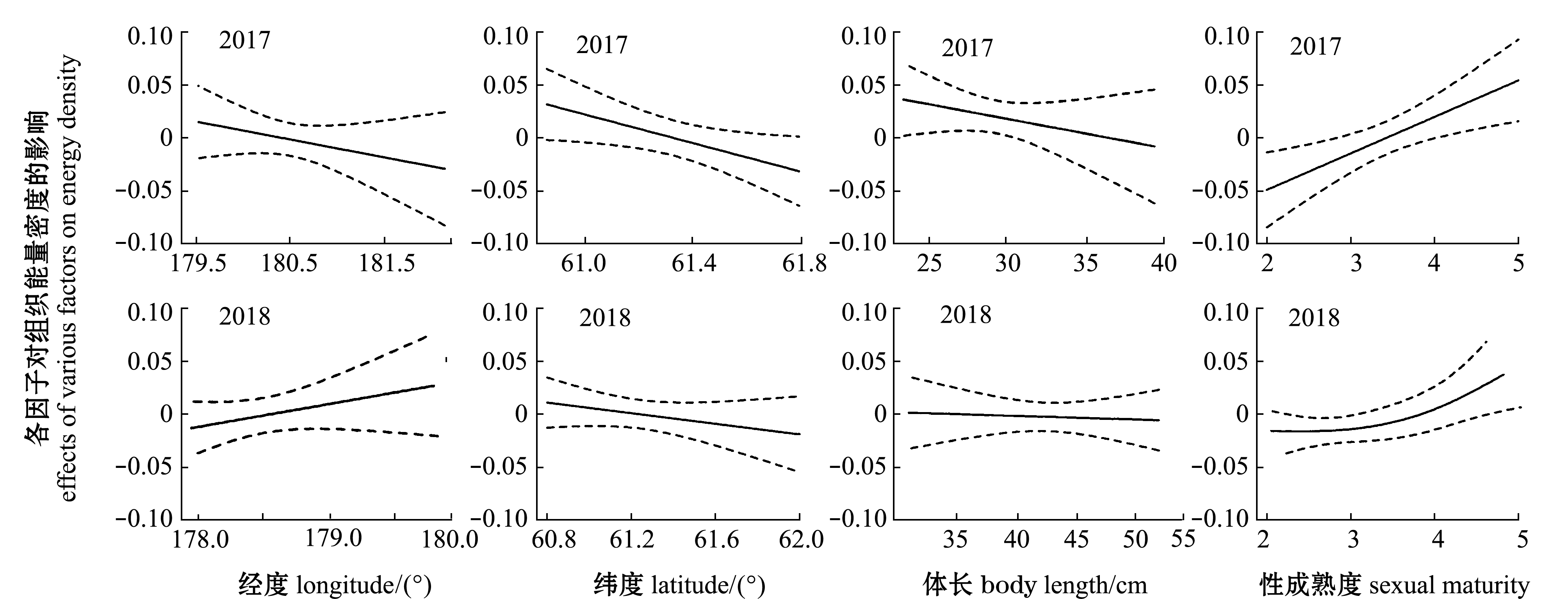
图3 2017和2018年夏季各因素对狭鳕组织能量密度的影响
Fig.3 Effects of various factors on energy density in gonad of Alaska pollock Gadus chalcogrammus during summer in 2017 and 2018
3 讨论
3.1 个体生物学特性
体长和体质量的关系一般可用于了解鱼类生长的季节性变化,评估鱼类生长环境的优劣和鱼类的营养状况,比较不同种或种群间生活史和体型特征的差异[12]。通常情况下,狭鳕在第一年可生长到15 cm,在两年后生长至32 cm,但季节性差异对体长也有一定影响[11]。本研究中样本采集时间均为6—10月,2017年和2018年样本体长范围分别为23.8~39.6 cm和30.5~51.7 cm。而西白令海狭鳕产卵期为4—6月,雌性和雄性分别在体长为34.8 cm和32.2 cm时达到性成熟[13]。因此,可以推测本研究中2017年所采集的狭鳕样本多处于未成熟状态,而2018年所采集的狭鳕样本多为产卵过后的个体。
通常不同海区相同体长的狭鳕间体质量存在着差异[14],而体长-体质量幂函数关系式的b值,可以作为表征鱼类生长率、身体形态发育等差异性的指标之一[15],并用于评估狭鳕的身体状况。据Hinckley[2]的研究,白令海狭鳕往往表现为异速生长,此时b值可以解释为两种情况(表4):(1)b<3的为负异速生长,即体长生长比体质量增长快,如东南陆架、阿留申海盆的群体;(2)b>3的为正异速生长,即体质量增长比体长生长快,如西北陆坡、东南陆坡的群体[15]。本研究中,西白令海狭鳕个体表现为负异速生长(b=2.68),这表明经历产卵期后的狭鳕身体状况受到一定影响,而这可能是狭鳕产卵时停止摄食所导致的[16]。
表4 白令海各海区狭鳕的体长-体质量关系
Tab.4 Length-weight relationship of Alaska pollock Gadus chalcogrammus in different regions of the Bering Sea
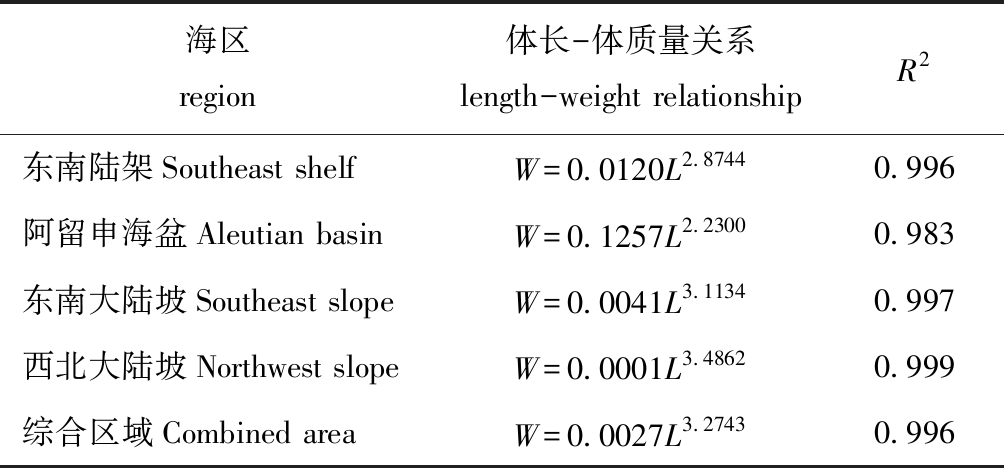
海区region体长-体质量关系length-weight relationshipR2东南陆架Southeast shelfW=0.0120L2.87440.996阿留申海盆Aleutian basinW=0.1257L2.23000.983东南大陆坡Southeast slopeW=0.0041L3.11340.997西北大陆坡Northwest slopeW=0.0001L3.48620.999综合区域Combined areaW=0.0027L3.27430.996
3.2 组织能量密度
组织能量密度是衡量能量储备的重要指标之一,是生物同化和异化作用的共同结果[17]。本研究显示,大个体狭鳕的性腺组织能量密度值显著高于小个体(P<0.05)。在个体生长发育成熟的过程中,性腺组织的能量密度值随着性腺发育成熟均呈现增长的趋势,但成熟度等级间均无显著性差异(P>0.05)。其中产卵前后能量密度发生较大变化的原因可能与性腺成熟度为Ⅱ期和Ⅴ期的样本较少有关,也可能与狭鳕性腺组织发育相对滞后有关[18],因为狭鳕通常直到发育至产卵期时性腺组织才开始迅速积累能量用于产卵。这也说明产卵时的狭鳕性腺组织能量密度达到最大值可能因发育成熟个体的生长、繁殖和储存能量的分配方式发生变化所致,产卵期个体的能量由大部分用于鱼体生长发育转变为更多地存储能量与脂质以用于繁殖。
Smith等[19]研究表明,狭鳕成熟个体产卵时基本会停止摄食,这期间的能量损失约占鱼体总能量的46%,而性腺组织的能量消耗在其中占据了较大一部分,其卵巢和精巢本身损失相当于初始能量的98%和94%。相比之下,大西洋鳕Gadus morhua产卵所消耗的能量约占鱼体总能量的30%[20]。这一差异可能来源于狭鳕在中上层聚集产卵,这与鳕类的底栖产卵方式相反[21]。
3.3 能量密度的影响因素
鱼类的能量密度会随着性腺发育程度的逐步推进而表现出相应的动态特征[22],而体型、性别、月份、繁殖状况、地理位置、年份等因素对能量密度皆有影响[16]。
本研究中,狭鳕性腺组织的能量密度与性成熟度相关性较为明显,而与体长、体质量、季节等因素无显著性相关。这可能源于发育过程中能量分配方式的转变:未成熟个体分配更高比例的同化能量用于生长,而对于已发育成熟的个体,其生长逐渐停缓,并存储更多的能量用于繁殖产卵,这种转变往往与性腺发育及鱼体营养状况密切相关[23]。狭鳕自性腺发育开始,发育前期鱼体生长迅速,性腺发育成熟后鱼体逐渐停止生长。而自产卵期(Ⅲ~Ⅳ期)开始,性腺组织迅速发育,能量密度值显著增长并在产卵时达到最大值。因此,狭鳕性腺组织的能量变化过程是发育前期鱼体生长逐渐向性腺组织快速生长转变的过程,也是产卵期间组织能量再分配的结果。
GAM模型结果显示,2017年所采集的狭鳕样本,体长和经度对性腺组织能量密度无显著性影响,而纬度和性成熟度对能量密度有显著性影响,这表明未成熟个体的能量水平不仅与自身发育情况有关,而且受到外界环境因素的影响,其原因在于鱼类不同发育阶段能量分配(用于生长的能量消耗和用于繁殖的能量储存)上的差异[24],未成熟个体会分配更高比例的同化能量用于鱼体生长。因此,体长的变化与能量密度差异无关。而2018年所采集狭鳕样本,性腺组织能量密度与各因子间均无显著性关系(P>0.05),这表明成熟个体的能量始终保持相对稳定的状态,其原因可能是,一方面狭鳕在进入产卵期并停止摄食之前,鱼体会主动代谢并进行能量摄入使能量储备水平达到峰值[19];另一方面产卵过后的雄性和雌性体质量均减少38%左右[16],即通过消耗脂肪等储能物质维持产卵过程中所需的能量。
4 结论
针对白令海水域最为重要的商业性鱼种,研究狭鳕性腺组织密度可以更好地了解该鱼种在能量分配上的机制。本文通过研究西白令海夏季狭鳕性腺组织能量密度的变化及主要影响因素,得到以下主要结论:
(1)狭鳕性腺组织的能量密度存在着年际差异,而个体大小可能是其致因之一。
(2)狭鳕的个体生长发育状况对能量密度有着显著的影响,其中性成熟度是影响能量密度变化的主要因素。
(3)狭鳕性腺组织能量密度的变化过程为发育前期,能量主要用于鱼体生长,而发育成熟后,性腺组织存储大量能量用于产卵。
致谢:感谢本次调查中“开利”轮船长及全体船员协助收集并提供样品!
[1] Hughes S E,Hirschhorn G.Biology of walleye pollock,Theragra chalcogramma,in the western Gulf of Alaska,1973-75[J].Fishery Bulletin,1979,77(1):263-274.
[2] Hinckley S.The reproductive biology of walleye pollock,Theragra chalcogramma,in the Bering Sea,with reference to spawning stock structure[J].Fishery Bulletin,1987,85(3):481-498.
[3] Smith G B.The biology of walleye pollock[C]//Favorite F,Ingraham W J,Waldron K D,et al.Fisheries Oceanography-Eastern Bering Sea shelf.Seattle:Northwest and Alaska Fisheries Center,1979:213-279.
[4] Ciannelli L,Brodeur R D,Napp J M.Foraging impact on zooplankton by age-0 walleye pollock (Theragra chalcogramma) around a front in the southeast Bering Sea[J].Marine Biology,2004,144(3):515-526.
[5] Jonsson N,Jonsson B.Body composition and energy allocation in life-history stages of brown trout[J].Journal of Fish Biology,1998,53(6):1306-1316.
[6] 段咪,魏联,朱国平.西白令海阿拉斯加狭鳕矢耳石形态特征研究[J].大连海洋大学学报,2018,33(4):492-498.
[7] Brodeur R D,Wilson M T.A review of the distribution,ecology and population dynamics of age-0 walleye pollock in the Gulf of Alaska[J].Fisheries Oceanography,1996,5(S1):148-166.
[8] Ianelli J N,Barbeaux S,Honkalehto T,et al.Assessment of the walleye pollock stock in the eastern Bering Sea.Stock assessment and fishery evaluation report for the groundfish resources of the Bering Sea/Aleutian Islands Region[R].Anchorage:North Pacific Fisheries Management Council,2010:53-156.
[9] Zhukova K A.Spermatogenesis and testes maturity scale in walleye pollock Theragra chalcogramma (Gadidae)[J].Journal of Ichthyology,2018,58(1):52-58.
[10] Guisan A,EdwardsJr T C,Hastie T.Generalized linear and generalized additive models in studies of species distributions:setting the scene[J].Ecological Modelling,2002,157(2-3):89-100.
[11] Burnham K P,Anderson D R.Model Selection and Multimodel Inference:A Practical Information-Theoretic Approach[M].2nd ed.New York:Springer,2002.
[12] 朱立新,侯刚,梁振林.基于贝叶斯方法的黄海北部鳀鱼体长与体重关系式参数估计[J].中国水产科学,2015,22(4):757-769.
[13] Kooka K.Life-history traits of walleye pollock,Theragra chalcogramma,in the northeastern Japan Sea during early to mid 1990s[J].Fisheries Research,2012,113(1):35-44.
[14] Tsuji S.Alaska pollack population,Theragra chalcogramma,of Japan and its adjacent waters,II:reproductive ecology and problems in population studies[J].Marine Behaviour and Physiology,1990,16(2):61-107.
[15] 魏嫣然,陈新军,林东明,等.秘鲁外海茎柔鱼肌肉组织的能量积累[J].中国水产科学,2018,25(2):444-454.
[16] Smith R L,Paul A J,Paul J M.Aspects of energetics of adult walleye pollock,Theragra chalcogramma (Pallas),from Alaska[J].Journal of Fish Biology,1988,33(3):445-454.
[17] 林东明,陈新军,魏嫣然,等.阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入[J].水产学报,2017,41(1):70-80.
[18] Anthony J A,Roby D D,Turco K R.Lipid content and energy density of forage fishes from the northern Gulf of Alaska[J].Journal of Experimental Marine Biologyand Ecology,2000,248(1):53-78.
[19] Smith R L,Paul A J,Paul J M.Seasonal changes in energy and the energy cost of spawning in Gulf of Alaska Pacific cod[J].Journal of Fish Biology,1990,36(3):307-316.
[20] Eliassen J E,Vahl O.Seasonal variations in biochemical composition and energy content of liver,gonad and muscle of mature and immature cod,Gadus morhua (L.) from Balsfjorden,northern Norway[J].Journal of Fish Biology,1982,20(6):707-716.
[21] Kjesbu O S.The spawning activity of cod,Gadus morhua L.[J].Journal of Fish Biology,1989,34(2):195-206.
[22] Wuenschel M J,Jugovich A R,Hare J A.Estimating the energy density of fish:the importance of ontogeny[J].Transactions of the American Fisheries Society,2006,135(2):379-385.
[23] Boyle P,Rodhouse P.Cephalopods:Ecology and Fisheries[M].Oxford:Blackwell,2005.
[24] Roff D A.An allocation model of growth and reproduction in fish[J].Canadian Journal of Fisheries and Aquatic Sciences,1983,40(9):1395-1404.