鱼类的繁殖生物学特征是内外因素共同作用的产物,与鱼体自身因素和外界环境、营养条件密切相关,直接影响着种群的补充和增殖,是决定种群动态的关键因子之一。繁殖活动是鱼类整个生命活动的重要组成,确保了种群的增殖与延续[1]。每种鱼类在特定的水域环境条件下,具有自身独特的繁殖特性。研究繁殖特性,不仅能为掌握该鱼种群资源现状提供数据支撑,同时也能推动建立有效的保护措施,为资源的补充与开发提供科学依据。
平舟原缨口鳅Vanmanenia pingchowensis属于鲤形目Cypriniformes平鳍鳅科Homalopteridae原缨口鳅属Vanmanenia。原缨口鳅属作为东亚特有种类,广泛分布于中国南部、越南中北部和老挝等区域的溪流中[2-3]。其中平舟原缨口鳅在中国主要分布在珠江、长江的清江及洞庭湖和鄱阳湖水系,是该属在长江中游一带分布较为广泛的一个种[3]。目前,对该鱼的报道主要集中在基础生物学和遗传多样性方面[4-6],对其繁殖生物学的研究内容较少。而对平鳍鳅科的繁殖生物学研究,仅见李恒德[7]报道了贡氏犁头鳅Lepturichthys güntheri的少量基础数据。对于乌江中游山溪性鱼类的报道还较少,仅见切尾拟鲿的相关资料[8]。作为乌江中游佛顶山支流一种典型的喜急流的溪流性底栖鱼类,平舟原缨口鳅的繁殖特征与其生活水域生态环境条件紧密相关。本研究中,通过周年采样调查分析,对乌江中游支流的平舟原缨口鳅进行了初步的繁殖生物学报道,旨在补充该鱼的生物学数据,探讨该鱼的种群适应机制,为溪流性鱼类的保护积累基础资料。
1 材料与方法
1.1 调查区域及时间
用刺网或地笼(网目1 cm)在乌江中游佛顶山东南侧支流包溪河采集,采集时间段为2017年1月至2018年9月,采集区域为(27°15′~27°25′N、107°56′~108°12′E)。
1.2 方法
1.2.1 样本采集 2017年逐月采集,2018年3、6、9月采集(补充样本量),单月份采集的样本不少于20尾,样本用8%福尔马林短暂固定,一周内测量体长、体质量、净体质量、性腺质量等基础生物学数据(长度精确到1 mm,质量精确到0.01 g)。解剖取第3~5枚脊椎骨作为年龄鉴定材料,去除杂质,清洗干净后在解剖镜下检测。
1.2.2 繁殖期 根据每月采集的样本,参照殷名称[9]和李忠利等[10]的方法解剖观察性腺发育分期,并结合性成熟系数的变化趋势判断繁殖期。
性成熟系数(GSI)=性腺质量/净体质量×100%。
1.2.3 繁殖力 参照殷名称[9]的方法统计繁殖力,将Ⅳ期卵巢称重,分别取前、中、后三部分称取0.4~0.5 g,统计有卵黄沉积的卵粒数,得到样本卵粒数,换算得到每尾鱼的怀卵量。
绝对繁殖力F =(样本卵粒数/样本卵巢质
量)×卵巢质量,
体质量相对繁殖力FW=F/W,
体长相对繁殖力FL=F/L。
其中:W为净体质量(g);L为体长(mm)。
1.2.4 初次性成熟体长、体质量和年龄 初次性成熟体长(L50)参照Morgan等[11]的方法,即50%个体达到性成熟时的体长。按5 mm的体长区间分别将雌、雄性成熟个体数和每个区间的总个体数进行统计,计算出性成熟个体数占各自区间相应的百分比,用Origin 8.5软件作图并拟合Logistic方程,推算出相应的初次性成熟值。
初次性成熟体质量根据体长(L)与体质量(W)关系式拟合为W=cLd,其中c、d为常数。
性成熟年龄占比和初次性成熟年龄推算参照性成熟体长占比和初次性成熟体长的计算方法。
1.2.5 产卵类型 将固定好的Ⅳ期卵巢卵子分散,用蒸馏水清洗,去除杂质,在OPTEC DV320体视显微镜下拍照,并用系统自带软件测量卵径(直径),每尾鱼随机测100粒卵以上,通过卵径频率分布图判断产卵类型。
1.3 数据处理
用SPSS 20.0对试验数据进行统计分析;用T检验分析相同年龄的雌雄个体体长和体质量比较、不同年龄的卵粒数比较;用协方差(ANCOVA)分析雌雄个体体长与体质量关系的差异。
2 结果与分析
共采集到标本262尾,体长为44~86 mm,平均(63±10)mm,体质量为1.45~13.51 g,平均(4.73±2.41)g。均能区分雌雄,年龄分布在3+~6+龄,其中雌性152尾,雄性110尾。
2.1 繁殖群体特征
实地采样结果显示,平舟原缨口鳅繁殖群体通常栖息在水流较急、底质为细砂石和鹅卵石堆积的河滩地带。采样点5—7月的水温为16.5~18.8 ℃,周年水温范围为7.2~19.5 ℃。
2.1.1 年龄、体长及体质量分布 性腺发育到Ⅳ期及以上个体数101尾,占标本总数的63.9%,年龄为3+~6+龄,其中雌性61尾,雄性40尾。
从表1可见:性成熟个体中,雌雄优势年龄组均为4+和5+龄;雌鱼最小个体3+龄,体长为46 mm,体质量为2.08 g,最大个体6+龄,体长为86 mm,体质量为13.51 g;雄鱼最小个体3+龄,体长为44 mm,体质量为1.50 g,最大个体6+龄,体长为76 mm,体质量为7.48 g。对相同年龄的雌雄鱼体长、体质量进行T检验,结果显示,雌、雄鱼各年龄组的体长、体质量均存在显著性差异(P<0.05)。
表1 平舟原缨口鳅性成熟个体的年龄、体长和体质量分布
Tab.1 Age, body length and body weight distribution of mature individuals of pingchow tasselmouth loach
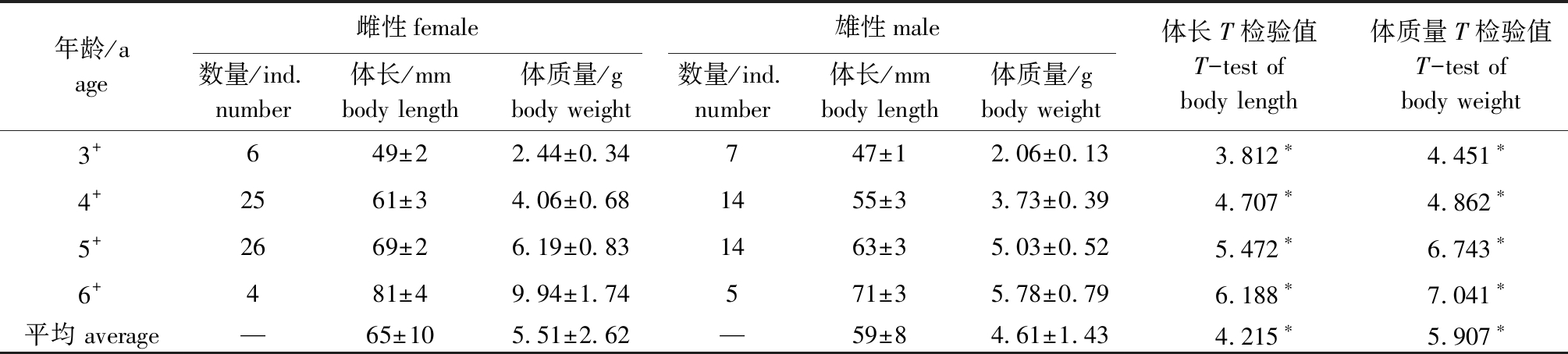
年龄/aage雌性female雄性male数量/ind.number体长/mmbody length体质量/gbody weight数量/ind.number体长/mmbody length体质量/gbody weight体长T检验值T-test of body length体质量T检验值T-test of body weight3+649±22.44±0.34747±12.06±0.133.812∗4.451∗4+2561±34.06±0.681455±33.73±0.394.707∗4.862∗5+2669±26.19±0.831463±35.03±0.525.472∗6.743∗6+481±49.94±1.74571±35.78±0.796.188∗7.041∗平均 average—65±105.51±2.62—59±84.61±1.434.215∗5.907∗
注:*表示T检验在0.05水平上有显著性差异
Note: * indicates the significant different at the 0.05 probability levels in T-test
2.1.2 生长特征 对雌雄个体分别作体长与体质量关系曲线图(图1),得到关系式如下:
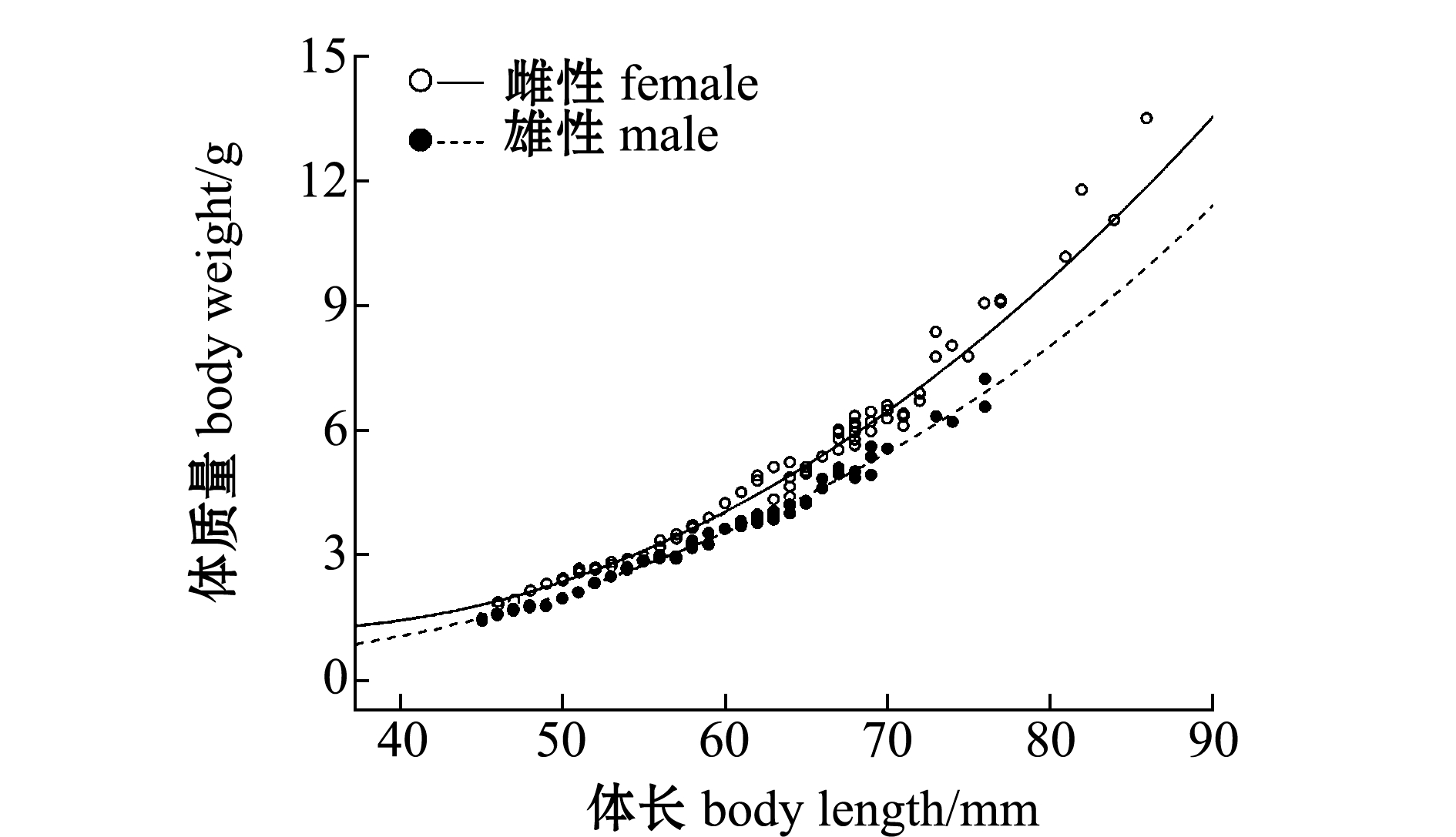
图1 雌雄繁殖群体体长与体质量的关系
Fig.1 Relationship between body length and body weight of spawning population
雌性: W=2.2×10-5L2.9632, R2=0.8632, n=152;
雄性: W=1.8×10-5L2.9328, R2=0.8783, n=110。
对雌雄个体体长与体质量关系进行协方差分析(ANCOVA),F=37.25,P<0.05,说明雌雄繁殖群
体存在显著性差异。
2.1.3 副性征和性比 在采集的标本中,雌雄个体均无明显的副性征,体表无珠星,腹腔内均无脂肪堆积;繁殖季节腹部略微膨大,雌鱼腹部肌肉层很薄,能隐约看见内部卵子。共采集到2尾Ⅴ期雌鱼和1尾Ⅴ期雄鱼,轻压腹部能挤出浅黄色卵子或乳白色精子。
在能区分性别的262尾标本中,雌雄性比(♀∶♂)=1.39∶1(χ2=4.27,P<0.05),性成熟的101尾标本中,雌雄性比(♀∶♂)=1.53∶1(χ2=4.36,P<0.05),均不符合1∶1的比值,雌性个体显著多于雄性个体。
2.1.4 初次性成熟特征 用Logistic方程拟合了雌雄繁殖群体各体长区间性成熟比例(PL)和各年龄组性成熟比例(PT)(图2),得到关系式如下:
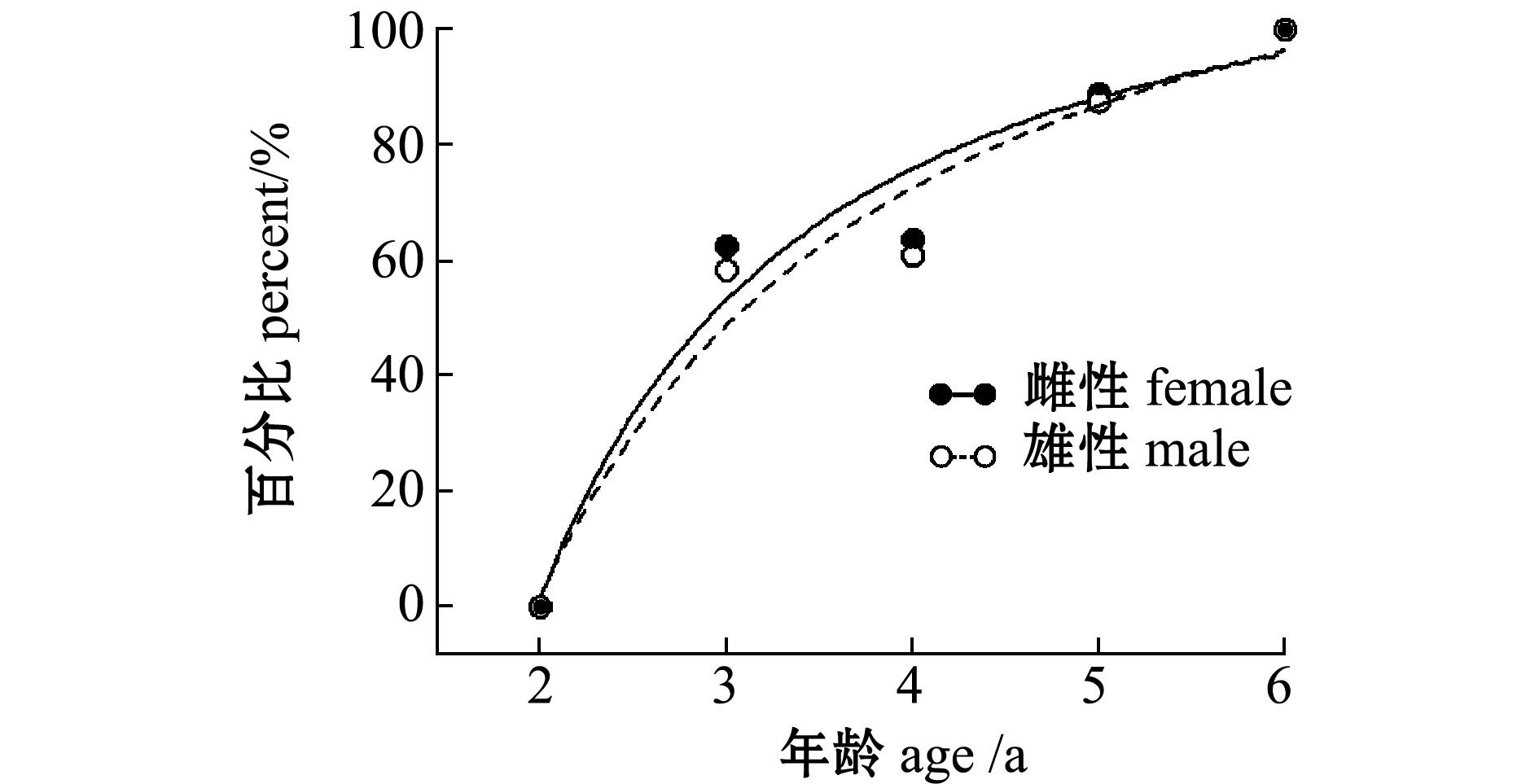
图2 性成熟群体占各体长组和年龄区间的百分比
Fig.2 Percentage of mature population in each body length class and age interval
雌性:
PL=105.9163-93.7045/[1+(L/61.1444)8.9208],
PT=121.0295-2600.94/[1+(T/0.2467)1.4499];
雄性:
PL=102.6397-126.3570/[1+(L/50.5216)9.0453],
PT=141.1938-1834.45/[1+(T/0.1988)1.0824]。
推算得到初次性成熟理论值:雌性体长为58.72 mm,体质量为3.83 g,年龄为2.93龄;雄性体长为52.45 mm,体质量为1.99 g,年龄为3.05龄。
2.1.5 繁殖力 统计了59尾Ⅳ期雌鱼卵巢的繁殖力,体长为46~86 mm,平均(65±10)mm,体质量为2.58~13.51 g,平均(5.51±2.62)g。绝对繁殖力为739~2953粒,平均(1629±520)粒,体质量相对繁殖力为150.5~358.4粒/g,平均(250.2±58.5)粒/g,体长相对繁殖力为10.4~34.3粒/mm,平均(21.2±5.7)粒/mm。
在不同年龄群体中,3+、4+、5+、6+龄雌鱼的平均怀卵量分别为(1228±295)、(1709±367)、(2044±353)、(2289±540)粒。T检验结果显示,4+、5+、6+龄雌鱼怀卵量之间无显著性差异(P>0.05),但均显著高于3+龄雌鱼(P<0.05)。

2.2 性成熟系数
雌鱼性成熟系数的变化范围为4.77%~21.04%,平均(10.26±6.18)%,雄鱼变化范围1.22%~5.38%,平均(2.27±1.51)%,逐月变化情况如图3所示。其中,雌雄性成熟系数变化基本相似,曲线都只有一个峰值,即1—3月相对平缓,3—6月逐渐上升,6月达到最大峰值,8月骤降,9—10月逐渐减小,并于11—12月份趋于平缓。由此推断,平舟原缨口鳅的繁殖季节在5—7月份。
2.3 卵的特征
本研究中,观察Ⅳ期到Ⅴ期卵巢中卵子的颜色变化,由灰白色变为淡黄色。Ⅴ期卵子吸水后膨胀,卵周隙较大,卵沉性,具黏性。测量了59尾Ⅳ期卵巢的卵子卵径,频率分布如图4所示。卵母细胞卵径存在两个峰,第一个峰值卵径在1.0~1.3 mm,平均(1.12 ±0.11)mm,卵粒数占63.5%,卵呈淡黄色,为第Ⅳ期卵子;第二个峰值卵径在0.4~0.6 mm,平均(0.55±0.09)mm,卵粒数占12.3%,卵呈灰白色,为有卵黄沉积的第Ⅲ期卵子。这表明平舟原缨口鳅卵巢中存在两批卵子,发育类型为分批同步型。结合卵径和卵粒数的差异及性成熟系数变化趋势(图3),推断该鱼每年仅成熟一批卵,产卵类型为完全同步产卵。

注:标有不同字母者表示同一性别不同月份间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters in same sex are significantly different in the different month at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图3 雌、雄个体性成熟系数的月变化
Fig.3 Monthly variations in gonado-somatic index(GSI) between males and females

图4 雌鱼Ⅳ期卵巢中卵母细胞卵径的频率分布
Fig.4 Oocyte diameter frequency distribution at stage Ⅳ of ovary
统计雌鱼卵巢中有卵黄沉积的卵子卵径的逐月变化情况(图5),结果显示,6月最高,平均卵径为1.12 mm,其次是7月和5月,分别为1.08、1.07 mm,5—7月间卵径无显著性差异(P>0.05);4月和8月分别为0.89、0.85 mm,与5—7月间卵径有显著性差异(P<0.05)。这表明该鱼为一次性产卵,繁殖盛期在5—7月。
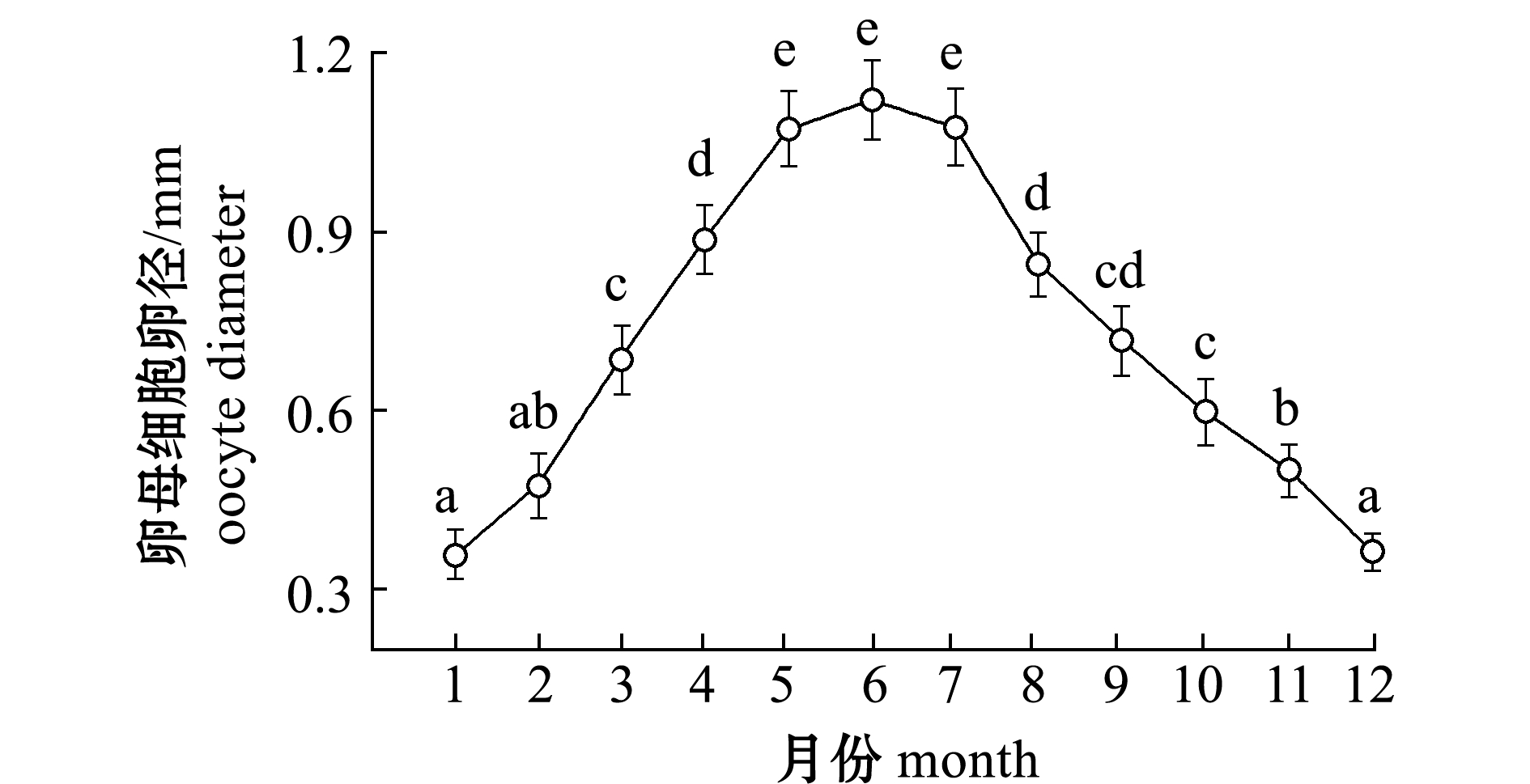
图5 雌鱼卵母细胞卵径的月变化
Fig.5 Monthly variation in oocyte diameter of females
3 讨论
3.1 平舟原缨口鳅产卵特征
鱼类的卵径和繁殖力反映了卵子的数量和质量,是在长期进化过程中对外界环境的适应。通过卵径的大小和频率分布可以推断该鱼的产卵类型,如完全同步产卵类型的种类一年仅成熟一批卵,在卵径频率分布图中会出现一个显著的高峰值。本研究中发现,平舟原缨口鳅卵巢中也存在Ⅲ期卵子的现象,表现为一个小峰值,属于此产卵类型,该鱼Ⅳ期卵巢卵径在0.4~0.6 mm处有一个明显的小峰(图4),为典型的两批卵。此特征在黑斑原鮡Glyptosternon maculatum也有报道,丁城志等[12]通过连续3年的观察,认为是生长季节短而形成两年成熟一批卵的繁殖策略。何德奎等[13]在对色林错裸鲤Gymnocypris selincuoensis性腺组织学研究中将类似现象描述为受环境制约而产生的繁殖间隔节律。
此外,亲鱼的繁殖群体特征也是在长期的环境选择中形成的。本研究中实际采集的雌雄最小性成熟个体明显偏小,体长都不足50 mm,体质量也在3 g以下,但雌鱼怀卵量很小,仅几十粒。通过Logistic方程推导的雌雄个体初次性成熟年龄都在3龄左右,雌鱼略微偏早且雌性明显偏多,个体偏大,这在花斑副沙鳅Parabotia fasciata[14]中也有报道,雌性优势有利于提高群体的繁殖输出。
3.2 种系比较
有关平鳍鳅科鱼类的报道,陈宜瑜[15]主要从骨骼性状对其进行了分类,其他主要见于一些新种的描述。对于繁殖生物学特征,李恒德[7]报道了金沙江贡氏犁头鳅的繁殖时间为4月中旬至6月初,产漂流性卵,怀卵量为300~500粒,卵直径为1.3~1.4 mm,相比之下,平舟原缨口鳅繁殖时间略晚,产黏性卵,怀卵量较多,卵径较小。
汇总了鳅超科Cobitoidea几种典型鳅类的繁殖生物学相关数据(表2)[14,16-18],平均卵径紫薄鳅偏大,花斑副沙鳅最小;雌雄性比、绝对繁殖力和体质量相对繁殖力花斑副沙鳅最大;平舟原缨口鳅的绝对繁殖力最小。在繁殖期上,除贝氏高原鳅在10月份以外,其他种类相近,都在5—6月份前后。在产卵类型上,除贝氏高原鳅为分批产卵外,其余种类均为一次性产卵。
表2 鳅超科不同种类鱼繁殖相关数据的比较
Tab.2 Comparison of reproductive data from different species in family Cobitoidea
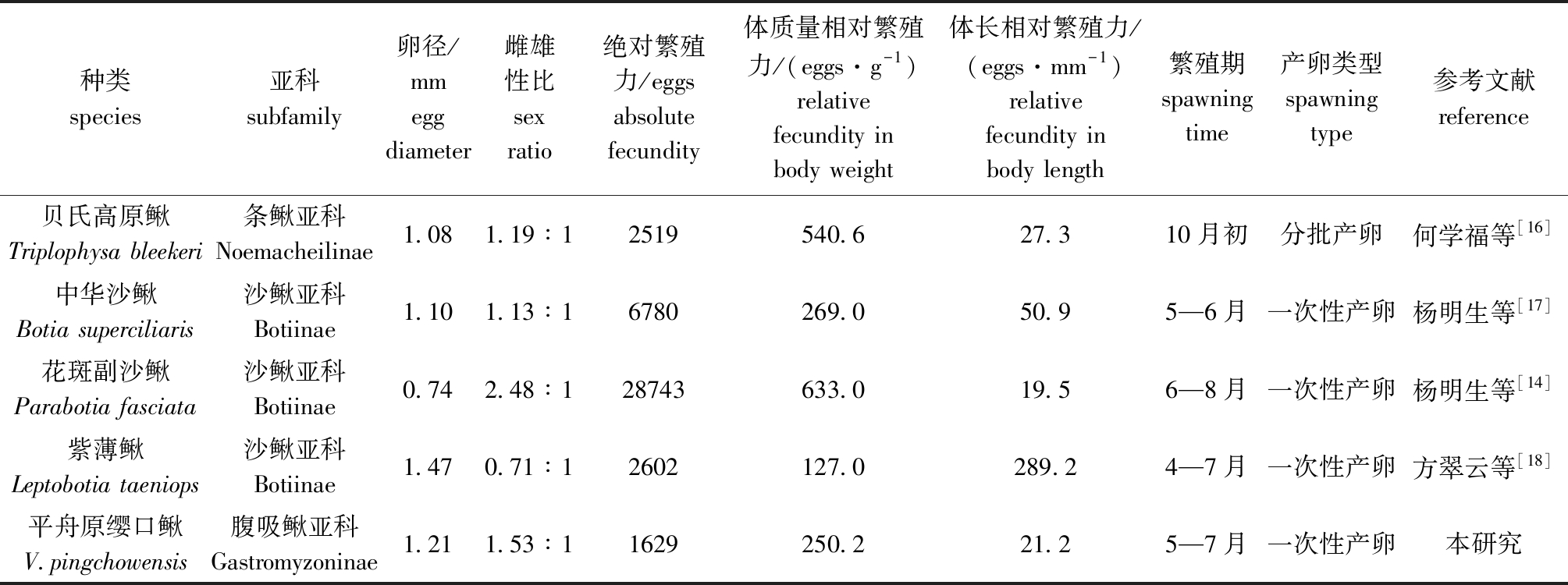
种类species亚科subfamily卵径/mmegg diameter雌雄性比sex ratio绝对繁殖力/eggsabsolute fecundity体质量相对繁殖力/(eggs·g-1)relative fecundity in body weight体长相对繁殖力/(eggs·mm-1)relative fecundity in body length繁殖期spawning time产卵类型spawning type参考文献reference贝氏高原鳅Triplophysa bleekeri条鳅亚科Noemacheilinae1.081.19∶12519540.627.310月初分批产卵何学福等[16]中华沙鳅Botia superciliaris沙鳅亚科Botiinae1.101.13∶16780269.050.95—6月一次性产卵杨明生等[17]花斑副沙鳅Parabotia fasciata沙鳅亚科Botiinae0.742.48∶128743633.019.56—8月一次性产卵杨明生等[14]紫薄鳅Leptobotia taeniops沙鳅亚科Botiinae1.470.71∶12602127.0289.24—7月一次性产卵方翠云等[18]平舟原缨口鳅V.pingchowensis腹吸鳅亚科Gastromyzoninae1.211.53∶11629250.221.25—7月一次性产卵本研究
对以上数据进行欧式距离和组间联结的聚类分析,结果见图6。平舟原缨口鳅先与贝氏高原鳅、紫薄鳅聚在一起,再与中华沙鳅、花斑副沙鳅聚类。这一结果与Mayden等[19]和Liu等[20]通过核基因、线粒体基因组分析得到鳅超科各亚科间的系统发育关系相似,即平鳍鳅科Balitoridae依次与条鳅亚科Nemacheilinae、沙鳅亚科Botiinae聚类。

图6 鳅超科不同鱼类繁殖数据的聚类分析
Fig.6 Cluster dendrogram of reproductive data in members in Cobitoidea
3.3 平舟原缨口鳅资源的保护与增殖
鱼类的繁殖是整个生活史的一个特殊而又重要的阶段,直接影响着整个种群的质和量,同时又最容易受到外界条件的干扰,其中环境压力是影响鱼类繁殖的主要因素之一[9]。佛顶山保护区内河流存在一定的人为因素影响,如河道改造、过度捕捞等,且在保护区西北侧另一支流甘溪河曾发生过毒鱼事件,对该鱼资源量造成了严重影响。从本次采样数据来看,群体主要以4+~5+龄个体为主,在全年采样期间观察到极少量幼体,补充群体严重不足,大龄化趋势明显,乌江佛顶山支流的平舟原缨口鳅种群资源正在受到破坏。
作为长江上游和中游的分水岭之一,佛顶山河流鱼类具有一定的特殊性。以平舟原缨口鳅为典型,该鱼主要分布在长江中游的洞庭湖水系及以下,本次调查在上游的乌江支流采集到标本,这与佛顶山地质隆起造成的地理隔离有关[3,21]。作为佛顶山国家级自然保护区内的特殊种群之一,平舟原缨口鳅拥有着特殊的生态位。在长期的进化过程中,该鱼的生态习性与保护区特有的山溪性流水环境相适应。但当前水体环境的变化直接造成鱼类生境的变迁,使得平舟原缨口鳅大龄化趋势明显,补充群体不足,资源保护迫在眉睫。建议当前从现有种群和人工增殖两方面采取措施进行保护。
[1] Fleming I A.Reproductive strategies of Atlantic salmon:ecology and evolution[J].Reviews in Fish Biology and Fisheries,1996,6(4):379-416.
[2] Kottelat M.Conspectus cobitidum:an inventory of the loaches of the world (Teleostei:Cypriniformes:Cobitoidei)[J].The Raffles Bulletin of Zoology,2012(S26):1-199.
[3] 陈宜瑜,唐文乔.平鳍鳅科[M].乐佩琦.中国动物志·硬骨鱼纲·鲤形目(下卷).北京:科学出版社,2000:438-567.
[4] 芦丽.平舟原缨口鳅和海南原缨口鳅的遗传变异和地理分化[D].广州:华南师范大学,2012.
[5] 汪丽.平舟原缨口鳅种组(species complex)的遗传变异与亲缘地理[D].广州:华南师范大学,2013.
[6] Liang Z Q,Wang C R,Wu Y N,et al.Complete mitochodrial genome of Vanmanenia pingchowensis (Cypriniformes,Cyprinidae)[J].Mitochondrial DNA Part A,2016,27(3):2184-2185.
[7] 李恒德.金沙江贡氏犁头鳅的繁殖和胚后发育的观察[J].动物学杂志,1965(2):79-83.
[8] 李忠利,梅杰,雷红梅,等.乌江中游支流佛顶山切尾拟鲿的年龄、生长与资源利用[J].大连海洋大学学报,2019,34(5):718-724.
[9] 殷名称.鱼类生态学[M].北京:中国农业出版社,1993.
[10] 李忠利,巴家文,魏文燕,等.锦江翘嘴鲌性腺发育的组织学研究[J].大连海洋大学学报,2019,34(4):519-525.
[11] Morgan D L,Gill H S,Potter I C.Age composition,growth and reproductive biology of the salamanderfish Lepidogalaxias salamandroides:a re-examination[J].Environmental Biology of Fishes,2000,57(2):191-204.
[12] 丁城志,陈毅峰,何德奎,等.雅鲁藏布江黑斑原鮡繁殖生物学研究[J].水生生物学报,2010,34(4):762-768.
[13] 何德奎,陈毅峰,陈自明,等.色林错裸鲤性腺发育的组织学研究[J].水产学报,2001,25(2):97-103.
[14] 杨明生,李建华,黄孝湘.澴河花斑副沙鳅的繁殖生态学研究[J].水利渔业,2007,27(5):84-85.
[15] 陈宜瑜.中国平鳍鳅科鱼类系统分类的研究:III.平鳍鳅科鱼类的系统发育[J].动物分类学报,1980,5(2):200-211.
[16] 何学福,贺吉胜,严太明.马边河贝氏高原鳅繁殖特性的研究[J].西南师范大学学报:自然科学版,1999,24(1):69-73.
[17] 杨明生,丁夏.中华沙鳅的繁殖生物学研究[J].水生态学杂志,2010,3(2):38-41.
[18] 方翠云,孟妍,祖国掌,等.长江铜陵段紫薄鳅个体生物学与资源保护[J].水生态学杂志,2011,32(2):100-104.
[19] Mayden R L,Chen W J,Bart H L,et al.Reconstructing the phylogenetic relationships of the earth’s most diverse clade of freshwater fishes—order Cypriniformes (Actinopterygii:Ostariophysi):a case study using multiple nuclear loci and the mitochondrial genome[J].Molecular Phylogenetics and Evolution,2009,51(3):500-514.
[20] Liu S Q,Mayden R L,Zhang J B,et al.Phylogenetic relationships of the Cobitoidea (Teleostei:Cypriniformes) inferred from mitochondrial and nuclear genes with analyses of gene evolution[J].Gene,2012,508(1):60-72.
[21] 高华端,袁靓,张旭贤,等.佛顶山自然保护区地质地貌、水文地质[M]//喻理飞.贵州佛顶山生物多样性-中国生物多样性保护优先区:武陵山-苗岭结点保护区研究.贵阳:贵州科技出版社,2016:26-39.