骨骼畸形是影响鱼类外部形态、运动与摄食功能、生长速度与成活率的重要因素之一[1-2]。在人工培育苗种过程中,遗传因素、不适宜鱼类生长的外界环境条件及不均衡的饵料营养胁迫皆会导致骨骼畸形的发生。骨骼畸形在经济鱼类苗种繁育过程中广泛存在并主要发生在仔稚鱼阶段[3]。仔稚鱼阶段骨骼畸形率依不同鱼种有所差别,如人工繁育卵形鲳鲹Trachinotus ovatus仔稚鱼的骨骼畸形率为33%[4],大菱鲆Scophthalmus maximus仔稚鱼的骨骼畸形率为51%[3],鞍带石斑鱼Epinephelus lanceolatus仔稚鱼的骨骼畸形率高达96%[5]。骨骼畸形的高发严重影响了养殖鱼类的产品质量与市场价值,据不完全统计,鱼类骨骼畸形每年给欧洲水产养殖业带来的直接经济损失已超过5000万欧元[6],因此,骨骼畸形发育已成为困扰水产养殖业发展的重要瓶颈之一,骨骼系统能否正常发育也成为衡量鱼类苗种质量好坏的关键指标之一。
大泷六线鱼Hexagrammos otakii隶属于鲉形目Scorpaeniformes六线鱼科Hexagrammidae六线鱼属Hexagrammos,为冷温性近海底层岩礁鱼类[7],在中国山东和辽宁等地的近海多岩礁海区分布广泛[8],是中国北方网箱养殖主要种类之一。近年来,为满足大泷六线鱼的产业需求,水产科技工作者对其人工繁育及养殖技术进行了深入的研究,并取得了突破性进展[9-11]。但人工繁育的大泷六线鱼苗种在生长发育过程中常会出现骨骼畸形的个体。因骨骼畸形会影响鱼体本身的功能发育,进而降低苗种生长速度及成活率[3],故如何有效避免苗种骨骼畸形的发生成为大泷六线鱼人工繁育过程中必须解决的重点问题。由于导致鱼类骨骼畸形的因素多且复杂[12],为确定引发大泷六线鱼骨骼畸形的因素,首先需摸清人工繁育条件下大泷六线鱼仔稚鱼骨骼畸形的发生时期及类型等。本研究中,通过观察分析大泷六线鱼仔稚鱼骨骼畸形现象,总结人工繁育条件下大泷六线鱼骨骼畸形发生时期、部位及类型,旨在为深入探究骨骼畸形形成机制,优化苗种培育关键时期的养殖管理条件,以及降低人工繁育条件下大泷六线鱼苗种的畸形率提供参考资料。
1 材料与方法
1.1 仔稚鱼培育
于2017年12月在威海圣航水产有限公司进行大泷六线鱼仔稚鱼培育,试验亲鱼取自大连黑石礁海上网箱养殖区,亲鱼自然成熟后,利用腹部挤压法获得卵与精液,进行人工干法授精。将受精卵置于网箱中进行流水平板孵化,孵化密度为30 000 粒/m2,孵化期间,水温为16~17 ℃,盐度为28~30,pH为7.8~8.2,溶解氧≥5 mg/L,光照强度为500 lx;将初孵仔鱼转移到培育池中进行培养,仔鱼布池密度为6000~8000 尾/m3,并随鱼苗生长及时分池,鱼苗全长达3 cm后,密度控制在800~1000 尾/m3。苗种培养期间,水温为14~15 ℃,盐度为28~30,pH为7.8~8.2,溶解氧≥5 mg/L,曝气,光照强度控制在500~1000 lx。
大泷六线鱼孵化初期至25 dph之间,每日向培育池中添加新鲜小球藻,5~25 dph时投喂轮虫,10~60 dph时投喂卤虫无节幼体,50 dph后开始投喂配合饵料。在养殖管理方面,初孵仔鱼至5 dph为静水培育,6 dph后随鱼苗的生长逐步增大换水量,6~20 dph时换水量为60%,21~40 dph时换水量提升至100%,41~60 dph时换水量调整为150%。为保证水质指标的稳定性,每天两次监测培育水体水质状况,同时每日使用清底器吸底一 次。
1.2 方法
1.2.1 样本采集及固定 每日6∶00投喂一次,投喂饵料之前对1~60 dph仔稚鱼进行连续随机采样,每次取样10尾,样品总数为600尾。样品采集后用MS-222麻醉,待仔稚鱼完全沉入烧杯底部后,将其收集放入10%福尔马林溶液中,保存于4 ℃冰箱中待用。
1.2.2 骨骼标本制作 参照杨安峰[13]、于超勇等[14]总结的软骨-硬骨双染色法进行操作。首先用蒸馏水滴洗仔稚鱼样品5~6 d后,用吸水纸吸干后,置于软骨染色液(20 mg阿利新蓝8GX+70 mL无水乙醇+30 mL冰乙酸)中浸泡处理24 h,直至尾部软骨染上鲜明蓝色为止;然后将样品置于无水乙醇中24 h,中间需更换无水乙醇1~2次;再分别用95%、75%、40%、15%的乙醇溶液处理2~3 h,最终置于蒸馏水中,直至样品下沉;将样品放入胰蛋白酶溶液(30 mL饱和硼酸钠水溶液+70 mL蒸馏水+1 g胰蛋白酶),直至样品基本透明,可透过残余组织看清仔稚鱼骨骼为止;将已软化的样品置于硬骨染色液(0.5%KOH+足够的茜素红,直至溶液呈现深紫色)24~48 h,直至硬骨染为紫红色为止;将已染好的样品移至0.5% KOH溶液中浸泡24 h后,再移入0.5% KOH-甘油溶液中(KOH与甘油的比例依次为3∶1、1∶1,最后确定为1∶3),分别浸泡24 h,最后转入到加入麝香草-酚纯甘油中保存。
1.2.3 骨骼标本观察与统计 将染色处理好的仔稚鱼标本在Olympus SZ61型体视显微镜下进行观察,详细记录仔稚鱼畸形发育发生时期、部位及形态特征,并进行照片采集,采集的图像用 Adobe Photoshop CS 软件(www.photoshop.com)进行处理。
参照Gao等[1]对美国鲥骨骼畸形、吕雪娇[5]对大菱鲆和鞍带石斑鱼骨骼畸形的研究报道及Boglione等[12]对欧洲养殖鱼类仔稚鱼骨骼畸形的综述,对大泷六线鱼仔稚鱼骨骼畸形进行归类,利用Excel软件对不同类型骨骼畸形发生数目进行分析处理。
2 结果与分析
2.1 仔稚鱼主要畸形类型及畸形发生率
600尾大泷六线鱼仔稚鱼样品中,观察到117尾存在骨骼畸形现象,畸形率为19.50%。其中,74尾仅存在一处畸形,43尾存在多处畸形。统计分析显示,117尾畸形个体共计发生189处骨骼畸形,可归为20种畸形类型(表1,图1~图3)。大泷六线鱼主轴骨骼的畸形发生频率远高于附肢骨骼。在头部骨骼畸形类型中,发生频率最高的是迈克尔氏软骨弯曲及角鳃骨弯曲;脊柱畸形类型中,脊柱后凸、脊柱前凸、脊柱侧凸等脊柱弯曲畸形类型高发;鳍畸形主要包括尾鳍畸形、背鳍畸形和臀鳍畸形,未发现胸鳍畸形及腹鳍畸形,尾鳍畸形发生率较背鳍与臀鳍低(表1)。大泷六线鱼仔稚鱼背鳍及臀鳍骨骼存在多处桡骨远端融合同时存在的现象(图3-D、E)。
表1 大泷六线鱼仔稚鱼骨骼畸形发生部位、类型与各畸形类型所占比率
Tab.1 Position, typologies and incidence of skeletal abnormality in larval and juvenile greenling Hexagrammos otakii
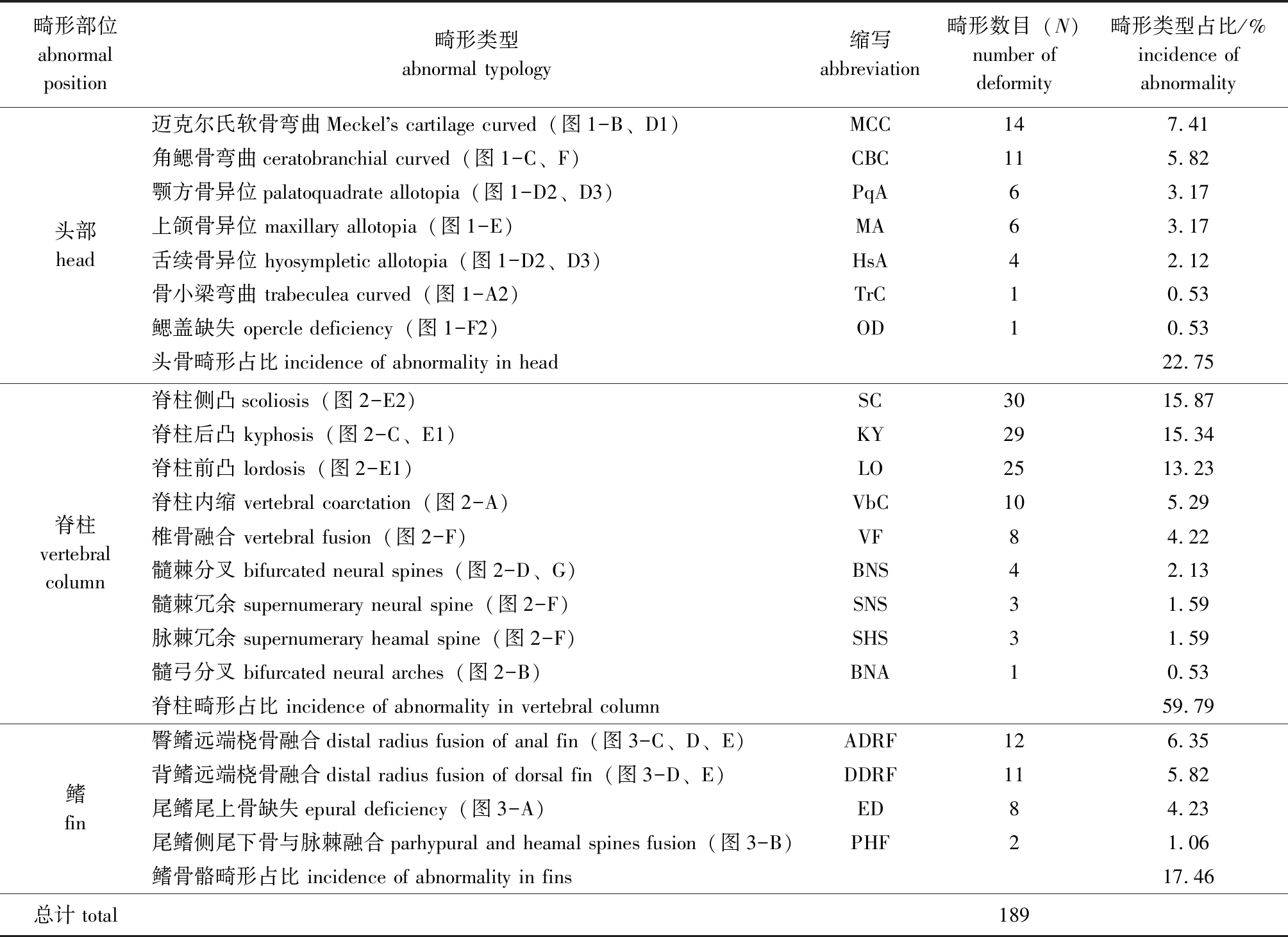
畸形部位abnormal position畸形类型abnormal typology缩写abbreviation畸形数目(N)number of deformity畸形类型占比/%incidence of abnormality头部head迈克尔氏软骨弯曲Meckels cartilage curved(图1-B、D1) MCC147.41角鳃骨弯曲ceratobranchial curved(图1-C、F) CBC115.82颚方骨异位palatoquadrate allotopia(图1-D2、D3) PqA63.17上颌骨异位 maxillary allotopia(图1-E)MA63.17舌续骨异位 hyosympletic allotopia(图1-D2、D3)HsA42.12骨小梁弯曲 trabeculea curved(图1-A2)TrC10.53鳃盖缺失 opercle deficiency(图1-F2)OD10.53头骨畸形占比incidence of abnormality in head22.75脊柱vertebral column脊柱侧凸scoliosis(图2-E2) SC3015.87脊柱后凸 kyphosis(图2-C、E1)KY2915.34脊柱前凸 lordosis(图2-E1)LO2513.23脊柱内缩 vertebral coarctation(图2-A)VbC105.29椎骨融合 vertebral fusion(图2-F)VF84.22髓棘分叉 bifurcated neural spines(图2-D、G)BNS42.13髓棘冗余 supernumerary neural spine(图2-F)SNS31.59脉棘冗余 supernumerary heamal spine(图2-F)SHS31.59髓弓分叉 bifurcated neural arches(图2-B)BNA10.53脊柱畸形占比 incidence of abnormality in vertebral column59.79鳍fin臀鳍远端桡骨融合distal radius fusion of anal fin(图3-C、D、E)ADRF126.35背鳍远端桡骨融合distal radius fusion of dorsal fin(图3-D、E)DDRF115.82尾鳍尾上骨缺失epural deficiency(图3-A)ED84.23尾鳍侧尾下骨与脉棘融合parhypural and heamal spines fusion(图3-B)PHF21.06鳍骨骼畸形占比 incidence of abnormality in fins17.46总计 total189
2.2 仔稚鱼骨骼畸形主要发生时期
从表2可见,人工繁育大泷六线鱼仔稚鱼骨骼畸形主要发生于6~10 dph及16~20 dph时期,畸形样本所占比例分别为50%及64%,观察到的畸形发生处数目分别为49和60。不同日龄的大泷六线鱼头部、脊柱、尾鳍、背鳍、臀鳍发生畸形的数量分布见图4,大泷六线鱼脊柱畸形主要发生在6~10 dph,该发育阶段仔鱼脊柱畸形类型为脊柱侧凸、脊柱后凸和脊柱前凸等。当脊柱硬骨化后(40 dph后),脊柱畸形率出现上升的趋势,其主要畸形类型为椎体融合;头骨畸形与鳍骨畸形均主要发生在16~20 dph时期,头骨畸形类型主要为迈克尔氏软骨弯曲、角鳃骨弯曲、颚方骨异位;鳍骨畸形类型主要为尾上骨缺失及背鳍、臀鳍的远端桡骨融合。同脊柱畸形类似,40 dph后鳍骨畸形率同样出现小幅度上升。

图4 大泷六线鱼不同类型骨骼畸形发生数量的日龄分布
Fig.4 Days old profile of skeletal abnormalities observed in deformities individual of different types in greenling Hexagrammos otakii
表2 大泷六线鱼仔稚鱼骨骼畸形发生数量的日龄分布
Tab.2 Days old profile of skeletal abnormality fish (days post hatching)
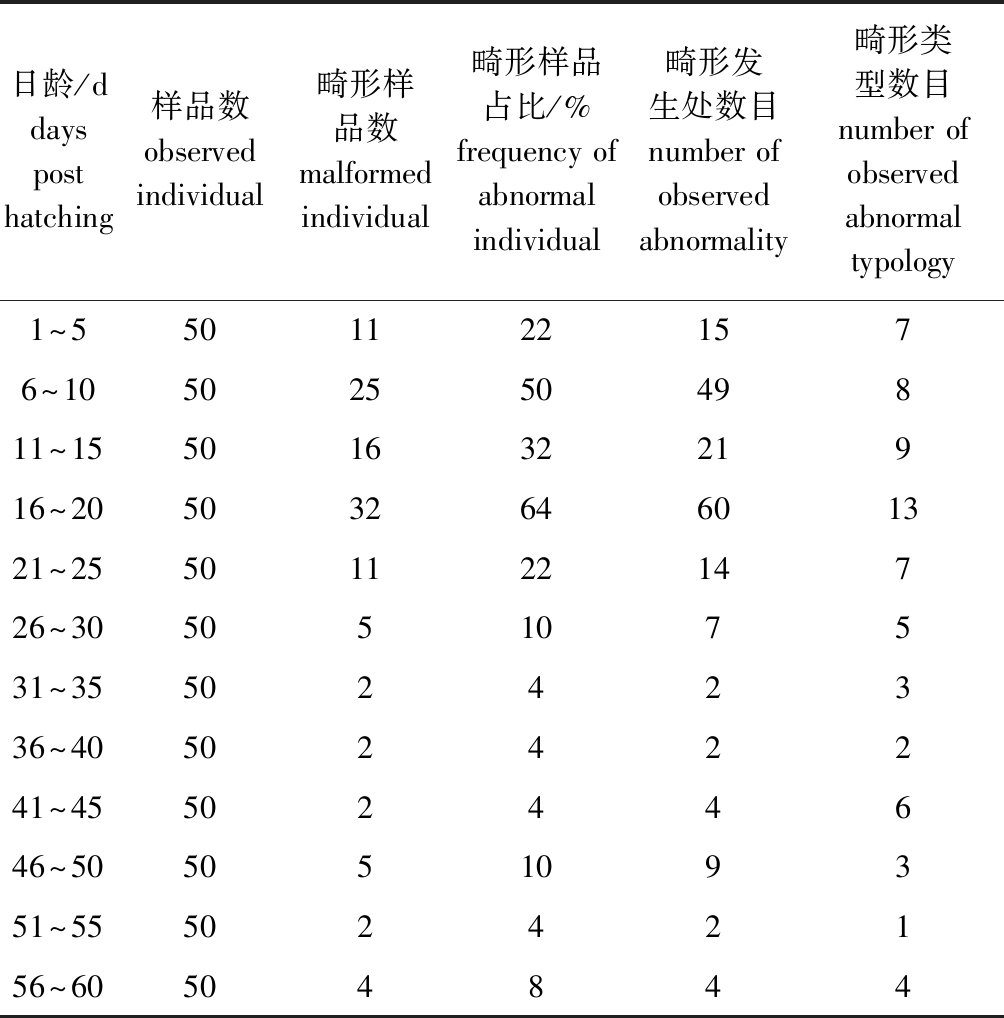
日龄/ddays post hatching样品数observed individual畸形样品数malformed individual畸形样品占比/%frequency of abnormal individual畸形发生处数目number of observed abnormality畸形类型数目number of observed abnormal typology1~55011221576~1050255049811~1550163221916~20503264601321~2550112214726~30505107531~3550242336~4050242241~4550244646~50505109351~5550242156~60504844
3 讨论
3.1 人工繁育大泷六线鱼仔稚鱼骨骼畸形与早期死亡率的关系
本研究中对人工繁育大泷六线鱼仔稚鱼主轴骨骼和附肢骨骼畸形发育进行观察时发现,在经历了运动及摄食行为改变后,部分大泷六线鱼发生了骨骼畸形。仔稚鱼阶段骨骼畸形发生时间、部位及类型依物种的不同而有所差异[15]。大泷六线鱼仔稚鱼骨骼畸形主要发生时期在6~10 dph及16~20 dph,据潘雷等[10]对大泷六线鱼人工繁育及育苗研究报道,孵化后开口前(6 dph左右)、仔稚鱼变态期(15~20 dph)均为大泷六线鱼早期死亡高峰期,这与本研究中大泷六线鱼仔稚鱼骨骼畸形高发期基本吻合。大泷六线鱼的骨骼畸形率虽明显低于半滑舌鳎Cynoglossus semilaevis Günther[16]、大菱鲆[3]等主要海水经济鱼类,但在上述两个发生发育阶段,畸形率均不低于50%。与此同时,与七带石斑鱼Epinephelus septemfasciatus[17]、青石斑鱼Epinephelus awoara[18]相似,大泷六线鱼仔稚鱼骨骼畸形主要发生部位为脊柱与头部,其中,16~20 dph期间发生的脊柱侧凸、脊柱后凸、迈克尔氏软骨弯曲等可能会引起大泷六线鱼仔稚鱼摄食与运动障碍[15,19-20],进而影响其生长发育及成活率[3],据此可推测,骨骼畸形是导致大泷六线鱼仔稚鱼发育前期高死亡率的重要因素之一;另外, 40~60 dph阶段大泷六线鱼脊柱与鳍骨骼畸形发生率均出现了不同程度的上升,但畸形类型主要为椎体融合和桡骨远端融合等,这些畸形类型可能会造成大泷六线鱼鱼体短小或外部形态受损[5],但对其成活率的影响不大,因此,骨骼畸形并非大泷六线鱼仔稚鱼发育后期死亡高发的主要原因。

注:A1~F1为侧面观;A2~F2为背面观;A3~F3为腹面观。TrC为梁小骨弯曲;MCC为迈克氏软骨弯曲;CBC为角鳃骨弯曲;PqA为颚方骨异位;HsA为舌续骨异位;MA为上颌骨异位;OD为鳃盖缺失。比例尺为1.00 mm
Note: A1-F1,lateral view; A2-F2, dorsal view; A3-F3, ventral view. TrC, trabeculea curved; MCC, Meckel’s cartilage curved; CBC, ceratobranchial curved; PqA, palatoquadrate allotopia; HsA, hyosympletic allotopia; MA, maxillary allotopia; OD, opercle deficiency. Scale bar, 1.00 mm
图1 大泷六线鱼仔稚鱼头部骨骼畸形
Fig.1 Skeletal abnormalities in head of larval and juvenile greenling Hexagrammos otakii

注:A~D、E1、F~G为侧面观;E2为腹面观。VbC为脊柱内缩;BNA为髓弓分叉;KY为脊柱后凸;BNS为髓棘分叉;LO为脊柱前凸;SC为脊柱侧凸;SNS为髓棘冗余;SHS为脉棘冗余;VF为椎骨融合。比例尺为1.00 mm
Note:A-D,E1,and F-G, lateral view; E2, ventral view. VbC, vertebral coarctation; BNA, bifurcated neural arches; KY, kyphosis; BNS, bifurcated neural spines; LO, lordosis; SC, scoliosis; SNS, supernumerary neural spines; SHS, supernumerary haemal spines; VF, vertebral fusion. Scale bar, 1.00 mm
图2 大泷六线鱼仔稚鱼脊柱骨骼畸形
Fig.2 Skeletal abnormalities in vertebral column of larval and juvenile greenling Hexagrammos otakii
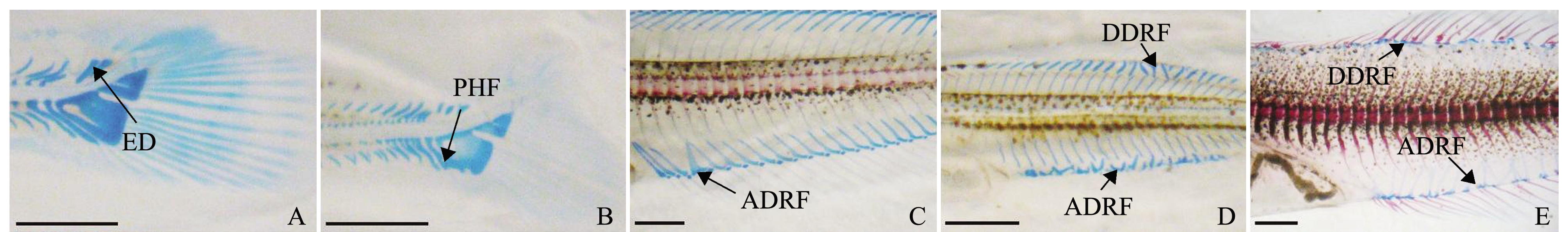
注:A、B为尾鳍畸形;C、D、E为臀鳍畸形;D、E为背鳍畸形。ED为尾上骨缺失;PHF为尾鳍侧尾下骨与脉棘融合;DDRF为背鳍桡骨远端融合;ADRF为臀鳍桡骨远端融合。比例尺为1.00 mm
Note:A and B, caudal fin deformity; C, D and E, anal fin deformity; D and E, dorsal fin deformity. ED, epural deficiency; PHF, parhypural and heamal spine fusion; DDRF, distal radius fusion of dorsal fin; ADRF, distal radius fusion of anal fin. Scale bar, 1.00 mm
图3 大泷六线鱼仔稚鱼鳍骨骼畸形
Fig.3 Skeletal abnormalities in fins of larval and juvenile greenling Hexagrammos otakii
3.2 人工繁育大泷六线鱼仔稚鱼骨骼畸形原因分析
造成鱼类骨骼畸形的因素有很多,包括营养、遗传因素和环境条件等。按照胡发文等[21]对大泷六线鱼仔稚鱼分期可知,六线鱼骨骼畸形主要发生在仔鱼后期,此时,鱼体处于快速生长阶段,器官的加速生成可能导致骨组织代谢功能失调,进而引起大泷六线鱼骨骼发育异常[3]。Martinez等[22]认为,各骨骼元件的发育对于不利条件的敏感度不同。本研究中得出的大泷六线鱼不同部位、不同类型骨骼畸形高发时间段不尽相同的结论证实了其假设。
在鱼类人工繁育过程中,不同部位骨骼畸形的发生可能受多种因素的影响。脊柱畸形通常考虑与养殖系统水体流动受阻[23]、仔鱼阶段鱼鳔形态缺陷与功能障碍[17,24]及饵料营养物质配比不平衡[25]有关。在本研究的苗种培育过程中,未明显观察到大泷六线鱼仔稚鱼鱼鳔的缺陷及养殖水体的不均匀流动,因此,饵料营养缺陷可能是诱导大泷六线鱼脊柱畸形的主要原因。据相关研究可知,饵料中维生素A含量未达到适当水平可导致欧洲鲈Dicentrarchus labrax脊柱侧凸、后凸、前凸等脊柱骨骼畸形的发生[26];维生素K缺乏是致使底鳉Fundulus heteroclitus椎体融合、髓弓畸形发生的重要原因之一[27];常量矿物质P缺乏可引起大西洋鲑Salmo salar脊柱棘部畸形的发生[28];与此同时,饵料中必需脂肪酸、微量矿物质等营养物质配比不平衡均有可能引起鱼类脊柱畸形的发生[13]。
综上可知,影响鱼类脊柱骨骼畸形的营养因素有很多,大泷六线鱼仔稚鱼脊柱畸形高发具体与饵料中哪类营养物质配比不平衡相关,还需通过单一变量试验进行进一步测定。由于鱼类鳍发育需经历较长的时间,鳍畸形率常被作为检测养殖条件是否合适的一项重要指标[29]。本研究中发现,大泷六线鱼鳍畸形发生率虽低,但其背鳍与臀鳍骨骼存在多处桡骨远端不规则融合现象,并且造成了鱼鳍条形态的外部损伤,由此可以推测,目前的苗种培育条件并不完全适宜,培育条件可能是影响大泷六线鱼鳍骨骼发育的主要因素。养殖水温及饵料中脂肪酸等营养组成是影响鱼类头部骨骼发育的重要因素。不同温度下日本鳗鲡Anguilla japonica的颌骨畸形发生率变化显著[30];投喂经DHA 强化的轮虫能够有效降低遮目鱼Chanos chanos仔稚鱼鳃盖畸形的发生率[31]。温度及营养条件是否为影响大泷六线鱼头部骨骼畸形的主要因素还需通过对比试验进一步确定。
骨骼畸形是影响鱼类外部形态、生存能力的重要因素之一[32]。人工繁育苗种的畸形发育可导致鱼类运动及摄食能力降低,进而影响其成活率及苗种质量。本研究中通过对人工繁育大泷六线鱼骨骼畸形现象的观察分析,摸清了大泷六线鱼骨骼畸形发生部位、类型及时期,并初步推测出不同部位骨骼畸形可能受到的来自营养、环境等因素的胁迫,本研究结果可为优化大泷六线鱼人工繁育条件及养殖管理参数提供参考。
[1] Gao Xiaoqiang,Liu Zhifeng,Guan Changtao,et al.Skeletal development and abnormalities of the vertebral column and fins in larval stage of hatchery-reared American shad,Alosa sapidissima[J].Aquaculture Research,2018,49(7):2376-2392.
[2] Puvanendran V,Calder-Crewe C,Brown J A.Vertebral deformity in cultured Atlantic cod larvae:ontogeny and effects on mortality[J].Aquaculture Research,2009,40(14):1653-1660.
[3] Tong X H,Liu Q H,Xu S H,et al.Skeletal development and abnormalities of the vertebral column and of the fins in hatchery-reared turbot Scophthalmus maximus[J].Journal of Fish Biology,2012,80(3):486-502.
[4] Zheng Panlong,Ma Zhenhua,Guo Huayang,et al.Osteological ontogeny and malformations in larval and juvenile golden pompano Trachinotus ovatus (Linnaeus 1758)[J].Aquaculture Research,2016,47(5):1421-1431.
[5] 吕雪娇.大菱鲆(Scophthalmus maximus)和鞍带石斑鱼(Epinephelus lanceolatus)生长特性以及骨骼发育与畸形研究[D].青岛:中国科学院海洋研究所,2018.
[6] Hough C.Malformations in the Mediterranean and in cold water productions[C]//Proceedings of the 5th Fish & Shellfish Larviculture Symposium.Ghent,Belgium:Ghent University,2009.
[7] 胡发文,李莉,刘元文,等.丁香油和MS-222对大泷六线鱼幼鱼的麻醉效果[J].大连海洋大学学报,2017,32(6):671-675.
[8] 中国科学院海洋研究所.中国经济动物志:海产鱼类[M].北京:科学出版社,1962:135-137.
[9] 胡发文,张少春,王雪,等.大泷六线鱼全人工繁育技术研究[J].海洋科学,2016,40(3):71-76.
[10] 潘雷,胡发文,高凤祥,等.大泷六线鱼人工繁殖及育苗技术初步研究[J].海洋科学,2012,36(12):39-44.
[11] 苏利,邢光敏,黃学玉.大泷六线鱼地下海水室内养殖试验[J].水产科技情报,2011,38(3):160-162.
[12] Boglione C,Gisbert E,Gavaia P,et al.Skeletal anomalies in reared European fish larvae and juveniles.Part 2:main typologies,occurrences and causative factors[J].Reviews in Aquaculture,2013,5(S1):S121-S167.
[13] 杨安峰.硬骨-软骨双染色技术[J].动物学杂志,1987,22(2):40-41.
[14] 于超勇,官曙光,于道德,等.大泷六线鱼仔稚鱼脊柱及附肢骨骼系统的发育观察[J].大连海洋大学学报,2020,35(1):47-55.
[15] 郑珂,岳昊,郑攀龙,等.海水养殖鱼类仔、稚鱼骨骼发育与畸形发生[J].中国水产科学,2016,23(1):250-261.
[16] 马慧,庄志猛,柳淑芳,等.养殖半滑舌鳎仔稚鱼骨骼畸形的发生过程[J].中国水产科学,2011,18(6):1399-1405.
[17] Nagano N,Hozawa A,Fujiki W,et al.Skeletal development and deformities in cultured larval and juvenile seven-band grouper,Epinephelus septemfasciatus (Thunberg)[J].Aquaculture Research,2007,38(2):121-130.
[18] 王秋荣,毕建功,林利民,等.青石斑鱼骨骼发育异常的形态特征[J].大连海洋大学学报,2012,27(5):417-421.
[19] Koumoundouros G,Maingot E,Divanach P,et al.Kyphosis in reared sea bass (Dicentrarchus labrax L.):ontogeny and effects on mortality[J].Aquaculture,2002,209(1-4):49-58.
[20] Basaran F,Ozbilgin H,Ozbilgin Y D.Effect of lordosis on the swimming performance of juvenile sea bass (Dicentrarchus labrax L.)[J].Aquaculture Research,2007,38(8):870-876.
[21] 胡发文,郭文,潘雷,等.大泷六线鱼仔稚幼鱼形态发育与生长特性[J].渔业科学进展,2012,33(6):16-22.
[22] Martinez G M,Baron M P,Bolker J A.Skeletal and pigmentation defects following retinoic acid exposure in larval summer flounder,Paralichthys dentatus[J].Journal of the world Aquaculture Society,2007,38(3):353-366.
[23] Divanach P,Papandroulakis N,Anastasiadis P,et al.Effect of water currents on the development of skeletal deformities in sea bass (Dicentrarchus labrax L.) with functional swimbladder during postlarval and nursery phase[J].Aquaculture,1997,156(1-2):145-155.
[24] Kitajima C,Watanabe T,Tsukashima Y,et al.Lordotic deformation and abnormal development of swim bladders in some hatchery-bred marine physoclistous fish in Japan[J].Journal of the World Aquaculture Society,1994,25(1):64-77.
[25] Negm R K,Cobcroft J M,Brown M R,et al.The effects of dietary vitamin A in rotifers on the performance and skeletal abnormality of striped trumpeter Latris lineata larvae and post larvae[J].Aquaculture,2013,404-405:105-115.
[26] Mazurais D,Glynatsi G,Darias M J,et al.Optimal levels of dietary vitamin A for reduced deformity incidence during development of European sea bass larvae (Dicentrarchus labrax) depend on malformation type[J].Aquaculture,2009,294(3-4):262-270.
[27] Udagawa M.The effect of dietary vitamin K (phylloquinone and menadione) levels on the vertebral formation in mummichog Fundulus heteroclitus[J].Fisheries Science,2001,67(1):104-109.
[28] Sullivan M,Reid S W J,Ternent H,et al.The aetiology of spinal deformity in Atlantic salmon,Salmo salar L.:influence of different commercial diets on the incidence and severity of the preclinical condition in salmon parr under two contrasting husbandry regimes[J].Journal of Fish Diseases,2007,30(12):759-767.
[29] Huang Chao,Tan Xiaoying,Wu Kun,et al.Osteological development and anomalies in larval stage of hatchery-reared yellow catfish Pelteobagrus fulvidraco[J].Aquaculture Research,2016,47(4):1125-1140.
[30] Kurokawa T,Okamoto T,Gen K,et al.Influence of water temperature on morphological deformities in cultured larvae of Japanese Eel,Anguilla japonica,at completion of yolk resorption[J].Journal of the World Aquaculture Society,2008,39(6):726-735.
[31] Gapasin R S J,Duray M N.Effects of DHA-enriched live food on growth,survival and incidence of opercular deformities in milkfish (Chanos chanos)[J].Aquaculture,2001,193(1-2):49-63.
[32] Gavaia P J,Dinis M T,Cancela M L.Osteological development and abnormalities of the vertebral column and caudal skeleton in larval and juvenile stages of hatchery-reared Senegal sole (Solea senegalensis)[J].Aquaculture,2002,211(1-4):305-323.