人类进入工业化社会后,大量使用矿物质燃料致使大气CO2浓度升高,由工业化前(1860年代)约280 mg/L升高至目前约390 mg/L,而且仍以每年约0.5%速率继续增长[1],预计2100年和2300年大气CO2浓度将分别达到1000、2000 mg/L[2]。作为全球最大碳泵,海洋以100万t/h平均速率不断从大气中吸收CO2[3],导致海水pH值降低[4-5]、海水碳酸盐平衡改变,影响到海洋生物的生存。
依据海洋生物沉积物的元素可将海洋生物分为钙质生物和硅质生物两类[6-7]。海洋钙质生物主要有颗石藻、有孔虫、翼足类软体动物等,海洋硅质生物主要有硅藻、放射虫、硅鞭藻等[6]。大气CO2浓度升高会导致海水pH降低,从而对海洋钙质生物产生负面影响,如距今2.52亿年前海洋物种大灭绝就与古海洋酸化事件相关[8]。相对于海洋钙质生物,海洋硅质生物受海洋酸化影响较小,因此,一直未引起人们重视,直到近十几年才逐渐吸引研究者关注,如美国南加州大学Xu等[9]证实海洋酸化降低了南极硅藻Fragilariopsis cylindrus的生物硅含量,另有研究表明,大气 CO2 浓度升高影响繁茂膜海绵Hymeniacidon perlevis滤食海水中有机质和细菌的功能[10-11]。
海绵是现存最低等的多细胞动物,生存在几乎所有纬度、深度海水中,淡水中也有海绵生存[12],因此,海绵在水域底栖生态系统具有重要作用[13]。目前,地球上生存着大约15 000种海绵,在已经命名的9000多种海绵中[14],约90%属于硅质海绵,10%属于钙质海绵[15],两种海绵分别由硅质骨针和钙质骨针构成其骨架。海绵成骨细胞表达的硅酶将海水中可溶性硅酸盐生物转化成硅质骨针[16]。因此,研究海绵硅酶基因的表达可以了解其对大气 CO2 浓度升高的最基础分子响应,进而帮助人类认知海洋硅质生物对大气 CO2 浓度升高的响应。
目前,有关大气CO2浓度升高如何影响生物的研究主要集中在大气CO2浓度升高环境下生物的响应,然而当大气CO2浓度恢复至当前(约390 mg/L CO2)状态下对生物基本功能的影响几乎未知。因此,本研究中以广泛分布于北黄海、渤海潮间带海域的一种典型硅质海绵——繁茂膜海绵[10-11]为模式生物,在实验室条件下研究了大气 CO2 浓度升高对海绵硅酶基因表达的影响,随后研究了大气 CO2 高浓度胁迫后海绵组织基本功能——滤食功能的变化,以期帮助认知海洋底栖典型硅质生物对大气CO2浓度升高的响应。
1 材料与方法
1.1 材料
试验用繁茂膜海绵采自辽宁省大连市黑石礁潮间带海域,将采集的海绵置于装有海水的塑料袋中,0.5 h内运回实验室,在水族缸中暂养2 d后,从中筛选健康的海绵组织块用于试验[10-11]。新月菱形藻Natzchia closterum源于辽宁省高校近岸海洋环境科学与技术重点实验室。海水取自辽宁省大连市黑石礁海域,经沙滤、煮沸灭菌,称为灭菌海水(SSW)。
试验装置采用发明专利——全球气候变化背景下海洋潮间带生态环境模拟系统及其应用(专利号:ZL 201210054111.1)[17]中的装置与方法(以下简称“模拟生态系统”),不同浓度CO2的制备参见文献[18]中的方法。
试验试剂Trizol、M-MLV 反转录酶、RNA 酶抑制剂、dNTP、ExTaq DNA聚合酶、实时定量PCR试剂盒等购自宝生物工程( 大连) 有限公司,PCR 引物由宝生物工程(大连)有限公司合成。
1.2 方法
1.2.1 大气CO2浓度升高对繁茂膜海绵压力试验 (1) 模拟大气CO2浓度500 mg/L试验。设5个模拟生态系统,每个系统分别装有冷却至室温的灭菌海水25 L。第一和第二个模拟生态系统,用蠕动泵将空气(CO2浓度约390 mg/L)泵入系统海水中[10],其中第一个系统作为空白组不放海绵,第二个系统放入若干块海绵组织块(合计25.0 g)作为对照组。第三、四和五个模拟生态系统,分别置入若干块海绵组织块,每个系统中合计25.0 g,用蠕动泵将气囊中气体( CO2浓度500 mg/L)泵入系统的海水中[18],作为试验组1、2、3。为了保持试验组CO2浓度稳定在500 mg /L,每12 h更换1个气囊(CO2浓度500 mg/L)。在试验的12、24、48 h时,从对照组和试验组1、2、3中分别随机取出几块海绵组织块,每块切割一小块海绵,合计约1.5 g海绵组织块用于海绵硅酶表达分析,然后封闭模拟生态系统。在试验开始和结束时,监测模拟生态系统中海水的温度和pH 值。
(2) 模拟大气CO2浓度750和1000 mg/L试验。除了试验组1、2、3中分别使用CO2浓度750和1000 mg/L气囊之外,其他与模拟大气CO2浓度500 mg/L试验相同。
1.2.2 海绵总RNA提取、反转录、硅酶基因表达
海绵总RNA提取、反转录及繁茂膜海绵硅酶基因定量表达按照文献[16]中的方法操作。
硅酶表达的实时定量PCR引物:
Forword:5′CAGTGACGGCAAATCTAAAGG 3′;
Reverse:5′CCCATAGCACTAAAGGCATAGC 3′。
参比基因为繁茂膜海绵18S rRNA,引物为:
Forword:5′AGGAGATGCTCGCTGACTTC 3′;
Reverse:5′ CTCACCAGGTCCAGACATAG 3′。
1.2.3 高浓度CO2胁迫后海绵滤食微藻能力试验 模拟大气CO2浓度500、750、1000 mg/L试验结束后,从对照组和试验组1、2、3中取出海绵块,分别置于各自水族缸中暂养1 h,然后从中随机取出合计5.0 g海绵组织块,置入预先装有300 mL新月菱形藻液[密度为(105.5±8.6)×104 cells/mL]的4个500 mL锥形瓶中,对应着“1.2.1节”试验中的对照组和试验组1、2、3。另设1个仅装有300 mL相同密度新月菱形藻液的锥形瓶且不放海绵作为空白组。上述5个锥形瓶均不加入营养盐,置于光照培养箱中培养(20 ℃、光照强度80 μmoL/(m2·s)、光暗周期12 h∶12 h)。在0、4、8、12、16、20、24 h,分别从锥形瓶中各取1.0 mL藻液,每次取3个平行,用血球计数板在显微镜下计数微藻密度。
1.2.4 海绵滤食微藻效率和清除率的计算 效率(filter rates,FR)和清除率(clearance rate,CR)分别直接和间接表征水生中滤食性动物尤其是海绵的过滤能力[15],计算公式[10,15]为
FR=(C0-Ct)·V /(t·W),
CR=ln(C0/Ct)·V/(t·W)。
其中:FR为过滤效率[cells/(h·g)];CR为清除率[mL/(h·g)];C0和Ct分别为初始和t时的微藻密度(104 cells/mL);V为锥形瓶中灭菌海水体积(300 mL);t为时间(h);W为海绵块的鲜质量(5.0 g)。
1.3 数据处理
试验数据采用SPSS 20 软件进行方差分析,用t检验进行组间多重比较。采用ABI Real-time 分析软件分析繁茂膜海绵硅酶基因的相对表达含量,具体参照文献[19],显著性水平设为0.05。
2 结果与分析
2.1 模拟生态系统中海水温度和pH的变化
试验期间,海水温度为17~21 ℃。空白组海水pH变化范围为8.05~8.15,对照组pH为8.06~8.15,模拟大气CO2浓度为500、750、1000 mg/L的试验组pH分别为7.90~7.97、7.73~7.80、7.56~7.63。空白组和对照组的海水pH几乎无差异,这表明,试验期间在模拟生态系统中放入海绵未影响海水pH。随着模拟生态系统中大气CO2浓度升高,海水pH呈降低趋势。
2.2 大气CO2浓度升高后海绵硅酶基因表达变化
从图1可见:对照组(390 mg/L CO2)海绵硅酶基因相对表达量在12、24、48 h间无显著性差异(P>0.05);在模拟大气CO2浓度500 mg/L条件下,试验组海绵硅酶相对表达量在12、24、48 h分别比对照组显著提高24.8%、14.8%和19.2%(P<0.05);在大气CO2浓度750、1000 mg/L条件下,试验组海绵硅酶基因相对表达量在12、24、48 h分别比对照组显著降低40.0%、71.9%、82.3%(750 mg/L CO2),55.2%、83.6%、80.8%(1000 mg/L CO2)。可见,大气CO2浓度为500 mg/L时可促进繁茂膜海绵硅酶基因表达,而大气CO2浓度为750、1000 mg/L时则严重抑制海绵硅酶基因表达。
此外,390 mg/L CO2的对照组和500 mg/L CO2试验组,海绵硅酶基因表达量随作用时间延长无显著性变化(P>0.05);而750、1000 mg/L CO2试验组,随着作用时间延长基因表达量显著降低(P<0.05),24、48 h时硅酶基因表达量仅分别为12 h的48.0%、30.7%(750 mg/L CO2),37.5%、44.6%(1000 mg/L CO2)。
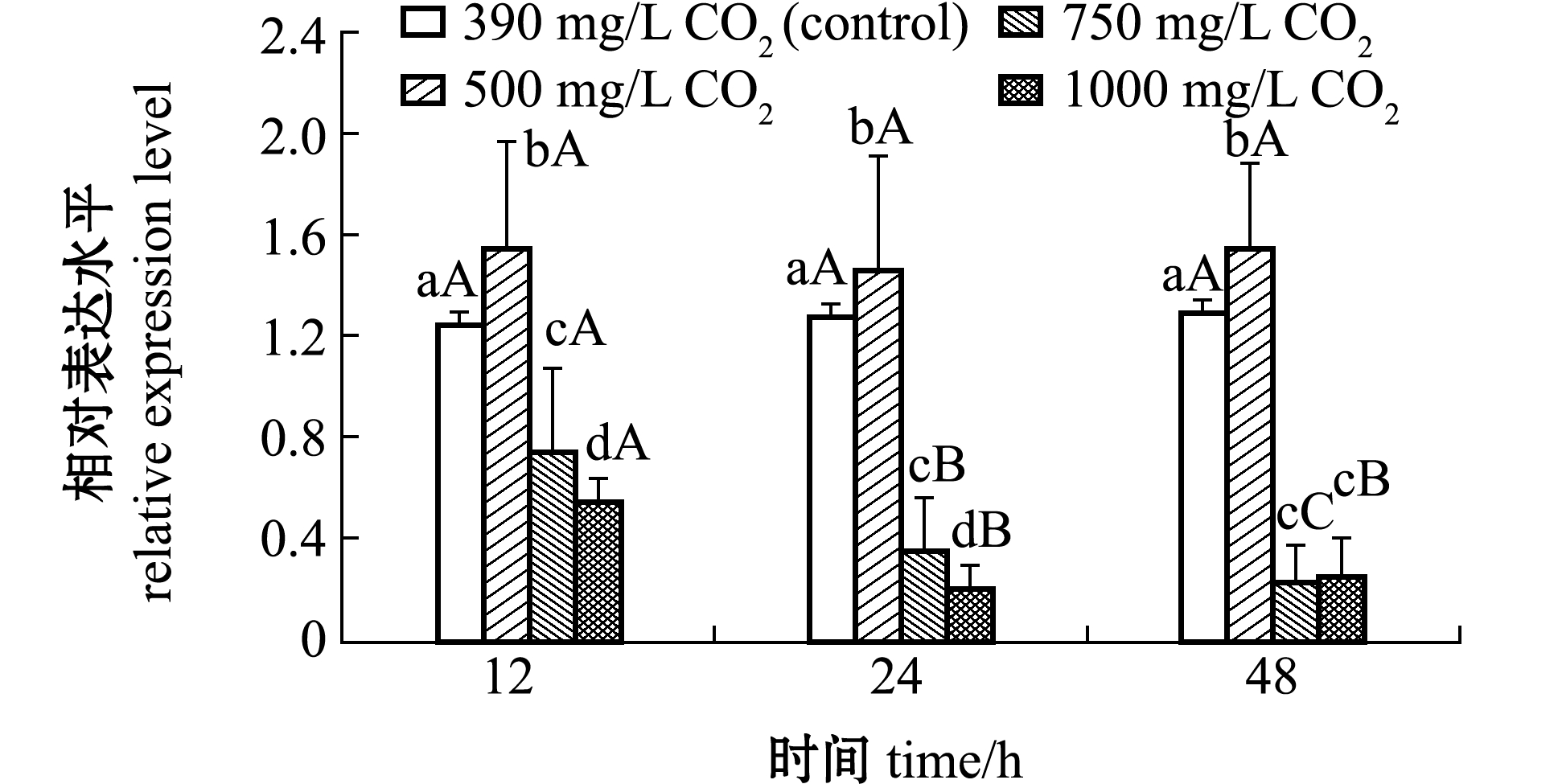
注:标有不同小写字母者表示同一时间不同浓度组间有显著性差异(P<0.05);标有不同大写字母者表示同一浓度不同时间点间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters in the same time are significantly different among different CO2 concentration groups at the 0.05 probability level, means with different capital letters in same concentration are significantly different in different time at the 0.05 probability level, and the means with the same letters are not significant differences
图1 不同大气CO2浓度下繁茂膜海绵硅酶基因表达变化
Fig.1 Changes in silicatein gene expression of marine sponge Hymeniacidon perlevis exposed to different concentrations of CO2
2.3 高浓度CO2胁迫后海绵滤食微藻能力的变化
不同高浓度大气CO2胁迫后海绵组织块的滤食能力有显著变化。从图2-A可见:各组新月菱形藻初始平均密度为(105.5±8.6)×104 cells/mL,空白组(未放入海绵组织块)微藻密度随作用时间延长无显著性差异(P>0.05);对照组和500 mg/L CO2试验组海绵组织块滤食微藻的能力相近,在24 h时两组中的微藻密度分别为(26.2±7.8)×104、(22.4±1.8)×104 cells/mL,分别为微藻初始密度的24.8%和21.2%,相应地,在24 h内对照组和500 mg/L CO2组海绵组织块滤食微藻的平均效率分别为198.2×104、207.8×104cells/(h·g);750 mg/L CO2组海绵块滤食微藻速率低于对照组,在24 h时微藻密度为(59.1±4.8)×104cells/mL,分别为初始微藻密度和对照组的56.0%、2.26倍,相应地,在24 h内海绵滤食微藻的平均效率为116.0×104cells/(h·g),比对照组降低41.5%;1000 mg/L CO2组海绵块滤食微藻速率进一步降低,在24 h时微藻密度为(81.1±4.8)×104cells/mL,分别为初始微藻密度和对照组的76.9%、3.09倍,相应地,在24 h内海绵滤食微藻平均效率为61.0×104cells/(h·g),比对照组降低69.2%。可见,大气CO2浓度为750、1000 mg/L时不但抑制繁茂膜海绵硅酶基因表达,而且实质性地损害了海绵块滤食微藻的基本功能。
从图2-B可见:除4、8 h时间点不同之外,对照组(390 mg/L)与500 mg/L CO2试验组海绵块滤食微藻的清除率变化趋势基本一致,在24 h内对照组和500 mg/L CO2试验组海绵块的平均清除率分别为4.09、3.95 mL/(h·g);750 mg/L CO2试验组海绵块清除率显著低于对照组,在24 h内海绵块平均清除率为2.67 mL/(h·g),比对照组降低34.7%,且其清除率随时间延长而逐渐下降;1000 mg/L CO2试验组海绵块清除率进一步降低,在24 h内其海绵块平均清除率为0.82 mL/(h·g),比对照组降低79.9%,海绵几乎丧失滤食微藻的基本功能。
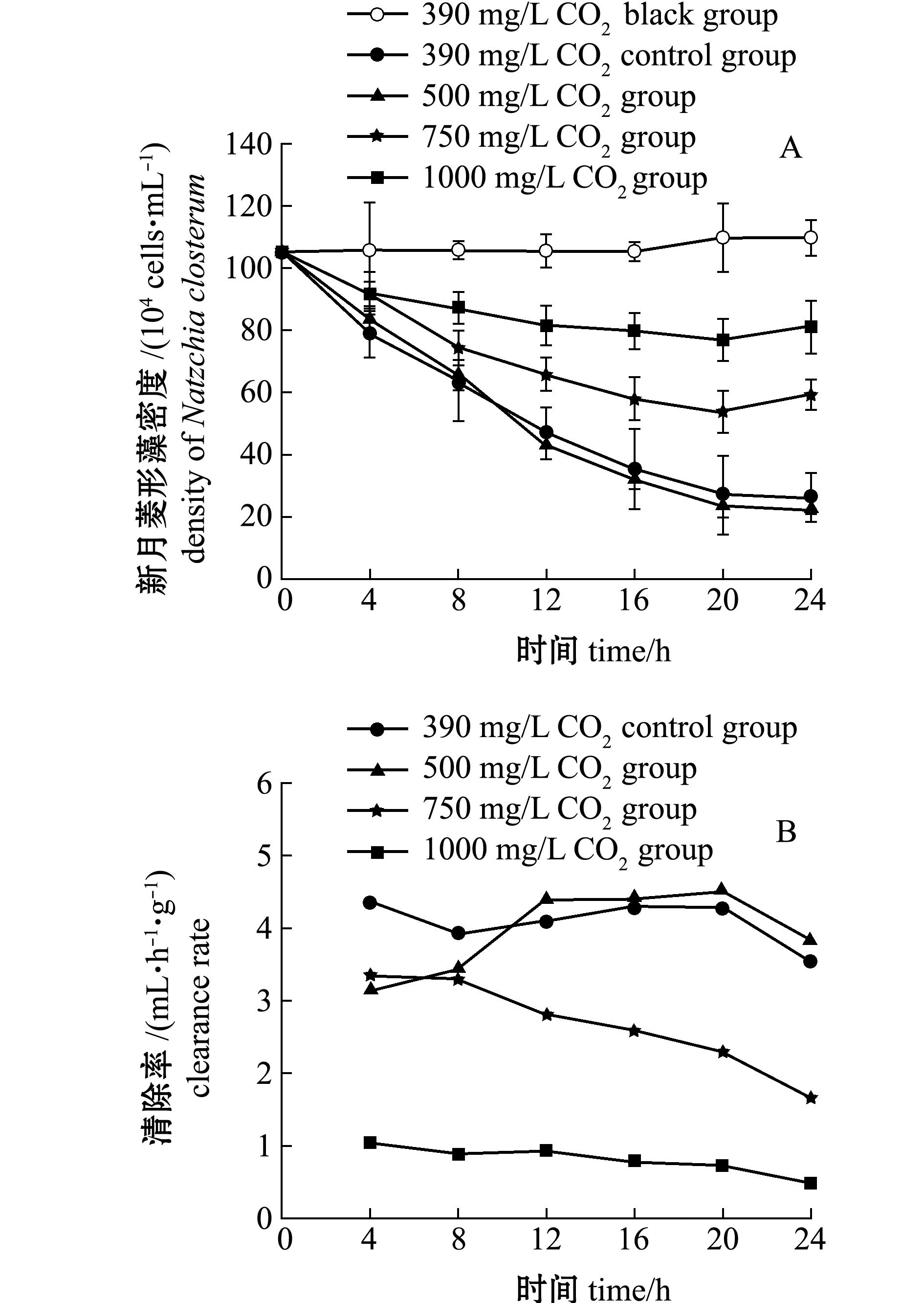
图2 不同浓度大气CO2胁迫后各组海绵滤食微藻能力的变化
Fig.2 Changes in filtering ability of marine sponge Hymeniacidon perlevis exposed to different concentration of CO2 in various groups
3 讨论
3.1 高浓度大气CO2对海绵硅酶基因表达的影响
海绵是固着生长的多细胞动物,只能被动适应环境变化[15]。海绵由形状各异、大小不同的骨针构成海绵骨架,海绵的成骨细胞分泌轴丝蛋白将海水中可溶性硅酸盐或可溶性钙盐生物合成为硅质骨针或钙质骨针,其中,合成硅质骨针的轴丝蛋白称为硅酶[16]。目前,已经鉴定的9000多种海绵中有90%属于硅质海绵,因此,海绵硅酶表达量的变化可以代表海洋底栖硅质生物对生态环境变化的基本响应。
本研究中,大气CO2浓度升高至500 mg/L时,在12、24、48 h时试验组海绵硅酶表达量均显著高于对照组(390 mg/L CO2)(图1),说明繁茂膜海绵在此环境下利用海水中可溶性硅酸盐的效率有所提高,海绵成骨细胞增加分泌硅酶以生物合成更多骨针,为海绵生物量增加提供了基本骨架。此结果与大气CO2浓度为500 mg/L时增强了繁茂膜海绵滤食海水中有机碳能力的结果相符合[10],且与低光照协同海洋酸化环境促进中国南海硅藻生长的结果相似[20],这意味着大气CO2浓度从目前约390 mg/L升高至500 mg/L时将会促进海洋硅质生物的生长。目前,大气CO2浓度为500 mg/L时负面影响海洋钙质生物已经被一些研究证实[21-22],因此,本研究中展示的大气CO2浓度为500 mg/L时促进海洋硅质生物生长的研究结果更具参考价值。
本研究中大气CO2浓度升高至750、1000 mg/L时,试验组海绵硅酶基因表达量呈逐渐下降趋势(图1),在12、24、48 h时,750 mg/L CO2浓度组海绵硅酶表达量分别比500 mg/L CO2浓度组对应时间下降了51.9%、75.5%和85.2%,1000 mg/L CO2浓度组海绵硅酶表达量进一步下降,分别比500 mg/L CO2浓度试验组对应时间下降了64.1%、85.7%和83.9%。已有研究表明,大气CO2浓度为750、1000 mg/L时显著抑制了繁茂膜海绵滤食海水中有机碳[10]和细菌[11]的功能,在海绵基本滤食功能减弱后,繁茂膜海绵硅酶基因表达降低应为海绵正常的生理反应。可见,大气CO2浓度从500 mg/L升高至750 mg/L以上时,抑制了繁茂膜海绵硅酶基因的表达和基本滤食功能,对海洋钙质生物和海洋硅质生物均会产生负面影响,此时海洋生态系统将遭到严重破坏。
3.2 高浓度大气CO2胁迫后海绵滤食微藻功能的恢复情况
随着极端气象条件不断出现,沿岸污染事件频繁发生,尤其工业污染导致的近海海洋酸化局域性频发,在黄、渤海潮间带生态系统占有重要地位的繁茂膜海绵在遭遇短时间海水酸化后能否保持其基本滤食功能是学界关注的重点。本试验中,对照组海绵样品在当前大气CO2浓度(390 mg/L CO2)下,海绵块保持了较高的滤食微藻的能力,在24 h内海绵滤食新月菱形藻的平均效率为198.2×104cells/(h·g),此数值与繁茂膜海绵滤食大肠杆菌(Escherichia coli AS 1.1017)的效率相当[23],但比一种地中海海绵Chondrilla nucula Schmidt滤食大肠杆菌的效率高出几百倍[24],这应与海绵种属和滤食对象(微藻、大肠杆菌)的差异有关。同样地,24 h内对照组海绵滤食微藻的平均清除率为4.09 mL/(h·g),这仅为繁茂膜海绵滤食大肠杆菌清除率的10%左右[23],但高于地中海海绵滤食大肠杆菌的清除率数倍[24],造成此差异的原因是试验用海绵样品的水沟系结构性不同[25]。经500 mg/L大气CO2胁迫48 h再于当前大气CO2浓度(390 mg/L CO2)下恢复1 h后,海绵样品滤食微藻的效率和清除率与对照组相近,而经750、1000 mg/L CO2浓度胁迫及当前大气CO2下恢复后,海绵样品滤食微藻的效率与清除率呈逐渐下降趋势,24 h内海绵块滤食微藻的平均效率与平均清除率分别仅为对照组的58.5%、65.3%(750 mg/L CO2),30.8%、20.0%(1000 mg/L CO2)(图2)。可见,经浓度为750、1000 mg/L大气CO2胁迫后,海绵样品的滤食能力大幅度降低。此结果与本研究中大气CO2浓度升高对繁茂膜海绵硅酶基因表达的结果在机理上相互印证。
本研究中,在大气CO2浓度为750、1000 mg/L时,随着CO2浓度升高和海洋酸化压力时间延长,繁茂膜海绵硅酶基因相对表达量显著降低,但最终会稳定在某一水平,这表明在海洋酸化压力下海洋钙质生物可能会逐渐灭绝,但海洋硅质生物可能会维持在一个较低生物量水平。此判断与距今2.52亿年前古海洋酸化导致海洋物种大灭绝相符合[8],同时也与浅海CO2喷口处海水pH低导致生物量明显减少、生物多样性明显降低的结果相符合[26]。这预示着如果大气CO2浓度升高至1000 mg/L以上甚至更高时,未来海洋生态系统中的钙质生物和硅质生物均将大幅度减少,其中海洋硅质生物仍能维持生存,但是否可长期生存需要进一步研究。
4 结论
(1)大气CO2浓度由目前约390 mg/L升高至500 mg/L时,可促进繁茂膜海绵硅酶基因表达, CO2浓度继续升高至750、1000 mg/L时,则抑制海绵硅酶基因表达,且随着作用时间延长,海绵硅酶基因表达也随之降低。(2)海绵样品经不同浓度大气CO2胁迫后,在当前大气CO2浓度下其滤食微藻的功能差异明显,经浓度为500 mg/L大气CO2胁迫后,海绵块与对照组几乎无差异(除了试验初始2个采样时间点外),经浓度为750 mg/L大气CO2胁迫后,海绵块滤食功能严重受损,而经浓度1000 mg/L CO2胁迫后,海绵块几乎丧失了滤食微藻功能。此研究结果对人类认知大气CO2浓度升高对海洋硅质生物的影响提供了数据参考。
[1] NOAA.Global warming update[EB/OL].[2016-07-07].https://www.CO2.earth/.
[2] IPCC.Climate Change 2013:the physical science basis[M]//Stocker T F,Qin D,Plattner G K,et al.Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change.Cambridge:Cambridge University Press,2013:1535.
[3] Sabine C L,Feely R A,Gruber N,et al.The oceanic sink for anthropogenic CO2 [J].Science,2004,305(5682):367-371.
[4] 高坤山.海洋酸化的生理生态效应及其与升温、UV辐射和低氧化的关系[J].厦门大学学报:自然科学版,2018,57(6):800-810.
[5] Hu Shunxin,Wang You,Wang Ying,et al.Effects of elevated pCO2 on physiological performance of marine microalgae Dunaliella salina (Chlorophyta,Chlorophyceae)[J].Journal of Oceanology and Limnology,2018,36(2):317-328.
[6] 张富元,章伟艳,张霄宇,等.深海沉积物分类与命名的关键技术和方案[J].地球科学——中国地质大学学报,2012,37(1):93-104.
[7] 高水土,张德玉,陈荣华,等.南海北部表层沉积物中黏土和碎屑矿物组成及其地质意义[J].海洋学报,2008,30(1):86-92.
[8] Garbelli C,Angiolini L,Shen Shuzhong.Biomineralization and global change:a new perspective for understanding the end-Permian extinction[J].Geology,2017,45(1):19-22.
[9] Xu Kai,Fu Feixue,Hutchins D A.Comparative responses of two dominant Antarctic phytoplankton taxa to interactions between ocean acidification,warming,irradiance,and iron availability[J].Limnology and Oceanography,2014,59(6):1919-1931.
[10] 徐辉,刘宏文,安宗福,等.大气CO2浓度升高对繁茂膜海绵阻留海水中有机碳功能的影响[J].大连海洋大学学报,2015,30(1):79-84.
[11] 张晓芳,徐辉,刘宏文,等.大气CO2浓度升高对繁茂膜海绵滤食海水细菌能力的影响[J].海洋科学,2017,41(7):16-22.
[12] Frost T M,Williamson C E.In situ determination of the effect of symbiotic algae on the growth of the fresh water sponge Spongilla lacustris[J].Ecology,1980,61(6):1361-1370.
[13] Bergquist P R.Sponges[M].London:Hutchinson,1978:181.
[14] Van Soest R W M,Boury-Esnault N,Hooper J N A,et al.World porifera database [EB/OL].[2019-11-11].http://www.marinespecies.org/porifera.
[15] Hooper J N A,Soest R W M V.Systema Porifera:A Guide to the Classification of Sponges[M].New York:Kluwer Academic/Plenum Publishers,2002.
[16] 孙黎明,曹旭鹏,虞星炬,等.繁茂膜海绵硅聚合酶抗体制备及其在造骨细胞鉴别中的应用[J].动物学报,2006,52(4):780-787.
[17] 付晚涛,张菊林,安宗福,等.气候变化背景下海洋潮间带生态环境模拟系统及其应用:中国,201210054111.1[P].2015-01-21.
[18] 付晚涛,刘佳,张菊林,等.大气CO2浓度升高对大型海藻孔石莼生长和色素含量的影响[J].大连海洋大学学报,2013,28(5):481-486.
[19] 田燚,莫海波,常亚青.低盐胁迫下仿刺参DD104基因的定量表达分析[J].大连海洋大学学报,2013,28(3):236-240.
[20] Gao Kunshan,Xu Juntian,Gao Guang,et al.Rising CO2 and increased light exposure synergistically reduce marine primary productivity[J].Nature Climate Change,2012,2(7):519-523.
[21] 秦艳杰,宋晓楠,李霞,等.海洋酸化和升温对中间球海胆幼虫发育和生长的影响[J].大连海洋大学学报,2013,28(5):450-455.
[22] Sordo L,Santos R,Barrote I,et al.Temperature amplifies the effect of high CO2 on the photosynthesis,respiration,and calcification of the coralline algae Phymatolithon lusitanicum[J].Ecology and Evolution,2019,9(19):11000-11009.
[23] Fu Wantao,Sun Liming,Zhang Xichang,et al.Potential of the marine sponge Hymeniacidon perleve as a bioremediator of pathogenic bacteria in integrated aquaculture ecosystems[J].Biotechnology and Bioengineering,2006,93(6):1112-1122.
[24] Milanese M,Chelossi E,Manconi R,et al.The marine sponge Chondrilla nucula Schmidt,1862 as an elective candidate for bioremediation in integrated aquaculture[J].Biomolecular Engineering,2003,20(4-6):363-368.
[25] Turon X,Galera J,Uriz M J.Clearance rates and aquiferous systems in two sponges with contrasting life-history strategies[J].Journal of Experimental Zoology,1997,278(1):22-36.
[26] Fabricius K E,Langdon C,Uthicke S,et al.Losers and winners in coral reefs acclimatized to elevated carbon dioxide concentrations[J].Nature Climate Change,2011,1(3):165-169.