鱼体皮肤黏液细胞能分泌多种活性物质,如酸性黏多糖、中性黏多糖等,这些物质可以有效降低外物对鱼体的摩擦作用,具有保护和润滑功能,能够保证鱼体生命活动正常有序地进行[1-2],而底栖鱼类易受其所在环境中异物和病原体的侵害,因此,开展底栖鱼类皮肤黏液细胞类型与分布的相关研究具有重要意义。泥鳅Misgurnus anguillicaudatus又称真泥鳅,隶属于鲤形目鳅科泥鳅属,其身体鳞片细小,埋于皮下,大多鳞片已退化[3];葛氏鲈塘鳢Perccottus glenii俗称老头鱼,隶属于鲈形目虾虎鱼亚目塘鳢科,其身体鳞片中等大小,头和鳃盖均有鳞片分布[4]。鳞片退化鱼类泥鳅和鳞片正常鱼类葛氏鲈塘鳢均为底栖淡水经济鱼类,是中国北方高寒地区的特色养殖鱼类[5-6]。目前,国内外对泥鳅黏液细胞的研究多集中在消化道方面[7-8],而对葛氏鲈塘鳢黏液细胞的研究几乎未见报道,为此,本研究中通过对中国东北高寒地区常见的淡水底栖鱼类泥鳅和葛氏鲈塘鳢在4个季节中皮肤黏液细胞的分布情况进行差异比较,探究淡水底栖鳞片退化鱼类和鳞片正常鱼类皮肤黏液细胞类型与分布的季节变化,旨在为高寒地区淡水底栖鱼类养殖和鱼病防治等方面提供一定的理论指导。
1 材料与方法
1.1 材料
以中国高寒地区淡水底栖鱼类泥鳅和葛氏鲈塘鳢为试验材料,于2018年4、7、9、11月分别在松花江流域哈尔滨段采集健康野生泥鳅和葛氏鲈塘鳢,每次每种鱼均采集5 尾,泥鳅体质量为(8.5±2.1)g、体长为(13.2±2.5)cm,葛氏鲈塘鳢体质量为(14.0±3.8)g、体长为(9.7±1.2)cm。
1.2 方法
1.2.1 组织化学染色 试验鱼采集后立即处死,分别取4个季节泥鳅和葛氏鲈塘鳢头部、背部、腹部、尾部皮肤组织若干,将获取的样品直接浸入Bouin’s液固定,用常规石蜡包埋,连续切片,切片厚度为5 μm,用阿利新蓝(AB,pH 2.6)和过碘酸雪夫(PAS)试剂染色。
1.2.2 黏液细胞计数 利用Leica显微镜,在43.5 μm×32.6 μm视野下,分别于4个季节中两种鱼头、背、腹、尾4个部位皮肤的相应切片中随机选择10 个视野进行拍照计数,共计320 个视野,观察并统计泥鳅和葛氏鲈塘鳢在不同季节不同部位的黏液细胞类型和数目。
1.2.3 黏液细胞分类标准 参照尹苗等[9]对鱼类黏液细胞类型的划分方法,根据试验中AB-PAS染色结果将黏液细胞划分为以下4种类型:Ⅰ型黏液细胞为红色,AB阴性、PAS阳性,主要含中性黏多糖;Ⅱ型黏液细胞为蓝色,AB阳性、PAS阴性,主要含酸性黏多糖;Ⅲ型黏液细胞为紫红色,AB、PAS均为阳性,主要含PAS阳性的中性黏多糖及少量AB阳性的酸性黏多糖;Ⅳ型黏液细胞为蓝紫色,AB、PAS均为阳性,主要含AB阳性的酸性黏多糖及少量PAS阳性的中性黏多糖。
1.3 数据处理
采用SPSS 24.0软件对试验数据进行单因素方差分析(ANOVA),用LSD法进行组间多重比较,试验数据以平均值±标准差(mean±S.D.)表示,显著性水平设为0.05。
2 结果与分析
2.1 不同季节两种鱼皮肤黏液细胞的形态特征
两种底栖鱼类皮肤中4种类型的黏液细胞在不同季节中均存在,但随季节变化呈现出不同的形态特征:(1)在泥鳅头部、背部和腹部,春夏秋季皮肤黏液细胞的形态特征基本一致,蓝色Ⅱ型黏液细胞体积最大且形态以囊状为主,蓝紫色Ⅳ型黏液细胞体积最小且以球状为主,Ⅲ型黏液细胞体积较大且形状多为不规则状(图1-A~C、E~G、I~K),冬季皮肤黏液细胞中Ⅱ型黏液细胞主要以棒状为主,Ⅳ型黏液细胞以球状或不规则状为主(图1-D、H、L);在尾部,4个季节皮肤黏液细胞中Ⅱ型黏液细胞主要呈棒状分布,Ⅳ型黏液细胞多呈现不规则状(图1-M~P)。(2)在葛氏鲈塘鳢头部、背部和腹部,春夏两季皮肤黏液细胞的形态特征相似,紫红色Ⅲ型黏液细胞和蓝紫色Ⅳ型黏液细胞以圆形为主,红色Ⅰ型黏液细胞多呈点状不均匀分布(图2-A、B、E、F、I、J),秋冬两季皮肤黏液细胞中Ⅲ型黏液细胞以椭圆状居多,Ⅳ型黏液细胞主要呈圆形分布(图2-C、D、G、H、K、L);在尾部,春夏秋三季皮肤黏液细胞的形态与头部春夏季基本相同,Ⅲ型和Ⅳ型黏液细胞均呈圆形分布(图2-M~O),冬季黏液细胞中Ⅲ型和Ⅳ型黏液细胞多呈现椭圆状(图2-P)。(3)泥鳅皮肤黏液细胞内容物着色较深且夏冬两季染色要深于春秋两季,而葛氏鲈塘鳢皮肤黏液细胞内容物着色较浅。

图2 4个季节葛氏鲈塘鳢皮肤黏液细胞的显微镜观察(100×20)
Fig.2 Microscopic observation of mucous cells in skin of Chinese sleeper Perccottus glenii in four seasons (100×20)
2.2 不同季节两种鱼皮肤黏液细胞的类型分布
泥鳅和葛氏鲈塘鳢皮肤中黏液细胞的类型分布随季节变化存在显著性差异(表1,表2,P<0.05):(1)在泥鳅头、背、腹、尾4个部位,春季和夏季皮肤黏液细胞均以Ⅳ型黏液细胞数量居多,其次为Ⅱ型黏液细胞,Ⅲ型黏液细胞数量较少,几乎不含Ⅰ型黏液细胞;秋季皮肤中分布有大量的Ⅱ型黏液细胞,其次为Ⅲ型、Ⅳ型黏液细胞,Ⅰ型黏液细胞几乎无分布;冬季黏液细胞同样以Ⅱ型黏液细胞为主,其次为Ⅳ型黏液细胞,Ⅰ型和Ⅲ型黏液细胞分布极少。(2)在葛氏鲈塘鳢头、背、腹、尾4个部位,春季、夏季和秋季皮肤黏液细胞中主要分布的是Ⅲ型黏液细胞,其次为Ⅳ型黏液细胞,Ⅰ型和Ⅱ型黏液细胞数量很少;冬季皮肤中也以Ⅲ型黏液细胞为主,依次分布的Ⅰ型、Ⅳ型黏液细胞数量基本相同,Ⅱ型黏液细胞几乎无分布。
表2 不同季节葛氏鲈塘鳢皮肤中4种类型黏液细胞数量
Tab.2 Number of four types of mucous cells in skin of Chinese sleeper Perccottus glenii in different seasons

部位 section季节 seasonⅠ型type ⅠⅡ型type ⅡⅢ型type ⅢⅣ型 type Ⅳ春季1.9±1.4a0.1±0.3a21.9±4.7c6.0±1.6b头部 head夏季0.9±1.4a0.1±0.3a17.6±2.6c5.6±1.1b秋季0.8±1.0a0.3±0.5a9.8±1.0c4.0±0.8b冬季5.9±2.7b1.2±0.6a13.4±2.1c4.3±0.9b春季1.1±1.0a0.1±0.3a27.8±1.6c6.0±1.9b背部 back夏季1.0±1.1a0.6±1.4a16.3±1.8c6.9±1.6b秋季0.0±0.0a1.2±1.5a17.4±2.0c4.4±1.1b冬季7.8±1.4c0.9±1.0a16.8±2.0d4.6±0.8b春季0.1±0.3a0.2±0.4a18.1±6.1b3.4±0.8a腹部 abdomen夏季0.7±0.6a0.0±0.0a9.7±1.2c3.0±1.0b秋季0.4±0.9a0.0±0.0a11.6±3.8c5.0±1.6b冬季6.9±1.4c0.7±0.7a12.8±3.7d3.6±1.0b春季0.1±0.3a0.3±0.5a9.3±1.9c3.4±1.2b尾部 tail夏季1.7±2.1a0.7±1.2a8.0±2.6b3.3±1.5a秋季1.3±0.6b0.0±0.0a10.0±1.0d3.7±0.6c冬季5.8±0.9c0.2±0.4a7.9±1.4d3.1±1.0b
注:同行中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters within the same line are significant differences(P<0.05), and the means with the same letters within the same line are not significant differences(P>0.05),et sequentia
表1 不同季节泥鳅皮肤中4种类型黏液细胞数量
Tab.1 Number of four types of mucous cells in skin of loach Misgurnus anguillicaudatus in different seasons
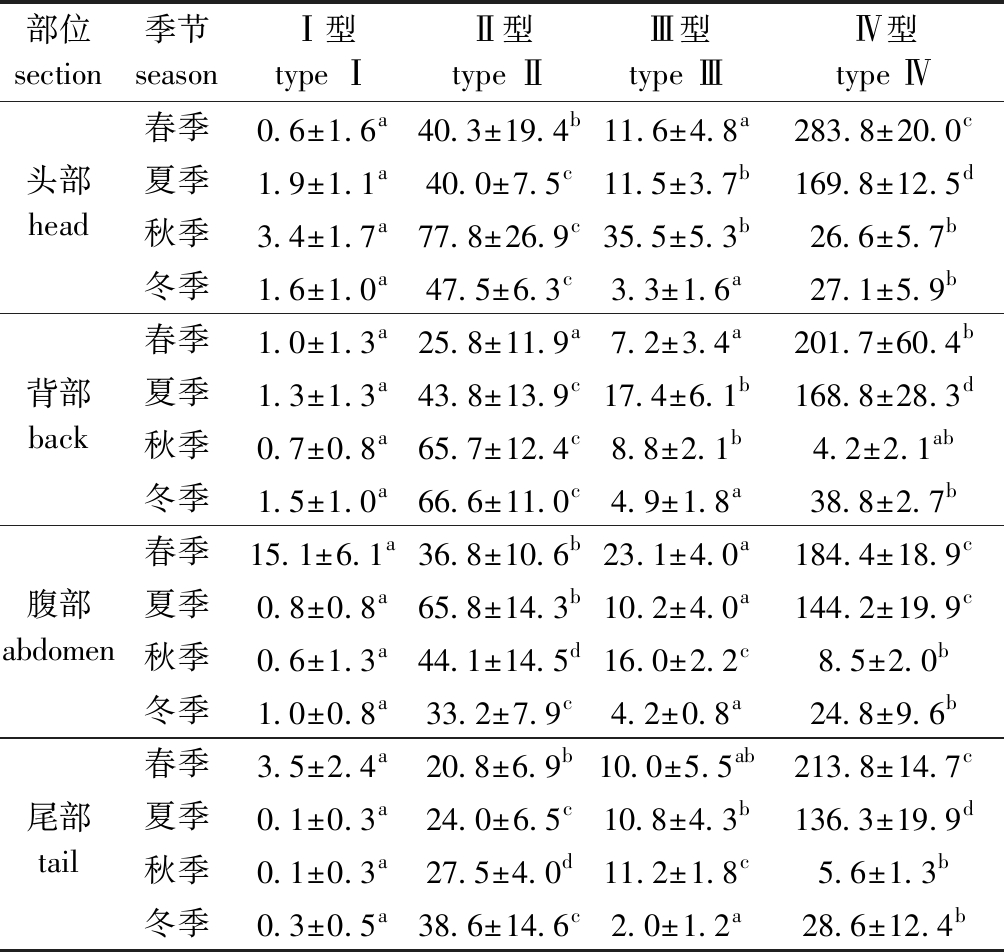
部位 section季节 seasonⅠ型type ⅠⅡ型type ⅡⅢ型type ⅢⅣ型 type Ⅳ春季0.6±1.6a40.3±19.4b11.6±4.8a283.8±20.0c头部 head夏季1.9±1.1a40.0±7.5c11.5±3.7b169.8±12.5d秋季3.4±1.7a77.8±26.9c35.5±5.3b26.6±5.7b冬季1.6±1.0a47.5±6.3c3.3±1.6a27.1±5.9b春季1.0±1.3a25.8±11.9a7.2±3.4a201.7±60.4b背部 back夏季1.3±1.3a43.8±13.9c17.4±6.1b168.8±28.3d秋季0.7±0.8a65.7±12.4c8.8±2.1b4.2±2.1ab冬季1.5±1.0a66.6±11.0c4.9±1.8a38.8±2.7b春季15.1±6.1a36.8±10.6b23.1±4.0a184.4±18.9c腹部 abdomen夏季0.8±0.8a65.8±14.3b10.2±4.0a144.2±19.9c秋季0.6±1.3a44.1±14.5d16.0±2.2c8.5±2.0b冬季1.0±0.8a33.2±7.9c4.2±0.8a24.8±9.6b春季3.5±2.4a20.8±6.9b10.0±5.5ab213.8±14.7c尾部 tail夏季0.1±0.3a24.0±6.5c10.8±4.3b136.3±19.9d秋季0.1±0.3a27.5±4.0d11.2±1.8c5.6±1.3b冬季 0.3±0.5a38.6±14.6c2.0±1.2a28.6±12.4b
2.3 不同季节两种鱼皮肤黏液细胞总数的分布
在不同季节泥鳅和葛氏鲈塘鳢4个部位的皮肤黏液细胞总数存在显著性差异(表3,P<0.05):(1)泥鳅春夏季皮肤黏液细胞总数的变化范围主要为200~350,秋冬季皮肤黏液细胞总数的变化范围主要为50~150,泥鳅头部和腹部皮肤黏液细胞总数的季节分布依次为春季>夏季>秋季>冬季,背部和尾部黏液细胞总数的季节分布依次为春季>夏季>冬季>秋季。(2)葛氏鲈塘鳢4个季节皮肤黏液细胞总数的变化范围主要在10~30,葛氏鲈塘鳢头部和背部皮肤黏液细胞总数在春季和冬季相对较多,腹部和尾部黏液细胞总数在冬季较多。(3)泥鳅皮肤黏液细胞总数远远多于葛氏鲈塘鳢;泥鳅在不同季节其皮肤黏液细胞总数不同,春季和夏季中皮肤黏液细胞总数明显多于秋季和冬季;葛氏鲈塘鳢皮肤黏液细胞在冬季分布较多。

注:箭头示黏液细胞;Ⅰ为Ⅰ型黏液细胞;Ⅱ为Ⅱ型黏液细胞;Ⅲ为Ⅲ型黏液细胞;Ⅳ为 Ⅳ型黏液细胞;AB-PAS染色,下同
Note: Arrows indicate mucous cells;Ⅰ,mucous cell Ⅰ; Ⅱ,mucous cell Ⅱ;Ⅲ,mucous cell Ⅲ;Ⅳ, mucous cell Ⅳ;AB-PAS staining,et sequentia
图1 4个季节泥鳅皮肤黏液细胞的显微镜观察(100×20)
Fig.1 Microscopic observation of mucous cells in skin of loach Misgurnus anguillicaudatus in four seasons (100×20)
表3 不同季节泥鳅和葛氏鲈塘鳢皮肤黏液细胞总数
Tab.3 Total number of mucous cells in skin of loach Misgurnus anguillicaudatus and Chinese sleeper Perccottus glenii in different seasons
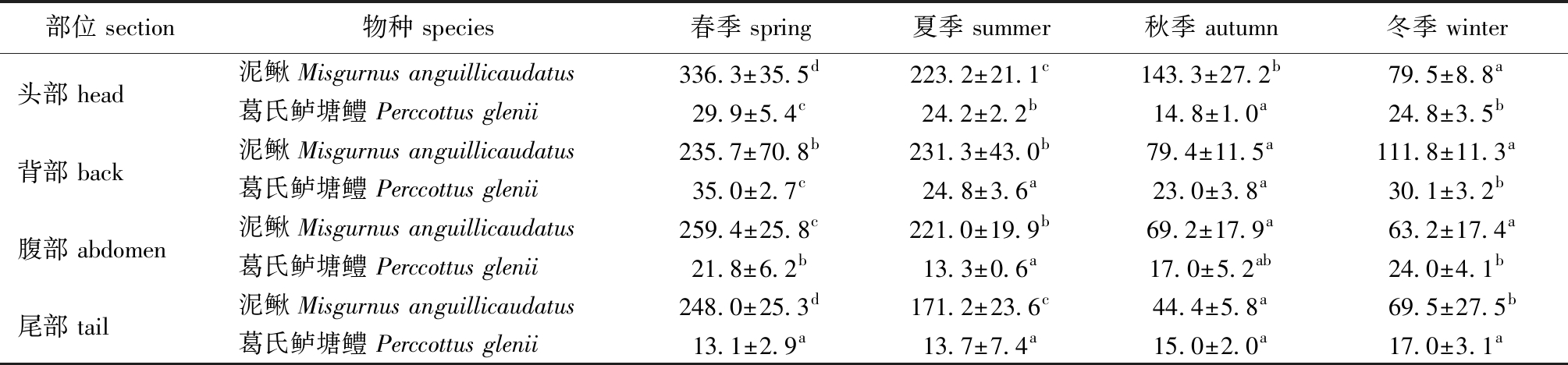
部位 section物种 species春季 spring夏季 summer秋季 autumn冬季 winter头部 head泥鳅 Misgurnus anguillicaudatus336.3±35.5d223.2±21.1c143.3±27.2b79.5±8.8a葛氏鲈塘鳢 Perccottus glenii29.9±5.4c24.2±2.2b14.8±1.0a24.8±3.5b背部 back泥鳅 Misgurnus anguillicaudatus235.7±70.8b231.3±43.0b79.4±11.5a111.8±11.3a葛氏鲈塘鳢 Perccottus glenii35.0±2.7c24.8±3.6a23.0±3.8a30.1±3.2b腹部 abdomen泥鳅 Misgurnus anguillicaudatus259.4±25.8c221.0±19.9b69.2±17.9a63.2±17.4a葛氏鲈塘鳢 Perccottus glenii21.8±6.2b13.3±0.6a17.0±5.2ab24.0±4.1b尾部 tail泥鳅 Misgurnus anguillicaudatus248.0±25.3d171.2±23.6c44.4±5.8a69.5±27.5b葛氏鲈塘鳢 Perccottus glenii13.1±2.9a13.7±7.4a15.0±2.0a17.0±3.1a
3 讨论
3.1 泥鳅和葛氏鲈塘鳢皮肤黏液细胞形态及类型的季节变化比较
本研究结果显示,泥鳅在春夏两季皮肤黏液细胞均以球状Ⅳ型黏液细胞为主,在秋冬两季均以囊状Ⅱ型黏液细胞为主;而葛氏鲈塘鳢在4个季节中均以圆形或椭圆状Ⅲ型黏液细胞为主,本试验中所采集的试验鱼均来自东北高寒地区哈尔滨,因此,其所处的春夏季环境温度明显高于秋冬季。黄智慧等[10]研究表明,水体温度的增加会导致水中病原微生物的活力增强,进而对鱼体构成威胁,但随着温度升高,鱼体皮肤表面分布的Ⅱ型和Ⅳ型黏液细胞分泌的酸性黏液成分也会随之增加,可有效防止病原菌侵入鱼体。因此,春夏两季泥鳅体表黏液细胞中Ⅳ型黏液细胞所分泌的酸性黏多糖对泥鳅皮肤起到了很好的保护作用;此外,泥鳅在秋冬两季皮肤中主要分布的是Ⅱ型黏液细胞,且其体积远远大于其他3种类型的黏液细胞,这一特征与鱼体的保护机制相适应。刘亚秋等[11]在关于消化道黏液细胞分布及发育的研究中也证实,在一定范围内黏液细胞的体积越大,其分泌黏液的能力越强,对鱼体越有利。与泥鳅不同,葛氏鲈塘鳢体表黏液细胞多以Ⅲ型混合型黏液细胞为主,有资料显示,牙鲆在最适生活温度(21 ℃)下,其皮肤黏液抗体应答强度才能达到最大[12],说明环境温度过低会对皮肤黏液抗体的产生起到一定的消极作用,进而影响皮肤黏液细胞的类型分布,而葛氏鲈塘鳢是中国高寒地区的特色鱼类,其所生活的环境多处于低温状态[13],刘德明等[14]研究中也有相关报道,在鱼类体表存在一个临界温度,当低于这一临界温度时,黏液黏度随温度变化不明显,这对于皮肤黏液细胞类型的分布也会产生一定的影响。
此外,本试验结果还表明,泥鳅皮肤黏液细胞中含有较多的酸性黏多糖,而葛氏鲈塘鳢皮肤黏液细胞中含有较多的中性黏多糖,这与陈楚等[15]的研究结果一致。泥鳅属于鳞片退化鱼类,其体表直接暴露于水环境中,因而容易受到水体中各种微生物的侵袭。张婷等[16]对鱼类体表黏液分泌机制的研究表明,体表黏液中所含有的酸性物质可以杀死鱼类皮肤表面的寄生物,从而起到保护机体的作用;国外也有研究发现,黏液细胞分泌的酸性黏多糖在免疫刺激中发挥着重要作用[17];AB染色呈阳性的黏膜细胞比PAS染色呈阳性的黏膜细胞多,可能有利于保护黏膜免受微生物侵袭[18]。因此,泥鳅皮肤黏液细胞中含有的酸性黏多糖在抵抗外物侵袭的过程中发挥着不可替代的作用。而葛氏鲈塘鳢属于有鳞鱼类,其体表覆盖鳞片,水体病原菌对其并不能构成过多威胁,因而其皮肤黏液细胞含有较多的中性黏多糖,中性黏多糖主要具有黏着食物、促进食物乳化等功能[19]。
3.2 泥鳅和葛氏鲈塘鳢皮肤黏液细胞总数的季节变化比较
泥鳅和葛氏鲈塘鳢不同季节黏液细胞总数的比较结果显示,泥鳅春夏两季皮肤中含有大量的黏液细胞,且黏液细胞总数远远超过秋冬两季;而葛氏鲈塘鳢皮肤黏液细胞在冬季分布较多。在一定范围内环境温度越高,水中病原微生物的数量也会相应增加,黏液细胞的数量会受到细菌感染的影响,在不利环境条件下鱼类黏液分泌的增加是鱼体内存在的一种非特异性机制[20],因此,泥鳅在春夏两季中黏液细胞数量远多于秋冬两季,吴红松[19]通过研究也证明,在不利环境的刺激之下,鱼类机体会试图利用黏液的抗菌作用以提高其对不利环境的免疫力;秋冬两季泥鳅皮肤黏液细胞数量较少,还可能与泥鳅在低温环境中食物获取量的减少有关,在对鲑鱼的研究显示,食物不足会引起鱼体表皮黏液细胞的密度迅速下降[21]。与泥鳅不同,葛氏鲈塘鳢皮肤黏液细胞在冬季时分布相对较多,这可能与其在冬季时的生活习性及黏液的生理作用有关,曲丽华等[22]对葛氏鲈塘鳢生活习性的研究发现,葛氏鲈塘鳢是潜伏在水底泥土或水草丛生的泡沼里进行冬眠,故其冬眠时身体周围存在大量的耐低温细菌和异物。陈超然[23]研究表明,黏液中有多种溶菌活性物质存在,能够抵御异物和病原体的侵袭,在机体防御中起着主要作用,这能够很好地解释冬季葛氏鲈塘鳢皮肤黏液细胞数量较多的现象。
此外,本试验结果还表明,泥鳅皮肤黏液细胞总数远远多于葛氏鲈塘鳢皮肤黏液细胞总数,这可能与鱼体鳞片的发达程度有关,鳞片不发达的鱼类其黏液分泌量相对较大[24]。泥鳅身体上的鳞片细小,埋于皮下,鳞片大多退化[1],而葛氏鲈塘鳢身体上的鳞片中等大小,头和鳃盖均有鳞片的分布[2],因此,鳞片退化鱼类泥鳅皮肤分布的黏液细胞总数要多于鳞片正常鱼类葛氏鲈塘鳢,这与无鳞鱼鲇及欧洲鳗鲡皮肤中含有大量的黏液细胞是相一致的[25-26]。杨淞等[27]在对无鳞鱼似鲇高原鳅的研究中报道,底栖鱼类长期生活在泥沙较多的水体底部,其体表分泌的大量黏液能够使鱼体保持清洁及润滑,对于鱼类体表而言十分重要,而泥鳅和葛氏鲈塘鳢同为底栖型鱼类,其体表均会受到泥沙中异物的侵害,但由于葛氏鲈塘鳢皮肤表面有鳞片作为保护屏障,因而相比于泥鳅,葛氏鲈塘鳢皮肤黏液细胞总数较少。
[1] 王祥.泥鳅体表黏液的流变行为及黏液糖蛋白的功能与超分子结构研究[D].杭州:浙江大学,2015.
[2] 王吉,骆剑,张本.匀斑裸胸鳝消化道粘液细胞的类型与分布[J].现代渔业信息,2010,25(5):14-17.
[3] 张慧忠.北方地产泥鳅养殖技术要点[J].黑龙江水产,2018(3):23-25.
[4] 杨培民,胡宗云,金广海,等.葛氏鲈塘鳢生物学特性与养殖前景展望[J].河北渔业,2008(1):26-27.
[5] 王自蕊,周秋白,张锦华,等.泥鳅营养需求研究进展[J].动物营养学报,2019,31(6):2451-2457.
[6] 李畅,陈紫琪,卢荆澳,等.野生葛氏鲈塘鳢营养成分及能量密度的季节变化[J].安徽农业科学,2017,45(8):117-118.
[7] 刘亚秋,李新辉,王志坚.大鳞副泥鳅肠道黏液细胞及消化酶活性分布特征研究[J].水生生物学报,2017,41(5):1048-1053.
[8] Bosi G,Giari L,DePasquale J A,et al.Protective responses of intestinal mucous cells in a range of fish-helminth systems[J].Journal of Fish Diseases,2017,40(8):1001-1014.
[9] 尹苗,安利国,杨桂文,等.鲤鱼粘液细胞类型的研究[J].动物学杂志,2000,35(1):8-9.
[10] 黄智慧,马爱军.大菱鲆体表粘液细胞组化研究及高温胁迫对其类型和分布的影响[J].水产学报,2010,34(5):719-725.
[11] 刘亚秋,李芳,赵健蓉,等.大鳞副泥鳅仔稚鱼消化道黏液细胞分布及发育[J].动物学杂志,2016,51(4):623-632.
[12] 许国晶,绳秀珍,战文斌.温度对牙鲆皮肤黏液抗体产生的影响[J].中国水产科学,2011,18(6):1377-1383.
[13] 李紫桥,杨荐,李婧,等.温度对葛氏鲈塘鳢摄食和生长的影响[J].安徽农业科学,2014,42(15):4662-4663.
[14] 刘德明,陶鑫峰,王一飞,等.泥鳅体表黏液的流变行为[J].高分子学报,2010(4):468-473.
[15] 陈楚,孙嘉,李滢钰,等.三种底栖淡水鱼类皮肤黏液细胞分布与数量比较[J].动物学杂志,2018,53(6):931-937.
[16] 张婷,史晋绒,宋柯,等.鱼类体表粘液分泌机制·组分与功能研究进展[J].安徽农业科学,2014,42(22):7445-7448,7458.
[17] Wang Y Z,Sun J F,Lv A J,et al.Histochemical distribution of four types of enzymes and mucous cells in the gastrointestinal tract of reared half-smooth tongue sole Cynoglossus semilaevis[J].Journal of Fish Biology,2018,92(1):3-16.
[18] Amiry A F,Kigata T,Shibata H.Wall thickness and mucous cell distribution in the rabbit large intestine[J].Journal of Veterinary Medical Science,2019,81(7):990-999.
[19] 吴红松.三聚氰胺对鲤鱼鳃、消化道粘液细胞分布与类型的影响[J].毒理学杂志,2016,30(6):451-454.
[20] Vatsos I N,Kotzamanis Y,Henry M,et al.Monitoring stress in fish by applying image analysis to their skin mucous cells[J].European Journal of Histochemistry,2010,54(2):e22.
[21] Landeira-Dabarca A, lvarez M,Molist P.Food deprivation causes rapid changes in the abundance and glucidic composition of the cutaneous mucous cells of Atlantic salmon Salmo salar L.[J].Journal of Fish Diseases,2014,37(10):899-909.
lvarez M,Molist P.Food deprivation causes rapid changes in the abundance and glucidic composition of the cutaneous mucous cells of Atlantic salmon Salmo salar L.[J].Journal of Fish Diseases,2014,37(10):899-909.
[22] 曲丽华,管红梅,巩丽娟.北方地区养殖葛氏鲈塘鳢前景展望[J].黑龙江水产,2018(3):12-14.
[23] 陈超然.鱼类体表的防御反应[J].北京水产,2000(5):12-13.
[24] Harris J E,Hunt S.The fine structure of the epidermis of two species of salmonid fish,the Atlantic salmon (Salmo solar L.) and the brown trout (Salmo trutta L.).I.General organization and filament-containing cells[J].Cell and Tissue Research,1975,157(4):553-565.
[25] 李学军,彭新亮,乔志刚.鲇皮肤和鳃粘液细胞的分类、分布和分泌研究[J].上海海洋大学学报,2010,19(6):751-755.
[26] 林旋,张伟妮,林树根,等.欧洲鳗鲡皮肤、鳃及消化道粘液细胞的分布与类型[J].福建农业学报,2008,23(1):39-43.
[27] 杨淞,李冬梅,赵柳兰,等.似鲇高原鳅皮肤与鳍的组织学观察[J].动物学杂志,2017,52(5):842-849.