近年来,刺参Apostichopus japonicus因营养价值较高,深受消费者喜爱,刺参产业得以快速发展,2017年中国刺参主产区辽宁、山东两省海参养殖规模分别占全国的43.11%和51.88%[1]。然而,池塘养殖中大型藻类暴发性增殖问题日益突出,使水体缺氧、底质腐败、氨氮及有害物质浓度升高,危害刺参的生长与存活,制约了刺参养殖业的健康发展。
目前,生物防治作为一种新型、高效、无污染的防治手段,越来越受到人们的重视,相关研究中,利用混养的生物防治手段治理刺参池塘大型藻类暴发性增殖的研究已有报道。如李朝政等[2]通过小球藻Chlorella vulgaris、孔石莼Ulva pertusa与刺参混养试验表明,适宜浓度小球藻可有效控制孔石莼增长;胡伦超[3]提出通过将褐蓝子鱼Siganus fuscescens或虾夷马粪海胆Strongylocentrotus intermedius与刺参混养的方法,抑制刺参池塘内的藻类暴发。然而,小球藻适宜温度范围仅为10~33 ℃[4],在水温低于12 ℃时会造成褐蓝子鱼死亡[5],虾夷马粪海胆在高于25 ℃时也会大量死亡[6]。大连地区刺参池塘全年水温为-3~27.9 ℃[7],故上述方法的全年应用均受限。马粪海胆Hemicentrotus pulcherrimus与刺参同属棘皮动物门,耐温范围广,在0~30 ℃时均能存活,并以多种大型藻类为食[8],因此,如果将其投放入刺参池塘中,可摄食控制大型藻类的数量,同时产生的碎屑及粪便沉积到底泥中,增加了养殖池塘的饵料来源。目前,关于马粪海胆能否用于刺参池塘防治大型藻类生物的相关研究尚未见报道。
本课题组已有研究发现,北方刺参池塘春季滋生的藻类主要为黏膜藻Leathesia difformis与孔石莼[9],为此,本研究中分别以这两种优势大型藻类为饵料,探究了不同藻类、马粪海胆与刺参混养比例对刺参与马粪海胆生长及刺参肠道酶活性的影响,旨在为构建刺参与马粪海胆生态养殖新模式及防控刺参池塘大型藻类暴发性增殖提供数据支持。
1 材料与方法
1.1 材料
试验用马粪海胆与刺参分别购于威海长青海洋科技股份有限公司和蓬莱安源水产有限公司,分别于硬质白色塑料水箱(30 cm×40 cm×50 cm)中暂养3 d后,选取健康、规格相近的马粪海胆(体质量0.38 g±0.15 g)和刺参(体质量1.24 g±0.17 g)进行试验。
试验用黏膜藻和孔石莼均采自蓬莱海益公司刺参池塘,对照组投喂安源水产有限公司生产的蓬安源幼参配合颗粒饲料。试验在烟台海益有限公司幼参育苗车间进行。
1.2 方法
1.2.1 试验条件 试验时间为2018年4月14日—5月24日,养殖试验共进行40 d。试验期间,水温为9.5~16.5 ℃,盐度为31,pH为7.8,溶解氧(DO)含量为8.06~9.01 mg/L,弱光,每日16:00投饵,每天换水一次,约为总水量的1/3。
1.2.2 试验设计 试验共设11组,其中藻类试验组分别投喂黏膜藻(H组)和孔石莼(L组)各20 g。各组刺参初始总质量均为20 g,按照胆参质量比例为3∶1、2∶1、1∶1、1∶2、1∶3投放马粪海胆,即每种藻类试验组海胆总质量分别为60.0、40.0、20.0、10.0、6.7 g,依次对应记为H1~H5组和L1~L5组;对照组仅养殖20 g刺参,投喂蓬安源幼参配合颗粒饲料20 g(D组),不投喂上述两种藻类。各比例混养组及对照组均设3个平行。
1.2.3 刺参、马粪海胆生长指标的测定与计算 每10 d测量一次刺参和马粪海胆的体质量,并记录存活个数。刺参、马粪海胆的特定生长率(SGR,%/d)、增重率(WGR,%)和存活率(SR,%)计算公式分别为
SGR=(lnWt-lnW0)/t×100%,
WGR=(Wt-W0)/W0×100%,
SR=Nt/N0×100%。
其中:Wt为第t天时刺参或马粪海胆的体质量(g);W0为初始体质量(g);t为试验时间(d);Nt为第t天时刺参或马粪海胆的存活数(ind.);N0为初始存活数(ind.)。
1.2.4 刺参、马粪海胆体成分测定 各组刺参去其肠道取体壁组织进行水分、灰分、粗脂肪及蛋白质测定,马粪海胆直接烘干研磨成粉状后进行上述指标测定。采用直接干燥法、马弗炉灰化法、索氏抽提法和FOSS全自动凯氏定氮仪(KJELTEC 8400)分别测定刺参体壁或马粪海胆的水分、灰分、粗脂肪和蛋白质含量。
1.2.5 刺参肠道消化酶活性测定 养殖试验结束后,解剖刺参取其肠道,清除肠道内容物、灭菌水冲洗两遍后,置于液氮中暂存。测定时,称取肠道组织置于玻璃匀浆器中,加入9倍体积的生理盐水,在冰水浴条件下匀浆5 min后,在4 ℃下以6000 r/min离心10 min,取上清液分装到1.5 mL离心管中冷冻待测。采用建成(南京)生物工程研究所生产的试剂盒测定其胰蛋白酶(TRY)、淀粉酶(AMS)和脂肪酶(LPS)含量。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 22.0软件进行单因素方差分析(One-way ANOVA)和组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 刺参、海胆的生长性能
2.1.1 不同藻类及混养比例对刺参生长的影响 从表1可见:不同藻类及胆参混养比例对刺参增重率和特定生长率有显著性影响(P<0.05);投喂黏膜藻的H4、H5组刺参呈负增长,其他黏膜藻组增重率和特定生长率随胆参混养比例减小而降低,其中,H1组刺参的增重率和特定生长率较高,且显著高于其他黏膜藻组(P<0.05),但各黏膜藻组均显著低于对照组(D)(P<0.05)。投喂孔石莼的各组刺参增重率和特定生长率随混养比例减小呈先上升后下降趋势,其中,L2组增重率及特定生长率最高,且与L1组、对照组无显著性差异(P>0.05),但显著高于L3~L5组(P<0.05);投喂黏膜藻的各组刺参存活率无显著性差异(P>0.05),而投喂孔石莼的L1组存活率显著低于L2、L3、L5组(P<0.05)。相同胆参混养比例下,L组刺参的增重率、特定生长率均高于H组。
表1 不同藻类、混养比例对刺参生长性能的影响
Tab.1 Effects of different macroalgae and polyculture ratio on growth performance of sea cucumber Apostichopus japonicus
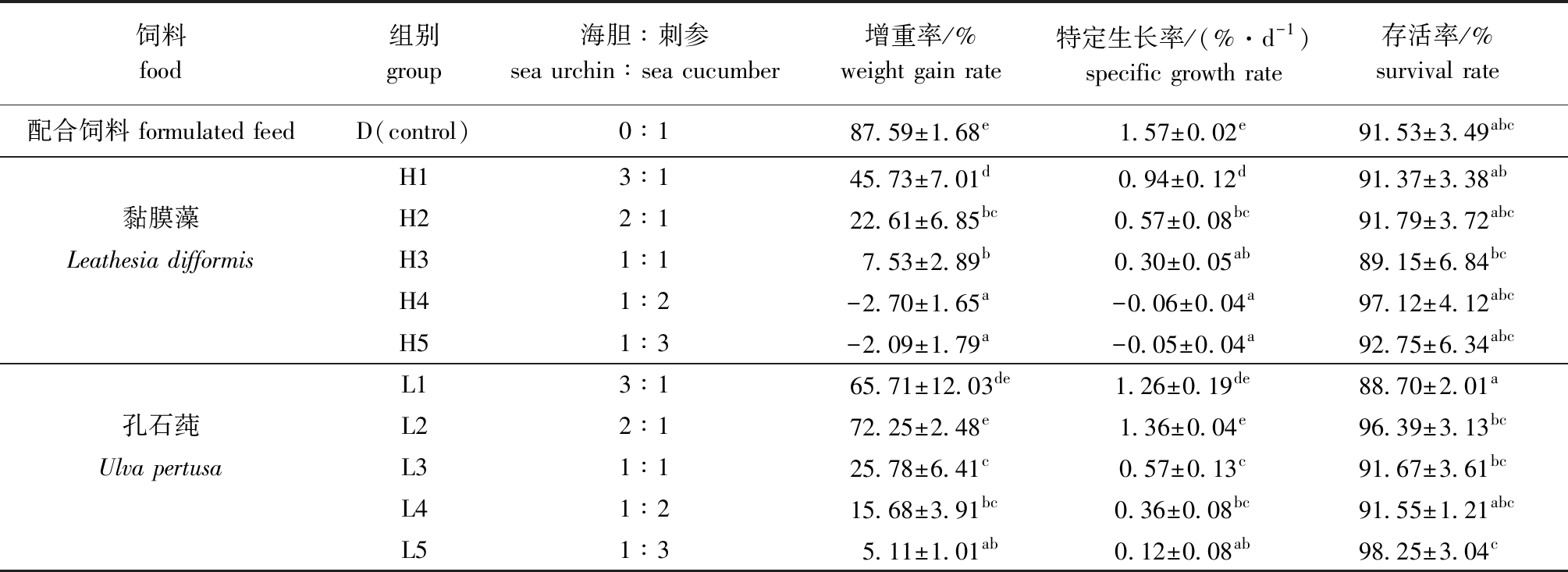
饲料 food组别 group海胆∶刺参 sea urchin∶sea cucumber增重率/% weight gain rate特定生长率/(%·d-1) specific growth rate存活率/% survival rate配合饲料 formulated feedD(control)0∶187.59±1.68e1.57±0.02e91.53±3.49abcH13∶145.73±7.01d0.94±0.12d91.37±3.38ab黏膜藻H22∶122.61±6.85bc0.57±0.08bc91.79±3.72abcLeathesia difformisH31∶17.53±2.89b0.30±0.05ab89.15±6.84bcH41∶2-2.70±1.65a-0.06±0.04a97.12±4.12abcH51∶3-2.09±1.79a-0.05±0.04a92.75±6.34abcL13∶165.71±12.03de1.26±0.19de88.70±2.01a孔石莼L22∶172.25±2.48e1.36±0.04e96.39±3.13bcUlva pertusaL31∶125.78±6.41c0.57±0.13c91.67±3.61bcL41∶215.68±3.91bc0.36±0.08bc91.55±1.21abcL51∶35.11±1.01ab0.12±0.08ab98.25±3.04c
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.1.2 不同藻类及混养比例对海胆生长的影响 从表2可见:不同藻类及混养比例对海胆的特定生长率及增重率有显著性影响(P<0.05);投喂两种藻类的各试验组海胆特定生长率及增重率均随胆参混养比例的减小而递增,其中,L5组海胆特定生长率最高,为3.41%/d,显著高于其他各组(P<0.05),H1组海胆特定生长率最小,为1.29%/d;L1、L2和L5组特定生长率显著高于同比例的H组(P<0.05);H组存活率为94.02%~97.99%,L组为94.75%~98.33%,不同藻类和混养比例对马粪海胆的存活率无显著性影响(P>0.05)。相同胆参混养比例下,L组海胆的增重率和特定生长率均高于H组。
表2 不同藻类、混养比例对马粪海胆生长性能的影响
Tab.2 Effects of different macroalgae and polyculture ratio on growth performance of sea urchin Hemicentrotus pulcherrimus
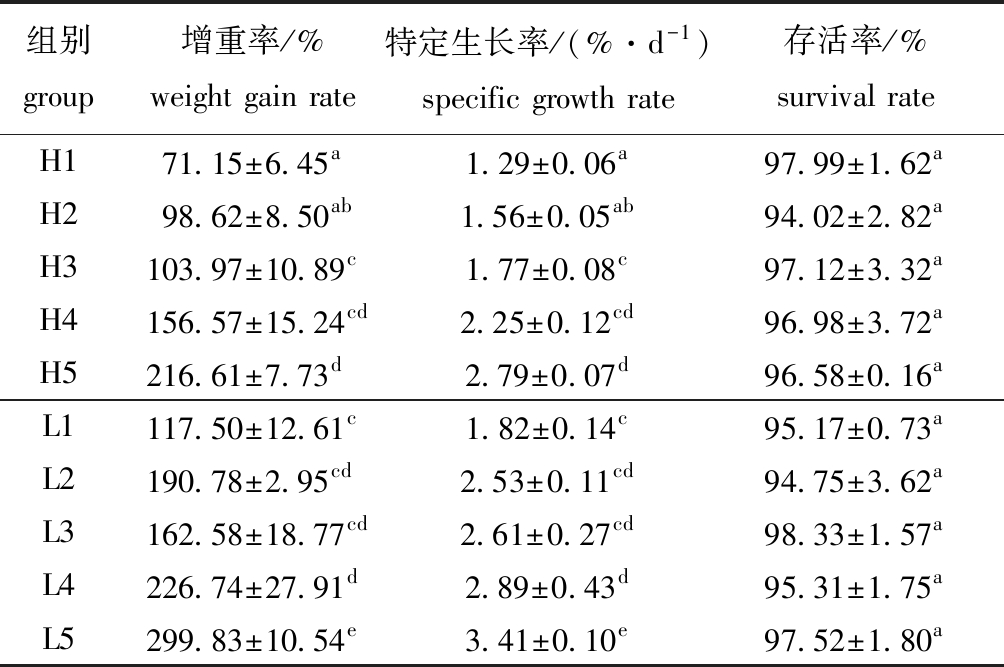
组别 group增重率/%weight gain rate特定生长率/(%·d-1)specific growth rate存活率/% survival rateH171.15±6.45a1.29±0.06a97.99±1.62aH298.62±8.50ab1.56±0.05ab94.02±2.82aH3103.97±10.89c1.77±0.08c97.12±3.32aH4156.57±15.24cd2.25±0.12cd96.98±3.72aH5216.61±7.73d2.79±0.07d96.58±0.16aL1117.50±12.61c1.82±0.14c95.17±0.73aL2190.78±2.95cd2.53±0.11cd94.75±3.62aL3162.58±18.77cd2.61±0.27cd98.33±1.57aL4226.74±27.91d2.89±0.43d95.31±1.75aL5299.83±10.54e3.41±0.10e97.52±1.80a
2.2 刺参体壁与马粪海胆体营养成分组成
2.2.1 刺参体壁营养组成 从表3可见:投喂黏膜藻时,不同胆参混养比例对刺参体壁水分、粗脂肪和灰分含量无显著性影响(P>0.05),H1、H2组粗蛋白质含量显著低于H3~H5组(P<0.05),H4组粗蛋白质含量最高;投喂孔石莼时,不同胆参混养比例对刺参体壁水分、粗脂肪含量无显著性影响(P>0.05),粗蛋白质含量随胆参混养比例的减小呈先增加后降低的趋势, 其中,L3组最高,且显著高于其他孔石莼组(P<0.05),但L3组灰分含量最低,且显著低于L1、L4、L5组(P<0.05)。
表3 不同藻类、混养比例对刺参体壁营养组成的影响
Tab.3 Effects of different macroalgae and polyculture ratio on approximate composition of body wall of sea cucumber Apostichopus japonicusw/%
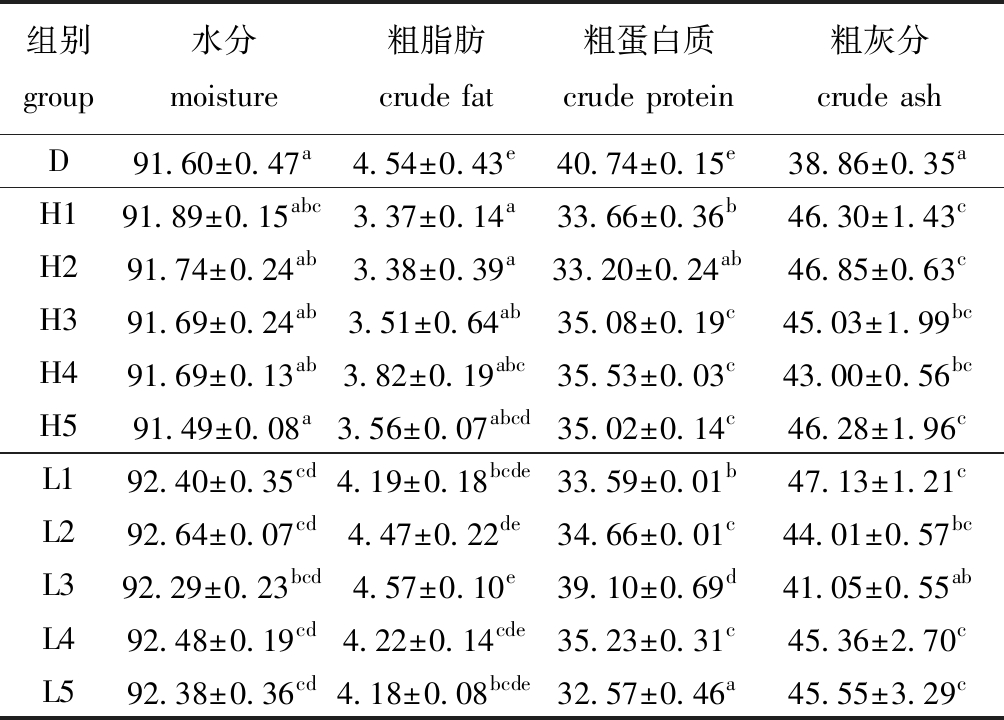
组别 group水分moisture粗脂肪crude fat粗蛋白质crude protein粗灰分crude ashD91.60±0.47a4.54±0.43e40.74±0.15e38.86±0.35aH191.89±0.15abc3.37±0.14a33.66±0.36b46.30±1.43cH291.74±0.24ab3.38±0.39a33.20±0.24ab46.85±0.63cH391.69±0.24ab3.51±0.64ab35.08±0.19c45.03±1.99bcH491.69±0.13ab3.82±0.19abc35.53±0.03c43.00±0.56bcH591.49±0.08a3.56±0.07abcd35.02±0.14c46.28±1.96cL192.40±0.35cd4.19±0.18bcde33.59±0.01b47.13±1.21cL292.64±0.07cd4.47±0.22de34.66±0.01c44.01±0.57bcL392.29±0.23bcd4.57±0.10e39.10±0.69d41.05±0.55abL492.48±0.19cd4.22±0.14cde35.23±0.31c45.36±2.70cL592.38±0.36cd4.18±0.08bcde32.57±0.46a45.55±3.29c
相同胆参混养比例下,H组中H1、H3组水分含量与同比例的L组无显著性差异(P>0.05),其他比例下H组均显著低于L组(P<0.05);H组中H4、H5组粗脂肪含量与同比例L组无显著性差异(P>0.05),其他比例下H组均显著低于L组(P<0.05);与对照组粗脂肪含量相比,H组均显著偏低(P<0.05),L组则无显著性差异(P>0.05);H1、H4组粗蛋白质含量与同比例L组无显著性差异(P>0.05),而H5组显著高于L5组(P<0.05),H2、H3组则显著低于L组(P<0.05),H组与L组粗蛋白质含量均显著低于对照组(P<0.05);同比例下H组粗灰分含量与L组无显著性差异(P>0.05),但两组均显著高于对照组(除L3组外)(P<0.05)。
2.2.2 海胆营养组成 从表4可见:投喂黏膜藻时,胆参混养比例对马粪海胆粗脂肪、灰分含量无显著性影响(P>0.05);H1、H2组马粪海胆水分含量显著低于H3~H5组(P<0.05);H5组马粪海胆粗蛋白质含量最低且显著低于其他各组(P<0.05)。投喂孔石莼时,胆参混养比例对马粪海胆粗脂肪含量无显著性影响(P>0.05);L1组水分含量最高且显著高于L4、L5组(P<0.05);L1、L2、L3组粗蛋白质含量显著高于L4和L5组(P<0.05);L1组灰分含量最低且显著低于L2~L5组(P<0.05)。相同胆参混养比例下,H3~H5水分含量显著高于同比例L组(P<0.05),同比例下H组的粗脂肪和粗蛋白质含量显著低于L组(P<0.05),而灰分含量则显著高于L组(P<0.05)。
表4 不同藻类、混养比例对马粪海胆营养组成的影响
Tab.4 Effects of different macroalgae and polyculture ratio on the approximate composition of sea urchin Hemicentrotus pulcherrimusw/%
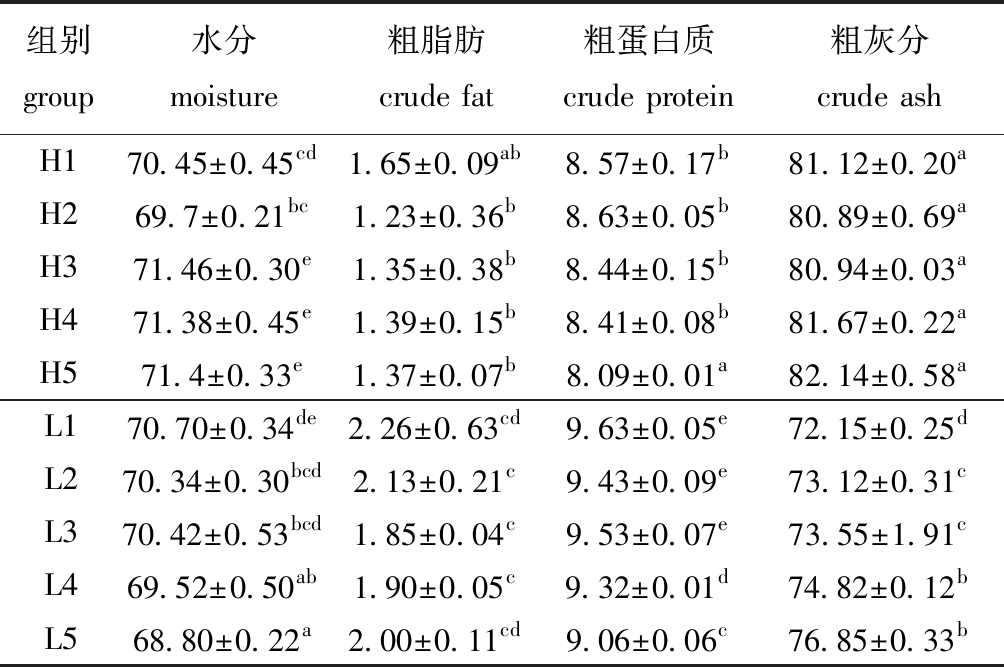
组别 group水分moisture粗脂肪crude fat粗蛋白质crude protein粗灰分crude ashH170.45±0.45cd1.65±0.09ab8.57±0.17b81.12±0.20aH269.7±0.21bc1.23±0.36b8.63±0.05b80.89±0.69aH371.46±0.30e1.35±0.38b8.44±0.15b80.94±0.03aH471.38±0.45e1.39±0.15b8.41±0.08b81.67±0.22aH571.4±0.33e1.37±0.07b8.09±0.01a82.14±0.58aL170.70±0.34de2.26±0.63cd9.63±0.05e72.15±0.25dL270.34±0.30bcd2.13±0.21c9.43±0.09e73.12±0.31cL370.42±0.53bcd1.85±0.04c9.53±0.07e73.55±1.91cL469.52±0.50ab1.90±0.05c9.32±0.01d74.82±0.12bL568.80±0.22a2.00±0.11cd9.06±0.06c76.85±0.33b
2.3 刺参肠道酶活性的变化
2.3.1 胰蛋白酶 从图1-A可见:各试验组胰蛋白酶(TRY)活性随胆参混养比例降低而下降;H组中H1组的TRY活性最高,为(531.38±26.42)U/mg prot,且显著高于其他各组(P<0.05),其他各组间无显著性差异(P>0.05);L组中L1组TRY活性最大,为(670.51±14.91)U/mg prot,与L2组无显著性差异(P>0.05),但二者均显著高于L3~L5组(P<0.05);各藻类试验组TRY活性均显著低于对照组(P<0.05)。相同混养比例下,H组TRY活性均显著低于L组(P<0.05)。
2.3.2 淀粉酶 从图1-B可见:与胰蛋白酶活性类似,试验组刺参肠道淀粉酶活性(AMS)也随胆参混养比例降低而下降;H组中H1组的AMS活性最高,为(1.81±0.07)U/mg prot,且显著高于其他各组(P<0.05),其他各组间无显著性差异(P>0.05);L组中L1 组AMS活性最大,为(2.28±0.11)U/mg prot,且与L2组无显著性差异(P>0.05),但二者均显著高于L3、L4和L5组(P<0.05);各藻类试验组AMS活性均显著低于对照组(P<0.05)。相同混养比例下,H组AMS活性显著低于L组(P<0.05),仅H5组与L5组间无显著性差异(P>0.05)。
2.3.3 脂肪酶 从图1-C可见:H组与L组中均在胆参混养比例为3∶1时脂肪酶(LPS)活性最高,且显著高于其他各组(P<0.05),2∶1混养比例组显著高于1∶1、1∶2和 1∶3混养比例组(P<0.05);除3∶1混养比例组外,其他藻类试验组LPS活性均显著低于对照组(P<0.05)。相同混养比例下,H组LPS活性与L组无显著性差异(P>0.05)。
3 讨论
3.1 投喂不同藻类对刺参生长的影响
本研究中利用马粪海胆与刺参的食性差异,在池塘系统中进行生态混养,探索了生物防治池塘大型藻类暴发性增殖的方法。有研究表明,马粪海胆对藻类的摄食能力强,可利用其摄食控制大型藻类数量,藻类碎屑及粪便又可为刺参提供食物[10-11]。曾晓起等[12]、尤凯等[8]研究了不同藻类对马粪海胆的影响,均发现相对于海带Laminaria japonica、裙带菜Undaria pinnatifida,马粪海胆对孔石莼具有更高的吸收转化能力。本研究中同样发现,投喂孔石莼时海胆的特定生长率,以及粗脂肪和粗蛋白质含量均高于投喂黏膜藻,其原因可能是两种藻类营养成分含量不同。刺参直接或间接利用藻类已有较多研究,其中,Xia等[13]、Wen等[14]、Anisuzzaman等[15]的研究表明,褐藻的促生长作用不及石莼。在本研究中,黏膜藻属于褐藻,黏膜藻组刺参的特定生长率最高为0.94%/d,同样低于孔石莼组(1.36%/d)。其原因可能是刺参褐藻酸酶活性较低,对富含褐藻酸的大型褐藻消化能力较弱[16]。
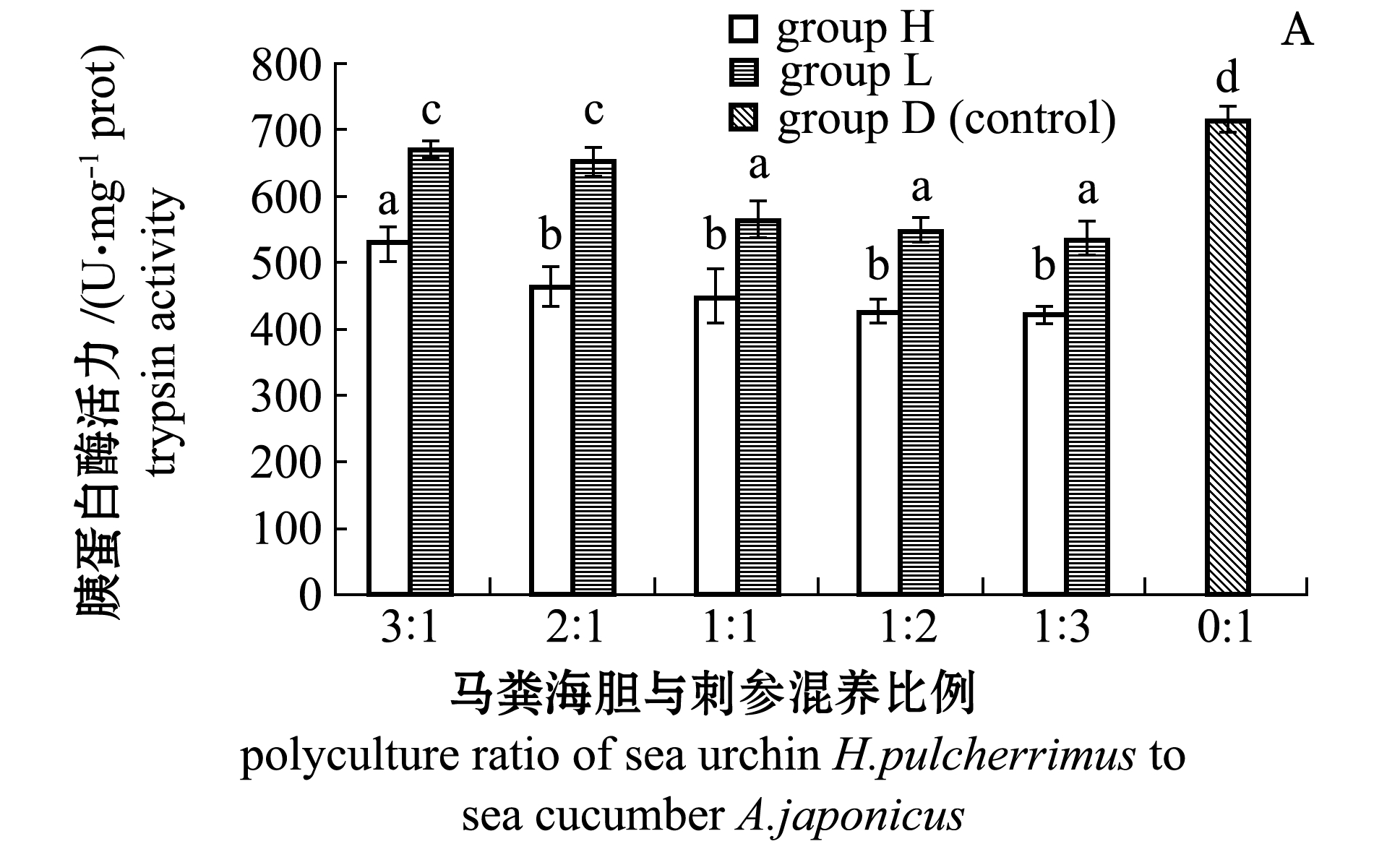
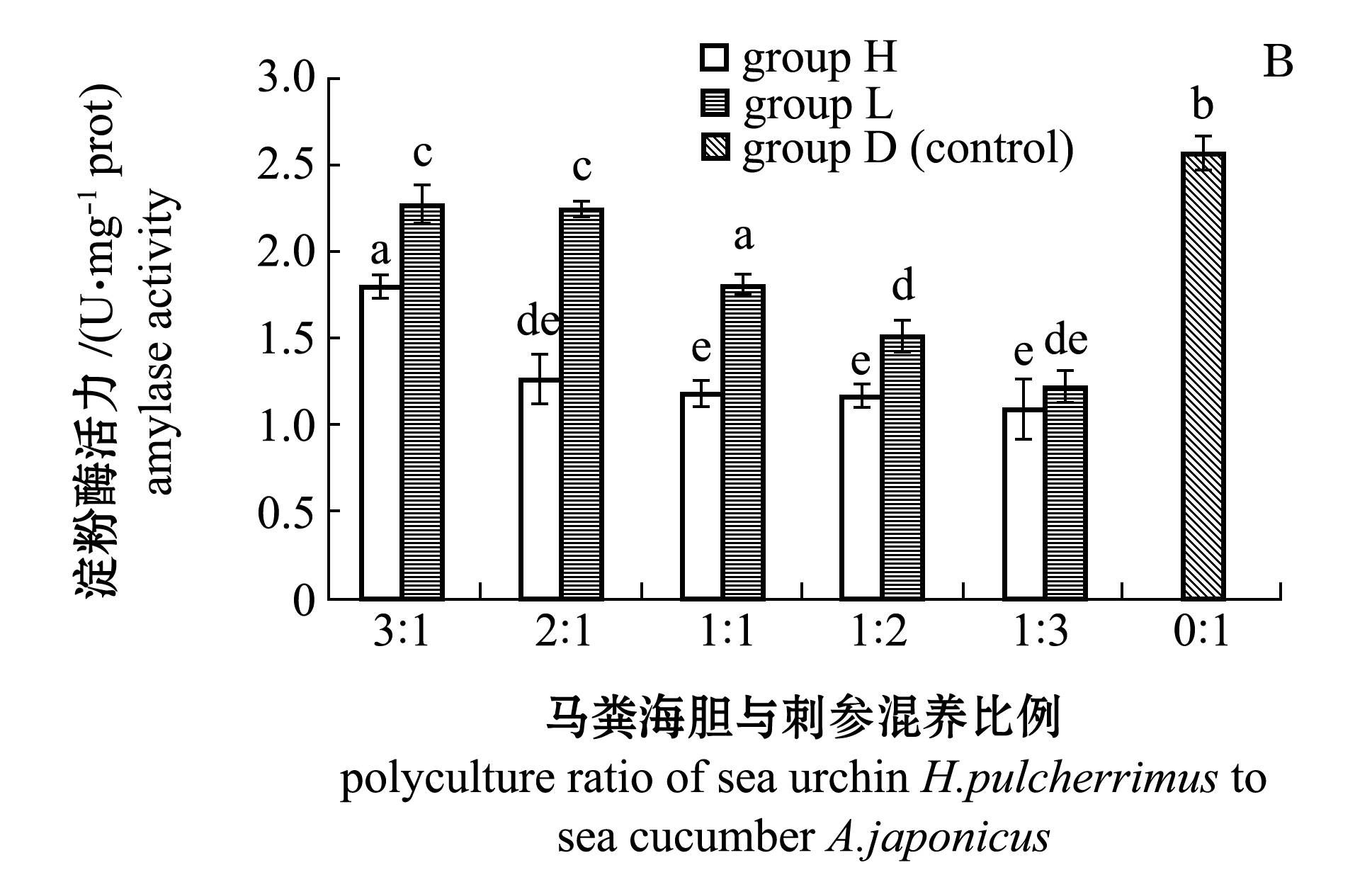
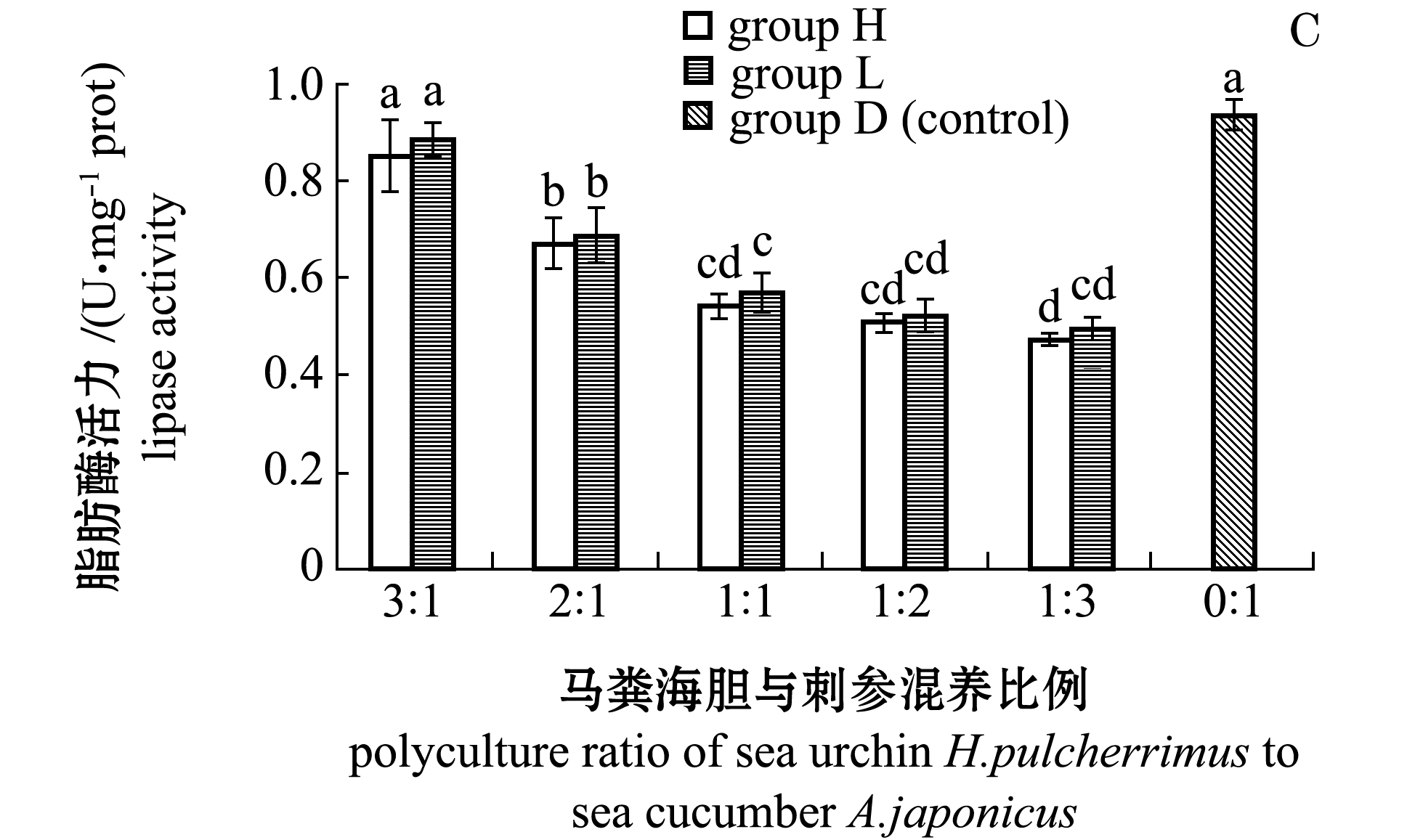
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same lette are not significant differences
图1 不同混养组刺参肠道胰蛋白酶、淀粉酶和脂肪酶活性
Fig.1 Intestinal trypsin,amylase and lipase activities of sea cucumber Apostichopus japonicus at different polyculture ratios of sea cucumber to sea urchin
3.2 不同胆参混养比例对刺参生长的影响
适宜的混养比例能够改良刺参生境,增加养殖收益,有效增强生态混养养殖效果。如对刺参与中国明对虾Fenneropenaeus chinensis[17-18]、红鳍东方鲀Takifugu rubripes[19]、皱纹盘鲍Haliotis discus hannai[20]、长牡蛎Crassostrea gigas[21]等研究中均有相关表述。而针对海胆与刺参的混养研究则集中于虾夷马粪海胆,对马粪海胆的研究尚未见报道。本研究中发现,在投喂单一池塘藻类时,马粪海胆随投喂数量增加而生长减缓,这与王吉桥等[22]的研究一致;而以刺参的生长为指标时,刺参与海胆的混养比例表现出一定的特异性,如投喂孔石莼时,刺参在试验设置比例内均可正常生长,最适比例为2∶1;而投喂黏膜藻时,胆参混养比例大于1∶2时才可满足刺参正常生长,最适比例为3∶1。王吉桥等[23]对虾夷马粪海胆和刺参及菲律宾蛤仔的混养研究中发现,投喂海带时适宜比例为11∶3,这与同为褐藻的黏膜藻组相近。有研究表明,马粪海胆密度过高或过低均会抑制刺参生长,但在刺参养成过程中,刺参的食物来源多样[24-25],以本试验中的结果作为参考,应适当调整混养比例。
3.3 不同藻类、混养比例对刺参消化酶活性的影响
刺参消化酶活性反映刺参对营养物质的利用能力,酶活性的高低对生长速度有着决定性影响[26-27]。本研究表明,投喂单一藻类时,刺参胰蛋白酶、淀粉酶和脂肪酶3种消化酶的活性均随混养比例的下降而递减,酶活性均在胆参比例为3∶1时最高,但在投喂孔石莼时,胰蛋白酶和淀粉酶活性在2∶1时同样表现出较高活性,此结果与王艺超等[28]对饱食水平影响刺参消化酶的趋势相一致,由此推测,海胆的数量越多,越可为刺参提供更多食物,从而使刺参达到饱食状态,消化酶活性相应会增加;而马粪海胆数量过少则提供食物相对较少,刺参长期处于食物匮乏的营养限制阶段,从而抑制其生理功能,降低消化酶活性[29]。在相同混养比例下,投喂孔石莼时刺参胰蛋白酶和淀粉酶活性均显著高于投喂黏膜藻,而脂肪酶活性无显著性差异,这与王晓艳等[30]得出的藻类种类的差异对胰蛋白酶影响显著但对脂肪酶影响不显著的结果一致。在刺参正常生长时,孔石莼组刺参体壁的粗蛋白质和粗脂肪含量高于黏膜藻组,这表明孔石莼与黏膜藻相比,能增加刺参体壁粗蛋白质和粗脂肪的含量,这与李旭等[31]的报道相似,均可说明藻类种类显著影响刺参胰蛋白酶、淀粉酶活性,以及对营养物质的吸收能力。但本研究中,两种藻类试验组刺参生长性能及肠道酶活性均不及投喂配合饲料的对照组,这与王晓艳等[30]发现投喂混合藻粉饲料优于单一藻粉饲料的结果相似,其原因可能是单一藻类营养不均衡。由于本研究中是针对刺参养殖进行的基础试验,马粪海胆作为食物提供者且长期处于饱食状态,不同混养比例组间缺乏可比性,因此,并未对试验组马粪海胆的消化酶进行测定和分析。
4 结论
综合不同藻类、不同胆参混养比例对刺参生长性能和消化酶活性的研究可知:(1)不同藻类及胆参混养比例均对刺参生长有着不同的影响;(2)投喂孔石莼的养殖效果优于黏膜藻;(3)当单独投喂孔石莼时,马粪海胆与刺参适宜混养比例为2∶1;(4)以黏膜藻作为食物来源时,适宜混养比例则为3∶1。在春季藻类大量增殖季节,以适宜的比例将海胆投放至刺参池塘中,既能够对刺参池塘中大型藻类起到有效的防治作用,又能降低配合饲料的使用,同时经过一段养殖时间后养成的海胆具有一定的经济价值,降低养殖成本的同时增加了养殖经济效益。该结论既为参胆生态混养的实际养成过程提供了参考,也为下一步继续探究综合食源对胆参混养的影响奠定了基础。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2018中国渔业统计年鉴[M].北京:中国农业出版社,2018.
[2] 李朝政,赵文,刘钢,等.参藻混养生态系统中孔石莼、蛋白核小球藻与刺参的相互作用研究[J].大连海洋大学学报,2016,31(6):640-645.
[3] 胡伦超.刺参养殖池塘混养新品种的相关基础研究[D].大连:大连海洋大学,2016.
[4] 吴松.小球藻工厂化人工培育技术[J].海洋与渔业,2008(8):34-35.
[5] 宁军号,秦宇博,胡伦超,等.水温骤降和缓降胁迫对褐篮子鱼血液生理生化指标的影响[J].大连海洋大学学报,2017,32(3):294-301.
[6] 常亚青,王子臣,王国江.温度和藻类饵料对虾夷马粪海胆摄食及生长的影响[J].水产学报,1999,23(1):69-76.
[7] 刘丹.三种水质控制技术下参池底质变化及参礁表面生态学特征初步研究[D].大连:大连海洋大学,2018.
[8] 尤凯,曾晓起,陈大刚,等.青岛近岸海域马粪海胆摄食的实验生态学研究[J].生态学报,2004,24(5):1006-1014.
[9] 时嘉赓,刘刚,冯艳微,等.刺参养殖池塘中几种大型藻类的形态学与分子生物学鉴定[J].齐鲁渔业,2018,35(12):1-4.
[10] Kang K H,Kwon J Y,Kim Y M.A beneficial coculture:charm abalone Haliotis discus hannai and sea cucumber Stichopus japonicus[J].Aquaculture,2003,216(1-4):87-93.
[11] Zhou Yi,Yang Hongsheng,Liu Shilin,et al.Feeding and growth on bivalve biodeposits by the deposit feeder Stichopus japonicus Selenka (Echinodermata:Holothuroidea) co-cultured in lantern nets[J].Aquaculture,2006,256(1-4):510-520.
[12] 曾晓起,尤凯,陈大刚.马粪海胆的摄食与吸收的初步研究[J].海洋科学,1997(1):3-5.
[13] Xia Sudong,Yang Hongsheng,Li Yong,et al.Effects of different seaweed diets on growth,digestibility,and ammonia-nitrogen production of the sea cucumber Apostichopus japonicus (Selenka)[J].Aquaculture,2012,338-341:304-308.
[14] Wen Bin,Gao Qinfeng,Dong Shuanglin,et al.Absorption of different macroalgae by sea cucumber Apostichopus japonicus (Selenka):evidence from analyses of fatty acid profiles[J].Aquaculture,2016,451:421-428.
[15] Anisuzzaman M,U-Cheol J,Feng Jin,et al.Effects of different algae in diet on growth and interleukin (IL)-10 production of juvenile sea cucumber Apostichopus japonicus[J].Fisheries and Aquatic Sciences,2017,20(1):24.
[16] 郭娜.不同饲料对刺参(Apostichopus japonicus)生长、消化生理和能量收支的影响[D].青岛:中国海洋大学,2011.
[17] Yu Haibo,Gao Qinfeng,Dong Shuanglin,et al.Effect of co-culture of Chinese shrimp (Fenneropenaeus chinensis) and sea cucumber (Apostichopus japonicus Selenka) on pond environment[J].Journal of Ocean University of China,2016,15(5):905-910.
[18] Zhou Shun,Ren Yichao,Pearce C M,et al.Ecological effects of co-culturing the sea cucumber Apostichopus japonicus with the Chinese white shrimp Fenneropenaeus chinensis in an earthen pond[J].Chinese Journal of Oceanology and Limnology,2017,35(1):122-131.
[19] 滕炜鸣,王庆志,周遵春,等.刺参与红鳍东方鲀的生态混养效果[J].水产学报,2017,41(3):407-414.
[20] Kim T,Yoon H S,Shin S,et al.Physical and biological evaluation of co-culture cage systems for grow-out of juvenile abalone,Haliotis discus hannai,with juvenile sea cucumber,Apostichopus japonicus (Selenka),with CFD analysis and indoor seawater tanks[J].Aquaculture,2015,447:86-101.
[21] Paltzat D L,Pearce C M,Barnes P A,et al.Growth and production of California sea cucumbers (Parastichopus californicus Stimpson) co-cultured with suspended Pacific oysters (Crassostrea gigas Thunberg)[J].Aquaculture,2008,275(1-4):124-137.
[22] 王吉桥,程鑫,杨义,等.不同密度的虾夷马粪海胆与仿刺参混养的研究[J].大连水产学院学报,2007,22(2):102-108.
[23] 王吉桥,程鑫,高志鹰,等.仿刺参与虾夷马粪海胆和菲律宾蛤仔混养效果的初步研究[J].水产学报,2008,32(5):740-748.
[24] 张宝琳,孙道元,吴耀泉.灵山岛浅海岩礁区刺参(Apostichopus japonicus)食性初步分析[J].海洋科学,1995(3):11-13.
[25] Jin Feng,Jeong U C,Choi J K,et al.Effect of fish farm fecal solid diets on the growth and energy budget of juvenile sea cucumber Apostichopus japonicus[J].Korean Journal of Fisheries and Aquatic Science,2016,49(2):168-175.
[26] Kennedy E J,Robinson S M C,Parsons G J,et al.Effect of lipid source and concentration on somatic growth of juvenile green sea urchins,Strongylocentrotus droebachiensis[J].Journal of the World Aquaculture Society,2007,38(3):335-352.
[27] Wever L A,Lysyk T J,Clapperton M J.The influence of soil moisture and temperature on the survival,aestivation,growth and development of juvenile Aporrectodea tuberculata (Eisen) (Lumbricidae)[J].Pedobiologia,2001,45(2):121-133.
[28] 王艺超,梁萌青,郑珂珂.不同投喂水平对刺参(Apostichopus japonicus Selenka)生长、消化酶及免疫相关酶活性的影响[J].渔业科学进展,2016,37(1):87-92.
[29] 郭娜,董双林,刘慧.几种饲料原料对刺参幼参生长和体成分的影响[J].渔业科学进展,2011,32(1):122-128.
[30] 王晓艳,乔洪金,黄炳山,等.5种海藻在刺参幼参饲料中的应用研究[J].渔业科学进展,2019,40(3):160-167.
[31] 李旭,章世元,陈四清,等.四种饲料原料对刺参生长、体成分及消化生理的影响[J].饲料工业,2013,34(8):36-40.