凡纳滨对虾Litopenaeus vannamei,又名南美白对虾、万氏对虾、白对虾,隶属于对虾科Penaeidae对虾属Penaeus白对虾亚属Litopenaeus,原产于中、南美洲太平洋沿岸的温暖水域,与斑节对虾、中国对虾并列为世界三大养殖虾类。据统计,2017年中国凡纳滨对虾养殖产量达167.2万t,占中国虾类总产量的48%[1],是中国水产养殖的重要经济品种之一。近几年来,随着高密度养殖及生态环境恶化,对虾疾病频繁暴发,这给越南、中国、马来西亚等诸多国家的对虾产业带来了巨大的经济损失,严重制约了对虾产业的健康发展[2-3]。
急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease, AHPND),又称“早期死亡综合征”、“偷死综合征”,一些致病性弧菌通常可引起该病的发生,这类弧菌通常携带能够编码独立蛋白PIRVP的质粒。据报道,副溶血弧菌Vibrio parahaemolyticus[4-5]、哈维氏弧菌Vibrio harveyi[6]、欧文斯弧菌Vibrio owensii[7]和坎贝氏弧菌Vibrio campbellii[8]均可引起对虾AHPND。这些致病菌所携带的致病毒素(pir toxins)均可引起肝胰腺等组织损坏,造成肝功能紊乱及消化系统障碍[9]。2014年以来,AHPND已成为天津地区水产养殖业中5种主要病害之一,已引起凡纳滨对虾大量死亡,对天津市对虾养殖业的发展造成了严重威胁[10]。
2017年6月,天津市某养殖场凡纳滨对虾出现大规模急性死亡,为分析天津地区凡纳滨对虾大规模死亡的原因,本研究团队及时采集发病对虾,对病原菌进行分离鉴定,利用人工感染试验确定分离株的致病性,并研究了病原菌对凡纳滨对虾免疫酶活力的影响,旨在为探讨副溶血弧菌的致病性及对虾AHPND的防控提供科学依据。
1 材料与方法
1.1 材料
试验用患病凡纳滨对虾取自天津市滨海新区某养殖场,体长为5~6 cm,患病对虾与AHPND临床特征相似,表现为甲壳变软、空肠空胃、肝胰腺颜色变浅。攻毒试验用健康对虾取自天津市通洋农业科技有限公司,室外池塘养殖,挑选体色正常、健康活泼、体表无损伤的凡纳滨对虾,体长为(10.65 ±1.10)cm,体质量为(12.18±3.74)g。
1.2 方法
1.2.1 病原菌分离与培养 采集具有典型症状的病虾带回实验室进行病原学检验。用75%的酒精棉球擦拭病虾体表,在无菌条件下解剖病虾,用无菌接种环蘸取肝胰腺样品,划线接种于TCBS琼脂培养基,于28 ℃恒温培养箱中培养18~24 h。挑取形态一致的优势菌进行纯化培养,菌株编号为VP0630。
1.2.2 菌株生化鉴定 利用梅里埃全自动微生物生化鉴定系统 (VITEK2-compact) 对菌株VP0630进行生理生化特性鉴定。挑取单菌落于0.85%无菌生理盐水中打散,吸取100 μL的菌液涂布于15 g/L NaCl营养琼脂培养基上,于28 ℃培养18 h。刮取菌苔于0.85%无菌生理盐水中,混合均匀制成菌悬液,并调节浓度至1.5×108 CFU/mL,将调好的菌悬液加入生化分析仪进行菌株鉴定。
1.2.3 16S rRNA基因序列测定与系统进化树的构建 用细菌DNA提取试剂盒(天根生物有限公司)提取菌株基因组DNA,并以此为模板,所用引物序列及退火温度见表1。PCR反应扩增体系及扩增程序参考张振国等[11]的方法。PCR扩增产物用10 g/L 琼脂糖凝胶电泳进行检测,阳性产物送生工生物工程(上海)股份有限公司进行序列测定。将VP0630菌株16S rRNA基因序列与GenBank数据库中已知弧菌的16S rRNA基因序列进行Blast比对分析,并利用MEGA 5.2软件采用邻位相连法(Neighbor-joining)构建系统进化树,Bootstrap重复检验1000次。
1.2.4 pir毒力基因检测 根据AP4套式PCR方法[12]进行pir毒力基因扩增,所用引物序列及退火温度见表1,PCR产物用10 g/L 琼脂糖凝胶电泳进行检测。
表1 副溶血弧菌鉴定所用引物
Tab.1 Primers used in identification of Vibrio parahaemolyticus
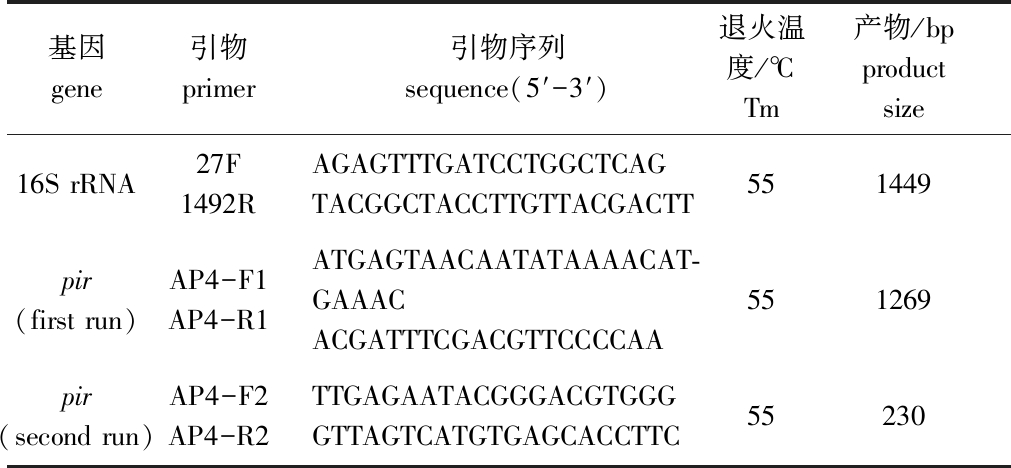
基因 gene 引物 primer 引物序列sequence(5′-3′)退火温度/℃Tm产物/bpproduct size16S rRNA27F1492RAGAGTTTGATCCTGGCTCAGTACGGCTACCTTGTTACGACTT551449pir(first run)AP4-F1AP4-R1ATGAGTAACAATATAAAACAT-GAAACACGATTTCGACGTTCCCCAA551269pir(second run)AP4-F2AP4-R2TTGAGAATACGGGACGTGGGGTTAGTCATGTGAGCACCTTC55230
1.2.5 攻毒试验 将健康凡纳滨对虾于100 L的蓝色水槽中暂养5 d,定期换水,盐度为5~6,溶氧量>5 mg/L以上,pH为8~9,氨氮浓度和亚硝酸氮浓度分别控制在0.2、0.1 mg/L以下。采用澳华公司生产的全价配合饲料作为饵料(蛋白质含量42%),每日投饵2次。试验前对凡纳滨对虾进行以下6种病原检测:参照《水生动物疾病诊断手册》对白斑综合征病毒 (WSSV)、传染性皮下及造血组织坏死病毒(IHHNV)、桃拉病毒(TSV)进行检测[13];参照相关文献对致急性肝胰腺坏死病副溶血弧菌 (VPAHPND)[12]、虾肝肠胞虫 (EHP)[14]和偷死野田村病毒(CMNV)[15]进行检测。检测结果为阴性后进行攻毒试验。
攻毒试验设对照组和感染组,每组设3个平行,每个平行30尾虾。每组的两个平行用于观察对虾死亡情况,一个平行用于检测酶活力。用血球计数法计算菌液浓度,感染组注射3×107 CFU/mL的副溶血弧菌,每尾虾注射25 μL,注射部位为凡纳滨对虾的第5腹节肌肉处。对照组注射相同体积0.86%的无菌生理盐水,攻毒期间不投饵,正常充气。在注射后3、6、9、12、24、48、72、96 h分别取血液和肝胰腺样品,每个时间点各取3尾濒临死亡对虾样品。连续观察感染组和对照组凡纳滨对虾的活力、发病及死亡情况,及时清除死虾。
1.2.6 免疫酶活力检测 用1 mL无菌注射器从对虾围心窦或腹血窦采集血淋巴,4 ℃下放置12 h(过夜),析出血清后,以5000 r/min低温离心10 min,吸取血清,于-20 ℃下保存,用于酶活力检测。将肝胰腺用滤纸擦干,称重,按照质量与体积比为1∶10(g∶mL)加入预冷的生理盐水,匀浆。将制备好的组织匀浆液以3000 r/min离心10 min,取上清于-80 ℃下保存备用,用于肝胰腺酶活性的测定。溶菌酶(LYS)、碱性磷酸酶(ALP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、酚氧化酶(PO)活力及总抗氧化能力(T-AOC)均采用上海纪宁实业有限公司生产的酶联免疫分析(ELISA)试剂盒进行测定。使用Rayto RT-6100酶标分析仪在450 nm波长下测定96孔板各孔吸光度,具体方法按照说明书进行。特定条件下1 min内转化1 μmol底物或者底物中1 μmol有关基团所需的酶量,称为一个酶活力国际单位(U)。
1.3 数据处理
试验数据均以平均数±标准差(mean±S.D.)表示,利用SPSS 21.0软件进行单因素方差分析(One-way ANOVA),采用Duncan’s法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 菌株鉴定结果
利用梅里埃全自动微生物生化鉴定系统对菌株进行了47项生化指标检测。结果显示,菌株VP0630鉴定为副溶血弧菌V.parahaemolyticus的概率为99%(表2)。
表2 菌株VP0630的生理生化特征
Tab.2 Physiological and biochemical characteristics of VP0630 strain
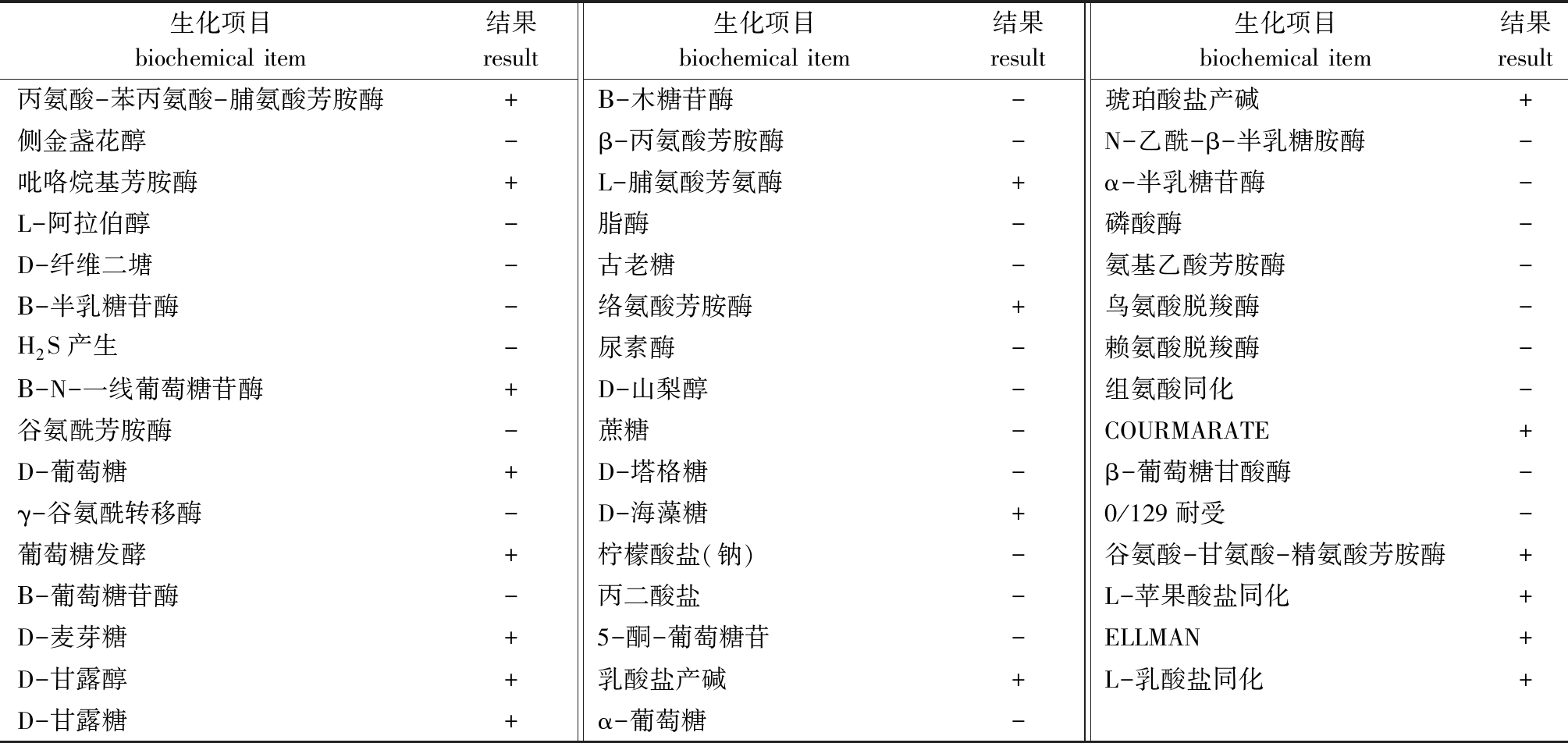
生化项目biochemical item结果result生化项目biochemical item结果result生化项目biochemical item结果result丙氨酸-苯丙氨酸-脯氨酸芳胺酶+Β-木糖苷酶-琥珀酸盐产碱+侧金盏花醇-β-丙氨酸芳胺酶-N-乙酰-β-半乳糖胺酶-吡咯烷基芳胺酶+L-脯氨酸芳氨酶+α-半乳糖苷酶-L-阿拉伯醇-脂酶-磷酸酶-D-纤维二塘-古老糖-氨基乙酸芳胺酶-Β-半乳糖苷酶-络氨酸芳胺酶+鸟氨酸脱羧酶-H2S产生-尿素酶-赖氨酸脱羧酶-Β-N-一线葡萄糖苷酶+D-山梨醇-组氨酸同化-谷氨酰芳胺酶-蔗糖-COURMARATE+D-葡萄糖+D-塔格糖-β-葡萄糖甘酸酶-γ-谷氨酰转移酶-D-海藻糖+0/129耐受-葡萄糖发酵+柠檬酸盐(钠)-谷氨酸-甘氨酸-精氨酸芳胺酶+Β-葡萄糖苷酶-丙二酸盐-L-苹果酸盐同化+D-麦芽糖+5-酮-葡萄糖苷-ELLMAN+D-甘露醇+乳酸盐产碱+L-乳酸盐同化+D-甘露糖+α-葡萄糖-
Note:+,psitive;-,negative
PCR扩增获得菌株VP0630的16S rRNA基因片段大小为1446 bp(LC500889),利用NCBI数据库进行Blast同源比对。结果显示,VP0630菌株的16S rRNA基因序列属于弧菌属。下载NCBI数据库中同源性较高的弧菌属16S rRNA基因序列与VP0630的16S rRNA基因序列进行多重比对并构建系统发育树。结果显示,VP0630菌株与副溶血弧菌的亲缘关系最近,与副溶血弧菌Vibro parahaemolyticus NR_113604和NR_041838首先聚为一支,之后再与坎贝氏弧菌Vibrio campbellii、欧文斯弧菌Vibrio owensii和哈维氏弧菌Vibrio harveyi聚为一支(图1)。结合生理生化鉴定结果,将菌株VP0630鉴定为副溶血弧菌。

图1 基于16S rRNA基因构建的系统发育树
Fig.1 Phylogenetic tree based on 16S rRNA gene sequences
为研究菌株VP0630的致病性,利用AP4套式PCR方法对分离菌株进一步开展毒力基因pir检测,检测结果如图2所示。套式PCR结果显示,两轮扩增产物均为阳性,表明菌株VP0630为致病性副溶血弧菌。
2.2 人工感染试验
利用菌株VP0630对健康凡纳滨对虾进行攻毒试验。结果显示:感染组感染3 h后无明显症状,个别个体出现死亡;24 h后感染组对虾活力明显减弱,死亡数量显著增多,部分死亡对虾出现空肠空胃,肝胰腺轻微糜烂,甲壳变软,肌肉轻微浑浊等现象;对照组对虾活力较好,虽有个别死亡,但无软壳及肝胰腺糜烂的现象;凡纳滨对虾感染副溶血弧菌48 h时,感染组累积死亡率为46.40%,对照组死亡率为8.67%;96 h时感染组累积死亡率为78.37%,对照组的死亡率为8.67%,感染组死亡率比对照组高69.70%(图3)。

图3 注射副溶血弧菌后凡纳滨对虾的累积死亡率
Fig.3 Cumulative mortality of Pacific white leg shrimp Litopenaeus vannamei challenged with Vibrio parahaemolyticus
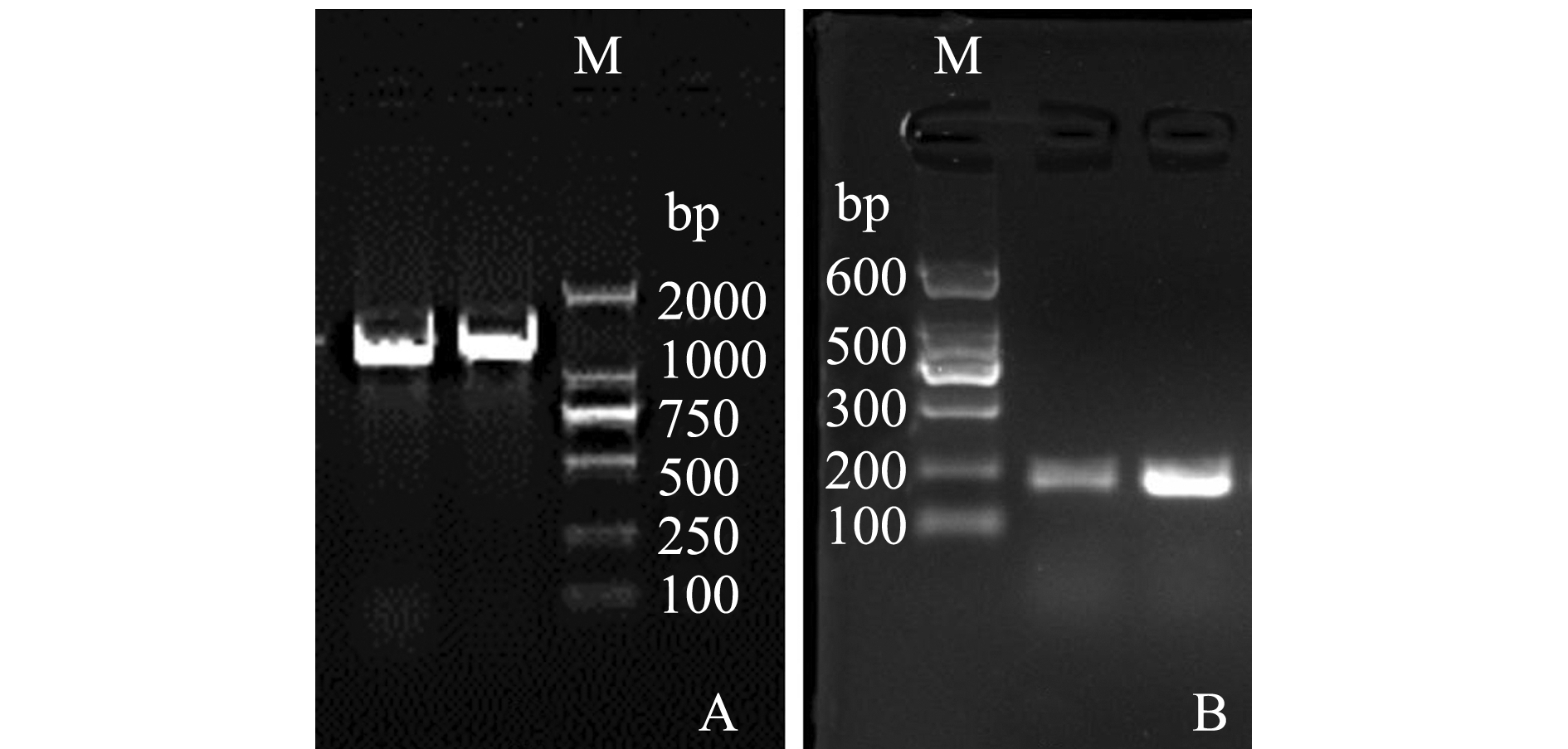
注:M为Marker;A为第一轮扩增结果;B为第二轮扩增结果
Note:M,Marker;A,the first PCR amplification;B,the second PCR amplification
图2 VP0630菌株AP4 PCR扩增结果
Fig.2 AP4 PCR amplification of VP0630 strain
2.3 血清中酶活力的变化
从表3可见:对照组血清中6种酶活力在3~96 h时无显著性差异(P>0.05),感染组6种酶活力均呈现先升高后降低的趋势;感染组LYS和T-AOC酶活力在12 h时达到最高, 96 h时酶活力降到最低且与对照组无显著性差异(P>0.05);感染组ALP酶活力在12 h时达到最高,72 h时酶活力降到最低且与对照组无显著性差异(P>0.05);感染组ACP酶活力在9 h时达到最高,96 h时降到最低且显著低于对照组水平(P<0.05);SOD和PO酶活力在6 h时达到最高,之后逐渐降低,96 h时降到最低且与对照组无显著性差异(P>0.05)。
表3 注射副溶血弧菌后凡纳滨对虾血清中6种酶活力的变化
Tab.3 Change in activities of six enzymes in serum of Pacific white leg shrimp Litopenaeus vannamei challenged with Vibrio parahaemolyticus
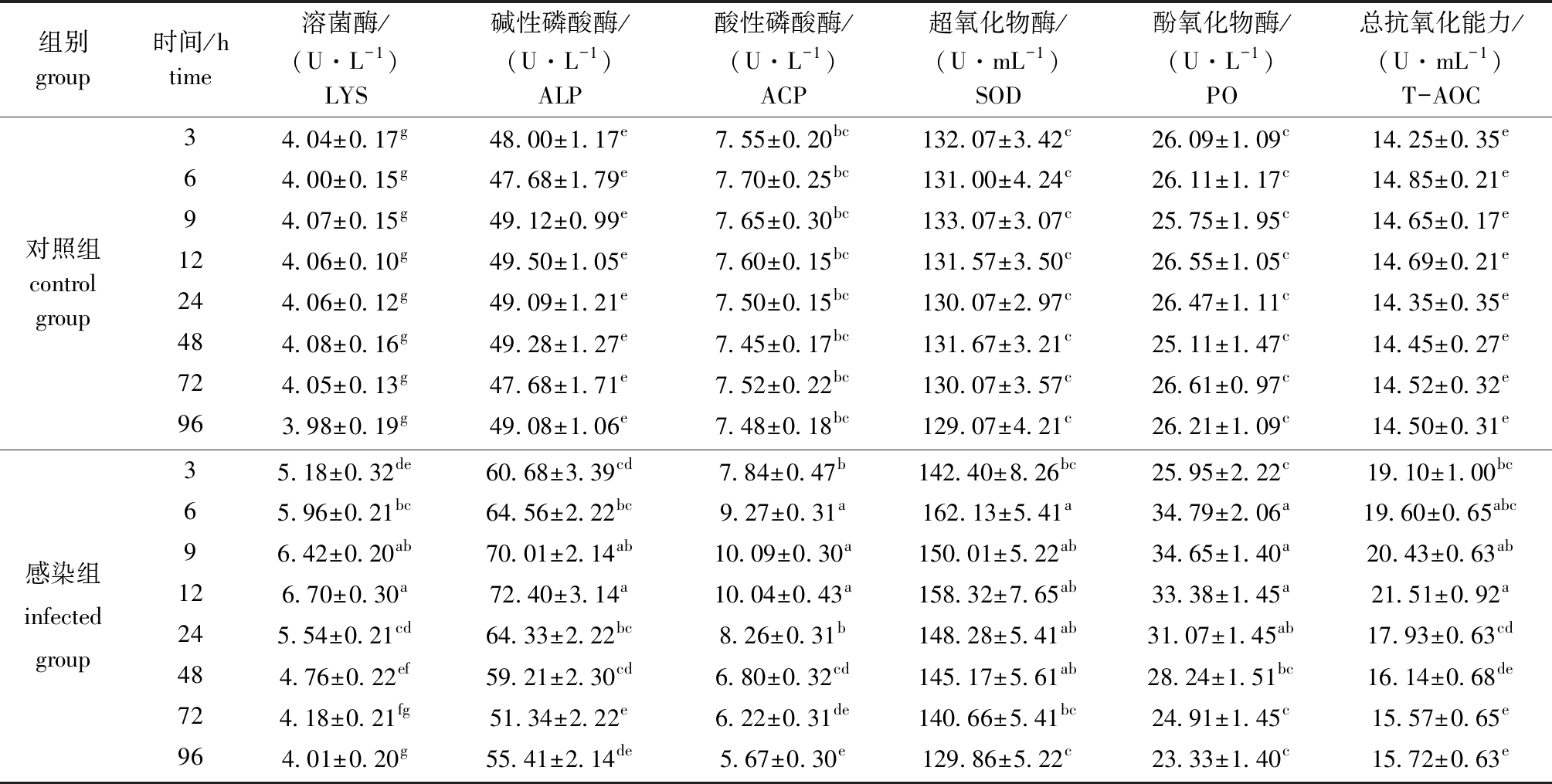
组别group时间/htime溶菌酶/(U·L-1)LYS碱性磷酸酶/(U·L-1)ALP酸性磷酸酶/(U·L-1)ACP超氧化物酶/(U·mL-1)SOD酚氧化物酶/(U·L-1)PO总抗氧化能力/(U·mL-1)T-AOC对照组control group34.04±0.17g48.00±1.17e7.55±0.20bc132.07±3.42c26.09±1.09c14.25±0.35e64.00±0.15g47.68±1.79e7.70±0.25bc131.00±4.24c26.11±1.17c14.85±0.21e94.07±0.15g49.12±0.99e7.65±0.30bc133.07±3.07c25.75±1.95c14.65±0.17e124.06±0.10g49.50±1.05 e7.60±0.15bc131.57±3.50c26.55±1.05c14.69±0.21e244.06±0.12g49.09±1.21e7.50±0.15bc130.07±2.97c26.47±1.11c14.35±0.35e484.08±0.16g49.28±1.27e7.45±0.17bc131.67±3.21c25.11±1.47c14.45±0.27e724.05±0.13g47.68±1.71e7.52±0.22bc130.07±3.57c26.61±0.97c14.52±0.32e963.98±0.19g49.08±1.06e7.48±0.18bc129.07±4.21c26.21±1.09c14.50±0.31e感染组infected group35.18±0.32de60.68±3.39cd7.84±0.47b142.40±8.26bc25.95±2.22c19.10±1.00bc65.96±0.21bc64.56±2.22bc9.27±0.31a162.13±5.41a34.79±2.06a19.60±0.65abc96.42±0.20ab70.01±2.14ab10.09±0.30a150.01±5.22ab34.65±1.40a20.43±0.63ab126.70±0.30a72.40±3.14a10.04±0.43a158.32±7.65ab33.38±1.45a21.51±0.92a245.54±0.21cd64.33±2.22bc8.26±0.31b148.28±5.41ab31.07±1.45ab17.93±0.63cd484.76±0.22ef59.21±2.30cd6.80±0.32cd145.17±5.61ab28.24±1.51bc16.14±0.68de724.18±0.21fg51.34±2.22e6.22±0.31de140.66±5.41bc24.91±1.45c15.57±0.65e964.01±0.20g55.41±2.14de5.67±0.30e129.86±5.22c23.33±1.40c15.72±0.63e
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia
2.4 肝胰腺中酶活力的变化
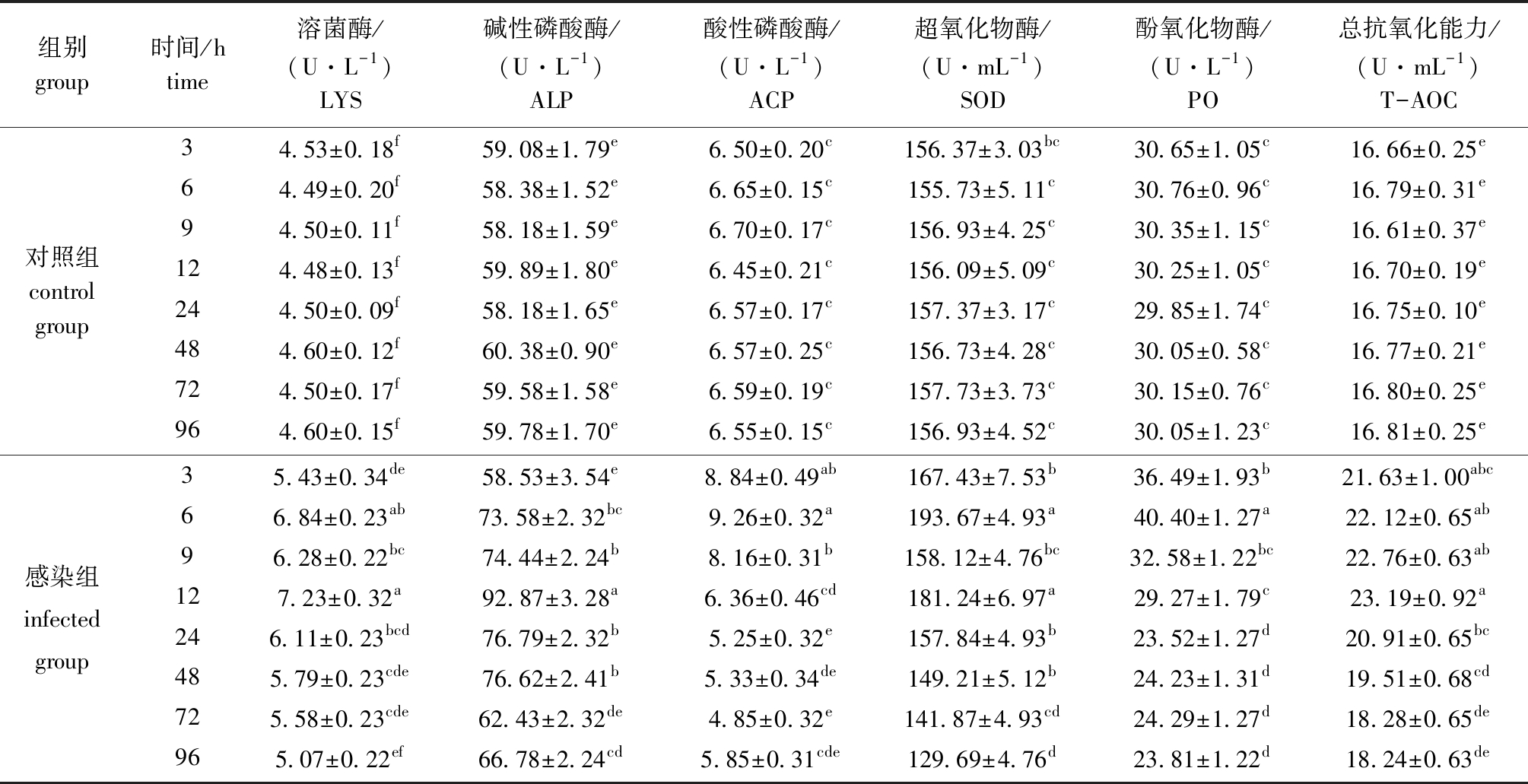
从表4可见:对照组肝胰腺中6种酶活力在3~96 h时无显著性差异(P>0.05),感染副溶血弧菌后6种酶活力均呈先升高后降低的趋势;感染组LYS和T-AOC酶活力在12 h时达到最高,之后显著降低(P<0.05),96 h时降低到最低水平;感染组ALP酶活力在12 h时达到最高,72 h时降到最低且与对照组无显著性差异(P>0.05);感染组ACP酶活力在6 h时达到最高,72 h时酶活力降到最低且与对照组无显著性差异(P>0.05);感染组SOD酶活力在6 h时急剧上升到最高水平,之后波动式降低,96 h时酶活力降低到最低且显著低于对照组(P<0.05);感染组PO酶活力在6 h时达到最高,9 h时迅速降低到对照组水平,24 h后酶活力显著低于对照组水平(P<0.05)。
表4 注射副溶血弧菌后凡纳滨对虾肝胰腺中6种酶活力的变化
Tab.4 Change in activities of six enzymes in hepatopancreas of Pacific white leg shrimp Litopenaeus vannamei challenged with Vibrio parahaemolyticus
组别group时间/htime溶菌酶/(U·L-1)LYS碱性磷酸酶/(U·L-1)ALP酸性磷酸酶/(U·L-1)ACP超氧化物酶/(U·mL-1)SOD酚氧化物酶/(U·L-1)PO总抗氧化能力/(U·mL-1)T-AOC对照组control group34.53±0.18f59.08±1.79e6.50±0.20c156.37±3.03bc30.65±1.05c16.66±0.25e64.49±0.20f58.38±1.52e6.65±0.15c155.73±5.11c30.76±0.96c16.79±0.31e94.50±0.11f58.18±1.59e6.70±0.17c156.93±4.25c30.35±1.15c16.61±0.37e124.48±0.13f59.89±1.80e6.45±0.21c156.09±5.09c30.25±1.05c16.70±0.19e244.50±0.09f58.18±1.65e6.57±0.17c157.37±3.17c29.85±1.74c16.75±0.10e484.60±0.12f60.38±0.90e6.57±0.25c156.73±4.28c30.05±0.58c16.77±0.21e724.50±0.17f59.58±1.58e6.59±0.19c157.73±3.73c30.15±0.76c16.80±0.25e964.60±0.15f59.78±1.70e6.55±0.15c156.93±4.52c30.05±1.23c16.81±0.25e感染组infected group35.43±0.34de58.53±3.54e8.84±0.49ab167.43±7.53b36.49±1.93b21.63±1.00abc66.84±0.23ab73.58±2.32bc9.26±0.32a193.67±4.93a40.40±1.27a22.12±0.65ab96.28±0.22bc74.44±2.24b8.16±0.31b158.12±4.76bc32.58±1.22bc22.76±0.63ab127.23±0.32a92.87±3.28a6.36±0.46cd181.24±6.97a29.27±1.79c23.19±0.92a246.11±0.23bcd76.79±2.32b5.25±0.32e157.84±4.93b23.52±1.27d20.91±0.65bc485.79±0.23cde76.62±2.41b5.33±0.34de149.21±5.12b24.23±1.31d19.51±0.68cd725.58±0.23cde62.43±2.32de4.85±0.32e141.87±4.93cd24.29±1.27d18.28±0.65de965.07±0.22ef66.78±2.24cd5.85±0.31cde129.69±4.76d23.81±1.22d18.24±0.63de
3 讨论
3.1 副溶血弧菌的分离鉴定
副溶血弧菌广泛分布于海洋、河口及海湾,可导致多种动物发病,在养殖的鱼类[16]、贝类[17-18]、甲壳类[2, 19]中均有副溶血弧菌感染致病的报道。副溶血弧菌在中国海产品和淡水产品中具有较高的检出率,是引起细菌性食物中毒的首要致病菌[20]。从地域分析,天津地区海产品副溶血弧菌检出率较高,携带毒力基因的菌株检出率可达52%[21]。本课题组从发病对虾肝胰腺分离得到菌株VP0630,通过梅里埃全自动微生物生化鉴定系统和16S rRNA基因序列对菌株进行分类鉴定,将菌株鉴定为副溶血弧菌。通过AP4套式PCR法确认该菌株含有pir毒力基因,为致病性副溶血弧菌。该研究丰富了致病性副溶血弧菌及AHPND疾病的研究资料。
3.2 副溶血弧菌的致病性
攻毒试验表明,VP0630菌株具有较强的致病力,感染组对虾96 h累积死亡率为78.37%,死亡对虾出现空肠空胃、肝胰腺轻微糜烂、甲壳变软及肌肉轻微浑浊等症状,与AHPND典型症状相似。有研究表明,体质量为2.20 g的凡纳滨对虾感染副溶血弧菌后,24 h累积存活率为44%[4]。体长为3 cm的凡纳滨对虾在注射1×107 CFU/mL的副溶血弧菌液24 h后,累积死亡率高达90%以上[2]。本研究中凡纳滨对虾感染副溶血弧菌24 h后累积死亡率为29.96%,这可能是因试验用凡纳滨对虾规格较大(10.65 cm),具有较强免疫调节能力,故死亡率和死亡时间与上述研究有所差异。本研究中,感染组对虾96 h累积死亡率达到78.37%,比对照组高出69.70%,说明菌株VP0630对凡纳滨对虾具有较强的致病力。由此可见,副溶血弧菌不仅仅对于幼虾(3~5 cm)具有致病力,对于规格较大的对虾也具有较强的致病力。
3.3 副溶血弧菌对凡纳滨对虾免疫酶活力的影响
甲壳动物免疫功能通过血淋巴中一些非特异性酶类和活性因子来发挥,其血淋巴中溶菌酶(LYS)、酚氧化酶(PO)、碱性磷酸酶(ALP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)等酶类均为非特异性免疫因子,可以抵御病原体的侵害。斑节对虾感染鳗弧菌后,肝胰腺和鳃中的LYS活性分别于6、12 h时达到最高值[22]。墨吉明对虾感染副溶血弧菌和溶藻弧菌后,LYS基因mRNA表达量持续升高,分别于24、12 h时表达量达到最高,且感染组显著高于对照组[23]。健康中国对虾血清中PO活性相对稳定,机体受到大量病原体侵害时,proPO转化为PO,PO活性短时间内急剧升高[24]。罗氏沼虾感染溶藻弧菌后,ALP和ACP活性均表现出先升高后降低的趋势[25]。而患病中国对虾的ALP和ACP阳性反应较健康对虾增多,且这些反应与透明细胞的吞噬作用相关[26]。日本蟳在感染溶藻弧菌后,肝胰腺中SOD活性在6~12 h时显著上升,随后呈下降趋势[27]。副溶血弧菌感染凡纳滨对虾后,肝胰腺中SOD活性显著高于对照组,在6 h时达到最大值,且随着时间延长活性降低[4]。斑节对虾感染副溶血弧菌后,肝胰腺和鳃中的T-AOC活性分别于12 h和6 h时达到最高,48 h时恢复到对照组水平[28]。
本研究中,凡纳滨对虾感染副溶血弧菌后,血清和肝胰腺中LYS、PO、SOD、ALP、ACP、T-AOC酶活性均在6~12 h显著升高,与上述研究中酶活力的变化趋势一致。这可能是副溶血弧菌诱导凡纳滨对虾发生非特异性免疫反应,合成大量抗菌蛋白和溶菌蛋白,用于清除入侵的副溶血弧菌,使得LYS活性升高。同时,副溶血弧菌的感染激活了凡纳滨对虾体内的proPO活性,短时间内(6 h)PO的活力显著提高,进而形成黑色素及诱导其他免疫功能以达到杀灭病原体的目的[29]。副溶血弧菌数量的骤然增加诱发细胞吞噬和包裹作用,使得血清和肝胰腺ALP和ACP活性显著升高。细胞吞噬和包裹作用发生时,诱导细胞释放大量的ROS,SOD作为抗氧化酶系统的重要组成部分被大量合成,用来清除机体产生的自由基,使得SOD活性在6 h内显著升高。作为机体抗氧化能力综合指标的T-AOC活性在6~12 h内也显著升高。而随着感染时间延长,副溶血弧菌在体内大量繁殖,高浓度的病原菌可能会破坏机体正常的细胞功能,细胞吞噬和包裹作用受到破坏,抑制proPO激活系统,同时降低机体抗氧化防御能力,使得LYS、PO、SOD、ALP、ACP、T-AOC活力降低,故本研究中大部分酶活性感染后72~96 h时降低至对照组水平,仅个别酶活力显著低于对照组。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会编制.2018中国渔业统计年鉴[M].北京:中国农业出版社,2018:26,34.
[2] 贾丹,史成银,黄倢,等.凡纳滨对虾急性肝胰腺坏死病(AHPND)病原分离鉴定及其致病性分析[J].渔业科学进展,2018,39(3):103-111.
[3] Dabu I M,Lim J J,Arabit P M T,et al.The first record of acute hepatopancreatic necrosis disease in the Philippines[J].Aquaculture Research,2017,48(3):792-799.
[4] 赵伟,王雷,刘梅,等.副溶血弧菌对凡纳滨对虾肝胰腺抗氧化酶活性和基因表达的影响[J].中国水产科学,2017,24(6):1261-1270.
[5] Lee C T,Chen I T,Yang Yiting,et al.The opportunistic marine pathogen Vibrio parahaemolyticus becomes virulent by acquiring a plasmid that expresses a deadly toxin[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(34):10798-10803.
[6] Kondo H,Van P T,Dang L T,et al.Draft genome sequence of non-Vibrio parahaemolyticus acute hepatopancreatic necrosis disease strain KC13.17.5,isolated from diseased shrimp in Vietnam[J].Genome Announcements,2015,3(5):e00978-15.
[7] Liu Liyuan,Xiao Jinzhou,Xia Xiaoming,et al.Draft genome sequence of Vibrio owensii strain SH-14,which causes shrimp acute hepatopancreatic necrosis disease[J].Genome Announcements,2015,3(6):e01395-15.
[8] Dong Xuan,Wang Hailiang,Xie Guosi,et al.An isolate of Vibrio campbellii carrying the pirVP gene causes acute hepatopancreatic necrosis disease[J].Emerging Microbes & Infections,2017,6(1):1-3.
[9] Tran L,Nunan L,Redman R M,et al.Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J].Diseases of Aquatic Organisms,2013,105(1):45-55.
[10] 丁子元,包海岩,张振奎.天津市南美白对虾养殖存在问题及发展对策[J].农业与技术,2017,37(2):107.
[11] 张振国,姜巨峰,孙志景,等.长丝鲈“突眼病”病原菌的分离鉴定及药敏试验[J].大连海洋大学学报,2014,29(6):624-628.
[12] Dangtip S,Sirikharin R,Sanguanrut P,et al.AP4 method for two-tube nested PCR detection of AHPND isolates of Vibrio parahaemolyticus[J].Aquaculture Reports,2015,2:158-162.
[13] 世界动物卫生组织.水生动物疾病诊断手册[M].国家质量监督检验检疫总局,译.3版.北京:中国农业出版社,2001:165-199.
[14] Jaroenlak P,Sanguanrut P,Williams B A P,et al.A nested PCR assay to avoid false positive detection of the microsporidian Enterocytozoon hepatopenaei (EHP) in environmental samples in shrimp farms[J].PLoS One,2016,11(11):e0166320.
[15] Zhang Qingli,Liu Qun,Liu Shuang,et al.A new nodavirus is associated with covert mortality disease of shrimp[J].Journal of General Virology,2014,95(12):2700-2709.
[16] Liu Lu,Ge Mingfeng,Zheng Xiaoye,et al.Investigation of Vibrio alginolyticus,V.harveyi,and V.parahaemolyticus in large yellow croaker,Pseudosciaena crocea (Richardson) reared in Xiangshan Bay,China[J].Aquaculture Reports,2016,3:220-224.
[17] Roque A,Lopez-Joven C,Lacuesta B,et al.Detection and identification of tdh-and trh-positive Vibrio parahaemolyticus strains from four species of cultured bivalve molluscs on the Spanish Mediterranean Coast[J].Applied and Environmental Microbiology,2009,75(23):7574-7577.
[18] Lee K K,Liu P C,Huang Chiyang.Vibrio parahaemolyticus infectious for both humans and edible mollusk abalone[J].Microbes and Infection,2003,5(6):481-485.
[19] Alapide-Tendencia E V,Dureza L A.Isolation of Vibrio spp.from Penaeus monodon (Fabricius) with red disease syndrome[J].Aquaculture,1997,154(2):107-114.
[20] 赵忠俊,于明明,王晓威,等.副溶血性弧菌的致病性、流行性及分子生物学检测技术研究进展[J].社区医学杂志,2017,15(6):84-86.
[21] 徐赟霞,赵良炜,吴艳辉,等.天津地区副溶血弧菌分离株血清型、部分毒力基因的分布和耐药性调查[J].天津农学院学报,2017,24(3):55-58,63.
[22] 段亚飞,董宏标,王芸,等.鳗弧菌感染对斑节对虾免疫相关指标的影响[J].海洋科学,2015,39(9):44-50.
[23] 史黎黎,周婷婷,李逸群,等.墨吉明对虾c型溶菌酶基因的克隆及表达[J].广东海洋大学学报,2017,37(3):8-13.
[24] 李天道,于佳.中国对虾血清中酚氧化酶活力研究[J].海洋湖沼通报,1998(1):51-56.
[25] 邹卫丽,戴习林,朱其建,等.溶藻弧菌对罗氏沼虾成活率及5种酶活性的影响[J].广东农业科学,2012,39(16):129-134,141.
[26] 刘晓云,张志峰,马洪明.中国对虾血细胞酶细胞化学的初步研究[J].青岛海洋大学学报,2002,32(2):259-265.
[27] 张萌萌,宁俊佳,徐善良,等.感染溶藻弧菌对日本蟳肝胰腺免疫功能的影响[J].水产学报,2015,39(12):1863-1871.
[28] 段亚飞,张家松,董宏标,等.副溶血弧菌对斑节对虾非特异性免疫酶活性的影响[J].水产学报,2014,38(9):1557-1564.
[29] 孟凡伦,张玉臻,孔健,等.甲壳动物中的酚氧化酶原激活系统研究评价[J].海洋与湖沼,1999,30(1):110-116.