哈维氏弧菌Vibrio harveyi是一种具有运动性的革兰氏阴性菌,是弧菌病的主要病原菌之一,广泛分布于海洋及河口水生生态系统中[1]。弧菌病是全球对虾和贝类养殖业中面临的最普遍、最严重的威胁之一,哈维氏弧菌感染可导致虾肝胰腺细胞坏死和肝胰腺小管萎缩,其胞外产物可导致双壳类幼虫活动能力降低、游动不规律、瓣膜关闭和面盘脱离[2-3]。随着中国水产养殖品种的增多,该病原菌感染的宿主范围也在逐渐扩大,包括半滑舌鳎Cynoglossus semilaevis Gunther、斜带石斑鱼Epinephelus coioides、红鳍东方鲀Takifugur ubripes等经济鱼类品种[1,4-5],细菌数量超过阈值就会大面积暴发弧菌病,临床症状表现为出血性败血症、肠炎和眼部病变等,死亡率较高,该病给养殖业造成了巨大的经济损失[6-7]。
与其他革兰氏阴性菌相似,哈维氏弧菌通过多种表面蛋白和毒力因子感染宿主细胞,包括磷脂酶C(PLC)、溶血素(hemolysin)、脂多糖(lipopolysaccharide)、黏附相关因子(adhesion factors)等[8]。其中,哈维氏弧菌溶血素(Vibrio harveyi hemolysin,VHH)作为哈维氏弧菌的主要毒力因子,是热不稳定性溶血素(thermolabile hemolysin,TLH)家族的成员之一,具有磷脂酶A2或溶血磷脂酶活性,能溶解细胞膜,进而促进细菌进入宿主细胞[9],在哈维氏弧菌致病过程中起到关键作用。Zhang等[10-11]研究发现,哈维氏弧菌的致病性与溶血素密切相关,且致病力最强的VIB645菌株含有两个溶血素(vhhA和vhhB)基因,其他致病菌株只有一个溶血素基因,而vhh缺失株则几乎无致病力。经验证,153号丝氨酸(Ser)是VHH活性的关键氨基酸残基之一,将其突变为无催化作用的甘氨酸(Gly)残基,得到的VHH突变蛋白失去了磷脂酶活性、溶血活性和对大菱鲆的致病性[12]。目前,溶血素已在大肠杆菌Escherichia coli、金黄色葡萄球菌Staphylococcus aureus、李斯特菌Listeria monocytogenes、弧菌属Vibrio sp.[13-16]等多个种属中发现,与细菌定植和免疫逃避相关,在病原菌致病机制中发挥重要作用。
本研究中,成功构建原核表达载体pET28a-vhh,并进行了VHH包涵体蛋白的重组表达及鼠源多克隆抗体的制备,验证了多抗的效价和活性,为完善哈维氏弧菌检测方法、制备VHH单抗和疫苗及进一步开展相关科研工作提供了基础资料。
1 材料与方法
1.1 材料
试验用哈维氏弧菌(No.2 HWH020)取自大连市海珍品疾病防控重点实验室。试验用6~8周龄BALB/c雌性小白鼠,购于大连医科大学SPF试验动物中心。
Taq扩增体系、DNA标准Marker、克隆载体pMD19-T、表达载体pET28a购于TaKaRa公司;限制性内切酶Xho Ⅰ和BamH Ⅰ、T4连接酶、Prestained Protein Ladder PageRuler购于Thermo公司;质粒小提试剂盒、DNA纯化回收试剂盒购于天根生化科技有限公司;His·Tag单克隆抗体、氨苄西林(Amp)、硫酸卡那霉素(Kan)、尿素、IPTG、Ni-NTA亲和层析柱购于生工生物工程(上海)股份有限公司;Triton X-100、PVDF膜、超滤离心管、NBT/BCIP显色试剂盒购于北京索莱宝科技有限公司;感受态细胞DH5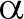 、BL21(DE3)购于北京全式金生物技术有限公司;弗氏完全佐剂、弗氏不完全佐剂、AP标记的羊抗鼠IgG购于Sigma公司;LB琼脂培养基、LB肉汤培养基购于青岛高科技工业园海博生物技术有限公司。
、BL21(DE3)购于北京全式金生物技术有限公司;弗氏完全佐剂、弗氏不完全佐剂、AP标记的羊抗鼠IgG购于Sigma公司;LB琼脂培养基、LB肉汤培养基购于青岛高科技工业园海博生物技术有限公司。
1.2 方法
1.2.1 重组表达载体pET28a-vhh的构建 根据NCBI中vhhA的基因序列(GenBank AF293430)设计引物vhh-F和vhh-R,引物序列见表1。以哈维氏弧菌基因组DNA为模板进行PCR扩增,扩增产物经DNA纯化回收试剂盒进行回收。将回收产物与pMD19-T连接并转化到DH5α感受态细胞中,挑取阳性菌落,再以M13-F/R为引物进行PCR验证并测序,获得重组克隆载体pMD19-T-vhh。提取质粒pMD19-T-vhh和pET28a,使用Xho I和BamH Ⅰ分别进行双酶切,酶切产物经T4连接酶连接后转化至DH5α感受态细胞中,挑取阳性菌落,以T7-F/R为引物进行PCR验证并测序,获得重组表达载体pET28a-vhh。
表1 本试验所用引物
Tab.1 Primers used in present experiment

引物primer序列sequence(5′-3′)vhh-FGCGGATCCATGAATAAAACTATTACGTTACTvhh-RGGCTCGAGGAAAGGATGGTTTGACAATTGAM13-FCGCCAGGGTTTTCCCAGTCACGACM13-RAGCGGATAACAATTTCACACAGGAT7-FTAATACGACTCACTATAGGGT7-RTGCTAGTTATTGCTCAGCGG
注:下划线标记的碱基为酶切位点
Note: Restriction enzyme cutting sites are marked by underlined letters
1.2.2 重组包涵体蛋白的诱导表达及纯化 提取质粒pET28a-vhh,并转化至BL21(DE3)感受态细胞中,于LB肉汤培养基中37 ℃下以180 r/min活化1 h,涂布于含有Kan抗性的LB琼脂培养基上,37 ℃下过夜培养。挑取单克隆接种于含有Kan抗性的LB肉汤培养基中,培养至OD600 nm=0.70,加入终浓度为1 mmol/L 的 IPTG 于16 ℃下以180 r/min诱导12 h。诱导结束后离心并收集菌体,用PBS缓冲液重悬,在冰浴条件下进行超声波破碎,离心分别收集上清、包涵体,进行SDS-PAGE分析。
经SDS-PAGE检测后进行Western-blot分析。将PAGE胶上的样品电转移至PVDF膜上,用质量分数为5%的脱脂奶粉在4 ℃下封闭过夜。再将膜置于His·Tag单克隆抗体(用5%脱脂奶粉按1∶2000稀释)中,室温孵育1.5 h,先用PBST洗涤,再用PBS清洗两遍。将PVDF膜置于碱性磷酸酶(AP)标记的羊抗鼠IgG二抗(用5%脱脂奶粉按1∶3000稀释)中,室温孵育1.5 h,经PBST、PBS洗涤后,加入配制的新鲜NBT/BCIP显色液,显色10 min,观察结果。
将包涵体置于8 mol/L尿素缓冲液中溶解过夜。次日,离心收集上清(粗蛋白),用0.22 μm滤膜过滤后,上样于Ni-NTA亲和层析柱,用梯度咪唑缓冲液(10、20、30、40、50、80、100、200、500 mmol/L)洗脱并分别收集洗脱液进行SDS-PAGE分析。将纯化后的蛋白进行复性,并使用截留相对分子质量30 000的超滤离心管进行蛋白浓缩和脱咪唑,测定浓度后分装,于-80 ℃下保存。取部分浓缩后的蛋白置于4 ℃下保存,每天取50 μL样品与上样缓冲Buffer混合,14 d后通过SDS-PAGE检测蛋白稳定性。
1.2.3 多克隆抗体的制备与效价检测 取上述重组蛋白与弗氏完全佐剂按1∶1混合、乳化,取200 μL给每只免疫小鼠皮下注射(共3只);两周后取同样剂量的纯化蛋白与等量弗氏不完全佐剂混合,进行第二次免疫;之后每隔7 d采用同样的方法进行第三、四次免疫。第四次免疫后7 d注射原抗原以加强免疫。于加强免疫后的第3天从小鼠眼眶取血,收集血清并分装,于-80 ℃下保存备用。
采用DOT-ELISA方法测定血清效价。将纯化所得的VHH蛋白作为抗原包被膜片,用5%脱脂奶粉4 ℃下封闭过夜。将血清按1∶320、1∶640、1∶1280、1∶2560、1∶5120、1∶10 240、1∶20 480、1∶40 960、1∶81 920、1∶163 840、1∶327 680比例进行稀释,加入酶标板中,37 ℃下孵育1 h。经洗涤,加入AP标记的羊抗鼠IgG二抗(用5%脱脂奶粉按1∶3000稀释),37 ℃下孵育1 h。清洗后加入NBT/BCIP底物显色液,待呈现明显的蓝紫色斑点时,用蒸馏水终止反应,待干燥后拍照记录。
1.2.4 多克隆抗体的活性验证 通过DOT-ELISA确定多克隆抗体的最高效价,以该抗体为一抗,用Western-blot检测VHH蛋白,以确定多抗的特异性,方法同“1.2.3”节。
将过夜培养的哈维氏弧菌菌液于4 ℃下以10 000 r/min离心1 min,获得培养上清液。取50 μL菌液上清与15 μL鱼脱纤维红细胞、1 μL不同稀释倍数的多抗和PBS缓冲液混合至终体积为500 μL。混合体系于28 ℃下孵育4 h,离心去除红细胞,通过测定上清液的OD543nm值以评估自制多抗体外抑制哈维氏弧菌溶血活性的作用。以1% Triton X-100处理组为阳性对照,无多抗组为空白对照。
1.3 数据处理
试验数据均以平均值和标准差(mean±S.D.)表示,使用SPSS 19.0软件进行统计分析和P值计算,组间差异分析采用独立样本t检验。
2 结果与分析
2.1 重组表达载体pET28a-vhh的构建
以哈维氏弧菌DNA为模板,以vhh-F/R为引物进行PCR扩增。PCR产物经10 g/L琼脂糖凝胶电泳后,在1257 bp处出现特异性条带(图1-A)。将目的片段与pMD19-T连接并转化至DH5α中,以M13-F/R为引物经PCR验证为阳性(图1-B)。测序结果经Blast比对,与vhhA(GenBank AF293430)序列的一致性为99%。重组克隆载体经双酶切后,回收目的片段vhh并与pET28a连接,以T7-F/R为引物经PCR验证为阳性(图1-C)。经测序验证正确,证明重组表达载体构建成功,命名为pET28a-vhh。
注:A为vhh基因扩增结果,1为vhh基因;B为质粒pMD19-T-vhh的鉴定结果,2~4均以M13-F/R为引物的扩增结果,5为质粒pMD19-T-vhh;C为质粒pET28a-vhh的鉴定结果,6~8均以T7-F/R为引物的扩增结果,9为质粒pET28a-vhh;M为DNA Marker
Note: A, amplification of vhh gene, 1, the vhh gene; B, identification of plasmid pMD19-T-vhh, 2-4, amplification of M13-F/R as primer, 5, plasmid pMD19-T-vhh; C, identification of plasmid pET28a-vhh, 6-8, amplification of T7-F/R as primer, 9, plasmid pET28a-vhh; M, DNA Marker
图1 重组表达载体pET28a-vhh的构建
Fig.1 Construction of recombinant expression vector pET28a-vhh
2.2 包涵体蛋白的表达与纯化
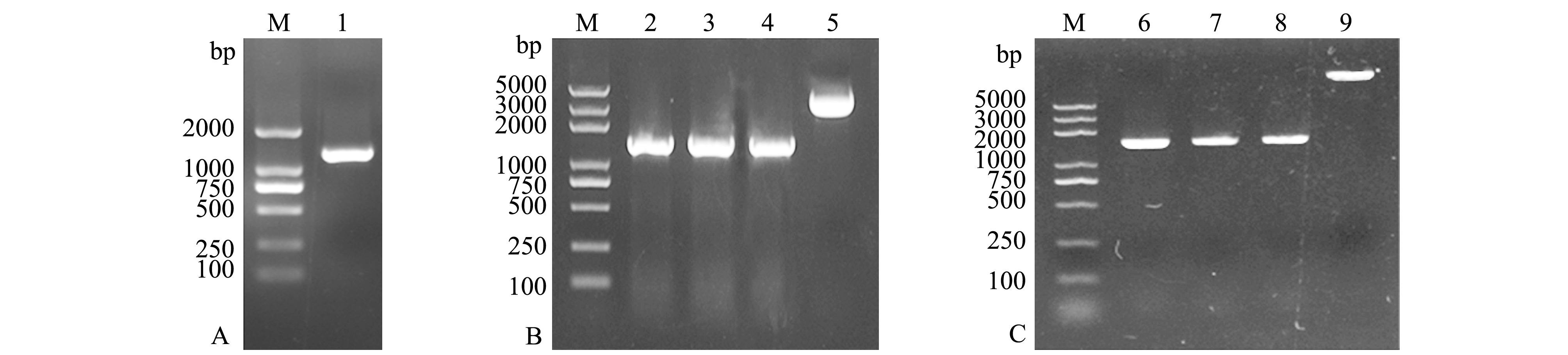
提取质粒pET28a-vhh并转化至BL21(DE3)感受态细胞中,加入1 mmol/L IPTG于16 ℃下过夜诱导表达,超声波破碎后进行SDS-PAGE分析。结果显示,在相对分子质量约47 000处出现特异性条带(图2-A),与预期大小一致,在该诱导条件下重组蛋白以包涵体形式存在。以His标签抗体为一抗,以AP标记的羊抗鼠IgG为二抗,进行Western-blot分析,成功检测到9、10泳道样品中的重组蛋白(图2-B),进一步证明了VHH蛋白已成功表达;8泳道样品BL21(DE3)未检测到条带,故图2-A中1泳道约47 000处为杂蛋白,而非目的蛋白。
梯度洗脱收集的样品经SDS-PAGE电泳检测,在相对分子质量47 000处出现目的条带(图2-C),可观察到200 mmol/L咪唑洗脱液中的目的蛋白含量最大,且杂蛋白最少。将浓缩后的蛋白置于4 ℃,14 d内连续取样以测定蛋白的稳定性,结果如图2-D所示,随着时间延长,蛋白相对分子质量由47 000下降至约34 000,说明该蛋白稳定性差易降解,为保证抗原的均一性,在多克隆抗体的制备过程中需使用新鲜纯化的蛋白进行免疫。
注:A为pET28a-vhh-BL21(DE3)的诱导表达结果,1为BL21(DE3),2、3分别为未诱导和诱导的pET28a-BL21(DE3),4为未诱导的pET28a-vhh-BL21(DE3),5~7分别为诱导的pET28a-vhh-BL21(DE3)全菌、上清、沉淀;B为His抗体检测结果,8为BL21(DE3),9~10分别为诱导的pET28a-vhh-BL21(DE3)全菌、沉淀;C为蛋白纯化结果,1~19分别为10、20、30、40、50、80、100、200、500 mmol/L咪唑缓冲液洗脱蛋白的洗脱液;D为蛋白稳定性检测结果,20~28分别为原蛋白和置于4 ℃后1~7、14 d的蛋白样品;M为蛋白Marker
Note: A, induced expression of pET28a-vhh-BL21(DE3), 1, BL21(DE3), 2 and 3, uninduced and induced pET28a-BL21(DE3), respectively, 4, uninduced pET28a-vhh-BL21(DE3), 5-7, whole bacteria, supernatant, and precipitation of induced pET28a-vhh-BL21(DE3), respectively; B, the detection of His antibody, 8, BL21(DE3), 9 and 10, whole bacteria and precipitation of induced pET28a-vhh-BL21(DE3), respectively; C, protein purification, 11-19, the eluent of protein eluted by 10, 20, 30, 40, 50, 80, 100, 200, and 500 mmol/L imidazole buffer; D, protein stability detection,20-28, the original protein and sample protein after 1 to 7 d, and 14 d at 4 ℃, respectively; M, protein Marker
图2 重组蛋白的表达与纯化
Fig.2 Expression and purification of recombinant protein
2.3 多克隆抗体的效价检测
利用Nanodrop微量核酸蛋白浓度测定仪测得浓缩后的蛋白浓度为6.27 mg/mL。通过DOT-ELISA测得3只小鼠血清中多克隆抗体的效价分别为1∶81 920、1∶163 840、1∶163 840(图3-A)。取效价最高的多克隆抗体为一抗,以AP磷酸酶标记的羊抗鼠抗体为二抗,对VHH蛋白、哈维氏弧菌培养上清液及诱导后的pET28a-vhh-BL21(DE3)菌液进行Western-blot检测,在相对分子质量约47 000处均能检测到大小相同的条带,结果表明,该多克隆抗体特异性良好(图3-B)。
2.4 多克隆抗体的活性验证
从图3-C可以看出,随着多抗稀释倍数的升高,上清液颜色变深,即体系中裂解的红细胞数量增多。测定各组样品OD543nm结果如图3-D所示,无多抗组的红细胞裂解率为97.49%,在混合体系中加入未稀释和稀释10、100、500、1000倍的多抗时,红细胞裂解率分别为9.70%、20.80%、42.80%、47.96%和97.10%。溶血试验结果表明,将VHH多抗稀释500倍时,对哈维氏弧菌体外溶血活性仍具有显著的抑制作用,即对VHH介导的鱼红细胞裂解起到保护作用。
3 讨论
3.1 VHH重组蛋白的表达与纯化
大肠杆菌是外源基因表达系统中最好的一种[17],且pET系统是目前在大肠杆菌中克隆和表达重组蛋白方面最强大的系统[18]。本试验中构建了pET28a-vhh重组表达载体,并将其转化到大肠杆菌BL21(DE3)中进行蛋白表达,在前期的试验中,对诱导温度、诱导时间和IPTG浓度进行了摸索,以筛选出VHH蛋白表达的最优条件。结果表明,诱导温度为16 ℃、诱导时间为12 h、IPTG浓度为1 mmol/L的条件下,重组蛋白的表达量最高,经SDS-PAGE电泳显示,VHH蛋白以包涵体形式高效表达。钟英斌[19]在关于vhh基因原核表达的研究中所用的表达载体是pET24d,表达菌株经IPTG于25 ℃下诱导6 h,与本研究中所采用的表达载体和诱导条件不同,故在重组蛋白的存在形式及表达量方面存在较大差异。
钟英斌[19]在上清中纯化得到的VHH蛋白相对分子质量大小为45 600,与本次试验从包涵体中纯化得到的蛋白相差2100,这可能是由于VHH蛋白N末端的20个氨基酸构成信号肽,蛋白分泌到胞外时信号肽被切除,故从上清中纯化得到的可溶性蛋白相对分子质量较小。与可溶性蛋白相比较,包涵体蛋白纯度更高,且包涵体表达可以有效避免蛋白酶对外源蛋白的降解。

注:A为多抗效价检测结果;B为多抗特异性检测结果,1~3分别为VHH蛋白、哈维氏弧菌培养上清、诱导后的pET28a-vhh-BL21(DE3)菌液;C和D为多抗与哈维氏弧菌培养上清的溶血试验结果(与无多抗组相比,*表示P<0.05,**表示 P<0.01);M为蛋白Marker
Note: A, detection of polyclonal antibody titer; B, detection of polyclonal antibody specificity, 1-3, VHH protein, V.harveyi culture supernatant, and induced pET28a-vhh-BL21(DE3), respectively; C and D, hemolytic test results of polyclonal antibody and V.harveyi culture supernatant(compared with the group without polyclonal antibody, *, P<0.05;**, P<0.01); M, protein Marker
图3 多克隆抗体的效价及活性检测
Fig.3 Titer and activity detection of polyclonal antibodies
3.2 包涵体蛋白的变性和复性
包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒[20]。本研究中,因大肠杆菌BL21(DE3)表达效率高,蛋白合成速度过快,以至于无足够的时间进行折叠,蛋白间非特异性结合过多,无法达到足够的溶解度,导致VHH蛋白以包涵体形式存在[21]。
纯化包涵体蛋白之前,需将包涵体溶解于高浓度尿素缓冲液(8 mol/L)中,通过离子间的相互作用破坏包涵体蛋白间的氢键使之变性,进而增加蛋白可溶性。纯化后进行蛋白复性,通过缓慢去除变性剂使目标蛋白从变性的完全伸展状态恢复到正常的折叠结构[22]。常见的复性方法有稀释、透析和超滤。稀释复性法是向蛋白中直接加入水或缓冲液,放置过夜,缺点是体积增加较大,变性剂稀释速度太快,不易控制;超滤复性法在生产中使用较多,不适合样品量较少的情况,且有些蛋白可能在超滤过程中发生不可逆的变性;本试验中采用的是透析复性法,透析袋中的蛋白样品与外透液进行离子交换,通过逐渐降低外透液浓度来去除蛋白样品中的变性剂,进而达到复性的目的。
3.3 VHH多克隆抗体的制备
多克隆抗体是应用于免疫防治、基础研究中的常见手段之一。为获得高质量的多抗,理论上应使用同一批次的抗原免疫小鼠,但由于重组VHH蛋白稳定性较差,故需使用新鲜制备的蛋白进行免疫,为弥补这一不足,本研究中将4次免疫的蛋白终浓度均调整为50 μg/mL,并进行一次加强免疫。DOT-ELISA和Western-blot结果表明,采用本方法制备的VHH多抗效价高达1∶163 840,均可识别重组蛋白和天然蛋白且特异性高。对该多抗活性检测发现,自制的多抗对哈维氏弧菌溶血活性的体外抑制效果良好。本研究结果对VHH单抗的制备、哈维氏弧菌检测手段的完善、哈维氏弧菌的疫苗研发及相关科研工作的开展均具有一定参考价值。
[1] Nguyen H T,Thu Nguyen T T,Tsai M A,et al.A formalin-inactivated vaccine provides good protection against Vibrio harveyi infection in orange-spotted grouper (Epinephelus coioides)[J].Fish & Shellfish Immunology,2017,65:118-126.
[2] Chen Ting,Wong N K,Jiang Xiao,et al.Nitric oxide as an antimicrobial molecule against Vibrio harveyi infection in the hepatopancreas of Pacific white shrimp,Litopenaeus vannamei[J].Fish & Shellfish Immunology,2015,42(1):114-120.
[3] Dubert J,Nelson D R,Spinard E J,et al.Following the infection process of vibriosis in Manila clam (Ruditapes philippinarum) larvae through GFP-tagged pathogenic Vibrio species[J].Journal of Invertebrate Pathology,2016,133:27-33.
[4] 姚志贤.半滑舌鳎皮肤溃疡病病原及免疫保护研究[D].厦门:集美大学,2012.
[5] 华昕彤,刘鹰,陈冰,等.红鳍东方鲀感染哈氏弧菌前后组织中socs3基因的表达差异分析[J].大连海洋大学学报,2019,34(1):33-40.
[6] Medina A,Mancera J M,Martínez-Manzanares E,et al.Identification of Vibrio harveyi proteins involved in the specific immune response of Senegalese sole (Solea senegalensis,Kaup)[J].Fish & Shellfish Immunology,2015,47(1):377-380.
[7] Austin B,Zhang Xiaohua.Vibrio harveyi:a significant pathogen of marine vertebrates and invertebrates[J].Letters in Applied Microbiology,2006,43(2):119-124.
[8] 张晓华,钟英斌,陈吉祥.哈维氏弧菌的生物学特性、流行病学及检测技术[J].中国海洋大学学报,2007,37(5):740-748.
[9] Ruwandeepika H A D,Jayaweera T S P,Bhowmick P P,et al.Pathogenesis,virulence factors and virulence regulation of vibrios belonging to the Harveyi clade[J].Reviews in Aquaculture,2012,4(2):59-74.
[10] Zhang Xiaohua,Austin B.Pathogenicity of Vibrio harveyi to salmonids[J].Journal of Fish Diseases,2000,23(2):93-102.
[11] Zhang Xiaohua,Meaden P G,Austin B.Duplication of hemolysin genes in a virulent isolate of Vibrio harveyi[J].Applied and Environmental Microbiology,2001,67(7):3161-3167.
[12] 白方方.哈维氏弧菌VHH溶血素对牙鲆组织细胞的侵染作用及诱导细胞凋亡作用研究[D].青岛:中国海洋大学,2010.
[13] Wang Jianfeng,Qiu Jiazhang,Tan Wei,et al.Fisetin inhibits Listeria monocytogenes virulence by interfering with the oligomerization of listeriolysin O[J].The Journal of Infectious Diseases,2015,211(9):1376-1387.
[14] Raghunath P.Roles of thermostable direct hemolysin (TDH) and TDH-related hemolysin (TRH) in Vibrio parahaemolyticus[J].Frontiers in Microbiology,2014,5:805.
[15] Diabate M,Munro P,Garcia E,et al.Escherichia coli α-hemolysin counteracts the anti-virulence innate immune response triggered by the rho GTPase activating toxin CNF1 during bacteremia[J].PLoS Pathogens,2015,11(3):e1004732.
[16] Hermann I,Räth S,Ziesemer S,et al.Staphylococcus aureus hemolysin A disrupts cell-matrix adhesions in human airway epithelial cells[J].American Journal of Respiratory Cell and Molecular Biology,2015,52(1):14-24.
[17] Sørensen H P,Mortensen K K.Advanced genetic strategies for recombinant protein expression in Escherichia coli[J].Journal of Biotechnology,2005,115(2):113-128.
[18] Mierendorf R C,Morris B B,Hammer B,et al.Expression and purification of recombinant proteins using the pET system[J].Methods in Molecular Medicine,1998,13:257-292.
[19] 钟英斌.哈维氏弧菌VHH溶血素的过量表达、纯化、性质及致病性研究[D].青岛:中国海洋大学,2006.
[20] 吉清,何凤田.包涵体复性的研究进展[J].国外医学临床生物化学与检验学分册,2004,25(6):516-518.
[21] 邝爱丽,陈圆圆,彭志峰,等.包涵体的形成原因及其处理方法[J].上海畜牧兽医通讯,2009(1):62-63.
[22] 郭蔼光.基础生物化学[M].北京:高等教育出版社,2001.