虹鳟Oncorhynchus mykiss是中国重要的冷水性养殖鱼类,具有较高的营养和经济价值[1]。近年来,为了满足庞大的市场需求量,虹鳟养殖的集约化程度不断提升[2],这种高密度的养殖模式导致虹鳟肌肉品质下降、免疫降低、疾病暴发,甚至大量死亡。然而,随着社会发展和生活水平的提高,人们对虹鳟肌肉品质的要求也越来越高。大量研究表明,中草药具有改善鱼类肉质、增强免疫力、防治疾病等药理功能,可作为一种安全高效、环保价廉的饲料添加剂[3]。 在团头鲂饲料中添加杜仲和大蒜素,可显著提高团头鲂肌肉蛋白质和鲜味氨基酸含量及其生长性能[4]。在施氏鲟饲料中添加茯苓、白芍、鱼腥草和大黄复方制剂,能增加施氏鲟肌肉蛋白质含量[5]。
杜仲Eucommia ulmoides Oliver作为一种传统的滋补中药材,在中国和亚洲其他地区使用历史悠久,基于传统中医学理论,其药理学和生理学功能包括强筋健骨、保肝护肾和降低血压等[6]。研究发现,杜仲皮和杜仲叶中含有112种化合物,其主要生物活性物质为绿原酸、桃叶珊瑚苷、京尼平苷酸和京尼平苷[7]。在畜禽动物如猪[8] 、羊[9]、鸡[10]饲料中添加杜仲叶可显著影响其生长性能,增强免疫力,改善肌肉品质。而在水产动物中,本研究团队前期研究发现,饲料添加浓度为4%的杜仲皮水提物可以改善虹鳟肌肉品质,显著增加肌肉弹力与弹性、肌肉胶着性、咀嚼性、肌肉内聚性,并显著减小肌肉肌纤维直径,增大肌纤维密度[11]。此外,在草鱼[12]、异育银鲫[13]、中华鳖[14]、鳗鲡[15] 和凡纳滨对虾[16] 等饲料中添加杜仲叶或杜仲提取物也有改善肌肉品质的功效。
动物肠道内生活着大量的真核微生物、细菌、古菌和病毒等微生物,它们共同组成肠道微生态系统,被誉为是机体自身的黑匣子,并共同维持着整个肠道生态系统的平衡与稳定[17]。研究发现,杜仲在促进水产动物物质代谢、增强免疫及改善肉质等方面功效显著[13-14]。本研究中,将不同浓度杜仲皮水提物添加到虹鳟基础饲料中,探讨了其对虹鳟生长、肠道组织学及肠道菌群多样性的影响,以期为杜仲在虹鳟饲料中的应用提供科学依据。
1 材料与方法
1.1 材料
试验用虹鳟幼鱼购自贵州丽水生态农业有限公司,初始体质量为(145.56±4.12) g。基础饲料购自山东升索渔用饲料研究中心,其主要营养成分含量为粗蛋白质42.0%、粗脂肪18.0%、粗纤维6.0%、粗灰分8.0%。杜仲皮购自贵州省贵阳市援生医院(产地:四川省古蔺县)。
1.2 方法
1.2.1 试验饲料的配制 杜仲皮水提物的制备:将杜仲皮粉碎后过60目筛网,称取处理好的杜仲皮粉末0、5.0、10.0、20.0、 40.0 g,分别置于1000 mL无菌蒸馏水中,连续熬制4 h,药液经300目尼龙滤网过滤,获取滤液,小火将滤液熬制浓缩到100 mL,得到浓度分别为0、0.5%、1%、2%、4%的水提物。杜仲皮水提物主要营养组成及生物活性物质含量见表1。
表1 杜仲皮水提物主要营养物质和生物活性成分含量
Tab.1 Primary nutritional and bioactive components of aqueous extract of Eucommia ulmoides Oliver bark
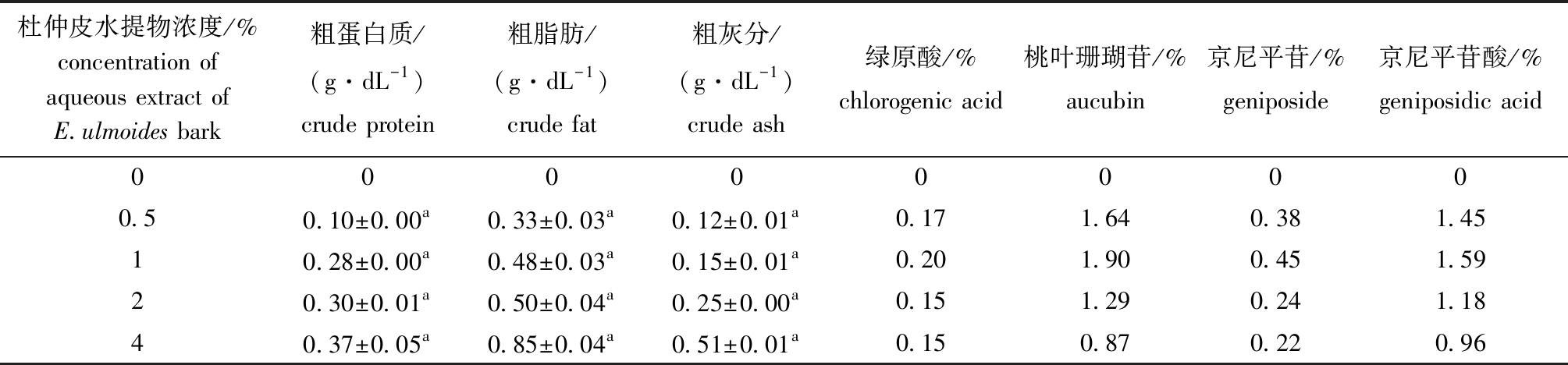
杜仲皮水提物浓度/%concentration of aqueous extract ofE.ulmoides bark 粗蛋白质/(g·dL-1)crude protein粗脂肪/(g·dL-1)crude fat粗灰分/(g·dL-1)crude ash 绿原酸/%chlorogenic acid桃叶珊瑚苷/%aucubin京尼平苷/%geniposide京尼平苷酸/%geniposidic acid000000000.50.10±0.00a0.33±0.03a0.12±0.01a0.171.640.381.4510.28±0.00a0.48±0.03a0.15±0.01a0.201.900.451.5920.30±0.01a0.50±0.04a0.25±0.00a0.151.290.241.1840.37±0.05a0.85±0.04a0.51±0.01a0.150.870.220.96
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia
不同浓度杜仲皮水提物饲料的制备:将虹鳟基础饲料用粉碎机粉碎,过40目筛。分别量取100 mL不同浓度的杜仲皮水提物(0、0.5%、1%、2%、4%)和300 mL蒸馏水与1 kg已粉碎的虹鳟基础饲料混匀,经制粒机制作成粒径为1 mm的颗粒饲料,自然风干,于无菌塑料密封袋中-20 ℃下保存备用。
1.2.2 试验设计 试验选择体质健康、大小均匀的虹鳟幼鱼450尾,随机分为5个试验组,记为A、B、C、D、E组,每组设3个重复,每个重复30尾,分别投喂含0、0.5%、1%、2%、4%杜仲皮水提物的试验饲料。
1.2.3 饲养管理 本试验于贵州丽水生态农业有限公司贵州大山三文鱼养殖场内进行,试验共有15个网箱(1.0 m×1.0 m×1.2 m),将网箱分别置于3个室外流水养殖池(18.0 m×3.8 m×1.2 m)中。每个网箱分别投放30尾虹鳟幼鱼,网箱有效水体积为 600 L。在自然光照条件下,养殖周期为10周,每天投喂 4次(9:00、12:00、15:00和 18:00),缓慢投喂(每隔5 min投喂一次),至饱食为准。养殖期间,水温为12.8~14.1 ℃,溶解氧大于7.5 mg/L,水流速度为0.04 m/s,氨氮浓度小于0.05 mg/L,pH 为7.6~8.4。
1.2.4 样品采集 饲养试验结束后,禁食24 h后对每个重复中的虹鳟进行称重(终末体质量),用于特定生长率的计算;从每个重复中随机抽取3尾虹鳟,取其背部白肌150 g左右,剪碎成均匀的混合物,用于其肌肉粗蛋白质、粗脂肪含量的测定;从每个重复中随机抽取2尾虹鳟,在无菌解剖盘中取其肠道组织,用生理盐水冲洗肠道,然后将肠道组织置于4%多聚甲醛固定液中,用于制作肠道组织切片;从每个重复中随机抽取3尾虹鳟,用75%的酒精棉球擦拭鱼体,无菌环境中剪取肠道组织,用无菌生理盐水冲洗肠道外壁2~3次后置于无菌离心管中,用液氮速冻后于超低温冰箱(-80 ℃)中保存,用于肠道菌群分析。
1.2.5 指标的测定与计算
(1) 生长性能。特定生长率 (SGR,%/d)和存活率(SR,%)计算公式为
SGR= (lnWt-lnW0)/t×100%,
SR=Nt/ N0 ×100%。
其中:W0和 Wt 分别为试验初始和终末虹鳟体质量(g);t为试验时间 (d);N0和 Nt 分别为试验初始和终末虹鳟个体数量(ind.)。
(2) 营养成分。采用105 ℃烘干恒重法、凯氏定氮法(GB/T 6432—1986)、索氏抽提法(GB/T 5009.6—2016)分别测定基础饲料、杜仲皮水提物与虹鳟肌肉中的水分、粗蛋白质和粗脂肪含量。
(3) 杜仲皮水提物生物活性成分。杜仲皮水提物处理后使用高效液相色谱仪进行检测,色谱柱为资生堂 CAPCELL PAK-C18(柱长250 mm ×内径2.5 mm,粒径5 μm)。
(4) 肠道组织学。将多聚甲醛固定液中的虹鳟肠道组织取出,依次经过冲洗、梯度浓度乙醇脱水、二甲苯透明、石蜡包埋后,用切片机连续切片(厚度为6 μm),烘干、脱蜡后复水,用苏木精-伊红(H.E)染色,中性树胶封片。采用(BA400Digital)数码三目摄像显微镜观察并拍照。
(5) 肠道菌群。根据 E.Z.N.A.® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)说明书进行总DNA抽提,利用338F (5′ACTCCTACGGGAGGCAGCAG 3′)和806R (5′GGACTACHVGGGTWTCTAAT 3′)引物对V3-V4可变区进行PCR扩增,在Illumina公司的Miseq PE300平台进行测序并分析,分析过程包括数据优化、序列统计、OTU分析、丰度及Alpha多样性分析(Shannon、Simpson、Ace、Chao1指数),并在不同的分类水平下对不同菌群分布的均匀度进行统计。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 19统计软件进行单因素方差分析(One-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 饲料添加杜仲皮水提物后虹鳟生长性能和肌肉营养成分的变化
从表2可见:各试验组间的初始体质量、终末体质量、特定生长率和存活率均无显著性差异(P>0.05);各试验组间的肌肉粗蛋白质含量均无显著性差异(P>0.05);4%添加组肌肉粗脂肪含量显著高于其他组(P<0.05),0.5%、1%和2%添加组间粗脂肪含量无显著性差异(P>0.05),但均显著高于对照组(P<0.05)。
表2 杜仲皮水提物对虹鳟生长性能和肌肉营养成分(湿质量)的影响
Tab.2 Effects of aqueous extract of Eucommia ulmoides Oliver bark on growth performance and proximate composition (wet weight)in muscle of rainbow trout
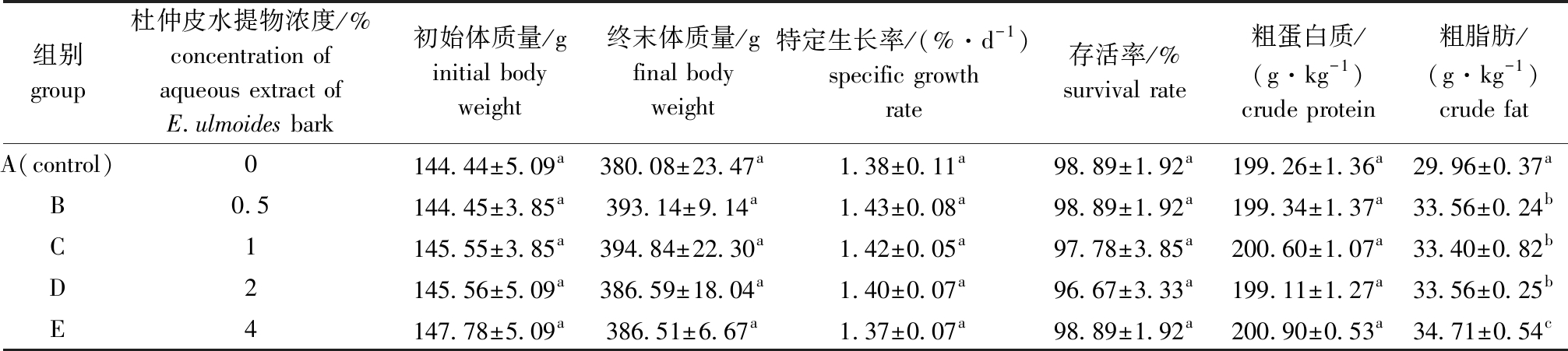
组别group杜仲皮水提物浓度/%concentration of aqueous extract ofE.ulmoides bark 初始体质量/ginitial body weight终末体质量/gfinal body weight特定生长率/(%·d-1)specific growth rate存活率/%survival rate粗蛋白质/(g·kg-1)crude protein粗脂肪/(g·kg-1)crude fatA(control)0144.44±5.09a380.08±23.47a1.38±0.11a98.89±1.92a199.26±1.36a29.96±0.37aB0.5144.45±3.85a393.14±9.14a1.43±0.08a98.89±1.92a199.34±1.37a33.56±0.24bC1145.55±3.85a394.84±22.30a1.42±0.05a97.78±3.85a200.60±1.07a33.40±0.82bD2145.56±5.09a386.59±18.04a1.40±0.07a96.67±3.33a199.11±1.27a33.56±0.25bE4147.78±5.09a386.51±6.67a1.37±0.07a98.89±1.92a200.90±0.53a34.71±0.54c
2.2 饲料添加杜仲皮水提物后肠道组织形态的变化
从图1可见:各试验组肠道黏膜皱襞、固有膜及肌层结构完整,未见坏死脱落;其中,0.5%、1%和2%添加组杯状细胞数量明显增多,而对照组、4%添加组杯状细胞数量正常;对照组、0.5%添加组肠上皮细胞结构完整;对照组肠绒毛排列整齐,0.5%添加组肠绒毛排列不整齐,1%、2%和4%添加组肠绒毛排列稍欠整齐;0.5%、1%、2%和4%添加组肠上皮细胞数量正常。
2.3 虹鳟肠道菌群测序数据的变化
使用Illumina MiSeq测序平台对肠道菌群16S rDNA的V3-V4 可变区进行测序,从5个杜仲皮水提物添加组的15个样品中共获得549 770条优质细菌序列用于分析,序列平均长度为444.12 bp。通过归类分析,共获得268个OTUs,所有OTUs在Silva数据库(SSU123)进行Blast比对后,所获OTUs归类于18个门106个科184个属。
从表3可见:随着杜仲皮水提物浓度的增加,有效序列呈现减少的趋势,但各组间无显著性差异(P>0.05);平均长度随着杜仲皮水提物浓度的增加而增加,其中,4%添加组最长,为450 bp,且显著高于0.5%添加组(P<0.05);0.5%添加组GC含量最高,为48.87%,且与对照组和1%添加组相比无显著性差异(P>0.05),但显著高于2%、4%添加组(P<0.05);各试验组的Q20值和Q30值均无显著性差异(P>0.05)。
表3 肠道菌群测序结果
Tab.3 Sequencing results of gut microbiota
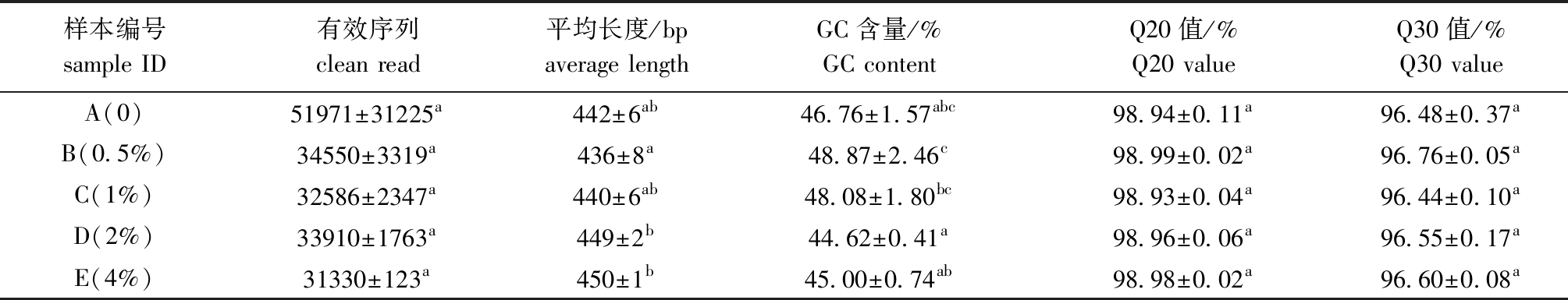
样本编号sample ID有效序列clean read平均长度/bpaverage lengthGC含量/%GC contentQ20值/%Q20 valueQ30值/%Q30 valueA(0)51971±31225a442±6ab46.76±1.57abc98.94±0.11a96.48±0.37aB(0.5%)34550±3319a436±8a48.87±2.46c98.99±0.02a96.76±0.05aC(1%)32586±2347a440±6ab48.08±1.80bc98.93±0.04a96.44±0.10aD(2%)33910±1763a449±2b44.62±0.41a98.96±0.06a96.55±0.17aE(4%)31330±123a450±1b45.00±0.74ab98.98±0.02a96.60±0.08a
2.4 虹鳟肠道菌群Alpha多样性的变化
从表4可见:各杜仲皮水提物添加组OTUs数、Ace指数、Chao1指数较对照组有降低的趋势,但均无显著性差异(P>0.05);Simpson指数以2%添加组最高(0.80),且与4%添加组无显著性差异(P>0.05),但二者均显著高于0.5%、1%添加组(P<0.05);Shannon指数以1%添加组最高(1.65),且显著高于2%、4%添加组(P<0.05),但与对照组、0.5%添加组无显著性差异(P>0.05)。各样本文库的覆盖率是反映本次测序结果是否代表了样本中微生物的真实情况,其数值越高,样本中序列被测出的概率就越高,而未被测出的概率越低。本次测序深度指数覆盖率在各个试验组间均大于0.999,说明本次测序已基本上覆盖虹鳟肠道内所有的微生物。
表4 肠道菌群Alpha多样性统计结果
Tab.4 Alpha diversities of gut microbiota
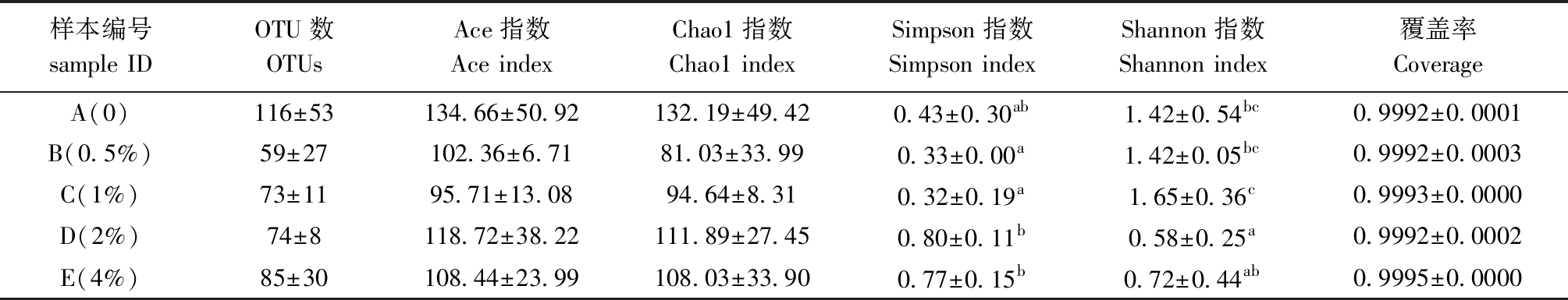
样本编号sample IDOTU数OTUsAce指数Ace indexChao1指数Chao1 indexSimpson指数Simpson indexShannon指数Shannon index覆盖率CoverageA(0)116±53134.66±50.92132.19±49.420.43±0.30ab1.42±0.54bc0.9992±0.0001B(0.5%)59±27102.36±6.7181.03±33.990.33±0.00a1.42±0.05bc0.9992±0.0003C(1%)73±1195.71±13.0894.64±8.310.32±0.19a1.65±0.36c0.9993±0.0000D(2%)74±8118.72±38.22111.89±27.450.80±0.11b0.58±0.25a0.9992±0.0002E(4%)85±30108.44±23.99108.03±33.900.77±0.15b0.72±0.44ab0.9995±0.0000
2.5 虹鳟肠道菌群Beta多样性的变化
基于OTUs水平的主成分分析(PCA) 结果见图2,其中主成分1(PC1)为第1主坐标,对所检测到的肠道总微生物的代表性贡献率为89.53%,主成分2(PC2) 为第 2主坐标,贡献率为8.02%。
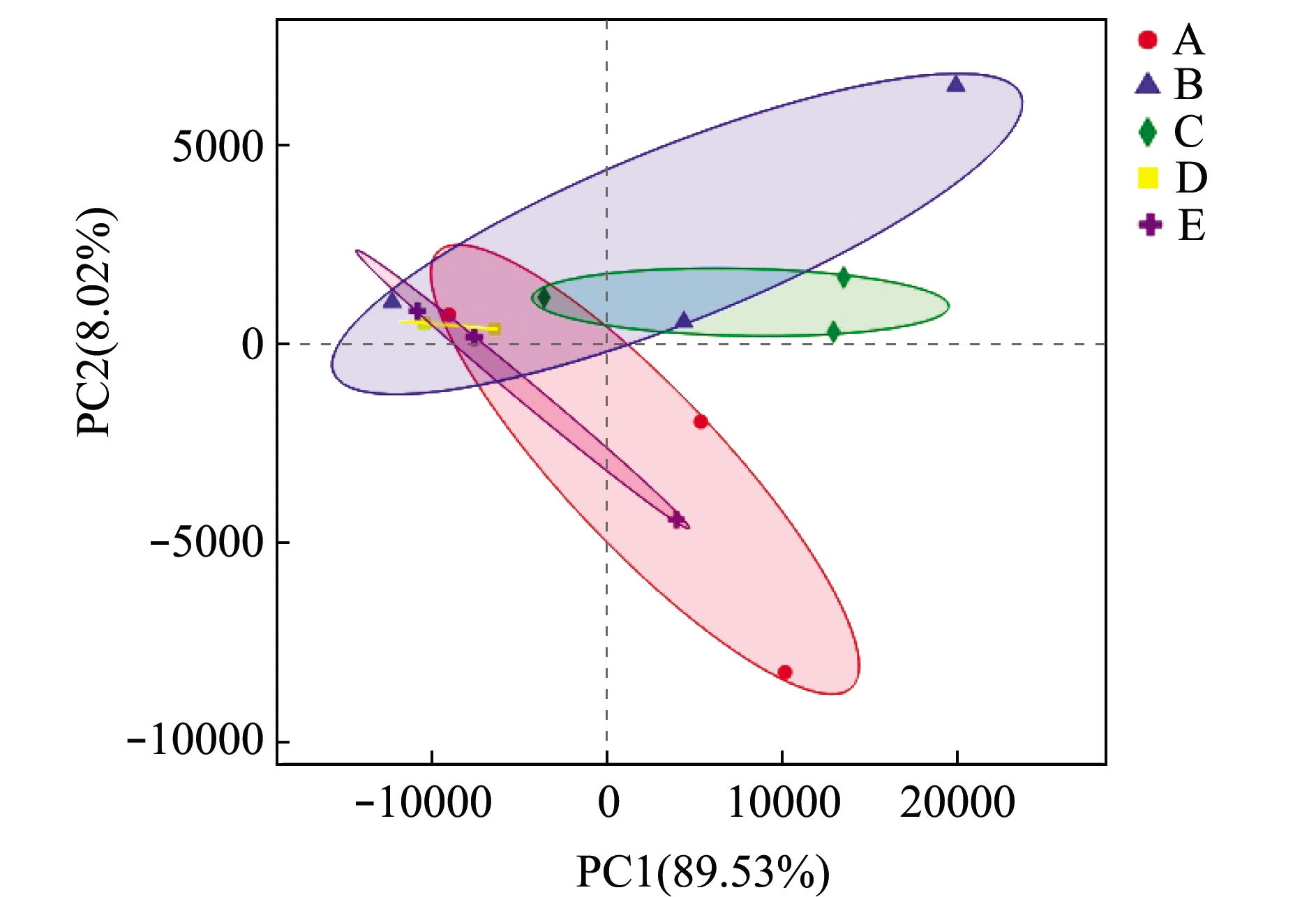
图2 PCA分析结果
Fig.2 Analysis results of principal component analysis(PCA)
2.6 门分类水平下肠道菌群结构分析
在门分类水平进行肠道菌群结构分析,这些菌群在分类学上主要归属于6个门,分别是软壁菌门Tenericutes、厚壁菌门Firmicutes、梭杆菌门Fusobacteria、变形杆菌门Proteobacteria、放线菌门Actinobacteria和拟杆菌门Bacteroidetes,其中,Tenericutes、Firmicutes、Fusobacteria和Proteobacteria是4大优势菌门(图3)。
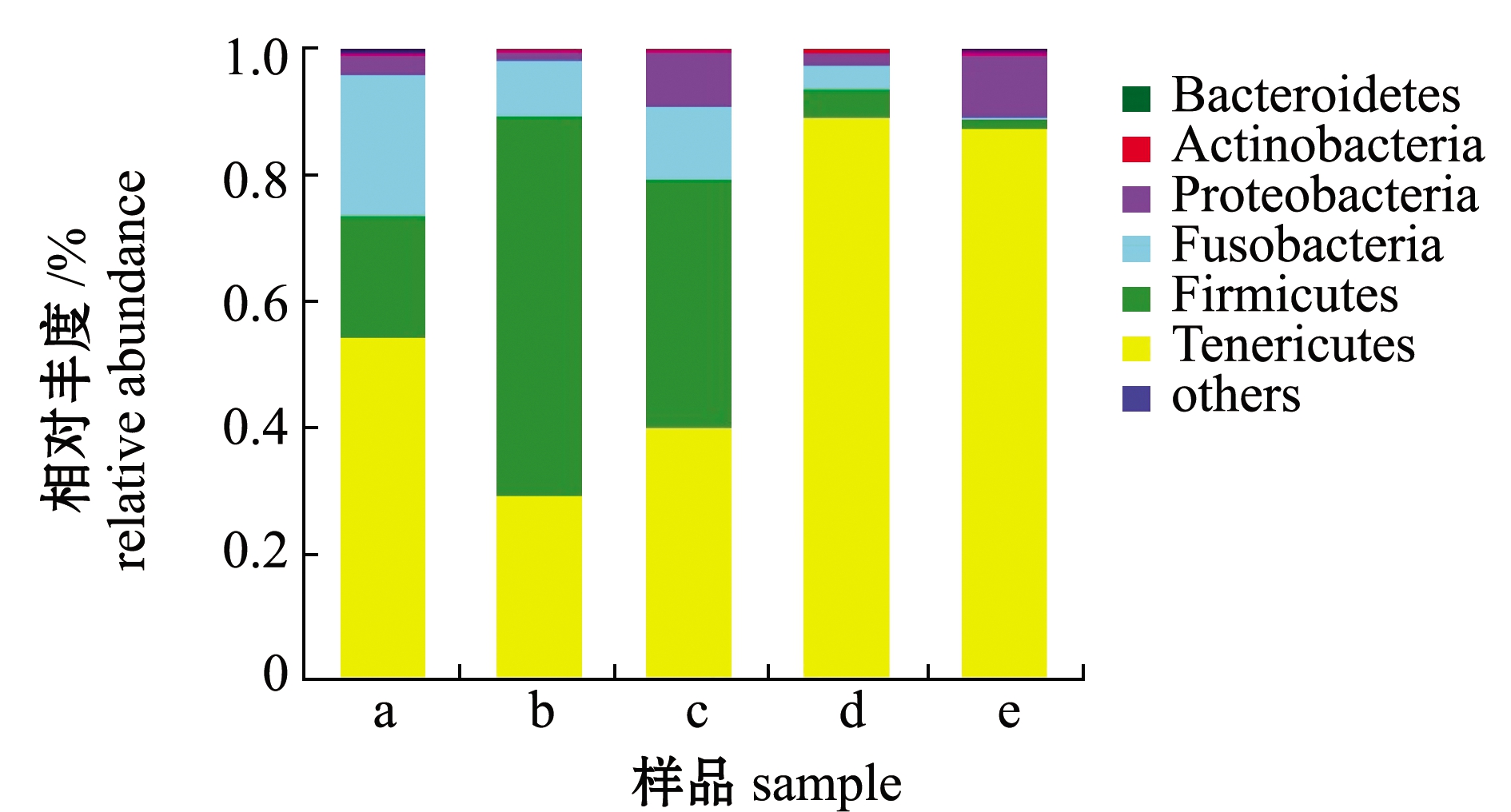
图3 虹鳟肠道菌群门分类水平相对丰度
Fig.3 Relative abundance of gut microbiota in rainbow trout at phylum level
2.7 科、属分类水平下肠道菌群结构分析
采用Wilcoxon秩和检验方法,对组间菌群差异显著性进行检验分析,设置显著性水平为0.05。表5为纲(class)、目(order)、科(family)、属(genus)和种(species)分类水平下显著变化的所有肠道菌群。
表5 杜仲皮水提物对纲、目、科、属和种水平下显著差异菌群的影响
Tab.5 Significant variation in microbiota at class, order, family, genus and species levels among different aqueous extract concentrations of Eucommia ulmoides Oliver bark
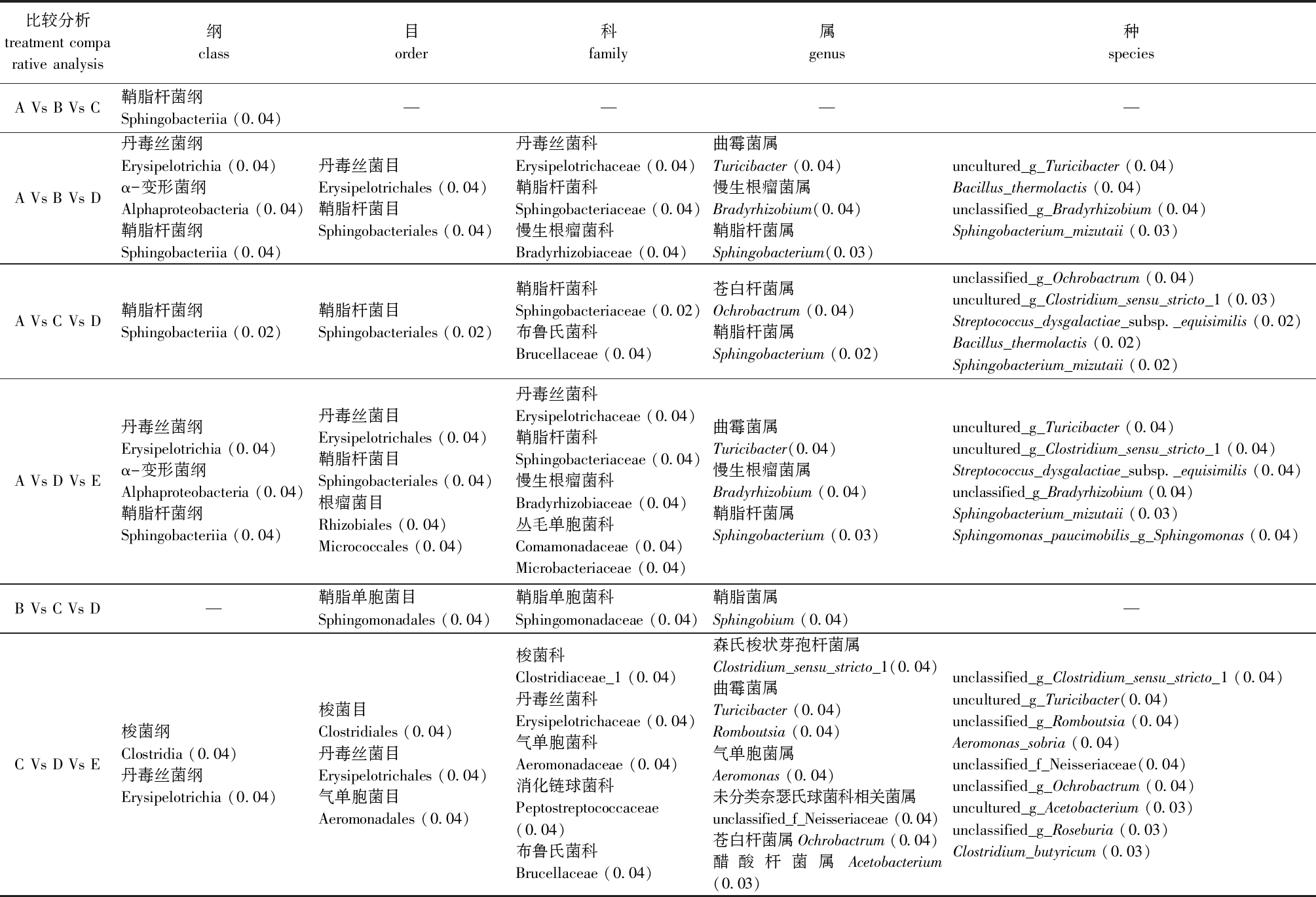
比较分析treatment comparative analysis纲class目order科family属genus种speciesA Vs B Vs C鞘脂杆菌纲Sphingobacteriia (0.04)————A Vs B Vs D丹毒丝菌纲Erysipelotrichia (0.04)α-变形菌纲Alphaproteobacteria (0.04)鞘脂杆菌纲Sphingobacteriia (0.04)丹毒丝菌目Erysipelotrichales (0.04)鞘脂杆菌目Sphingobacteriales (0.04)丹毒丝菌科Erysipelotrichaceae (0.04)鞘脂杆菌科Sphingobacteriaceae (0.04)慢生根瘤菌科Bradyrhizobiaceae (0.04)曲霉菌属Turicibacter (0.04)慢生根瘤菌属Bradyrhizobium(0.04) 鞘脂杆菌属Sphingobacterium(0.03)uncultured_g_Turicibacter (0.04)Bacillus_thermolactis (0.04) unclassified_g_Bradyrhizobium (0.04)Sphingobacterium_mizutaii (0.03)A Vs C Vs D鞘脂杆菌纲Sphingobacteriia (0.02)鞘脂杆菌目Sphingobacteriales (0.02)鞘脂杆菌科Sphingobacteriaceae (0.02)布鲁氏菌科Brucellaceae (0.04)苍白杆菌属Ochrobactrum (0.04)鞘脂杆菌属Sphingobacterium (0.02)unclassified_g_Ochrobactrum (0.04) uncultured_g_Clostridium_sensu_stricto_1 (0.03)Streptococcus_dysgalactiae_subsp._equisimilis (0.02) Bacillus_thermolactis (0.02)Sphingobacterium_mizutaii (0.02)A Vs D Vs E丹毒丝菌纲Erysipelotrichia (0.04)α-变形菌纲Alphaproteobacteria (0.04)鞘脂杆菌纲Sphingobacteriia (0.04)丹毒丝菌目Erysipelotrichales (0.04)鞘脂杆菌目Sphingobacteriales (0.04)根瘤菌目Rhizobiales (0.04) Micrococcales (0.04)丹毒丝菌科Erysipelotrichaceae (0.04)鞘脂杆菌科Sphingobacteriaceae (0.04) 慢生根瘤菌科Bradyrhizobiaceae (0.04)丛毛单胞菌科Comamonadaceae (0.04) Microbacteriaceae (0.04)曲霉菌属Turicibacter(0.04) 慢生根瘤菌属Bradyrhizobium (0.04)鞘脂杆菌属Sphingobacterium (0.03)uncultured_g_Turicibacter (0.04) uncultured_g_Clostridium_sensu_stricto_1 (0.04) Streptococcus_dysgalactiae_subsp._equisimilis (0.04) unclassified_g_Bradyrhizobium (0.04) Sphingobacterium_mizutaii (0.03) Sphingomonas_paucimobilis_g_Sphingomonas (0.04)B Vs C Vs D—鞘脂单胞菌目Sphingomonadales (0.04)鞘脂单胞菌科Sphingomonadaceae (0.04)鞘脂菌属Sphingobium (0.04)—C Vs D Vs E梭菌纲Clostridia (0.04)丹毒丝菌纲 Erysipelotrichia (0.04)梭菌目Clostridiales (0.04) 丹毒丝菌目Erysipelotrichales (0.04) 气单胞菌目Aeromonadales (0.04)梭菌科Clostridiaceae_1 (0.04) 丹毒丝菌科Erysipelotrichaceae (0.04) 气单胞菌科Aeromonadaceae (0.04) 消化链球菌科Peptostreptococcaceae (0.04)布鲁氏菌科Brucellaceae (0.04)森氏梭状芽孢杆菌属Clostridium_sensu_stricto_1(0.04) 曲霉菌属Turicibacter (0.04)Romboutsia (0.04)气单胞菌属Aeromonas (0.04)未分类奈瑟氏球菌科相关菌属unclassified_f_Neisseriaceae (0.04)苍白杆菌属Ochrobactrum (0.04)醋酸杆菌属Acetobacterium (0.03)unclassified_g_Clostridium_sensu_stricto_1 (0.04)uncultured_g_Turicibacter(0.04) unclassified_g_Romboutsia (0.04)Aeromonas_sobria (0.04) unclassified_f_Neisseriaceae(0.04) unclassified_g_Ochrobactrum (0.04)uncultured_g_Acetobacterium (0.03) unclassified_g_Roseburia (0.03) Clostridium_butyricum (0.03)
由表6可知,在肠道有害菌群中,随着杜仲皮水提物浓度的增加,大部分有害菌群的丰度较对照组显著降低,而有益菌群的丰度较对照组显著升高。在科分类水平上进行肠道菌群功能分析可知,与对照组相比,所有科水平有害菌群物种丰度在2%添加组肠道中均显著下降(P<0.05),4%添加组中Brucellaceae、Sphingomonadaceae科则显著升高(P<0.05);4%组肠道有益菌群慢生根瘤菌科Bradyrhizobiaceae、丛毛单胞菌科Comamonadaceae物种丰度显著升高(P<0.05)。在属分类水平下进行分析可知,与对照组相比,所有属水平有害菌群物种丰度在2%组肠道中均显著下降(P<0.05);4%组中有害菌群Aeromonas和Clostridium属丰度显著降低(P<0.05)。
表6 杜仲皮水提物对有益、有害菌群物种丰度的影响
Tab.6 Effects of aqueous extract of Eucommia ulmoides Oliver bark on abundance of beneficial/harmful pathogenic bacteria
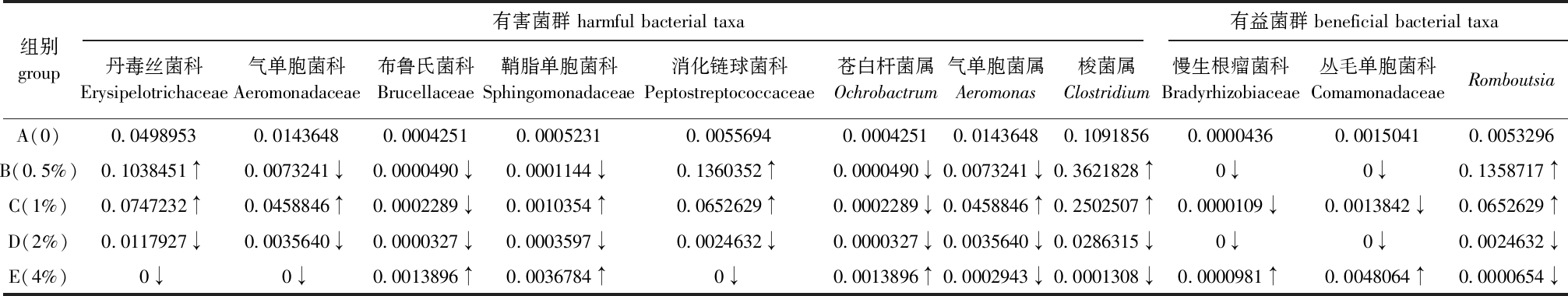
组别group有害菌群 harmful bacterial taxa有益菌群 beneficial bacterial taxa丹毒丝菌科Erysipelotrichaceae气单胞菌科Aeromonadaceae布鲁氏菌科Brucellaceae鞘脂单胞菌科Sphingomonadaceae消化链球菌科Peptostreptococcaceae苍白杆菌属Ochrobactrum气单胞菌属Aeromonas梭菌属Clostridium慢生根瘤菌科Bradyrhizobiaceae丛毛单胞菌科ComamonadaceaeRomboutsiaA(0)0.04989530.01436480.00042510.00052310.00556940.00042510.01436480.10918560.00004360.00150410.0053296B(0.5%)0.1038451↑0.0073241↓0.0000490↓0.0001144↓0.1360352↑0.0000490↓0.0073241↓0.3621828↑0↓0↓0.1358717↑C(1%)0.0747232↑0.0458846↑0.0002289↓0.0010354↑0.0652629↑0.0002289↓0.0458846↑0.2502507↑0.0000109↓0.0013842↓0.0652629↑D(2%)0.0117927↓0.0035640↓0.0000327↓0.0003597↓0.0024632↓0.0000327↓0.0035640↓0.0286315↓0↓0↓0.0024632↓E(4%)0↓0↓0.0013896↑0.0036784↑0↓0.0013896↑0.0002943↓0.0001308↓0.0000981↑0.0048064↑0.0000654↓
注:↑为与对照组相比显著升高;↓为与对照组相比显著降低
Note:↑ shows significant increase compared with control group; ↓ means significant decrease compared with control group

注:A为0%组;B为 0.5%组;C为1%组;D为 2%组;E为 4%组。MF为黏膜皱襞; M为肌层; TP为固有膜; MV为微绒毛; EH为肠上皮细胞; GC为杯状细胞
Note: A, control group; B, 0.5% group; C, 1% group; D, 2% group; E, 4% group. MF, mucosal fold; M, muscularis; TP, tunica propria; MV, microvillus; EH, enterocyte; GC, goblet cell
图1 杜仲皮水提物对虹鳟肠道组织学结构的影响
Fig.1 Effects of aqueous extract of Eucommia ulmoides Oliver bark on intestinal histological structure of rainbow trout
3 讨论
3.1 杜仲皮水提物对虹鳟生长的影响
目前,杜仲对动物生长性能的影响效果结论不一致。有研究表明,杜仲可改善养殖动物的生长性能。在畜禽动物中,在鸡饲料中添加25 g/kg的杜仲可使肉仔鸡的平均日采食增加3.2%,存活率提高9.2%[18]。在猪饲料中添加1.5%杜仲,可显著提高猪日增重,降低料重比和日均腹泻评分[19];在猪饲料中添加0.08%杜仲提取物可显著提高育肥猪终末体质量和平均增重率[20]。在水产动物中,饲料中添加0.15%杜仲提取物可提高动物的增重率,其中,与对照组相比,罗非鱼增加27.09%[21]、草鱼增加8.57%[22],异育银鲫增加12.9%[13];饲料中添加6%杜仲叶粉可提高鲤增重率,较对照组增加21.5%[23];在草鱼饲料中添加4%[12]、凡纳滨对虾饲料中添加2%[16]杜仲,均能显著改善养殖动物的生长性能。也有研究表明,杜仲能显著抑制动物的生长性能,如在大菱鲆饲料中添加20 g/kg的杜仲叶粉可显著降低大菱鲆终末体质量、增重率和特定生长率,但能显著提高其抗氧化能力与非特异性免疫力[24]。也有研究表明,杜仲对养殖动物生长性能无显著性影响,如在饲料中添加1.0%杜仲对中华绒螯蟹生长性能无显著性影响[25];在饲料中添加1%的杜仲叶对羊[26]和鸡[27]生长性能均无显著性影响。本试验中,饲料中添加杜仲皮水提物对虹鳟的生长性能也无显著性影响,本试验结果属于最后一种情况,杜仲对动物生长性能影响效果不一致的原因可能与动物种属差异、肠道消化吸收能力、肠道菌群差异及杜仲的选取部位等有关。
3.2 杜仲皮水提物对虹鳟肌肉营养成分的影响
本试验发现,饲料中添加杜仲皮水提物能显著提升虹鳟肌肉粗脂肪含量,其中,以4%浓度组最为明显。这与猪饲料中添加2000 mg/kg杜仲皮提取物[19]、绵羊饲料中添加20%浓度杜仲叶均能显著提高动物粗脂肪含量[28]的结论相似。这表明,杜仲可改变体内脂肪的代谢和分配,减少畜禽动物皮下脂肪的沉积,增加肌内脂肪的含量,从而改善肉的品质。然而这与对草鱼、青鱼的研究结果不一致。Sun等[29]研究报道,饲料中添加20 g/kg杜仲可降低草鱼肌肉粗脂肪含量,添加200~800 mg/kg绿原酸可显著降低草鱼肌肉粗脂肪含量。李乃顺等[30]研究指出,饲料中添加0.04%绿原酸对草鱼鱼种肌肉粗脂肪含量无显著性差异。许晓莹等[31]研究显示,饲料中添加2%杜仲对草鱼肌肉粗脂肪和粗蛋白质含量均无显著性影响。张青红[32]研究表明,饲料添加2.5%和7%杜仲叶粉可显著降低青鱼肌肉粗脂肪含量。本试验结果与上述研究结论不一致,可能与动物种类、食性、消化吸收率、肠道菌群结构和杜仲产地等有关。
3.3 杜仲皮水提物对虹鳟肠道组织学的影响
肠道是鱼类重要的消化场所,肠道组织的完整性是其行使消化能力的前提,研究肠道形态特征是了解鱼类正常或异常生理状况的必要条件。徐明涛等[33]研究表明,杜仲叶提取物能促进仔猪小肠绒毛发育,增加小肠绒毛长度,促进黏膜层增厚,且回肠淋巴小结明显增多,这表明,杜仲叶提取物可增强小肠黏膜上皮细胞自分泌ghrelin能力,促进其对营养物质的消化吸收,进而提高仔猪的生长性能并增强机体免疫力。赖星等[34]研究显示,日粮中添加绿原酸能显著提高断奶仔猪的平均日增重、平均日采食量和空肠黏膜绒毛高度,并显著降低料肉比。本试验中,随着杜仲皮水提物浓度的增加,各试验组肠道皱襞、固有膜及肌层结构完整,其中,0.5%、1%和2%杜仲皮水提物添加组杯状细胞数量有增多趋势,但对照组、4%添加组杯状细胞数量未见变化,表明杜仲皮水提物中活性成分含量能够影响虹鳟肠道内杯状细胞的生长。
3.4 虹鳟肠道菌群丰度和多样性比较
肠道菌群多样性可对宿主的新陈代谢、营养吸收及免疫功能产生重要的影响[35]。多样性指数中,Ace和Chao1指数反映群落丰富度,而Shannon和Simpson指数反映群落多样性。大多数情况下,肠道菌群多样性和丰富度越高,表明微生物的种类越丰富,微生态系统越庞大[36];不同菌群间构成的肠道菌群动态平衡是宿主正常新陈代谢的基础。隋明静[37]研究表明,仔猪饲料中添加0.05%杜仲提取物能提高其肠道菌群Shannon指数,降低Simpson指数,并增加仔猪肠道菌群多样性。本研究表明,虹鳟饲料中添加杜仲皮水提物后肠道微生物测序有效序列有所减少,Alpha多样性统计结果中OTU数、Ace指数和Chao1指数均有降低趋势,但均无显著性差异;随着杜仲皮水提物浓度的增加,Shannon指数呈先升高后降低趋势,而Simpson指数呈先降低后升高趋势,表明饲料添加杜仲皮水提物能增加虹鳟肠道菌群多样性,这与Bhandarkar等[38]得出的绿原酸能提高肠道菌群多样性的研究结果一致。而亓英姿等[39]研究发现,大鼠灌胃杜仲-刺蒺藜后肠道微生物PD-whole-tree指数有降低趋势,即Alpha多样性有降低趋势;而Wang等[40]研究显示,在小鼠饲料中添加绿原酸后肠道菌群多样性结果中OTU数、Ace和Chao1指数均有所减少,Shannon指数较对照组显著降低,Simpson指数降低但无显著性差异。这表明不同形式的杜仲提取物对动物肠道菌群多样性的影响也不一样。
3.5 科、属水平上虹鳟肠道菌群多样性比较
本研究中,饲料添加杜仲皮水提物后虹鳟肠道微生物物种丰度发生显著变化,肠道菌群优势门类为Tenericutes、Firmicutes、Fusobacteria和Proteobacteria,与Romero等[41]的研究结果一致。Romero等[41]指出,鲑科鱼类肠道主要以Proteobacteria、Firmicutes、Actinobacteria、Bacteroidetes、Fusobacteria和Tenericutes等门类为主。本研究表明,杜仲皮水提物不会影响虹鳟肠道的优势门类。然而,随着杜仲皮水提物浓度的增加,其中一些敏感菌群的丰度发生明显的变化。
总体来说,随着杜仲皮水提物浓度的增加,有害菌群的丰度明显减少,如Erysipelotrichaceae、Aeromonadaceae、Peptostreptococcaceae、Aeromonas、Clostridium,而有益菌群的丰度明显升高,其中,Bradyrhizobiaceae和Comamonadaceae以4%添加组丰度最高。研究报道,在患结直肠癌的病人肠道中Erysipelotrichaceae菌群丰度升高[42],提示该科菌群丰度升高将影响宿主健康。本研究中,2%添加组该科菌群丰度显著降低,4%添加组则降为0,这可能与杜仲皮水提物中绿原酸含量有关,上述两浓度组中绿原酸含量均为0.15%。Wang等[40]在高脂老鼠饲料中添加150 mg/kg的绿原酸可以显著抑制Erysipelotrichaceae菌的生长,改善高脂饲料引起的肠道菌群失调。Aeromonadaceae科的细菌大多数均会引起鱼类细菌性败血症和细菌性肠炎等疾病的发生[43],如嗜水气单胞菌Aeromonas hydrophila和杀鲑气单胞菌Aeromonas salmonicida。本研究中Aeromonadaceae的菌群丰度在4%组降为0。王纯[44]研究了健康与患病大西洋鲑的肠道菌群差异,指出病鱼肠道中Aeromonadaceae的某些属为优势菌群。范彩云等[45]研究发现,饲料中联合添加黄曲霉毒素B1、赭曲霉毒素A和玉米赤霉烯酮3种毒素,可以显著增加奶山羊肠道菌群中Aeromonadaceae的丰度。该科菌群丰度增加说明宿主肠道菌群发生紊乱,极易影响宿主的正常生理状态。反之菌群丰度降低,则表明对宿主产生的健康威胁程度降低,宿主的新陈代谢趋于更加稳定的状态。同样,本试验中4%添加组Peptostreptococcaceae科菌群丰度也降低为0。姜敏等[46]研究发现,感染陈氏刺棘虫的刀鲚肠道菌群中Peptostreptococcaceae菌群丰度较对照组显著升高,寄生虫对宿主的损伤主要包括机械刺激及损伤、掠夺营养和毒素作用,从而降低宿主免疫,扰乱健康的肠道生态平衡。而Ahn等[47]研究也发现,结直肠癌患者较正常人肠道中Peptostreptococcaceae含量显著增加。因此,该科菌群丰度降低表明宿主肠道健康更加趋于稳定。容祖华等[48]在间歇性断食对老年前期肥胖大鼠肠道菌群及代谢的影响研究中,首次发现Bradyrhizobiaceae与脂肪代谢相关联。在本研究中发现,4%添加组Bradyrhizobiaceae菌群丰度显著升高,同时4%添加组肌肉粗脂肪含量也显著高于其他各组,这也表明Bradyrhizobiaceae与虹鳟机体脂肪代谢密切相关。此外,Comamonadaceae在4%组的菌群丰度也显著升高。Jara等[49]指出,Comamonadaceae具有降解有机物的功能,表明该科菌群参与宿主的营养消化过程。
另外,在属分类水平中, 4%添加组Aeromonas和Clostridium丰度显著降低,Aeromonas是鱼类肠道中常见的菌属,可引起鱼类传染性败血症和疖病发生[50]。Clostridium是人和动物肠道条件致病性菌属之一,包括产气荚膜梭菌、肉毒梭菌等,其产生的毒素对宿主健康影响较大。杨俊花等[51]研究指出,脱氧雪腐镰刀菌烯醇(由禾谷镰刀菌产生的次级代谢产物,一种毒素)灌胃小鼠可显著提高肠道梭菌属菌群丰度,提示致病菌与灌胃毒素相关,宿主健康状况可能受到影响。因此,本研究中2%和4%添加组可显著降低Aeromonas和Clostridium菌群丰度,促进肠道微生态的平衡。研究表明,Romboutsia能够利用纤维素进行生长代谢,同时产生乙酸、乙醇和H2等物质[52]。本研究发现,0.5%、1%添加组Romboutsia菌群丰度显著增加,这表明适量添加杜仲皮水提物可提高虹鳟对饲料纤维素的利用率。
4 结论
(1)饲料中添加杜仲皮水提物对虹鳟生长性能无显著性影响。(2)饲料添加4%杜仲皮水提物显著提高虹鳟肌肉粗脂肪含量,但对肌肉粗蛋白质含量无显著性影响。(3)饲料添加杜仲皮水提物对虹鳟肠道皱襞结构、固有膜及肌层结构无影响,但0.5%、1%和2%添加组杯状细胞数量增多。(4)总体上随着杜仲皮水提物浓度的增加,有害菌群丰度明显减少,而有益菌群丰度明显升高,4%添加组肠道有益菌群慢生根瘤菌科Bradyrhizobiaceae、丛毛单胞菌科Comamonadaceae物种丰度显著升高。
[1] Li Yongjuan,Huang Jinqiang,Liu Zhe,et al.Transcriptome analysis provides insights into hepatic responses to moderate heat stress in the rainbow trout (Oncorhynchus mykiss)[J].Gene,2017,619:1-9.
[2] Jean-Marc R,Alexis G,Dominique H,et al.Feeding the river:the fate of feed-pellet-derived material escaping from land-based trout farms[J].Aquaculture,2018,495:172-178.
[3] Pu Hongyu,Li Xiaoyu,Du Qingbo,et al.Research progress in the application of Chinese herbal medicines in aquaculture:a review[J].Engineering,2017,3(5):731-737.
[4] 林建斌,朱庆国,梁萍,等.不同添加剂对团头鲂生长性能和肌肉品质的影响[J].福建农业学报,2015,30(7):636-641.
[5] 马玲巧,彭晓珍,李大鹏.复方中草药添加剂对施氏鲟肌肉营养成分及品质的影响[J].华中农业大学学报,2015,34(3):111-116.
[6] He Xirui,Wang Jinhui,Li Maoxing,et al.Eucommia ulmoides Oliv.:ethnopharmacology,phytochemistry and pharmacology of an important traditional Chinese medicine[J].Journal of Ethnopharmacology,2014,151(1):78-92.
[7] Zhu Mingqiang,Wen Jialong,Zhu Yahong,et al.Isolation and analysis of four constituents from barks and leaves of Eucommia ulmoides Oliver by a multi-step process[J].Industrial Crops and Products,2016,83:124-132.
[8] Lee S D,Kim H Y,Song Y M,et al.The effect of Eucommia ulmoides leaf supplementation on the growth performance,blood and meat quality parameters in growing and finishing pigs[J].Animal Science Journal,2009,80(1):41-45.
[9] Liu H W,Zhao J S,Li K,et al.Effects of chlorogenic acids-enriched extract from Eucommia ulmoides leaves on growth performance,stress response,antioxidant status and meat quality of lambs subjected or not to transport stress[J].Animal Feed Science and Technology,2018,238:47-56.
[10] 陈玉敏,黄涛,宋小珍,等.饲粮中添加杜仲叶提取物对爱拔益加肉鸡生长性能及免疫功能的影响[J].动物营养学报,2015,27(7):2224-2230.
[11] 张安青,姜海波,安苗,等.杜仲皮水提物对虹鳟生长和肌肉品质、质构特性的影响[J].动物营养学报,2019,31(4):1943-1951.
[12] 冷向军,孟晓林,李家乐,等.杜仲叶对草鱼生长、血清非特异性免疫指标和肉质影响的初步研究[J].水产学报,2008,32(3):434-440.
[13] 石英,冷向军,李小勤,等.杜仲叶提取物对异育银鲫生长、血清非特异性免疫和肌肉品质的影响[J].浙江大学学报:农业与生命科学版,2008,34(2):200-206.
[14] 温安祥,舒辉,肖洋.绿原酸对中华鳖生产性能及抗氧化能力的影响[J].动物营养学报,2010,22(3):729-733.
[15] Tanimoto S Y,Koike K,Takahashi S.Improvement in broiled meat texture of cultured eel by feeding of Tochu leaf powder[J].Bioscience,Biotechnology,and Biochemistry,1993,57(2):325-327.
[16] 刘波,冷向军,李小勤,等.杜仲对凡纳滨对虾生长、血清非特异性免疫和肌肉成分的影响[J].中国水产科学,2013,20(4):869-875.
[17] Björkstén B.The gut microbiota:a complex ecosystem[J].Clinical & Experimental Allergy,2006,36(10):1215-1217.
[18] Wang M Q,Du Y J,Ye S S,et al.Effects of Duzhong (Eucommia ulmoides Oliv.) on growth performance and meat quality in broiler chicks[J].Journal of Animal and Veterinary Advances,2012,11(9):1385-1389.
[19] 王建辉,贺建华,易宣,等.杜仲提取物对猪胴体品质及肌肉氨基酸含量的影响[J].动物营养学报,2007,19(3):269-276.
[20] Zhou Y,Ruan Z,Li X L,et al.Eucommia ulmoides Oliver leaf polyphenol supplementation improves meat quality and regulates myofiber type in finishing pigs[J].Journal of Animal Science,2016,94(S3):164-168.
[21] 谢丽玲,曹俊辉,杨素霞,等.中草药作为饲料添加剂养殖罗非鱼试验[J].水产科学,2009,28(1):11-14.
[22] 孟晓林,冷向军,李小勤,等.杜仲对草鱼鱼种生长和血清非特异性免疫指标的影响[J].上海水产大学学报,2007,16(4):329-333.
[23] 罗庆华,卢向阳,李文芳.杜仲叶粉对鲤鱼肌肉品质的影响[J].湖南农业大学学报:自然科学版,2002,28(3):224-226.
[24] Zhang Beili,Li Chaoqun,Wang Xuan,et al.The effects of dietary Eucommia ulmoides Oliver on growth,feed utilization,antioxidant activity and immune responses of turbot (Scophthalmus maximus L.)[J].Aquaculture Nutrition,2019,25(2):367-376.
[25] 季延滨,张凤东,孙学亮,等.刘寄奴和杜仲对中华绒螯蟹生长及健康指标的影响[J].经济动物学报,2015,19(1):34-40.
[26] Liu Huawei,Li Ke,Zhao Jinshan,et al.Effects of polyphenolic extract from Eucommia ulmoides Oliver leaf on growth performance,digestibility,rumen fermentation and antioxidant status of fattening lambs[J].Animal Science Journal,2018,89(6):888-894.
[27] Kim Y J,Choi I H.Evaluation of dietary Duzhong (Eucommia ulmoides Oliver) and castor aralia (Kalopanax pictus Nakai) leaf powder on growth performance,serum cholesterol,and meat quality in broilers[J].Acta Agriculturae Scandinavica,Section A—Animal Science,2013,63(4):183-189.
[28] 杨改青,王林枫,朱河水,等.杜仲叶对绵羊脂肪代谢的影响及其机理 [J].动物营养学报,2017,29(10):3635-3647.
[29] Sun W T,Li X Q,Xu H B,et al.Effects of dietary chlorogenic acid on growth,flesh quality and serum biochemical indices of grass carp (Ctenopharyngodon idella)[J].Aquaculture Nutrition,2017,23(6):1254-1263.
[30] 李乃顺,冷向军,李小勤,等.绿原酸对草鱼鱼种生长、非特异性免疫和肉质的影响[J].水生生物学报,2014,38(4):619-626.
[31] 许晓莹,李小勤,孙文通,等.杜仲对草鱼生长、肌肉品质和胶原蛋白基因表达的影响[J].水产学报,2018,42(5):787-796.
[32] 张青红.饲料中添加杜仲叶粉对青鱼生长、免疫和肉质的影响研究[D].南宁:广西大学,2015.
[33] 徐明涛,冯蕾,陈鹏,等.杜仲叶提取物对三元杂交断奶仔猪小肠内ghrelin表达的影响[J].中国兽医学报,2018,38(10):1994-2000.
[34] 赖星,陈庆菊,卢昌文,等.日粮添加绿原酸和橙皮苷对断奶仔猪生长性能与肠道功能的影响[J].畜牧兽医学报,2019,50(3):570-580.
[35] Hildebrand F,Nguyen T L A,Brinkman B,et al.Inflammation-associated enterotypes,host genotype,cage and inter-individual effects drive gut microbiota variation in common laboratory mice[J].Genome Biology,2013,14(1):27.
[36] 李晓斌,赵国栋,刘振,等.3~6月龄伊犁马肠道微生物群落多样性的研究[J].动物营养学报,2017,29(5):1535-1544.
[37] 隋明静.植物提取复方制剂对断奶仔猪生长性能、免疫机能及肠道菌群的影响[D].保定:河北农业大学,2019.
[38] Bhandarkar N S,Brown L,Panchal S K.Chlorogenic acid attenuates high-carbohydrate,high-fat diet-induced cardiovascular,liver,and metabolic changes in rats[J].Nutrition Research,2019,62:78-88.
[39] 亓英姿,姜月华,姜凌宇,等.杜仲-刺蒺藜对老龄自发性高血压大鼠肠道微生物组的影响[J].中华高血压杂志,2019,27(5):454-462.
[40] Wang Zhengyu,Lam K L,Hu Jiamiao,et al.Chlorogenic acid alleviates obesity and modulates gut microbiota in high-fat-fed mice[J].Food Science & Nutrition,2019,7(2):579-588.
[41] Romero J,Ringø E,Merrifield D L.The Gut Microbiota of Fish[M]//Merrifield D, Ringø E.Aquaculture Nutrition:Gut Health,Probiotics and Prebiotics.Chichester:John Wiley & Sons,Ltd,2014.
[42] Tegtmeier D,Riese C,Geissinger O,et al.Breznakia blatticola gen.nov.sp.nov.and Breznakia pachnodae sp.nov.,two fermenting bacteria isolated from insect guts,and emended description of the family Erysipelotrichaceae[J].Systematic and Applied Microbiology,2016,39(5):319-329.
[43] Araújo C,Mu oz-Atienza E,Nahuelquín Y,et al.Inhibition of fish pathogens by the microbiota from rainbow trout (Oncorhynchus mykiss,Walbaum) and rearing environment[J].Anaerobe,2015,32:7-14.
oz-Atienza E,Nahuelquín Y,et al.Inhibition of fish pathogens by the microbiota from rainbow trout (Oncorhynchus mykiss,Walbaum) and rearing environment[J].Anaerobe,2015,32:7-14.
[44] 王纯.芽孢杆菌V4和胶红酵母对鲑鳟鱼生长免疫及肠道菌群影响研究[D].青岛:中国科学院大学(中国科学院海洋研究所),2017.
[45] 范彩云,苏娣,李晓娇,等.黄曲霉毒素B1、赭曲霉毒素A和玉米赤霉烯酮联合对奶山羊肠道微生物的影响[J].中国畜牧兽医,2017,44(12):3418-3425.
[46] 姜敏,张希昭,杨彦平,等.陈氏刺棘虫感染对洄游型刀鲚肠道微生物群落的影响[J].中国水产科学,2019,26(3):577-585.
[47] Ahn J,Sinha R,Pei Zhiheng,et al.Human gut microbiome and risk for colorectal cancer[J].JNCI:Journal of the National Cancer Institute,2013,105(24):1907-1911.
[48] 容祖华,梁少聪,路浚齐,等.间歇性断食对老年前期肥胖大鼠肠道菌群及代谢的影响[J].南方医科大学学报,2017,37(4):423-430.
[49] Jara E,Morel M A,Lamolle G,et al.The complex pattern of codon usage evolution in the family Comamonadaceae[J].Ecological Genetics and Genomics,2018,6:1-8.
[50] Gonçalves Pessoa R B,de Oliveira W F,Marques D S C,et al.The genus Aeromonas:a general approach[J].Microbial Pathogenesis,2019,130:81-94.
[51] 杨俊花,赵志辉,郭文博,等.应用Illumina-MiSeq高通量测序技术分析脱氧雪腐镰刀菌烯醇对小鼠肠道菌群的影响[J].动物营养学报,2017,29(1):158-167.
[52] 鲁帅领,朱慧,符波,等.高温条件下混菌发酵合成气产乙酸及其群落结构[J].应用与环境生物学报,2019,25(1):164-169.