南美白对虾Penaeus vannamei学名凡纳滨对虾,在贮藏过程中极易受酶类和微生物作用的影响,产生腐败变质。目前,针对水产品的低温贮藏研究主要有微冻、流化冰和酸性电解水冰等方法,生物保鲜研究主要有壳聚糖和茶多酚等方法。这些方法都存在一定程度的不足。在微冻贮藏条件下,南美白对虾TVB-N含量在第8 天时达到38.93 mg/100 g,超出食用上限,贮藏期较短[1];流化冰贮藏在后期冰晶融化,水产品下沉与底部冰晶产生摩擦,造成交叉污染[2];酸性电解水冰贮藏后期,随着腐败胺类物质的增加,pH值升高,氧化还原电位降低,抑菌效果下降[3]。而壳聚糖的成膜性较差,生物保鲜剂存在过量残余等食品安全问题。因此,探索新的处理方式延长水产品的贮藏期具有重要意义。
目前,一种低盐-高水分的半干制品克服了传统腌干制品味道咸和质地坚硬的缺点,满足了健康食品的要求,逐渐发展成为一种新的趋势。市场上低盐-高水分的半干制品,通常含盐量在6%以内,含水率在50%~60%,属于鲜品范畴,需冷冻贮藏[4],但冻藏过程中巯基易被氧化,导致 Ca2+-ATPase活性降低,蛋白质变性,且解冻后汁液流失现象严重,损伤口感[5]。Niammuy等[6]认为,在低温真空条件下脱水,真空环境能够保留虾青素的含量。此外,低盐能够降低腌制品的脂肪氧化[7]。因此,采用冰温贮藏,同时贮藏前进行冰温真空脱水,在降低水分活度的同时,最大限度地保持虾仁新鲜度。为此,本研究中首次探讨盐渍+冰温脱水对虾仁贮藏性的影响,对4种处理方式后贮藏的虾仁样品进行对比研究,以期为虾仁贮藏的实际应用提供理论支撑。
1 材料与方法
1.1 材料
活体南美白对虾购于上海市南汇新城芦潮港农贸市场,体质量为(15.0±0.8)g,挑选同一批次且规格大小一致的活体南美白对虾用于试验。
主要试剂:邻苯二酚、L-脯氨酸、BapNA底物溶液、磷酸氢二钠、磷酸二氢钠、硫代巴比妥酸、三氯乙酸和二甲基亚砜等均为分析纯。
主要仪器:Kjeltec2300凯氏定氮仪(丹麦福斯公司)、UV-2100型分光光度计(上海尤尼柯仪器有限公司)、H-2050R-1高速冷冻离心机(湘仪离心机有限公司)、TA.XT Plus质构仪(英国Stable Micro System公司)、Color Meter ZE-2000色差计(日本尼康公司)和S-3400N扫描电子显微镜(日本日立公司)。
冰温干燥装置[8]为本课题组自行研制,对虾仁进行冰温脱水处理(图1)。冰温干燥装置参数设置:压力为1000~1200 Pa,温度为(-1.5±0.5) ℃。
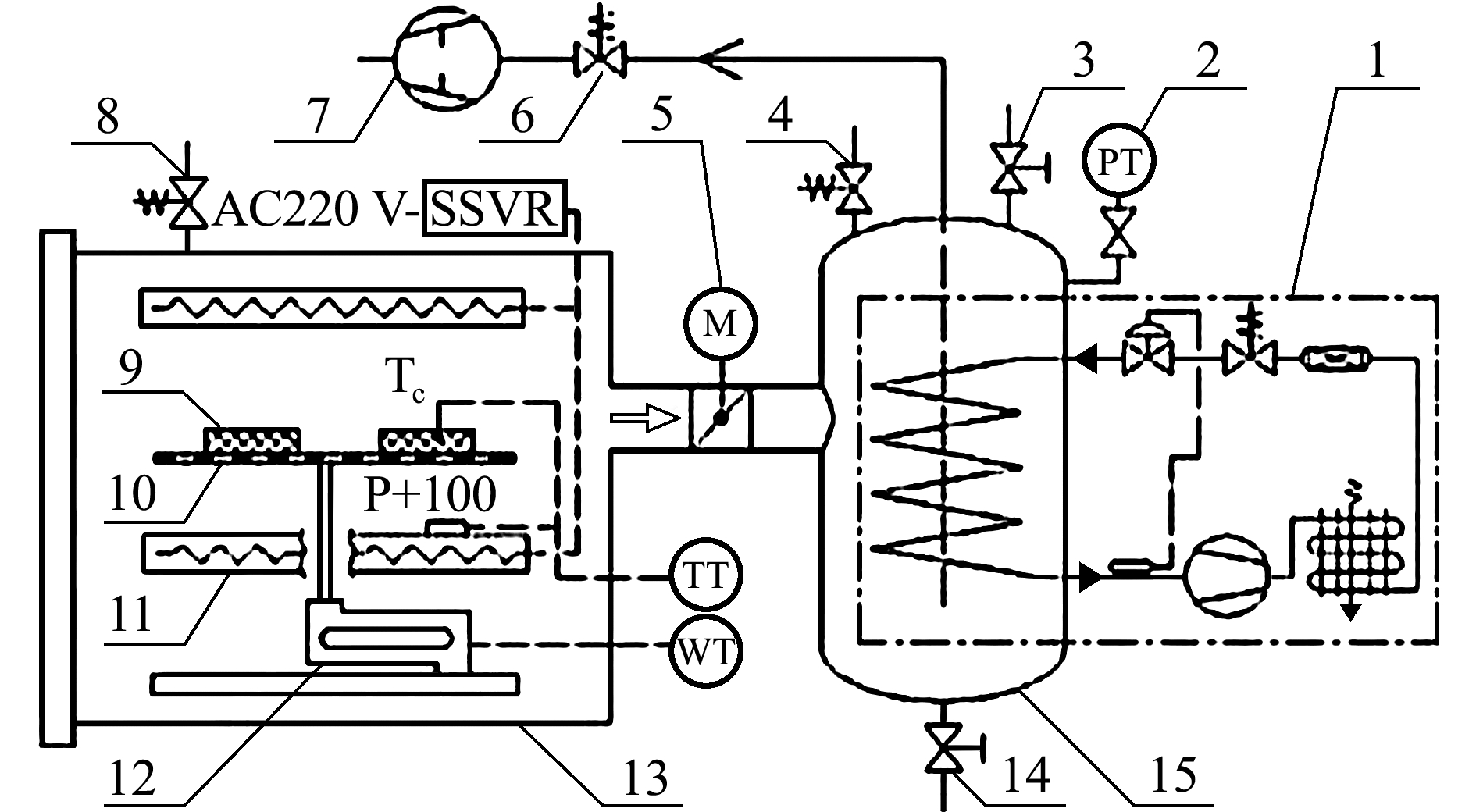
1.冷阱制冷机组; 2.真空压力变送器; 3.手阀; 4.放气阀; 5.电动蝶阀; 6.止油阀; 7.真空泵; 8.漏气阀; 9.物料; 10.托盘; 11.电加热板; 12.重量传感器; 13.真空箱; 14.排水阀; 15.冷阱
图1 冰温干燥装置
Fig.1 Controlled freezing-point dried device
1.2 方法
1.2.1 试验设计 活体南美白对虾充氧包装运至实验室后,立即用碎冰覆盖猝死,在低温条件下,剥壳、去头处理,3个/包。鲜虾仁初始含水率实测为80.05%。将新鲜虾仁分为空白对照组(CK)、6%盐浸组(Ⅰ组)、冰温脱水组(Ⅱ组)和混合组(6%盐浸+冰温脱水,Ⅲ组),其中,对照组为新鲜虾仁;6%盐浸组,将虾仁样品与盐液(浓度为6%)按照1∶6的比例(质量比),在4 ℃下用盐液浸泡6 h;冰温脱水组,虾仁样品经自制的冰温干燥装置脱水至含水率为(50±1)%为止;混合组,虾仁样品先用6%盐液浸泡6 h(4 ℃)后再进行冰温脱水,脱水至含水率为(50±1)%为止。
1.2.2 感官评定 参考郭彤等[9]的虾类产品鲜度判定方法,对肌肉组织、体表色泽和气味3项指标分别进行打分。9分最新鲜,0分完全腐败,6分以下不可食用(表1)。由感官评定小组(20人)进行打分,取其平均值。
1.2.3 pH值测定 参照国标GB 5009.237—2016食品pH值的测定。
1.2.4 酶活力测定
胰蛋白酶:参考李凤梅等[10]的方法处理样品,用分光光度法测定胰蛋白酶活力。酶活力定义:以每秒钟转换1 μmol BApNA底物所需的酶量为1个酶活力单位(U)。
多酚氧化酶(PPO):参考Nirmal等[11]的方法处理样品,用L-脯氨酸-儿茶酚分光光度法测定多酚氧化酶活力。酶活力定义:以每分钟1 mL酶液引起吸光度改变0.01为1个酶活力单位(U)。
表1 虾仁感官评定表
Tab.1 Sensory evaluation criterion for shrimp muscle

指标 index3分 score 32分score 21分score 10分 score 0肌肉组织muscle肌肉纹理清晰,有弹性肌肉略有弹性,不变色肌肉弹性较差,表面相对松弛肌肉组织松软,肉质发黄体表色泽color and lustre体表有光泽度,体节间紧密连接肉体微红或颜色暗沉肌体无色泽,颜色暗红体表色泽灰暗,体节分离气味smell具有海虾固有气味,无任何异味略有异味异味较强强烈腐臭味
1.2.5 质构特性的测定 将处理好的虾仁第二节置于测试面中心进行质地多面分析(texture profile analysis,TPA)。所用探头为直径50 mm的P50平底柱形探头。测试参数:① 测定部位为第二节背部肌肉;② 测试速度1.00 mm/s;③ 压缩程度30%。样品平行测定6次,取其平均值。
1.2.6 色差特性的测定 用ZE-2000色差仪对样品的第二和第三腹节侧面进行测定[12-13]。参照国际照明委员会(CIE)Lab值的测量方法进行测定。虾体颜色值分别用L*、a*、b*表示,其中,L*值为亮度;a*值,正值表示偏红,负值偏绿;b*值,正值表示偏蓝,负值偏黄。试验设置3个平行样,每个平行样品测定3次,取其平均值。
1.2.7 硫代巴比妥酸(TBARS)值测定 参考Erkan等[14]的方法处理样品,采用分光光度计在532 nm处测量样品吸光度A,然后计算TBARS值。
1.2.8 挥发性盐基氮(TVB-N)含量测定 根据半微量定氮法原理,通过凯氏定氮仪测定虾仁的TVB-N变化。平行测定3次,求其平均值。
1.2.9 电子显微镜观察 参考刘彩花等[15]的方法处理样品。SEM(scanning electronic microscopy)样品制备方法:将样品切成3 mm×3 mm×1 mm的小块, 用戊二醛固定,4 ℃冰箱中固定1.5 h以上,用0.1 mol/L PBS缓冲溶液漂洗3次,每次10 min;用乙醇浓度分别为30%(5 min)、50%(5 min)、70%(10 min)、80%(10 min)、95%(15 min)、100%(10 min,2次)脱水;在没有张力的条件下干燥,完整保存样品全貌;喷金厚度为15 nm左右;最后观察拍片。
1.3 数据处理
采用SPSS、Excel 等软件分析试验结果。
2 结果与分析
2.1 感官评价
从图2可见:在贮藏过程中对照(CK)组感官评分下降速度最快;Ⅲ组在初始几天评分下降相对较慢,可能是加盐和干燥处理后轻微破坏了组织结构,但在后期明显抑制了酶类和微生物等腐败作用,下降趋势变得缓慢;Ⅰ组和Ⅱ组在第12天时感官评分分别为5.5和4.5分,已经达到腐败,失去可食用价值,虾仁分别呈现暗红色和深褐色,产生腐臭味;而Ⅲ组在第12天左右评分有所上升,可能是盐浸+冰温脱水处理后的虾仁在贮藏过程中发酵产生的风味物质提升了感官评分。
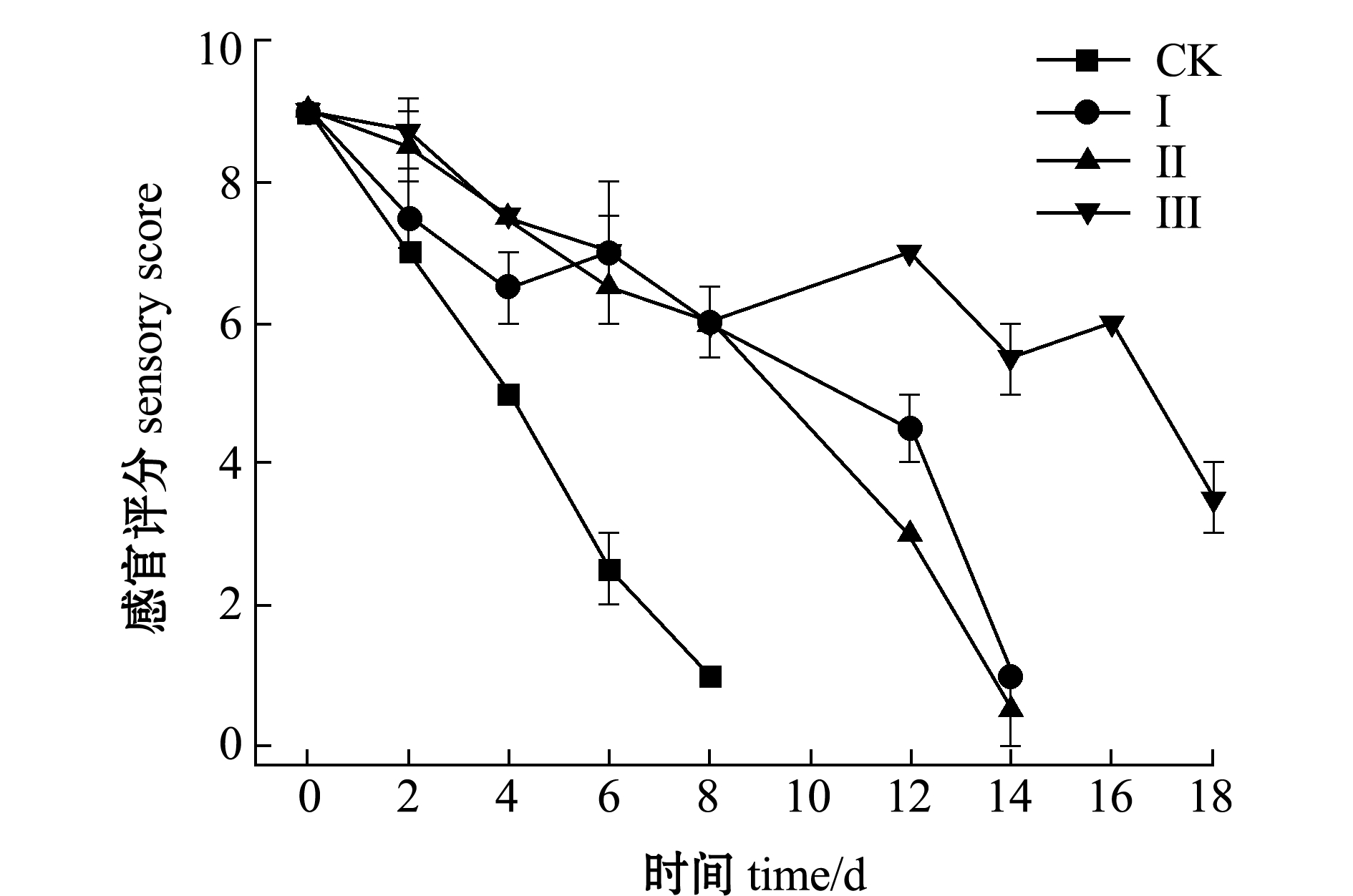
图2 不同处理组虾仁感官评定结果
Fig.2 Sensory evaluation of shrimp muscle in different treatment groups during storage
2.2 pH值
从图3可见:新鲜虾仁的初始pH值为7.0左右,Ⅰ、Ⅱ、Ⅲ组虾仁的pH值总体变化趋势一致,均呈先减后增;在贮藏前期各组pH值均降低,是因为南美白对虾体内的糖类物质通过无氧酵解过程生成乳酸,体内ATP关联物质被分解产生无机磷酸盐等酸类物质;在贮藏后期,虾仁体内蛋白质被内源酶类降解导致自溶,微生物胞外酶分解产生三甲胺等碱性物质,故各组pH呈现上升趋势[16]。
pH变化过程受季节和宰杀前应激反应等多种因素影响,pH的变化速率是评估水产品腐败的重要参数,小于或等于0.1个单位的变化表示品质较新鲜,0.1~0.2单位为可接受范围,超过0.2个单位表明水产品达到腐败水平[17]。在整个贮藏过程中,与对照组相比,Ⅲ组样品pH值变化更为平缓,表明6%盐浸+冰温脱水能够明显抑制内源酶类和微生物活动。
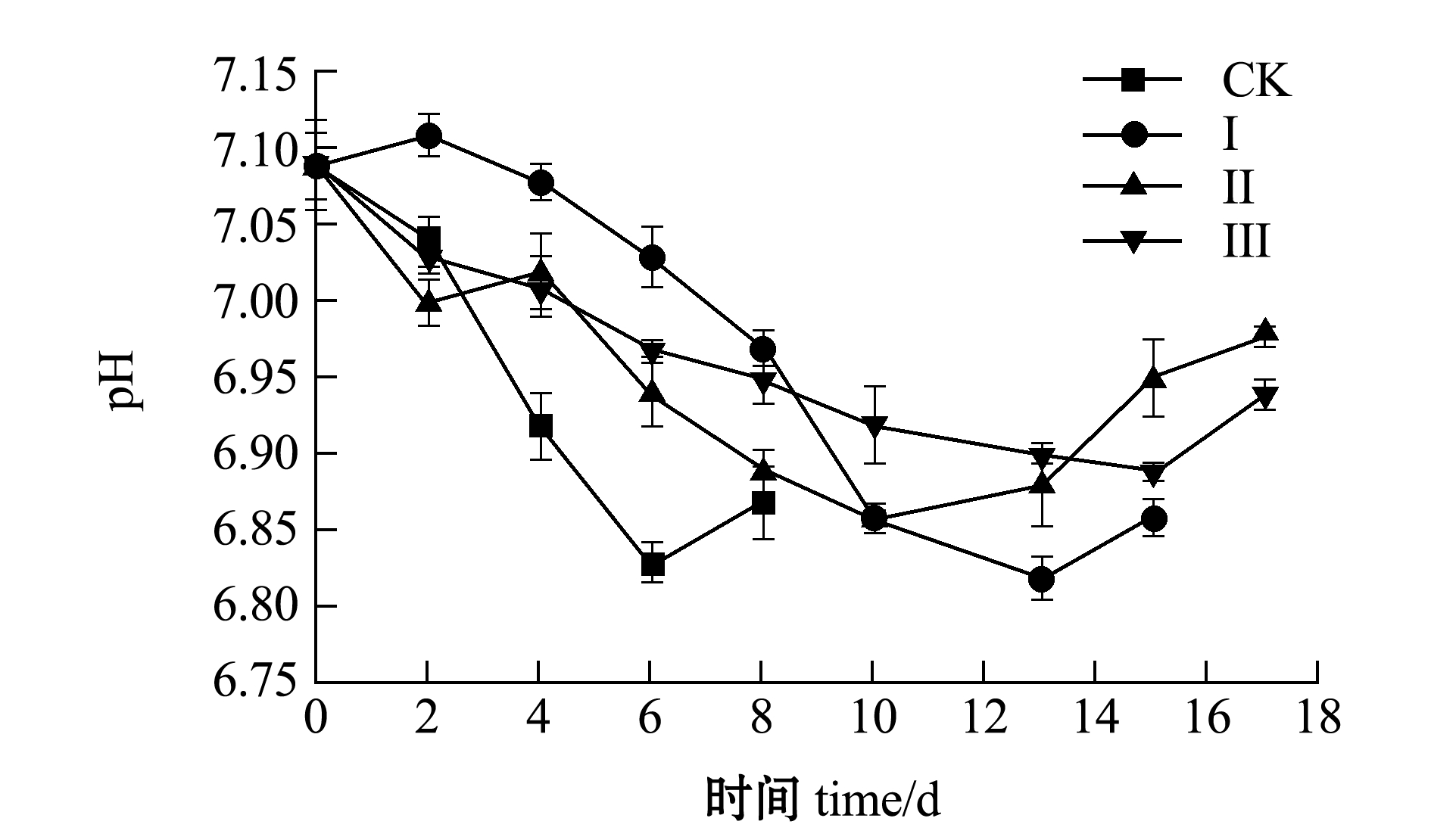
图3 不同处理组虾仁pH值的变化
Fig.3 Changes in pH value of shrimp muscle in different treatment groups during storage
2.3 胰蛋白酶和多酚氧化酶活力变化
从图4-A可以看出:对照组虾仁胰蛋白酶活力值明显高于其他3组,最高值达到0.019 3 U/mL,肌原纤维蛋白被大量水解,腐败速度最快;Ⅰ组与Ⅱ组相比,在初始阶段,盐分并未充分渗入虾仁体内,Ⅰ组酶活性明显高于Ⅱ组,随着贮藏时间的延长,酶活力被渗入的盐抑制,第10天时Ⅱ组的胰蛋白酶活性逐渐高于Ⅰ组,这表明,用6%盐浸处理后的样品,在贮藏后期能够明显抑制胰蛋白酶活性,延缓组织蛋白降解速度;Ⅲ组样品的胰蛋白酶活性力在4组样品中始终处于最低水平,酶活力总体上呈先升高后降低的趋势。
从图4-B可以看出:4种处理方式下的虾仁多酚氧化酶总体呈现先减后增趋势,对照组在第5天左右时酶活力降至最低点(1.3 U/mL);Ⅰ组和Ⅱ组分别在第7、9天时酶活力降至最低点,多酚氧化酶是一种含铜蛋白质,在酸性或碱性环境中,铜会被解离而失活,因此,酶与底物络合物的反应与pH值显著相关;而Ⅲ组经加盐和冰温脱水后,虾仁pH范围为6.89~7.09,变化趋势较稳定,多酚氧化酶在此条件下,蛋白质分子间的部分氢键被破坏,蛋白质结构发生了改变,从而解释了Ⅲ组的酶活力较低的现象。
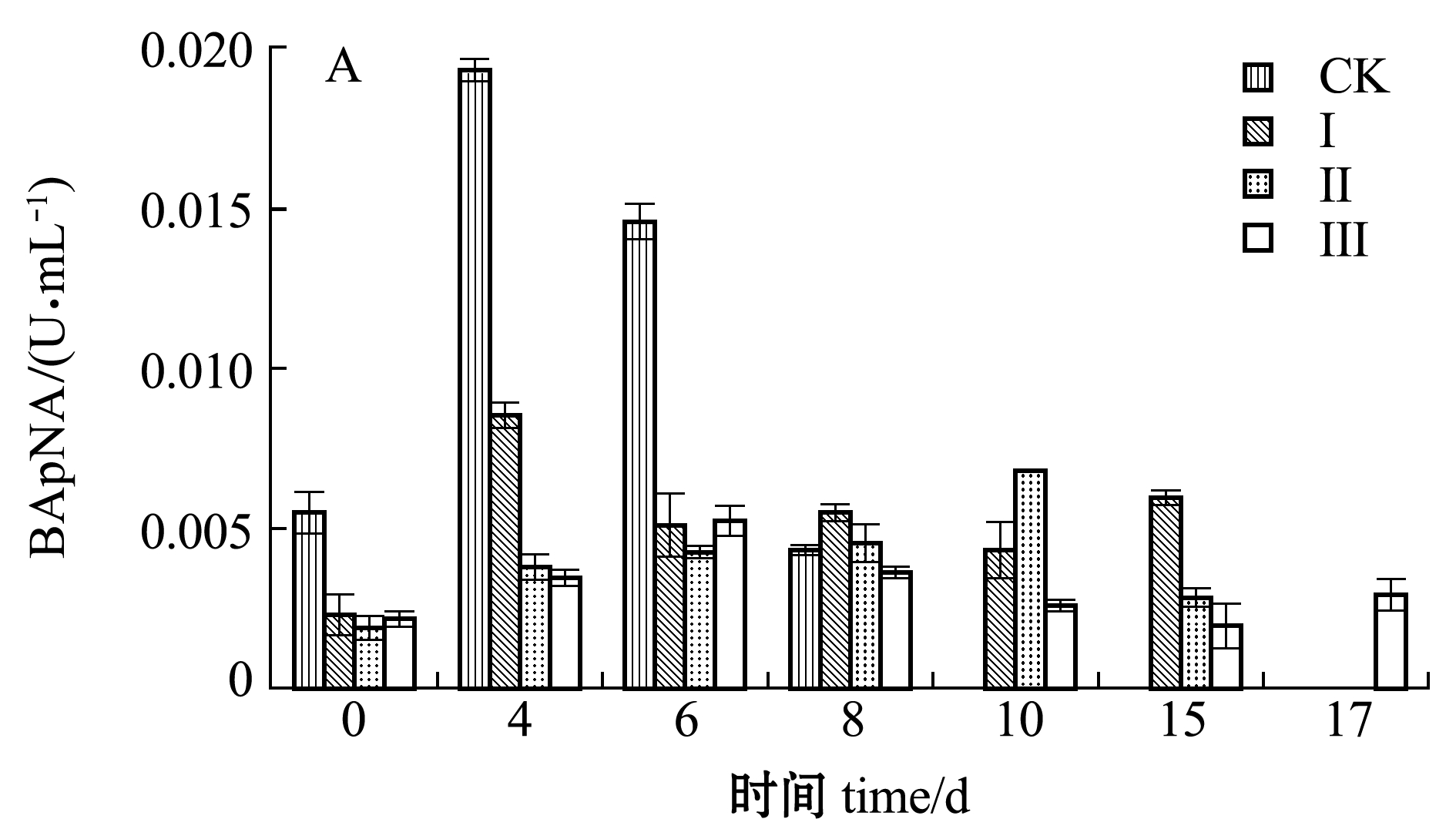
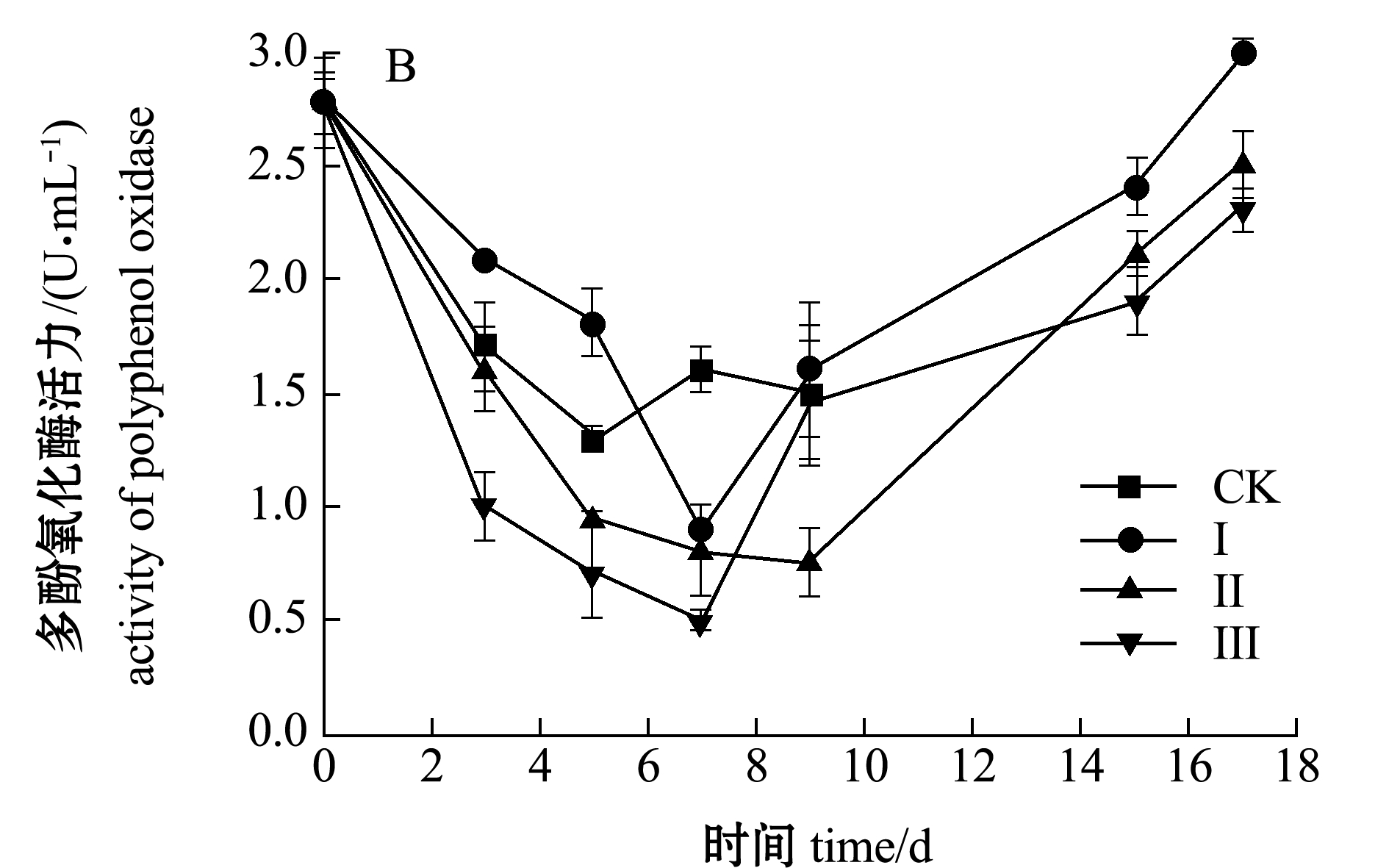
图4 不同处理组虾仁胰蛋白酶和多酚氧化酶活力变化
Fig.4 Changes in activities of trypsin and polyphenol oxidase (PPO) of shrimp muscle in different treatment groups during storage
2.4 质构特性
在低温贮藏过程中,硬度和弹性指数能够较好地反映虾体肌肉组织的变化情况。从图5-A可以看出:4个处理组虾仁的质构特性发生了明显变化,虾仁在贮藏过程中,硬度指标总体呈下降趋势(P<0.05),对照组的虾仁硬度值处于4组中最低水平,第8天时降至1334.43 g,肌肉组织软化程度最高;Ⅰ组整体硬度略高于对照组,表明低浓度的盐能够改善组织软化现象;Ⅱ、Ⅲ组的硬度指标明显高于其他两组,说明冰温脱水能够显著提高肌肉的硬度。
从图5-B可以看出:对照组弹性指数下降程度最快,最低将至0.35,组织结构被破坏,极易腐败变质;Ⅰ组样品的弹性指数明显高于对照组,弹性最低达到0.383,说明6%盐浸处理能够增加凝胶蛋白的分子键,提高南美白对虾肉质的弹性;Ⅲ组弹性指数明显高于另外3组,表明6%盐浸+冰温脱水对虾仁的弹性保护效果明显,能够延缓肌肉组织软化过程,有效延长贮藏期。
2.5 色差特性
肌肉组织的颜色是判断产品品质的重要指标。从表2可见:在贮藏前2 d内,4组虾体颜色值a*值为负值(颜色偏绿),说明虾体内的虾青素尚未被破坏,样品仍处于新鲜状态,而贮藏后期,对照组和Ⅰ组的a*值升高较快;第6天时,对照组、Ⅰ组、Ⅱ组和Ⅲ组a*值分别为2.09、1.26、1.05和-0.50,冰温脱水后a*值明显低于对照组和Ⅰ组,表明冰温脱水处理能够明显抑制虾仁红变反应;总体来说,Ⅱ、Ⅲ组的L*值低于对照组和Ⅰ组,表明脱水处理后会降低虾仁的亮度值。
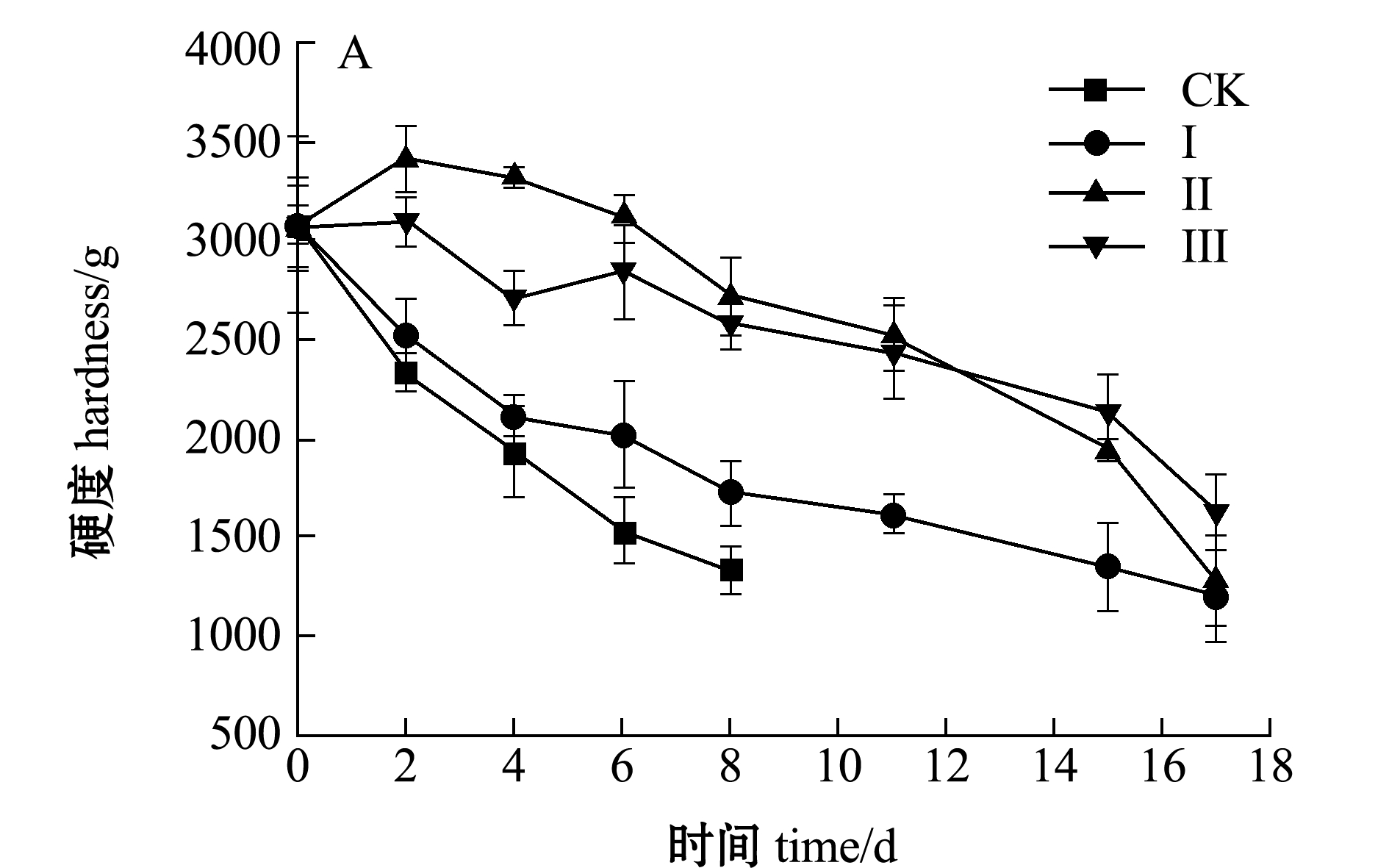
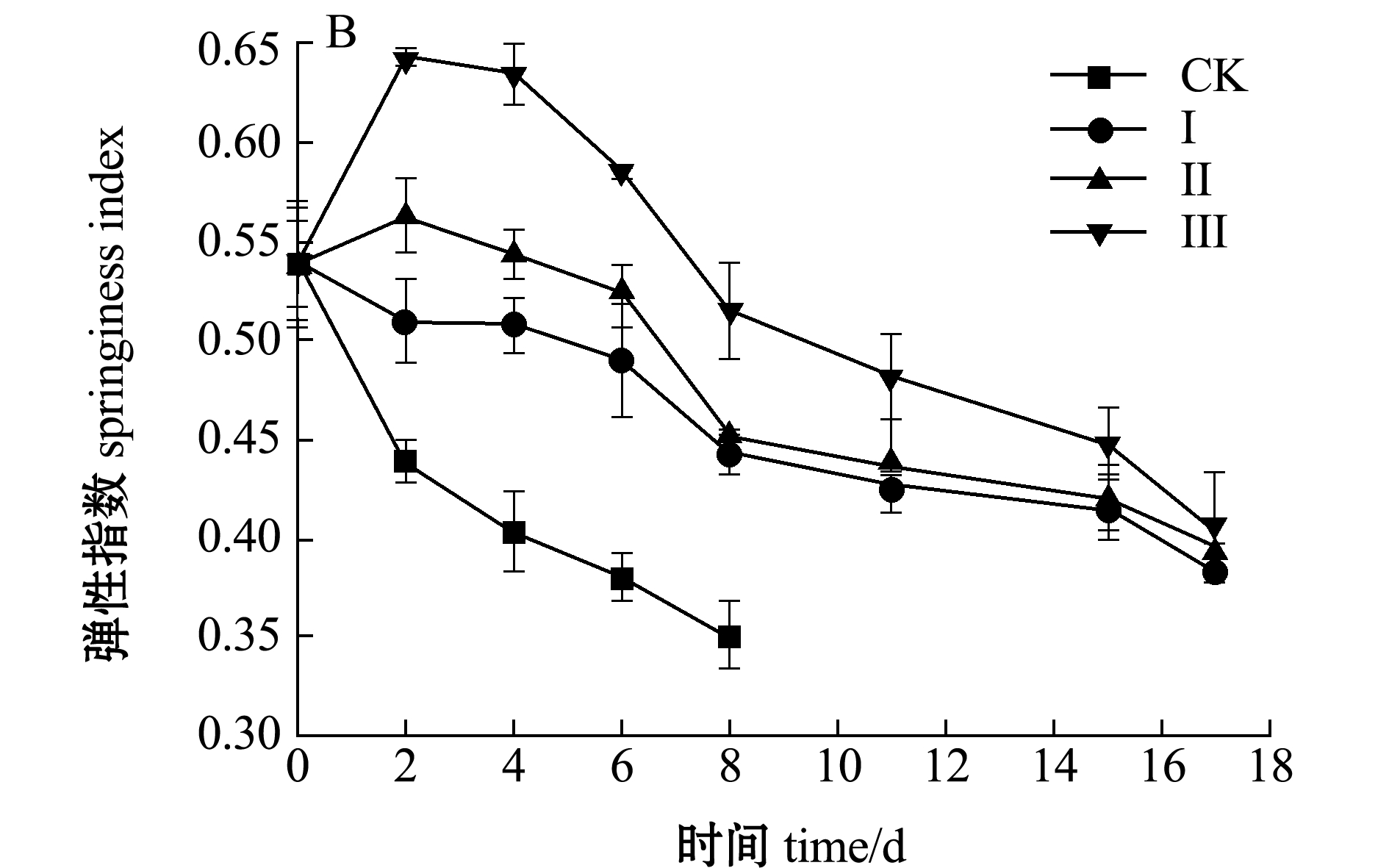
图5 不同处理组虾仁硬度值和弹性指数的变化
Fig.5 Change in hardness value and springiness index of shrimp muscle in different treatment groups during storage
2.6 TBARS值和挥发性盐基氮含量变化
水产品肌肉中含有高度不稳定的多不饱和脂肪酸(PUFA),尤其是ω-3和ω-6家族的高不饱和脂肪酸(HUFA),极易快速氧化变质。TBARS作为评价肉类制品脂肪氧化程度的指标,能与虾仁体内的脂肪酸氧化产物丙二醛(MDA)反应生成稳定的红色复合物[18]。从图6-A可见:对照组的TBARS明显高于其他3组,最高值达到了0.43 mg/kg;Ⅰ组虾仁经过低盐处理后,脂肪氧化酶和微生物的生长被抑制,从而延缓了虾仁氧化过程;Ⅱ组通过在冰温条件下减少虾仁体内的水分含量,降低了酶促反应底物的流动性,并且改变了脂肪氧化酶的结构,达到了抑制脂肪氧化的目的,此外,水分含量的降低,也会减少肌肉中溶解氧含量,阻滞脂质的氧化[19];Ⅲ组的TBARS值增幅最为缓慢,在4组处理样品中处于最低水平,贮藏时间达到18 d左右,此时TBARS值为0.25 mg/kg。
表2 不同处理组虾仁L*值和a*值的变化
Tab.2 Changes in variance of lightness (L*) and redness (a*) in shrimp muscle in different treatment groups
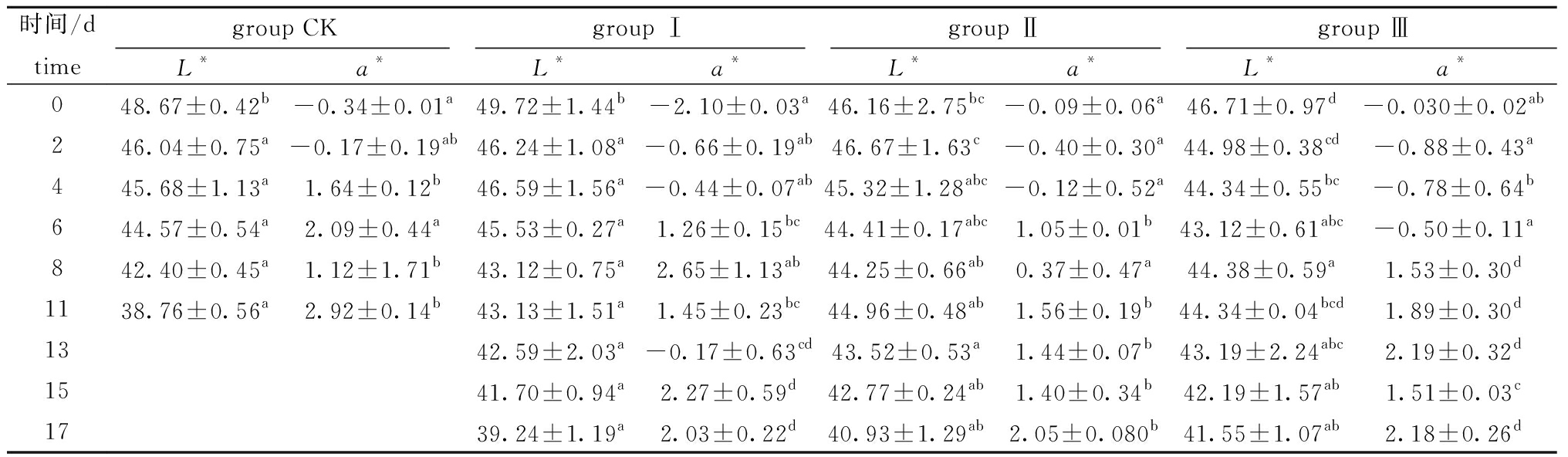
时间/dtimegroup CKgroup Ⅰgroup Ⅱgroup ⅢL*a*L*a*L*a*L*a*048.67±0.42b-0.34±0.01a49.72±1.44b-2.10±0.03a46.16±2.75bc-0.09±0.06a46.71±0.97d-0.030±0.02ab246.04±0.75a-0.17±0.19ab46.24±1.08a-0.66±0.19ab46.67±1.63c-0.40±0.30a44.98±0.38cd-0.88±0.43a445.68±1.13a1.64±0.12b46.59±1.56a-0.44±0.07ab45.32±1.28abc-0.12±0.52a44.34±0.55bc-0.78±0.64b644.57±0.54a2.09±0.44a45.53±0.27a1.26±0.15bc44.41±0.17abc1.05±0.01b43.12±0.61abc-0.50±0.11a842.40±0.45a1.12±1.71b43.12±0.75a2.65±1.13ab44.25±0.66ab0.37±0.47a44.38±0.59a1.53±0.30d1138.76±0.56a2.92±0.14b43.13±1.51a1.45±0.23bc44.96±0.48ab1.56±0.19b44.34±0.04bcd1.89±0.30d1342.59±2.03a-0.17±0.63cd43.52±0.53a1.44±0.07b43.19±2.24abc2.19±0.32d1541.70±0.94a2.27±0.59d42.77±0.24ab1.40±0.34b42.19±1.57ab1.51±0.03c1739.24±1.19a2.03±0.22d40.93±1.29ab2.05±0.080b41.55±1.07ab2.18±0.26d
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences
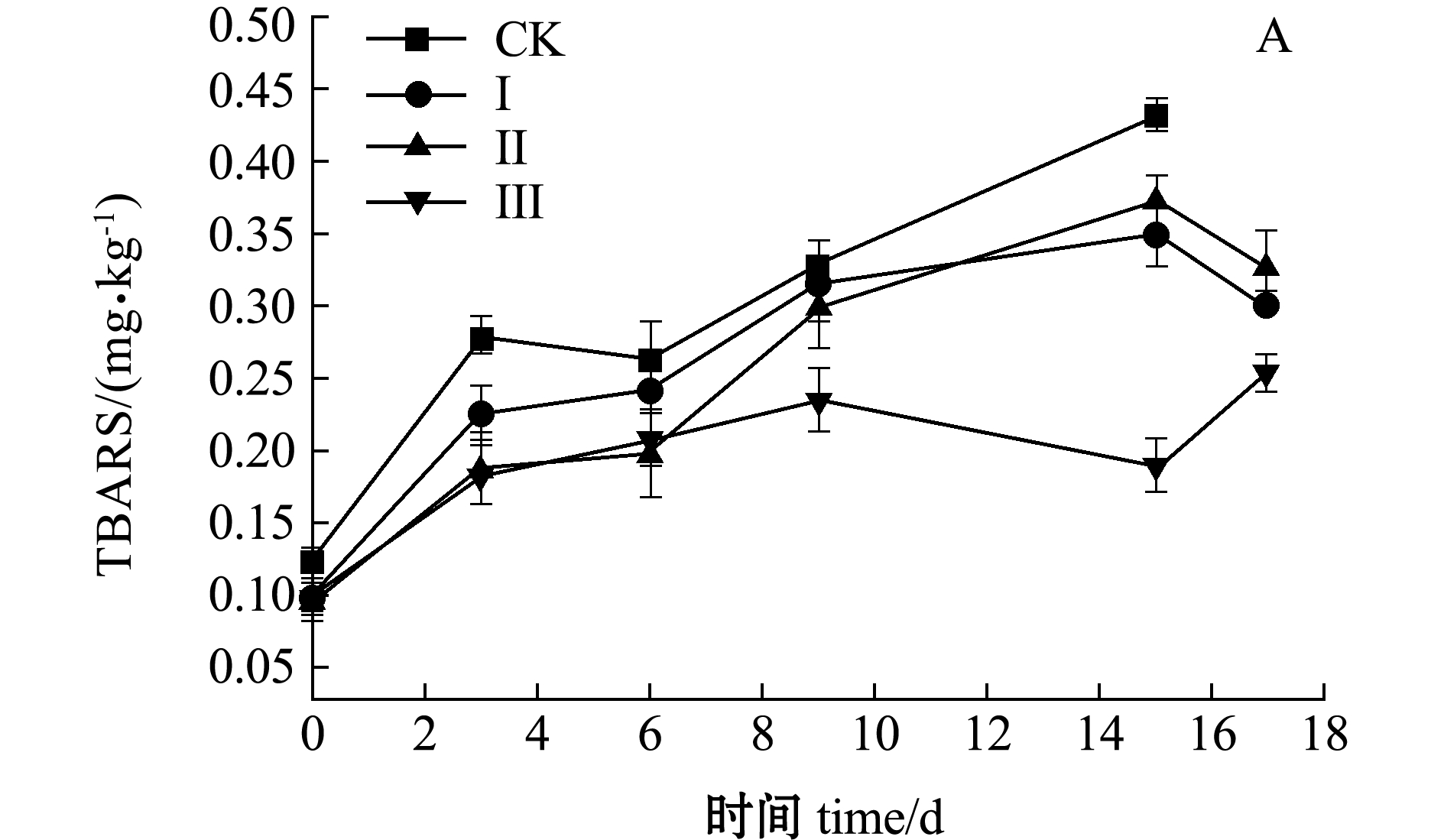
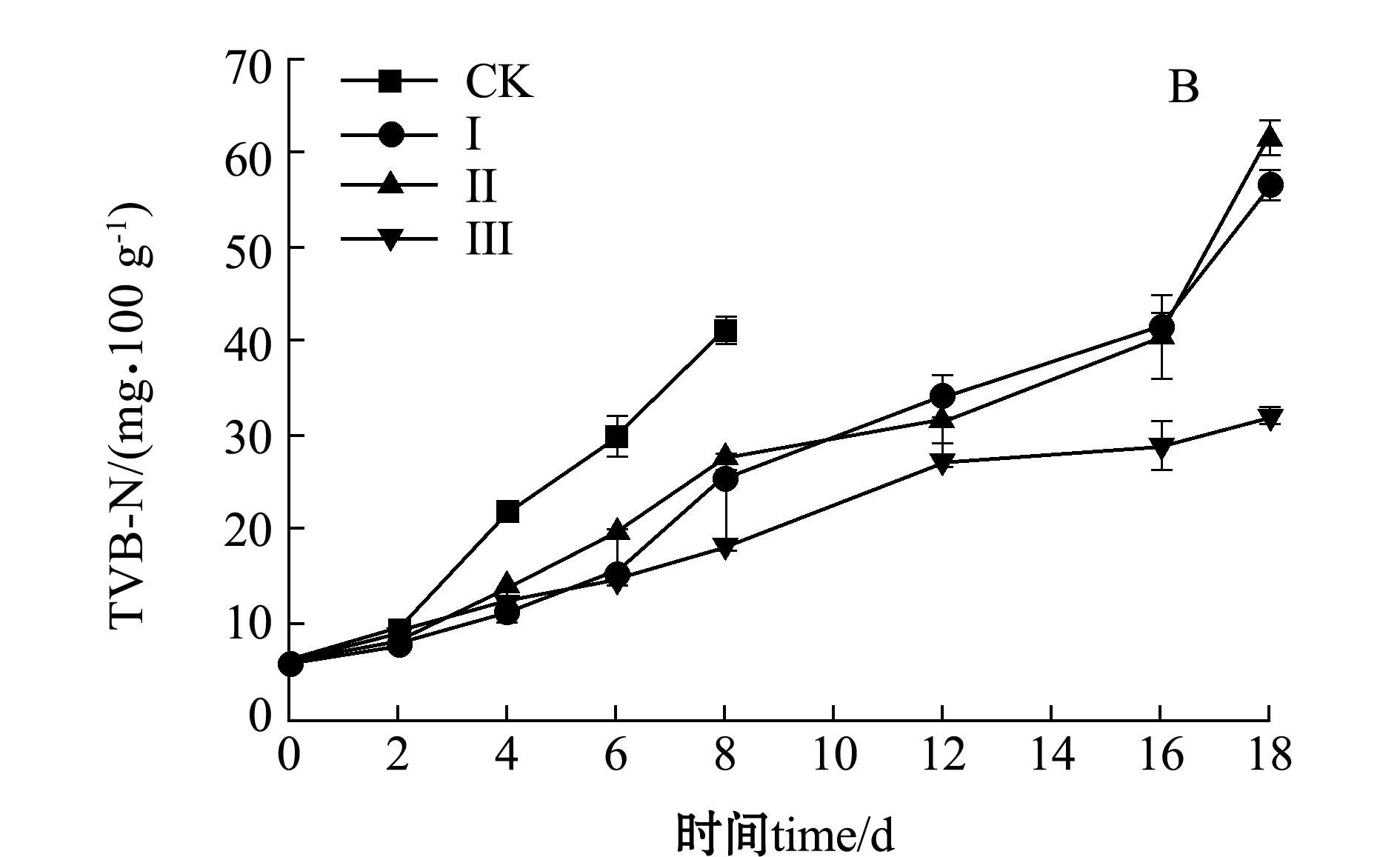
图6 不同处理组虾仁TBARS值和TVB-N值的变化
Fig.6 Changes in TBARS and TVB-N values of shrimp muscle in different treatment groups during storage
水产品在内源酶和微生物的作用下会分解产生胺类等碱性化合物。TVB-N含量能够反映水产品的腐败程度。从图6-B可见:新鲜虾仁的初始TVB-N值为6.06 mg/100 g左右,各组TVB-N含量总体呈现上升趋势;在贮藏过程中,空白对照、Ⅰ、Ⅱ、Ⅲ组在第4、6、6、8天时虾仁TVB-N含量达到22.10、15.61、19.76、18.32 mg/100 g,均低于南美白对虾的一级鲜度值上限,而在贮藏的第6、12、12、18天时,虾仁TVB-N含量达到30.32、34.33、31.83、32.15 mg/100 g,均超出淡水虾TVB-N含量上限(TVB-N≤30 mg/100 g),已超出可食用范围。Le等[20]的研究结果表明,在冰藏(0 ℃)条件下,黑虎虾TVB-N含量在第9天时达到32.28 mg/100 g,贮藏期间TVB-N呈上升趋势,本研究结果与此结果一致。本研究中,在第8天时,4个处理组 TVB-N含量差异明显增大,混合处理对TVB-N抑制作用愈发显著。
2.7 菌落总数变化
微生物分解作用是导致水产品腐败的重要原因,低温条件下大部分微生物活动被抑制,嗜冷菌(革兰氏阴性菌、假单胞菌等)成为优势菌属,利用氨基酸等肌肉组织分解成分进行增殖。一般鲜虾初始菌落总数为4~5 lg(CFU/g)[21]。从图7可见:鲜虾仁初始细菌总数为4.04 lg(CFU/g),在4种处理条件下,对照组微生物增长速度最快,第8天时菌落总数为7.89 lg(CFU/g),超过水产品腐败标准1×107 CFU/g,表明对照组贮藏期在6 d左右;贮藏过程中Ⅰ组和Ⅱ组菌落生长趋势相近,说明6%盐浸和单纯冰温脱水均能增加保鲜抑菌效果,虾仁菌落总数在第10天时分别为6.53、6.63 lg(CFU/g),比对照组虾仁贮藏期延长了2倍左右;Ⅲ组在第18天时,菌落总数达到7.32 lg(CFU/g),贮藏期是对照组的3倍左右,表明6%盐浸+冰温脱水能够显著增强虾仁的保鲜抑菌效果。
2.8 虾仁组织电子显微镜观察
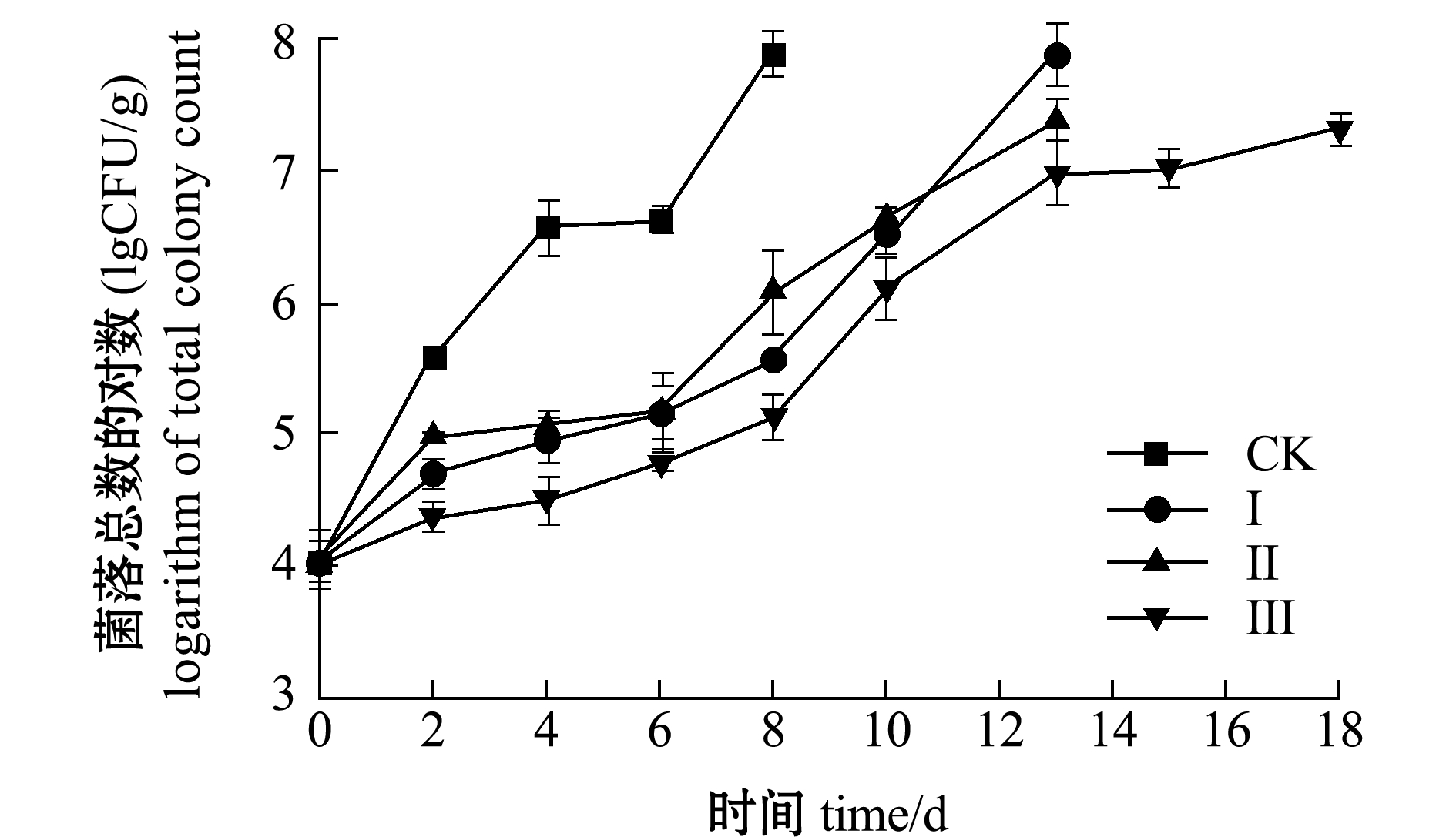
图7 不同处理组虾仁菌落总数的变化
Fig.7 Changes in total colony count of shrimp muscle in different treatment groups during storage
图8呈现了贮藏初期(1 d)4个处理方式下虾仁组织结构的状态。从图8可见:新鲜的虾仁(对照)组织结构排列较为整齐(图8-CK-1),局部放大1200倍(图8-CK-2)后略有凹陷,但并未出现断裂现象;盐浸(Ⅰ组)后的虾仁组织出现较多凸起,纤维排列顺序杂乱无章,纤维出现断裂情况,可能与低盐浸渍后纤维的膨胀作用有关[7];冰温脱水处理(Ⅱ组)后的虾仁在两种不同放大倍数下,组织排列顺序整齐致密,纤维束与Ⅰ组相比显著变窄,表明冰温脱水对肌肉组织影响较小;6%盐浸+冰温脱水处理(Ⅲ组)后,显微结构呈现整齐分布的块状凸起结构,可能与Ⅲ组弹性值较好密切相关。

注:第一行组放大倍数均为800倍;第二行组放大倍数均为1200倍
Note: A, B, C, and D, the magnifications are all 800 times in the first line; E, F, G, and H, the magnifications are all 1200 times in the second line
图8 虾仁组织电子显微镜观察图像(处理后1 d)
Fig.8 Tissue electron microscope image of shrimp muscle during storage(1 d after treatment)
3 讨论
3.1 盐浸脱水对胰蛋白酶活性的影响
本研究表明,盐浸+冰温脱水处理后,胰蛋白酶活性被显著抑制,这两种酶类分别对虾仁的组织结构和色泽起主要作用。內源蛋白酶类对结缔组织的降解,是肌肉组织软化的重要原因。鱼类组织中的内源蛋白酶为钙蛋白酶和组织蛋白酶,虾类肌肉软化则是肠道消化器官内的胰蛋白酶等丝氨酸蛋白酶类作用的结果[22]。此外,Sriket 等[23]研究表明,胰蛋白酶是虾类在死后的主要自溶酶,通过专一性切割多肽链中的精氨酸和赖氨酸残基,使得机体内复合酶系统抑制因子失去制约作用,机体软化并伴随自溶。因此,胰蛋白酶活力可作为判断虾肌肉组织软化的重要指标。本研究中各组虾仁胰蛋白酶活呈现先升后降的趋势,这一变化趋势与Kolakowski[24]研究相吻合,虾类腐败过程主要分两个阶段,前一阶段内源酶类占主要作用,后期随着微生物数量的指数型增加,内源酶优势地位被胞外酶所取代,因此,酶活性呈下降趋势。微生物活动逐渐处于优势地位,产生三甲胺等胺类异味物质,导致产品腐败变质。
3.2 盐浸脱水对多酚氧化酶活性的影响
多酚氧化酶是影响虾仁色泽度的重要指标。通常指与苯酚氧化有关的两种类似酶,即酪氨酸酶和儿茶酚氧化酶,分别催化单羟基酚的O-羟基化和邻二羟基酚。虾死后体内蛋白质会分解成DOPA(酪氨酸类似成分)等水溶性色素,在酶的作用下氧化生成黑色素等物质[25]。本研究中,Ⅱ、Ⅲ组经冰温脱水后的虾仁酶活处于较低水平,表明水分含量的降低会在一定程度上限制酶底物的转移性,降低酶活力。4种处理方式下多酚氧化酶的活性趋势与pH值的变化相似,总体呈现先减后增的趋势,表明多酚氧化酶对酸碱性变化较为敏感。此外,Manheem等[26]研究发现,肝胰腺中的胰蛋白酶对多酚氧化酶具有激活作用,与对照(非肝胰腺蛋白酶)相比,多酚氧化酶活性增加了16%。多酚氧化酶和胰蛋白酶的相互作用最终导致虾仁的腐败变质。因此,探索合理的方法抑制酶活具有重要的现实意义。
3.3 盐浸脱水对虾仁品质特征的影响
3.3.1 盐浸脱水对虾仁色泽品质的影响 虾青素是类胡萝卜色素之一,分子结构是由11个共轭双键和2个羟基组成,通过猝灭单线态氧和自由基,发挥抗氧化能力。虾青素与a*值变化呈正相关,促进虾体变红。在贮藏过程中未经冰温脱水的虾仁腐败时虾体颜色呈橘红色,产生红变。虾死后体内蛋白质发生变性,束缚虾青素的共价键、氢键和疏水键被破坏,导致虾青素游离,颜色显现为原来的橘红色[27]。因此,本试验中通过对比,4种预处理条件下虾仁的亮度值(L*)可知,Ⅱ、Ⅲ组略低于对照和Ⅰ组,表明水分的流失会降低虾仁的感官品质。此外,Ⅲ组虾仁样品a*值处于最低水平,表明6%盐浸+冰温脱水能够较好地抑制多酚氧化酶活力,延缓虾仁色泽红变现象。
3.3.2 盐浸脱水对虾仁质构特性的影响 本试验空白组在冰温条件下组织软化速度较快,这一结果与Wang等[28]得出的虾死后体内肌原纤维和结缔组织被破坏,硬度与弹性等指数均呈现下降趋势的结果相一致。Ⅰ组经低盐浸渍处理后,在延长贮藏期的同时,能够增强蛋白质的溶出能力,抑制蛋白分解酶活性,增加肌肉硬度,这一结果与胡晓飞等[29]得出的6%盐含量是提高多宝鱼肉质弹性质地最佳浓度的研究结果相一致。Ⅱ组冰温脱水的虾仁在硬度和弹性方面显著优于对照组,Aguilera等[30]认为,脱水后食品物料的蛋白质等大分子积聚,肌肉收缩,导致硬度增加从而增强口感。Ⅲ组使用6%盐浸与冰温脱水两种方式结合处理,能够使虾仁贮藏期被延长至18 d,对盐渍冰温脱水虾仁的产业化生产提供了重要的理论依据。
4 结论
本研究结果表明,3种处理方式均能达到抑制菌落和酶活力的目的。6%低盐浸渍(样品∶盐液=1∶6,4 ℃下浸泡6 h)能够有效防止传统高盐造成的高强度氧化缺点,TBARS值始终低于对照组;Ⅱ组和Ⅲ组冰温脱水处理后亮度值(L*)降低,存在色泽暗淡的缺点,相比于冷冻和热风干燥等常见的脱水方式,冰温条件下脱水细胞结构保存完整,对鲜度值影响较小;盐浸脱水混合处理后虾仁组织结构发生明显改变,电镜图可知虾仁组织排列顺序整齐致密,此外,弹性和硬度值的变化,改善了虾仁的感官品质,与空白组相比贮藏期延长了3倍,达到18 d,为盐渍冰温脱水虾仁制品的商业化流通提供一定的理论参考。
[1] 陈思名,郜佳雁,李宏吉,等.微冻保鲜对南美白对虾品质的影响研究[J].食品研究与开发,2014,35(3):100-103.
[2] 张皖君,蓝蔚青,肖蕾,等.流化冰在水产品保鲜中的应用研究进展[J].食品与机械,2016,32(7):214-218.
[3] 谢晶,蓝蔚青.水产品流通过程中保鲜技术研究进展[J].中国食品学报,2017,17(7):1-8.
[4] 王雪锋.低盐高水分草鱼的风味品质变化研究[D].杭州:浙江工商大学,2015.
[5] Shi Liu,Yang Tao,Xiong Guangquan,et al.Influence of frozen storage temperature on the microstructures and physicochemical properties of pre-frozen perch (Micropterus salmoides)[J].LWT,2018,92:471-476.
[6] Niamnuy C,Devahastin S,Soponronnarit S,et al.Kinetics of astaxanthin degradation and color changes of dried shrimp during storage[J].Journal of Food Engineering,2008,87(4):591-600.
[7] Bombrun L,Gatellier P,Carlier M,et al.The effects of low salt concentrations on the mechanism of adhesion between two pieces of pork semimembranosus muscle following tumbling and cooking[J].Meat Science,2014,96(1):5-13.
[8] 厉建国,万金庆,赵彦峰.冰温真空干燥系统的设计与实现[J].食品与机械,2017,33(11):89-91,156.
[9] 郭彤,周德庆,朱兰兰,等.解冻方式对南极磷虾感官品质的影响[J].食品研究与开发,2016,37(18):1-5.
[10] 李凤梅,祝倩倩.南极磷虾自溶过程中胰蛋白酶活性的检测[J].水产科技情报,2016,43(3):139-142.
[11] Nirmal N P,Benjakul S.Use of tea extracts for inhibition of polyphenoloxidase and retardation of quality loss of Pacific white shrimp during iced storage[J].LWT,2011,44(4):924-932.
[12] 王伟,柴春祥,鲁晓翔,等.色差和质构评定南美白对虾的新鲜度[J].浙江农业学报,2015,27(2):271-277.
[13] Tsironi T,Dermesonlouoglou E,Giannakourou M,et al.Shelf life modelling of frozen shrimp at variable temperature conditions[J].LWT,2009,42(2):664-671.
[14] Erkan N,Özden Ö.Quality assessment of whole and gutted sardines (Sardina pilchardus) stored in ice[J].International Journal of Food Science & Technology,2008,43(9):1549-1559.
[15] 刘彩华,朱新荣,张建.羟自由基氧化对冷藏高白鲑品质及微观结构的影响[J].食品工业科技,2017,38(23):238-244.
[16] Zeng Qingzhu,Thorarinsdottir K A,Olafsdottir G.Quality changes of shrimp (Pandalus borealis) stored under different cooling conditions[J].Journal of Food Science,2005,70(7):S459-S466.
[17] MartinezI,Friis T J,Careche M.Post mortem muscle protein degradation during ice-storage of Arctic (Pandalus borealis) and tropical (Penaeus japonicus and Penaeus monodon) shrimps:a comparative electrophoretic and immunological study[J].Journal of the Science of Food and Agriculture,2001,81(12):1199-1208.
[18] Kwon T W,Watts B M.Determination of malonaldehyde by ultraviolet spectrophotometry[J].Journal of Food Science,1963,28(6):627-630.
[19] 贾洋洋.预调理白鱼的加工及品质控制研究[D].上海:上海海洋大学,2016.
[20] Le N T,Doan N K,Nguyen B T,et al.Towards improved quality benchmarking and shelf life evaluation of black tiger shrimp (Penaeus monodon)[J].Food Chemistry,2017,235:220-226.
[21] Lalitha K V,Surendran P K.Microbiological changes in farm reared freshwater prawn (Macrobrachium rosenbergii de Man) in ice[J].Food Control,2006,17(10):802-807.
[22] Peng Yuanhuai,Chen Shiyan,Ji Hongwu,et al.Localization of trypsin-like protease in postmortem tissue of white shrimp (Litopenaeus vannamei) and its effect in muscle softening[J].1Food Chemistry,2019,290:277-285.
[23] Sriket C,Benjakul S,Visessanguan W.Characterisation of proteolytic enzymes from muscle and hepatopancreas of fresh water prawn (Macrobrachium rosenbergii)[J].Journal of the Science of Food and Agriculture,2011,91(1):52-59.
[24] Kolakowski E.Changes of non-protein nitrogens fractions in Antarctic krill (Euphausia superba Dana) during storage at 3° and 20 ℃[J].Zeitschrift für Lebensmittel-Untersuchung und Forschung,1986,183(6):421-425.
[25] Zamorano J P,Martínez- lvarez O,Montero P,et al.Characterisation and tissue distribution of polyphenol oxidase of deepwater pink shrimp (Parapenaeus longirostris)[J].Food Chemistry,2009,112(1):104-111.
lvarez O,Montero P,et al.Characterisation and tissue distribution of polyphenol oxidase of deepwater pink shrimp (Parapenaeus longirostris)[J].Food Chemistry,2009,112(1):104-111.
[26] Manheem K,Benjakul S,Kijroongrojana K,et al.The effect of heating conditions on polyphenol oxidase,proteases and melanosis in pre-cooked Pacific white shrimp during refrigerated storage[J].Food Chemistry,2012,131(4):1370-1375.
[27] 魏玖红,娄永江,魏丹丹,等.南美白对虾红变因素及控制技术研究[J].食品工业科技,2016,37(19):148-152.
[28] Wang Qianyun,Lei Jun,Ma Junjie,et al.Effect of chitosan-carvacrol coating on the quality of Pacific white shrimp during iced storage as affected by caprylic acid[J].International Journal of Biological Macromolecules,2018,106:123-129.
[29] 胡晓飞,林洪,隋建新,等.食盐浓度对即热型多宝鱼食用品质的影响[J].食品科技,2018,43(7):261-269.
[30] Aguilera J M,Chiralt A,Fito P.Food dehydration and product structure[J].Trends in Food Science & Technology,2003,14(10):432-437.